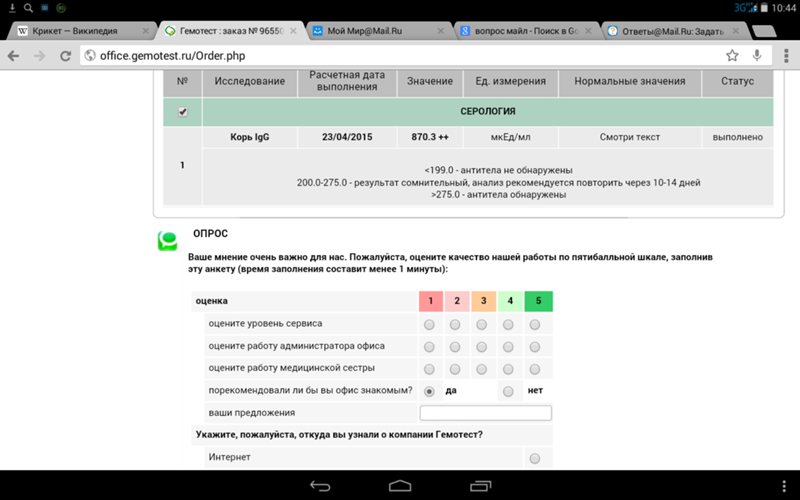
Корь антитела: Сдать анализ на антитела IgG к вирусу кори
Сдать анализ на наличие антител к кори в Зеленограде, расшифровка анализа антитела к вирусу кори
icon Версия для слабовидящих
icon Диспансеризация
icon Платные услуги
Больница
8 (499) 735-82-89 Перинатальный центр
8 (499) 729-30-31
8 (985) 780-37-31Поликлиника
8 (499) 734-31-01
icon Телефоны горячих линий
Горячая линия больницы
8 (925) 483-23-21 Горячая линия перинатального центра
8 (915) 309-83-36 Роды для иногородних
8 (800) 500-00-03 Единая справочная служба
8 (499) 735-25-97 Горячая линия поликлиник: 122
или 8 (495) 122-02-21
(для звонков из Московской области)
icon Телефоны горячих линий
Горячая линия больницы:
8 (925) 483-23-21
Горячая линия перинатального центра:
8 (915) 309-83-36
Роды для иногородних:
8 (800) 500-00-03
Единая справочная служба:
8 (499) 735-25-97
Горячая линия поликлиник: 122
или 8 (495) 122-02-21
icon Платные услуги
Платные услуги больницы:
8 (499) 735-82-89
Платные услуги перинатального центра:
8 (499) 729-30-31
8 (985) 780-37-31
Платные услуги поликлиники:
8 (499) 734-31-01
Запись на плановую госпитализацию
Корь (morbilli) – острая вирусная инфекция. Сопровождается высокой температурой, специфической экзантемой (сыпью), общей интоксикацией, воспалением слизистых оболочек глотки, конъюнктив и органов дыхания.
Человеческий организм чрезвычайно чувствителен к вирусу кори. При контакте с больными не привитые и ранее не болевшие корью люди, заболевают в 100% случаев. Поэтому каждому чрезвычайно важно знать, есть ли у него иммунитет к этой инфекции.
К сожалению, далеко не у всех есть точные сведения о том, болели они корью в детстве или нет. У многих не сохранились данные о вакцинации. Чтобы понять, имеет ли ваш организм естественный защитный барьер и может ли противостоять вирусу кори, ВОЗ рекомендует периодически проверять количество Антител IgG в сыворотке крови методом ИФА.
Зачем нужен анализ на наличие антител, если Вы уже делали прививку ранее или уже переболели корью?
- У 10-12% людей иммунитет против кори не вырабатывается даже после прививки
- У 20-30% людей иммунитет против кори снижается со временем в результате употребления антибиотиков, иммунодепрессантов и т.д.
- Все эти факторы повышают вероятность непредвиденного заражения, например, взрослого при контакте с больным ребенком.
Определить наличие иммуноглобулинов класса G к вирусу кори можно в клинико-диагностической лаборатории ГБУЗ «ГКБ им. М.П. Кончаловского ДЗМ».
Биоматериалом для исследования является сыворотка крови, в которой определяется наличие вирусоспецифических антител к кори. Основным методом для выявления иммуноглобулинов класса G к данному заболеванию является метод иммуноферментного анализа (ИФА). Этот метод исследования высокочувствителен и специфичен, а также автоматизирован. В нашей лаборатории он выполняется на автоматическом иммуноферментном анализаторе «Лазурит».
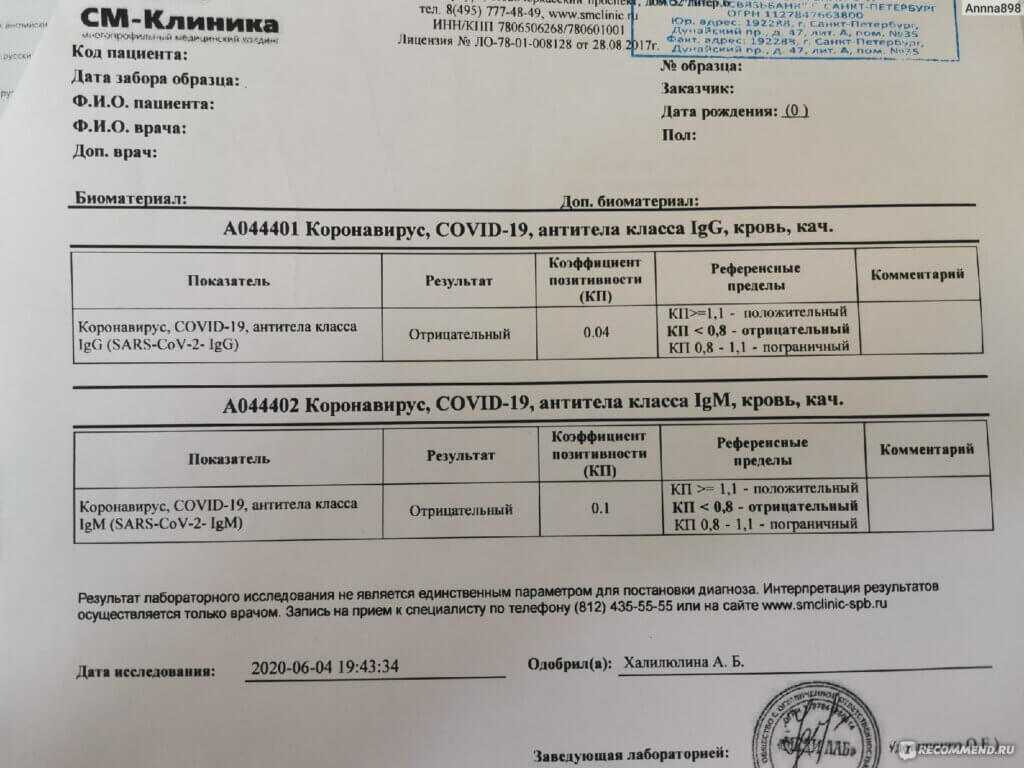
- менее 0,12 – результат отрицательный
- от 0,12 до 0,18 – результат сомнительный
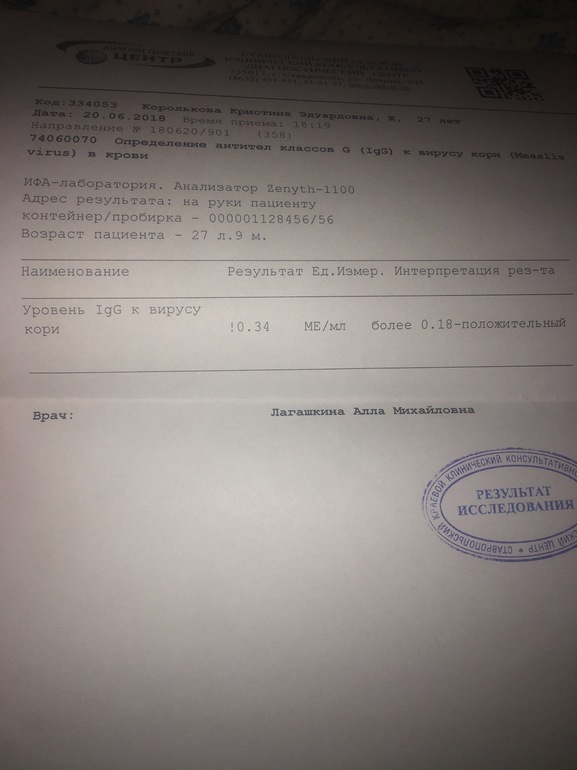
- 0,18 и более – результат положительный
Положительный результат свидетельствует о наличии иммунитета против вируса кори (вследствие перенесенного заболевания или вакцинации).
Отрицательный результат исследования свидетельствует об отсутствии иммунитета против кори. Отрицательный результат может быть получен при проведении исследования в ранние сроки инфекции (в данном случае исследование необходимо повторить через 1 – 2 недели).
Сомнительный результат анализа также требует повторного проведения данного исследования через 2 недели.
Если уровень антител недостаточен, необходимо проконсультироваться с лечащим врачом и пройти вакцинацию.
Где можно сдать анализы в Зеленограде
- в поликлиническом отделении больницы по адресу: г. Москва, г. Зеленоград, ул.
 Каштановая аллея, д. 2, строение 7, 3 этаж, с 8.00 до 12.00.
Каштановая аллея, д. 2, строение 7, 3 этаж, с 8.00 до 12.00. - в акушерско-гинекологическом отделении женской консультации № 1 по адресу: г. Москва, г. Зеленоград, Каштановая аллея, д. 2, стр. 6, 1 этаж, с 8.00 до 12.00.
- в акушерско-гинекологическом отделении № 2 женской консультации по адресу: г. Москва, г. Зеленоград, корп. 911, 5 этаж (ГП № 201), с 8.00 до 12.00.
- в акушерско-гинекологическом отделении №3 женской консультации по адресу: г. Москва, г. Зеленоград, корп. 1460, (ГП № 201), с 8.00 до 12.00.
- в консультативно-диагностическом отделении филиала «Перинатальный центр» по адресу: г. Москва, г. Зеленоград, ул. Александровка, д. 8, гинекологический корпус, с 8.00 до 20.00.
ВАЖНО! Для проведения такого лабораторного исследования необходима венозная кровь. Материал для анализа сдаётся утром, натощак. В течение 8 часов перед анализом нельзя принимать пищу, пить спиртные напитки, проходить медицинские процедуры и переносить чрезмерные физические нагрузки. В течение часа до сбора крови запрещено курить.
В течение часа до сбора крови запрещено курить.
Вирус кори (антитела класса IgG)
Рейтинг статьи: 4,68 (90)
Описание Подготовка
Корь (лат. Morbilli) — острое инфекционное вирусное заболевание с высоким уровнем восприимчивости (индекс контагиозности приближается к 100 %), которое характеризуется высокой температурой (до 40,5 °C), воспалением слизистых оболочек полости рта и верхних дыхательных путей, конъюнктивитом и характерной пятнисто-папулезной сыпью кожных покровов, общей интоксикацией.
Корь известна со времён глубокой древности. Его подробное клиническое описание составили арабский врач Разес (IX век), англичане Т. Сиднэм и Р. Мортон (XVII век).
Возбудителем кори является РНК-вирус рода морбилливирусов, семейства парамиксовирусов, имеет сферическую форму и диаметр 120-230 нм. Состоит из нуклеокапсида — спирали РНК плюс три белка и внешней оболочки образованной матричными белками (поверхностными глюкопротеинами) двух типов — один из них гемагглютинин, другой «гантелеобразный» белок.
Все известные штаммы вируса принадлежат к одному серовару; антигенная структура сходна с возбудителями парагриппа и эпидемического паротита. Наиболее важные антигены — гемагглютинин, гемолизин, нуклеокапсид и мембранный белок.
Вирус малоустойчив во внешней среде, быстро погибает вне человеческого организма от воздействия различных химических и физических факторов (облучение, кипячение, обработка дезинфицирующими средствами).
 При комнатной температуре сохраняет активность около 1-2 сут, при низкой температуре — в течение нескольких недель. Оптимальная температура для сохранения вируса — (-15)-(-20) °С.
При комнатной температуре сохраняет активность около 1-2 сут, при низкой температуре — в течение нескольких недель. Оптимальная температура для сохранения вируса — (-15)-(-20) °С.Несмотря на нестойкость к воздействию внешней среды известны случаи распространения вируса на значительные расстояния с током воздуха по вентиляционной системе — в холодное время года в одном отдельно взятом здании. Ослабленные штаммы коревого вируса используются для производства живой противокоревой вакцины.
Путь передачи кори
Источник инфекции — больной корью в любой форме, который заразен для окружающих с последних дней инкубационного периода (последние 2 дня) до 4-го дня высыпаний. С 5-го дня высыпаний больной считается незаразным.
Корью болеют преимущественно дети в возрасте 2-5 лет и значительно реже взрослые, не переболевшие этим заболеванием в детском возрасте.
 Новорожденные дети имеют колостральный иммунитет, переданный им от матерей, если те переболели корью ранее. Этот иммунитет сохраняется первые 3 месяца жизни. Встречаются случаи врожденной кори при трансплацентарном заражении вирусом плода от больной матери.
Новорожденные дети имеют колостральный иммунитет, переданный им от матерей, если те переболели корью ранее. Этот иммунитет сохраняется первые 3 месяца жизни. Встречаются случаи врожденной кори при трансплацентарном заражении вирусом плода от больной матери.После перенесенного заболевания развивается стойкий иммунитет, повторное заболевание корью человека, без сопутствующей патологии иммунной системы, сомнительно, хотя и такие случаи описаны. Большинство случаев кори наблюдаются в зимне-весенний (декабрь-май) период с подъёмом заболеваемости каждые 2-4 года.
В настоящее время в странах, проводящих тотальную вакцинацию против кори, заболевание встречается в виде единичных случаев или мини-эпидемий.
Воротами инфекции служат слизистые оболочки верхних дыхательных путей и, возможно, конъюнктивы. После первичной репликации в эпителиальных клетках и регионарных лимфатических узлах возбудитель проникает в кровь, первичная вирусемия развивается уже в инкубационном периоде.
 В результате вирус диссеминирует, фиксируется в различных органах и вторично накапливается в клетках макрофагальной системы. В органах (лимфатических узлах, миндалинах, лёгких, кишечнике, печени и селезёнке, миелоидной ткани костного мозга) развиваются небольшие воспалительные инфильтраты с пролиферацией ретикулоэндотелия и образованием многоядерных гигантских клеток. В инкубационном периоде количество вирусов в организме ещё сравнительно невелико и может быть нейтрализовано введением противокоревого иммуноглобулина лицам, контактировавшим с больным корью, не позднее 5-го дня после контакта.
В результате вирус диссеминирует, фиксируется в различных органах и вторично накапливается в клетках макрофагальной системы. В органах (лимфатических узлах, миндалинах, лёгких, кишечнике, печени и селезёнке, миелоидной ткани костного мозга) развиваются небольшие воспалительные инфильтраты с пролиферацией ретикулоэндотелия и образованием многоядерных гигантских клеток. В инкубационном периоде количество вирусов в организме ещё сравнительно невелико и может быть нейтрализовано введением противокоревого иммуноглобулина лицам, контактировавшим с больным корью, не позднее 5-го дня после контакта.Обладая тропностью к эпителиальным клеткам слизистых оболочек и ЦНС, вирус в основном поражает верхние отделы дыхательных путей (иногда также бронхи и лёгкие), конъюнктиву, в незначительной степени ЖКТ.
 Развивается воспаление с появлением гигантских клеток в лимфоидных образованиях кишечника, а также в ЦНС, вследствие чего появляется возможность развития осложнений в виде менингитов и менингоэнцефалитов. Белковые компоненты вируса и биологически активные вещества, высвобождающиеся в ответ на циркуляцию вируса, придают катаральному воспалению в поражённых органах инфекционно-аллергический характер. Специфический воспалительный очаговый процесс с аллергической реакцией, дистрофией эпителия, увеличением проницаемости сосудов, периваскулярной инфильтрацией и отёком лежит в основе формирования коревой энантемы, пятен Филатова-Коплика-Вельского на слизистой оболочке щёк и губ, а позже и экзантемы.
Развивается воспаление с появлением гигантских клеток в лимфоидных образованиях кишечника, а также в ЦНС, вследствие чего появляется возможность развития осложнений в виде менингитов и менингоэнцефалитов. Белковые компоненты вируса и биологически активные вещества, высвобождающиеся в ответ на циркуляцию вируса, придают катаральному воспалению в поражённых органах инфекционно-аллергический характер. Специфический воспалительный очаговый процесс с аллергической реакцией, дистрофией эпителия, увеличением проницаемости сосудов, периваскулярной инфильтрацией и отёком лежит в основе формирования коревой энантемы, пятен Филатова-Коплика-Вельского на слизистой оболочке щёк и губ, а позже и экзантемы.Системное поражение лимфоидной ткани, макрофагальных элементов, отделов ЦНС (ретикулярной формации, подбугровои области и др.) приводит к транзиторному подавлению гуморальных и клеточных иммунных реакций. Ослабление активности неспецифических и специфических факторов защиты, свойственное кори, обширные поражения слизистых оболочек респираторного тракта и ЖКТ, а также снижение витаминного обмена с дефицитом витаминов С и А составляют группу факторов, способствующих возникновению разнообразных бактериальных осложнений.

После выздоровления формируется иммунитет с пожизненным сохранением противокоревых антител в крови. Вместе с тем считают, что вирус может длительно оставаться в организме человека и быть виновником развития медленной инфекции в форме рассеянного склероза, подострого склерозирующего панэнцефалита, а также, возможно, некоторых системных заболеваний — системной красной волчанки, системной склеродермии, ревматоидного артрита.
Микроскопическая картина: слизистая дыхательных путей — отек, полнокровие сосудов, очаги некроза, участки метаплазии эпителия, очаговая лимфогистиоцитарная инфильтрация в подслизистом слое. Ретикулоэндотелиальная система — клетки Warthin-Finkeldey. Кожа — изменения в сосочковом слое дермы в виде отека, полнокровия сосудов, кровоизлияний с периваскулярной лимфогистиоцитарной инфильтрацией, фокусы некроза в эпидермисе.
Инкубационный период составляет в среднем 1-2 нед, при пассивной иммунизации иммуноглобулином он может удлиняться до 3-4 нед.
 Существующие клинические классификации выделяют типичную форму кори различных степеней тяжести и атипичную форму. Цикличность течения заболевания в типичной форме позволяет выделить три последовательных периода клинических проявлений кори:
Существующие клинические классификации выделяют типичную форму кори различных степеней тяжести и атипичную форму. Цикличность течения заболевания в типичной форме позволяет выделить три последовательных периода клинических проявлений кори:• катаральный период;
• период высыпания;
• период реконвалесценции.
Катаральный период начинается остро. Появляются общее недомогание, головная боль, снижение аппетита, нарушения сна. Повышается температура тела, при тяжёлых формах она достигает 39-40 °С. Признаки интоксикации у взрослых больных выражены значительно больше, чем у детей. С первых дней болезни отмечают насморк с обильными слизистыми, иногда слизисто-гнойными выделениями. Развивается навязчивый сухой кашель, у детей он часто становится грубым, «лающим», сопровождается осиплостью голоса и (в ряде случаев) стенотическим дыханием. Одновременно развивается конъюнктивит с отёчностью век, гиперемией конъюнктив, инъекцией склер и гнойным отделяемым.
 Нередко по утрам веки слипаются. Больного раздражает яркий свет. При осмотре больных корью детей выявляют одутловатость лица, гиперемию слизистой оболочки ротоглотки, зернистость задней стенки глотки. У взрослых эти симптомы выражены незначительно, но наблюдают лимфаденопатию (преимущественно шейных лимфатических узлов), прослушивают жёсткое дыхание и сухие хрипы в лёгких. У части больных отмечают непродолжительный кашицеобразный стул.
Нередко по утрам веки слипаются. Больного раздражает яркий свет. При осмотре больных корью детей выявляют одутловатость лица, гиперемию слизистой оболочки ротоглотки, зернистость задней стенки глотки. У взрослых эти симптомы выражены незначительно, но наблюдают лимфаденопатию (преимущественно шейных лимфатических узлов), прослушивают жёсткое дыхание и сухие хрипы в лёгких. У части больных отмечают непродолжительный кашицеобразный стул.На 3-5-й день самочувствие больного несколько улучшается, снижается лихорадка. Однако через день вновь усиливаются проявления интоксикации и катарального синдрома, температура тела поднимается до высоких цифр. В этот момент на слизистой оболочке щёк напротив малых коренных зубов (реже на слизистой оболочке губ и дёсен) можно обнаружить кардинальный клинический диагностический признак кори — пятна Филатова-Коплика-Вельского. Они представляют собой несколько выступающие и плотно фиксированные белые пятна, окружённые тонкой каймой гиперемии (вид «манной каши»).
 У детей элементы обычно исчезают с появлением экзантемы, у взрослых могут сохраняться в течение первых её дней. Несколько раньше пятен Филатова-Коплика-Вельского или одновременно с ними на слизистой оболочке мягкого и частично твёрдого нёба появляется коревая энантема в виде красных пятен неправильной формы, величиной с булавочную головку. Через 1-2 сут они сливаются и теряются на общем гиперемированном фоне слизистой оболочки.
У детей элементы обычно исчезают с появлением экзантемы, у взрослых могут сохраняться в течение первых её дней. Несколько раньше пятен Филатова-Коплика-Вельского или одновременно с ними на слизистой оболочке мягкого и частично твёрдого нёба появляется коревая энантема в виде красных пятен неправильной формы, величиной с булавочную головку. Через 1-2 сут они сливаются и теряются на общем гиперемированном фоне слизистой оболочки.В это же время при нарастании симптомов интоксикации иногда можно наблюдать диспептические явления. В целом катаральный период продолжается 3-5 дней, у взрослых иногда затягивается до 6-8 сут.
Период высыпания сменяет катаральный период. Характерно появление яркой пятнисто-папулёзной экзантемы, имеющей тенденцию к слиянию и образованию фигур с участками здоровой кожи между ними.
• В первый день элементы сыпи появляются за ушами, на волосистой части головы, затем в тот же день возникают на лице и шее, верхней части груди.
• На 2-й день высыпания сыпь покрывает туловище и верхнюю часть рук.
• На 3-е сутки элементы экзантемы выступают на нижних конечностях и дистальных отделах рук, а на лице бледнеют.
Нисходящая последовательность высыпаний характерна для кори и служит очень важным дифференциально-диагностическим признаком. У взрослых сыпь бывает обильнее, чем у детей, она крупнопятнисто-папулёзная, часто сливная, при более тяжёлом течении заболевания возможно появление геморрагических элементов.
Период высыпания сопровождает усиление катаральных явлений — насморка, кашля, слезотечения, светобоязни — и максимальная выраженность лихорадки и других признаков токсикоза. При обследовании больных часто выявляют признаки трахеобронхита, умеренно выраженные тахикардию и артериальную гипотензию.
Период реконвалесценции (период пигментации) проявляется улучшением общего состояния больных: их самочувствие становится удовлетворительным, нормализуется температура тела, постепенно исчезают катаральные симптомы. Элементы сыпи бледнеют и угасают в том же порядке, в каком они появлялись, постепенно превращаясь в светло-коричневые пятна.
 В последующем пигментация исчезает за 5-7 дней. После её исчезновения можно наблюдать отрубевидное шелушение кожи, в основном на лице. Пигментация и шелушение также служат диагностически важными, хотя и ретроспективными признаками кори. В этот период отмечают снижение активности неспецифических и специфических факторов защиты (коревая анергия). Реактивность организма восстанавливается медленно, в течение нескольких последующих недель и даже месяцев сохраняется пониженная сопротивляемость к различным патогенным агентам.
В последующем пигментация исчезает за 5-7 дней. После её исчезновения можно наблюдать отрубевидное шелушение кожи, в основном на лице. Пигментация и шелушение также служат диагностически важными, хотя и ретроспективными признаками кори. В этот период отмечают снижение активности неспецифических и специфических факторов защиты (коревая анергия). Реактивность организма восстанавливается медленно, в течение нескольких последующих недель и даже месяцев сохраняется пониженная сопротивляемость к различным патогенным агентам.Митигированная корь. Атипичная форма, развивающаяся у лиц, получивших пассивную или активную иммунизацию против кори или ранее переболевших ею. Отличается более длительным инкубационным периодом, лёгким течением с мало выраженной или совсем не выраженной интоксикацией, сокращённым катаральным периодом. Пятна Филатова-Коплика-Вельского чаще всего отсутствуют. Сыпь типична, но высыпание может возникнуть одновременно по всей поверхности туловища и конечностей или иметь восходящую последовательность.

Абортивная корь также относится к атипичным формам заболевания. Начинается как типичная форма, но прерывается через 1-2 дня от начала болезни. Сыпь появляется только на лице и туловище, повышение температуры тела наблюдают обычно только в первый день высыпаний.
Также встречают субклинические варианты кори, выявляемые только при серологическом исследовании парных сывороток крови.
Осложнения кори.
Наиболее частое осложнение кори — пневмония. Ларингиты и ларинготрахеобронхиты у детей младшего возраста могут вести к развитию ложного крупа. Встречают стоматиты. Менингиты, менингоэнцефалиты и полиневриты чаще наблюдают у взрослых, эти состояния обычно развиваются в периоде пигментации. Наиболее грозным, но, к счастью, редким осложнением (чаще у взрослых) бывает коревой энцефалит.
Лабораторные данные при кори:
лимфопения, лейкопения, в случае бактериальных осложнений — лейкоцитоз, нейтрофилез.
 При коревом энцефалите — повышенное содержание лимфоцитов в спинномозговой жидкости. Через 1-2 дня после высыпаний повышается специфический IgM. Через 10 дней IgG. Для выявления специфических противокоревых антител используется реакция гемагглютинации. В ранние сроки болезни вирус обнаруживается методом иммунофлюоресценции.
При коревом энцефалите — повышенное содержание лимфоцитов в спинномозговой жидкости. Через 1-2 дня после высыпаний повышается специфический IgM. Через 10 дней IgG. Для выявления специфических противокоревых антител используется реакция гемагглютинации. В ранние сроки болезни вирус обнаруживается методом иммунофлюоресценции.Корь следует дифференцировать от краснухи, скарлатины, псевдотуберкулёза, аллергических (лекарственных и др.) дерматитов, энтеровирусных инфекций, сывороточной болезни и других заболеваний, сопровождающихся появлением кожных высыпаний.
Корь отличает комплекс основных клинических проявлений в катаральном периоде: интоксикация, насморке обильными выделениями, навязчивый грубый, «лающий» кашель, осиплость голоса, выраженный конъюнктивит с отёчностью век, инъекцией сосудов склер и гнойным отделяемым, фотофобия, появление кардинального клинического диагностического признака — пятен Филатова-Коплика-Вельского на 3-5-й день болезни. Затем возникает яркая пятнисто-папулёзная экзантема, имеющая тенденцию к слиянию.
 Очень важным дифференциально-диагностическим признаком, характерным для кори (за исключением митигированной), является нисходящая последовательность высыпаний.
Очень важным дифференциально-диагностическим признаком, характерным для кори (за исключением митигированной), является нисходящая последовательность высыпаний.
Необходимо воздержаться от приема пищи в течение 2-3 часов.
Используя сайт gemohelp.ru, вы соглашаетесь с использованием файлов cookie
Подтверждаю
Подробнее
Антитела класса IgM к вирусу кори
Описание
Исследуемый материал Сыворотка крови
Метод определения Иммуноанализ.
Вирус кори относится к семейству Morbillivirus семейства парамиксовирусов. Вирусная частица содержит РНК, окруженную белковым капсидом и внешней белково-липидной оболочкой. Вирус способен связываться с клетками, несущими рецептор комплемента CD46.
Корь – высококонтагиозное заболевание. Ранее, до повсеместной вакцинации, она была одной из самых распространённых детских инфекций (преимущественно среди детей дошкольного и школьного возраста). Передача вируса происходит воздушно-капельным путем. Первоначально вирус размножается в слизистой, что сопровождается умеренной виремией. Затем с кровью попадает в лимфоидную ткань, в которой активно размножается, особенно в моноцитах. После этого происходит широкое распространение вируса, совпадающее с продромальным периодом (повышение температуры, недомогание). В это время (9 — 10 сутки от момента заражения) вирус выявляется практически во всех тканях, особенно в эпителии дыхательных путей и лимфоидной ткани. Появляется кашель, насморк, конъюнктивит, повышается температура. В течение последующих 5 — 6 суток, больные наиболее заразны. Во время появления характерной сыпи (примерно на 14-е сутки) репродукция вируса снижается, к 16-м суткам вирус уже может не выявляться. В это время в крови выявляются специфические антитела. С появлением сыпи симптомы достигают максимума, наиболее тяжёлое состояние отмечается на 2 — 4 сутки, когда сыпь охватывает всё тело. Нередко сыпь сопровождается головной болью, рвотой, болями в животе, поносом и болями в мышцах.
Передача вируса происходит воздушно-капельным путем. Первоначально вирус размножается в слизистой, что сопровождается умеренной виремией. Затем с кровью попадает в лимфоидную ткань, в которой активно размножается, особенно в моноцитах. После этого происходит широкое распространение вируса, совпадающее с продромальным периодом (повышение температуры, недомогание). В это время (9 — 10 сутки от момента заражения) вирус выявляется практически во всех тканях, особенно в эпителии дыхательных путей и лимфоидной ткани. Появляется кашель, насморк, конъюнктивит, повышается температура. В течение последующих 5 — 6 суток, больные наиболее заразны. Во время появления характерной сыпи (примерно на 14-е сутки) репродукция вируса снижается, к 16-м суткам вирус уже может не выявляться. В это время в крови выявляются специфические антитела. С появлением сыпи симптомы достигают максимума, наиболее тяжёлое состояние отмечается на 2 — 4 сутки, когда сыпь охватывает всё тело. Нередко сыпь сопровождается головной болью, рвотой, болями в животе, поносом и болями в мышцах.
Выраженное увеличение лимфоузлов и селезёнки, появляющееся в первые дни болезни, может сохраняться несколько недель. В острой стадии болезни и после исчезновения сыпи могут развиваться вторичные осложнения, связанные с инвазией гноеродных бактерий в дыхательные пути. Возможно развитие среднего отита или бронхопневмонии. Самые тяжёлые осложнения кори – поражения центральной нервной системы (панэнцефалит).
У переболевших корью людей развивается пожизненный иммунитет. Вакцинация живой противокоревой вакциной также обеспечивает стойкий иммунитет, инактивированной – на 6 — 18 месяцев. В зрелом возрасте иммунитет против кори (вследствие перенесённого заболевания или вакцинации) имеют практически все. Корь у беременных встречается редко, она может вызвать преждевременные роды, самопроизвольный аборт, мёртворождение. Однако пороков развития плода не наблюдается. Новорожденные дети у матерей, имеющих иммунитет против кори, защищены от инфекции материнскими антителами, прошедшими в их кровь через плаценту, вплоть до 6 — 7-месячного возраста после рождения. Начиная со второго полугодия жизни, восприимчивость детей к заболеванию растет.
Начиная со второго полугодия жизни, восприимчивость детей к заболеванию растет.
Лабораторная диагностика. В случае затруднений в диагностике по клинической картине заболевания, целесообразно использование серологическох тестов (исследование уровня в крови IgM и IgG антител к вирусу кори – в лаборатории ИНВИТРО тесты № 251 и № 250). Неспецифическим лабораторным признаком кори является лейкопения со снижением абсолютного количества нейтрофилов и выраженным снижением числа лимфоцитов в продромальном периоде и периоде высыпаний (в лаборатории ИНВИТРО тесты № 5, № 119).
Антитела класса IgG к вирусу кори появляются вслед за антителами класса IgM примерно через 2 недели после инфицирования. В ходе дальнейшего развития иммунного ответа их концентрация быстро растёт. Специфические антитела в крови можно выявить практически у всех больных корью уже ко 2 дню появления сыпи. Антитела класса IgG сохраняются после перенесённого заболевания обычно пожизненно. IgG против вируса кори выявляются также и после вакцинации. По их присутствию в крови можно судить о наличии иммунитета к этому заболеванию. В крови новорожденных до 6 — 7 месячного возраста могут выявляться материнские IgG антитела, полученные через плаценту из крови матери в период беременности (IgM антитела через плаценту не проходят). При повторном контакте с вирусом у иммунных лиц наблюдается быстрый рост титров высокоспецифичных IgG, что обеспечивает защиту от инфекции (клинических проявлений и выделения вируса при этом не наблюдается).
По их присутствию в крови можно судить о наличии иммунитета к этому заболеванию. В крови новорожденных до 6 — 7 месячного возраста могут выявляться материнские IgG антитела, полученные через плаценту из крови матери в период беременности (IgM антитела через плаценту не проходят). При повторном контакте с вирусом у иммунных лиц наблюдается быстрый рост титров высокоспецифичных IgG, что обеспечивает защиту от инфекции (клинических проявлений и выделения вируса при этом не наблюдается).
Литература
- Инфекционные болезни у детей. Ред. Д. Марри. М. Практика, 2006. 928 с.
- Материалы фирмы – производителя реагентов.
- Jacobs D. et al. Laboratory test handbook/ Lexi-Comp./2002 — 1534 p.
Подготовка
Специальная подготовка не требуется. Рекомендуется взятие крови не ранее чем через 4 часа после последнего приема пищи.
С общими рекомендациями для подготовки к исследованиям можно ознакомиться здесь >>.
Литература
- Инфекционные болезни у детей. Ред. Д. Марри. М. Практика, 2006. 928 с.
- Материалы фирмы – производителя реагентов.
- Jacobs D. et al. Laboratory test handbook/ Lexi-Comp./2002 — 1534 p.
Показания
- Лабораторное подтверждение клинического диагноза кори.
Литература
- Инфекционные болезни у детей. Ред. Д. Марри. М. Практика, 2006. 928 с.
- Материалы фирмы – производителя реагентов.
- Jacobs D. et al. Laboratory test handbook/ Lexi-Comp./2002 — 1534 p.
Интерпретация результатов
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом.
Информацию из этого раздела нельзя использовать для самодиагностики и самолечения.
Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза,
результатов других обследований и т. д.
д.
Единицы измерения в лаборатории ИНВИТРО: тест качественный. Результаты выдаются в терминах «положительно», «отрицательно», «сомнительно».
Интерпретация результатов
Положительно: острая инфекция вирусом кори.
Отрицательно:
- отсутствие инфекции;
- ранние сроки инфекции (до появления сыпи). Исследование целесообразно повторить через 1 — 2 недели для выявления сероконверсии.
- отдалённые сроки после начала инфекции (более 2 — 3 месяцев).
Сомнительно: результат близкий к пороговому значению. Исследование следует повторить через 1 — 2 недели.
Литература
- Инфекционные болезни у детей. Ред. Д. Марри. М. Практика, 2006. 928 с.
- Материалы фирмы – производителя реагентов.
- Jacobs D. et al. Laboratory test handbook/ Lexi-Comp./2002 — 1534 p.
Серология кори | CDC
- Серологическое тестирование на корь в условиях низкой распространенности
- Инструкции по сбору крови (сыворотки)
- Отправка образцов в CDC: вопросы и ответы
- Специализированное серологическое тестирование: анализ авидности и PRN
- Справочные материалы для тестирования 900 корь в условиях низкой распространенности
- Серология кори (тест CDC-10244)
- Коревая авидность (Тест CDC-10248)
- Cremer NE, Cossen CK, Shell G, Diggs J, Gallo D и Schmidt NJ. Иммуноферментный анализ против нейтрализации бляшек и других методов определения иммунного статуса к вирусам кори и ветряной оспы и против связывания комплемента для серодиагностики инфекций, вызванных этими вирусами. Дж Клин Микробиол . 1985; 21:869-873.
- Эрдман Д.Д., Андерсон Л.Дж., Адамс Д.Р., Стюарт Дж.А., Марковиц Л.Е. и Беллини В.Дж. Оценка иммуноферментных анализов захвата на основе моноклональных антител для выявления специфических антител к вирусу кори. Дж Клин Микробиол . 1991; 29:1466-1471.
- Хаммель К.Б., Эрдман Д.Д., Хит Дж. и Беллини В.Дж. Бакуловирусная экспрессия нуклеопротеинового гена вируса кори и использование рекомбинантного белка в диагностических иммуноферментных анализах.
 J Clin Microbiol. 1992;30:2874-2880.
J Clin Microbiol. 1992;30:2874-2880. - Хелфанд Р.Ф., Хит Дж.Л., Андерсон Л.Дж., Маес Э.Ф., Гурис Д. и Беллини В.Дж. Диагностика кори с помощью ИФА с захватом IgM: оптимальное время сбора образца после появления сыпи. J Заражение Dis. 1997; 175:195-199.
- Ратнам С., Типплс Дж., Хед С., Фовель М., Фирон М. и Уорд Б.Дж. Проведение серологических тестов непрямого иммуноглобулина М (IgM) и анализов захвата IgM для лабораторной диагностики кори. J Clin Microbiol. 2000;38:99-10.
- Hickman CJ, Sowers SB, Mercader S, McGrew M, Williams NJ, Beeler JA et al. Лабораторная характеристика вирусной инфекции кори у ранее привитых и непривитых лиц. J Заражение Dis. 2011;204(Приложение 1):S549-558.
- Рота Дж. Р., Хикман С. Дж., Сауэрс С. Б., Рота П. А., Меркадер С. и Беллини В. Дж. . Два тематических исследования модифицированной кори у вакцинированных врачей, подвергшихся первичному заражению корью: высокий риск заражения, но низкий риск передачи.
 J Заражение Dis. 2011;204(Приложение 1):S559-563.
J Заражение Dis. 2011;204(Приложение 1):S559-563. - Сауэрс С.Б., Рота Дж.Р., Хикман С.Дж., Меркадер С., Редд С., МакНолл Р.Дж., Уильямс Н., МакГрю М., Уоллс М.Л., Рота П.А. и Беллини В.Дж. Диагностическая лабораторная иммунология: высокие концентрации коревых нейтрализующих антител и высокоавидные коревые IgG точно определяют случаи повторного заражения корью. Вакцина Клин Иммунол . 2016;23(8):707-16.
- Латнер Д.Р., Сауэрс С.Б., Энтони К., Колли Х., Бадо С., Коутс Дж., Вонг П., Факиле И., Интериано С., Паннелл К.Б., Леунг-Пинеда В., Патель М.М., Рота П.А., Лимбаго Б.М., Хикман С.Дж. Качественная вариация среди коммерческих иммуноанализов для обнаружения специфичных к кори IgG. Дж. Клин Микробиол. 2020;58(6):e00265-20.
- 1 Департамент гигиены окружающей среды Каролинской больницы, Стокгольм, Швеция.
- PMID: 8147093
- DOI: 10.1016/0264-410х(94)-3
- 1 Департамент гигиены окружающей среды Каролинской больницы, Стокгольм, Швеция.
- PMID: 8147093
- DOI: 10.1016/0264-410х(94)-3
Сохранение антител после первичной вакцины против кори, эпидемического паротита и краснухи и ответ на введение второй дозы в возрасте от четырех до шести лет по сравнению с одиннадцатью-тринадцатью годами.
Джонсон К.Э., Кумар М.Л., Уитвелл Дж.
 К., Штеле Б.О., Рим Л.П., Динакар С., Хурни В., Налин Д.Р.
Джонсон К.Э. и соавт.
Pediatr Infect Dis J. 1996 Aug;15(8):687-92. doi: 10.1097/00006454-199608000-00010.
Педиатр Infect Dis J. 1996.
PMID: 8858673
К., Штеле Б.О., Рим Л.П., Динакар С., Хурни В., Налин Д.Р.
Джонсон К.Э. и соавт.
Pediatr Infect Dis J. 1996 Aug;15(8):687-92. doi: 10.1097/00006454-199608000-00010.
Педиатр Infect Dis J. 1996.
PMID: 8858673Изменения иммунологического паттерна против кори, эпидемического паротита и краснухи. Программа вакцинации изучалась через 3–7 лет после введения двухдозового режима.
Кристенсон Б., Бёттигер М. Кристенсон Б. и соавт. вакцина. 1991 г., май; 9(5):326-9. doi: 10.1016/0264-410x(91)
-e. вакцина. 1991. PMID: 1872016
Иммунитет к кори до и после ревакцинации MMR или первичной вакцинации в возрасте 12 лет в первом поколении предложил программу иммунизации двумя дозами.
Бролиден К., Левен Б., Арнеборн М.
 , Бёттигер М.
Бролиден К. и др.
Scand J Infect Dis. 1998;30(1):23-7. дои: 10.1080/003655498750002259.
Scand J Infect Dis. 1998.
PMID: 9670354
, Бёттигер М.
Бролиден К. и др.
Scand J Infect Dis. 1998;30(1):23-7. дои: 10.1080/003655498750002259.
Scand J Infect Dis. 1998.
PMID: 9670354[Продолжительность иммунитета и возникновение вторичной неудачи вакцины после вакцинации против кори, эпидемического паротита и краснухи].
Триер Х., Рённе Т. Триер Х. и др. Угескр Лаегер. 1992 г., 13 июля; 154 (29): 2008-13. Угескр Лаегер. 1992. PMID: 1509566 Обзор. датский.
Стандарт качества для обеспечения иммунитета против кори среди медицинских работников. Американское общество инфекционистов.
Krause PJ, Gross PA, Barrett TL, Dellinger EP, Martone WJ, McGowan JE Jr, Sweet RL, Wenzel RP. Krause PJ и др. Infect Control Hosp Epidemiol.
 1994 марта; 15(3):193-9. дои: 10.1086/646889.
Infect Control Hosp Epidemiol. 1994.
PMID: 8207178
Обзор.
1994 марта; 15(3):193-9. дои: 10.1086/646889.
Infect Control Hosp Epidemiol. 1994.
PMID: 8207178
Обзор.Иммуногенность после мероприятий по иммунизации в ответ на вспышку среди молодых медицинских работников с вторичной неудачей вакцины во время эпидемии кори в Корее, 2019 г.
Seok H, Españo E, Kim J, Jeon JH, Choi WS, Kim YK, Kim JK, Park DW. Сок Х и др. BMC Infect Dis. 2022 8 июня; 22(1):530. дои: 10.1186/s12879-022-07511-2. BMC Infect Dis. 2022. PMID: 35676650 Бесплатная статья ЧВК.
Идентификация терапевтической мешающей частицы — однократного противовирусного вмешательства против SARS-CoV-2 с высоким барьером устойчивости.

Чатурведи С., Васен Г., Пабло М., Чен Х., Бейтлер Н., Кумар А., Таннер Э., Иллоуз С., Рахгошай Д., Бернетт Дж., Ольгин Л., Чен П.Ю., Нджамен Б., Отт М., Родик Р., Роджерс Т., Смит Д.М., Вайнбергер Л.С. Чатурведи С. и др. Клетка. 2021 9 дек.;184(25):6022-6036.e18. doi: 10.1016/j.cell.2021.11.004. Epub 2021 10 ноября. Клетка. 2021. PMID: 34838159 Бесплатная статья ЧВК.
Долгосрочная иммуногенность после коревой вакцины против дикой инфекции: итальянское ретроспективное когортное исследование.
Бьянки Ф.П., Маскипинто С., Стефаницци П., Де Нитто С., Жерминарио С., Тафури С. Бьянки Ф.П. и др. Hum Вакцина Иммунотер. 2021 3 июля; 17 (7): 2078-2084. дои: 10.1080/21645515.2020.1871296. Epub 2021, 27 января. Hum Вакцина Иммунотер. 2021. PMID: 33502929 Бесплатная статья ЧВК.
Растительные частицы, подобные вирусу денге, продуцируемые путем совместной экспрессии структурных и неструктурных белков, вызывают гуморальный иммунный ответ у мышей.

Понндорф Д., Мещерякова Ю., Туенеманн Э.К., Добон Алонсо А., Оверман Р., Холтон Н., Доуэлл С., Кеннеди Э., Стокс М., Ломоносов Г.П., Пейре Х. Понндорф Д. и соавт. Plant Biotechnol J. 2021 Apr;19(4): 745-756. doi: 10.1111/pbi.13501. Epub 2020 22 ноября. Завод Биотехнолог Ж. 2021. PMID: 33099859 Бесплатная статья ЧВК.
Возрождение кори и разработка лекарств.
Племпер РК. Племпер РК. Карр Опин Вирол. 2020 апр;41:8-17. doi: 10.1016/j.coviro.2020.02.007. Epub 2020 1 апр. Карр Опин Вирол. 2020. PMID: 32247280 Бесплатная статья ЧВК. Обзор.
Текущая активность кори в других странах приведет к спорадическим случаям кори в Соединенных Штатах. Оценка и интерпретация результатов диагностики кори могут быть сложными, особенно в условиях элиминации кори. Обнаружение специфических IgM-антител в образцах сыворотки, собранных в течение первых нескольких дней после появления сыпи, может дать предположительные доказательства текущей или недавней инфекции вирусом кори. Однако, поскольку ни один анализ не является специфичным на 100%, серологическое тестирование некоревых случаев с использованием любого анализа иногда дает ложноположительные результаты IgM. Серологические тесты также могут давать ложноотрицательные результаты, если образцы сыворотки берутся слишком рано относительно появления сыпи.
Оценка и интерпретация результатов диагностики кори могут быть сложными, особенно в условиях элиминации кори. Обнаружение специфических IgM-антител в образцах сыворотки, собранных в течение первых нескольких дней после появления сыпи, может дать предположительные доказательства текущей или недавней инфекции вирусом кори. Однако, поскольку ни один анализ не является специфичным на 100%, серологическое тестирование некоревых случаев с использованием любого анализа иногда дает ложноположительные результаты IgM. Серологические тесты также могут давать ложноотрицательные результаты, если образцы сыворотки берутся слишком рано относительно появления сыпи.
В таких странах, как США, где эндемичная циркуляция кори ликвидирована, большинство подозрительных случаев не связаны с корью, а сыпь и лихорадка более вероятны из-за ряда других вызывающих сыпь заболеваний, таких как парвовирус B19, энтеровирусы или вирус герпеса человека-6 (розеола). Наличие ревматоидного фактора (РФ) также может привести к ложноположительному результату IgM. Непрямой иммуноферментный анализ (ИФА), по-видимому, более подвержен влиянию RF, чем анализ захвата IgM. Кроме того, у пациентов с инфекциями горла или уха иногда появляется сыпь после введения антибиотиков. Последующие серологические образцы, отправленные для тестирования на коревые IgM, могут привести к ложноположительному результату.
Непрямой иммуноферментный анализ (ИФА), по-видимому, более подвержен влиянию RF, чем анализ захвата IgM. Кроме того, у пациентов с инфекциями горла или уха иногда появляется сыпь после введения антибиотиков. Последующие серологические образцы, отправленные для тестирования на коревые IgM, могут привести к ложноположительному результату.
Лабораторные данные об иммунитете основаны на тестировании на выявление коревых IgG. Людей с отрицательными или сомнительными результатами на IgG против кори следует вакцинировать или ревакцинировать. В некоторых случаях вакцинация невозможна, и может потребоваться тестирование с помощью диагностического теста второй линии для определения иммунного статуса пациента. CDC оценил эффективность нескольких коммерческих ИФА, используемых для выявления коревых IgG (Latner et al, 2020). Некоторые коммерческие ИФА, обрабатываемые вручную, немного более чувствительны, чем высокопроизводительные автоматизированные тестовые платформы IgG, которые обычно используются крупными коммерческими лабораториями. Свяжитесь с CDC или государственной лабораторией общественного здравоохранения для получения информации о тестах второй линии.
Свяжитесь с CDC или государственной лабораторией общественного здравоохранения для получения информации о тестах второй линии.
Инструкции по сбору крови (сыворотки):
Кровь для серологического тестирования на корь в CDC собирают, как описано в записи Справочника лабораторий инфекционных заболеваний для каждого теста, указанного ниже.
Кровь для серологического исследования у младенцев или детей младшего возраста можно собирать палочкой из пальца/пятки. Капиллярные трубки можно использовать для младенцев. Капиллярные трубки требуют, чтобы отправитель имел доступ к центрифуге гематокрита. Клинические лаборатории должны иметь капиллярные пробирки на 50 или 100 мкл, которые обычно используются для различных тестов, таких как определение гематокрита или общего содержания липидов у новорожденных. Не менее 3 из 50 мкл гематокритных капиллярных трубок следует собрать и центрифугировать в гематокритной центрифуге.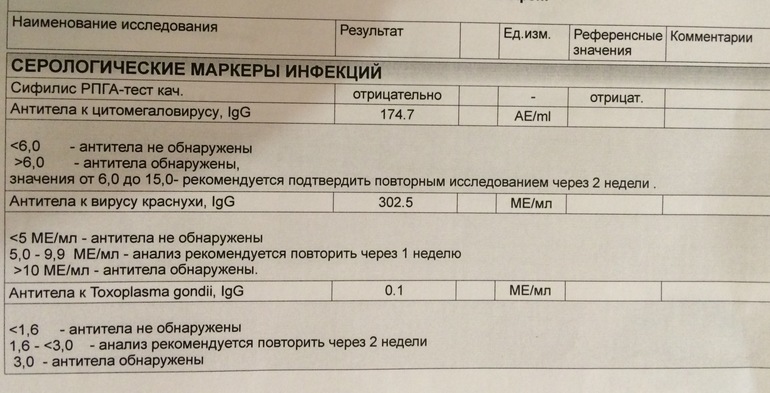
Подача образцов в CDC для серологического тестирования на корь: вопросы и ответы
Какие тесты доступны для лабораторного подтверждения кори ?ИФА с захватом IgM (неколичественный), который включает рекомбинантный нуклеокапсидный белок вируса кори в качестве антигена, используется для выявления коревых IgM. Для обнаружения IgG используется коммерческий непрямой ИФА (неколичественный) анализ. Методы обнаружения вируса включают стандартные методы культивирования вируса в соответствующих клеточных линиях и методы, такие как ОТ-ПЦР в реальном времени для обнаружения РНК вируса кори. ОТ-ПЦР доступен во многих государственных лабораториях общественного здравоохранения, а также в справочных центрах APHL/CDC по вакциноуправляемым заболеваниям.
Кто может отправлять образцы в CDC? Чтобы определить, куда отправлять образцы для тестирования, обратитесь в департамент здравоохранения штата или в местный отдел. Образцы могут быть отправлены в государственную лабораторию, VPD-RC или CDC. См. страницу «Сбор, хранение и отправка образцов».
См. страницу «Сбор, хранение и отправка образцов».
Во время вспышек кори коревая лаборатория CDC может помочь с тестированием.
Для ускорения подтверждения наличия кори в крайне подозрительных случаях (недавние поездки, классические признаки и симптомы кори), особенно в условиях большого числа потенциальных контактов, аликвоту сыворотки, а также мазок из носоглотки или зева можно отправить в CDC во время тестирования проводится в SPHL или местной клинической лаборатории.
Запросы на серологическое тестирование на корь, предназначенные строго для исключения (низкий уровень подозрения, несоответствие клиническому определению случая, отсутствие поездок или контактов с больными), следует направлять либо в SPHL, либо в клинические лаборатории. Предварительная связь с Отделением вирусных вакциноуправляемых заболеваний CDC (VVPDB) относительно предполагаемых случаев кори, требующих помощи, является предпочтительной.
Вместе с каждым образцом необходимо предоставить заполненную форму подачи образцов CDC (50.34). Предоставьте следующую информацию в Форме подачи образцов CDC (50.34): клинические признаки и симптомы, дату начала заболевания, дату взятия образца, дату (даты) вакцинации MMR (если известна) и историю поездок. Предоставьте любые доступные предварительные результаты. В форму необходимо ввести идентификационный номер и/или имя пациента, а также дату рождения пациента.
Образцы сыворотки для серологического тестирования на корь (IgG, IgM) доставляются курьером в лабораторию STATT (Группа сортировки и отслеживания образцов) Центра контроля заболеваний. Затем образцы доставляются в коревую лабораторию VVPDB (подразделение № 81). Срок выполнения тестирования образцов на IgM и IgG составляет 7 рабочих дней после доставки образцов лабораторией STATT в референс-лабораторию по кори.
Если ситуация требует немедленного уведомления о результате, сообщите об этом в лабораторию (д-р Стивен Крук 404-718-4003 или д-р Пол Рота 404-639-4181) после подачи образца. Укажите номер телефона, адрес электронной почты и номер факса.
Специализированное серологическое тестирование, доступное в CDC: тесты на авидность и PRN. быть ложноотрицательным или ложноположительным (Сауэрс и др.). Эти анализы могут быть предложены, когда подтверждение с помощью ОТ-ПЦР не было успешным или молекулярный образец был недоступен. Необходимо получить предварительное одобрение лаборатории VVPDB (Dr. Stephen Crooke 404-718-4003). Тестирование на авидность и анализ PRN требуют специальных реагентов, и их использование ограничено необычными случаями, как правило, в условиях вспышки, когда выявляются случаи с легкой или неклассической формой кори.
Одна сыворотка может быть протестирована на авидность IgG; однако в образцах должен быть определяемый IgG. Срок выполнения тестирования образцов на авидность IgG составляет 30 рабочих дней после доставки образцов лабораторией STATT в референс-лабораторию по кори. Для PRN-тестирования рекомендуется сыворотка как острой фазы, так и фазы выздоровления. Установленного времени выполнения PRN-тестирования на корь не установлено.
Для PRN-тестирования рекомендуется сыворотка как острой фазы, так и фазы выздоровления. Установленного времени выполнения PRN-тестирования на корь не установлено.
Ссылки
К началу страницы
Антитела против кори: сравнение титров длительной вакцинации, титров ранней вакцинации и естественно приобретенного иммунитета к вирусу кори и ревакцинации
Сравнительное исследование
. 1994 февраль; 12(2):129-33.
1994 февраль; 12(2):129-33.
doi: 10.1016/0264-410x(94)-3.
Б Кристенсон 1 , M Böttiger
принадлежность
Сравнительное исследование
B Christenson et al. вакцина. 1994 февраля
. 1994 февраль; 12(2):129-33.
doi: 10.1016/0264-410x(94)-3.
Авторы
Б Кристенсон 1 , М Бёттигер
принадлежность
Абстрактный
Программа двухдозовой вакцинации с использованием комбинированной вакцины против кори, эпидемического паротита и краснухи (КПК) в возрасте 18 месяцев и 12 лет была внедрена в Швеции в 1919 году. 82. С момента внедрения комбинированной вакцины MMR проводится ежегодная оценка характеристик иммунитета и показателей сероконверсии у 12-летних детей. Это исследование включает в себя три исследовательские группы. Все группы состояли из до- и поствакцинальных образцов, взятых у детей 12 лет в связи с иммунизацией MMR. Было отобрано 332 парные пробы от детей, которые 8-10 лет назад были вакцинированы живой коревой вакциной. Довакцинальные сыворотки этих детей представляют собой поздние поствакцинальные титры. Поствакцинальная сыворотка 49дети, серонегативные к кори до вакцинации, полученные через 2 мес после вакцинации, представляют собой ранний поствакцинальный иммунитет. 95 детей, ранее не привитых и серопозитивных к кори, представляют естественно приобретенный иммунитет. Все образцы исследовали методом иммуноферментного анализа (ИФА). Сыворотки детей с поздним поствакцинальным иммунитетом имели достоверно более низкие титры, чем дети 2-й группы, представлявшие ранние поствакцинальные сыворотки (p < 0,001).
82. С момента внедрения комбинированной вакцины MMR проводится ежегодная оценка характеристик иммунитета и показателей сероконверсии у 12-летних детей. Это исследование включает в себя три исследовательские группы. Все группы состояли из до- и поствакцинальных образцов, взятых у детей 12 лет в связи с иммунизацией MMR. Было отобрано 332 парные пробы от детей, которые 8-10 лет назад были вакцинированы живой коревой вакциной. Довакцинальные сыворотки этих детей представляют собой поздние поствакцинальные титры. Поствакцинальная сыворотка 49дети, серонегативные к кори до вакцинации, полученные через 2 мес после вакцинации, представляют собой ранний поствакцинальный иммунитет. 95 детей, ранее не привитых и серопозитивных к кори, представляют естественно приобретенный иммунитет. Все образцы исследовали методом иммуноферментного анализа (ИФА). Сыворотки детей с поздним поствакцинальным иммунитетом имели достоверно более низкие титры, чем дети 2-й группы, представлявшие ранние поствакцинальные сыворотки (p < 0,001). Дети с естественным приобретенным иммунитетом имели значительно более высокие титры, чем дети с вакцино-индуцированным иммунитетом (p < 0,001). После ревакцинации ранее привитых детей наблюдался достоверный бустерный прирост (p < 0,001). После ревакцинации детей с приобретенным естественным путем иммунитетом значимого бустер-эффекта не наблюдалось. У 65 детей из 332 (20%) ранее вакцинированных детей не было или были пограничные титры кори до ревакцинации. Исследование предполагает, что индуцированные вакциной антитела против кори со временем снижаются и могут опускаться ниже защитного уровня.
Дети с естественным приобретенным иммунитетом имели значительно более высокие титры, чем дети с вакцино-индуцированным иммунитетом (p < 0,001). После ревакцинации ранее привитых детей наблюдался достоверный бустерный прирост (p < 0,001). После ревакцинации детей с приобретенным естественным путем иммунитетом значимого бустер-эффекта не наблюдалось. У 65 детей из 332 (20%) ранее вакцинированных детей не было или были пограничные титры кори до ревакцинации. Исследование предполагает, что индуцированные вакциной антитела против кори со временем снижаются и могут опускаться ниже защитного уровня.
Похожие статьи
Посмотреть все похожие статьи
Цитируется
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Уровни специфических антител к вирусу кори у лиц в Аргентине, получивших однократную дозу вакцины
1. Ааби, П., Дж. Бух, Дж. Лирхой, И.М. Лиссе, Ч.Х. Мордхост и Р. Педерсен. 1986. Вакцинированные дети заражаются корью в более легкой форме: исследование сообщества в Гвинее-Бисау. Дж. Заразить. Дис. 154 : 858-863. [PubMed] [Google Scholar]
Ааби, П., Дж. Бух, Дж. Лирхой, И.М. Лиссе, Ч.Х. Мордхост и Р. Педерсен. 1986. Вакцинированные дети заражаются корью в более легкой форме: исследование сообщества в Гвинее-Бисау. Дж. Заразить. Дис. 154 : 858-863. [PubMed] [Google Scholar]
2. Альбрехт П., Ф. А. Эннис, Э. Дж. Зальцман и С. Кругман. 1977. Сохранение материнских антител у младенцев старше 12 месяцев: механизм неэффективности вакцины против кори. Дж. Педиатр. 91 : 715-718. [PubMed] [Академия Google]
3. Альбрехт П., К. Херрманн и Г. Р. Бернс. 1981. Роль штамма вируса в обычном и расширенном тесте на нейтрализацию коревого налета. Дж. Вирол. Методы 3 : 251-260. [PubMed] [Google Scholar]
4. Арья, С. К. и Н. Агарвал. 2004. Эффективность вакцины против кори взаимосвязана с активностью и сроками хранения. Acta Trop. 90 : 223-225. [PubMed] [Google Scholar]
5. Аткинсон В. Л., В. А. Оренштейн и С. Кругман. 1992. Возрождение кори в США, 1989-1990 гг. Анну. преподобный мед. 43 : 451-463. [PubMed] [Google Scholar]
Аткинсон В. Л., В. А. Оренштейн и С. Кругман. 1992. Возрождение кори в США, 1989-1990 гг. Анну. преподобный мед. 43 : 451-463. [PubMed] [Google Scholar]
6. Баутиста-Лопес, Н. Л., А. Вайсберг, Р. Канасиро, Х. Эрнандес и Б. Дж. Уорд. 2001. Иммунный ответ на коревую вакцину у перуанских детей. Бык. WHO 79 : 1038-1046. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Bellini, WJ, D.E. McFalin, GD Silver, ES Mingioli, and HF McFarland. 1981. Иммунная реактивность очищенного гемагглютинина вируса кори. Заразить. Иммун. 32 : 1051-1057. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Black, F.L., L.L. Berman, JM Borgono, R.A. Capper, A.A. Carvalho, C. Collins, O. Glover, Z. Hijazi, D.L. Jacobson, and Y.L. Ли. 1986. Географические различия в младенческой потере материнских антител против кори и распространенности антител против краснухи. Являюсь. Дж. Эпидемиол. 124 : 442-452. [PubMed] [Академия Google]
Являюсь. Дж. Эпидемиол. 124 : 442-452. [PubMed] [Академия Google]
9. Боттигер М., Б. Кристенсон, В. Романус, Дж. Тарангер и А. Странделл. 1987. Шведский опыт программы двухдозовой вакцинации, направленной на элиминацию кори, эпидемического паротита и краснухи. бр. Мед. Дж. Клин. Рез. 295 : 1264-1267. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Bouche, F., W. Ammerlaan, F. Berthet, S. Houard, F. Schneider и CP Muller. 1998. Иммуносорбентный анализ на основе рекомбинантного белка гемагглютинина, полученного в высокоэффективной экспрессионной системе млекопитающих, для надзора за коревым иммунитетом. Дж. Клин. микробиол. 36 : 721-726. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Bradford, MM 1976. Быстрый и чувствительный метод количественного определения количества белка в микрограммах, использующий принцип связывания белка с красителем. Анальный. Биохим. 7 : 248-254. [PubMed] [Google Scholar]
Анальный. Биохим. 7 : 248-254. [PubMed] [Google Scholar]
12. Бролиден К., Б. Левен, М. Арнеборн и М. Бётиггер. 1998. Иммунитет к кори до и после ревакцинации вакциной MMR или первичной вакцинации в возрасте 12 лет в первом поколении предлагается в рамках программы иммунизации двумя дозами. Сканд. Дж. Заразить. Дис. 30 : 23-27. [PubMed] [Google Scholar]
13. Калверт Н., Ф. Каттс, Р. Ирвинг, Д. Браун, Дж. Марш и Э. Миллер. 1996. Иммунитет против кори и реакция на ревакцинацию среди школьников в Камбрии. Эпидемиол. Заразить. 116 : 65-70. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Чен, Р. Т., Л. Э. Марковиц, П. Альбрехт, Дж. А. Стюарт, Л. М. Мофенсон, С. Р. Преблуд и В. А. Оренштейн. 1990. Антитела против кори: переоценка защитных титров. Дж. Заразить. Дис. 162 : 1036-1042. [PubMed] [Google Scholar]
15. Чиофи дельи Атти, М. Л., Ф. Фаби, С. Салмасо, Р. Пиццути и Э. де Кампора. 2003 г. Эпидемия кори, связанная с недостаточным охватом вакцинацией: Кампания, Италия, 2002 г. Morb. Смертный. еженедельно. Респ. 52 : 1044-1047. [PubMed] [Google Scholar]
Л., Ф. Фаби, С. Салмасо, Р. Пиццути и Э. де Кампора. 2003 г. Эпидемия кори, связанная с недостаточным охватом вакцинацией: Кампания, Италия, 2002 г. Morb. Смертный. еженедельно. Респ. 52 : 1044-1047. [PubMed] [Google Scholar]
16. Crovari, P., G. Gabutti, G. Giammanco, P. Dentico, A.R. Moiraghi, F. Ponzio, R. Soncini, et al. 2000. Реактогенность и иммуногенность новой комбинированной вакцины против кори, эпидемического паротита и краснухи: результаты многоцентрового исследования. Вакцина 18 : 2796-2803. [PubMed] [Google Scholar]
17. Cutts, FT 1993. Иммунологическая основа серии иммунизации. Модуль 7: корь. ВОЗ/EPI/GEN/93.17. Всемирная организация здравоохранения, Женева, Швейцария.
18. Cutts, F.T., M. Grabowsky, and L.E. Markowitz. 1995. Влияние дозы и штамма живых аттенуированных коревых вакцин на серологические реакции у детей раннего возраста. Биопрепараты 23 : 95-106. [PubMed] [Академия Google]
[PubMed] [Академия Google]
19. Давидкин И., Валье М. 1998. Вакцино-индуцированные антитела к вирусу кори после введения двух доз комбинированной вакцины против кори, эпидемического паротита и краснухи: 12-летнее наблюдение в двух когортах. Вакцина 16 : 2052-2057. [PubMed] [Google Scholar]
20. Домингес А., Х. Видаль, П. Планс, Г. Кармона, П. Годой, Х. Баталла и Л. Саллерас. 1999. Иммунитет против кори и политика вакцинации в Каталонии. Вакцина 17 : 530-534. [PubMed] [Академия Google]
21. Ганс, Х. А., Л. Л. Ясукава, А. Алдерсон, М. Ринки, Р. Де Ховиц, Дж. Билер, С. Одет, Ю. Мальдонадо и А. М. Арвин. 2004. Гуморальный и клеточно-опосредованный иммунный ответ на раннюю двухдозовую вакцинацию против кори в США. Дж. Заразить. Дис. 190 : 83-90. [PubMed] [Google Scholar]
22. Garenne, M., O. Leroy, JP Beau, and I. Sene. 1993. Вакцины против вируса кори с высоким титром: оценка защиты, с. 119-131. В Э. Курстак (ред.), Корь и полиомиелит: вакцины, иммунизация и контроль. Springer-Verlag, Вена, Австрия.
119-131. В Э. Курстак (ред.), Корь и полиомиелит: вакцины, иммунизация и контроль. Springer-Verlag, Вена, Австрия.
23. Гарли М.Л., К. Бейл, К.Л. Мартинс, М. Монтейро, Э. Джордж, М. Кидд, Д. Диас, П. Оби и Х.К. Уиттл. 2001. Реакция антител против кори после ранних двухдозовых испытаний в Гвинее-Бисау со стандартными титрами вакцины против кори Эдмонстон-Загреб и Шварц: лучшее увеличение антител от бустерной дозы вакцины Эдмонстон-Загреб. Вакцина 19 : 1951-1959 гг. [PubMed] [Google Scholar]
24. Gay, NJ 2000. Ликвидация кори: быстрого решения нет. Бык. WHO 78 : 949. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Glikmann, G., S.N. Chen, CH Mordhorst, and C. Koch. 1995. Моноклональные антитела для экспресс-диагностики инфекций, вызванных вирусом гриппа В, с помощью ИФА: производство и характеристика. клин. Диагн. Вирол. 4 : 27-42. [PubMed] [Google Scholar]
26. Гликманн Г., И. Педерсен и Ч. Х. Мордхорст. 1987. Распространенность IgG-антител к вирусу эпидемического паротита и кори у непривитых детей. Дэн. Мед. Бык. 55 : 105-107. [PubMed] [Google Scholar]
Гликманн Г., И. Педерсен и Ч. Х. Мордхорст. 1987. Распространенность IgG-антител к вирусу эпидемического паротита и кори у непривитых детей. Дэн. Мед. Бык. 55 : 105-107. [PubMed] [Google Scholar]
27. Хасси, Г. Д., Э. А. Годдард, Дж. Хьюз, Дж. Дж. Рион, М. Керран, Э. Карелс, П. М. Стребель, Л. Э. Марковиц, Дж. Муди, П. Бэррон, З. Латиф, Р. Сайед, Д. Битти и Д. Э. Гриффин. 1996. Влияние вакцин против кори Эдмонстон-Загреб и Шварц на иммунный ответ младенцев. Дж. Заразить. Дис. 173 : 1320-1326. [PubMed] [Google Scholar]
28. Jensen, T.G., H. Whittle, CH Mordhorst, I.R. Pedersen, J. Thaarup, A. Poulsen, M. Sodemann, M. Jakobsen, L. Brink, U. Gansted, А. Пермин, М. К. да Силва и П. Оби. 1994. Испытания вакцины против кори Эдмонстон-Загреб в Гвинее-Бисау: серологические реакции после вакцинации штаммом Эдмонстон-Загреб в возрасте 4-8 месяцев по сравнению с вакцинацией штаммом Шварц в возрасте 9-12 месяцев. Вакцина 12 : 1026-1031. [PubMed] [Google Scholar]
Вакцина 12 : 1026-1031. [PubMed] [Google Scholar]
29. Джонсон, К. Э., А. Дарбари, Д. С. Дарбари, Д. Налин, Дж. Уитвелл, Л. В. Чуи, М. А. Кливс и М. Л. Кумар. 2000. Иммуногенность вакцины против кори и персистенция антител у детей в возрасте 12 и 15 месяцев. Вакцина 18 : 2411-2415. [PubMed] [Google Scholar]
30. Джонсон Х., И. Б. Хиллари, Г. Маккуойд и Б. Гилмер. 1995. Вакцинация MMR, эпидемиология кори и серологический надзор в Ирландской Республике. Вакцина 13 : 533-537. [PubMed] [Google Scholar]
31. Kiepiela, P., HM Coovadia, WE Loening, P. Coward и S.S. Abdool Karim. 1991. Потеря материнских антител против кори у темнокожих детей из Южной Африки в первый год жизни — последствия возрастной вакцинации. С. Афр. Мед. Дж. 79 : 145-148. [PubMed] [Google Scholar]
32. Koch, C. 1997. Immunologisk Udviklingsafdeling IUA 006, p. 1-7. In Årsberetning 1997. Statens Seruminstitut, Копенгаген, Дания. (на датском языке)
1-7. In Årsberetning 1997. Statens Seruminstitut, Копенгаген, Дания. (на датском языке)
33. Кумар, М. Л., К. Э. Джонсон, Л. В. Чуи, Дж. К. Уитвелл, Б. Стэле и Д. Налин. 1998. Иммунный ответ на противокоревую вакцину у 6-месячных детей от коревых серонегативных матерей. Вакцина 16 : 2047-2051. [PubMed] [Академия Google]
34. Маст, Э. Э., Дж. Л. Берг, Л. П. Ханрахан, Дж. Т. Вассел и Дж. П. Дэвис. 1990. Факторы риска кори среди ранее вакцинированного населения и экономическая эффективность стратегий ревакцинации. JAMA 264 : 2529-2533. [PubMed] [Google Scholar]
35. Миллер Э., А. Хилл, П. Морган-Кэпнер, Т. Форси и М. Раш. 1995. Антитела к кори, эпидемическому паротиту и краснухе у детей в Великобритании через 4 года после вакцинации различными вакцинами MMR. Вакцина 13 : 799-802. [PubMed] [Google Scholar]
36. Mossong, J., and CP Muller. 2003. Моделирование повторного появления кори в результате ослабления иммунитета у привитых групп населения. Вакцина 21 : 4597-4603. [PubMed] [Google Scholar]
2003. Моделирование повторного появления кори в результате ослабления иммунитета у привитых групп населения. Вакцина 21 : 4597-4603. [PubMed] [Google Scholar]
37. Моссонг Дж., К. Дж. О’Каллаган и С. Ратнам. 2000. Моделирование ответа антител на противокоревую вакцину и последующее ослабление иммунитета у населения с низким уровнем воздействия. Вакцина 19 : 523-529. [PubMed] [Академия Google]
38. Наниш Д., М. Гаренн, К. Рэй, М. Манчестер, Р. Бухта, С. К. Бродайн и М. Б. А. Олдстайн. 2004. Снижение специфической для вируса кори CD4 Т-клеточной памяти у вакцинированных субъектов. Дж. Заразить. Дис. 190 : 1387-1395. [PubMed] [Google Scholar]
39. Нейтс, С. В., М. О. Джордано, С. И. Медеот, Л. К. Мартинес, А. М. Бауданья, Э. Наретто, П. Гарридо и К. Д. де Вольф. 1998. Потеря материнского иммунитета к кори у аргентинских младенцев. Педиатр. Заразить. Дис. Дж. 17 : 313-316. [PubMed] [Google Scholar]
Дис. Дж. 17 : 313-316. [PubMed] [Google Scholar]
40. Национальный консультативный комитет по вакцинам. 1991. Эпидемия кори. Проблемы, барьеры и рекомендации. JAMA 266 : 1547-1552. [PubMed] [Google Scholar]
41. Никоара, К., К. Цах, Д. Трахсель, Д. Германн и Л. Маттер. 1999. Распад пассивно материнских антител против вирусов кори, эпидемического паротита и краснухи. клин. Диагн. лаборатория Иммунол. 6 : 868-871. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Отдел вакцин и иммунизации Панамериканской организации здравоохранения (HVP). 2000. Прерывание передачи кори в Америке. Эпидемиологический бюллетень 21. [Онлайн.] http://www.paho.org/english/sha/be_v21n4-measles.htm.
43. Паннути, К.С., Р.Дж. Морелло, Х.К. де Мораес, С.П. Курти, А.М.С. Афонсо, М.К.К. Камарго и В.А.У.Ф. де Соуза. 2004. Выявление первичных и вторичных неудач вакцин против кори путем измерения авидности иммуноглобулина G у больных корью в течение 1997 Эпидемия в Сан-Паулу. клин. Диагн. лаборатория Иммунол. 11 : 119-122. [Бесплатная статья PMC] [PubMed] [Google Scholar]
клин. Диагн. лаборатория Иммунол. 11 : 119-122. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Паунио, М., К. Хедман, И. Давидкин, М. Валле, О. П. Хейнонен, П. Лейники, А. Салми и Х. Пелтола. 2000. Вторичные неудачи вакцинации против кори, выявленные путем измерения авидности IgG: высокая частота среди подростков, привитых в молодом возрасте. Эпидемиол. Заразить. 124 : 263-271. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Педерсен И. Р., С. Х. Мордхост, Г. Гликманн и Х. фон Магнус. 1989. Субклиническая коревая инфекция у вакцинированных серопозитивных лиц в арктической Гренландии. Вакцина 7 : 345-348. [PubMed] [Google Scholar]
46. Пелтола Х., И. Давидкин, М. Валле, М. Паунио, Т. Хови, О. П. Хейнонен и П. Лейникки. 1997. Кори в Финляндии нет. Ланцет 350 : 1364-1365. [PubMed] [Google Scholar]
47. Ратнам С. , В. Гадаг, Р. Уэст, Дж. Беррис, Э. Оутс, Ф. Стед и Н. Булианн. 1995. Сравнение коммерческих наборов для иммуноферментного анализа с тестом нейтрализации уменьшения зубного налета для обнаружения антител к вирусу кори. Дж. Клин. микробиол. 33 : 811-815. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, В. Гадаг, Р. Уэст, Дж. Беррис, Э. Оутс, Ф. Стед и Н. Булианн. 1995. Сравнение коммерческих наборов для иммуноферментного анализа с тестом нейтрализации уменьшения зубного налета для обнаружения антител к вирусу кори. Дж. Клин. микробиол. 33 : 811-815. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Song, MK, CJ Vindurampulle, AVE Capozzo, J. Ulmer, JM Polo, M. Pasetti, EM Barry и MM Levine. 2005. Характеристика иммунных реакций, индуцированных внутримышечной вакцинацией ДНК-вакциной, кодирующей гемагглютинин вируса кори и/или слитые белки. Дж. Вирол. 79 : 9854-9861. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Ст. Зауэр, Дж. Л., Р. М. Якобсон, Р. А. Виркант, С. Дж. Якобсен, Э. М. Грин, Д. Дж. Шайд и Г. А. Польша. 2001. Корреляция между уровнями сывороточных антител против кори, эпидемического паротита и краснухи у школьников округа Олмстед. Вакцина 19 : 1363-1368. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
50. Сушил Дж., Г. Лалита, К. Джордж и А. Джозеф. 2004. Серологический ответ на раннюю вакцинацию против кори. Дж. Троп. Педиатр. 50 : 175-177. [PubMed] [Google Scholar]
51. Sutcliffe, P.A., and E. Rea. 1996. Вспышка кори среди хорошо привитых школьников. Можно. Мед. доц. Дж. 155 : 1407-1413. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Тишер А. и Э. Герике. 2000. Иммунный ответ после первичной и ревакцинации различными комбинированными вакцинами против кори, эпидемического паротита и краснухи. Вакцина 18 : 1382-1392. [PubMed] [Академия Google]
53. Udem, S.A. 1984. Вирус кори: условия для размножения и очистки инфекционного вируса с высоким выходом. Дж. Вирол. Методы 8 : 123-136. [PubMed] [Google Scholar]
54. UytdeHaag, FG, RS van Binnendijk, MJ Kenter, and AD Osterhaus. 1994. Реакция цитотоксических Т-лимфоцитов на вирус кори. Курс. Верхний. микробиол. Иммунол. 189 : 151-167. [PubMed] [Google Scholar]
1994. Реакция цитотоксических Т-лимфоцитов на вирус кори. Курс. Верхний. микробиол. Иммунол. 189 : 151-167. [PubMed] [Google Scholar]
55. . 1992. Трансмембранный слитый белок вируса кори, синтезированный de novo или представленный в иммуностимулирующих комплексах, эндогенно процессируется для распознавания цитотоксических Т-клеток, ограниченных HLA класса I и класса II. Дж. Эксп. Мед. 176 : 119-128. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. van Binnendijk, RS, JPM Versteeg-van Oosten, MCM Poelen, HF Brugghe, P. Hoogerhout, ADME Osterhaus и FGCM Uytdehaag. 1993. Клонированные цитотоксические Т-лимфоциты человека, рестриктированные по HLA классов I и II, идентифицируют кластер эпитопов на слитом белке вируса кори. Дж. Вирол. 67 : 2276-2284. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Вильегас, Г. А., М. Х. Аргуэльес, А. А. Кастелло, Н.

 Каштановая аллея, д. 2, строение 7, 3 этаж, с 8.00 до 12.00.
Каштановая аллея, д. 2, строение 7, 3 этаж, с 8.00 до 12.00. J Clin Microbiol. 1992;30:2874-2880.
J Clin Microbiol. 1992;30:2874-2880. J Заражение Dis. 2011;204(Приложение 1):S559-563.
J Заражение Dis. 2011;204(Приложение 1):S559-563. К., Штеле Б.О., Рим Л.П., Динакар С., Хурни В., Налин Д.Р.
Джонсон К.Э. и соавт.
Pediatr Infect Dis J. 1996 Aug;15(8):687-92. doi: 10.1097/00006454-199608000-00010.
Педиатр Infect Dis J. 1996.
PMID: 8858673
К., Штеле Б.О., Рим Л.П., Динакар С., Хурни В., Налин Д.Р.
Джонсон К.Э. и соавт.
Pediatr Infect Dis J. 1996 Aug;15(8):687-92. doi: 10.1097/00006454-199608000-00010.
Педиатр Infect Dis J. 1996.
PMID: 8858673 , Бёттигер М.
Бролиден К. и др.
Scand J Infect Dis. 1998;30(1):23-7. дои: 10.1080/003655498750002259.
Scand J Infect Dis. 1998.
PMID: 9670354
, Бёттигер М.
Бролиден К. и др.
Scand J Infect Dis. 1998;30(1):23-7. дои: 10.1080/003655498750002259.
Scand J Infect Dis. 1998.
PMID: 9670354 1994 марта; 15(3):193-9. дои: 10.1086/646889.
Infect Control Hosp Epidemiol. 1994.
PMID: 8207178
Обзор.
1994 марта; 15(3):193-9. дои: 10.1086/646889.
Infect Control Hosp Epidemiol. 1994.
PMID: 8207178
Обзор.