Лаваж легких: Бронхоальвеолярный лаваж у собак и кошек
Применение лечебного бронхоальвеолярного лаважа при хронической обструктивной болезни легких | Штейнер
1. Паламарчук Г.Ф., Успенская А.Л. Экстренная диагностика и лечебная бронхофиброскопия при неотложных состояниях в пульмонологии. Материалы научно-практической конференции “Актуальные вопросы неотложной эндоскопии”. Санкт-Петербург. 14 декабря 2001; http:// www.endoscopy.ru
2. Овчинников А.А. Острые и хронические гнойные заболевания легких. Рус. мед. журн. 2002; 10 (23): 1073-1079.
3. Овчинников А.А. Лечебные возможности бронхоскопии при заболеваниях легких. Атмосфера: пульмонол. и аллергол. 2005; 4: 15-19.
4. Куртуков В.А. Санационная фибробронхоскопия в комплексном лечении больных с обострением хронической обструктивной болезнью легких и бронхоэктатической болезни: Автореф. дис. … канд. мед. наук. Барнаул; 2007.
5. Чернеховская Н.Е., Андреев В.Г., Поваляев А.В. Лечебная бронхоскопия в комплексной терапии заболеваний органов дыхания. М.: МЕДпресс-информ; 2008.
6. Hattotuwa K., Gamble E.A., O’Shaughnessy T. Safety of bronchoscopy, biopsy, and BAL in research patients with COPD. Chest 2002; 122: 1909-1912.
7. Busse W.W., Wanner. A., Adams K. Investigative bron� choprovocation and bronchoscopy in airway diseases. Am. J. Respir. Crit. Care Med. 2005; 172: 807-816.
8. Gayathri A.R., Narasimhan R. Critical care bronchoscopy — a retrospective analysis in two teritary care hospitals. Indian J. Bronchol. 2006; 1 (1): 16-23.
9. Soler N., Agusti C., Angrill J. et аl. Bronchoscopic validation of the significance of sputum purulence in severe exacerba� tions of chronic obstructive pulmonary disease. Thorax 2007; 62: 29-35
10. Лукомский Г.И., Шулутко М.Л., Виннер М.Г., Овчинников А.А. Бронхопульмонология. М.: Медицина; 1982
11. Маколкин В.И., Овчаренко С. И., Заводнов В.Я. и др. Бронхоскопическое пособие в терапии больных брон� хиальной астмой тяжелого течения. Тер. арх. 1996; 4: 12-15
12. Блашенцева С.А., Богданов В. Е., Блашенцев К.В. и др. Современные аспекты диагностики и лечения острых гнойных абсцессов легких. Самара: ГП «Перспектива»; 2002
Е., Блашенцев К.В. и др. Современные аспекты диагностики и лечения острых гнойных абсцессов легких. Самара: ГП «Перспектива»; 2002
13. Нагродский С.Л. Интраброхиальная иммунотерапия хронического обструктивного бронхита. Автореф. дис. …канд. мед. наук. М.; 2002
14. Шпак О.И., Венгерова О.А., Евтушенко О.А., Яцына М.Ф. Применение протеолитических ферментов трипсина и химотрипсина в бронхологической практике. Укр. пульмонол. журн. 2004; 3: 44-45
15. Oho K., Amemiya R. Practical Fiberoptic Bronchoscopy. 2�nd ed. Tokyo: Igaky�Shoin; 1984
16. Luisetti M., Meloni F., Ballabio P., Leo G. Role of bronchial and bronchoalveolar lavage in chronic obstructive lung dis� ease. Monaldi Arch. Chest Dis. 1993; 48: 54-57
17. Пальцев Н.А. (ред.). Методические рекомендации по применению растворов гипохлорита натрия, получае� мых с помощью аппарата ЭДО�4. М.; 1991
18. Карсаков В.Б. Опыт применения гипохлорита натрия для лечения острых экзогенных интоксикаций в отде� лении экстракорпоральной детоксикации Нижегоро� дского токсикологического центра. В кН.: Сборник на� уч. работ, посвящ. 15�летию Нижегород. токсикологи� ческого центра. Н. Новгород; 1992. 3-6
В кН.: Сборник на� уч. работ, посвящ. 15�летию Нижегород. токсикологи� ческого центра. Н. Новгород; 1992. 3-6
19. Singh S., Evans T.V. Nitric oxide, the biological mediator of the decade: fact or Fiction? Eur. Respir. J. 1997; 10: 699-707
20. Лопаткин Н.А., Лопухин Ю.М. Эфферентные методы в медицине (теоретические и клинические аспекты экстракорпоральных методов лечения). М.: Медицина; 1989
21. Семенкова Г.Г., Провоторов В.М., Шайдарова В.А. и др. Эффективность лечения больных гнойным эндоброн� хитом с использованием гипохлорита натрия. В кн.: 4�й Национальный конгресс по болезням органов ды� хания. Сборник резюме. М.; 1994. № 1103
22. Рыжко А.А. Применение гипохлорита натрия при сана� ционных бронхоскопиях. В кн. 11�й Национальный конгресс по болезням органов дыхания. М.; 2001. № LVI.19
23. Шойхет Я.Н., Мартыненко Т.И., Скалозуб Е.А. и др. Ре� гиональная модель организации пульмонологической помощи населению на примере Алтайского края. Пульмонология 2002; 3: 12-17
24. Овчаренко С.И. Муколитические (мукорегуляторные) препараты в лечении в лечении хронической обструк� тивной болезни легких. Рус. мед. журн. 2002; 10 (4): 153-156
Овчаренко С.И. Муколитические (мукорегуляторные) препараты в лечении в лечении хронической обструк� тивной болезни легких. Рус. мед. журн. 2002; 10 (4): 153-156
25. Pela R. N�acetylcysteine reduces the exacerbation rate in patients with moderate to severe COPD. Respiration 1999; 66: 495-500
26. Poole P.J., Black P.N. Oral mucolytic drugs for exacerba� tions of chronic obstructive pulmonary disease: systematic review. Br. Med J. 2001; 322: 1-6
27. Волков И.К. Применение флуимуцила® (N�ацетилцис� теина) при заболеваниях легких. Пульмонология 2002; 2: 116-121
28. Штейнер М.Л. Клинико�иммунологическая характе� ристика и оптимизация лечения обострений при хро� нической обструктивной болезни легких тяжелой сте� пени: Автореф. дис. … канд. мед. наук. Самара; 2004
29. Чучалин А.Г., Соодаева С.К, Авдеев С.Н. Флумуцил®: ме� ханизмы действия и значение в терапии заболеваний органов дыхания. Милан; 2005
30. Dekhuijzen P.N.R. Antioxidant properties ov N�acetylcys� teine: their relevance in relationnto chronic obstructive pul� monary disease. Eur. J. Respir. Dis. 2004; 23: 629-636
Eur. J. Respir. Dis. 2004; 23: 629-636
31. Дуганов В.К., Дмитриев Ю.К., Яськов А.И., Филатова Е.Г. Лечебная фибробронхоскопия при острых бронхоле� гочных заболеваниях и обострении хронических брон� холегочных заболеваний. Интернет�публикация. 2001; cайт: www.zambon.ru
32. Perruchoud A. Atelectasis of the lung: bronchoscopic lavage with acetylcysteine. Experience in 51 patients. Eur. J. Respir. Dis. 1980; 61 (111): 163-168
33. Kelly G.S. Clinical applications of N�acetylcysteine. Alt. Med. Rev. 1998; 3 (2): 114-127
34. Grandjean E.M., Berthet P., Ruffmann R. Efficacy of oral long�term N�acetylcysteine in chronic bronchopulmonary disease: a meta�analysis of published double�blind, placebo� controlled clinical trials. Clin. Ther. 2000; 22: 209-221
35. Gerrits C.M., Herings R.M.C., LeufKens H.G.M., Lammers J.W.J. N�acetylcysteine reduce risk of re�hospitaliza� tion among patients with chronic obstructive pulmonary disease. Eur. Respir. J. 2003; 21: 795-798
36. Пат. РФ № 2246307. 5.05.2003. Способ проведения бронхоальвеолярного лаважа / Штейнер М.Л., Бороду� лин Б.Е., Жестков А.В., Данилин А.В. Российского агентства по патентам и товарным знакам «Изобрете� ния. Полезные модели»: Бюл. 20.02.2005; № 5
Пат. РФ № 2246307. 5.05.2003. Способ проведения бронхоальвеолярного лаважа / Штейнер М.Л., Бороду� лин Б.Е., Жестков А.В., Данилин А.В. Российского агентства по патентам и товарным знакам «Изобрете� ния. Полезные модели»: Бюл. 20.02.2005; № 5
Особенности отбора бронхоальвеолярного лаважа у лабораторных животных
Ключевые слова: легкие трахея бронхоальвеолярный лаваж лабораторные животные компоненты лаважа
Органы дыхательной системы обеспечивают функцию газообмена, при котором возможно попадание в организм различных патогенных веществ и микроорганизмов, вызывающих респираторные заболевания и оседание их в эпителиальной выстилке легких и дыхательных путей, поэтому респираторные заболевания разной этиологии поражают всех млекопитающих и являются наиболее распространенными. В связи с этим существует необходимость в разработке лекарственных средств для лечения респираторных заболеваний. Забор бронхоальвеолярной лаважной жидкости (БАЛЖ) (смыва) – это традиционная инвазивная методика, которая позволяет отобрать смывы дыхательных путей и легких животных для диагностики заболевания в ветеринарии или изучения респираторной токсичности тестируемых препаратов в доклинических исследованиях. Популярность в использовании метода забора БАЛ органов дыхательной системы обосновывается тем, что данная процедура является экономически выгодной и простой для воспроизведения, и позволяет нанести минимальный физический ущерб животному для последующего послеоперационного восстановления, если необходимо. Преимущество исследования БАЛЖ и дыхательных путей заключается в выявлении ранних изменений биохимических, цитологических и микробиологических показателей БАЛЖ, которые в будущем приводят к морфологическим изменениям тканей органов дыхательной системы в процессе заболевания. Для получения информативного материала важна правильность выполнения методики забора, обработки и анализа образца БАЛЖ, а именно необходимо избегать любых повреждений легких и дыхательных путей; проводить манипуляции с образцами смыва органов дыхательной системы по возможности сразу и в охлажденном состоянии.
Забор бронхоальвеолярной лаважной жидкости (БАЛЖ) (смыва) – это традиционная инвазивная методика, которая позволяет отобрать смывы дыхательных путей и легких животных для диагностики заболевания в ветеринарии или изучения респираторной токсичности тестируемых препаратов в доклинических исследованиях. Популярность в использовании метода забора БАЛ органов дыхательной системы обосновывается тем, что данная процедура является экономически выгодной и простой для воспроизведения, и позволяет нанести минимальный физический ущерб животному для последующего послеоперационного восстановления, если необходимо. Преимущество исследования БАЛЖ и дыхательных путей заключается в выявлении ранних изменений биохимических, цитологических и микробиологических показателей БАЛЖ, которые в будущем приводят к морфологическим изменениям тканей органов дыхательной системы в процессе заболевания. Для получения информативного материала важна правильность выполнения методики забора, обработки и анализа образца БАЛЖ, а именно необходимо избегать любых повреждений легких и дыхательных путей; проводить манипуляции с образцами смыва органов дыхательной системы по возможности сразу и в охлажденном состоянии.
Введение
Получение бронхоальвеолярной лаважной жидкости (БАЛЖ) (смыва) – это процедура, используемая для изучения клеточного и внеклеточного содержимого пространства легких [1, 2].
Исследование БАЛЖ с помощью цитологических и иммунологических методов позволяет установить определенные изменения жизнеспособности клеток, их функциональной активности и соотношений между отдельными клеточными элементами, что дает возможность судить об этиологии и активности патологического процесса в легких. При заболеваниях, характеризующихся образованием специфических клеток и телец, информативность цитологического исследования бронхоальвеолярных смывов может быть приравнена к информативности биопсии. При микробиологическом исследовании бронхоальвеолярных смывов могут быть выявлены возбудители туберкулеза, пневмоцистоза и другие. При биохимическом исследовании могут быть оценены содержание белков, липидов, диспропорции в соотношении их фракций, нарушения в активности ферментов и их ингибиторов, биологически активные соединения. Особенно информативно комплексное применение перечисленных методов исследования бронхоальвеолярных смывов [3].
При заболеваниях, характеризующихся образованием специфических клеток и телец, информативность цитологического исследования бронхоальвеолярных смывов может быть приравнена к информативности биопсии. При микробиологическом исследовании бронхоальвеолярных смывов могут быть выявлены возбудители туберкулеза, пневмоцистоза и другие. При биохимическом исследовании могут быть оценены содержание белков, липидов, диспропорции в соотношении их фракций, нарушения в активности ферментов и их ингибиторов, биологически активные соединения. Особенно информативно комплексное применение перечисленных методов исследования бронхоальвеолярных смывов [3].
БАЛЖ содержит секрет, покрывающий апикальные поверхности бронхиального и альвеолярного эпителия. На объем аспирированной жидкости и клеточные и неклеточные компоненты БАЛЖ влияют многие факторы. Вследствие этого для получения информативного материала важное значение имеет методика выполнения забора, обработка и анализ БАЛЖ [4].
Основные принципы и особенности забора бронхоальвеолярного лаважа
Целью данной манипуляции является взятие БАЛЖ, в котором содержатся образцы жидкости эпителиальной выстилки легких и нижних дыхательных путей животного.
Как было указано ранее, особенности забора БАЛЖ зависят от вида животного и цели проведения манипуляции. Процедура забора БАЛЖ может быть как терминальной, так и не терминальной (забор БАЛЖ прижизненный). Обычно для мелких грызунов (крысы, мыши и морские свинки) данную манипуляцию проводят терминально, для хомяков и крупных млекопитающих животных процедура может быть проведена прижизненно для оценки динамики каких-либо патологий и эффективности терапии [5]. Чаще всего процедуру забора БАЛЖ проводят на анестезированных животных. Общую анестезию животного обеспечивают с помощью введения анестезирующих препаратов таких, как хлоральгидрат [6, 7], трибромэтанол (или авертин) [8], уритан [9], пентобарбитал натрия [10, 11], золетил [12], изофлюран [13], диазепам, кетамин, смесь ксилазина и кетамина [14] и галотан [5].
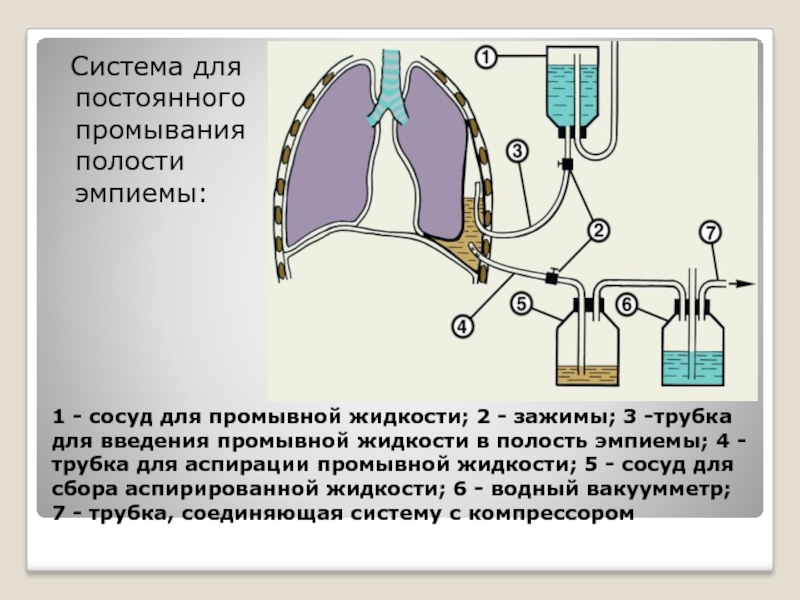
Существует два способа получения БАЛ, которые зависят от места введения инструмента (катетер, шприц с тупой иглой): открытый и закрытый. Открытый способ приемлем для наркотизированных животных, подлежащих эвтаназии, или уже эвтаназированных животных, так как для этого способа необходимо вскрывать грудную клетку для обеспечения доступа к легким. В большинстве случаев открытый способ используют для промывки отдельного сегмента легкого у крупных животных и полностью одного легкого с лигированием второго у мелких грызунов.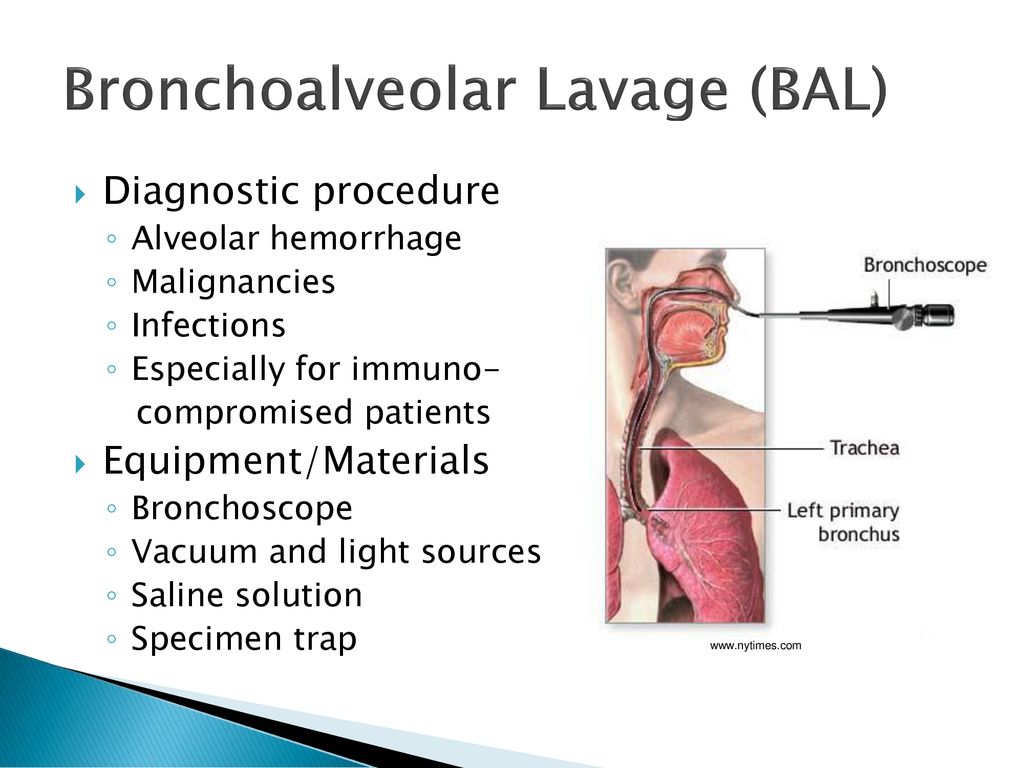
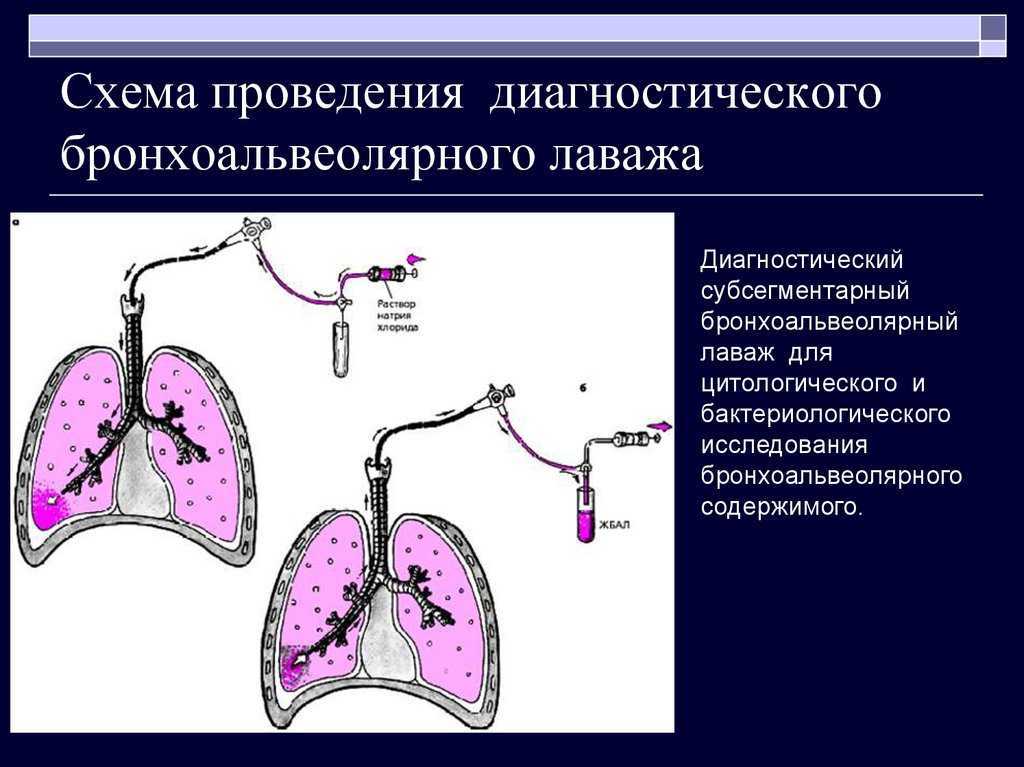
Забор БАЛ при закрытом способе удобен при исследовании динамики протекания болезни или лечения животных [13]. При закрытом типе чаще всего проводят забор БАЛ непосредственно через трахею, выделенную в области шеи [7, 25], либо с помощью трубки для интубации [13] или эндоскопа [26] без вскрытия грудной клетки (рис. 3).
Рис. 3. Забор БАЛЖ у кролика с помощью эндоскопа (26)Данный способ забора БАЛ не позволит проводить промывку отдельного сегмента легкого или одного легкого.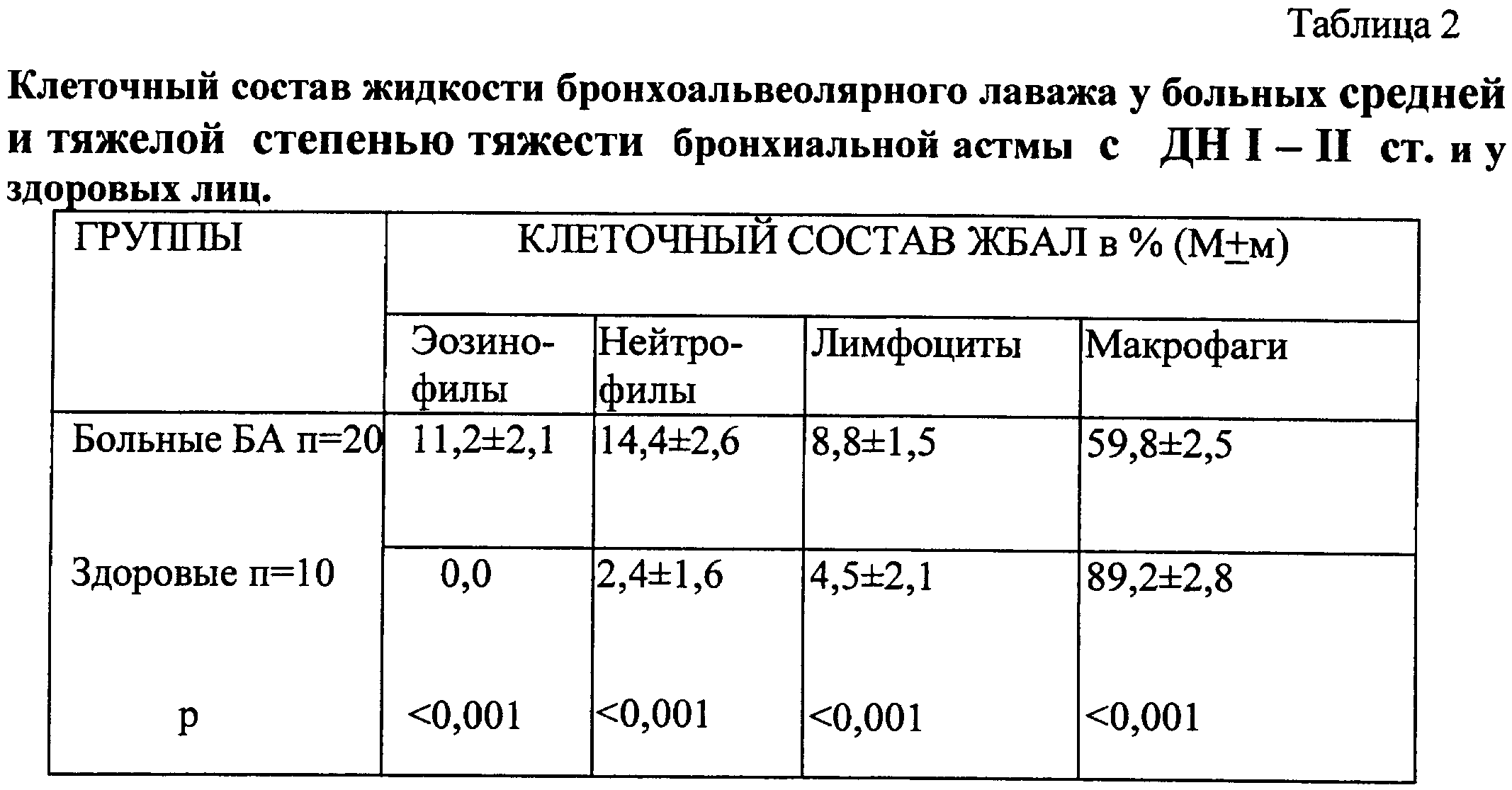
Для забора БАЛ в качестве жидкости для промывания легких используют изотонические растворы: физиологический раствор [10, 12, 13, 20, 25, 27], сбалансированные солевые растворы (фосфатно-солевой раствор (PBS) [6-9, 15–19, 21, 22, 24, 28–31], буфер Хэнкса [32], растворы, свободные от кислорода (OFS) [11]) или 0,5% раствором глюкозы [33]. Такие растворы помогают избежать повреждения клеток и тканей легких при процедуре забора БАЛ, а OFS используют для минимизации дальнейшего окисления тканей легких. Важным аспектом является отсутствие или наличие в омывающей жидкости катионов кальция и магния, которые необходимы для прилипания макрофагов к поверхности эпителия легких. Решение включить эти катионы или нет, будет зависеть от цели исследования, поскольку наличие данных катионов в жидкости приводит к сбору только свободных и неприкрепленных клеток в альвеолах, исключая макрофагов. Если целью является изучение полного клеточного состава, следует использовать омывающую жидкость без катионов кальция и магния.
Для того чтобы избежать повреждения тканей легкого, в результате введения омывающей жидкости, необходимо подобрать объем для определенного животного. В работах R.F. Henderson (2005) описано, что такой объем можно рассчитать на основе 80% изменения объема легких при давлении 20 см вод. ст. или 80% общей емкости легких, рассчитанной на основе массы тела по уравнению Шталя, или в 5 раз больше объема ткани легкого. В таблице представлены использованные объемы омывающей жидкости для забора БАЛ разных видов животных.
Объемы омывающей жидкости для однократного введения в легкие животных различных видов
| Виды животных | Объемы омывающей жидкости для забора БАЛЖ, мл | Литературный источник |
Крысы | 2 | [9] |
| 3 | [11] | |
| 5 | [1, 5] | |
| 8 | [24] | |
| 7 | [5] | |
| 10 | [18] | |
| 25 | [6] | |
Мыши | 0,3 | [7] |
| 0,5 | [8, 15–17, 19, 27, 29] |
| 0,6 | [11, 14] |
| 0,7 | [28] |
| 0,8 | [22] |
| 1 | [5, 21, 30] |
Морские свинки | 2 | [10] |
| 6 | [11] | |
Хомяки | 4 | [5] |
| 10 | [14] | |
Хорьки | 2 | [13] |
| 7 | [18] | |
| 10 | [32] | |
Собаки | 100/10 г ткани легкого | [33] |
Макака-резус | 20 | [18] |
Для большинства токсикологических исследований целесообразно использовать наименьшее количество повторных промываний для получения БАЛЖ. Большое количество промывок может привести к разбавлению компонентов БАЛЖ, которые необходимо изучить. В работе F. Rogene Henderson (2005) доказано, что 75% от общего количества компонентов БАЛ извлекается при первых двух промывках. В большинстве случаев при процедуре забора БАЛЖ достаточно 2–4 промывок легких, чтобы получить адекватный образец без разведения содержимого. В промывках отдельных сегментов легкого возврат первоначального объема жидкости обычно невелик, и может потребоваться 5 или 6 промывок. Многократное промывание легких необходимо в случаях, когда целью исследования является получение как можно большего количества макрофагов альвеол для функциональных анализов. Также для получения большего количества активных клеток можно применить массаж легких в перерывах между промывками [5].
Большое количество промывок может привести к разбавлению компонентов БАЛЖ, которые необходимо изучить. В работе F. Rogene Henderson (2005) доказано, что 75% от общего количества компонентов БАЛ извлекается при первых двух промывках. В большинстве случаев при процедуре забора БАЛЖ достаточно 2–4 промывок легких, чтобы получить адекватный образец без разведения содержимого. В промывках отдельных сегментов легкого возврат первоначального объема жидкости обычно невелик, и может потребоваться 5 или 6 промывок. Многократное промывание легких необходимо в случаях, когда целью исследования является получение как можно большего количества макрофагов альвеол для функциональных анализов. Также для получения большего количества активных клеток можно применить массаж легких в перерывах между промывками [5].
При первой промывке легкого возврат БАЛЖ составляет 75% изначального объема, начиная со второй промывки, возвратный объем увеличивается до 100%. При промывке отдельного сегмента легкого обычно возвращается 40% изначального объема и 100% при последующих промываниях.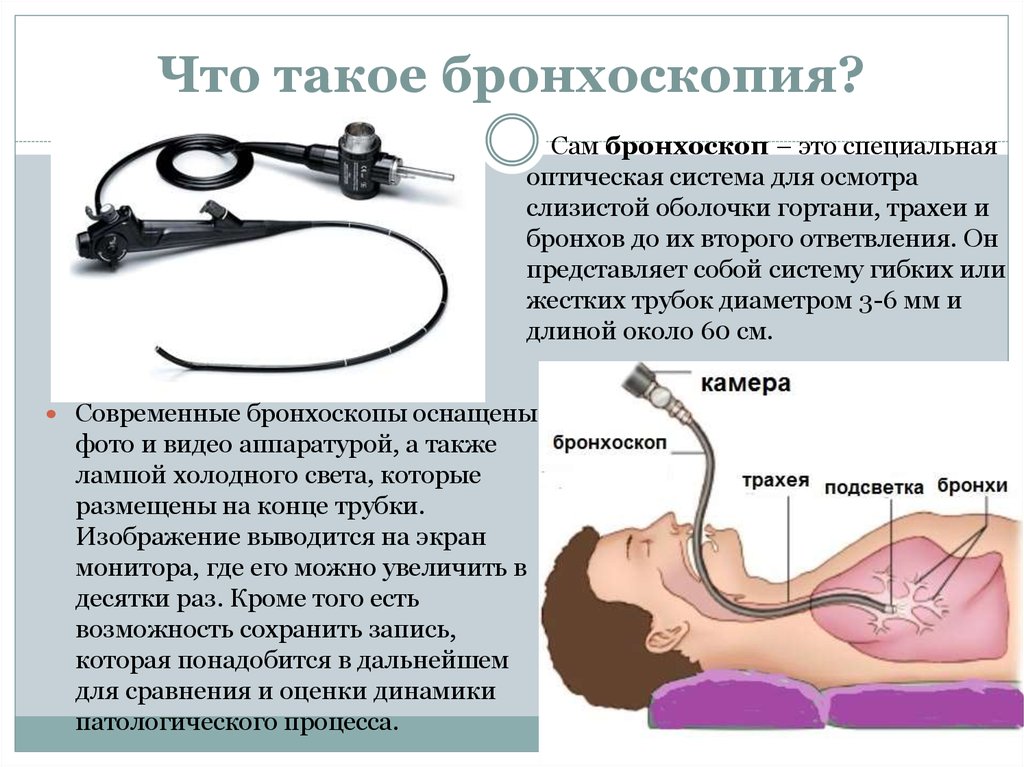 Одним из маркеров активного воспалительного процесса легких (отек) является увеличение возвратного объема БАЛЖ после промывки в связи с выделением большого количества слизи в легких животного [5].
Одним из маркеров активного воспалительного процесса легких (отек) является увеличение возвратного объема БАЛЖ после промывки в связи с выделением большого количества слизи в легких животного [5].
Компоненты бронхоальвеолярного лаважа
Непосредственно после отбора БАЛЖ образцы помещают на лед и хранятся в холодном состоянии. Последующие манипуляции (центрифугирование, отбор супернатанта и замораживание, если необходимо, ресуспендирование осадка) с образцом БАЛЖ необходимо начать по возможности быстро [5]. Для подсчета общего количества клеток образец БАЛЖ центрифугируют и ресуспендируют клеточный осадок [5, 7, 8, 12, 14–20, 22, 29–31]. Для получения чистого супернатанта необходимо удалить промытые клетки из образца БАЛЖ как можно быстрее, чтобы избежать утечки ферментов и биологически активных веществ в супернатант [5].
Основным компонентом БАЛЖ здоровых животных является легочный макрофаг (90% от общего количества клеток). Содержание нейтрофилов очень мало, и приток этих клеток является чувствительным индикатором воспалительного ответа.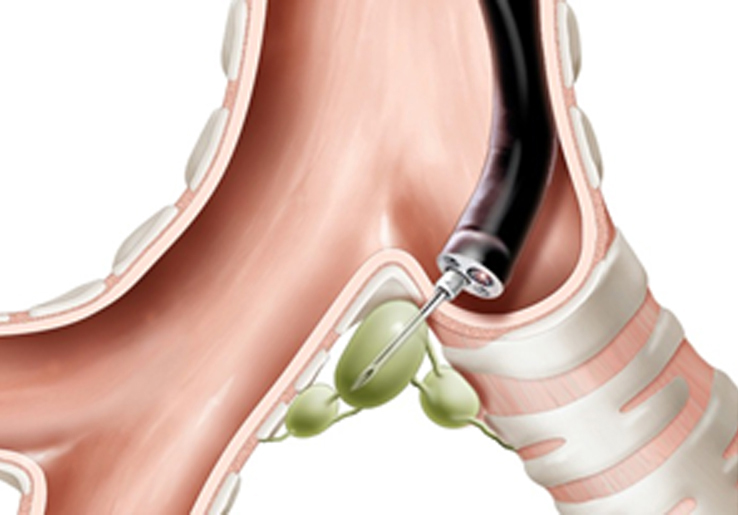 Лимфоциты в БАЛЖ обычно отсутствуют у крыс, мышей и хомяков, но они могут составлять до 10% клеток БАЛЖ у более крупных животных, таких как овцы, лошади и обезьяны. Эозинофилы встречаются в образцах БАЛЖ морских свинок. Индикатором воспалительной реакции на основе иммунного ответа является увеличение количества лимфоцитов или эозинофилов в образце БАЛЖ [5, 24].
Лимфоциты в БАЛЖ обычно отсутствуют у крыс, мышей и хомяков, но они могут составлять до 10% клеток БАЛЖ у более крупных животных, таких как овцы, лошади и обезьяны. Эозинофилы встречаются в образцах БАЛЖ морских свинок. Индикатором воспалительной реакции на основе иммунного ответа является увеличение количества лимфоцитов или эозинофилов в образце БАЛЖ [5, 24].
При анализе биохимических показателей БАЛЖ можно изучить концентрацию белка [9, 11, 17, 18, 25, 29, 31] для мониторинга повышенной проницаемости альвеолярного/капиллярного барьера, которая возникает при воспалительной реакции [5, 9, 11].
При повреждении клеток легких высвобождается лактатдегидрогеназа (ЛДГ) в слизистую оболочку легких, поэтому увеличение активности ЛДГ в образцах БАЛЖ является биомаркером при острых и модельных респираторных заболеваниях [5, 24, 25].
β-Глюкоронидаза, являющаяся лизосомальным ферментом, при воспалительных процессах продуцируется нейтрофилами, которые собираются в месте повреждения клеток легких. Повышенная активность β-глюкоронидазы во внеклеточной жидкости является хорошим биомаркером активности макрофагов, нарушения проницаемости альвеолярных эпителиальных клеток [5, 34].
Повышенная активность β-глюкоронидазы во внеклеточной жидкости является хорошим биомаркером активности макрофагов, нарушения проницаемости альвеолярных эпителиальных клеток [5, 34].
Увеличение активности щелочной фосфатазы является индикатором разрушения эпителия дыхательных путей [25]. Увеличение продуктов перекисного окисления липидов наблюдается при повреждении различных клеток легких и дыхательных путей, при остром повреждении легких грызунов, например при ингаляционном поступлении фосгена [11], также подобное наблюдали при трансфузионном остром повреждении легких собак [33]. При разрушении эпителия и поверхностно-активного слоя легких и дыхательных путей в образцах БАЛЖ крыс наблюдают увеличение глутатионов [11].
Ранними биохимическими маркерами воспаления легких являются фактор некроза опухоли-α и интерлейкин-1 (IL-1), цитокины, высвобождаемые из резидентных макрофагов, которые способствуют прикреплению циркулирующих воспалительных клеток к эндотелию. Эти цитокины стимулируют высвобождение факторов хемоаттрактанта, таких как IL-8, MIP-2 (нейтрофильный хемоаттрактант у грызунов), IL-6 и макрофаги, хемоаттрактантный белок-1 (MCP-1), которые привлекают воспалительные клетки в альвеолы [6, 8, 10, 13, 15–17, 19, 21, 24, 28, 30].
Заключение
Методология забора БАЛЖ является достаточно простой для воспроизведения и получения данных о протекании респираторных воспалительных процессов. В целом, процедура забора БАЛЖ лучше всего подходит для выявления ранних признаков повреждения легких до того, как легкое стало настолько сильно затронуто, что вызывает проблемы с извлечением лаважа. Однако стоит принять во внимание следующие особенности: при заборе лаважа необходимо избегать любых повреждений легких и дыхательных путей; необходимо проводить манипуляции с образцами БАЛЖ по возможности сразу и в охлажденном состоянии. Получение БАЛЖ может быть полезным при исследовании заболеваний дыхательного тракта в экспериментах на животных.
В целом при планировании в эксперименте забора БАЛЖ необходимо заранее выбрать:
- метод забора (открытый, закрытый) в зависимости от дизайна исследования;
- вид животного – определяет объем БАЛЖ;
- состав БАЛЖ, который должен осуществляться с учетом возможных помех для определения целевых компонентов биологически активных веществ;
- количество БАЛЖ, что обеспечивает сохранность тканей легких и дыхательных путей.

В зависимости от дизайна исследования можно исследовать клеточный состав БАЛЖ, активность ферментов, содержание различных биологически активных веществ, как в составе БАЛЖ, так и в составе его клеточных компонентов.
Бронхоальвеолярный лаваж — StatPearls — NCBI Bookshelf
Pujan H. Patel; Марша Х. Антуан; Саад Улла.
Информация об авторе и организациях
Последнее обновление: 28 августа 2022 г.
Непрерывное обучение
Бронхоальвеолярный лаваж или БАЛ — это минимально инвазивная процедура, которая включает инстилляцию стерильного физиологического раствора в подсегмент легкого с последующей аспирацией и сбор закапывания на анализ. Эта процедура обычно облегчается введением гибкого бронхоскопа в субсегмент легкого. Процедура была популяризирована в 1974 благодаря работе американских врачей Рейнольдса и Ньюболла в Мэриленде. Сегодня он служит преимущественно диагностическим инструментом для оценки патологии нижних дыхательных путей, а при некоторых необычных состояниях также имеет терапевтическую ценность. В этом упражнении рассматривается представление, оценка и управление бронхоальвеолярным лаважем и подчеркивается роль подхода межпрофессиональной команды к лечению пострадавших пациентов.
В этом упражнении рассматривается представление, оценка и управление бронхоальвеолярным лаважем и подчеркивается роль подхода межпрофессиональной команды к лечению пострадавших пациентов.
Цели:
Опишите причины проведения бронхоальвеолярного лаважа.
Объясните, каким пациентам может помочь бронхоальвеолярный лаваж.
Кратко опишите, как оценивается бронхоальвеолярный лаваж.
Опишите методы улучшения координации помощи между членами межпрофессиональной бригады с целью улучшения результатов лечения пациентов, получающих бронхоальвеолярный лаваж.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Бронхоальвеолярный лаваж или БАЛ — это минимально инвазивная процедура, которая включает инстилляцию стерильного физиологического раствора в субсегмент легкого с последующей аспирацией и сбором инстилляций для анализа.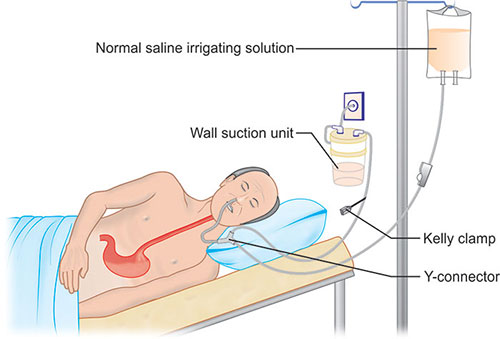 Эта процедура обычно облегчается введением гибкого бронхоскопа в субсегмент легкого. Процедура была популяризирована в 1974 благодаря работе американских врачей Рейнольдса и Ньюболла в Мэриленде. Сегодня он служит преимущественно диагностическим инструментом для оценки патологии нижних дыхательных путей, а при некоторых необычных состояниях также имеет терапевтическую ценность.
Эта процедура обычно облегчается введением гибкого бронхоскопа в субсегмент легкого. Процедура была популяризирована в 1974 благодаря работе американских врачей Рейнольдса и Ньюболла в Мэриленде. Сегодня он служит преимущественно диагностическим инструментом для оценки патологии нижних дыхательных путей, а при некоторых необычных состояниях также имеет терапевтическую ценность.
Этиология
Значительная часть патологических заболеваний в легких возникает на альвеолярном уровне. БАЛ позволяет собирать альвеолярную среду и проводить дальнейший анализ ее состава. Общие сценарии использования БАЛ включают выявление оппортунистических и атипичных респираторных инфекций у пациентов с ослабленным иммунитетом, необъяснимые рентгенологические легочные инфильтраты или гипоксемию. БАЛ также может дать ключ к постановке диагноза некоторых неинфекционных состояний, таких как диффузное альвеолярное кровотечение (ДАГ), легочный альвеолярный протеиноз (ЛАП), эозинофильная пневмония, гиперчувствительный пневмонит (ГП), интерстициальные заболевания легких (ИЗЛ), хронический бериллиоз, наличие злокачественных клеток и воздействия асбеста.
Патофизиология
Несмотря на то, что такие общества, как Американское торакальное общество и Британское торакальное общество, опубликовали рекомендации по выполнению БАЛ, его эффективность остается некоторая вариабельность. БАЛ обычно выполняется после введения бронхоскопа в трахеобронхиальное дерево и осмотра дыхательных путей, но до сбора биопсии или мазков. Это сводит к минимуму потенциальное попадание обломков бронхиальной стенки и дополнительных эритроцитов (эритроцитов) в самые дистальные дыхательные пути, что может изменить состав лаважной жидкости. Внешний диаметр наконечников гибких бронхоскопов для взрослых варьируется примерно от 3 мм до 6 мм, и эндоскоп направляется в подсегмент легкого, который должен пройти БАЛ, и продвигается до тех пор, пока наконечник не вклинится в бронхиолу.
В зависимости от местной практики стерильный физиологический раствор в диапазоне от 20 до 60 мл комнатной температуры вводится с помощью ручного шприца, а затем постепенно набирается обратно в шприц. Это повторяется 3-5 раз, всего закапывается до 300 мл. Если возвращается только 5% каждой введенной аликвоты, что указывает на то, что большая часть введенной жидкости задерживается, процедуру следует прервать. Возвратный образец, составляющий 30 % или более от инстиллята, считается адекватным возвратом, из которых не менее 10–20 мл требуется для клеточного и инфекционного исследования.
Это повторяется 3-5 раз, всего закапывается до 300 мл. Если возвращается только 5% каждой введенной аликвоты, что указывает на то, что большая часть введенной жидкости задерживается, процедуру следует прервать. Возвратный образец, составляющий 30 % или более от инстиллята, считается адекватным возвратом, из которых не менее 10–20 мл требуется для клеточного и инфекционного исследования.
Если преобладает локализованный патологический процесс, обычно выявляемый при рентгенологической визуализации (например, при рентгенографии грудной клетки или компьютерной томографии (КТ) грудной клетки), то бронхоскоп направляется в эту конкретную область и вклинивается в подсегмент с визуализацией дистального отдела дыхательных путей в идеале в центре изображения. Если диффузный (гетерогенное заболевание присутствует на визуализации), наиболее предпочтительным местом для лаважа будет правая средняя доля или язычок. Поскольку бронхоскопия обычно проводится в положении пациента лежа на спине, передняя проекция этих сегментов позволяет гравитации способствовать максимальному БАЛ. Поэтому мы предпочитаем эти сайты. Если эти сегменты недоступны, можно также использовать верхний или передний сегмент любой из нижних долей. Теоретически этот процесс позволяет промывать до 1 миллиона альвеол.
Поэтому мы предпочитаем эти сайты. Если эти сегменты недоступны, можно также использовать верхний или передний сегмент любой из нижних долей. Теоретически этот процесс позволяет промывать до 1 миллиона альвеол.
Гистопатология
Несмотря на то, что сбор образцов БАЛ не стандартизирован, эксперты предлагают следовать протоколу, чтобы свести к минимуму контаминацию и артефакты. Собранную лаважную жидкость следует объединить, смешать и записать объем. Жидкость следует отправлять в лабораторию при хранении на льду, если транспортировка задерживается более чем на 1 час. Исследования показывают, что клетки в жидкости БАЛ могут оставаться жизнеспособными в течение 4 часов при комнатной температуре. Жидкость обычно анализируют на лейкоциты и эритроциты. Чтобы отличить незрелые макрофаги от больших лимфоцитов, применяют окраску эстеразой. Другие пятна могут определять наличие железа, злокачественных клеток, неорганической пыли и микроорганизмов. В целом, если образец БАЛ содержит менее 2 миллионов клеток или менее десяти альвеолярных макрофагов в поле зрения при большом увеличении, или содержит большое количество эритроцитов (из-за травмы), или имеются дегенеративные изменения, образец не должен быть уверенным в правильности диагноза. Следует отметить, что среднее количество клеток, выделенных из жидкости БАЛ у здоровых некурящих взрослых, варьируется от 100 до 150 000/мл. Курение увеличивает количество клеток в 4-6 раз, большинство из которых являются макрофагами.[5][6]
Следует отметить, что среднее количество клеток, выделенных из жидкости БАЛ у здоровых некурящих взрослых, варьируется от 100 до 150 000/мл. Курение увеличивает количество клеток в 4-6 раз, большинство из которых являются макрофагами.[5][6]
Токсикокинетика
Как и при любой гибкой бронхоскопии, необходимо знать о токсичности и побочных эффектах лекарств, назначаемых для успокоения сознания (например, мидазолам, пропофол, фентанил и т. д.) и подавления кашля (лидокаин для местного применения).
Анамнез и физикальное исследование
При сборе анамнеза убедитесь в отсутствии противопоказаний к бронхоскопии с целью БАЛ, таких как инфаркт миокарда в течение последних четырех недель или нестабильная стенокардия, гемодинамическая нестабильность, неконтролируемые аритмии и рефрактерная гипоксемия.
Принятие во внимание статуса курения и экспозиции в анамнезе также важно для того, чтобы выявить существенное влияние курения на клеточный состав ЖБАЛ, а именно на большее количество нейтрофилов и макрофагов, чем у некурящих.
Оценка
Недостаток убедительных доказательств, подтверждающих конкретные значения нормального БАЛ, заставляет нас обратить внимание на отсечения конкретных клеточных линий, которые подтверждают определенные диагнозы, такие как:
Увеличение нейтрофилов (>5%)
Идиопатический фиброз легких (ИЛФ), острый респираторный дистресс-синдром (ОРДС), инфекции, заболевания соединительной ткани.
Эозинофилия
>25%: предполагают наличие эозинофильных заболеваний легких, таких как острая эозинофильная пневмония, хроническая эозинофильная пневмония и синдром Чарга-Стросса
Лимфоцитоз
> 50%: гиперчувствительный пневмонит
При наличии более или равного 15% лимфоцитов можно оценить соотношение CD4/CD8.
Повышенный уровень CD4/CD8: гиперчувствительный пневмонит (хронический или курения), саркоидоз, бериллиоз, асбестоз, болезнь Крона, заболевания соединительной ткани острый гиперчувствительный пневмонит, силикоз, лекарственное заболевание легких, ВИЧ-инфекция, BOOP (COP)
Постепенное потемнение аликвоты кровавого БАЛ свидетельствует о ДАГ. Нагруженные гемосидерином макрофаги также могут быть обнаружены при анализе БАЛ.
Нагруженные гемосидерином макрофаги также могут быть обнаружены при анализе БАЛ.
При подозрении на хронический бериллиоз положительный результат теста на пролиферацию лимфоцитов будет положительным.
Лечение/управление
БАЛ — отличный метод получения образцов для исключения оппортунистических инфекций у лиц с ослабленным иммунитетом. Важно сочетать результаты культивирования с цитологией, которая может показать вирусные внутриядерные или внутрицитоплазматические тельца включения при исследовании клеток легочного эпителия. это может помочь идентифицировать такие вирусы, как простой герпес и ЦМВ. БАЛ также очень полезен для обнаружения грибков и микобактерий, которые не всегда можно идентифицировать в крови. Одним из больших недостатков БАЛ является то, что многие потенциально патогенные микроорганизмы могут колонизировать дыхательные пути при отсутствии какого-либо клинического заболевания, и, следовательно, их восстановление может быть бессмысленным.

Использование БАЛ широко изучалось у пациентов с интерстициальными заболеваниями легких, такими как гиперчувствительный пневмонит, саркоидоз и идиопатический легочный фиброз. К сожалению, результаты БАЛ часто неспецифичны для этих заболеваний легких, и поэтому врач должен также учитывать клинические данные и данные визуализации, прежде чем ставить диагноз. При некоторых заболеваниях, таких как острая эозинофильная пневмония, БАЛ спасает пациента от ненужной биопсии легкого
BAL также оказался полезным при оценке людей с профессиональным воздействием асбеста и других силикатов. Эти проглоченные макрофагами частицы профессиональной пыли обычно видны в жидкости в поляризованном свете. Цитология БАЛ также полезна для оценки пациентов со злокачественными новообразованиями дыхательных путей.
В большинстве случаев БАЛ проводится в диагностических целях. Однако БАЛ уникально используется для лечения легочного альвеолярного протеиноза. Это включает закапывание от 30 до 50 литров стерильного физиологического раствора через двухпросветную эндотрахеальную трубку, когда пациент находится под общей анестезией.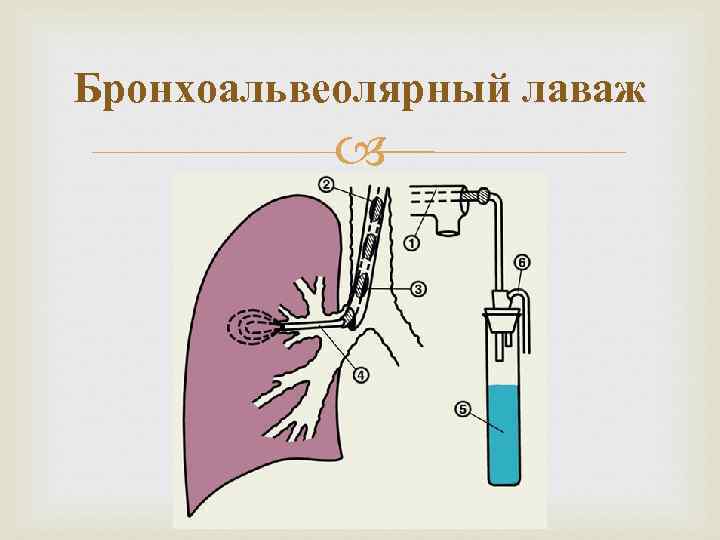
Дифференциальный диагноз
Реакция препарата
ЛИМФОМА
Саркоидоз
. К ним относятся транзиторная гипоксемия, лихорадка после БАЛ (наблюдается у 30% пациентов), бронхоспазм и очень редко пневмоторакс. Учитывая низкую заболеваемость, рутинная рентгенография грудной клетки после процедуры не проводится, если нет клинических показаний.
Улучшение результатов медицинской бригады
И основной лечащий врач, и практикующая медсестра должны быть знакомы с БАЛ. Техника включает закапывание стерильного физиологического раствора в субсегмент легкого с последующим отсасыванием и сбором закапывания для анализа. Эта процедура обычно облегчается введением гибкого бронхоскопа в субсегмент легкого. Процедура в том виде, в каком мы ее знаем сегодня, была популяризирована в 1974 году благодаря работе американских врачей Рейнольдса и Ньюболла в Мэриленде. Сегодня он служит преимущественно в качестве диагностического инструмента для оценки патологии нижних дыхательных путей, а при некоторых необычных состояниях также имеет терапевтическую ценность. В то время как любой медицинский работник может выполнить БАЛ, процедуру лучше всего проводить пульмонолог или торакальный хирург для достижения оптимальных результатов.
В то время как любой медицинский работник может выполнить БАЛ, процедуру лучше всего проводить пульмонолог или торакальный хирург для достижения оптимальных результатов.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Список литературы
- 1.
Gibelin A, Parrot A, Fartoukh M, de Prost N. Редкие респираторные заболевания в отделении интенсивной терапии: когда их подозревать и конкретные подходы. Curr Opin Crit Care. 2019 фев; 25 (1): 29-36. [PubMed: 30531533]
- 2.
Lachant DJ, Croft DP, McGrane Minton H, Hardy DJ, Prasad P, Kottmann RM. Клиническое влияние пневмоцисты и вирусной ПЦР на бронхоальвеолярный лаваж у пациентов с иммуносупрессией. Респир Мед. 2018 дек;145:35-40. [Бесплатная статья PMC: PMC7126456] [PubMed: 30509714]
- 3.
Lehrnbecher T, Hassler A, Groll AH, Bochennek K.
 Диагностические подходы к инвазивному аспергиллезу, специфичные для педиатрической популяции. Фронт микробиол. 2018;9:518. [PMC free article: PMC5879093] [PubMed: 29632518]
Диагностические подходы к инвазивному аспергиллезу, специфичные для педиатрической популяции. Фронт микробиол. 2018;9:518. [PMC free article: PMC5879093] [PubMed: 29632518]- 4.
Pennington K, Wilson J, Limper AH, Escalante P. Can Respir J. 2018; 2018: 6283935. [Бесплатная статья PMC: PMC5903325] [PubMed: 29849833]
- 5.
Джайн К., Уэйнрайт С., Смит А.Р. Антимикробная терапия муковисцидоза под контролем бронхоскопии. Cochrane Database Syst Rev. 2018 Sep 17;9(9):CD009530. [Бесплатная статья PMC: PMC6513589] [PubMed: 30221745]
- 6.
Гарсалли Х., Млика М., Сахнун И., Маалей С., Дуик Эль Гарби Л., Мезни Ф.Е. Полезность бронхоальвеолярного лаважа в оценке интерстициальных заболеваний легких: клинико-патологическая перспектива. Семин Диагн Патол. 2018 сен; 35 (5): 280-287. [В паблике: 30173880]
- 7.
Salzer HJF, Schäfer G, Hoenigl M, Günther G, Hoffmann C, Kalsdorf B, Alanio A, Lange C.
 Клинические, диагностические и лечебные различия между ВИЧ-инфицированными и не-ВИЧ-инфицированными людьми с ослабленным иммунитетом Пациенты с пневмоцистной пневмонией Pneumocystis jirovecii. Дыхание. 2018;96(1):52-65. [PubMed: 29635251]
Клинические, диагностические и лечебные различия между ВИЧ-инфицированными и не-ВИЧ-инфицированными людьми с ослабленным иммунитетом Пациенты с пневмоцистной пневмонией Pneumocystis jirovecii. Дыхание. 2018;96(1):52-65. [PubMed: 29635251]- 8.
Сизар О, Талати Р. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 22 августа 2022 г. Бериллиоз. [В паблике: 29261866]
Новая процедура «промывания легких» помогает пациентам снова дышать — Jagwire
Корвина Райт в эти дни дышит намного лучше благодаря новой процедуре, выполняемой врачами в Медицинском центре Университета Огасты.
Райт является первым пациентом медицинского центра, прошедшим промывание всего легкого, терапевтическое лечение для пациентов, которые, как и Райт, страдают легочным альвеолярным протеинозом (ЛАП), редким и опасным для жизни заболеванием легких, вызванным накоплением белок и другие остатки в альвеолах. По мере того, как вырабатывается больше белка, пациентам становится труднее дышать, и им часто прописывают кислород, чтобы выжить.
Неинвазивная процедура включает в себя очистку одного легкого за один раз с использованием физиологического раствора для вымывания белка и других аномальных веществ из воздушных мешочков, называемых альвеолами. Эта процедура может занять до четырех часов, и пациенты обычно возвращаются к нормальной деятельности в течение нескольких дней без использования кислорода.
«В течение многих лет я имел дело с таким количеством осложнений, связанных с этим заболеванием, и без этого варианта у меня не было бы хорошего качества жизни», — сказал Райт. «Раньше я ездил в Джексонвилл, штат Флорида, чтобы пройти это лечение, и я благодарен за то, что его предлагают так близко к моему дому в Трентоне, Южная Каролина, потому что уход, который я получаю в Университете Огасты, действительно успокаивает меня».
Медицинский центр AU — единственное учреждение в районе Огасты, предлагающее такое лечение. Процедуры проводит доктор Шахин Ислам, заведующий отделением легочной и интенсивной терапии медицинского факультета Медицинского колледжа Джорджии. Как национальный лидер в области интервенционной пульмонологии, Ислам сказал, что он в восторге от этой возможности медицинского обслуживания, которая теперь доступна в Огасте.
Как национальный лидер в области интервенционной пульмонологии, Ислам сказал, что он в восторге от этой возможности медицинского обслуживания, которая теперь доступна в Огасте.
«Мы стремимся обеспечить таких пациентов, как Корвина, оптимальным уходом, и я благодарен за возможность предложить этот вид лечения тем, кто страдает от этой редкой и ограничивающей жизнь болезни», — сказал он. «Поскольку это хроническое заболевание, промывание всего легкого — это лечение, которое пациентам с ЛАП потребуется один или два раза в год. Однако это улучшает качество их жизни, поэтому мы это делаем».
Прошло четыре недели с тех пор, как Райт прошла курс лечения, и теперь она говорит, что ее дыхание улучшилось, и она с нетерпением ждет будущего.
«Как мама, я хочу быть рядом со своими детьми, и это лечение дает мне шанс осуществить эту мечту», — сказала она. «Доктор. Ислам и его команда — замечательные люди, и я выздоровел быстрее, чем ожидал. Поэтому я рад быть его пациентом, потому что доверяю ему».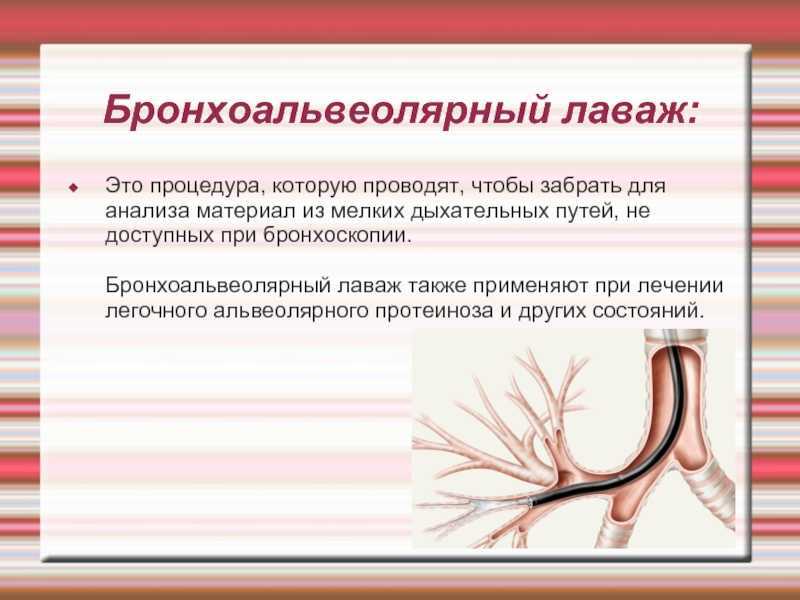


 Диагностические подходы к инвазивному аспергиллезу, специфичные для педиатрической популяции. Фронт микробиол. 2018;9:518. [PMC free article: PMC5879093] [PubMed: 29632518]
Диагностические подходы к инвазивному аспергиллезу, специфичные для педиатрической популяции. Фронт микробиол. 2018;9:518. [PMC free article: PMC5879093] [PubMed: 29632518]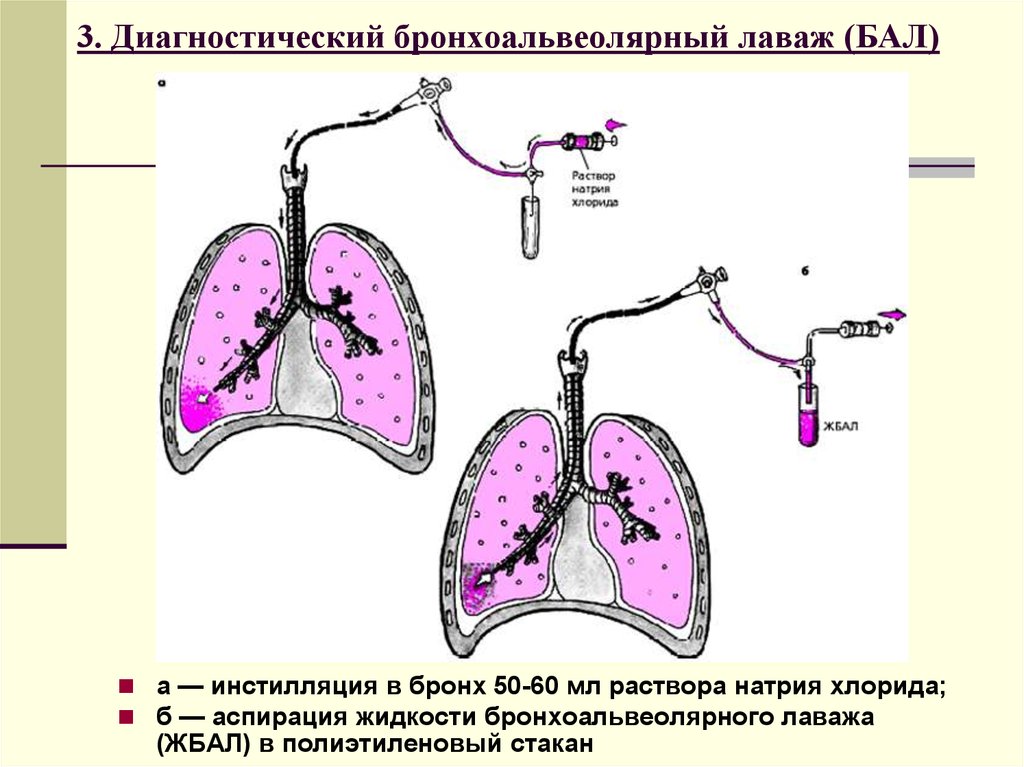 Клинические, диагностические и лечебные различия между ВИЧ-инфицированными и не-ВИЧ-инфицированными людьми с ослабленным иммунитетом Пациенты с пневмоцистной пневмонией Pneumocystis jirovecii. Дыхание. 2018;96(1):52-65. [PubMed: 29635251]
Клинические, диагностические и лечебные различия между ВИЧ-инфицированными и не-ВИЧ-инфицированными людьми с ослабленным иммунитетом Пациенты с пневмоцистной пневмонией Pneumocystis jirovecii. Дыхание. 2018;96(1):52-65. [PubMed: 29635251]