Лечение бактериофагами синегнойной палочки: Бактериофаг псевдомонас аеругиноза (синегнойный), инструкция по применению, противопоказания. состав
Бактериофаги
БАКТЕРИОФАГИ КАК АЛЬТЕРНАТИВА АНТИБИОТИКАМ В ЛЕЧЕНИИ ИНФЕКЦИЙ
Бактериофаги — вирусы бактерий, естественные микроорганизмы, которые, размножаясь внутри бактериальной клетки, ведут к ее быстрой гибели.
Из истории открытия
В 1896 году английский бактериолог Э. Ханкин, исследуя антибактериальное действие воды индийских рек, пришел к выводу о существовании агента, проходящего через бактериальные фильтры и вызывающего лизис холерных вибрионов. Российский микробиолог Н. Ф. Гамалея в 1897 году наблюдал лизис бацилл сибирской язвы. Однако первой научной публикацией о фагах стала статья английского микробиолога Ф. Туорта, в которой он в 1915 году описал инфекционное поражение стафилококков, значительно изменявшее морфологию колоний. В 1917 году канадский бактериолог Ф. Д’Эрелль независимо от Туорта сообщил об открытии вируса, «пожирающего» бактерии — бактериофага.
Интересный факт: при нанесении бактериофага на влажные слизистые он за 20 минут очищает их от определенного вида бактерий, например от стафилококка.
Так быстро не работает ни один антибиотик.
Действие бактериофагов отличается от действия антибиотиков:
- Для определенного вида бактерий существует свой определенный бактериофаг. Но стоит отметить, что не ко всем бактериям есть бактериофаги (это основной недостаток этих препаратов). Для решения вопроса, какую терапию выбрать для лечения инфекции, врач должен сначала взять материал для посева на флору с точным определением вида возбудителя и только после получения анализа на чувствительность микроорганизма к бактериофагам выбрать препарат.
- Бактериофаги не действуют на нормофлору (нормальные бактерии), поэтому лечение бактериофагами экологично и не требует коррекции нормофлоры.
- Бактериофаги не влияют на организм человека, поскольку не способны проникнуть в клетки человека. Поэтому бактериофаги не токсичны и не вызывают побочных эффектов.
- После уничтожения патогена элиминируются (самовыводятся) из организма.

- Бактериофаги просты в применении: большинство их производится в жидком виде. Доступно наружное орошение при местном применении, полоскании, в виде микроклизм при кишечных инфекциях. Но действуют бактериофаги только местно, то есть именно там, где вы их применяете при полоскании, орошении и закапывании. В отличие от антибиотиков, которые при приеме внутрь распределяются по организму и действуют во всех органах и тканях.
- Бактериофаги стимулируют местный иммунитет, так как частицы уничтоженных бактерий побуждают иммунную систему к выработке специфических антител. Из-за этого свойства бактериофаги являются препаратом выбора в лечении бактерионосительства (например, стафилококконосительства) и хронических форм бактериальных инфекций.
- Сочетаются с другими препаратами, в том числе с антибиотиками. Их совместное применение ведет к быстрому выздоровлению от бактериальной инфекции.
- По совокупности описанных свойств бактериофаги применимы как основной препарат для лечения бактериальных инфекций у беременных, детей с рождения и людей пожилого возраста, а также в тех случаях, когда имеется полирезистентность микроорганизма к антибиотикам.

В лаборатории KDL предлагается 2 варианта посевов на флору с определением чувствительности выделенной культуры микроорганизма к препаратам бактериофагов и разным наборам антибиотиков в зависимости от ситуации пациента (выбирает врач), например:
Посев на микрофлору отделяемого урогенитального тракта женщины с определением чувствительности к основному спектру антибиотиков и бактериофагам, в т.ч. Кандида
Посев на микрофлору отделяемого урогенитального тракта женщины с определением чувствительности к расширенному спектру антибиотиков и бактериофагам, в т.ч. Кандида
Какие инфекции можно лечить бактериофагами:
- кожные, ожоговые и раневые инфекции;
- инфекции ЛОР органов;
- инфекции урогенитального тракта;
- отдельные инфекции желудочно-кишечного тракта.
Возбудителями этих инфекций могут быть такие бактерии, как золотистый стафилококк, синегнойная палочка, патогенные формы кишечной палочки, сальмонеллы, стрептококки.
В Новосибирском научном центре технологии персонализированного лечения бактериофагами в большой коллекции бактериофагов есть уникальные штаммы, способные бороться с недавно появившимися и уже получившими широкое распространение возбудителями больничных инфекций, такими как грамотрицательные бактерии Acinetobacter baumanii, Stenotrophomonas maltophilia и др.
Последние годы ознаменовались широкими исследованиями бактериофагов из-за нарастающей проблемы антибиотикорезистентности микроорганизмов, которые находят всё новые применения не только в терапии и профилактике, но и в биотехнологиях. Их очевидным практическим результатом должно стать возникновение нового мощного направления персонализированной медицины, а также создание целого спектра технологий в пищевой промышленности, ветеринарии, сельском хозяйстве и в производстве современных материалов. Мы ждем, что второе столетие исследований бактериофагов принесет не меньше открытий, чем первое.
Поделиться статьей:
Остались вопросы?Вирусы вместо антибиотиков. Как бороться с суперинфекциями
https://ria.ru/20200411/1569880170.html
Вирусы вместо антибиотиков. Как бороться с суперинфекциями
Вирусы вместо антибиотиков. Как бороться с суперинфекциями — РИА Новости, 11.04.2020
Вирусы вместо антибиотиков. Как бороться с суперинфекциями
С некоторых пор болезнетворные бактерии стали вырабатывать устойчивость к антибиотику последнего резерва — колистину. Его применяют в тех случаях, когда… РИА Новости, 11.04.2020
2020-04-11T08:00
2020-04-11T08:00
2020-04-11T08:08
наука
воз
российская академия наук
московский физико-технический институт
открытия — риа наука
арктика
здоровье
биология
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.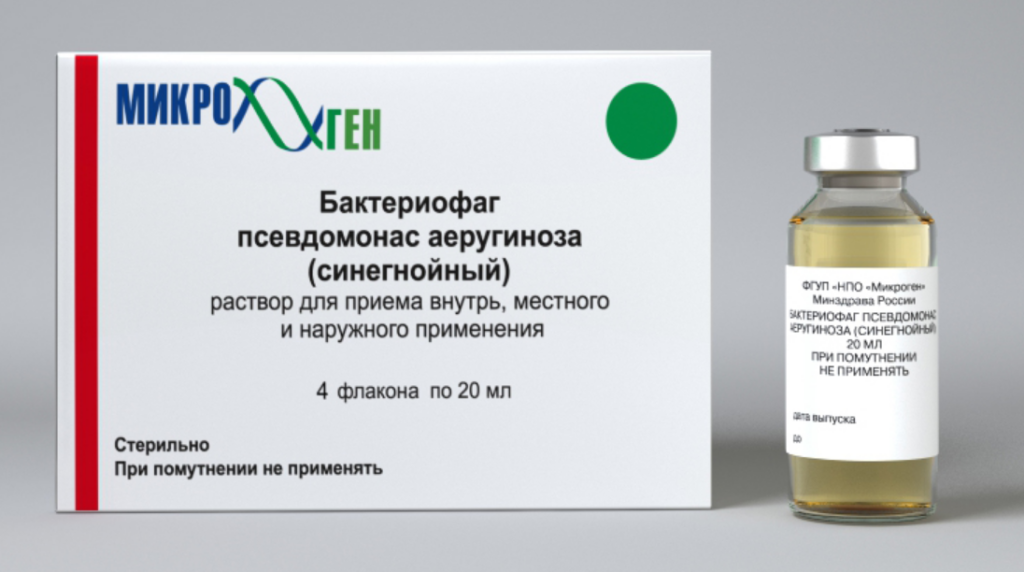 img.ria.ru/images/07e4/04/0a/1569869506_0:160:3072:1888_1920x0_80_0_0_61f0d2a50007a6cbe170aec94920d95c.jpg
img.ria.ru/images/07e4/04/0a/1569869506_0:160:3072:1888_1920x0_80_0_0_61f0d2a50007a6cbe170aec94920d95c.jpg
МОСКВА, 11 апр — РИА Новости, Альфия Еникеева. С некоторых пор болезнетворные бактерии стали вырабатывать устойчивость к антибиотику последнего резерва — колистину. Его применяют в тех случаях, когда остальные лекарства бессильны перед возбудителями инфекций. Неубиваемые микроорганизмы появились даже в Арктике, а Всемирная организация здравоохранения составила список из 12 наиболее опасных супербактерий, средство против которых необходимо найти уже сейчас. Глобальная угрозаПо данным британских исследователей, к 2050 году число смертей от антибиотикорезистентных супербактерий с сегодняшних семисот тысяч увеличится до десяти миллионов в год. Чаще всего люди, как считают специалисты ВОЗ, будут умирать от устойчивых к карбапенему энтеробактерий, синегнойной палочки (Pseudomonas aeruginosa) и ацинетобактера (Acinetobacter baumannii). Все эти возбудители связаны с так называемыми внутрибольничными инфекциями, которые пациенты цепляют в госпиталях и поликлиниках, где лечатся от других заболеваний. Также среди наиболее опасных супербактерий, по данным ВОЗ, оказались энтерококки (Enterococcus faecium), золотистый стафилококк (MRSA), гонококк и устойчивый к кларитромицину хеликобактер — патогены, вызывающие менингит, заражение крови, пневмонию, гонорею и инфекции мочевыводящих путей.Судя по эксперименту гарвардских ученых, невосприимчивость к лекарствам развивается у этих микроорганизмов стремительно. Обычная кишечная палочка Escherichia coli всего за 11 дней приспособилась к тысячекратной дозе антибиотиков и фактически превратилась в супермикроб, практически неуязвимый для любых существующих препаратов.Найти новый антибиотикТеоретически ученые способны создать лекарство против бактерий, нечувствительных к нынешним антибиотикам, однако его разработка и испытания могут занять долгие годы. А это, в свою очередь, может быть финансово невыгодно фармацевтическим компаниям. Выход из сложившейся ситуации предложили исследователи из МФТИ, МГУ и Института биохимии и генетики РАН, придумавшие полуавтоматический метод поиска антибиотиков нового класса.
Также среди наиболее опасных супербактерий, по данным ВОЗ, оказались энтерококки (Enterococcus faecium), золотистый стафилококк (MRSA), гонококк и устойчивый к кларитромицину хеликобактер — патогены, вызывающие менингит, заражение крови, пневмонию, гонорею и инфекции мочевыводящих путей.Судя по эксперименту гарвардских ученых, невосприимчивость к лекарствам развивается у этих микроорганизмов стремительно. Обычная кишечная палочка Escherichia coli всего за 11 дней приспособилась к тысячекратной дозе антибиотиков и фактически превратилась в супермикроб, практически неуязвимый для любых существующих препаратов.Найти новый антибиотикТеоретически ученые способны создать лекарство против бактерий, нечувствительных к нынешним антибиотикам, однако его разработка и испытания могут занять долгие годы. А это, в свою очередь, может быть финансово невыгодно фармацевтическим компаниям. Выход из сложившейся ситуации предложили исследователи из МФТИ, МГУ и Института биохимии и генетики РАН, придумавшие полуавтоматический метод поиска антибиотиков нового класса. Он основан на анализе того, как те или иные вещества действуют на патогенные микроорганизмы и уничтожают их. Ученые проверили действие почти 125 тысяч соединений на штамме кишечной палочки Escherichia coli и выявили 688 веществ, обладающих выраженной антибактериальной активностью. Некоторые из них обладали одинаковой подструктурной 2-пиразол-1-ил-тиазол группой. А значит, соединения, относящиеся к этому классу, могут быть эффективны в борьбе с лекарственно устойчивыми бактериями.Затем исследователи проанализировали принадлежащие к этой группе восемь молекул, которые уничтожали микроорганизмы, блокируя им синтез белка. Среди изученных веществ только одно не проявляло цитотоксического эффекта и гипотетически не представляло опасности для человека. Однако его еще следует тщательно исследовать и испытывать на модельных животных, отмечают авторы работы.Вирусы против бактерийАмериканские ученые предлагают бороться с микроорганизмами, устойчивыми к антибиотикам, с помощью бактериофагов — вирусов, избирательно поражающих бактериальные клетки.
Он основан на анализе того, как те или иные вещества действуют на патогенные микроорганизмы и уничтожают их. Ученые проверили действие почти 125 тысяч соединений на штамме кишечной палочки Escherichia coli и выявили 688 веществ, обладающих выраженной антибактериальной активностью. Некоторые из них обладали одинаковой подструктурной 2-пиразол-1-ил-тиазол группой. А значит, соединения, относящиеся к этому классу, могут быть эффективны в борьбе с лекарственно устойчивыми бактериями.Затем исследователи проанализировали принадлежащие к этой группе восемь молекул, которые уничтожали микроорганизмы, блокируя им синтез белка. Среди изученных веществ только одно не проявляло цитотоксического эффекта и гипотетически не представляло опасности для человека. Однако его еще следует тщательно исследовать и испытывать на модельных животных, отмечают авторы работы.Вирусы против бактерийАмериканские ученые предлагают бороться с микроорганизмами, устойчивыми к антибиотикам, с помощью бактериофагов — вирусов, избирательно поражающих бактериальные клетки. Правда, при такой терапии следует использовать частицы, созданные специально под определенный штамм возбудителя.Специалисты уже помогли подобным образом пациентке, страдающей муковисцидозом и хронически инфицированной антибиотикорезистентным штаммом Mycobacterium abscessus. В начале 2018 года девушке провели двустороннюю трансплантацию легких, а потом обнаружили в анализах опасную микобактерию, спровоцировавшую загноение послеоперационной раны. Противомикробная терапия в течение семи месяцев не давала никаких результатов.Тогда ученые подобрали три фага, наиболее агрессивных по отношению к патогенному микроорганизму, смешали их и проверили действие созданного препарата на культуре штамма GD01 Mycobacterium abscessus, который был выделен у пациентки через месяц после операции. Полученная смесь не оставляла в живых ни одной бактерии, даже при высоких концентрациях.Затем комбинацию из трех бактериофагов в течение 32 недель внутривенно вводили пациентке каждые 12 часов. В результате ее состояние значительно улучшилось: послеоперационная рана стала заживать, а опасная бактерия больше не проявлялась в мокроте и крови.
Правда, при такой терапии следует использовать частицы, созданные специально под определенный штамм возбудителя.Специалисты уже помогли подобным образом пациентке, страдающей муковисцидозом и хронически инфицированной антибиотикорезистентным штаммом Mycobacterium abscessus. В начале 2018 года девушке провели двустороннюю трансплантацию легких, а потом обнаружили в анализах опасную микобактерию, спровоцировавшую загноение послеоперационной раны. Противомикробная терапия в течение семи месяцев не давала никаких результатов.Тогда ученые подобрали три фага, наиболее агрессивных по отношению к патогенному микроорганизму, смешали их и проверили действие созданного препарата на культуре штамма GD01 Mycobacterium abscessus, который был выделен у пациентки через месяц после операции. Полученная смесь не оставляла в живых ни одной бактерии, даже при высоких концентрациях.Затем комбинацию из трех бактериофагов в течение 32 недель внутривенно вводили пациентке каждые 12 часов. В результате ее состояние значительно улучшилось: послеоперационная рана стала заживать, а опасная бактерия больше не проявлялась в мокроте и крови. Впрочем, авторы статьи предупреждают: говорить об эффективности лечения бактериофагами пока рано, ведь это единичный клинический случай. Тем не менее в медицинской литературе уже описана успешная терапия инфекций, вызванных супербактериями, с помощью антибиотиков и бактериофага. Искусственные и эффективныеКитайские, американские и сингапурские ученые синтезировали вещество, способное разрушить сразу несколько бактерий, устойчивых к антибиотикам, — в том числе синегнойную палочку и золотистый стафилококк (MRSA). Речь идет о биоразлагаемом поликарбонатном полимере с гуанидиновыми функциональными группами, чьи молекулы могут связываться с бактериальной мембраной и, не разрушая ее, проникать внутрь клетки. Там гуанидин нарушает структуру белков цитоплазмы, и они выпадают в осадок, убивая бактерию.Исследователи протестировали новое лекарство на крысиных эритроцитах и клетках эмбриональных человеческих почек. Полимер оказался абсолютно нетоксичен для первых и менее ядовит для вторых, чем антибиотик полимиксин В, используемый сегодня в лечении бактериальных инфекций.
Впрочем, авторы статьи предупреждают: говорить об эффективности лечения бактериофагами пока рано, ведь это единичный клинический случай. Тем не менее в медицинской литературе уже описана успешная терапия инфекций, вызванных супербактериями, с помощью антибиотиков и бактериофага. Искусственные и эффективныеКитайские, американские и сингапурские ученые синтезировали вещество, способное разрушить сразу несколько бактерий, устойчивых к антибиотикам, — в том числе синегнойную палочку и золотистый стафилококк (MRSA). Речь идет о биоразлагаемом поликарбонатном полимере с гуанидиновыми функциональными группами, чьи молекулы могут связываться с бактериальной мембраной и, не разрушая ее, проникать внутрь клетки. Там гуанидин нарушает структуру белков цитоплазмы, и они выпадают в осадок, убивая бактерию.Исследователи протестировали новое лекарство на крысиных эритроцитах и клетках эмбриональных человеческих почек. Полимер оказался абсолютно нетоксичен для первых и менее ядовит для вторых, чем антибиотик полимиксин В, используемый сегодня в лечении бактериальных инфекций. Кроме того, новое соединение полностью разлагалось за трое суток, а продукты его распада были безвредны.Кроме того, выяснилось, что созданный учеными полимер не вызывает привыкания у опасных микроорганизмов. Специалисты обрабатывали культуру Acinetobacter baumannii — возбудителя пневмонии — этим соединением в концентрациях, позволявших некоторым бактериям выживать. Затем из них выращивали новую культуру и снова обрабатывали ее поликарбонатом. И так тридцать раз подряд. Однако даже после этого микробы не выработали устойчивости к полимеру. Для сравнения: резистентность к антибиотику, который обычно применяют против Acinetobacter baumannii, бактерии выработали за восемь циклов.Авторы работы намерены в будущем протестировать созданный ими полимер на людях.
Кроме того, новое соединение полностью разлагалось за трое суток, а продукты его распада были безвредны.Кроме того, выяснилось, что созданный учеными полимер не вызывает привыкания у опасных микроорганизмов. Специалисты обрабатывали культуру Acinetobacter baumannii — возбудителя пневмонии — этим соединением в концентрациях, позволявших некоторым бактериям выживать. Затем из них выращивали новую культуру и снова обрабатывали ее поликарбонатом. И так тридцать раз подряд. Однако даже после этого микробы не выработали устойчивости к полимеру. Для сравнения: резистентность к антибиотику, который обычно применяют против Acinetobacter baumannii, бактерии выработали за восемь циклов.Авторы работы намерены в будущем протестировать созданный ими полимер на людях.
https://ria.ru/20200408/1569747118.html
https://ria.ru/20190621/1555750534.html
https://ria.ru/20171121/1509250548.html
арктика
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.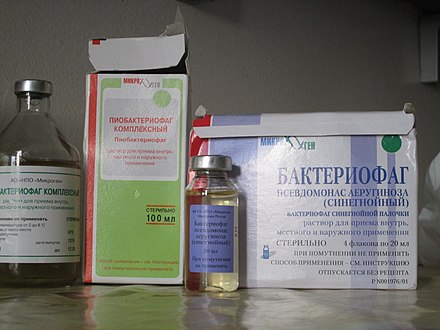 xn--p1ai/awards/
xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/07e4/04/0a/1569869506_171:0:2902:2048_1920x0_80_0_0_85334f89062d108c10a940e7e6b52f3a.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
воз, российская академия наук, московский физико-технический институт, открытия — риа наука, арктика, здоровье, биология, бактерии
МОСКВА, 11 апр — РИА Новости, Альфия Еникеева. С некоторых пор болезнетворные бактерии стали вырабатывать устойчивость к антибиотику последнего резерва — колистину. Его применяют в тех случаях, когда остальные лекарства бессильны перед возбудителями инфекций. Неубиваемые микроорганизмы появились даже в Арктике, а Всемирная организация здравоохранения составила список из 12 наиболее опасных супербактерий, средство против которых необходимо найти уже сейчас.
С некоторых пор болезнетворные бактерии стали вырабатывать устойчивость к антибиотику последнего резерва — колистину. Его применяют в тех случаях, когда остальные лекарства бессильны перед возбудителями инфекций. Неубиваемые микроорганизмы появились даже в Арктике, а Всемирная организация здравоохранения составила список из 12 наиболее опасных супербактерий, средство против которых необходимо найти уже сейчас.
Глобальная угроза
По данным британских исследователей, к 2050 году число смертей от антибиотикорезистентных супербактерий с сегодняшних семисот тысяч увеличится до десяти миллионов в год. Чаще всего люди, как считают специалисты ВОЗ, будут умирать от устойчивых к карбапенему энтеробактерий, синегнойной палочки (Pseudomonas aeruginosa) и ацинетобактера (Acinetobacter baumannii). Все эти возбудители связаны с так называемыми внутрибольничными инфекциями, которые пациенты цепляют в госпиталях и поликлиниках, где лечатся от других заболеваний.Также среди наиболее опасных супербактерий, по данным ВОЗ, оказались энтерококки (Enterococcus faecium), золотистый стафилококк (MRSA), гонококк и устойчивый к кларитромицину хеликобактер — патогены, вызывающие менингит, заражение крови, пневмонию, гонорею и инфекции мочевыводящих путей.
Найти новый антибиотик
Теоретически ученые способны создать лекарство против бактерий, нечувствительных к нынешним антибиотикам, однако его разработка и испытания могут занять долгие годы. А это, в свою очередь, может быть финансово невыгодно фармацевтическим компаниям.
Выход из сложившейся ситуации предложили исследователи из МФТИ, МГУ и Института биохимии и генетики РАН, придумавшие полуавтоматический метод поиска антибиотиков нового класса. Он основан на анализе того, как те или иные вещества действуют на патогенные микроорганизмы и уничтожают их.
Он основан на анализе того, как те или иные вещества действуют на патогенные микроорганизмы и уничтожают их.Ученые проверили действие почти 125 тысяч соединений на штамме кишечной палочки Escherichia coli и выявили 688 веществ, обладающих выраженной антибактериальной активностью. Некоторые из них обладали одинаковой подструктурной 2-пиразол-1-ил-тиазол группой. А значит, соединения, относящиеся к этому классу, могут быть эффективны в борьбе с лекарственно устойчивыми бактериями.
8 апреля 2020, 14:08НаукаУченые раскрыли, почему стафилоккок больше не лечится антибиотикамиЗатем исследователи проанализировали принадлежащие к этой группе восемь молекул, которые уничтожали микроорганизмы, блокируя им синтез белка. Среди изученных веществ только одно не проявляло цитотоксического эффекта и гипотетически не представляло опасности для человека. Однако его еще следует тщательно исследовать и испытывать на модельных животных, отмечают авторы работы.
Вирусы против бактерий
Американские ученые предлагают бороться с микроорганизмами, устойчивыми к антибиотикам, с помощью бактериофагов — вирусов, избирательно поражающих бактериальные клетки. Правда, при такой терапии следует использовать частицы, созданные специально под определенный штамм возбудителя.
Правда, при такой терапии следует использовать частицы, созданные специально под определенный штамм возбудителя.Специалисты уже помогли подобным образом пациентке, страдающей муковисцидозом и хронически инфицированной антибиотикорезистентным штаммом Mycobacterium abscessus. В начале 2018 года девушке провели двустороннюю трансплантацию легких, а потом обнаружили в анализах опасную микобактерию, спровоцировавшую загноение послеоперационной раны. Противомикробная терапия в течение семи месяцев не давала никаких результатов.
21 июня 2019, 08:00НаукаУченые нашли замену антибиотикамТогда ученые подобрали три фага, наиболее агрессивных по отношению к патогенному микроорганизму, смешали их и проверили действие созданного препарата на культуре штамма GD01 Mycobacterium abscessus, который был выделен у пациентки через месяц после операции. Полученная смесь не оставляла в живых ни одной бактерии, даже при высоких концентрациях.
Затем комбинацию из трех бактериофагов в течение 32 недель внутривенно вводили пациентке каждые 12 часов. В результате ее состояние значительно улучшилось: послеоперационная рана стала заживать, а опасная бактерия больше не проявлялась в мокроте и крови.
В результате ее состояние значительно улучшилось: послеоперационная рана стала заживать, а опасная бактерия больше не проявлялась в мокроте и крови.
Искусственные и эффективные
Китайские, американские и сингапурские ученые синтезировали вещество, способное разрушить сразу несколько бактерий, устойчивых к антибиотикам, — в том числе синегнойную палочку и золотистый стафилококк (MRSA). Речь идет о биоразлагаемом поликарбонатном полимере с гуанидиновыми функциональными группами, чьи молекулы могут связываться с бактериальной мембраной и, не разрушая ее, проникать внутрь клетки. Там гуанидин нарушает структуру белков цитоплазмы, и они выпадают в осадок, убивая бактерию.
Исследователи протестировали новое лекарство на крысиных эритроцитах и клетках эмбриональных человеческих почек. Полимер оказался абсолютно нетоксичен для первых и менее ядовит для вторых, чем антибиотик полимиксин В, используемый сегодня в лечении бактериальных инфекций. Кроме того, новое соединение полностью разлагалось за трое суток, а продукты его распада были безвредны.
Кроме того, выяснилось, что созданный учеными полимер не вызывает привыкания у опасных микроорганизмов. Специалисты обрабатывали культуру Acinetobacter baumannii — возбудителя пневмонии — этим соединением в концентрациях, позволявших некоторым бактериям выживать. Затем из них выращивали новую культуру и снова обрабатывали ее поликарбонатом. И так тридцать раз подряд. Однако даже после этого микробы не выработали устойчивости к полимеру. Для сравнения: резистентность к антибиотику, который обычно применяют против Acinetobacter baumannii, бактерии выработали за восемь циклов.
Авторы работы намерены в будущем протестировать созданный ими полимер на людях.
Бактериофаги успешнее борются с инфекциями, чем антибиотики — Российская газета
«РГ» (26.10.2009 г. и 3.09.2010 г.) писала о том, что во время операции по удалению катаракты пациенту был занесен штамм синегнойной палочки. В результате тот ослеп. И он оказался не единственным, кто стал жертвой больничной инфекции.
В статье «Заразились в операционной» доктор медицинских наук профессор Сергей Митрохин («РГ» за 17.09 с.г.), продолжая разговор, говорил об опасности бесконтрольного применения антибиотиков, о необходимости запрета их продажи без рецепта врача.
Революционерам-антибиотикам пришел конец? А что же защитит нас от инфекций? Как выстоять в борьбе с ними? Инфекции, в том числе и внутрибольничные, сдавать свои позиции не собираются. Особую силу, судя по всему, им придала тропическая жара и смог нынешнего лета. Знаем, что это привело к снижению иммунитета, знаем уже о первых потерях. Но впереди наступление сезонных инфекций. Не далее как вчера в Роспотребнадзоре сообщили, что в России начался рост заболеваемости гриппом.
В Москве прошла 60-я сессия Европейского регионального бюро Всемирной организации здравоохранения. Одна из главных, пожалуй, даже самых актуальных тем, которые на ней обсуждались, — профилактика инфекционных заболеваний, современные подходы к их лечению. А незадолго до этого в Японии состоялся еще один знаменательный международный форум. Его тема: применение бактериофагов для лечения инфекционных болезней — прежде всего тех, которые обрели устойчивость (резистентность) к их возбудителям.
Обеспокоенность мирового медицинского сообщества данной проблемой не случайна. Инфекции — одна из ведущих причин летальных исходов. И если раньше против них успешно применялись антибиотики, то теперь… По данным 2009 года, более 25 000 пациентов в странах ЕС ежегодно умирают из-за инфекций, вызванных бактериями, устойчивыми ко множеству существующих лекарств. В России от сепсиса погибает людей больше, чем от ишемической болезни сердца. Страдает не только пациент. Существенно возрастают расходы государства на здравоохранение, снижается производительность труда.
В России от сепсиса погибает людей больше, чем от ишемической болезни сердца. Страдает не только пациент. Существенно возрастают расходы государства на здравоохранение, снижается производительность труда.
Один пример — лечение туберкулеза. Палочка Коха прекрасно адаптировалась к имеющимся антибиотикам, и потому туберкулез так распоясался. Нужны новые антибиотики, которые сумеют эту палочку одолеть? Пока таких нигде в мире нет. Не забудем и о том, что разработка новых видов эффективных препаратов классическим путем требует почти десять лет и очень значительных материальных ресурсов. В прошлом году американское общество специалистов по инфекционным болезням обратилось к президенту страны Бараку Обаме с заявлением о том, что если к 2020 году фармацевтические компании не создадут десять принципиально новых антибиотиков, то мир по борьбе с инфекциями вернется в XIX век.
Об этой проблеме корреспондент «РГ» говорит с заведующим кафедрой дезинфектологии первого Московского государственного медицинского университета имени Сеченова Василием Акимкиным.
Российская газета: Антибиотики появились в середине ХХ века. А до того? Человечество же не вымерло от инфекций? Значит, были иные средства борьбы с ними. Средства естественные, биологические. Они же не исчезли?
Василий Акимкин:
Были и не исчезли. И один из таких природных антибиотиков — бактериофаги. Это вирусы, созданные самой природой с единственной целью, единственным предназначением — убивать бактерии. Причем почти на каждую бактерию — свой бактериофаг. В переводе с греческого бактериофаг означает «пожиратель бактерий».РГ: Как действует этот природный вирус?
Акимкин: Он безошибочно находит свою бактерию-мишень. Бактерии другого рода ему не интересны. Бактериофаг поселяется внутри мишени, начинает в ней размножаться и в конечном итоге уничтожает ее. Бактериофаги были открыты и опробованы до антибиотиков в далеком 1896 году. А началось все со священных вод Ганга. Тогда английский исследователь Эрнест Ханкин задался вопросом: что делает воды Ганга чудотворными, целебными? Почему они умудряются противостоять даже проказе, холере? Что такое есть в воде, способное убивать столь страшные бактерии? Ответил на эти вопросы в 1915 году другой английский ученый Фредерик Творт.
РГ: Ведь советские врачи тоже занимались бактериофагами?
Акимкин: Конечно. Виднейший советский микробиолог Георгий Элиава изучал возможности их применения для лечения различных болезней. Не стану далее вдаваться в подробности исследований и наработок в данной области. Отмечу только, что в 2006 году британское министерство обороны взяло на себя ответственность за дальнейшие исследования, справедливо полагая, что такие наработки важны для медицины и здравоохранения ХХI века. Ведь бактериофаги востребованы не только в медицине, но и в пищевой промышленности для обезвреживания некоторых продуктов питания. Изучается и вопрос их использования для обработки поверхностей и униформы в госпиталях и так далее.
РГ: Бактериофаги свободно продаются в аптеках. Их применяют для борьбы с кишечными инфекциями, дизентерией, сальмонеллой, синегнойной палочкой. Их назначают детям и беременным, советуют брать с собой тем, кто отправляется в экзотические страны. Ими обрабатывают раны, лечат кожные болезни, пневмонию, циститы, отиты, холециститы… Это не опасно? Это не приведет к тому же приручению инфекции, как происходит с антибиотиками?
Их назначают детям и беременным, советуют брать с собой тем, кто отправляется в экзотические страны. Ими обрабатывают раны, лечат кожные болезни, пневмонию, циститы, отиты, холециститы… Это не опасно? Это не приведет к тому же приручению инфекции, как происходит с антибиотиками?
Акимкин: Думаю, что нет. И главное. Применение антибиотиков неизбежно оставляет после себя следы разрушений разной степени. Бактериофаги в подобном замечены не были.
Доктор вирус – Огонек № 6 (5213) от 13.02.2012
Эра антибиотиков подходит к концу. Колоссальный потенциал их воздействия на микробов обесценен человеческим легкомыслием. Теперь многие ученые возлагают надежды на бактериофаги — природные вирусы — разрушители бактерий. Это лекарство буквально лежит у нас под ногами
Ольга Волкова
Сенсация пришла, откуда не ждали,— с берегов Антарктиды. Пока российские полярники бурили 4-километровый ледяной панцирь над антарктическим озером Восток, стремясь добраться до древних микроорганизмов, шведские исследователи из Университета Упсалы обнаружили бактерии нового типа в морской воде у берегов полярного континента. На первый взгляд это были бактерии самой обычной кишечной палочки, попавшей в океан, судя по всему, вместе с бытовыми отходами соседней чилийской станции Arturo Prat. А необычным в них было то, что эти бактерии способны запросто нейтрализовать активность практически всех известных науке антибиотиков.
На первый взгляд это были бактерии самой обычной кишечной палочки, попавшей в океан, судя по всему, вместе с бытовыми отходами соседней чилийской станции Arturo Prat. А необычным в них было то, что эти бактерии способны запросто нейтрализовать активность практически всех известных науке антибиотиков.
Но и это не все. Бактерии оказались из группы носителей гена бета-лактамазы, а он, в свою очередь, входит в состав плазмид — эдаких универсальных деталей, которые, подобно элементам детского конструктора «Лего», могут быть встроены в генную структуру любой другой бактерии. То есть уже завтра эта антарктическая бактерия может передать свою неуязвимость к антибиотикам всем прочим бактериям. И тогда человечество окажется практически безоружным перед угрозой новых глобальных пандемий.
Дешево и эксклюзивно
Специалисты уточняют: угроза далеко не нова. С момента открытия пенициллина все большее число инфекций теряет чувствительность к антибиотикам. Стафилококки, туберкулез, синегнойная палочка, гонорея, множество других приспособившихся к антибиотикам возбудителей болезней втянули человечество в бесконечную «гонку вооружений», в которой науке противостоят примитивные организмы. И медицина, увы, не всегда в ней лидирует: ежегодно в странах ЕС устойчивыми к антибиотикам инфекциями заражается около 400 тысяч человек, а умирает более 25 тысяч. Эта «гонка», подсчитали в Европе, стоит не менее 1,5 млрд евро: в мире ежегодно разрабатывается и тестируется около 2 тысяч новых антибиотиков.
И медицина, увы, не всегда в ней лидирует: ежегодно в странах ЕС устойчивыми к антибиотикам инфекциями заражается около 400 тысяч человек, а умирает более 25 тысяч. Эта «гонка», подсчитали в Европе, стоит не менее 1,5 млрд евро: в мире ежегодно разрабатывается и тестируется около 2 тысяч новых антибиотиков.
— Однако в последнее время фармацевтические компании сокращают финансирование подобных поисков из-за экономического риска,— говорит «Огоньку» известный эпидемиолог профессор Михаил Фаворов из Международного института вакцин при ООН.— Инфекции слишком быстро приспосабливаются, и колоссальные затраты на разработку новых препаратов не успевают окупаться.
Всемирная организация здравоохранения призывает ввести строгий контроль использования антибиотиков и искать им альтернативу. Один из возможных путей — использование бактериофагов, вирусов, которые по собственному почину уничтожают в природе половину бактерий. Эти нановоители были открыты почти век назад и потрясли научный мир. Первый в США нобелевский лауреат по литературе Синклер Льюис даже написал об этом роман «Эрроусмит».
Первый в США нобелевский лауреат по литературе Синклер Льюис даже написал об этом роман «Эрроусмит».
Типичный бактериофаг имеет настолько малый размер — от 20 до 200 нанометров, что рассмотреть его можно только в электронный микроскоп
Фото: Getty Images/Fotobank
Но еще через 10 лет был открыт пенициллин, который оказался эффективнее в борьбе с микробами. Ведь антибиотики способны уничтожать целые группы разных микроорганизмов, а бактериофаг поражает только один. И чтобы лечить бактериофагом, не обойтись без предварительных точных анализов. Фаги не выдержали конкуренции, их исследование было приостановлено почти повсеместно.
Но не в России. Наши ученые не прекращали исследовать бактериофаги и применять это доступное и недорогое средство в хирургии, при лечении острых кишечных инфекций, дисбактериозов и прочих бед. Приверженцы фаговой терапии утверждают: бактериофагами без каких-либо ограничений и осложнений можно лечить почти все болезни, кроме тех, что вызваны вирусами и простейшими.
Сейчас волна интереса к фагам поднимается и на Западе, хотя там их используют не в лечебных целях, а скорее в профилактических. В США Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) признало безопасность и целесообразность фагов в качестве БАДов, предотвращающих размножение нежелательных бактерий на сырах, кисломолочных продуктах и мясных полуфабрикатах,— словом, рекомендовало использовать в качестве консервантов. В июне 2011-го отечественный Роспотребнадзор созвал ученый совет, на котором была подписана резолюция о внедрении бактериофагов как нового класса пищевых добавок.
— У бактериофагов могут быть хорошие перспективы,— говорит биолог Андрей Алешкин из лаборатории биологии бифидобактерий Московского НИИ эпидемиологии и микробиологии (МНИИЭМ) им. Г.Н. Габричевского.— Например, их можно использовать и для борьбы со стойкими внутрибольничными инфекциями. Золотистый стафилококк — это большая проблема, в том числе и родильных домов. Можно обкормить рожениц антибиотиками или бесконечно закрываться на мойку, а можно обработать поверхности и инструментарий аэрозольным фагом, даже не нарушая режима учреждения. Роспотребнадзор делает так называемые контрольные смывы на предприятиях пищевой отрасли, в детских учреждениях, больницах, поэтому спектр бактерий, живущих там, известен. И к нему можно подобрать действенный бактериофаг.
Можно обкормить рожениц антибиотиками или бесконечно закрываться на мойку, а можно обработать поверхности и инструментарий аэрозольным фагом, даже не нарушая режима учреждения. Роспотребнадзор делает так называемые контрольные смывы на предприятиях пищевой отрасли, в детских учреждениях, больницах, поэтому спектр бактерий, живущих там, известен. И к нему можно подобрать действенный бактериофаг.
Враг моего врага
Священные воды Ганга еще в 1896 году заинтересовали ученых своим антибактериальным действием. Британский химик Эрнест Ханкин сумел получить из образцов речной воды агент, который вызывал разрушение микробов. В 1917 году французский бактериолог Феликс Д’Эрелль из Института Пастера назвал этих «суперагентов» бактериофагами — пожирателями микробов.
Сейчас уже известно, что бактериофаг — это вирус, состоящий из ДНК и белковой оболочки. Как и все вирусы, он размножается только в живых клетках хозяина. При этом, в отличие от антибиотиков, бактериофаги не нарушают нормальную микрофлору организма. Они способны присоединяться только к единственному типу микробов, а остальным не причиняют вреда. Проникнув внутрь болезнетворной клетки, ДНК фага начинает воспроизводство себе подобных. Размножившись, бактериофаги разрывают оболочку клетки-хозяина и атакуют другие микробы.
Они способны присоединяться только к единственному типу микробов, а остальным не причиняют вреда. Проникнув внутрь болезнетворной клетки, ДНК фага начинает воспроизводство себе подобных. Размножившись, бактериофаги разрывают оболочку клетки-хозяина и атакуют другие микробы.
Первым делом в 20-х годах прошлого века стафилококковым фагом начали лечить кожные заболевания. А Феликс Д’Эрелль на посту инспектора службы здравоохранения Лиги Наций использовал фаговую терапию в борьбе со вспышками инфекционных заболеваний на Среднем Востоке и в Индии.
В то же время грузинский последователь Д’Эрелля Георгий Элиава при поддержке наркома советской тяжелой промышленности Серго Орджоникидзе основал в Тбилиси Институт исследования бактериофагов. Институт имел большую научную и производственную базу со своими клиниками, он стал всемирным центром фаговой терапии инфекционных заболеваний. В 1937-м по приказу Берии Георгий Элиава был расстрелян как враг народа, но его институт продолжал работать вплоть до распада СССР.
— До 1991 года научными центрами разработки бактериофагов были Тбилиси и Уфа,— напоминает «Огоньку» Андрей Алешкин из МНИИЭМ им. Г.Н. Габричевского.— После распада Союза в России препараты производили независимо в нескольких городах, пока все заводы-производители не были переданы гособъединению ФГУП «НПО «Микроген»», ему теперь принадлежит 13 заводов. И если к 2000-му бактериофагов выпускалось ориентировочно на 10 млн долларов в год, то сейчас производство сократилось. А жаль: рыночный спрос на эти препараты значительно больше предложения.
Изначально бактериофаги выпускали в жидком виде. Затем были разработаны таблетки с кислотоустойчивым покрытием, удобные для употребления и транспортировки, а также концентрат, линимент и гель. При этом сейчас в России используют как препараты с одним действующим вирусом, так и комбинированные (от 2 до 8 видов бактериофагов).
— Чаще всего мы используем бактериофаги при кишечной инфекции,— рассказывает педиатр-инфекционист Татьяна Москалева, которая назначает эти препараты больным детям практически ежедневно. — Они хорошо работают, когда известен возбудитель болезни и проверена его чувствительность к фагам. Тогда лекарство действует направленно, сохраняется нормальная флора, а побочные эффекты практически отсутствуют. Претензии у меня разве что к органолептическим свойствам — уж больно они невкусные. Вот сальмонеллезный бактериофаг в таблетках — приемлемый. А жидкие формы имеют очень неприятный вкус и запах, и это создает сложности при лечении маленьких детей.
— Они хорошо работают, когда известен возбудитель болезни и проверена его чувствительность к фагам. Тогда лекарство действует направленно, сохраняется нормальная флора, а побочные эффекты практически отсутствуют. Претензии у меня разве что к органолептическим свойствам — уж больно они невкусные. Вот сальмонеллезный бактериофаг в таблетках — приемлемый. А жидкие формы имеют очень неприятный вкус и запах, и это создает сложности при лечении маленьких детей.
Врачи признают, что при вспышках таких инфекций, как пневмония, они скорее будут назначать пациентам интенсивные антибиотики. Но в ряде случаев антибиотики бессильны, а помогают именно фаги. Например, в период подъема заболеваемости дифтерией в 1990-х годах в России многие не болели сами, но являлись носителями инфекции — лежали в больнице месяцами без какого-либо лечебного эффекта. Антибиотики не срабатывали, и на помощь пришли бактериофаги. Та же ситуация сейчас с сальмонеллезом: те люди, которые сами не болеют, но переносят бактерии, чаще излечиваются не антибиотиками, а фагами.
Вместо или вместе
Когда в лаборатории консультативно-диагностического центра при МНИИЭМ им. Г.Н. Габричевского пациенту делают анализ микрофлоры и находят какой-нибудь микроб, то обязательно проводят пробы на чувствительность этого микроба и к спектру антибиотиков, и к спектру бактериофагов. Бактериофагом стоит лечиться только при высокой чувствительности к нему бактерий, но даже в этом случае врачи не могут гарантировать лечебного эффекта.
— В организме не так все просто, как в чашке Петри из лаборатории,— говорит Татьяна Москалева.— Микроб может быть покрыт пленкой, и бактериофаг не сумеет к нему присоединиться. Или может иметь место симбиоз нескольких микробов, тогда реакция тоже будет другой.
За долгую историю фаговой терапии российские исследовательские центры собрали богатую базу (ею сейчас очень интересуются западные микробиологи). Крупнейший музей микроорганизмов, в том числе и фагов, хранится в Научном центре экспертизы средств медицинского применения Минздравсоцразвития России. Здесь поддерживаются в жизнеспособном состоянии тысячи штаммов болезнетворных бактерий, к ним же были выведены вирусы, которые до сих пор используются для производства препаратов бактериофагов.
Здесь поддерживаются в жизнеспособном состоянии тысячи штаммов болезнетворных бактерий, к ним же были выведены вирусы, которые до сих пор используются для производства препаратов бактериофагов.
— В этом может быть проблема,— говорит Андрей Алешкин.— Фаги могут разрушать только тот микроб, против которого они выведены. Фаги, которые производят в России с 1995 года, адресованы тем штаммам бактерий, которые хранятся в музее. А как насчет современных микробов?
Чтобы решить этот вопрос, МНИИЭМ наладил в 1998 году сотрудничество с предприятием «Биофаг» в Уфе. Механизм был такой: НИИ проверял болезнетворные бактерии, входящие в популяцию в текущем сезоне, на чувствительность к препаратам, разработанным на «Биофаге». Но после слияния всех заводов по производству фагов в одно предприятие эта связь была потеряна.
В принципе же селекция бактериофагов значительно проще и дешевле, чем производство новых антибиотиков. Каждый тип бактерий имеет свои фаги, и они могут быть выделены в любом месте существования этих бактерий: из сточных вод, фекалий или почвы.
Есть, впрочем, и доводы против фаговой терапии, один звучит так: фаги, встраиваясь в геном бактериальной клетки, могут переносить генетический материал от одной бактерии к другой, а это ведет к развитию защитного механизма у микробов.
— Лабораторные опыты показывают, что такое возможно, но на практике в нашей стране это не подтверждалось,— объясняет Андрей Алешкин.— Иначе после применения бактериофага появилась бы суперинфекция с нетипичной для данного вида возбудителя симптоматикой. Чтобы исключить это, нужно использовать фаги только после определения их чувствительности к выделенной от пациента микрофлоре. Нужно очищать препараты от умеренных фагов, которые, встроившись в бактерию, не разрушают ее, а какое-то время сосуществуют с ней. Необходимо продолжать исследования и обмениваться данными с производителями.
Ученые ведут работы над генно-инженерными препаратами — планируется использовать только ДНК фага без оболочки, чтобы максимально увеличить эффективность. Создают комбинированные препараты — бактериофаги сочетают с бактериоцинами (ферментами бактерий), с интерфероном. А еще фаги применяют в тандеме с антибиотиками, чтобы многократно увеличить шансы победы над болезнью.
Создают комбинированные препараты — бактериофаги сочетают с бактериоцинами (ферментами бактерий), с интерфероном. А еще фаги применяют в тандеме с антибиотиками, чтобы многократно увеличить шансы победы над болезнью.
— Ставить крест на антибиотиках все-таки еще рано,— разъясняет профессор Михаил Фаворов.— Они будут становиться все более дорогими и менее доступными, но решающую роль в борьбе с бактериями пока что играть продолжат, возможно, при участии вспомогательных средств, вроде бактериофагов. А для разработки научно обоснованной стратегии использования фагов в медицине было бы важно проведение всеобъемлющего стандартизированного клинического испытания фагосодержащих медицинских препаратов. Пока результаты таких испытаний не опубликованы ни у нас, ни за рубежом.
Исторический обзор опыта применения бактериофагов в России
Информация только для специалистов в сфере медицины, фармации и здравоохранения!
А.В. АЛЕШКИН, д. б.н., руководитель Лаборатории клинической микробиологии и биотехнологии бактериофагов, Московский научно-исследовательский институт эпидемиологии и микробиологии им. Г.Н. Габричевского
б.н., руководитель Лаборатории клинической микробиологии и биотехнологии бактериофагов, Московский научно-исследовательский институт эпидемиологии и микробиологии им. Г.Н. Габричевского
Уже более 80 лет в бывшем Советском Союзе сначала на базе Тбилисского НИИ вакцин и сывороток им. Г. Элиавы, а позднее в Российской Федерации на филиалах ФГУП «Микроген» (Уфимском, Пермском и Нижегородском) производится свыше десятка наименований лекарственных средств, на основе как отдельных видов бактериофагов, так и их комбинаций для лечения и профилактики острых кишечных инфекций и декомпенсированных форм дисбактериоза, а также против возбудителей ряда гнойно-воспалительных заболеваний, включая заболевания респираторной системы.
В настоящее время доступны жидкие и таблетированные формы лечебных моновалентных препаратов стафилококкового, стрептококкового, коли, клебсиеллезного, сальмонеллезного, дизентерийного, брюшнотифозного, протейного и синегнойного бактериофагов и комбинированные рецептуры, содержащие несколько видов фагов: колипротейный, пиобактериофаг (против стафило-, стрептококков, клебсиелл, протеев, синегнойной и кишечной палочек) и интести-фаг (против шигелл, сальмонелл, стафило-, энтерококков, протея, кишечной и синегнойной палочек) (рис. 1). Лекарственные препараты представляют собой стерильные фильтраты бактериальных фаголизатов, их назначают внутрь и местно: орошение ран и слизистых оболочек, введение в полость матки, мочевого пузыря, среднего уха, придаточных пазух носа, конъюнктиву глаза, а также в дренированные полости – брюшную, плевральную, в полости абсцессов после удаления гноя. Они широко используются с лечебной, в т. ч. в хирургической практике, особенно при лекарственно-устойчивых формах инфекций, и профилактической целью в регионах, эндемичных по инфекционным заболеваниям, а также в организованных коллективах, таких как ясли, детские сады, школы и армейские казармы, где могут происходить быстрые вспышки инфекций. В современных отечественных и зарубежных литературных источниках достаточно подробно освещены клинические исследования, направленные на профилактику и лечение ОКИ бактериофаговыми препаратами [1—4]. В то же время в тени остались многочисленные клинические исследования, посвященные применению фагов в профилактике и лечении гнойно-септических осложнений в хирургии, в т.
1). Лекарственные препараты представляют собой стерильные фильтраты бактериальных фаголизатов, их назначают внутрь и местно: орошение ран и слизистых оболочек, введение в полость матки, мочевого пузыря, среднего уха, придаточных пазух носа, конъюнктиву глаза, а также в дренированные полости – брюшную, плевральную, в полости абсцессов после удаления гноя. Они широко используются с лечебной, в т. ч. в хирургической практике, особенно при лекарственно-устойчивых формах инфекций, и профилактической целью в регионах, эндемичных по инфекционным заболеваниям, а также в организованных коллективах, таких как ясли, детские сады, школы и армейские казармы, где могут происходить быстрые вспышки инфекций. В современных отечественных и зарубежных литературных источниках достаточно подробно освещены клинические исследования, направленные на профилактику и лечение ОКИ бактериофаговыми препаратами [1—4]. В то же время в тени остались многочисленные клинические исследования, посвященные применению фагов в профилактике и лечении гнойно-септических осложнений в хирургии, в т. ч. для купирования часто возникающих патологических состояний органов дыхания.
ч. для купирования часто возникающих патологических состояний органов дыхания.
Впервые в Советском Союзе Г.А. Кокиным в статье «Применение бактериофагов в хирургии» были описаны 5 клинических случаев внутриполостного применения бактериофагов при открытых ранениях грудной полости с повреждением легкого, кровоизлиянием в плевру и открытым пневмотораксом, а также 6 случаев эмпиемы плевры, при которых также использовали промывание стафилококковым бактериофагом плевральной полости [5]. Это и ряд других исследований, проведенных врачами больницы им. А.А. Остроумова (Москва), послужили основой для разработанной в 1942 г. «Инструкции по применению бактериофага при лечении ран», включавшей орошение поверхности раны, внутриполостное, подкожное, внутримышечное и внутривенное применение фагов — последнее было особенно необходимо в случаях терапии системной инфекции, развивавшейся как последствие хирургических вмешательств и боевых ранений [6].
Не менее выдающимся исследователем, применявшим бактериофаги при гнойных и некротических состояниях, по праву признается академик Н. Н. Жуков-Вережников. Он считал весьма целесообразным использование в хирургической клинике монофагов, адаптированных к штаммам возбудителей, выделенных от конкретных больных и примененных для их же лечения. Систематические клинико-микробиологические исследования применения бактериофагов проводились им с целью лечения различных форм хирургических гнойных инфекций (абсцессов, флегмон, маститов, карбункулов и т. д.), возбудителями которых в большинстве случаев были антибиотикорезистентные штаммы стафилококка, синегнойной палочки и других патогенных бактерий. В результате проводимой под его руководством фаготерапии гладкое заживление ран у пациентов данного профиля после наложения ранних вторичных швов наступало в кратчайшие сроки [7].
Н. Жуков-Вережников. Он считал весьма целесообразным использование в хирургической клинике монофагов, адаптированных к штаммам возбудителей, выделенных от конкретных больных и примененных для их же лечения. Систематические клинико-микробиологические исследования применения бактериофагов проводились им с целью лечения различных форм хирургических гнойных инфекций (абсцессов, флегмон, маститов, карбункулов и т. д.), возбудителями которых в большинстве случаев были антибиотикорезистентные штаммы стафилококка, синегнойной палочки и других патогенных бактерий. В результате проводимой под его руководством фаготерапии гладкое заживление ран у пациентов данного профиля после наложения ранних вторичных швов наступало в кратчайшие сроки [7].
Позднее в сравнительном исследовании, проведенном под руководством Г.Д. Иоселиани, изучалась эффективность местного применения бактериофагов для профилактики пострезекционных острых эмпием плевры при хронических нагноительных заболеваниях легких. В рамках данных клинических испытаний 45 пациентам назначали стафилококковый или поливалентный бактериофаг, а 107 больным фаготерапия до и после операции не проводилась. Представителям обеих групп в процессе предоперационной подготовки осуществляли санацию трахеобронхиального дерева путем ингаляции, трансназальной катетеризации или бронхоскопии. При катетеризации пациентам опытной группы ежедневно вводили 5—10 мл бактериофагового препарата и антибиотики с учетом предварительно оцененной чувствительности к ним патогенной микрофлоры. Такой же тактики придерживались при проведении бронхоскопии. При наличии абсцессов и вскрывшихся в плевральную полость гнойников прибегали к пункции и дренированию очага инфекции антисептиками с последующим введением туда 10—30 мл бактериофагов с антибиотиками. В послеоперационном периоде аспирацию экссудата и расправление легкого осуществляли пункциями с последующим введением 10—50 мл бактериофага с антибиотиками. Результаты оперативного лечения больных, получавших и не получавших фаготерапию, представлены в таблице 1. Применение бактериофагов вместе с антибиотиками путем ингаляции, катетеризации, бронхоскопии и внутриплеврально по 5—50 мл ежедневно не вызывало аллергических и пирогенных реакций.
Представителям обеих групп в процессе предоперационной подготовки осуществляли санацию трахеобронхиального дерева путем ингаляции, трансназальной катетеризации или бронхоскопии. При катетеризации пациентам опытной группы ежедневно вводили 5—10 мл бактериофагового препарата и антибиотики с учетом предварительно оцененной чувствительности к ним патогенной микрофлоры. Такой же тактики придерживались при проведении бронхоскопии. При наличии абсцессов и вскрывшихся в плевральную полость гнойников прибегали к пункции и дренированию очага инфекции антисептиками с последующим введением туда 10—30 мл бактериофагов с антибиотиками. В послеоперационном периоде аспирацию экссудата и расправление легкого осуществляли пункциями с последующим введением 10—50 мл бактериофага с антибиотиками. Результаты оперативного лечения больных, получавших и не получавших фаготерапию, представлены в таблице 1. Применение бактериофагов вместе с антибиотиками путем ингаляции, катетеризации, бронхоскопии и внутриплеврально по 5—50 мл ежедневно не вызывало аллергических и пирогенных реакций. По мнению авторов, местная фаготерапия значительно снижала возможность возникновения острой послеоперационной эмпиемы легких (с 18,7 до 6,7%) и хорошо переносилась пациентами [8].
По мнению авторов, местная фаготерапия значительно снижала возможность возникновения острой послеоперационной эмпиемы легких (с 18,7 до 6,7%) и хорошо переносилась пациентами [8].
|
Таблица 1. Результаты хирургического лечения больных [8] |
||
| Показатель | Пациенты, получавшие бактериофаг (%) | Пациенты, не получавшие бактериофаг |
| Гнойные пострезекционные плевральные осложнения |
5 (11,11) |
23 (21,49) |
|
Отсутствие плевральных осложнений |
40 (88,88) | 84 (78,50) |
| Всего |
45 |
107 |
В задачи другой группы исследователей, работавшей, как и предыдущие коллеги, в НИИ экспериментальной и клинической хирургии им. К.Д. Эристави Минздрава Грузинской ССР, входило не только изучение эффективности стафилококкового бактериофага для лечения, предоперационной подготовки и профилактики послеоперационных осложнений при нагноительных заболеваниях легких и плевры, но и создание методики его применения, определение показаний и противопоказаний к его использованию. Всего под наблюдением у данных клиницистов находилось 340 пациентов с неспецифическими гнойными заболеваниями легких и плевры, у 223 (1-я группа) из которых в комплекс лечения был включен бактериофаг, а 117 (2-я группа) получали только антибиотики. Стафилококковый бактериофаг применяли как отдельно, так и в комбинации с антибиотиками. Пути введения стафилококкового бактериофага подбирали индивидуально. Бактериофаг назначали как местно — в виде эндобронхиальных санаций (ингаляции, катетеризация трахеи, бронхоскопия) непосредственно в гнойный очаг в легком или плевральной полости (трансторакальная пункция и катетеризация гнойных очагов), так и парентерально — внутримышечно, внутривенно, путем длительной перфузии в бронхиальную или легочную артерию.
К.Д. Эристави Минздрава Грузинской ССР, входило не только изучение эффективности стафилококкового бактериофага для лечения, предоперационной подготовки и профилактики послеоперационных осложнений при нагноительных заболеваниях легких и плевры, но и создание методики его применения, определение показаний и противопоказаний к его использованию. Всего под наблюдением у данных клиницистов находилось 340 пациентов с неспецифическими гнойными заболеваниями легких и плевры, у 223 (1-я группа) из которых в комплекс лечения был включен бактериофаг, а 117 (2-я группа) получали только антибиотики. Стафилококковый бактериофаг применяли как отдельно, так и в комбинации с антибиотиками. Пути введения стафилококкового бактериофага подбирали индивидуально. Бактериофаг назначали как местно — в виде эндобронхиальных санаций (ингаляции, катетеризация трахеи, бронхоскопия) непосредственно в гнойный очаг в легком или плевральной полости (трансторакальная пункция и катетеризация гнойных очагов), так и парентерально — внутримышечно, внутривенно, путем длительной перфузии в бронхиальную или легочную артерию. Количество бактериофага лимитировалось местом введения: для эндобронхиальных санаций — 10—30 мл, непосредственно в гнойный очаг в паренхиме легкого — 10—50 мл, в полость эмпиемы — 20—100 мл, парентерально — 0,5—1,0 мл/кг. Длительность фаготерапии зависела от клинического и рентгенологического эффекта и составляла 2—4 нед. В таблице 2 приведены результаты лечения больных 1-й и 2-й групп. Подводя итоги многолетнего исследования, авторы на основании клинических и лабораторных данных не только подтверждали высокие лечебные свойства стафилококковых бактериофагов в комплексе с антибиотиками, выражавшиеся в т. ч. и в положительных статистически достоверных иммунологических сдвигах, но и отмечали отсутствие аллергических и пирогенных реакций даже при интравенозных инфузиях * фагового препарата [9].
Количество бактериофага лимитировалось местом введения: для эндобронхиальных санаций — 10—30 мл, непосредственно в гнойный очаг в паренхиме легкого — 10—50 мл, в полость эмпиемы — 20—100 мл, парентерально — 0,5—1,0 мл/кг. Длительность фаготерапии зависела от клинического и рентгенологического эффекта и составляла 2—4 нед. В таблице 2 приведены результаты лечения больных 1-й и 2-й групп. Подводя итоги многолетнего исследования, авторы на основании клинических и лабораторных данных не только подтверждали высокие лечебные свойства стафилококковых бактериофагов в комплексе с антибиотиками, выражавшиеся в т. ч. и в положительных статистически достоверных иммунологических сдвигах, но и отмечали отсутствие аллергических и пирогенных реакций даже при интравенозных инфузиях * фагового препарата [9].
* Стафилококковый бактериофаг, культивированный на полусинтетической питательной среде, свободный от белкового расщепления, не содержащий стафилококковых токсинов и пирогенных веществ, пригодный для внутривенного применения [9].![]()
|
Таблица 2. Результаты лечения больных стафилококковым бактериофагом с антибиотиком и только антибиотиками [9] |
||||||
|
Заболевание |
Стойкая ремиссия или выздоровление |
Относительная ремиссия |
Обострение или смерть | |||
|
А |
Б |
А | Б | А | Б | |
| Острый абсцесс легкого | 23 |
8 |
0 |
2 |
1 |
7 |
| Хронический абсцесс легкого | 41 |
23 |
3 |
13 |
7 |
4 |
| Хроническая пневмония |
39 |
11 |
16 |
8 |
1 |
1 |
| Хронический гнойный бронхит |
24 |
9 |
5 |
4 |
0 |
0 |
|
Бронхоэктатическая болезнь |
23 |
9 | 4 | 4 |
0 |
0 |
|
Нагноившаяся киста легкого |
11 | 9 | 0 | 0 | 0 | 0 |
|
Эмпиема плевры |
24 | 6 | 0 | 3 | 1 | 2 |
| Всего | 185 | 75 | 28 | 34 | 10 | 14 |
Примечание. А — больные 1-й группы; Б — больные 2-й группы. А — больные 1-й группы; Б — больные 2-й группы.
|
||||||
В педиатрической практике бактериофаги активно применялись для лечения бактериальной пневмонии. Пятилетний опыт ингаляционного использования бактериофагов в НИИ педиатрии Грузинской ССР у 189 детей первого года жизни показал существенное сокращение срока болезни, сопровождавшееся как более редким выделением патогенных микроорганизмов из носоглотки, так и снижением их вирулентности. Для лечения применяли поливалентный бактериофаг, состоящий из 55% стафилофага, 30% стрептофага и 15% колифага, изготовленный в НИИ вакцин и сывороток Министерства здравоохранения Грузинской ССР. Исходная чувствительность к фаговому препарату микробов, выделенных из носоглотки пациентов, достигала 97%. Пациентам, страдавшим токсической (153 ребенка) и локализованной (36 детей) формой пневмонии, проводили 10 сеансов ингаляционной фаготерапии по 5—10 мин каждый. Учитывая, что бактериофаговый препарат не вызывал побочных явлений, авторы рекомендовали его включение в арсенал препаратов для лечения бактериальной пневмонии, особенно стафилококковой этиологии [10].
Под руководством заведующего кафедрой терапии Центрального института усовершенствования врачей Е.В. Ермакова на небольшой группе пациентов (34 человека) было проведено исследование эффективности бактериофагов в комплексной терапии острой абсцедирующей пневмонии и пневмонии затяжного течения с сопутствующим хроническим гнойным обструктивным бронхитом (ХОБ). Полученные клиницистами данные свидетельствовали о значительной лечебной эффективности фаг-препаратов у больных с давностью ХОБ не более 5 лет. Санационная бронхоскопия с применением фаг-препаратов Горьковского и Тбилисского НИИ вакцин и сывороток вызывала у этих пациентов выраженную реакцию Яриша — Герксгеймера, после которой наступало резкое улучшение состояния, связанное с нормализацией бронхиального дренажа, снижением интоксикации, значительным повышением содержания сывороточных иммуноглобулинов IgA и IgG, разрешением эндобронхита и воспалительного процесса в легочной паренхиме. Менее значительный эффект фаг-препаратов авторы отмечали у больных с более длительным хроническим гнойным обструктивным бронхитом [11].
Ведущие онкологические научно-исследовательские институты СССР также активно использовали бактериофаги для профилактики и лечения послеоперационных гнойно-воспалительных осложнений. Так, в клиническом исследовании Т.Р. Пономарева и соавт. лечебные бактериофаги получали 77 пациентов с инфекционными осложнениями, в т. ч. у 6 больных очаг находился в легких и плевральной полости. Поливалентные препараты бактериофагов Горьковского НИИ эпидемиологии и микробиологии вводили в полость после эвакуации гнойного содержимого в течение 1—14 дней. В случаях когда у онкологических больных выделяли монокультуры золотистого стафилококка, включение в комплексную терапию фагов давало хороший клинический эффект, связанный с высокой (97%) чувствительностью S. aureus in vitro к стафилококковому бактериофагу [12].
Врачи-исследователи МНИОИ им. П.А. Герцена с целью объективной оценки эффективности фаготерапии провели сравнительный клинико-лабораторный анализ у 131 онкологического больного, из которых 65 пациентов (1-я группа) получали в плане этиотропного лечения гнойных осложнений бактериофаги, а 66 пациентов — 2-я контрольная группа — только антибиотики. У половины пациентов из обеих групп в опухолевый процесс были вовлечены органы дыхания, однако локализация гнойно-воспалительного очага могла быть другой. Сравнительный анализ показал, что купирование гнойного процесса — эмпиемы плевры при лечении больных раком легкого с использованием фагов, которые вводили внутриплеврально по 50 мл ежедневно в течение 5—7 дней, наступало в 66,7% случаях против 43,8% в контрольной группе. Эффективность фаготерапии в целом по группам с различной локализацией гнойно-воспалительного процесса оказалась наиболее высокой при лечении раневой инфекции и менее успешной при лечении остеомиелита ребер, медиастинита и эмпиемы плевры со свищем. Кроме того, авторы резюмировали, что при моноинфекции было целесообразно использование одного фага; при смешанной инфекции лучшие результаты давала одновременно проводимая фаго- и антибиотикотерапия. Наибольшей терапевтической активностью (86,7%) обладал синегнойный фаг, меньшей (74,4 %) — стафилококковый при лечении одноименной моноинфекции.
У половины пациентов из обеих групп в опухолевый процесс были вовлечены органы дыхания, однако локализация гнойно-воспалительного очага могла быть другой. Сравнительный анализ показал, что купирование гнойного процесса — эмпиемы плевры при лечении больных раком легкого с использованием фагов, которые вводили внутриплеврально по 50 мл ежедневно в течение 5—7 дней, наступало в 66,7% случаях против 43,8% в контрольной группе. Эффективность фаготерапии в целом по группам с различной локализацией гнойно-воспалительного процесса оказалась наиболее высокой при лечении раневой инфекции и менее успешной при лечении остеомиелита ребер, медиастинита и эмпиемы плевры со свищем. Кроме того, авторы резюмировали, что при моноинфекции было целесообразно использование одного фага; при смешанной инфекции лучшие результаты давала одновременно проводимая фаго- и антибиотикотерапия. Наибольшей терапевтической активностью (86,7%) обладал синегнойный фаг, меньшей (74,4 %) — стафилококковый при лечении одноименной моноинфекции. Пиополивалентный бактериофаг, примененный при смешанной инфекции, дал положительный результат у 57,1% больных [13].
Пиополивалентный бактериофаг, примененный при смешанной инфекции, дал положительный результат у 57,1% больных [13].
Несмотря на скептическое отношение в этот период к фаготерапии западных ученых, нам удалось обнаружить сделанные ими описания ряда случаев клинического использования бактериофагов при инфекционно-воспалительных заболеваниях органов дыхания. Так, M. Cevey и Z. Schwiez в 1958 г. применили стафилококковые бактериофагии у пациента с эмпиемой плевры, вызванной гомологичными антибиотикорезистентными штаммами на фоне активной формы туберкулеза. Фаговый препарат вводили внутриплеврально в течение 15 дней, постепенно увеличивая его объем. Улучшение состояние пациента было медленным, но стабильным, что позволило сделать авторам следующий вывод: в случаях гнойной инфекции, вызванной бактериальным штаммом, устойчивым к антибиотикам, стоит немедленно рассмотреть возможность комбинированного лечения антибиотиками и бактериофагами [14].
Годом позже P. Delacoste описал успешное лечение пациентов, страдавших упорным кашлем, с помощью ингаляционной фаготерапией. В 15 из 19 клинических случаях ему удалось добиться полного выздоровления, под которым он понимал купирование кашля и избавление больных от мокроты гнойного характера [15].
В 15 из 19 клинических случаях ему удалось добиться полного выздоровления, под которым он понимал купирование кашля и избавление больных от мокроты гнойного характера [15].
В 1962 г. J. Hoeflmayr добился излечения бронхита в 90% клинических случаев, также используя ингалятор (небулайзер). Лечение проводилось ежедневно в течение 11 дней сеансами по 10—15 мин аэрозолем из бактериофагов, разведенных 1:5-ным физиологическим раствором. Автор не наблюдал побочных эффектов от фаготерапии при таком режиме использования [16].
Нельзя не отметить клинические испытания польских исследователей, внесших неоценимый вклад в развитие фаготерапии вообще и лечение бактериофагами гнойно-воспалительных заболеваний органов дыхания в частности. S. Slopek и соавт. в 1987 г. опубликовали обзор многочисленных историй болезни, предоставленных польскими врачами, работающими совместно с Институтом иммунологии и экспериментальной терапии имени Гиршфельда (Hirszfeld Institute of Immunology and Experimental Therapy) (г. Вроцлав) в направлении оценки эффективности фаготерапии при гнойных бактериальных инфекциях. В исследования были включены такие патологические состояния, как абсцесс легких, бронхит, пневмония и др. В качестве этиологического фактора выступали следующие виды бактерий: Escherichia, Klebsiella, Proteus, Pseudomonas, Staphylococcus и Streptococcus. Штаммы бактериофагов подбирались индивидуально для каждого пациента на основании чувствительности высеянных из очага инфекции бактерий. На графике представлены данные, отражающие эффективность примененной фаготерапии (рис. 2). Процент успешного лечения этого контингента больных составил более 80% случаев, для большинства из которых предшествующее лечение антибиотиками было неэффективным. Бактериофаги вводились пациентам перорально и местно, в т. ч. посредством ингаляций. Несмотря на то что продолжительность фаготерапии обычно составляла несколько недель, авторы утверждали: «Бактериофаги безопасны, побочные эффекты довольно редки и не представляют опасности для пациента…» [17].
Вроцлав) в направлении оценки эффективности фаготерапии при гнойных бактериальных инфекциях. В исследования были включены такие патологические состояния, как абсцесс легких, бронхит, пневмония и др. В качестве этиологического фактора выступали следующие виды бактерий: Escherichia, Klebsiella, Proteus, Pseudomonas, Staphylococcus и Streptococcus. Штаммы бактериофагов подбирались индивидуально для каждого пациента на основании чувствительности высеянных из очага инфекции бактерий. На графике представлены данные, отражающие эффективность примененной фаготерапии (рис. 2). Процент успешного лечения этого контингента больных составил более 80% случаев, для большинства из которых предшествующее лечение антибиотиками было неэффективным. Бактериофаги вводились пациентам перорально и местно, в т. ч. посредством ингаляций. Несмотря на то что продолжительность фаготерапии обычно составляла несколько недель, авторы утверждали: «Бактериофаги безопасны, побочные эффекты довольно редки и не представляют опасности для пациента…» [17].
Столетняя история фаготерапии бактериальных инфекций такова, что основные клинически испытания были проведены задолго до разработки надежной экспериментальной модели инфекционной патологии на лабораторных животных и внедрения в медицинскую практику для вновь регистрируемых лекарственных средств высоких стандартов двойного слепого плацебо-контролируемого исследование. Однако, по словам известного американского исследователя S.T. Abedon, невозможно игнорировать существовавший ранее обширный клинический опыт использования бактериофагов в качестве антибактериальных агентов в пульмонологической практике, даже несмотря на относительное отсутствие формального одобрения на сегодняшний день использования фаготерапии в клинической практике западной медицины [18]. Развитие новых представлений в конце ХХ — начале ХХI в. как о молекулярной биологии, так и об экологических взаимоотношениях бактериофагов и их хозяев, а также все более широкое распространение в биосфере антибиотикорезистентных микроорганизмов актуализировали своего рода второе рождение вирусов бактерий. Существенно возросшее количество персистирующих антибиотикорезистентных патогенных и условно-патогенных штаммов бактерий, утяжеляющих клиническое течение патологических состояний и существенно ухудшающих показатели инфекционной заболеваемости во многих странах мира, связано как с бесконтрольным использованием антибиотиков при самолечении и профилактике нозокомиальных инфекций в стационарах, так и с массовым применением консервантов и бактерицидных препаратов в пищевой промышленности и сельском хозяйстве. Улучшение качества медицинской помощи инфекционным больным подразумевает поиск новых и возрождение известных ранее форм и методов лечения гнойно-воспалительных заболеваний органов дыхания. Научно-производственное объединение «Микроген», единственное на сегодняшний день в мире фармацевтическое предприятие, выпускающее лекарственные средства на основе фагов, активно внедряет в практику российского здравоохранения новые бактериофаговые препараты и инновационные технологии их клинического применения.
Существенно возросшее количество персистирующих антибиотикорезистентных патогенных и условно-патогенных штаммов бактерий, утяжеляющих клиническое течение патологических состояний и существенно ухудшающих показатели инфекционной заболеваемости во многих странах мира, связано как с бесконтрольным использованием антибиотиков при самолечении и профилактике нозокомиальных инфекций в стационарах, так и с массовым применением консервантов и бактерицидных препаратов в пищевой промышленности и сельском хозяйстве. Улучшение качества медицинской помощи инфекционным больным подразумевает поиск новых и возрождение известных ранее форм и методов лечения гнойно-воспалительных заболеваний органов дыхания. Научно-производственное объединение «Микроген», единственное на сегодняшний день в мире фармацевтическое предприятие, выпускающее лекарственные средства на основе фагов, активно внедряет в практику российского здравоохранения новые бактериофаговые препараты и инновационные технологии их клинического применения.
Литература
1. Sulakvelidze A, Alavidze Z and Morris JG Jr. Bacteriophage Therapy Antimicrob. Agents Chemother, 2001, 45, 649-659.
2. Chanishvili N. A Literature Review of the Practical Application of Bacteriophage Research. Nova Science Publishers, Hauppauge, New York, 2012, 283.
3. Солодовников Ю.П., Павлова Л.И., Емельянов П.И. и др. Профилактическое применение сухого поливалентного бактериофага с пектином в дошкольных учреждениях. ЖМЭИ, 1970,5, 131-137.
4. Aleshkin AV, Volozhantsev NV, Svetoch EA, Afanas’ev SS. Bacteriophages as Probiotics and Decontaminating Agents for Food Products, in book: Bacteriophages: Biology, Applications and Role in Health and Disease, Eds. Denton C. and Crosby R.J., N.Y.: NOVA Biomedical Publications, 93-110.
5. Кокин Г.А. Применение бактериофагов в хирургии. Советская медицина, 1941, 9, 15-18.
6. Покровская М.П., Каганова Л.С., Морозенко М.А. и др. Лечение ран бактриофагом.
 М.: Медгиз, 1942, 60.
М.: Медгиз, 1942, 60.7. Жуков-Вережников Н.Н., Перемитина Л.Д., Берило Э.А. и др. Изучение терапевтического эффекта препаратов бактериофага в комплексном лечении гнойных хирургических заболеваний. Советская медицина, 1978, 12, 64-66.
8. Иоселиани Г.Д., Меладзе Г.Д., Чхетия Н.Ш. Применение бактериофага с антибиотиками для профилактики острых пострезекционных эмпием плевры при хронических нагноительных заболеваниях легких. Грудная хирургия, 1980, 6, 63-67.
9. Меладзе Г.Д., Медуке М.Г., Чхетия Н.Ш. и др. Применение стафилококкового бактериофага при лечении неспецифических заболеваний легких и плевры. Грудная хирургия, 1982..1. 53-56.
10. Гарсеванишвили Т.И. Некоторые методические аспекты применения ингаляции поливалентного бактериофага при лечении пневмонии раннего детского возраста. Ж Педиатрия им. Сперанского, 1974, 53, 65-66.
11. Ермаков Е.В., Новожилов В.Г., Кириллова В.А. и др. Об эффективности бактериофагов в лечении неспецифических заболеваний легких.
 Сов. мед. 1984. 2. 37-39.
Сов. мед. 1984. 2. 37-39.12. Пономарева Т.Р., Смолянская А.З., Соколова Е.Н. и др. Бактериофаги в лечении послеоперационных осложнений у онкологических больных. Сов. Мед. 1985. 4. 89-92.
13. Кочеткова В.А., Мамонтов А.С., Московцева P.JI. и др. Фаготерапия послеоперационных гнойных осложнений у онкологических больных. Сов. мед. 1989. 6. 23-26.
14. Cevey M, Schwiez Z. Le bacteriophage dans le traitement des empyemes pleuraux a germes resistants aux antibiotiques [Bacteriophage in the treatment of pleural empyema antibiotic resistant bacteria]. Tuberk (Swiss Tuberculosis Journal or Schw Zt Tbc) 1958; 15: 34-39.
15. Delacoste P. Considerations sur le traitement des affections respiratoires banales au moyen de bacteriophages [Considerations on the treatment of common respiratory diseases by means of bacteriophages]. Rev Med Suisse Romande 1959; 79:552-563; PMID:13815551.
16. Hoeflmayr J. Inhalationstherapie mit Bakteriophagen bei therapieresistenten Infektionen [Inhalation therapy with bacteriophages for treatment-resistant infections].
 In: Nuckel H, ed. Fortschritte der biologischen Aerosol-Forschung in den Jahren 1957–1961 [Advances in Biological Aerosols Research in the Years 1957–1961]. Stuttgart, Germany: 1962: 403-409.
In: Nuckel H, ed. Fortschritte der biologischen Aerosol-Forschung in den Jahren 1957–1961 [Advances in Biological Aerosols Research in the Years 1957–1961]. Stuttgart, Germany: 1962: 403-409.17. Slopek S, Weber-Dąbrowska B, Dąbrowski M, Kucharewicz-Krukowska A. Results of bacteriophage treatment of suppurative bacterial infections in the years 1981-1986. Arch Immunol Ther Exp, 1987, 35:569-583; PMID:3455647.
18. Abedon ST. Phage therapy of pulmonary infections, Bacteriophage, 2015, 5: 1, e1020260.
Источник: Медицинский совет, № 7, 2015
медицинский портал Сибмеда — Sibmeda
ВОЗ считает устойчивость к антибиотикам глобальной угрозой: из-за развития антибиотикорезистентности многие инфекции становятся неизлечимыми и уносят жизни людей. В ряде случаев, когда антибиотики не справляются, помочь могут бактериофаги.
Об особенностях применения фаготерапии порталу Sibmeda рассказала Вера Морозова, старший научный сотрудник ИХБФМ СО РАН, кандидат биологических наук.
– Вера Витальевна, что представляют собой бактериофаги?
– Бактериофаги — это вирусы, поражающие бактерии. Они не размножаются сами по себе, их гены начинают работать только внутри бактерии. У них имеется «голова», в которой содержится наследственная информация, и «хвосты», чтобы прикрепляться к бактериальной клетке. Если бактериофаг узнаёт знакомый рецептор на поверхности бактериальной клетки, то он присоединяется к ней и впрыскивает ДНК внутрь клетки. В результате размножения бактериофагов внутри бактерии, она погибает. Каждый отдельный вид бактериофагов поражает свой вид бактерий. Например, стафилококковый бактериофаг убивает только стафилококки.
– Как действие бактериофагов отличается от антибиотиков? Есть ли преимущества применения бактериофагов, по сравнению с антибиотиками?
– Антибиотики обычно широкого спектра, они действуют на несколько бактерий: стафилококки, стрептококки, кишечную палочку и другие. Бактериофаг очень узкого действия, чтобы им лечить, нужно выделить бактерию и посмотреть, насколько она будет чувствительна к этому фагу.
Тестируя десяток бактериофагов из нашей коллекции, мы выбираем один, который будет действовать.
С одной стороны, это неудобно из-за долгого процесса отбора. С другой стороны – хорошо, потому что вся остальная микрофлора сохраняется.
– Насколько широко в настоящее время бактериофаги используются в медицине?
– Достаточно широко. Но сейчас это применяется как экспериментальное лечение. Например, нам звонят пациенты и просят фаговое лечение, в случаях, когда им не помогают антибиотики. Кроме лечения человеческого организма, фаготерапию применяют для растений и в ветеринарии.
– Могут ли в дальнейшем бактериофаги глобально заменить антибиотики?
– Я думаю, что бактериофаги и антибиотики надо комбинировать, зачастую это даёт очень хороший эффект. Например, когда бактерия резистентна к антибиотикам, мы её инфицируем бактериофагом, она теряет свои патогенные свойства и становится чувствительна к антибиотикам.
– Существуют ли негативные побочные эффекты при лечении бактериофагами?
– Серьёзных побочных эффектов мы не заметили. Наоборот, применение бактериофага в ряде случаев даёт быстрый противовоспалительный эффект и быстро снижает количество бактерий, но иногда мы сталкиваемся с отсутствием нужного эффекта. Вы видите негативные колонии бактериофага в чашке Петри и в лабораторных условиях он хорошо убивает бактерии, а в организме человека или животного – ситуация может оказаться другой. При этом бактериофаг быстро выводится из организма, если в течение двух-трёх часов не находит нужную бактерию.
– Какие есть проблемы при разработке новых бактериофагов? Почему их достаточно мало на рынке?
– В связи со сложностями регулирования фармацевтических препаратов. Например, в некоторых московских клиниках тоже занимаются фаготерапией, но у них такие же проблемы, как и у нас. Лекарственные препараты должны проходить доклинические и клинические испытания, которые стоят очень дорого и занимают длительное время. В случае применения бактериофагов это не очень целесообразно, потому что одному пациенту мы проведём через клинические испытания один бактериофаг, а другому будет нужен другой. Поэтому на наш взгляд необходим другой подход к использованию бактериофагов, как персонализированного метода лечения. Нужно подбирать дозы препаратов, учитывать особенности организма.
В случае применения бактериофагов это не очень целесообразно, потому что одному пациенту мы проведём через клинические испытания один бактериофаг, а другому будет нужен другой. Поэтому на наш взгляд необходим другой подход к использованию бактериофагов, как персонализированного метода лечения. Нужно подбирать дозы препаратов, учитывать особенности организма.
– Над созданием какого бактериофага работает ваша лаборатория?
– Мы занимаемся разработкой терапевтических препаратов бактериофагов. У нас достаточно большая коллекция. Есть стафилококковые бактериофаги, против синегнойной палочки, клебсиеллы, кишечной палочки. Это – основные патогены, которые вызывают большие проблемы.
– Уже есть какие-нибудь результаты от вашего проекта?
– Да, у нас уже есть случаи, когда лечение бактериофагами помогало пациентам. Так, к нам обратилась женщина с хроническим циститом, которую несколько лет лечили антибиотиками, но ей это не помогало. Применив фаготерапию, мы увидели положительный результат. Есть и другие случаи успешного применения бактериофагов. Так мы постепенно набираем свою статистику лечения для того, чтобы расширить использование бактериофагов.
Применив фаготерапию, мы увидели положительный результат. Есть и другие случаи успешного применения бактериофагов. Так мы постепенно набираем свою статистику лечения для того, чтобы расширить использование бактериофагов.
– Какая в настоящее время потребность в этих препаратах?
– Потребность достаточно большая, сейчас существуют разные области применения. Например, фаги используются для лечения младенцев, у которых бывают инфекции. В таких случаях врачи ограничены в назначении антибиотиков, и они применяют бактериофаг, зачастую это помогает. Другая область – это хронические инфекции, которые плохо устраняются антибиотиками. Например, диабетическая стопа. Поскольку появляются проблемы с кровообращением и с нервными окончаниями, в место инфекции трудно проникают антибиотики. Там размножаются микроорганизмы, которые можно устранять бактериофагами. Также, бактериофаги можно применять при пост-операционных инфекциях и инфекциях лор-органов.
– Есть ли уже заинтересованность со стороны фармацевтических компаний?
– Есть препараты компании «Микроген», которые сейчас продаются в аптеке. Но эти препараты необходимо тестировать на чувствительность каждый раз, так как эти препараты изготавливаются в трёх разных городах и у каждого производителя имеется своя коллекция бактериофагов, соответственно, спектр чувствительных бактерий к каждому из препаратов тоже различается. С одной стороны, есть потребители, которым нужны лекарства. С другой стороны, для больших предприятий – это риск, и нужно всё просчитывать.
Бактериофаг синегнойный: инструкция, дозировка, лекарственная форма
В статье рассмотрим инструкцию к «Бактериофагу синегнойному».
Препарат используют для лечения и профилактики гнойных и воспалительных, а, кроме того, энтеральных заболеваний, которые вызваны синегнойной палочкой или дисбактериозом.
Форма выпуска
«Бактериофаг синегнойный» выпускают в жидкой форме для местного использования и приема внутрь. Средство выпускают во флаконах по 50 и 100 миллилитров. Этот препарат представляет собой фильтрат фаголизата, который активен в отношении синегнойной палочки.
Средство выпускают во флаконах по 50 и 100 миллилитров. Этот препарат представляет собой фильтрат фаголизата, который активен в отношении синегнойной палочки.
Показания к применению
Согласно инструкции, «Бактериофаг синегнойный» применяется для терапии пациентов, которые страдают заболеваниями разной локализации, обусловленными синегнойной палочкой. В частности этот препарат применяют при наличии заболеваний ушей, носа и дыхательных каналов, включая наличие отита, синусита, ангины, трахеита, фарингита, ларингита, трахеита, пневмонии, бронхита и плеврита.
Список показаний у «Бактериофага синегнойного» обширный.
Это средство используется в хирургической практике при наличии у пациентов ожогов, нагноений, флегмона, абсцесса, фурункул, гидрадениа, карбункулов и бурсита. Применяется в лечении урогенитальной инфекции, включая циститы, пиелонефриты, уретриты, кольпиты, сальпингоофориты и эндометриты.
Что еще нам сообщает инструкция? «Бактериофаг синегнойный» назначается пациентам, которые страдают холециститами, гастроэнтеритом, нарушением кишечной микрофлоры, гнойными и воспалительными, а, кроме того, септическими заболеваниями. Кроме того, данное средство используют для терапии пиодермии, конъюнктивитов и язвенного поражения роговицы. «Бактериофаг синегнойный» применим и для профилактики инфицирования послеоперационной раны.
Кроме того, данное средство используют для терапии пиодермии, конъюнктивитов и язвенного поражения роговицы. «Бактериофаг синегнойный» применим и для профилактики инфицирования послеоперационной раны.
Способ применения
Как указывает инструкция, «Бактериофаг синегнойный» предназначен для местного, а, кроме того, для перорального и ректального использования. Непосредственно перед применением данного раствора его надо взболтать. В том случае, если есть изменение в прозрачности средства или какой-либо видимый осадок, то применять средство запрещено.
В растворе содержится питательная среда. В целях предупреждения заражения лекарства микроорганизмами надо тщательно помыть руки перед его использованием, обработав колпачок антисептическим раствором. Помимо этого, следует избегать контакта пробки с разными предметами. Запрещается оставлять этот флакон открытым. Набор необходимых доз препарата следует выполнять стерильным шприцом. Как правило, пациентам перорально назначается прием трехкратно в сутки:
- Рекомендованная разовая дозировка «Бактериофага синегнойного» для детей до шести месяцев составляет 5 миллилитров перорально и 10 миллилитров в клизме.

- Разовая доза для детей до двенадцати месяцев составляет 10 миллилитров перорально и 20 миллилитров в клизме.
- Разовое дозирование для детей от одного года до трех лет составляет 15 миллилитров перорально и 20 миллилитров в клизме.
- Доза «Бактериофага» в возрасте от трех до восьми лет составляет 20 миллилитров перорально и 40 миллилитров в клизме.
- Доза для детей, которые старше восьми лет, и для взрослых составляет 30 миллилитров перорально и 50 миллилитров в клизме.
Отзывы о лекарстве
Отзывы о «Бактериофаге синегнойном» в интернете встречаются положительные. К примеру, люди часто в своих комментариях отмечают, что этот препарат эффективно справляется с лечением гнойных и воспалительных заболеваний, которые вызваны синегнойной палочкой или дисбактериозом. О каких-либо побочных эффектах не сообщается. Таким образом, отмечается, что этот препарат легко переносится детьми и взрослыми пациентами.
Использование лекарства у детей в возрасте до полугода, у недоношенных детей в том числе
Если у новорожденного энтероколит, сепсис, осуществляют постановку высоких клизм по 5-10 мл препарата трижды в сутки. Перорально использовать лекарство тоже можно путем перемешивания с грудным молоком. Терапию продолжают до 15 дней.
Перорально использовать лекарство тоже можно путем перемешивания с грудным молоком. Терапию продолжают до 15 дней.
Чтобы предупредить энтероколит, сепсис при внутриутробном инфицировании или риск возникновения госпитальной инфекции у новорожденных детей, медикамент может быть использован 2 раза в день в форме клизм в течение недели.
Как лечат пиодермию, омфалит, септические раны? В данных случаях делают аппликации пропитанной марлевой салфеткой, которая накладывается на раневую поверхность 2 раза в сутки.
Синегнойная палочка
Это такая подвижная бактерия, которая является возбудителем огромного количества всевозможных инфекционных болезней. Опасность такой палочки состоит в том, что она весьма устойчива к подавляющему числу всевозможных противомикробных лекарств. Название свое эта бактерия получила потому, что ею окрашивается питательная среда, в которой она растет, в синий оттенок.
Рассмотрим подробнее симптомы и лечение синегнойной палочки.
Симптомы заболевания
Рассмотрим особенности симптомов заболеваний, которые вызывает синегнойная палочка:
- При эндокардите у людей возникает лихорадка наряду с шумом в сердце и положительным посевом крови на синегнойную палочку.
 Кожная симптоматика проявляется в виде пятен Рота, узелков Ослера и кровоизлияний. Увеличивается селезенка.
Кожная симптоматика проявляется в виде пятен Рота, узелков Ослера и кровоизлияний. Увеличивается селезенка. - При пневмонии у людей под воздействием этой палочки возникает кашель наряду с хрипами, лихорадкой, бледностью и цианозом, гипоксией, а иногда и шоком.
- При поражении пищеварительной системы этой палочкой возникает лихорадка наряду с признаками обезвоживания, расстройствами желудка и кишечника и перитонитом.
- Когда поражается кожа с мягкими тканями, возникает кровоизлияние наряду с районами некроза, которые окружаются эритемой, подкожными узелками, абсцессом, целлюлитом и фасциитом.
Лечение
Симптомы и лечение синегнойной палочки взаимосвязаны.
Приведем далее схемы назначаемых препаратов при различных проявлениях синегнойных инфекций:
- При эндокардите пациентам прописывают высокие дозы аминогликозидов, а, кроме того, пенициллинов или цефалоспоринов широкого спектра воздействия. Лечение продолжают до шести недель.
- При пневмонии лечение начинают с двух антибиотиков, а по ходу улучшения самочувствия больного один из антибиотиков отменяют.

- При бактериемии по причине опасности и тяжести патологического процесса антибактериальную терапию назначают до того, как приходят результаты кровяного посева. Больным получается «Аминогликозид» и «Пенициллин» либо цефалоспорины широкого спектра воздействия, иногда один из медикаментов меняется на «Ципрофлоксацин» или же на препарат «Рифампицин».
- При менингите препаратом выбора выступает «Цефтазидим», к которому подключается «Аминогликозид». Антибиотикотерапия продолжается не меньше двух недель.
- При поражении ушей обычно назначается сочетание антибиотиков и кортикостероидов (например, «Метипред»).
Таким образом, при синегнойной палочке лечение проводится в зависимости от района поражения организма.
Терапия бактериофагами против биопленок Pseudomonas aeruginosa: обзор | Анналы клинической микробиологии и противомикробных препаратов
Шариати А., Азими Т., Ардебили А., Чирани А., Бахрамян А., Пормохаммад А., Садрединамин М., Эрфаниманеш С. , Бостангадири Н., Шамс С. Вставочная инактивация oprD в резистентных к карбапенемам Штаммы Pseudomonas aeruginosa , выделенные от ожоговых больных в Тегеране, Иран. Новые микробы Новые инфекции. 2018;21:75–80.
, Бостангадири Н., Шамс С. Вставочная инактивация oprD в резистентных к карбапенемам Штаммы Pseudomonas aeruginosa , выделенные от ожоговых больных в Тегеране, Иран. Новые микробы Новые инфекции. 2018;21:75–80.
КАС пабмед Статья Google Scholar
Bahramian A, Khoshnood S, Shariati A, Doustdar F, Chirani AS, Heidary M. Молекулярная характеристика гена pilS2 и его связь с частотой Pseudomonas aeruginosa плазмиды pKLC102 и острова патогенности PAPI-1. Заразить устойчивостью к наркотикам. 2019;12:221.
КАС пабмед ПабМед Центральный Статья Google Scholar
Мах Т-Ф, Питтс Б., Пеллок Б., Уокер Г.К., Стюарт П.С. О’Тул Г.А.: Генетическая основа устойчивости биопленки Pseudomonas aeruginosa к антибиотикам.Природа. 2003; 426: 306–10.
КАС пабмед Статья Google Scholar

Remold SK, Brown CK, Farris JE, Hundley TC, Perpich JA, Purdy ME. Дифференциальное использование среды обитания и разделение ниши видами Pseudomonas в домах человека. Микроб Экол. 2011;62:505.
ПабМед Статья Google Scholar
Wagner V, Filiatrault M, Picardo K, Iglewski B: Pseudomonas aeruginosa вопросы вирулентности и патогенеза.Pseudomonas genomics Mol Biol. 2008:129-158
Брайденштайн Э.Б., де ла Фуэнте-Нуньес С., Хэнкок Р.Э. Pseudomonas aeruginosa : все дороги ведут к сопротивлению. Тенденции микробиол. 2011;19:419–26.
КАС пабмед Статья Google Scholar
Пирес Д.П., Боас Д.В., Силланкорва С., Азередо Дж. Фаговая терапия: шаг вперед в лечении инфекций Pseudomonas aeruginosa . Дж Вирол.2015; 89: 7449–566.
КАС пабмед ПабМед Центральный Статья Google Scholar

CfD C. Профилактика: угрозы устойчивости к антибиотикам в США, 2013 г. Атланта, Джорджия: CDC; 2013.
Google Scholar
Пул К. Наружные мембраны и отток: путь к множественной лекарственной устойчивости грамотрицательных бактерий. Карр Фарм Биотехнолог. 2002; 3: 77–98.
КАС пабмед Статья Google Scholar
Вагнер В., Филиатро М., Пикардо К., Иглевски Б., Корнелис П. Pseudomonas: геномика и молекулярная биология. Норфолк, Великобритания: Caister Academic Press; 2008.
Google Scholar
Фахардо А., Мартинес-Мартин Н., Меркадильо М., Галан Дж. К., Гизелс Б., Маттейс С., Корнелис П., Вилманн Л., Туммлер Б., Бакеро Ф. Забытый внутренний резистом бактериальных патогенов. ПЛОС ОДИН. 2008;3:e1619.
ПабМед ПабМед Центральный Статья КАС Google Scholar

Вакуленко С.Б., Мобашеры С.М. Универсальность аминогликозидов и перспективы их развития. Clin Microbiol Rev. 2003; 16:430–50.
КАС пабмед ПабМед Центральный Статья Google Scholar
Costerton JW, Stewart PS, Greenberg EP. Бактериальные биопленки: частая причина персистирующих инфекций. Наука. 1999; 284:1318–22.
КАС пабмед ПабМед Центральный Статья Google Scholar
Стюарт П.С., Костертон Дж.В. Антибиотикорезистентность бактерий в биопленках. Ланцет. 2001; 358: 135–8.
КАС пабмед Статья Google Scholar
Костертон Дж.В., Гизи Г., Ченг К.Дж. Как прилипают бактерии. наук Ам. 1978; 238: 86–95.
КАС пабмед Статья Google Scholar
Spoering AL, Lewis K. Биопленки и планктонные клетки Pseudomonas aeruginosa обладают сходной устойчивостью к уничтожению противомикробными препаратами. J Бактериол. 2001; 183:6746–51.
J Бактериол. 2001; 183:6746–51.
КАС пабмед ПабМед Центральный Статья Google Scholar
Ма Л., Коновер М., Лу Х., Парсек М.Р., Бейлс К., Возняк Д.Дж. Сборка и разработка матрицы биопленки Pseudomonas aeruginosa . Возбудители PLoS. 2009;5:100354.
Артикул КАС Google Scholar
Harper DR, Parracho HM, Walker J, Sharp R, Hughes G, Werthén M, Lehman S, Morales S.Бактериофаги и биопленки. Антибиотики. 2014;3:270–84.
КАС ПабМед Центральный Статья пабмед Google Scholar
Twort FW: Исследование природы ультрамикроскопических вирусов. Acta Kravsi 1961.
d’Herelle M: Сур и микроб невидимый антагонист дизентерийных бацилл. Acta Kravsi 1961.
Гуттман Б., Рая Р., Каттер Э. Основы биологии фагов. Бактериофаги: биология и применение 2005, 4.
Бактериофаги: биология и применение 2005, 4.
Уолдор М.К., Фридман Д.И., Адхья С.Л. Фаги: их роль в бактериальном патогенезе и биотехнологии. Нью-Йорк: пресса ASM; 2005.
Книга Google Scholar
Сулаквелидзе А., Алавидзе З., Моррис Дж.Г. Бактериофаговая терапия. Противомикробные агенты Chemother. 2001; 45: 649–59.
КАС пабмед ПабМед Центральный Статья Google Scholar
Чанишвили Н.: Фаготерапия — история от Туорта и д’Эреля через советский опыт к современным подходам. В: Успехи в исследованиях вирусов. Том 83: Эльзевир; 2012: 3–40
Кутателадзе М., Адамия Р. Бактериофаги как потенциальные новые терапевтические средства для замены или дополнения антибиотиков. Тенденции биотехнологии. 2010;28:591–5.
КАС пабмед Статья Google Scholar

Potera C: Возрождение фагов: новая надежда против устойчивости к антибиотикам.Национальный институт наук о гигиене окружающей среды; 2013.
Келленбергер Г., Келленбергер Э. Электронно-микроскопические исследования размножения фагов: III Наблюдение всплесков одиночных клеток. Вирусология. 1957; 3: 275–85.
КАС пабмед Статья Google Scholar
Холлоуэй Б., Иган Дж., Монк М. Лизогения в Pseudomonas aeruginosa . Aust J Exp Biol Med Sci. 1960; 38: 321–30.
КАС пабмед Статья Google Scholar
Gu J, Liu X, Li Y, Han W, Lei L, Yang Y, Zhao H, Gao Y, Song J, Lu R. Метод создания фагового коктейля с большим терапевтическим потенциалом. ПЛОС ОДИН. 2012;7:e31698.
КАС пабмед ПабМед Центральный Статья Google Scholar
Jaiswal A, Koley H, Ghosh A, Palit A, Sarkar B. Эффективность коктейльной фаговой терапии при лечении инфекции Vibrio cholerae на модели кролика. микробы заражают. 2013;15:152–156.
Эффективность коктейльной фаговой терапии при лечении инфекции Vibrio cholerae на модели кролика. микробы заражают. 2013;15:152–156.
ПабМед Статья ПабМед Центральный Google Scholar
Hall AR, De Vos D, Friman VP, Pirnay JP, Buckling A. Влияние последовательного и одновременного применения бактериофагов на популяции Pseudomonas aeruginosa in vitro и в личинках восковой моли. Appl Environ Microbiol. 2012; 78: 5646–52.
КАС пабмед ПабМед Центральный Статья Google Scholar
Хэнлон ГВ. Бактериофаги: оценка их роли в лечении бактериальных инфекций.Противомикробные агенты Int J. 2007; 30:118–28.
КАС пабмед Статья ПабМед Центральный Google Scholar
Yan J, Mao J, Xie J. Деполимеразы полисахарида бактериофагов и биомедицинские применения. Биопрепараты. 2014; 28: 265–74.
2014; 28: 265–74.
КАС пабмед Статья Google Scholar
Брайерс Ю., Шмельхер М., Лесснер М.Дж., Хендрикс Дж., Энгельборгс Ю., Волкерт Г., Лавин Р.Высокоаффинный пептидогликан-связывающий домен эндолизина фага Pseudomonas KZ144. Biochem Biophys Res Commun. 2009; 383:187–91.
КАС пабмед Статья ПабМед Центральный Google Scholar
Лесснер М.Дж. Эндолизины бактериофагов — современное состояние исследований и приложений. Curr Opin Microbiol. 2005; 8: 480–7.
КАС пабмед Статья ПабМед Центральный Google Scholar
Jun SY, Jang IJ, Yoon S, Jang K, Yu K-S, Cho JY, Seong M-W, Jung GM, Yoon SJ, Kang SH. Фармакокинетика и переносимость препарата-кандидата на основе фагового эндолизина SAL200 после однократного внутривенного введения здоровым добровольцам. Противомикробные агенты Chemother. 2017;61:6.
2017;61:6.
Артикул Google Scholar
Граич С., Брегеон Ф., Ролен Ж.-М. Терапия на основе бактериофагов при муковисцидоз-ассоциированных инфекциях Pseudomonas aeruginosa : обоснование и современное состояние.Dev Design Dev Ther. 2015;9:3653.
КАС Google Scholar
Verma V, Harjai K, Chhibber S. Структурные изменения, вызванные литическим бактериофагом, делают ципрофлоксацин эффективным против более старой биопленки Klebsiella pneumoniae. Биообрастание. 2010;26:729–37.
КАС пабмед Статья Google Scholar
Льюис К. Персистерные клетки, покой и инфекционные заболевания.Nat Rev Microbiol. 2007; 5:48–56.
КАС пабмед ПабМед Центральный Статья Google Scholar
Пей Р., Ламас-Саманамуд Г. Р. Ингибирование образования биопленки бактериофагами Т7, продуцирующими ферменты, подавляющие кворум. Appl Environ Microbiol. 2014;80:5340–8.
Р. Ингибирование образования биопленки бактериофагами Т7, продуцирующими ферменты, подавляющие кворум. Appl Environ Microbiol. 2014;80:5340–8.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Аднан М., Шах М.Р.А., Джамал М., Джалил Ф., Андлеб С., Наваз М.А., Первез С., Хуссейн Т., Шах И., Имран М.Выделение и характеристика бактериофага для контроля планктонных клеток и биопленки с множественной лекарственной устойчивостью Pseudomonas aeruginosa . Биопрепараты. 2020;63:89–96.
КАС пабмед Статья Google Scholar
Латц С., Крюттген А., Хефнер Х., Буль Э.М., Риттер К., Хорц Х-П. Дифференциальный эффект вновь выделенных фагов, принадлежащих к PB1-подобным, phiKZ-подобным и LUZ24-подобным вирусам, против мультирезистентных к лекарственным средствам Pseudomonas aeruginosa при различных условиях роста.Вирусы. 2017;9:315.
Центральный пабмед Статья КАС Google Scholar
Fong SA, Drilling A, Morales S, Cornet ME, Woodworth BA, Fokkens WJ, Psaltis AJ, Vreugde S, Wormald P-J. Активность бактериофагов в удалении биопленок изолятов Pseudomonas aeruginosa от больных хроническим риносинуситом. Front Cell Infect Microbiol. 2017;7:418.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Джамал М., Андлеб С., Джалил Ф., Имран М., Наваз М.А., Хуссейн Т., Али М., Дас Ч.Р. Выделение и характеристика бактериофага и его использование против полирезистентной Pseudomonas aeruginosa -2995. Жизнь наук. 2017;190:21–8.
КАС пабмед Статья ПабМед Центральный Google Scholar
Guo M, Feng C, Ren J, Zhuang X, Zhang Y, Zhu Y, Dong K, He P, Guo X, Qin J. Новый противомикробный эндолизин, LysPA26, против Pseudomonas aeruginosa . Фронт микробиол. 2017;8:293.
Фронт микробиол. 2017;8:293.
ПабМед ПабМед Центральный Google Scholar
Квиатек М., Парасион С., Рутина П., Мизак Л., Грико Р., Немцевиц М., Олендер А., Лобокка М. Выделение бактериофагов и их применение для борьбы с Pseudomonas aeruginosa в планктонных и биопленочных моделях. Рез микробиол. 2017; 168:194–207.
ПабМед Статья ПабМед Центральный Google Scholar
Mapes AC, Trautner BW, Liao KS, Ramig RF. Разработка фага расширенного круга хозяев, активного на биопленки полирезистентной к лекарственным средствам Pseudomonas aeruginosa . Бактериофаг. 2016;6:e1096995.
КАС пабмед ПабМед Центральный Статья Google Scholar
Ahiwale S, Tamboli N, Thorat K, Kulkarni R, Ackermann H, Kapadnis B. In vitro управление больницей Pseudomonas aeruginosa с использованием местного T7-подобного литического фага. Карр микробиол. 2011;62:335–40.
Карр микробиол. 2011;62:335–40.
КАС пабмед Статья ПабМед Центральный Google Scholar
Kim S, Rahman M, Seol SY, Yoon SS, Kim J. Pseudomonas aeruginosa бактериофаг PA1Ø требует пили типа IV для инфекции и проявляет широкую бактерицидную активность и активность по удалению биопленки. Appl Environ Microbiol. 2012;78:6380–5.
КАС пабмед ПабМед Центральный Статья Google Scholar
Mi L, Liu Y, Wang C, He T, Gao S, Xing S, Huang Y, Fan H, Zhang X, Yu W. Идентификация литической деполимеразы фага Pseudomonas aeruginosa и ее антибиопленочного эффекта и бактерицидного вклада к сыворотке. Гены вирусов. 2019;55:394–405.
КАС пабмед Статья Google Scholar
Guo Y, Chen P, Lin Z, Wang T. Характеристика двух вирусов Pseudomonas aeruginosa vB_PaeM_SCUT-S1 и vB_PaeM_SCUT-S2. Вирусы. 2019;11:318.
Вирусы. 2019;11:318.
КАС ПабМед Центральный Статья пабмед Google Scholar
Ольшак Т., Шнейдер М.М., Латка А., Мачеевская Б., Браунинг С., Сычева Л.В., Корнелиссен А., Данис-Влодарчик К., Сенченкова С.Н., Шашков А.С. О-специфическая полисахарид-лиаза из хвостового шипа фага LKA1 снижает вирулентность Pseudomonas. Научный доклад 2017; 7: 1–14.
КАС Статья Google Scholar
Алвес Д.Р., Перес-Эстебан П., Кот В., Бин Дж., Арнот Т., Хансен Л.Х., Энрайт М.С., Дженкинс АТА. Новый коктейль бактериофагов уменьшает и рассеивает биопленки Pseudomonas aeruginosa в статических и проточных условиях. Микроб Биотехнология. 2016;9:61–74.
КАС пабмед Статья Google Scholar
Shafique M, Alvi IA, Abbas Z. ur Rehman S: Оценка способности бактериофага JHP широкого круга хозяев к удалению биопленки против Pseudomonas aeruginosa . Апмис. 2017;125:579–84.
Апмис. 2017;125:579–84.
КАС пабмед Статья Google Scholar
Phee A, Bondy-Denomy J, Kishen A, Basrani B, Azarpazhooh A, Maxwell K. Эффективность лечения бактериофагами Pseudomonas aeruginosa биопленок. Джей Эндодон. 2013; 39: 364–9.
Артикул Google Scholar
Данис-Влодарчик К., Ольшак Т., Арабски М., Васик С., Майковска-Скробек Г., Аугустыняк Д., Гула Г., Бриерс Ю., Янг Х.Б., Ванденхёвель Д.Характеристика недавно выделенных литических бактериофагов KTN6 и KT28 и их эффективность против биопленки Pseudomonas aeruginosa . ПЛОС ОДИН. 2015;10:6.
Google Scholar
Леман С.М., Донлан Р.М. Опосредованный бактериофагами контроль биопленки двух видов, образованной микроорганизмами, вызывающими инфекции мочевыводящих путей, связанные с катетером, в модели мочевого катетера in vitro. Противомикробные агенты Chemother. 2015;59:1127–37.
Противомикробные агенты Chemother. 2015;59:1127–37.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Пирес Д., Силланкорва С., Фаустино А., Азередо Дж. Использование недавно выделенных фагов для контроля биопленок Pseudomonas aeruginosa PAO1 и ATCC 10145. Рез микробиол. 2011; 162: 798–806.
КАС пабмед Статья Google Scholar
Кнежевич П., Обрехт Д., Курчин С., Петрушич М., Алексич В., Костаньсек Р., Петрович О.Фаги Pseudomonas aeruginosa : реакция на факторы окружающей среды и способность ингибировать рост бактерий и образование биопленок in vitro. J Appl Microbiol. 2011; 111: 245–54.
КАС пабмед Статья Google Scholar
Кей М.К., Эрвин Т.С., Маклин Р.Дж., Арон Г.М. Экология бактериофагов в смешанных биопленочных сообществах Escherichia coli и Pseudomonas aeruginosa . Appl Environ Microbiol.2011;77:821–9.
Appl Environ Microbiol.2011;77:821–9.
КАС пабмед Статья Google Scholar
Фу В., Форстер Т., Майер О., Кертин Дж.Дж., Леман С.М., Донлан Р.М. Бактериофаговый коктейль для предотвращения образования биопленки Pseudomonas aeruginosa на катетерах в модельной системе in vitro. Противомикробные агенты Chemother. 2010;54:397–404.
КАС пабмед Статья Google Scholar
Waters EM, Neill DR, Kaman B, Sahota JS, Clokie MR, Winstanley C, Kadioglu A. Фаговая терапия высокоэффективна против хронических инфекций легких с помощью Pseudomonas aeruginosa . грудная клетка. 2017;72:666–7.
ПабМед ПабМед Центральный Статья Google Scholar
Wright A, Hawkins C, Änggård E, Harper D. Контролируемое клиническое исследование терапевтического препарата бактериофага при хроническом отите, вызванном резистентностью к антибиотикам Pseudomonas aeruginosa ; предварительный отчет об эффективности. Клин Отоларингол. 2009; 34: 349–57.
Клин Отоларингол. 2009; 34: 349–57.
КАС пабмед Статья Google Scholar
Роуз Т., Вербекен Г., Де Вос Д., Мерабишвили М., Ваничутте М., Лавин Р., Дженнес С., Зизи М., Пирней Ж-П. Экспериментальная фаготерапия ожоговой раневой инфекции: трудные первые шаги. Int J Бернс Травма. 2014;4:66.
ПабМед ПабМед Центральный Google Scholar
Чон Дж., Ён Д.Два новых бактериофага улучшают выживаемость при инфекции Galleria mellonella и мышиных моделях острой пневмонии, инфицированных широко устойчивыми к лекарственным препаратам Pseudomonas aeruginosa . Appl Environ Microbiol. 2019;85:e02900–02918.
КАС пабмед ПабМед Центральный Статья Google Scholar
Ольгин А., Рангель Г., Клавихо В., Прада С., Мантилья М., Гомес М., Каттер Э., Тейлор С., Финеран П., Барриос А. Phage Pan70, предполагаемый умеренный фаг, контролирует Pseudomonas aeruginosa в планктонные, биопленочные и ожоговые модельные анализы на мышах.Вирусы. 2015;7:4602–23.
Phage Pan70, предполагаемый умеренный фаг, контролирует Pseudomonas aeruginosa в планктонные, биопленочные и ожоговые модельные анализы на мышах.Вирусы. 2015;7:4602–23.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Alemayehu D, Casey P, McAuliffe O, Guinane C, Martin J, Shanahan F, Coffey A, Ross R, Hill C. Бактериофаги MR299-2 и NH-4 могут элиминировать Pseudomonas aeruginosa у мышей легкие и клетки дыхательных путей при муковисцидозе. МБио. 2012;3:e00029–e112.
КАС пабмед ПабМед Центральный Статья Google Scholar
Forti F, Roach DR, Cafora M, Pasini ME, Horner DS, Fiscarelli EV, Rossitto M, Cariani L, Briani F, Debarbieux L. Разработка широкого спектра бактериофагового коктейля, который уменьшает биопленки Pseudomonas aeruginosa и лечит острые инфекции на двух моделях животных. Противомикробные агенты Chemother. 2018;62:e02573–e2517.
2018;62:e02573–e2517.
КАС пабмед ПабМед Центральный Статья Google Scholar
Басу С., Агарвал М., Кумар С.Б., Натх Г., Кумар В.С.Модель раны in vivo с использованием бактериофаговой терапии биопленок Pseudomonas aeruginosa . Стома/управление раной. 2015;61:16–23.
Google Scholar
Wintachai P, Naknaen A, Pomwised R, Voravuthikunchai SP, Smith DR. Выделение и характеристика фага Siphoviridae, инфицирующего Acinetobacter baumannii с широкой лекарственной устойчивостью, и оценка терапевтической эффективности in vitro и in vivo. J Med Microbiol. 2019;68:1096–108.
КАС пабмед Статья Google Scholar
Луд Р., Винер Б.Я., Пельцек А.Дж., Диез-Мартинес Р., Тандар М., Эйлер К.В., Шух Р., Фишетти В.А. Новый фаговый лизин, способный убивать полирезистентную грамотрицательную бактерию Acinetobacter baumannii в модели бактериемии у мышей. Противомикробные агенты Chemother. 2015;59:1983–91.
Противомикробные агенты Chemother. 2015;59:1983–91.
КАС пабмед ПабМед Центральный Статья Google Scholar
Yele AB, Thawal ND, Sahu PK, Chopade BA. Новый литический бактериофаг AB7-IBB1 Acinetobacter baumannii: выделение, характеристика и его влияние на биопленку. Арх Вирол. 2012; 157:1441–500.
КАС пабмед Статья Google Scholar
Thawal ND, Yele AB, Sahu PK, Chopade BA. Влияние нового подофага AB7-IBB2 на биопленку Acinetobacter baumannii. Карр микробиол. 2012;65:66–72.
КАС пабмед Статья Google Scholar
Qi ZY, Yang SY, Dong SW, Zhao FF, Qin JH, Xiang J. Биологические характеристики и геномная информация бактериофага против панрезистентной Klebsiella pneumoniae у ожогового пациента и его влияние на бактериальную биопленку. Чжунхуа Шао Шан Цза Чжи.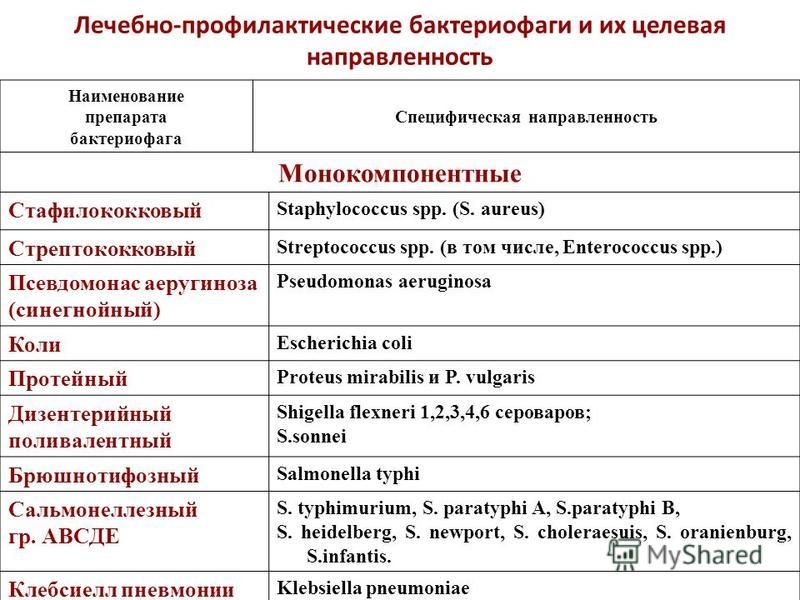 2020; 36:14–23.
2020; 36:14–23.
КАС пабмед Google Scholar
Wu Y, Wang R, Xu M, Liu Y, Zhu X, Qiu J, Liu Q, He P, Li Q. Новая полисахаридная деполимераза, кодируемая фагом SH-KP152226, придает специфическую активность против многих лекарственных устойчивый Klebsiella pneumoniae за счет деградации биопленки.Фронт микробиол. 2019;10:2768.
ПабМед ПабМед Центральный Статья Google Scholar
Табассум Р., Шафик М., Хаваджа К.А., Алви И.А., Рехман Ю., Шейх К.С., Аббас З., Рехман С.У. Полный анализ генома фага Siphoviridae TSK1, показывающий потенциал удаления биопленки против Klebsiella pneumoniae. Научный доклад 2018; 8:17904.
КАС пабмед ПабМед Центральный Статья Google Scholar
Таха О.А., Коннертон П.Л., Коннертон И.Ф., Эль-Шибины А. Бактериофаг ZCKP1: потенциальное лечение клебсиеллы пневмонии, выделенной у пациентов с диабетической стопой. Фронт микробиол. 2018;9:2127.
Фронт микробиол. 2018;9:2127.
ПабМед ПабМед Центральный Статья Google Scholar
Jamal M, Hussain T, Das CR, Andleeb S. Характеристика фага Z Siphoviridae и изучение его эффективности против полирезистентных Klebsiella pneumoniae планктонных клеток и биопленки.J Med Microbiol. 2015;64:454–62.
ПабМед Статья КАС Google Scholar
Дахил К.Х., Рахим Р.А., Нила В.К., Аль-Обаиди Дж.Р., Хун Т.Г., Иса М.Н.М., Юсофф К. Геномный анализ двух новых фагов Staphylococcus aureus, разрушающих биопленку и устойчивых к метициллину. БМС микробиол. 2019;19:114.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Cha Y, Chun J, Son B, Ryu S: Характеристика и анализ генома подовируса Staphylococcus aureus CSA13 и его способности противостоять биопленке. Viruses 2019, 11.
Tkhilaishvili T, Lombardi L, Klatt AB, Trampuz A, Di Luca M. Бактериофаг Sb-1 усиливает антибиотическое действие против биопленки, разрушает экзополисахаридный матрикс и нацеливается на персистеры Staphylocococf . Противомикробные агенты Int J. 2018;52:842–53.
КАС пабмед Статья Google Scholar
Gu Y, Xu Y, Xu J, Yu X, Huang X, Liu G, Liu X. Идентификация нового бактериофага vB_EcoP-EG1 с литической активностью в отношении планктонных и биопленочных форм уропатогенной Escherichia coli . Приложение Microbiol Biotechnol. 2019;103:315–26.
КАС пабмед Статья Google Scholar
Тхилаишвили Т., Ди Лука М., Аббандонато Г., Майоло Э.М., Клатт А.Б., Ройтер М., Монке-Бюхнер Э., Трампуз А. Оценка в реальном времени антимикробной активности, полученной из бактериофага Т3, против планктона и биопленки Escherichia coli методом изотермической микрокалориметрии.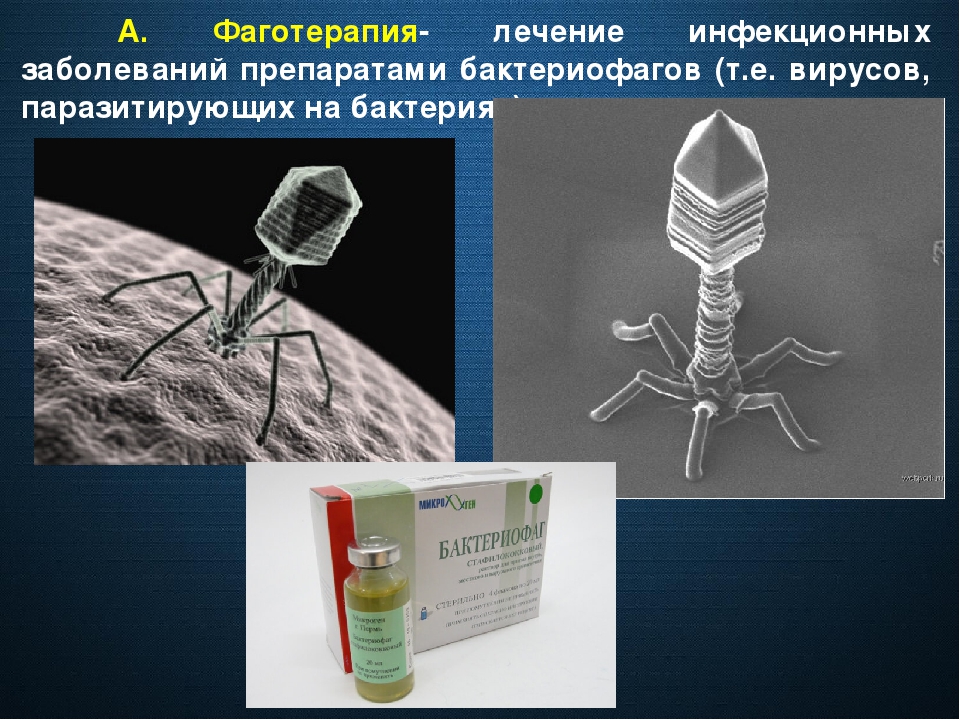 Рез микробиол. 2018;169:515–21.
Рез микробиол. 2018;169:515–21.
КАС пабмед Статья Google Scholar
Ribeiro KVG, Ribeiro C, Dias RS, Cardoso SA, de Paula SO, Zanuncio JC, de Oliveira LL. Бактериофаг, выделенный из сточных вод, устраняет и предотвращает образование биопленки Escherichia coli . Ад Фарм Булл. 2018;8:85–95.
КАС пабмед ПабМед Центральный Статья Google Scholar
D’Andrea MM, Frezza D, Romano E, Marmo P, De Angelis LH, Perini N, Thaller MC, Di Lallo G. Литический бактериофаг vB_EfaH_EF1TV, новый член семейства Herelleviridae, разрушает биопленку, продуцируемую Enterococcus faecalis . клинические штаммы. J Glob противомикробный резист. 2019;21:68–75.
ПабМед Статья Google Scholar
Shlezinger M, Coppenhagen-Glazer S, Gelman D, Beyth N, Hazan R. Эрадикация устойчивых к ванкомицину энтерококков путем комбинирования фага и ванкомицина. Вирусы. 2019;11(10):954.
Вирусы. 2019;11(10):954.
КАС ПабМед Центральный Статья пабмед Google Scholar
Мело ЛДР, Феррейра Р., Коста А.Р., Оливейра Х., Азередо Дж. Оценка эффективности и безопасности двух энтерококковых фагов в модели раны с биопленкой in vitro. Научный доклад 2019; 9: 6643.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Шарахи Д.Ю., Ахован З.А., Малеки Д.Т., Рад З.Р., Рад З.Р., Гударзи М., Шариати А., Бостангадири Н., Аббаси Э., Хашеми А.Антибактериальная активность комбинации куркумин-меропенем in vitro в отношении бактерий с широкой лекарственной устойчивостью (ШЛУ), выделенных из инфекций ожоговых ран. Авиценна Ж Фитомед. 2020;10:3.
КАС Google Scholar
Yonezawa H, Osaki T, Kamiya S: Образование биопленки Helicobacter pylori и ее участие в устойчивости к антибиотикам. BioMed research international 2015, 2015.
BioMed research international 2015, 2015.
Sharahi JY, Azimi T, Shariati A, Safari H, Tehrani MK, Hashemi A.Передовые стратегии борьбы с бактериальными биопленками. J Cell Physiol. 2019; 234:14689–708.
КАС Статья Google Scholar
Тхилаишвили Т., Винклер Т., Мюллер М., Перка С., Трампуз А. Бактериофаги в качестве адъюванта к антибиотикам для лечения перипротезной инфекции суставов, вызванной полирезистентной Pseudomonas aeruginosa . Противомикробные агенты Chemother. 2019;64:1.
Артикул Google Scholar
Актюрк Э., Оливейра Х., Сантос С.Б., Коста С., Куюмку С., Мело Л.Д., Азередо Дж. Синергетическое действие фага и антибиотиков: параметры для повышения эффективности уничтожения моно- и двухвидовых биопленок. Антибиотики. 2019;8:103.
КАС ПабМед Центральный Статья пабмед Google Scholar

Чаудхри В.Н., Консепсьон-Асеведо Дж., Парк Т., Андлеб С., Булл Дж.Дж., Левин Б.Р. Синергизм и порядок действия антибиотиков и фагов при уничтожении Pseudomonas aeruginosa биопленок.ПЛОС ОДИН. 2017;12:e0168615.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Стурино Дж.М., Klaenhammer TR. Ингибирование репликации бактериофага в Streptococcus thermophilus путем отравления субъединицей примазы. Микробиология. 2007; 153:3295–302.
КАС пабмед Статья Google Scholar
Вилас Боас Д., Алмейда С., Силланкорва С., Николау А., Азередо Дж., Азеведо Н.Ф.Дискриминация инфицированных бактериофагом клеток с помощью флуоресцентной гибридизации in situ с заблокированными нуклеиновыми кислотами (LNA-FISH). Биообрастание. 2016;32:179–90.
КАС пабмед Статья Google Scholar

Глонти Т., Чанишвили Н., Тейлор П. Бактериофаговый фермент, который деполимеризует капсулу альгиновой кислоты, связанную с изолятами кистозного фиброза Pseudomonas aeruginosa . J Appl Microbiol. 2010; 108: 695–702.
КАС пабмед Статья Google Scholar
Чанг РИК, Дас Т., Манос Дж., Каттер Э., Моралес С., Чан Х-К. Комбинированное лечение бактериофагом PEV20 и ципрофлоксацином способствует удалению биопленки Pseudomonas aeruginosa , выделенной у пациентов с муковисцидозом и раневых больных. Журнал ААПС. 2019;21:49.
ПабМед ПабМед Центральный Статья Google Scholar
Henriksen K, Rørbo N, Rybtke ML, Martinet MG, Tolker-Nielsen T, Høiby N, Middelboe M, Ciofu O. P. aeruginosa Биопленки проточных клеток усиливаются повторными обработками фагами, но могут быть уничтожены фаго-ципрофлоксацином сочетание: — мониторинг взаимодействий фаг– P.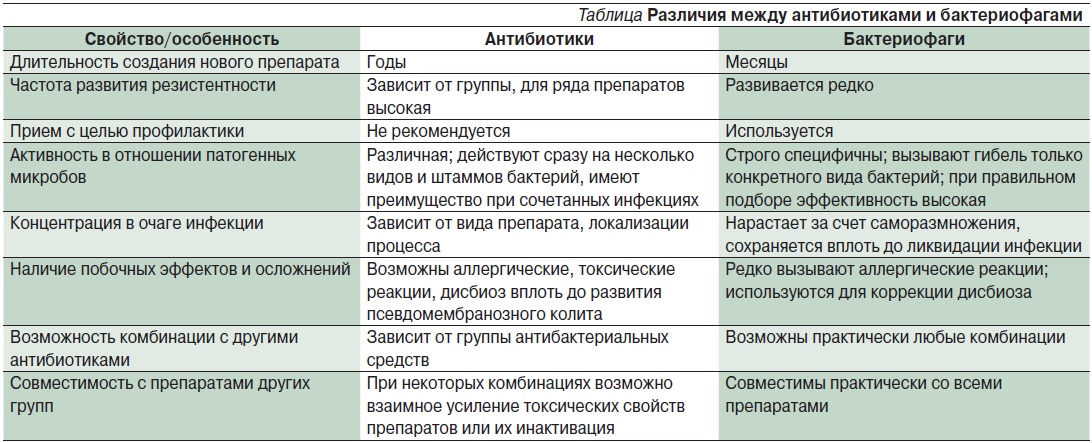 aeruginosa биопленок. Возбудители и болезни. 2019;77:011.
aeruginosa биопленок. Возбудители и болезни. 2019;77:011.
Артикул КАС Google Scholar
Торрес-Барсело К., Ариас-Санчес Ф.И., Вассе М., Рамсайер Дж., Кальц О., Хохберг М.Э.Окно возможностей для контроля бактериального патогена Pseudomonas aeruginosa , сочетающего антибиотики и фаги. ПЛОС ОДИН. 2014;9:e106628.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Torres-Barceló C, Hochberg ME. Эволюционное обоснование фагов в качестве дополнения к антибиотикам. Тенденции микробиол. 2016;24:249–56.
ПабМед Статья КАС Google Scholar
Коултер Л.Б., Маклин Р.Дж., Роде Р.Э., Арон Г.М. Влияние заражения бактериофагом в сочетании с тобрамицином на появление резистентности в биопленках Escherichia coli и Pseudomonas aeruginosa . Вирусы. 2014; 6: 3778–866.
Вирусы. 2014; 6: 3778–866.
КАС пабмед ПабМед Центральный Статья Google Scholar
Уоттерс С., Эверетт Дж. А., Хейли С., Клинтон А., Рамбо К.П. Лечение инсулином модулирует иммунную систему хозяина, усиливая раневые биопленки.Заразить иммун. 2014; 82: 92–100.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Wroe JA, Johnson CT, García AJ. Бактериофаги, доставляющие гидрогели, уменьшают образование биопленок in vitro и инфекцию in vivo. J Biomed Mater Res, Часть A. 2020; 108:39–49.
КАС Статья Google Scholar
Оливейра А., Соуза Х.К., Сильва А.С., Мело Л.Д., Силланкорва С.Применение каштанового меда и бактериофага для борьбы с биопленками Pseudomonas aeruginosa и Escherichia coli : оценка на модели раны ex vivo. Фронт микробиол. 2018;9:1725.
2018;9:1725.
ПабМед ПабМед Центральный Статья Google Scholar
Zhang Y, Hu Z. Комбинированная обработка биопленок Pseudomonas aeruginosa бактериофагами и хлором. Биотехнология Биоинж. 2013; 110: 286–95.
КАС пабмед Статья Google Scholar
Ahiwale S, Bankar A, Tagunde S, Kapadnis B. Синтез наночастиц золота, опосредованный бактериофагами, и их антибиопленочная активность. Индиан Дж Микробиол. 2017;57:188–94.
КАС пабмед ПабМед Центральный Статья Google Scholar
Мион С., Реми Б., Пленер Л., Брежон Ф., Шабриер Э., Доде Д.Лактоназа, подавляющая кворум, усиливает арсенал бактериофагов и антибиотиков против клинических изолятов Pseudomonas aeruginosa . Фронт микробиол. 2019;10:2049.
ПабМед ПабМед Центральный Статья Google Scholar

Chhibber S, Bansal S, Kaur S. Разрушение биопленки смешанных видов Klebsiella pneumoniae B5055 и Pseudomonas aeruginosa PAO с использованием бактериофагов отдельно или в сочетании с ксилитом.Микробиология. 2015; 161:1369–77.
КАС пабмед Статья Google Scholar
Пирес Д.П., Мело Л.Д., Боас Д.В., Силланкорва С., Азередо Дж. Фаговая терапия как альтернативная или дополнительная стратегия профилактики и контроля инфекций, связанных с биопленкой. Curr Opin Microbiol. 2017;39:48–56.
КАС пабмед Статья Google Scholar
Флемминг Х.-К., Вингендер Дж.Матрица биопленки. Nat Rev Microbiol. 2010; 8: 623–33.
КАС пабмед Статья Google Scholar
Романи А.М., Фонд К., Артигас Дж., Шварц Т., Сабатер С., Обст У. Актуальность ферментов полимерной матрицы при формировании биопленки. Микроб Экол. 2008; 56: 427–36.
Микроб Экол. 2008; 56: 427–36.
ПабМед Статья КАС Google Scholar
Рахуба Д, Коломиец Е, Дей Э.С., Новик Г.Рецепторы бактериофагов, механизмы адсорбции и проникновения фага в клетку-хозяина. Пол Дж Микробиол. 2010;59:145–55.
КАС пабмед Статья Google Scholar
Hu J, Miyanaga K, Tanji Y. Диффузионные свойства бактериофагов через мембрану из агарозного геля. Биотехнологическая прог. 2010;26:1213–21.
КАС пабмед Статья Google Scholar
Каттер Э., Рая Р., Карлсон К. Молекулярные механизмы фаговой инфекции. 2005.
Донлан РМ. Предотвращение биопленок клинически значимых организмов с помощью бактериофага. Тенденции микробиол. 2009; 17:66–72.
КАС пабмед Статья Google Scholar

Донлан Р.М., Костертон Дж.В. Биопленки: механизмы выживания клинически значимых микроорганизмов. Clin Microbiol Rev. 2002; 15:167–93.
КАС пабмед ПабМед Центральный Статья Google Scholar
Азередо Дж., Сазерленд И.В. Использование фагов для удаления инфекционных биопленок. Карр Фарм Биотехнолог. 2008; 9: 261–6.
КАС пабмед Статья Google Scholar
Cerca N, Oliveira R, Azeredo J. Восприимчивость планктонных клеток и биопленок Staphylococcus epidermidis к литическому действию стафилококкового бактериофага K. Lett Appl Microbiol. 2007;45:313–7.
КАС пабмед Статья Google Scholar
Labrie SJ, Samson JE, Moineau S. Механизмы устойчивости к бактериофагам. Nat Rev Microbiol. 2010;8:317–27.
КАС пабмед Статья Google Scholar

Lacqua A, Wanner O, Colangelo T, Martinotti MG, Landini P. Возникновение биопленкообразующих субпопуляций при воздействии Escherichia coli на бактериофаги окружающей среды. Appl Environ Microbiol. 2006; 72: 956–9.
КАС пабмед ПабМед Центральный Статья Google Scholar
Охслин Ф., Пиккарди П., Манчини С., Габар Дж., Морейон П., Энтенза Дж.М., Реш Г., Куэ Ю.А. Синергическое взаимодействие между фаговой терапией и антибиотиками устраняет инфекцию Pseudomonas aeruginosa при эндокардите и снижает вирулентность. J заразить Dis. 2017; 215:703–12.
КАС пабмед Google Scholar
Чан Б.К., Абедон С.Т., Лок-Каррильо К. Фаговые коктейли и будущее фаговой терапии. Будущая микробиология.2013; 8: 769–83.
КАС пабмед Статья Google Scholar
Лось М. , Голец П., Лось Ю.М., Венглевска-Юркевич А., Чиж А., Венгжин А., Венгжин Г., Нойбауэр П. Эффективное ингибирование литического развития бактериофагов λ, P1 и T4 голоданием их хозяина, Кишечная палочка . Биотехнология БМС. 2007; 7:13.
, Голец П., Лось Ю.М., Венглевска-Юркевич А., Чиж А., Венгжин А., Венгжин Г., Нойбауэр П. Эффективное ингибирование литического развития бактериофагов λ, P1 и T4 голоданием их хозяина, Кишечная палочка . Биотехнология БМС. 2007; 7:13.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Силланкорва С., Оливейра Р., Виейра М.Дж., Сазерленд И., Азередо Дж. Заражение Pseudomonas fluorescens бактериофагом ΦS1: влияние температуры, фазы роста хозяина и среды. FEMS Microbiol Lett. 2004; 241:13–20.
КАС пабмед Статья Google Scholar
Силланкорва С., Оливейра Р., Виейра М.Дж., Сазерленд И., Азередо Дж. Заражение бактериофагом Φ S1 планктонных клеток Pseudomonas fluorescens в сравнении с биопленками.Биообрастание. 2004; 20:133–138.
ПабМед Статья Google Scholar

Ng W-L, Bassler BL. Бактериальные сетевые архитектуры с определением кворума. Анну Рев Жене. 2009;43:197–222.
КАС пабмед ПабМед Центральный Статья Google Scholar
Абисадо Р.Г., Беномар С., Клаус Дж.Р., Дандекар А.А., Чендлер Дж.Р. Чувство бактериального кворума и взаимодействие микробного сообщества.МБио. 2018;9:e02331–e2317.
КАС пабмед ПабМед Центральный Google Scholar
Папенфорт К., Басслер Б.Л. Системы сигнала-ответа кворума у грамотрицательных бактерий. Nat Rev Microbiol. 2016;14:576.
КАС пабмед ПабМед Центральный Статья Google Scholar
Høyland-Kroghsbo NM, Mærkedahl RB, Svenningsen SL. Защитный механизм бактериофагов, индуцированный определением кворума.МБио. 2013;4:e00362–e312.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Фаговая терапия против Pseudomonas aeruginosa на модели рыбок данио с муковисцидозом
Без названия. В Всемирной организации здравоохранения . В: Борьба с лекарственной устойчивостью . 2011 , http://www.who.int/world-health-day/2011/en/.
Без названия. InW Всемирная организация здравоохранения . In: Устойчивость к антибиотикам – угроза глобальной безопасности здравоохранения .
Карам Г., Частр Дж., Уилкокс М. Х. и Винсент Дж. Л. Стратегии применения антибиотиков в эпоху множественной лекарственной устойчивости. Интенсивная терапия 20 (2016 г.).
Лок-Каррильо, К. и Абедон, С. Т. Плюсы и минусы фаготерапии. Бактериофаг 1 , 111–114 (2011).
Артикул Google Scholar
Дюфур, Н., Дебарбье, Л., Фромантен, М. и Рикар, Ж.-Д. Лечение высоковирулентной внекишечной патогенной пневмонии Escherichia coli бактериофагами*. Крит . Care Med . 43 , e190–e198 (2015).
Labrie, S.J., Samson, J.E. & Moineau, S. Механизмы устойчивости к бактериофагам. Нац. Преподобный Микробиолог. 8 , 317–327 (2010).
КАС Статья Google Scholar
D’Hérelle, F. О невидимом микробе, антагонистическом бацилле дизентерии. Comptes Rendus Acad. наук 1651 , 373–5 (1917).
Google Scholar
Дженнес С. и др. . Использование бактериофагов в лечении септицемии Pseudomonas aeruginosa, чувствительной только к колистину, у пациента с острым повреждением почек. Интенсивная терапия 21 (2017).
Берндсен, Р. Х. и др. . Эпигенетический подход к ангиостатической терапии: перспективные комбинации для лечения рака. Ангиогенез 20 , 245–267 (2017).
Артикул Google Scholar
Pirnay, J. P. и др. . Требования к качеству и безопасности продуктов для устойчивой фаготерапии. Pharmaceutical Research 32 , 2173–2179 (2015).
КАС Статья Google Scholar
Цао, Ф. и др. . Оценка эффективности бактериофага при лечении пневмонии, вызванной мультирезистентной клебсиеллой пневмонии у мышей. Биомед Рез . Интервал . 2015 (2015).
Фукуда, К. и др. . Кератит Pseudomonas aeruginosa у мышей: эффекты местного введения бактериофага KPP12. PLoS One 7 (2012 г.).
Alemayehu, D. и др. .Бактериофаги φMR299-2 и φNH-4 могут элиминировать Pseudomonas aeruginosa в легком мыши и в клетках дыхательных путей муковисцидоза. МБио 3 (2012).
Роуч, Д. Р. и Дебарбье, Л. Фаговая терапия: пробуждение спящего гиганта. Аварийный. Вверх. Жизнь наук. 1 , 93–103 (2017).
1 , 93–103 (2017).
Артикул Google Scholar
Форти, Ф. и др. . Разработка коктейля бактериофагов широкого спектра действия, который уменьшает биопленки Pseudomonas aeruginosa и лечит острые инфекции на двух моделях животных. Антимикроб . Агенты Чемотер . AAC.02573-17, https://doi.org/10.1128/AAC.02573-17 (2018 г.).
Дебарбье, Л. и др. . Бактериофаги могут лечить и предотвращать легочные инфекции Pseudomonas aeruginosa. Дж. Заражение. Дис. 201 , 1096–1104 (2010).
КАС Статья Google Scholar
Chadha, P., Katare, O.P. & Chhibber, S. Эффективность in vivo одного фага по сравнению с фаговым коктейлем при лечении ожоговой раневой инфекции у мышей BALB/c. Микроб. Патог. 99 , 68–77 (2016).
КАС Статья Google Scholar

Stoltz, Da, Meyerholz, D.K. & Welsh, M.J. Происхождение кистозного фиброза легких. Н. англ. Дж. Мед. 372 , 351–362 (2015).
Артикул Google Scholar
Риордан, Дж. Р. и др. . Идентификация гена муковисцидоза: клонирование и характеристика комплементарной ДНК. Наука 245 , 1066–73 (1989).
ОБЪЯВЛЕНИЕ КАС Статья Google Scholar
Лю, Ф. и др. . Молекулярная структура ионного канала CFTR человека. Cell 169 , 85–95.e8 (2017).
КАС Статья Google Scholar
Фенниси, Р. Т., Салливан, М. Дж., Сингер, Дж. Т., Йодер, Дж. А.и Ким, С. Х. Специфическая устойчивость к инфекции Pseudomonas aeruginosa у рыбок данио опосредована регулятором трансмембранной проводимости муковисцидоза. Заразить. Иммун. 78 , 4542–4550 (2010).
КАС Статья Google Scholar
Renshaw, S.A. & Trede, N.S. Модель создавалась 450 миллионов лет: рыбки данио и иммунитет позвоночных. Дис. Модель. мех. 5 , 38–47 (2012).
КАС Статья Google Scholar
Евтов И., Самуэльссон Т., Яо Г., Амстердам А. и Риббек К. Рыбки данио как модель для изучения физиологии живой слизи. Наука . Респ. . 4 (2014).
Рокер, А. Дж., Вайс, А. Р. Э., Лам, Дж. С., Ван Раай, Т. Дж. и Хурсигара, К. М. Визуализация и количественная оценка инфекции Pseudomonas aeruginosa в желудочке заднего мозга рыбок данио с использованием конфокальной лазерной сканирующей микроскопии. J. Microbiol. Методы 117 , 85–94 (2015).
Артикул Google Scholar
Navis, A., Mayjoram, L. & Bagnat, M. Cftr контролирует расширение просвета и функцию пузырьков Купфера у рыбок данио. Девелопмент 140 , 1703–1712 (2013).
Cftr контролирует расширение просвета и функцию пузырьков Купфера у рыбок данио. Девелопмент 140 , 1703–1712 (2013).
КАС Статья Google Scholar
Навис, А. и Багнат, М.Потеря функции cftr приводит к разрушению поджелудочной железы у личинок рыбок данио. Дев. биол. 399 , 237–248 (2015).
КАС Статья Google Scholar
Guilbault, C., Saeed, Z., Downey, G.P. & Radzioch, D. Модели мышей с муковисцидозом. Американский журнал респираторной клеточной и молекулярной биологии 36 , 1–7 (2007).
КАС Статья Google Scholar
Sun, H. и др. . Мутация CFTR усиливает деградацию Disheveled и приводит к нарушению Wnt-зависимой статьи кроветворения. Гибель клеток Dis . 9 (2018).
Новоа, Б. и Фигерас, А. Рыбки данио: Модель для изучения воспаления и врожденного иммунного ответа на инфекционные заболевания. Доп. Эксп. Мед. биол. 946 , 253–275 (2012).
и Фигерас, А. Рыбки данио: Модель для изучения воспаления и врожденного иммунного ответа на инфекционные заболевания. Доп. Эксп. Мед. биол. 946 , 253–275 (2012).
КАС Статья Google Scholar
Bruscia, E.M. & Bonfield, TL. Врожденный и адаптивный иммунитет при кистозном фиброзе. Клиники грудной медицины 37 , 17–29 (2016).
Артикул Google Scholar
Треде, Н. С., Лангенау, Д. М., Травер, Д., Лук, А. Т. и Зон, Л. И. Использование рыбок данио для понимания иммунитета. Иммунитет 20 , 367–379 (2004).
КАС Статья Google Scholar
Clatworthy, AE и др. . Инфекция Pseudomonas aeruginosa рыбок данио включает детерминанты как хозяина, так и патогена. Заразить. Иммун. 77 , 1293–1303 (2009).
КАС Статья Google Scholar

Rottner, M., Freyssinet, J.M. & Martinez, M.C. Механизмы болезненного воспалительного цикла при кистозном фиброзе. Респираторные исследования 10 (2009 г.).
Шульц А. и Стик С. Раннее воспаление легких и повреждение легких у детей с муковисцидозом. Респирология 20 , 569–78 (2015).
Артикул Google Scholar
Nichols, D.P. & Chmiel, J.F. Воспаление и его генезис при муковисцидозе. Детская пульмонология 50 , S39–S56 (2015).
Артикул Google Scholar
Ламас, М. А. и ван дер, С. А. Оценка вирулентности Pseudomonas с хозяином, не являющимся млекопитающим: рыбками данио. Methods Mol Biol 1149 , 70921 (2014).
Google Scholar
Brannon, M.K. и др. . Система секреции Pseudomonas aeruginosa типа III взаимодействует с фагоцитами, модулируя системную инфекцию эмбрионов рыбок данио. Сотовый. микробиол. 11 , 755–768 (2009).
Сотовый. микробиол. 11 , 755–768 (2009).
КАС Статья Google Scholar
Исваран, М. и др. . Характеристика бактериофага pAh-1 и его защитного действия при экспериментальном заражении Aeromonas hydrophila у рыбок данио (Danio rerio). J Fish Dis 40 , 841–846 (2017).
КАС Статья Google Scholar
Dubern, J. F. et al . Комплексный полногеномный скрининг генов вирулентности Pseudomonas aeruginosa с использованием нескольких моделей заболеваний показывает, что патогенность зависит от хозяина. Окружающая среда. микробиол. 17 , 4379–4393 (2015).
КАС Статья Google Scholar
Клокгетер, Дж. и др. . Геномное разнообразие лабораторных штаммов Pseudomonas aeruginosa PAO1. J. Бактериол. 192 , 1113–1121 (2010).
КАС Статья Google Scholar
Дорин, Дж. Р. и др. .Кистозный фиброз у мышей с помощью направленного инсерционного мутагенеза. Природа 359 , 211–215 (1992).
ОБЪЯВЛЕНИЕ КАС Статья Google Scholar
Роджерс, К. С. и др. . Нарушение гена CFTR создает модель кистозного фиброза у новорожденных свиней. Наука (80-.). 321 , 1837–1841 (2008 г.).
ОБЪЯВЛЕНИЕ КАС Статья Google Scholar
Sun, X. и др. . Фенотип заболевания модели муковисцидоза с нокаутом CFTR у хорьков. Дж. Клин. Вкладывать деньги. 120 , 3149–3160 (2010).
КАС Статья Google Scholar
Лавель, Г. М., Уайт, М. М., Браун, Н., МакЭлвани, Н. Г. и Ривз, Е. П. Модели патологии муковисцидоза на животных: фенотипические параллели и расхождения. Биомед Рез . Интервал . 2016 (2016).
П. Модели патологии муковисцидоза на животных: фенотипические параллели и расхождения. Биомед Рез . Интервал . 2016 (2016).
Keiser, N.W. & Engelhardt, J.F. Новые модели муковисцидоза на животных: чему они нас учат? Curr opin Med 17 , 478–483 (2011).
Google Scholar
Доринг Г. и Гулбинс Э. Муковисцидоз и врожденный иммунитет: как мутации хлоридных каналов провоцируют заболевания легких. Cell Microbiol 11 , 208–216 (2009).
Артикул Google Scholar
Bonfield, T.L., Konstan, M.W. & Berger, M. Измененная продукция цитокинов клетками респираторного эпителия при муковисцидозе. J. Аллергическая клиника. Иммунол. 104 , 72–78 (1999).
КАС Статья Google Scholar
Цучия М. и др. . Дифференциальная регуляция воспаления медиаторами воспаления в эпителиальных клетках муковисцидоза легких. J. Интерферон Цитокин Res. 33 , 121–9 (2013).
Дифференциальная регуляция воспаления медиаторами воспаления в эпителиальных клетках муковисцидоза легких. J. Интерферон Цитокин Res. 33 , 121–9 (2013).
КАС Статья Google Scholar
Горски А. и др. . Новое понимание возможной роли бактериофагов в трансплантологии. В Transplantation Proceedings 35 , 2372–2373 (2003).
КАС Статья Google Scholar
Гурски А. и др. . Бактериофаги и трансплантационная толерантность.В Transplantation Proceedings 38 , 331–333 (2006).
Артикул Google Scholar
Охслин Ф. и др. . Синергическое взаимодействие между фаговой терапией и антибиотиками устраняет Pseudomonas aeruginosa при эндокардите и снижает вирулентность. Дж. Заражение. Дис. 215 , 703–712 (2017).
КАС пабмед Google Scholar
Чан, Б.К. и др. . Отбор фагов восстанавливает чувствительность к антибиотикам при MDR Pseudomonas aeruginosa. Наука . Rep , https://doi.org/10.1038/srep26717 (2016).
Гизотти, Д. и др. . Генетический анализ области иммунитета фага-плазмиды Р4. Мол. микробиол. 6 , 3405–3413 (1992).
КАС Статья Google Scholar
Strähle, U. и др. . Эмбрионы рыбок данио как альтернатива экспериментам на животных — комментарий к определению начала защищенных стадий жизни в правилах защиты животных. Репрод. Токсикол. 33 , 128–132 (2012).
Артикул Google Scholar
Киммел С., Баллард В., Киммел С., Ульманн Б. и Шиллинг Т. Стадии эмбрионального развития рыбок данио. Дев.Дин. 203 , 253–310 (1995).
Дев.Дин. 203 , 253–310 (1995).
КАС Статья Google Scholar
Такаки К., Дэвис Дж. М., Уингли К. и Рамакришнан Л. Оценка патогенеза и лечения инфекции Mycobacterium marinum у рыбок данио. Нац. протокол 8 , 1114–1124 (2013).
Артикул Google Scholar
Миллиган-Мире, К. и др. . Изучение взаимодействия хозяин-микроб у рыбок данио. Методы Cell Biol. 105 , 87–116 (2011).
Артикул Google Scholar
Ellett, F., Pase, L., Hayman, J.W., Andrianopoulos, A. & Lieschke, G.J. Трансгены промотора mpeg1 направляют экспрессию линии макрофагов у рыбок данио. Блок от 117 (2011).
Тисс, К. и Тисс, Б.Гибридизация с высоким разрешением in situ с эмбрионами рыбок данио целиком. Нац. протокол 3 , 59–69 (2008).
протокол 3 , 59–69 (2008).
КАС Статья Google Scholar
Писточчи, А. и др. . Решающая роль prox1 рыбок данио в развитии катехоламинергических нейронов гипоталамуса. BMC Dev . Биол . 8 (2008).
Эффективность обработки бактериофагами биопленок Pseudomonas aeruginosa
Введение: Бактериальные вирусы (фаги) успешно используются для лечения бактериальных инфекций животных и человека.В этом исследовании изучалось потенциальное использование фаготерапии против биопленок штамма Pseudomonas aeruginosa PA14 на модели корневого канала.
Методы: Часть 1: 24-часовые и 96-часовые биопленки PA14, выращенные в микропланшетах, обрабатывали фагами, идентифицированными как обладающие потенциальной активностью по разложению биопленки, и количественно определяли бактериальную биомассу после обработки с использованием окрашивания кристаллическим фиолетовым. Часть 2: 24-часовые и 96-часовые биопленки PA14, выращенные в подготовленных корневых каналах извлеченных резцов нижней челюсти человека, были обработаны фагами, идентифицированными с потенциальной активностью по разложению биопленки. Внутриканальные образцы после лечения были взяты с использованием бумажных штифтов и круглых боров для оценки количества фагов и бактерий.
Часть 2: 24-часовые и 96-часовые биопленки PA14, выращенные в подготовленных корневых каналах извлеченных резцов нижней челюсти человека, были обработаны фагами, идентифицированными с потенциальной активностью по разложению биопленки. Внутриканальные образцы после лечения были взяты с использованием бумажных штифтов и круглых боров для оценки количества фагов и бактерий.
Результаты: Часть 1: Мы идентифицировали 2 фага (JBD4 и JBD44a) с предполагаемой активностью по разрушению биопленки.Обработка биопленок PA14 этими фагами приводила к значительному снижению среднего процента биомассы в 24-часовых (P<0,05) и 96-часовых (P=0,08) биопленках. Часть 2: В 24-часовых и 96-часовых биопленках PA14 в модели корневого канала не было обнаружено существенной разницы в количестве колониеобразующих единиц после обработки фагом (P> 0,05).
Выводы: Применение фага значительно уменьшило биомассу 24-часовых и 96-часовых биопленок PA14, выращенных на микропланшетах, но не привело к значительному снижению 24-часовых или 96-часовых биопленок PA14, выращенных в модели удаленного зуба.
границ | Бактериофаговая терапия: клинические испытания и регуляторные препятствия
Проблема бактерий с множественной лекарственной устойчивостью
В 2017 году Всемирная организация здравоохранения опубликовала список глобальных приоритетных патогенов, включающий 12 видов бактерий, разделенных на критические, высокие и средние приоритеты в зависимости от их уровня устойчивости и доступных терапевтических средств (Tacconelli et al., 2018). Нынешняя скорость развития резистентности намного превышает уровень открытия и разработки антибиотиков и представляет собой глобальную проблему общественного здравоохранения.По оценкам, к 2050 году из-за устойчивости к противомикробным препаратам ежегодно может умирать более 10 миллионов человек (O’neill, 2014). Хотя это спорная цифра (De Kraker et al., 2016), она, тем не менее, подчеркивает серьезную проблему, с которой мы сталкиваемся в отношении вариантов лечения бактериальных инфекций с множественной лекарственной устойчивостью (MDR) (Bassetti et al. , 2017). Естественными хищниками бактерий являются бактериальные вирусы, известные как бактериофаги или фаги. Повсеместно встречающиеся, эти организмы, по оценкам, присутствуют в количествах, эквивалентных триллиону на песчинку на Земле (Keen, 2015).Развиваясь параллельно с бактериями, фаги являются потенциальными антибактериальными терапевтическими агентами против таких возбудителей МЛУ (Burrowes et al., 2011). Здесь мы сосредоточимся на трех важнейших приоритетных патогенах, Acinetobacter baumannii, Pseudomonas aeruginosa и членах Enterobacteriaceae (Tacconelli et al., 2018), а также на текущих достижениях в исследованиях фаговой терапии для воздействия на эти организмы, а также на изучении других общие вопросы клинических испытаний и регуляторные сложности фаготерапии.
, 2017). Естественными хищниками бактерий являются бактериальные вирусы, известные как бактериофаги или фаги. Повсеместно встречающиеся, эти организмы, по оценкам, присутствуют в количествах, эквивалентных триллиону на песчинку на Земле (Keen, 2015).Развиваясь параллельно с бактериями, фаги являются потенциальными антибактериальными терапевтическими агентами против таких возбудителей МЛУ (Burrowes et al., 2011). Здесь мы сосредоточимся на трех важнейших приоритетных патогенах, Acinetobacter baumannii, Pseudomonas aeruginosa и членах Enterobacteriaceae (Tacconelli et al., 2018), а также на текущих достижениях в исследованиях фаговой терапии для воздействия на эти организмы, а также на изучении других общие вопросы клинических испытаний и регуляторные сложности фаготерапии.
A. baumannii признан критическим приоритетным патогеном из-за растущей частоты случаев устойчивости к противомикробным препаратам и значительной роли в внутрибольничных инфекциях (Mcconnell et al.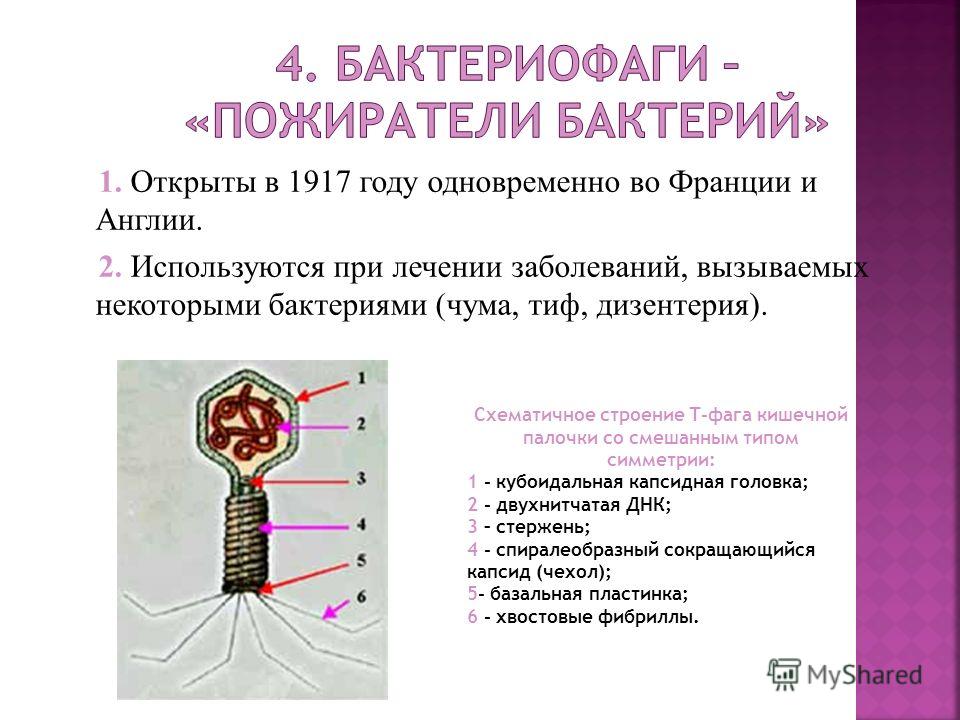 , 2013). Примерно через 20 лет после раннего испытания терапии фагом A. baumannii на мышах (Soothill, 1992) произошел всплеск сообщений об выделении литического фага A. baumannii и их активности in vitro , согласно обзору Гарсия-Кинтанилья и др.(2013). С тех пор были достигнуты значительные успехи благодаря дальнейшим исследованиям in vitro (Liu et al., 2016; Ghajavand et al., 2017) и многочисленным исследованиям исследований in vivo на животных (Kusradze et al., 2016; Regeimbal et al. ., 2016; Инь и др., 2017; Чжоу и др., 2018). Оценка фаготерапии на мышиной модели инфекции A. baumannii привела к увеличению выживаемости в группе, получавшей фаг, в 2,3 раза по сравнению с контрольными группами (Cha et al., 2018).
, 2013). Примерно через 20 лет после раннего испытания терапии фагом A. baumannii на мышах (Soothill, 1992) произошел всплеск сообщений об выделении литического фага A. baumannii и их активности in vitro , согласно обзору Гарсия-Кинтанилья и др.(2013). С тех пор были достигнуты значительные успехи благодаря дальнейшим исследованиям in vitro (Liu et al., 2016; Ghajavand et al., 2017) и многочисленным исследованиям исследований in vivo на животных (Kusradze et al., 2016; Regeimbal et al. ., 2016; Инь и др., 2017; Чжоу и др., 2018). Оценка фаготерапии на мышиной модели инфекции A. baumannii привела к увеличению выживаемости в группе, получавшей фаг, в 2,3 раза по сравнению с контрольными группами (Cha et al., 2018).
Новый лизин из А.baumannii , способные убивать клинические изоляты с МЛУ и спасать мышей от смертельных инфекций (Lood et al., 2015). Использование этих ферментативных соединений не является новой концепцией; и хотя использование лизина было ограничено грамотрицательными бактериями из-за их внешнего мембранного барьера, рост числа публикаций предполагает, что это больше не ограничивает использование лизина грамотрицательными бактериями (Thandar et al. , 2016; Peng et al. ., 2017; Ларпин и др., 2018).
, 2016; Peng et al. ., 2017; Ларпин и др., 2018).
Были также достигнуты успехи в испытаниях фаготерапии на людях.Ключевой случай в Соединенных Штатах связан с первым внутривенным введением фаговой терапии и привел к успешному лечению и выздоровлению пациента с инфекцией псевдокисты поджелудочной железы A. baumannii (Schooley et al., 2017). Это привело к увеличению воздействия фаговой терапии на публику и, возможно, к повышению клинической осведомленности об этом альтернативном терапевтическом средстве. Совсем недавно в другом тематическом исследовании, связанном с инфекцией MDR- A. baumannii в месте краниоэктомии, применялся персонализированный коктейль фагов внутривенно в попытке улучшить результаты лечения пациентов (Lavergne et al., 2018). К сожалению, пациент скончался после того, как по просьбе семьи были прекращены меры жизнеобеспечения. В таких случаях сложно своевременно решать вопросы регулирования; хотя персонализированная терапия идеально подходит для адаптации к потребностям пациента, она может быть сложной задачей.
P. aeruginosa является основным условно-патогенным микроорганизмом и причиной внутрибольничных инфекций (Lyczak et al., 2000; Breidenstein et al., 2011).Он также является частой причиной хронических инфекций легких у пациентов с муковисцидозом и поэтому рассматривается как мишень для фаготерапии (Olszak et al., 2015). Фаговая терапия инфекций P. aeruginosa насчитывает более 50 лет (Bertoye et al., 1959; Soothill, 2013), но недавние разработки в области использования как фаговых лизинов, так и живых фагов весьма многообещающи. Обзор Росситто и его коллег описывает текущую литературу в этой области и проблемы, связанные с фаговой терапией при муковисцидозе, в частности, они предлагают, чтобы будущие исследования включали тестирование как слизистых, так и немукоидных P.aeruginosa и использование как легочных, так и нелегочных моделей хозяина (Rossitto et al., 2018). Высушенные распылением составы фагов также были тщательно протестированы для ингаляционного применения против легочной инфекции P. aeruginosa (Chang et al., 2017, 2018). Данные по иммуногенности были оценены с использованием модели легких человека in vitro и продемонстрировали увеличение IL-6 и TNF-a для одного из двух фагов (Shiley et al., 2017). Иммунный ответ человека является важным фактором при оценке терапевтического применения фагов (Krut and Bekeredjian-Ding, 2018), однако также сообщалось о положительных эффектах иммунного ответа, способствующих положительным результатам фаготерапии (Roach et al., 2017).
aeruginosa (Chang et al., 2017, 2018). Данные по иммуногенности были оценены с использованием модели легких человека in vitro и продемонстрировали увеличение IL-6 и TNF-a для одного из двух фагов (Shiley et al., 2017). Иммунный ответ человека является важным фактором при оценке терапевтического применения фагов (Krut and Bekeredjian-Ding, 2018), однако также сообщалось о положительных эффектах иммунного ответа, способствующих положительным результатам фаготерапии (Roach et al., 2017).
Было обнаружено, что коктейль из шести фагов успешно лечит респираторную инфекцию P. aeruginosa у мышей и, кроме того, сепсис на моделях Galleria mellonella (Forti et al., 2018). Способность некоторых фагов проникать в биопленки P. aeruginosa является еще одним важным преимуществом по сравнению с традиционными методами лечения (Fong et al., 2017; Waters et al., 2017), в то время как сообщалось о совместном введении фагов и антибиотиков как о механизме восстановление чувствительности к антибиотикам (Chan et al. , 2016). В последнем случае, когда фаги используют в качестве рецепторов компоненты насосных систем множественного оттока лекарств, мутация, придающая устойчивость к фагам, изменяет механизм насоса, что приводит к повторной сенсибилизации антибиотиками. Исследование случая инфицирования протеза аорты штаммом P. aeruginosa при прямом введении в трансплантат комбинации фага и цефтазидима привело к разрешению и, возможно, эрадикации инфекции (Chan et al., 2018). Наконец, исследования фагового лизина также расширяются: Guo et al.описали новый эндолизин с активностью in vitro против P. aeruginosa и других грамотрицательных бактерий из списка критически важных патогенов (Guo et al., 2017), с аналогичными сообщениями других групп (Larpin et al., 2018). ).
, 2016). В последнем случае, когда фаги используют в качестве рецепторов компоненты насосных систем множественного оттока лекарств, мутация, придающая устойчивость к фагам, изменяет механизм насоса, что приводит к повторной сенсибилизации антибиотиками. Исследование случая инфицирования протеза аорты штаммом P. aeruginosa при прямом введении в трансплантат комбинации фага и цефтазидима привело к разрешению и, возможно, эрадикации инфекции (Chan et al., 2018). Наконец, исследования фагового лизина также расширяются: Guo et al.описали новый эндолизин с активностью in vitro против P. aeruginosa и других грамотрицательных бактерий из списка критически важных патогенов (Guo et al., 2017), с аналогичными сообщениями других групп (Larpin et al., 2018). ).
В пределах семейства Enterobacteriaceae, Escherichia coli и Klebsiella spp. занимает первое место в списке критических приоритетов ВОЗ для устойчивых к антибиотикам бактерий, за которым следуют Enterobacter, Serratia и Proteus spp. (Такконелли и др., 2018). Занимая много комменсальных ниш, изолятов E. coli включают важные кишечные и внекишечные патогены (Bolocan et al., 2016). Большинство ранних исследований фагов было проведено с колифагами (фаги, которые инфицируют E. coli ), особенно T4 (Stahl, 1989; Edgar, 2004), о чем свидетельствуют многочисленные исследования, некоторые из которых суммированы Bolocan et al. (2016). Совсем недавно исследования in vitro и in vivo показали многообещающие результаты, например контроль энтеропатогенных E.coli у мышей с фагом, выделенным из больничных сточных вод (Vahedi et al., 2018), и эффект колифагов против планктонных и биопленкоассоциированных инфекций (Tkhilaishvili et al., 2018).
(Такконелли и др., 2018). Занимая много комменсальных ниш, изолятов E. coli включают важные кишечные и внекишечные патогены (Bolocan et al., 2016). Большинство ранних исследований фагов было проведено с колифагами (фаги, которые инфицируют E. coli ), особенно T4 (Stahl, 1989; Edgar, 2004), о чем свидетельствуют многочисленные исследования, некоторые из которых суммированы Bolocan et al. (2016). Совсем недавно исследования in vitro и in vivo показали многообещающие результаты, например контроль энтеропатогенных E.coli у мышей с фагом, выделенным из больничных сточных вод (Vahedi et al., 2018), и эффект колифагов против планктонных и биопленкоассоциированных инфекций (Tkhilaishvili et al., 2018).
Klebsiella spp. являются частыми внутрибольничными и внебольничными патогенами, признанными в связи с их статусом МЛУ. Цао и др. вводили интраназально фаг для лечения легочной инфекции K. pneumoniae у мышей, что приводило к защите от летальной инфекции и снижению уровня воспалительных цитокинов в легких (Cao et al. , 2015). Аналогичным образом, в мышиной модели инфекции K. pneumoniae с ожоговой раной местное применение фага привело к значительному снижению смертности (Kumari et al., 2011), а фаговый коктейль, нагруженный липосомами, увеличил бактериальный клиренс и скорость заживления (Chadha et al. др., 2017).
, 2015). Аналогичным образом, в мышиной модели инфекции K. pneumoniae с ожоговой раной местное применение фага привело к значительному снижению смертности (Kumari et al., 2011), а фаговый коктейль, нагруженный липосомами, увеличил бактериальный клиренс и скорость заживления (Chadha et al. др., 2017).
Другие терапевтические применения фагов включают предотвращение образования биопленок. Деполимераза, продуцирующая K. pneumoniae фага , в сочетании с агентами, антагонистами железа, продемонстрировала способность уничтожать ранние биопленки K.pneumoniae : многообещающая профилактическая стратегия (Chhibber et al., 2013). Также был достигнут прогресс в исследованиях лизина: Yan et al. описали новый слитый белок, который объединяет рецептор-связывающие домены колицина А с лизином фага E. coli для преодоления блокирующего эффекта внешней мембраны грамотрицательных бактерий с успешным контролем E. coli как in vitro и в мышиной модели (Yan et al. , 2017).
, 2017).
В то время как многие исследования посвящены фаговой терапии in vitro и in vivo , для перевода на человека требуется еще много работы.Сообщения о клинических случаях обсуждались, но отсутствуют убедительные доказательства клинических испытаний.
Фаговая терапия у людей
Использование фагов в Восточной Европе и бывшем Советском Союзе широко распространено с момента их открытия; в результате терапевтическое использование фагов интегрировано в их системы здравоохранения. Однако эта потенциальная терапия только недавно исследуется в соответствии со строгими научными стандартами (Kutter et al., 2010; Villarroel et al., 2017). Abedon представил список ключевых критериев, которые следует тщательно учитывать и сообщать в исследованиях фаготерапии (Abedon, 2017).Информация, имеющая решающее значение для успеха клинических испытаний, включает адекватную характеристику и выбор фагов, а также субъектов (людей) и целевых бактерий. Требуются также дополнительные данные, такие как рецептуры, дозировка и эффективность, однако без обоснования охарактеризованных и хорошо спланированных целей они не имеют ценности. Подробная отчетность улучшит качество будущих исследований и позволит повторить и расширить предыдущие исследования. Еще одним соображением является выбор подходящих мишеней заболевания для фаговой терапии (Harper, 2018).Например, видовая специфичность, характерная для большинства фагов, обычно очень желательна при мономикробных заболеваниях, однако эта специфичность может быть основным ограничением в случаях полимикробных инфекций, если, возможно, фаг не вводят в комбинации с подходящим антибиотиком. Такие соображения необходимы для безопасности пациентов в клинических испытаниях, поскольку удаление одного патогена и последующее чрезмерное развитие второго потенциально могут иметь фатальные последствия (Harper, 2018). С другой стороны, может случиться так, что фаги с широким кругом хозяев более распространены, чем считается в настоящее время, отчасти из-за ошибок в методах выделения фагов (De Jonge et al., 2018): это несоответствие заслуживает дальнейшего изучения.
Подробная отчетность улучшит качество будущих исследований и позволит повторить и расширить предыдущие исследования. Еще одним соображением является выбор подходящих мишеней заболевания для фаговой терапии (Harper, 2018).Например, видовая специфичность, характерная для большинства фагов, обычно очень желательна при мономикробных заболеваниях, однако эта специфичность может быть основным ограничением в случаях полимикробных инфекций, если, возможно, фаг не вводят в комбинации с подходящим антибиотиком. Такие соображения необходимы для безопасности пациентов в клинических испытаниях, поскольку удаление одного патогена и последующее чрезмерное развитие второго потенциально могут иметь фатальные последствия (Harper, 2018). С другой стороны, может случиться так, что фаги с широким кругом хозяев более распространены, чем считается в настоящее время, отчасти из-за ошибок в методах выделения фагов (De Jonge et al., 2018): это несоответствие заслуживает дальнейшего изучения.
Клинические испытания с участием фагов
Одной из текущих проблем внедрения фаговой терапии в клиническую практику является отсутствие подтвержденных и адекватно контролируемых клинических испытаний.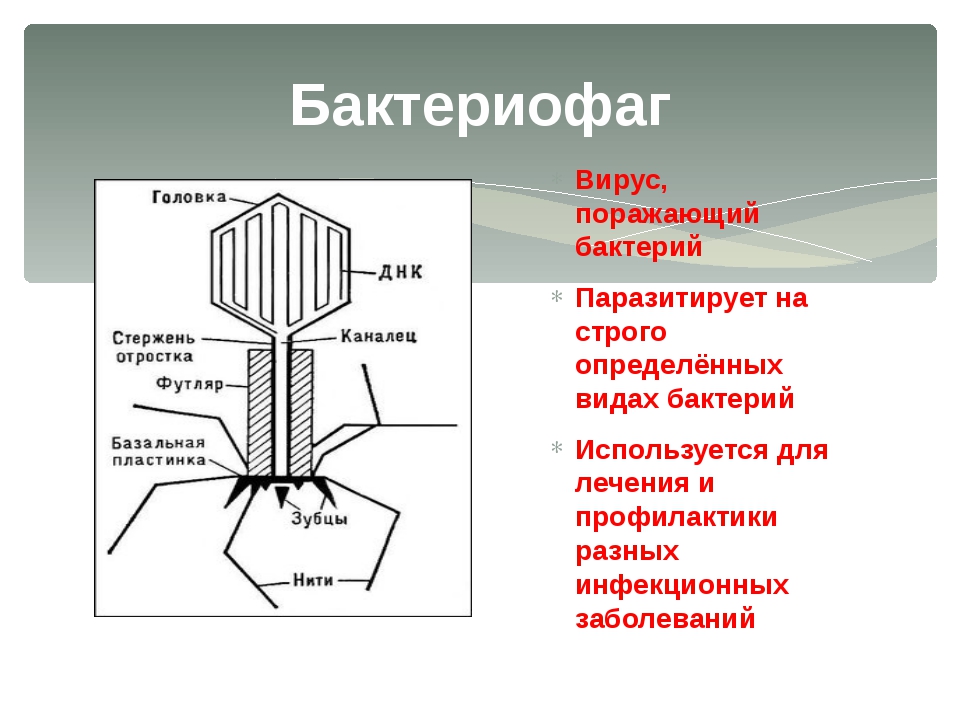 Следует проявлять особую осторожность при планировании и дизайне таких испытаний, поскольку, хотя дизайн клинических испытаний для фаговой терапии, естественно, имеет много параллелей со стандартными клиническими испытаниями лекарств, есть несколько факторов, которые являются уникальными для фагов.К ним относятся фармакологические соображения, такие как дозировка (Payne and Jansen, 2003). Поскольку это самовоспроизводящиеся вирусы, их доза может экспоненциально увеличиваться при достижении интересующих бактерий. Это приводит к другому соображению применения: фаги требуют прямого контакта с бактериями, и при слишком широком распространении они будут менее эффективными. Однако для решения этой проблемы широко использовались местные приложения, однако, как уже упоминалось, с успехом использовались и другие методы.При рассмотрении подходов монотерапии или комбинированной терапии фаговые коктейли обладают широким спектром активности и снижают вероятность формирования резистентности, однако следует отметить, что комбинированная терапия значительно усложняет оценку воспалительных эффектов, потенциала переноса генов и развития фаговой резистентности для всех фаги в коктейле (Parracho et al.
Следует проявлять особую осторожность при планировании и дизайне таких испытаний, поскольку, хотя дизайн клинических испытаний для фаговой терапии, естественно, имеет много параллелей со стандартными клиническими испытаниями лекарств, есть несколько факторов, которые являются уникальными для фагов.К ним относятся фармакологические соображения, такие как дозировка (Payne and Jansen, 2003). Поскольку это самовоспроизводящиеся вирусы, их доза может экспоненциально увеличиваться при достижении интересующих бактерий. Это приводит к другому соображению применения: фаги требуют прямого контакта с бактериями, и при слишком широком распространении они будут менее эффективными. Однако для решения этой проблемы широко использовались местные приложения, однако, как уже упоминалось, с успехом использовались и другие методы.При рассмотрении подходов монотерапии или комбинированной терапии фаговые коктейли обладают широким спектром активности и снижают вероятность формирования резистентности, однако следует отметить, что комбинированная терапия значительно усложняет оценку воспалительных эффектов, потенциала переноса генов и развития фаговой резистентности для всех фаги в коктейле (Parracho et al. , 2012).
, 2012).
Некоторые утверждают, что воздействие бактериофагов на людей происходит каждый день и свидетельствует об их безопасности, однако в контексте клинических испытаний необходимо учитывать ряд соображений.Первый из них касается стерильности и чистоты фагового препарата. Крайне важно, чтобы продукты не содержали токсинов и бактериального мусора, чтобы соответствовать надлежащей производственной практике или эквивалентным стандартам обеспечения качества. Паррачо и др. описали параметры качества, рекомендуемые для продуктов бактериофагов, от момента идентификации фага до производственных процессов (Parracho et al., 2012). Во-вторых, следует также обратить внимание на опасения, связанные с возможностью возникновения токсического шока в результате бактерицидного действия фагов.Хотя сообщалось, что это не является проблемой (Speck and Smithyman, 2016), и этот метод уничтожения бактерий используется совместно с бактерицидными антибиотиками (Dufour et al., 2017), это является необходимым соображением безопасности перед клиническими испытаниями.
Предыдущие клинические испытания фаговой терапии подробно описаны Kutter et al. и включают те, которые проводились в Грузии и Польше (Kutter et al., 2010). Следует отметить два клинических испытания фаговой терапии, которые используются в качестве примеров в литературе и посвящены безопасности фагов для лечения венозных язв нижних конечностей (Rhoads et al., 2009), безопасность и эффективность при хроническом отите (Wright et al., 2009). Rhoads и его коллеги сообщили о безопасности в небольшом исследовании фазы I у пациентов с венозными язвами нижних конечностей и не сообщили об отсутствии побочных эффектов при введении фагов (Rhoads et al., 2009). Райт и др. продемонстрировали эффективность и безопасность антисинегнойных фагов против поздних стадий рецидивирующего отита, в котором доминировал MDR- P. aeruginosa . Это одни из первых контролируемых клинических испытаний на людях, проведенных в западном мире.Совсем недавно был зарегистрирован ряд клинических испытаний (https://clinicaltrials. gov/ и https://globalclinicaltrialdata.com/), как показано на рисунке 1 (Miedzybrodzki et al., 2012; Sarker et al., 2016; Лейтнер и др., 2017). На обоих веб-сайтах использование поисковой фразы «фаговая терапия» привело к 15 исследованиям/испытаниям на первом сайте, девять из которых были связаны с фаговой терапией с упором на лечение инфекции. Два дополнительных исследования были найдены с использованием ресурса глобальных клинических испытаний.Не все результаты поиска представляли собой стандартные клинические испытания, например, также были включены сборы мокроты для тестов на фаги in vitro и интервенционные исследования с расширенным доступом. Дополнительные, научно обоснованные клинические испытания имеют жизненно важное значение для повышения признания западными клиническими мирами применения фаготерапии. Хотя было проведено множество обсервационных исследований, они были ограничены небольшими размерами выборки, и многие из них плохо контролировались. И наоборот, многообещающие тематические исследования действительно существуют, однако регулирующие органы требуют надежных данных клинических испытаний для разработки клинических руководств по фаготерапии.
gov/ и https://globalclinicaltrialdata.com/), как показано на рисунке 1 (Miedzybrodzki et al., 2012; Sarker et al., 2016; Лейтнер и др., 2017). На обоих веб-сайтах использование поисковой фразы «фаговая терапия» привело к 15 исследованиям/испытаниям на первом сайте, девять из которых были связаны с фаговой терапией с упором на лечение инфекции. Два дополнительных исследования были найдены с использованием ресурса глобальных клинических испытаний.Не все результаты поиска представляли собой стандартные клинические испытания, например, также были включены сборы мокроты для тестов на фаги in vitro и интервенционные исследования с расширенным доступом. Дополнительные, научно обоснованные клинические испытания имеют жизненно важное значение для повышения признания западными клиническими мирами применения фаготерапии. Хотя было проведено множество обсервационных исследований, они были ограничены небольшими размерами выборки, и многие из них плохо контролировались. И наоборот, многообещающие тематические исследования действительно существуют, однако регулирующие органы требуют надежных данных клинических испытаний для разработки клинических руководств по фаготерапии.
Регулирование и разработка политики
В настоящее время не существует структуры, которая бы прямо определяла фаги в контексте лекарственных средств для применения у людей, однако в Грузии они встроены в систему здравоохранения в качестве стандартного медицинского применения (Кутаталадзе, 2015). В частности, в Институте бактериофагов, микробиологии и вирусологии Элиавы есть несколько готовых фаговых препаратов (безрецептурных) и более широкий ассортимент продуктов, специально предназначенных для практикующих врачей (Kutter et al., 2010; Кутателадзе, 2015). Точно так же в Польше есть Институт иммунологии и экспериментальной терапии Хиршфельда, хотя этот центр поставляет персонализированные фаговые продукты непосредственно врачам, используя более индивидуальный подход (Kutter et al., 2010). Однако в других частях мира бактериофаги представляют собой уникальную программу регулирования.
Горски обобщает текущие схемы доступа по всему миру и определяет основное включение вариантов использования из соображений сострадания в большинстве стран в качестве крайней меры (Горски и др. , 2018). Схемы различаются, однако все они соответствуют ситуации тяжелобольного или хронически больного пациента, для которого исчерпаны все разрешенные варианты лечения. Хотя эти схемы полезны в краткосрочной перспективе, было признано, что специальная правовая база фаготерапии необходима для беспрепятственного внедрения естественной фаготерапии в западную медицину. В Европе прозвучали призывы к действию со стороны регулирующих органов, где обсуждались регуляторные препятствия и будущие шаги, необходимые для разработки соответствующих терапевтических руководств на основе фагов (Huys et al., 2013; Вербекен и др., 2014).
, 2018). Схемы различаются, однако все они соответствуют ситуации тяжелобольного или хронически больного пациента, для которого исчерпаны все разрешенные варианты лечения. Хотя эти схемы полезны в краткосрочной перспективе, было признано, что специальная правовая база фаготерапии необходима для беспрепятственного внедрения естественной фаготерапии в западную медицину. В Европе прозвучали призывы к действию со стороны регулирующих органов, где обсуждались регуляторные препятствия и будущие шаги, необходимые для разработки соответствующих терапевтических руководств на основе фагов (Huys et al., 2013; Вербекен и др., 2014).
Работа над решением
Тщательный анализ мнений ключевых заинтересованных сторон о статусе регулирования фаговой терапии был проведен Verbeken et al. (2014). Были предложены два пути регулирования, включая размещение на рынке продуктов на основе натуральных фагов и пути освобождения больниц для индивидуальной фаговой терапии. Среди опрошенных заинтересованных сторон был достигнут консенсус в отношении необходимости создания специальной новой нормативно-правовой базы для фаготерапии, которая признает специфические свойства фагов и их взаимодействия, в дополнение к роли больниц как поставщиков фаготерапии (Verbeken et al. , 2014). В том же духе семинар с Европейским агентством по лекарственным средствам (EMA) был направлен на совместную работу со всеми заинтересованными сторонами, чтобы найти решение регуляторных барьеров, с которыми сталкиваются исследователи фагов, при сохранении стандартов качества и безопасности (Pelfrene et al., 2016). ). Здесь EMA подтвердило, что ни одно из действующих правил не подходит для фаготерапии, и обсудило варианты дальнейших действий.
, 2014). В том же духе семинар с Европейским агентством по лекарственным средствам (EMA) был направлен на совместную работу со всеми заинтересованными сторонами, чтобы найти решение регуляторных барьеров, с которыми сталкиваются исследователи фагов, при сохранении стандартов качества и безопасности (Pelfrene et al., 2016). ). Здесь EMA подтвердило, что ни одно из действующих правил не подходит для фаготерапии, и обсудило варианты дальнейших действий.
Магистральные фаги
Политический прогресс в Бельгии привел к созданию магистральной системы регулирования фагов: прагматичной системы, охватывающей специализированную фаговую терапию (Pirnay et al., 2018). Данная нормативная база включает магистральную формулу, в которой неавторизованные фаговые препараты могут быть приготовлены фармацевтом с учетом внешней оценки качества фаговых препаратов. Обеспечение качества и надлежащая производственная практика имеют чрезвычайно важное значение для любого терапевтического агента, и соображения, касающиеся банков фагов, должны включать характеристику всех фагов, чтобы, среди прочих параметров, были обеспечены идентичность, жизнеспособность, эффективность и чистота (Pirnay et al. , 2015; Pelfrene). и другие., 2016).
, 2015; Pelfrene). и другие., 2016).
Терапевтическая классификация фагов
Вопросы, касающиеся биологического статуса фагов, включают вопрос о том, живы они или нет, что подчеркивает необходимость определенных условий политики, специфичных для фагов. В настоящее время фаготерапия во многих случаях представляет собой воплощение персонализированной медицины, поскольку это процесс, включающий индивидуальные комбинации фагов, специфичные для бактериальной инфекции (инфекций) отдельного пациента. Это создает трудности в нормативном потоке, поскольку этот переход к персонализированной медицине ломает шаблон нормативных соглашений.Следует признать, что другие терапевтические методы, например терапия рака (Daly, 2007), сталкивались с подобным препятствием в прошлом, и их усовершенствование, безусловно, возможно. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США недавно предоставило новому Центру инновационных применений фагов и терапии (IPATH) возможность использовать фаговую терапию в рамках схемы экстренного исследования новых лекарств. Эти инициативы, вероятно, улучшат клиническое понимание и признание, а также предоставят подтверждающие доказательства необходимости в специальных нормативных руководствах.
Эти инициативы, вероятно, улучшат клиническое понимание и признание, а также предоставят подтверждающие доказательства необходимости в специальных нормативных руководствах.
Будущее фагов
Нет никаких сомнений в том, что фаготерапия является привлекательным решением для борьбы с растущей устойчивостью к антибиотикам. Многочисленные исследования подчеркивают потенциал терапевтических фагов in vitro и in vivo , и хотя за последнее десятилетие был проведен ряд клинических испытаний, необходимы дополнительные данные, чтобы представить надежное нормативное обоснование для клинического использования. Перед фаговой терапией остаются очевидные проблемы, особенно в отношении управления регуляторной политикой.Переход к новым схемам, основанным на знании фаговых приложений, должен направлять эти процессы и работать над разумной структурой реализации. В идеале нормативные изменения должны осуществляться стандартизированным и глобальным образом; однако это понятно. В то время как область быстро развивается в сторону терапевтических средств, подпитываемых очевидной потребностью в альтернативах антибиотикам, регуляторные процессы должны быть усовершенствованы и рассмотрены с новой точки зрения, основанной на фагах.Один размер не подходит для всех, и совместные усилия по созданию моделей, подходящих для фагов, несомненно, приведут к улучшению состояния здоровья для всех. Мы также должны помнить, что, несмотря на неудовлетворенность законодательными параметрами, крайне важно сохранить высокие стандарты безопасности, качества и эффективности. Жизненно важно, чтобы ученые и клиницисты продолжали вести эти обсуждения с соответствующими регулирующими органами и как можно раньше продвигали эту область вперед.
В то время как область быстро развивается в сторону терапевтических средств, подпитываемых очевидной потребностью в альтернативах антибиотикам, регуляторные процессы должны быть усовершенствованы и рассмотрены с новой точки зрения, основанной на фагах.Один размер не подходит для всех, и совместные усилия по созданию моделей, подходящих для фагов, несомненно, приведут к улучшению состояния здоровья для всех. Мы также должны помнить, что, несмотря на неудовлетворенность законодательными параметрами, крайне важно сохранить высокие стандарты безопасности, качества и эффективности. Жизненно важно, чтобы ученые и клиницисты продолжали вести эти обсуждения с соответствующими регулирующими органами и как можно раньше продвигали эту область вперед.
Вклад авторов
LF разработала тему и направленность обзора, подготовила рукопись и одобрила окончательный вариант для публикации.И BC, и MP внесли свой вклад в структуру и содержание, критически отредактировали черновой вариант рукописи и утвердили окончательный вариант для публикации.
Финансирование
ПрограммаLF поддерживается стипендией Австралийского правительства по программе обучения научных исследований и стипендией профессора Гордона Кинга для аспирантов, предоставляемой Фондом исследований женщин и младенцев. MP поддерживается грантом проекта NHMRC [1144040].
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Каталожные номера
Бассетти М., Пулаку Г., Руппе Э., Буза Э., Ван Хал С. Дж. и Бринк А. (2017). Устойчивость к противомикробным препаратам в ближайшие 30 лет, человечество, микробы и лекарства: дальновидный подход. Интенсивная терапия Мед. 43, 1464–1475. doi: 10.1007/s00134-017-4878-x
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Bertoye, A., Gaillard, L., and Courtieu, A.L. (1959). Адаптированные бактериофаги в лечении инфекций, вызванных антибиотикорезистентными микроорганизмами. J. Med. Лион 40, 465–471.
Адаптированные бактериофаги в лечении инфекций, вызванных антибиотикорезистентными микроорганизмами. J. Med. Лион 40, 465–471.
Резюме PubMed | Академия Google
Болокан А.С., Калланан Дж., Форде А., Росс П. и Хилл К. (2016). Фаготерапия против Escherichia coli – история без конца? FEMS микробиол. лат. 363:fnw256. doi: 10.1093/femsle/fnw256
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Брейденштейн, Э. Б., Де Ла Фуэнте-Нуньес, К., и Хэнкок, Р. Э. (2011). Pseudomonas aeruginosa : все дороги ведут к сопротивлению. Тенденции микробиол. 19, 419–426. doi: 10.1016/j.tim.2011.04.005
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Берроуз Б., Харпер Д. Р., Андерсон Дж., Макконвилл М. и Энрайт М. К. (2011). Терапия бактериофагами: потенциальное использование в борьбе с устойчивыми к антибиотикам патогенами. Expert Rev. Anti Infect Ther. 9, 775–785. doi: 10.1586/eri.11.90
doi: 10.1586/eri.11.90
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Цао, Ф., Wang, X., Wang, L., Li, Z., Che, J., Wang, L., et al. (2015). Оценка эффективности бактериофага при лечении пневмонии, вызванной множественной лекарственной устойчивостью Klebsiella pneumoniae у мышей. Биомед. Рез. Междунар. 2015:752930. дои: 10.1155/2015/752930
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Cha, K., Oh, H.K., Jang, J.Y., Jo, Y., Kim, W.K., Ha, G.U., et al. (2018). Характеристика двух новых бактериофагов, инфицирующих мультирезистентный (МЛУ) Acinetobacter baumannii , и оценка их терапевтической эффективности in vivo . Фронт. микробиол. 9:696. doi: 10.3389/fmicb.2018.00696
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Чадха П., Катаре О. П. и Чхиббер С. (2017). Нагруженный липосомами фаговый коктейль: повышенный терапевтический потенциал в разрешении опосредованных Klebsiella pneumoniae ожоговых раневых инфекций. Бернс 43, 1532–1543. doi: 10.1016/j.burns.2017.03.029
Бернс 43, 1532–1543. doi: 10.1016/j.burns.2017.03.029
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Чан, Б.К., Систром М., Верц Дж. Э., Кортрайт К. Э., Нараян Д. и Тернер П. Э. (2016). Отбор фагов восстанавливает чувствительность к антибиотикам MDR Pseudomonas aeruginosa . Науч. Респ. 6:26717. дои: 10.1038/srep26717
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Чан Б.К., Тернер П.Е., Ким С., Моджибиан Х.Р., Элефтериадес Дж.А. и Нараян Д. (2018). Фаговая обработка аортального трансплантата, инфицированного Pseudomonas aeruginosa . Эволюция. Мед. Общественное здравоохранение 2018, 60–66. doi: 10.1093/emph/eoy005
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Чанг Р.Ю., Вонг Дж., Матай А., Моралес С., Каттер Э., Бриттон В. и др. (2017). Производство высокостабильных составов фагов, высушенных распылением, для лечения легочной инфекции Pseudomonas aeruginosa . евро. Дж. Фарм. Биофарм. 121, 1–13. doi: 10.1016/j.ejpb.2017.09.002
евро. Дж. Фарм. Биофарм. 121, 1–13. doi: 10.1016/j.ejpb.2017.09.002
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Чанг, Р.Ю.К., Чен К., Ван Дж., Валлин М., Бриттон В., Моралес С. и др. (2018). Доказательство принципа на мышиной модели легочной инфекции антипсевдомонадной активности фага PEV20 в составе сухого порошка. Антимикроб. Агенты Чемотер. 62:e01714–e01717.
Резюме PubMed | Академия Google
Чхиббер, С., Наг, Д., и Бансал, С. (2013). Ингибирование образования биопленки Klebsiella pneumoniae B5055 с использованием молекулы-антагониста железа и бактериофага. ВМС микробиол. 13:174. дои: 10.1186/1471-2180-13-174
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
De Jonge, P.A., Nobrega, F.L., Brouns, SJJ, and Dutilh, B.E. (2018). Молекулярные и эволюционные детерминанты круга хозяев бактериофагов. Trends Microbiol . 7:1352. doi: 10.1016/j.tim.2018. 08.006
08.006
Полнотекстовая перекрестная ссылка | Академия Google
Де Кракер, М.Э., Стюардсон, А.Дж., и Харбарт, С. (2016). Будет ли к 2050 году умирать 10 миллионов человек в год из-за устойчивости к противомикробным препаратам? PLoS Мед. 13:e1002184. doi: 10.1371/journal.pmed.1002184
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Дюфур, Н., Делатр, Р., Рикар, Дж. Д., и Дебарбье, Л. (2017). Лизис патогенной Escherichia coli бактериофагами высвобождает меньше эндотоксина, чем бета-лактамами. клин. Заразить. Дис. 64, 1582–1588. doi: 10.1093/cid/cix184
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Фонг С.А., Дриллинг А., Morales, S., Cornet, M.E., Woodworth, B.A., Fokkens, W.J., et al. (2017). Активность бактериофагов в удалении биопленок изолятов Pseudomonas aeruginosa от больных хроническим риносинуситом. Фронт. Заражение клетки. микробиол. 7:418. doi: 10.3389/fcimb.2017.00418
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Форти, Ф., Роуч, Д. Р., Кафора, М., Пазини, М. Е., Хорнер, Д. С., Фискарелли, Е. В., и соавт. (2018). Разработка коктейля бактериофагов широкого спектра действия, который уменьшает биопленки Pseudomonas aeruginosa и лечит острые инфекции на двух моделях животных. Антимикроб. Агенты Чемотер. 62:e02573–17. doi: 10.1128/AAC.02573-17
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Гарсия-Кинтанилья, М., Пулидо, М. Р., Лопес-Рохас, Р., Пачон, Дж., и Макконнелл, М. Дж. (2013). Новые методы лечения множественной лекарственной устойчивости Acinetobacter baumannii . Тенденции микробиол. 21, 157–163. doi: 10.1016/j.tim.2012.12.002
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Гаджавенд, Х., Эсфахани Б.Н., Хаваи А., Фазели Х., Джафари Р. и Могим С. (2017). Выделение бактериофагов против полирезистентных Acinetobacter baumannii . Рез. фарм. науч. 12, 373–380. дои: 10.4103/1735-5362.213982
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Горски А., Мендзыбродски Р., Лобокка М., Гловацка-Рутковска А., Беднарек А., Борисовски Дж. и соавт. (2018). Фаготерапия: чему мы научились? Вирусы 10:E288.дои: 10.3390/v10060288
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Guo, M., Feng, C., Ren, J., Zhuang, X., Zhang, Y., Zhu, Y., et al. (2017). Новый антимикробный эндолизин, LysPA26, против Pseudomonas aeruginosa . Фронт. микробиол. 8:293. doi: 10.3389/fmicb.2017.00293
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Huys, I., Pirnay, J.P., Lavigne, R., Jennes, S., De Vos, D., Casteels, M., et al.(2013). Прокладывание регуляторного пути для фаговой терапии. Европа должна собрать ресурсы для финансовой, технической и юридической поддержки внедрения фаготерапии. EMBO Rep. 14, 951–954. doi: 10.1038/embor.2013.163
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Кумари С., Харджай К. и Чхиббер С. (2011). Бактериофаг против антимикробных агентов для лечения мышиной ожоговой раневой инфекции, вызванной Klebsiella pneumoniae B5055. J. Med. Микробиол . 60, 205–210. doi: 10.1099/jmm.0.018580-0
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Кусрадзе И., Карумидзе Н., Ригвава С., Двалидзе Т., Кацитадзе М., Амиранашвили И. и др. (2016). Характеристика и тестирование эффективности Acinetobacter baumannii фага vB-GEC_Ab-M-G7 в качестве антибактериального агента. Фронт. микробиол. 7:1590. doi: 10.3389/fmicb.2016.01590
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Каттер, Э., Де Вос Д., Гвасалия Г., Алавидзе З., Гогохия Л., Куль С. и соавт. (2010). Фаготерапия в клинической практике: лечение инфекций человека. Курс. фарм. Биотехнолог. 11, 69–86. дои: 10.2174/138
07401Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Ларпин Ю., Окслин Ф., Морейон П., Реш Г., Энтенза Дж. М. и Манчини С. (2018). In vitro характеристика PlyE146, нового фагового лизина, нацеленного на грамотрицательные бактерии. PLoS ONE 13:e01. doi: 10.1371/journal.pone.01
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Лавернь С., Гамильтон Т., Бисвас Б., Кумарасвами М., Шули Р. Т. и Вутен Д. (2018). Фаговая терапия полирезистентной инфекции Acinetobacter baumannii в месте краниэктомии. Открыть форум Infect. Дис. 5:ofy064. doi: 10.1093/ofid/ofy064
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Лейтнер, Л., Сыбесма В., Чанишвили Н., Годердзишвили М., Чхотуа А., Уджмаджуридзе А. и др. (2017). Бактериофаги для лечения инфекций мочевыводящих путей у пациентов, перенесших трансуретральную резекцию простаты: рандомизированное плацебо-контролируемое двойное слепое клиническое исследование. БМС Урол. 17:90. doi: 10.1186/s12894-017-0283-6
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Liu, Y., Mi, Z., Niu, W., An, X., Yuan, X., Liu, H., et al. (2016). Потенциал литического бактериофага разрушать биопленки Acinetobacter baumannii in vitro . Будущее микробиол. 11, 1383–1393. дои: 10.2217/fmb-2016-0104
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Lood, R., Winer, B.Y., Pelzek, A.J., Diez-Martinez, R., Thandar, M., Euler, C.W., et al. (2015). Новый фаговый лизин, способный убивать полирезистентную грамотрицательную бактерию Acinetobacter baumannii в модели бактериемии у мышей. Противомикробные агенты Chemother. 59, 1983–1991. doi: 10.1128/AAC.04641-14
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Лычак, Ю.Б., Кэннон, С.Л., и Пьер, ГБ (2000). Установление инфекции Pseudomonas aeruginosa : уроки разностороннего оппортуниста. Заражение микробами. 2, 1051–1060. doi: 10.1016/S1286-4579(00)01259-4
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Макконнелл, М. Дж., Актис, Л., и Пачон, Дж. (2013). Acinetobacter baumannii : инфекции человека, факторы, способствующие патогенезу, и животные модели. FEMS микробиол. преп. 37, 130–155. doi: 10.1111/j.1574-6976.2012.00344.x
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Miedzybrodzki, R., Borysowski, J., Weber-Dabrowska, B., Fortuna, W., Letkiewicz, S., Szufnarowski, K., et al. (2012). Клинические аспекты фаготерапии. Доп. Вирус рез. 83, 73–121. doi: 10.1016/B978-0-12-394438-2.00003-7
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Ольшак Т., Зарновец П., Каца В., Данис-Влодарчик К., Аугустыняк Д., Древинек П. и соавт. (2015). In vitro и in vivo антибактериальная активность бактериофагов из окружающей среды против штаммов Pseudomonas aeruginosa у пациентов с муковисцидозом. Заяв. микробиол. Биотехнолог. 99, 6021–6033. doi: 10.1007/s00253-015-6492-6
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
О’Нил, Дж. (2014). Устойчивость к противомикробным препаратам: преодоление кризиса для здоровья и благосостояния наций.Преподобный Антимикроб. Сопротивление . Доступно в Интернете по адресу: http://amr-review.org/
.Parracho, H.M., Burrowes, B.H., Enright, M.C., McConville, M.L., and Harper, D.R. (2012). Роль регулируемых клинических испытаний в разработке бактериофаговой терапии. Дж. Мол. Жене. Мед. 6, 279–286. дои: 10.4172/1747-0862.1000050
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Пелфрен Э., Виллебранд Э., Кавалейру Санчес А., Себрис З.и Кавалери, М. (2016). Бактериофаговая терапия: регуляторная перспектива. J. Антимикроб. Чемотер. 71, 2071–2074. doi: 10.1093/jac/dkw083
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Пэн, С.Ю., Ю, Р.И., Лай, М.Дж., Линь, Н.Т., Чен, Л.К., и Чанг, К.С. (2017). Высокоэффективные антимикробные модифицированные пептиды, полученные из эндолизина LysAB2 фага Acinetobacter baumannii . Науч. Респ. 7:11477. doi: 10.1038/s41598-017-11832-7
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Пирней, Дж.П., Бласдел Б.Г., Бретодо Л., Баклинг А., Чанишвили Н., Кларк Дж.Р. и соавт. (2015). Требования к качеству и безопасности продуктов для устойчивой фаготерапии. Фарм. Рез. 32, 2173–2179. doi: 10.1007/s11095-014-1617-7
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Пирней, Дж. П., Вербекен, Г., Сейссенс, П. Дж., Хюйс, И., Де Вос, Д., Амелут, К., и соавт. (2018). Магистральный фаг. Вирусы 10:E64. дои: 10.3390/v10020064
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Регеймбал, Дж.М., Джейкобс, А.С., Кори, Б.В., Генри, М.С., Томпсон, М.Г., Павличек, Р.Л., и соавт. (2016). Персонализированный терапевтический коктейль диких фагов из окружающей среды спасает мышей от раневых инфекций Acinetobacter baumannii . Антимикроб. Агенты Чемотер. 60, 5806–5816. doi: 10.1128/AAC.02877-15
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Роудс Д. Д., Уолкотт Р. Д., Кусковски М. А., Уолкотт Б. М., Уорд Л. С. и Сулаквелидзе А.(2009). Бактериофаговая терапия венозных язв нижних конечностей у людей: результаты первой фазы исследования безопасности. J. Wound Care 18, 237–238, 240–233. doi: 10.12968/jowc.2009.18.6.42801
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Роуч, Д. Р., Леунг, С. Ю., Генри, М., Морелло, Э., Сингх, Д., Ди Санто, Дж. П., и соавт. (2017). Синергия между иммунной системой хозяина и бактериофагом необходима для успешной фаготерапии против острого респираторного патогена. Микроб-хозяин клетки 22 , 38–47.е34. doi: 10.1016/j.chom.2017.06.018
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Росситто М., Фискарелли Э. В. и Розати П. (2018). Проблемы и перспективы планирования будущих клинических исследований терапии бактериофагами против Pseudomonas aeruginosa при муковисцидозе. Аргументативный обзор. Фронт. микробиол. 9:775. doi: 10.3389/fmicb.2018.00775
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Саркер, С.А., Султана С., Рютелер Г., Мойн Д., Дескомб П., Чартон Ф. и соавт. (2016). Пероральная фаготерапия острой бактериальной диареи двумя препаратами колифага: рандомизированное исследование у детей из Бангладеш. EBioMedicine 4, 124–137. doi: 10.1016/j.ebiom.2015.12.023
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Шули, Р. Т., Бисвас, Б., Гилл, Дж. Дж., Эрнандес-Моралес, А., Ланкастер, Дж., Лессор, Л., и др. (2017). Разработка и применение персонализированных лечебных коктейлей на основе бактериофагов для лечения больного с диссеминированной резистентной инфекцией Acinetobacter baumannii . Антимикробные агенты Chemother . 61: e00954–17. doi: 10.1128/AAC.00954-17
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Шили, Дж. Р., Комфорт, К. К., и Робинсон, Дж. Б. (2017). Иммуногенность и антимикробная эффективность специфического бактериофага Pseudomonas aeruginosa в модели легкого человека in vitro . Заяв. микробиол. Биотехнолог. 101, 7977–7985. doi: 10.1007/s00253-017-8504-1
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Такконелли, Э., Carrara, E., Savoldi, A., Harbarth, S., Mendelson, M., Monnet, D.L., et al. (2018). Открытие, исследование и разработка новых антибиотиков: список приоритетов ВОЗ в отношении устойчивых к антибиотикам бактерий и туберкулеза. Ланцет Infect Dis. 18, 318–327. doi: 10.1016/S1473-3099(17)30753-3
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Тандар, М., Луд, Р., Винер, Б.Ю., Дойч, Д.Р., Эйлер, К.В., и Фишетти, В.А. (2016). Новые сконструированные пептиды фагового лизина как эффективные противомикробные препараты против полирезистентных Acinetobacter baumannii . Противомикробные агенты Chemother. 60, 2671–2679. doi: 10.1128/AAC.02972-15
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Тхилаишвили Т., Ди Лука М., Аббандонато Г., Майоло Э. М., Клатт А. Б., Рейтер М. и соавт. (2018). Оценка в реальном времени антимикробной активности, полученной из бактериофага Т3, в отношении планктона и встроенной в биопленку Escherichia coli с помощью изотермической микрокалориметрии. Рез. Микробиол . doi: 10.1016/j.resmic.2018.05.010. [Epub перед печатью].
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Вахеди А., Даллал М. М. С., Дураги М., Никхахи Ф., Раджаби З., Юсефи М. и др. (2018). Выделение и идентификация специфического бактериофага против энтеропатогенной кишечной палочки (ЕРЕС) и in vitro и in vivo Характеристика бактериофага. FEMS микробиол. Письмо . 365:fny136. doi: 10.1093/femsle/fny136
Полнотекстовая перекрестная ссылка | Академия Google
Вербекен, Г., Pirnay, J.P., Lavigne, R., Jennes, S., De Vos, D., Casteels, M., et al. (2014). Призыв к созданию специальной европейской правовой базы для терапии бактериофагами. Арх. Иммунол. тер. Эксп. 62, 117–129. doi: 10.1007/s00005-014-0269-y
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Вильярроэль, Дж., Ларсен, М.В., Килструп, М., и Нильсен, М. (2017). Метагеномный анализ терапевтических коктейлей фагов PYO с 1997 по 2014 год. Вирусы 9:E328. дои: 10.3390/в
28
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Waters, E.M., Neill, D.R., Kaman, B., Sahota, J.S., Clokie, M.R.J., Winstanley, C., et al. (2017). Фаговая терапия высокоэффективна против хронических легочных инфекций с помощью Pseudomonas aeruginosa . Грудная клетка 72:666. doi: 10.1136/thoraxjnl-2016-209265
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Райт А., Хокинс С. Х., Ангард Э. Э.и Харпер, Д. Р. (2009). Контролируемое клиническое исследование терапевтического препарата бактериофага при хроническом отите, вызванном резистентной к антибиотикам Pseudomonas aeruginosa ; предварительный отчет об эффективности. клин. Отоларингол. 34, 349–357. doi: 10.1111/j.1749-4486.2009.01973.x
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Yan, G., Liu, J., Ma, Q., Zhu, R., Guo, Z., Gao, C., et al. (2017). N-концевой и центральный домен колицина А позволяет лизину фага лизировать Escherichia coli внеклеточно. Антони Ван Левенгук 110, 1627–1635. doi: 10.1007/s10482-017-0912-9
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Инь, С., Хуан, Г., Чжан, Ю., Цзян, Б., Ян, З., Дун, З., и др. (2017). Фаг Abp1 спасает клетки человека и мышей от заражения панрезистентным к лекарственным средствам Acinetobacter baumannii . Клеточная физиол. Биохим. 44, 2337–2345. дои: 10.1159/000486117
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Чжоу, В., Фэн Ю. и Цзун З. (2018). Два новых литических бактериофага семейства myoviridae против резистентного к карбапенемам Acinetobacter baumannii . Фронт. микробиол. 9:850. doi: 10.3389/fmicb.2018.00850
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
границ | Разработка коктейля бактериофагов для сдерживания появления устойчивых к фагам Pseudomonas aeruginosa
Введение
Pseudomonas aeruginosa является распространенным условно-патогенным микроорганизмом, который вызывает инфекции кровотока, мочевыводящих путей, ожоговых ран и является одним из основных патогенов, поражающих дыхательные пути больных муковисцидозом и P.aeruginosa могут быть опасными для жизни (Jonckheere et al., 2018; Waters and Grimwood, 2018). Кроме того, штамма P. aeruginosa часто устойчивы к нескольким классам антибиотиков (Lopez-Causape et al., 2018), а штамма P. aeruginosa является представителем патогенов ESKAPE (Boucher et al., 2009), которые включают шесть патогенов с общепризнанной способностью развивать устойчивость к антибиотикам и вызывать смертельные клинические вспышки. С появлением полирезистентных изолятов P.aeruginosa (Sun et al., 2013; Lopez-Causape et al., 2018), фаготерапия вновь привлекла внимание (Forde and Hill, 2018; Jault et al., 2018; Kortright et al., 2019) и многообещающий альтернативный подход к лечению резистентных инфекций P. aeruginosa (Roach et al., 2017; Waters et al., 2017; Forti et al., 2018; Jault et al., 2018).
Оптимальный фаговый терапевтический агент должен иметь некоторые характеристики: низкая иммуногенность, строго литический образ жизни, отсутствие токсинов или генов, устойчивых к антибиотикам, широкий круг хозяев в отношении множественных изолятов целевого патогена и способность ограничивать появление фагорезистентных мутантов (Pires и другие., 2017; Роде и др., 2018; Кортрайт и др., 2019). Диапазон хозяев при лечении фагами может быть расширен за счет включения в коктейль нескольких фагов с различной специфичностью в отношении диапазона хозяев. Диапазон хозяев и эффективность уничтожения фаговых коктейлей, нацеленных на P. aeruginosa , были изучены in vitro и in vivo (Roach et al., 2017; Forti et al., 2018). Устойчивость к фагам представляет собой несколько более сложную проблему, поскольку бактерии развили ряд различных механизмов для защиты от бактериофагов, включая предотвращение адсорбции фагов и инъекции ДНК, рестрикционные ферменты и системы CRISPR/Cas (Hyman and Abedon, 2010). .Эти механизмы очень эффективны и возникают быстро. Например, коктейль из 6 фагов, составленный против широкого круга хозяев P. aeruginosa , изначально убивал с большой эффективностью. Как и ожидалось, устойчивые к фагам мутанты выросли до высокой плотности in vitro уже после инкубации в течение ночи (Forti et al., 2018). Однако в модели заражения мышей и личинок устойчивых к фаговому коктейлю мутантов не наблюдается (Forti et al., 2018). При использовании животных моделей для оценки эффективности фаговой терапии редко наблюдается фаговая устойчивость, потому что устойчивые мутанты обычно имеют компромисс в отношении приспособленности, или минорные мутанты могут быть уничтожены иммунной системой.Напротив, устойчивость к фагам довольно распространена in vitro (Kortright et al., 2019). Однако в клиниках растет число пациентов, инфицированных полирезистентными бактериями, с ослабленным иммунитетом, таких как больные СПИДом, реципиенты трансплантатов с подавленной иммунной системой, больные диабетом и др. Эти пациенты могут быть не в состоянии избавиться от мелких устойчивых к фагам бактерий, что приведет к неэффективности лечения. Таким образом, появление устойчивости к фагам было вновь подтверждено экспертами в этой области как ключевой вопрос, касающийся осуществимости фаготерапии (Rohde et al., 2018; Кортрайт и др., 2019).
Pseudomonas aeruginosa развивает устойчивость к фагам посредством нескольких механизмов, включая модификацию или потерю О-антигенного компонента липополисахарида (ЛПС) или гликозилирование его пилуса типа IV (Harvey et al., 2018; Shen et al., 2018) . Ранее мы идентифицировали два типа устойчивых к фагам мутантов P. aeruginosa после заражения фагами двухцепочечной ДНК PaP1 или PaoP5 на основе пигментации колоний (рис. 1А). Мутант, обозначенный PAO1r-1, с коричневым фенотипом колонии, содержал крупную хромосомную делецию, включающую гены galU и hmgA , что соответственно приводило к полной потере О-антигена и накоплению характерных коричневых гомогентитических клеток. кислоты, придавая устойчивость к фагам (Le et al., 2014; Шен и др., 2018). Между тем, мутант, обозначенный как PA1RG, с фенотипом белых колоний, содержал мутации wzy , гена биосинтеза ЛПС, что приводило к усеченной структуре О-антигена, а также придавало устойчивость к фагам (Li et al., 2018). Таким образом, кажется, что мутации, приводящие к изменениям в структуре LPS, вероятно, являются основным источником устойчивости к фагам P. aeruginosa . Эти устойчивые к фагам мутанты возникали с общей высокой частотой ∼10 -5 in vitro (Shen et al., 2018) и его следует учитывать при разработке фагового коктейля для возможного использования в клинических условиях.
Рисунок 1. Фаг дцРНК phiYY заражает PAO1r-1 через открытые олигосахариды ядра ЛПС (A) : Фенотип колонии P. aeruginosa устойчивых к фагу мутантов, PAO1r-1 (коричневый) и PAO1w-1 (белый) . (B) : Анализ пятна фага, показывающий, что фаг phiYY дцРНК, но не фаги дцДНК PaP1, PaoP5 и PaP8, инфицирует PAO1r-1. Анализы пятна фага (C, D) и анализы адсорбции фага (E, F) , иллюстрирующие, что phiYY инфицирует и адсорбирует штаммы, производные PAO1, без O-антигена, включая PAO1r-1 и PAO1Δ galU , в то время как фаг dsDNA PaoP5 заражает и адсорбирует штаммы, производные PAO1, с полным O-антигеном, такие как PAO1 и штаммы комплемента galU .( P < 0,05, однофакторный дисперсионный анализ, n = 3).
В этом исследовании был разработан фаговый коктейль, предназначенный для сдерживания появления этих устойчивых к фагам фенотипов у P. aeruginosa . Фаговый коктейль был успешным в том, что он имел более широкий диапазон хозяев по сравнению с панелью из клинических изолятов P. aeruginosa по сравнению с любым из протестированных отдельных фагов и ограничивал появление ранее описанных фенотипов устойчивости к фагам.
Результаты
Фаг phiYY дцРНК инфицирует устойчивый к фагам PAO1r-1 с помощью LPS с открытым ядром
Ранее в П.aeruginosa PAO1, мы идентифицировали два типа мутантов, устойчивых к заражению фагом двухцепочечной ДНК, PaoP5 (рис. 1А). Один из них, PAO1r-1, потерял О-антиген и может быть легко идентифицирован по фенотипу коричневых колоний, вызванному накоплением гомогентизиновых кислот (Shen et al., 2018). Чтобы попытаться идентифицировать фаг, который обходит этот механизм устойчивости и способен убивать PAO1r-1, была исследована панель литических фагов (таблица 1). В то время как PAO1r-1 был устойчив к фагам двухцепочечной ДНК, включая PaP1 (Lu et al., 2013), PaoP5 (Shen et al., 2016) и PaP8 (таблица 1), фаг dsRNA, phiYY, был способен лизировать PAOr-1 и образовывать прозрачные бляшки (рис. 1B).
Таблица 1. Бактериальные штаммы и фаги, использованные в этом исследовании.
Как указывалось выше, PAO1r-1 несет делецию в galU и, следовательно, лишен О-антигенного компонента ЛПС, оставляя основные олигосахариды ЛПС открытыми на поверхности клетки (Choudhury et al., 2005; Le et al., 2014). Соответственно, phiYY, вероятно, использует основной олигосахарид ЛПС вместо О-антигена в качестве рецептора для инициации инфекции (рис. 2).Поскольку PAO1r-1 содержит крупную хромосомную делецию, мутант, содержащий нарушение одного гена galU (PAO1Δ galU ), а также штаммы комплемента, восстанавливающие galU в обоих генетических фонах (PAO1r-1:: galU и PAO1Δ галлона :: галлона ), исследовали на чувствительность к phiYY и PaoP5. Как показано на фиг. 1C, phiYY лизировал PAO1r-1 и PAO1Δ galU , но не убивал комплементированные штаммы galU , что указывает на то, что потеря galU делает возможной инфекцию phiYY.Напротив, PaoP5 заразил PAO1, PAO1r-1:: galU и PAO1Δ galU :: galU , но не мутант PAO1Δ galU (рис. 1D), что указывает на то, что потеря galU предотвращает 9005 PaoP5.
Рисунок 2. Гликоформы ЛПС на поверхности штаммов P. aeruginosa . PAO1 дикого типа образует LPS с OSA-кепкой, CPA-capped и uncapped LPS. PAO1Δ wzy имеет только одну копию типично повторяющейся сахарной единицы О-антигена.PAO1Δ galU не имеет О-антигена, что обнажает незакрытое ядро. PAO1Δ PA5455 содержит только GlcNAc вместо полноразмерного CPA. PAO1Δ migA не имеет L-Rha и D-Glc, обычно наблюдаемых на незакрытом ядре. d-ManNAc3NAcA: ди-N-ацетилированная маннуроновая кислота; D-FucNAc: d-2-амино-2,6-дидезоксигалактоза-ацетамидо; D-Rha: D-рамноза; L-Rha: L-рамноза; D -Glc: D -глюкоза; D-GalN-L-Ala: d-галактозамин-1-аланил; L-D-Hep: L-глицеро-d-манно-гептоза; Kdo: 3-дезокси-d-манно-окт-2-улозоновая кислота; GlcNAc: глюкоза-ацетамидо.
Для дальнейшего исследования связывания этих фагов с бактериальными штаммами использовали анализ адсорбции фагов. phiYY адсорбируется на PAO1r-1 и PAO1Δ galU с высокой эффективностью, но не может связываться с PAO1 или штаммами комплемента galU (рис. 1E). Между тем, фаг PaoP5 эффективно адсорбируется на PAO1 и комплементарных штаммах galU , но не на PAO1r-1 или PAO1Δ galU (рис. 1F). Вместе эти данные убедительно указывают на то, что рецептор для phiYY представляет собой основной олигосахарид, тогда как рецептор для PaoP5 представляет собой О-антиген.Следовательно, phiYY может инфицировать мутантов P. aeruginosa , лишенных О-антигена, которые возникают после инфицирования связывающими О-антиген фагами, такими как PaoP5.
Обучение фага двухцепочечной ДНК PaoP5 для заражения белых мутантов укороченным LPS
Ранее мы идентифицировали PA1RG, мутант P. aeruginosa PA1, устойчивый к фагу двухцепочечной ДНК, PaP1, с фенотипом белых колоний (Li et al., 2018). Этот штамм несет мутацию C595T в wzy , полимеразе O-антигена B-диапазона, что приводит к укороченному O-антигену только с одной копией нормально повторяющейся сахарной единицы (рис. 2).
В этом исследовании мы выделили устойчивые к 5 фагам мутанты PAO1 с фенотипом белых колоний. Три из этих пяти изолятов имели мутации wzy , что было обнаружено секвенированием по Сэнгеру ПЦР-фрагмента, амплифицированного из изолятов. Два мутанта имели мутацию a wzy C736G, а третий, обозначенный PAO1w-1, содержал мутацию wzy C1075T, которая приводила к преждевременному стоп-кодону.
PAO1w-1 обладал высокой устойчивостью к фагам PaP1, PaoP5, PaP8 и phiYY (рис. 3А).Чтобы попытаться изолировать мутантный фаг, способный эффективно инфицировать PAO1w-1, 10 7 бляшкообразующих единиц (БОЕ) PaoP5 смешивали с PAO1w-1, и десятки мутантных фагов, которые преодолели резистентность и лизировали PAO1w-1, были наблюдаемый. Были отобраны, очищены и секвенированы пять мутантных фагов (таблица 2). Все 5-фаговые изоляты, которые сломали устойчивость к PAO1w-1, содержали мутацию A715C в orf75 , которая, вероятно, была ответственна за расширенный диапазон хозяев (рис. 3B). orf75 расположен между геном хвостового отростка и геном базовой пластинки.Хотя он не аннотирован blastp, Orf75 был идентифицирован как структурный белок с помощью SDS-PAGE и высокоэффективной жидкостной хроматографии-масс-спектрометрии (Shen et al., 2016). Таким образом, продукт orf75 , скорее всего, представляет собой рецептор-связывающий белок, связанный с диапазоном хозяев.
Рис. 3. Фаг PaoP5-m1 способен инфицировать устойчивых к фагу P. aeruginosa мутантов с укороченными структурами О-антигена. (A) Анализ пятен фага, который показывает PaoP5-m1, но не PaoP1, PaoP5, PaP8 и phiYY, эффективно инфицирует PAO1w-1. (B) PaoP5-m1-5 содержит мутацию A715C в orf75 . PaoP5-m1 эффективно инфицирует (C) и адсорбирует (D) на всех штаммах, происходящих от PAO1, с полной или укороченной структурой О-антигена. (E) Анализ пятен фага показывает, что пять дополнительных мутантов P. aeruginosa , отобранных по устойчивости к двухцепочечной ДНК фага PaoP5, чувствительны к PaoP-m1.
Таблица 2. Праймеры, использованные в этом исследовании.
Один из 5 мутантных фагов, обозначенный как PaoP5-m1, был выбран для дальнейшего исследования.Интересно, что в отличие от родительского штамма PaoP5, который не инфицировал PAO1w-1 или инактивацию одного гена wzy (PAO1Δ wzy ), PaoP5-m1 был способен адсорбировать и инфицировать все штаммы, производные PAO1. независимо от наличия полноразмерного или укороченного О-антигена (рис. 3C,D). Чтобы протестировать диапазон хозяев PaoP5-m1 на большей панели устойчивых к PaoP5 мутантов, мы отобрали 30 белых колоний, выживших после инфекции PaoP5, в 3 биологических повторах. Поразительно, что PaoP5-m1 заразил все собранные белые мутанты (рис. 3E), что указывает на то, что PaoP5-m1 является превосходным фагом для элиминации P.aeruginosa с укороченными структурами О-антигена.
Интересно, что аналогичное обучение фагам не смогло создать мутантный фаг, инфицирующий PAO1r-1, несущий полное отсутствие О-антигена (данные не показаны). Вероятно, это связано с тем, что структуры О-антигена и сердцевинных олигосахаридов весьма различны по сравнению со структурными различиями между полноразмерным и укороченным О-антигеном (Lam et al., 2011). Таким образом, хотя фаговые мутанты могут быстро адаптироваться к укороченной структуре рецептора, они не могут адаптироваться к совершенно новой структуре рецептора за такой короткий период времени (Schwartz and Lindell, 2017).
Создание пятифазного коктейля с широким кругом хозяев
Поскольку генотипы и фенотипы, представленные PAO1r-1 и PAO1w-1, представляют собой два основных типа устойчивых мутантов, которые возникли после обработки P. aeruginosa фагом двухцепочечной ДНК , phiYY и PaoP5-m1 были включены в коктейль из 5 фагов. разработан для сдерживания возникновения резистентности во время фаготерапии P. aeruginosa. В дополнение к phiYY и PaoP5-m1 в фаговый коктейль были включены родительский фаг PaoP5-m1, PaoP5 и 2 дополнительных фага двухцепочечной ДНК с широким кругом хозяев (PaP1 и PaP8).Эффективность этого коктейля при уничтожении P. aeruginosa была исследована на панели штаммов, которая включала типовые штаммы PAO1 и PA1, устойчивые к фагам мутанты PAO1-r-1 и PAO1-w-1, а также 19 штаммов . P. aeruginosa клинических изолятов из семи китайских больниц (Yang et al., 2016). Чтобы максимально разнообразить панель, 19 клинических изолятов были отобраны на основе различного типирования методом Eric-PCR (Khosravi et al., 2016; Yang et al., 2016): два штамма были выбраны из кластеров 1, 4 и 5, в то время как один штамм был выбран из каждого из оставшихся 13 типизирующих кластеров (рис. 4).
Рисунок 4. EOP отдельных фагов или коктейль из 5 фагов на панели из 23 штаммов P. aeruginosa . Эффективность уничтожения каждого штамма фага и смеси определяли с помощью анализа EOP. (+) = ЕОР 1; (±) = ЭОП 0,1–0,01; (–/+) = ЭОП 0,001; (–) = ЭОП < 0,0001. Для клинических изолятов P. aeruginosa в столбце «Изолировано из» указана больница, в которой был выделен штамм: SW, SouthWest Hospital; ДП, больница Дапин; XQ, больница СиньЦяо; туалет, Западно-китайская больница; SC, Народная больница провинции Сычуань; XJ, больница Сицзин; HN, Народная больница провинции Хэнань.
Эффективность посева (EOP) каждого фага и смеси из 5 фагов измеряли на панели из 23 штаммов P. aeruginosa (рис. 4). EOP является более точным, чем простой точечный анализ бляшек для определения чувствительности к фагам и круга хозяев, поскольку фаговый лизат серийно разводят, чтобы свести к минимуму влияние других противомикробных агентов, таких как лизин, в лизате (Forti et al., 2018). Интересно, что phiYY смог убить 12 штаммов на панели, однако EOP был низким.У каждого фага был свой диапазон хозяев, и ни один отдельный фаг не лизировал все штаммы в панели. Как и ожидалось, коктейль из 5 фагов имел самый широкий круг хозяев и высокие значения EOP.
Коктейль Phage ингибирует рост бактерий в жидких культурах и биопленках
Чтобы проверить влияние отдельных фагов или смеси фагов на жидкую культуру P. aeruginosa и предоставить более подробную информацию о кинетике лизиса каждой обработки, культуры PAO1 или PA1 были инфицированы каждым фагом или смесью, а оптическую плотность (OD 600 ) контролировали в течение 5 ч (рис. 5А).Для PA1, чувствительного к PaP1, добавление PaP1 приводило к снижению OD 600 PA1 в течение 1 ч после заражения. Между тем, заражение PaP8 не оказывало существенного влияния на OD 600 по сравнению с контролем без фага, что, вероятно, связано с низкой эффективностью заражения PaP8 против PA1, как показано выше на рисунке 4. В PAO1 инфекция фагом PaoP5 вызывала снижение OD 600 через 1–2 часа после заражения, а PaP8 может убивать и ингибировать рост PAO1, на что указывает относительно стабильная OD 600 .При обработке коктейлем из 5 фагов OD 600 культур PAO1 и PA1 снижалась примерно через 1 ч после инфицирования фагом, что указывает на то, что фаговый коктейль эффективен при лизисе жидких культур штаммов P. aeruginosa и это было сделано в те же сроки, что и испытание с одиночными эффективными фагами.
Рисунок 5. Влияние смеси из 5 фагов на жидкие культуры и биопленки P. aeruginosa. (A) Кинетика роста P.aeruginosa в жидкой культуре в присутствии или в отсутствие отдельных штаммов фагов или смеси фагов. (B) Разрушение биопленок P. aeruginosa отдельными штаммами фагов или смесью фагов. ( P < 0,05, однофакторный дисперсионный анализ, n = 3). Звездочками отмечены значения P <0,05, рассчитанные с помощью теста Стьюдента t между двумя группами.
Способность фагов уменьшать биопленки, образованные P. aeruginosa PA1 или PAO1, исследовали с помощью окрашивания кристаллическим фиолетовым.После 24-часового образования биопленки штаммами P. aeruginosa на 96-луночных планшетах фаги наносили индивидуально или в коктейле из 5 фагов. Планшеты инкубировали в течение 4 часов, после чего биопленки окрашивали кристаллическим фиолетовым. Заражение фаговым коктейлем вызвало значительное снижение биомассы биопленки как PA1, так и PAO1 (рис. 5B), и устранило биопленки с несколько более высокой эффективностью по сравнению с заражением с использованием одного эффективного фага.
Фаговый коктейль ингибирует развитие фагорезистентных бактерий в краткосрочной перспективе
Чтобы определить, подавляет ли коктейль из 5 фагов появление устойчивых к фагам мутантов, P.aeruginosa PAO1 или PA1 смешивали с одним фагом или смесью фагов. При обработке одним фагом ОП 600 PAO1 и PA1 претерпевала первоначальное снижение в течение первых нескольких часов. Однако оба штамма повторно выросли до высоких плотностей через 12–24 ч инкубации, скорее всего, за счет роста устойчивых к фагам мутантов. С другой стороны, при обработке коктейлем из 5 фагов ОП 600 обоих штаммов оставалась низкой даже после 48 ч инкубации (рис. 6).Эти данные убедительно показывают, что коктейль из 5 фагов не только эффективно убивает P. aeruginosa , но также предотвращает появление устойчивых к фагам мутантов in vitro .
Рисунок 6. Коктейль из 5 фагов на короткое время сдерживает устойчивые к фагам мутанты. Кинетика роста P. aeruginosa PA1 и PAO1 в жидких культурах в присутствии или отсутствии отдельных штаммов фагов или смеси фагов в течение 48 часов.
После длительного воздействия фагового коктейля появляются устойчивые изоляты с мутациями в
migA и wzyЧтобы проверить, появилась ли резистентность к коктейлю из 5 фагов через более длительный период времени, P.aeruginosa PAO1, содержащая фаговую смесь, инкубировали еще 7 дней без добавления свежей питательной среды (фиг. 7А). Во всех трех повторностях плотность бактерий, наконец, начала увеличиваться примерно через 5 дней (OD 600 = 0,5~1,1), что указывает на развитие устойчивости к фаговому коктейлю. Эти культуры высевали на LB-агар и из каждой чашки выделяли по две колонии (табл. 3). Исследовали EOP каждого выбранного мутанта, и все шесть изолятов действительно были устойчивы ко всем фагам в коктейле, поскольку не образовывались бляшки.Чтобы определить генетическую причину устойчивости к фагам, эти шесть изолятов и PAO1 дикого типа подвергли секвенированию всего генома. Данные секвенирования показали, что все 6 изолятов содержали мутации как в wzy , так и в migA (таблица 3).
Рисунок 7. Устойчивость к коктейлю из 5 фагов возникает через 7 дней и требует мутаций в wzy и migA. (A) Кинетика роста P. aeruginosa PAO1 в жидкой культуре в присутствии фагового коктейля в течение 7 дней.Было выполнено три биологических повтора. (B) Анализ пятен фага, показывающий, что устойчивый к фаговому коктейлю мутант S1-1 и двойной мутант PAO1Δ wzy Δ migA устойчивы к заражению PaoP5-m1, в то время как одногенные нарушения PAO1Δ wzy и PAO1Δ migA чувствительны к PaoP5-m1.
Таблица 3. Мутации, обнаруженные у устойчивых к фаговому коктейлю мутантов.
Многие P. aeruginosa одновременно синтезируют несколько форм липополисахарида (рис. 2).К ним относятся кэпированные сердечные гликоформы О-антиген-специфического (OSA) и общего полисахаридного антигена (CPA), а также некэпированные сердечники. Фермент, кодируемый migA , отвечает за перенос L-рамнозы на глюкозу II полисахарида сердцевины и необходим для синтеза непокрытой сердцевины. Так, у мутанта migA отсутствует остаток L-рамнозы на непокрытых ядрах (Kocincova et al., 2012), а у мутанта wzy отсутствует OSA, и он продуцирует ЛПС «ядро + 1» (Li et al., 2018). Представленные здесь данные секвенирования предполагают, что для устойчивости к фаговому коктейлю необходимы мутации как в wzy , так и в migA . Как и ожидалось, хотя и PAO1Δ wzy , и PAO1Δ migA были чувствительны к PaoP5-m1, двойной мутант PAO1Δ wzy Δ migA был устойчив к PaoP5-m1 (рис. 7B). Эти данные предполагают, что PaoP5-m1 может использовать в качестве рецепторов либо коровый антиген, либо OSA.
Среди шести отобранных изолятов, устойчивых к коктейлю из 5 фагов, четыре имели дополнительные мутации.Эти мутации локализованы в генах gmd, rmd или PA5455 (табл. 3), все три из которых участвуют в синтезе ЦПК (Lam et al., 2011; Hao et al., 2013). Эти мутации с меньшей вероятностью связаны с устойчивостью к фаговому коктейлю, наблюдаемой у этих штаммов, поскольку двойной мутации PAO1Δ wzy Δ migA было достаточно, чтобы придать устойчивость к фаговому коктейлю.
Обсуждение
Pseudomonas aeruginosa представляет собой условно-патогенный микроорганизм, который представляет серьезную угрозу для здоровья, особенно для пациентов с муковисцидозом или травматическими ожогами, а также для лиц с ослабленным иммунитетом. P. aeruginosa является мастером устойчивости к антибиотикам с внутренней устойчивостью к нескольким лекарствам за счет низкой проницаемости мембраны и экспрессии эффлюксных насосов, а также обладает замечательной способностью мутировать и горизонтально приобретать дополнительные признаки, ведущие к множественной лекарственной устойчивости (МЛУ) и обширной -резистентные (XDR) штаммы (Lopez-Causape et al., 2018). С появлением этих фенотипов, которые серьезно ограничивают текущие возможности лечения, фаговая терапия снова исследуется как потенциальное терапевтическое средство.Однако фаготерапия до сих пор не получила широкого распространения из-за проблем с законодательством и отсутствия надлежащих клинических испытаний и исследований эффективности. Что касается фаговых агентов, то одним из основных препятствий для успешной фаговой терапии является быстрое появление устойчивых к фагам мутантов (Rohde et al., 2018).
Совместная эволюция фагов и их хозяев является обычным явлением в естественной среде, а мутация и модификация рецепторов и рецептор-связывающих белков как фагами, так и их хозяевами хорошо изучены как основной механизм этого классического феномена Красной Королевы (Peterson et al. др., 2010). Действительно, одним из основных механизмов устойчивости к фагам у P. aeruginosa являются модификации молекул ЛПС, экспонированных на клеточной поверхности. Поскольку мутантные фаги с расширенным или измененным кругом хозяев могут быть выделены путем обучения фагам и служить дополнительными компонентами терапевтического коктейля фагов для предотвращения появления устойчивых к фагам мутантов, целью этого исследования было дальнейшее охарактеризовать устойчивые к фагам мутанты фага. P. aeruginosa , провести обучение фагов для выделения фагов, разрушающих эти устойчивые фенотипы, и разработать фаговый коктейль, эффективный для сдерживания развития устойчивых к фагам P.aeruginosa во время лечения.
Мутантный штамм PAO1r-1, полученный из P. aeruginosa PAO1, был устойчив к фагам двухцепочечной ДНК, но восприимчив к заражению фагом двухцепочечной РНК, phiYY (рис. 1). Это связано с тем, что PAO1r-1 содержит большую делецию, включающую galU , что приводит к укороченному LPS с обнаженными олигосахаридами ядра. phiYY, по-видимому, использует эти основные олигосахариды в качестве рецептора инфекции (рис. 1). Дополнительным подтверждением этой гипотезы является тот факт, что phiYY не инфицировал и не адсорбировал родительский штамм полным ЛПС или комплементарными штаммами PAO1r-1:: galU или PAO1Δ galU::galU (рис. 1). .
ФагиdsRNA представляют собой уникальную группу фагов, которые относятся к семейству Cystoviridae (Mantynen et al., 2018). В настоящее время существует только 7 секвенированных фагов дцРНК, и phiYY является единственным, который инфицирует патоген человека (Yang et al., 2016), в то время как остальные 6 фагов дцРНК инфицируют Pseudomonas syringae . phi6 является первым выделенным фагом дцРНК и служит отличной моделью для изучения биологии фага дцРНК (Bamford et al., 1987), в то время как наше исследование продемонстрировало антимикробный потенциал фага дцРНК phiYY, который элиминирует коричневые мутанты после заражения фаги дцДНК.Более того, коричневые мутанты также часто обнаруживаются у пациентов с муковисцидозом с хроническими инфекциями P. aeruginosa , что позволяет предположить, что коричневые мутанты могут лучше выживать при хронической инфекции (Smith et al., 2006; Hocquet et al., 2016). Таким образом, дцРНК-фаг phiYY может быть эффективным агентом для уничтожения коричневых мутантов при хронических инфекциях P. aeruginosa , что требует дальнейшего изучения.
Между тем, мутации в другом локусе, участвующем в продукции LPS, wzy , привели к образованию устойчивых к фагам мутантов в P.aeruginosa PA1, которые экспрессируют укороченный LPS «ядро + 1» только с одним повтором трисахаридной части О-антигена. Подобные устойчивые к фагам мутанты wzy были получены в этом исследовании из генетического фона PAO1 (рис. 3). Фаговая подготовка PaoP5 генерировала мутантные фаги, способные преодолевать устойчивость, обеспечиваемую PAO1 мутацией wzy , содержащейся в PAO1w-1, включая изолят фага PaoP5-m1 (рис. 3). PaoP5-m1 содержит мутацию orf75 и был способен адсорбироваться и инфицировать PAO1 и все протестированные мутанты wzy , которые возникли после инфицирования PAO1 PaoP5 (рис. 3).Коэволюция фаг-хозяин может расширить круг хозяев фагов и повысить устойчивость эволюционировавших бактерий (Paterson et al., 2010). Таким образом, мутантные фаги с расширенным или измененным кругом хозяев могут быть выделены путем обучения фагам и служить вспомогательными компонентами фагового коктейля для устранения фагорезистентных бактерий. Однако аналогичный подход к обучению фагов не смог произвести фаг, который мог бы сломать фенотип устойчивости PAO1r-1, вероятно, потому, что открытые олигосахариды ядра LPS PAO1r-1 слишком структурно отличаются от полноразмерного LPS.
Был создан коктейль из 5 фагов, содержащий три фага P. aeruginosa с широким кругом хозяев (PaP1, PaoP5, PaP8), а также два фага, способных нарушать описанный выше механизм устойчивости к фагу P. aeruginosa (phiYY и PaoP5-m1). Этот фаговый коктейль исследовали на панели из штаммов P. aeruginosa , включая два лабораторных штамма, имеющих отношение к данному исследованию (PAO1 и PA1), устойчивые к фагам мутанты, описанные выше (PAO1r-1 и PAO1w-1), и 19 клинических штаммов. изоляты, которые были выбраны для представления 15 типирующих кластеров Eric-PCR.Фаговый коктейль смог заразить и убить около 90% протестированных штаммов, что выше, чем каждый из компонентов коктейля по отдельности, и сделал это с повышенными значениями EOP (рис. 4). Фаговый коктейль был эффективен для уничтожения штаммов P. aeruginosa в жидких культурах и биопленках, а также в твердых средах (рис. 5). В то время как фаговый коктейль был эффективен в сдерживании появления устойчивых к фагам мутантов в течение временных рамок, используемых для разработки устойчивых к фагам мутантов, описанных выше, расширенная инкубация до 5-7 дней привела к росту мутантов, устойчивых к коктейлю.Все изолированные мутанты, устойчивые к коктейлю, имели мутации как в wzy , так и в migA . Это развитие резистентности, требующее мутаций во множестве локусов, является классической иллюстрацией динамики Красной Королевы.
В естественной среде динамика коэволюции фаг-хозяин была описана как отбор флуктуаций гонки вооружений. Интересно отметить, что это исследование, несмотря на включение phiYY и PaoP5-m1, двух фагов, нацеленных на два основных типа устойчивых к фагам мутантов в P.aeruginosa значительно ограничивали появление устойчивых к фагам мутантов, мутанты, несущие двойные или тройные генные мутации, в том числе wzy и migA , в конечном итоге появлялись после 5 дней инкубации. Таким образом, лучшее понимание механизма эволюции этих мутантов даже после длительной инкубации важно для разработки лучшей стратегии фаготерапии и требует дальнейшего изучения.
Экспериментальные процедуры
Бактериальные штаммы, фаги и условия культивирования
Бактериальные штаммы и фаги в этой работе перечислены в Таблице 1.Штаммы P. aeruginosa выращивали на бульоне Луриа-Бертани (LB) при 37°C. При необходимости использовали гентамицин (50 мкг/мл) или тетрациклин (35 мкг/мл) в конечных концентрациях в бульоне LB, как описано ниже. Для полного удаления бактерий фаги дцДНК обрабатывали хлороформом, а фаги дцРНК многократно фильтровали через фильтры 0,22 мкм (Millipore), поскольку phiYY чувствителен к хлороформу. Для создания фагового коктейля 5 фагов с одинаковым титром смешивали до конечного титра 10 9 БОЕ/мл.
Отбор фагорезистентных мутантов
Процесс выделения устойчивых к фагам мутантов и расчета частоты устойчивости подробно описан ранее (Shen et al., 2018). PAO1r-1 был ранее выделен, протестирован и секвенирован (Shen et al., 2018). Чтобы выделить производный от PAO1 мутант белого фенотипа PAO1w-1, PAO1 инфицировали PaoP5 и немедленно высевали на чашки с агаром LB на 24 часа. Затем были выделены белые мутанты. Ген wzy подвергали ПЦР-амплификации с праймерами, перечисленными в таблице 2, и продукты ПЦР секвенировали для идентификации сайта мутации в wzy .
Конструирование штаммов
P. aeruginosaНокаут и комплементацию galU и wzy проводили, как описано ранее (Le et al., 2014; Li et al., 2018). Вкратце, для комплементации galU в PAO1r-1 и PAO1Δ galU ген galU подвергали ПЦР-амплификации с использованием праймеров galU-CF и galU-CR, а продукт ПЦР расщепляли с помощью Bam HI/ Pst I и клонировали в Bam HI/ Pst I, расщепленную плазмидой pUCP24, с образованием pucp- galU .Затем pucp- galU подвергали электропорации в PAO1r-1 или PAO1Δ galU . Метод выборки был применен для дополнения wzy в PAO1w-1 и PAO1Δ wzy с праймерами Wzy-C-F и Wzy-CR.
Для инсерционной делеции wzy в PAO1 и PAO1Δ migA фрагмент внутри wzy амплифицировали с праймерами Wzy-KF и Wzy-KR, а продукт ПЦР расщепляли с помощью Bam HI/ Eco RI, и клонировали в плазмиду pEX18Gm, расщепленную Bam HI/ Eco RI, с получением плазмиды pEX- wzy .Затем pEX- wzy подвергали электропорации в PAO1 или PAO1Δ migA для получения инсерционного мутанта.
Анализ адсорбции бактериофагов
Анализ адсорбции бактериофагов с различными штаммами P. aeruginosa был проведен в соответствии с ранее описанным протоколом (Le et al., 2014). Вкратце, бактериальные культуры логарифмической фазы собирали и ресуспендировали в бульоне LB с OD 600 0,5. Затем добавляли фаг при MOI 0,01 и проводили адсорбцию при 37°C в течение 5 мин.Затем отбирали пробы объемом 1 мл и центрифугировали при 16 000 × 90 004 g 90 005 в течение 1 мин. Супернатант фильтровали с использованием фильтров с размером пор 0,22 мкм (Millipore). Затем определяли титр фага в супернатанте (t1) и в исходном запасе фагов (t0) с использованием анализа двойного посева на агар. Скорость адсорбции фага рассчитывали как (t0-t1)/t0. Значения скорости адсорбции, показанные на гистограмме, представляют собой средние значения, а стандартные отклонения представляют собой планки погрешностей для трех биологических повторностей.
Анализ EOP и анализ пятна фага
EOP каждого изолята фага и смеси из 5 фагов на P.aeruginosa определяли в соответствии с ранее описанным протоколом (Forti et al., 2018). По 5 мкл серийных 10-кратных разведений фага наносили на двухслойные агаровые чашки, на которые в верхний мягкий агар наносили специфического бактериального хозяина. Количество бляшек, наблюдаемое после инкубации в течение ночи, сравнивали с количеством, полученным на чувствительном штамме PAO1, PA1 или PAO1r-1. Анализ пятна фага аналогичен анализу EOP. Смешайте 200 мкл бактериальной культуры с 4 мл мягкого агара и вылейте в чашку с агаром.Затем капните 1 мкл фага на мягкий агар и наблюдайте за образованием налета после инкубации в течение ночи.
Выделение и секвенирование мутантных фагов PaoP5
Процесс обучения фагов устойчивости к разрушению был описан ранее (Le et al., 2013). Вкратце, ~10 7 БОЕ фага PaoP5 смешивали с 200 мкл логарифмической фазы штамма P. aeruginosa PAO1 (OD 600 = 0,5) и высевали в двухслойный планшет. Десятки бляшек появились после ночного культивирования.Пять прозрачных бляшек были выбраны случайным образом и перенесены в среду LB. После серийных 10-кратных разведений анализ бляшек повторяли с 10 мкл каждого разведения для получения четко разделенных бляшек. Эту же процедуру повторяли дважды для очистки каждого мутантного фага. После очистки мутантного фага геномную ДНК экстрагировали, как описано ранее (Le et al., 2013). Впоследствии всю область, кодирующую структурные белки (от Orf62 до Orf 88), амплифицировали с помощью ПЦР с использованием праймеров, указанных в таблице 2.Затем ампликоны ПЦР очищали и секвенировали с использованием технологии Сэнгера. Сайт мутации определяли по данным бластного секвенирования генома PaoP5 (инвентарный номер GeneBank KU297675).
Эксперимент по разрушению биопленки
Окрашивание кристаллическим фиолетовымиспользовали для мониторинга разрушения биопленки (Forti et al., 2018). Ночную культуру P. aeruginosa разводили до 0,02 OD 600 в бульоне LB в 96-луночных полистироловых титрационных микропланшетах, которые затем инкубировали при 37°C в течение 24 часов.Бульон удаляли и лунки промывали 200 мкл LB. Затем добавляли 200 мкл LB или LB, содержащего фаг или смесь фагов, и инкубировали в течение 4 ч при 37°C. Затем применяли окрашивание кристаллическим фиолетовым, как описано ранее (Forti et al., 2018). Было выполнено три биологических повтора.
Отбор мутантов, устойчивых к фаговому коктейлю
100 мкл фагового коктейля добавляли в 5 мл экспоненциальной фазы PAO1 (OD 600 = 0,2). Культуру инкубировали при 37°С в течение 7 дней при встряхивании и контролировали OD 600 .
Секвенирование бактериального генома
Бактериальная геномная ДНК была выделена из шести мутантов, устойчивых к фаговому коктейлю и PAO1 дикого типа, с использованием набора для выделения бактериальной геномной ДНК на колонке UNlQ-10 (Sangon Biotec), а затем секвенирована с использованием платформы Illumina Hiseq 2500 (~1 Гбит/с). образец). Fastp (Chen et al., 2018) использовался для обрезки адаптера и фильтрации качества после демультиплексирования необработанных чтений. Мутации идентифицировали в чистых ридах с использованием Breseq (Barrick et al., 2014) с PAO1 (доступ в GenBank: NC_002516.2) в качестве эталонного генома. Данные последовательности доступны в архиве NCBI Sequence Read Archive под регистрационным номером SRA PRJNA517283.
Статистический анализ
Статистический анализ проводили с использованием однофакторного дисперсионного анализа или теста Стьюдента t . Значение P <0,05 считалось статистически значимым.
Заявление о доступности данных
В этом исследовании были проанализированы общедоступные наборы данных.Эти данные можно найти здесь: Архив чтения последовательностей NCBI под регистрационным номером SRA PRJNA517283.
Вклад авторов
SL и FH задумали исследование. YY, WS и QZ провели эксперименты. QC, KX, XJ и JW проанализировали данные. SL, XH и JB написали рукопись. Все авторы прочитали и одобрили окончательный вариант рукописи для публикации.
Финансирование
Это исследование было поддержано Национальным фондом естественных наук Китая (NSFC, 31870167 до SL) и NIH/NIDCR F32-DE026947 (JB).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Каталожные номера
Бамфорд Д.Х., Романчук М. и Сомерхарью П.Дж. (1987). Слияние мембран у прокариот: мембрана бактериофага phi 6 сливается с наружной мембраной Pseudomonas syringae. EMBO J. 6, 1467–1473. дои: 10.1002/j.1460-2075.1987.tb02388.x
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Баррик, Дж. Э., Колберн, Г., Дезеридж, Д. Э., Траверс, К. С., Стрэнд, М. Д., и Борхес, Дж. Дж. (2014). Выявление структурных вариаций в гаплоидных микробных геномах по данным повторного секвенирования с коротким считыванием с использованием breseq. BMC Genomics 15:1039. дои: 10.1186/1471-2164-15-1039
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Буше, Х. В., Талбот, Г.Х., Брэдли Дж. С., Эдвардс Дж. Э., Гилберт Д. и Райс Л. Б. (2009). Плохие жуки, никаких лекарств: нет ESKAPE! обновление от общества инфекционных заболеваний Америки. клин. Заразить. Дис. 48, 1–12. дои: 10.1086/595011
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Чоудхури, Б., Карлсон, Р.В., и Голдберг, Дж.Б. (2005). Структура липополисахарида из мутанта galU Pseudomonas aeruginosa серогруппы-O11. Углеводы.Рез. 340, 2761–2772. doi: 10.1016/j.carres.2005.09.017
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Форти Ф., Роуч Д. Р., Кафора М., Пазини М. Э., Хорнер Д. С. и Фискарелли Э. В. (2018). Разработка коктейля бактериофагов широкого спектра действия, который уменьшает биопленки Pseudomonas aeruginosa и лечит острые инфекции на двух моделях животных. Антимикроб. Агенты Чемотер. 62:e02573-17.
Академия Google
Хао Ю., King, JD, Huszczynski, S., Kocincova, D., and Lam, JS (2013). Пять новых генов важны для биосинтеза общего полисахаридного антигена в Pseudomonas aeruginosa . mBio 4, e631–e612.
Академия Google
Харви, Х., Бонди-Деноми, Дж., Маркиз, Х., Штанко, К.М., Дэвидсон, А.Р., и Берроуз, Л.Л. (2018). Pseudomonas aeruginosa защищает от фагов посредством гликозилирования ворсинок IV типа. Нац. микробиол. 3, 47–52.doi: 10.1038/s41564-017-0061-y
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Хокке Д., Петижан М., Ромер Л., Валот Б., Куласекара Х. Д. и Бедель Э. (2016). Pyomelanin-продуцирующая Pseudomonas aeruginosa , отобранная во время хронических инфекций, имеет большую хромосомную делецию, которая придает устойчивость к пиоцинам. Окружающая среда. микробиол. 18, 3482–3493. дои: 10.1111/1462-2920.13336
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Джейкобс, М.А., Алвуд А., Тайписуттикул И., Спенсер Д., Хауген Э. и Эрнст С. (2003). Полная библиотека мутантов транспозонов Pseudomonas aeruginosa . Проц. Натл. акад. науч. США 100, 14339–14344. doi: 10.1073/pnas.2036282100
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Jault, P., Leclerc, T., Jennes, S., Pirnay, J.P., Que, Y.A., and Resch, G. (2018). Эффективность и переносимость коктейля бактериофагов для лечения ожоговых ран, инфицированных Pseudomonas aeruginosa (PhagoBurn): рандомизированное контролируемое двойное слепое исследование фазы 1/2. ЛанцетИнфект.Дис. 19, 35–45. doi: 10.1016/s1473-3099(18)30482-1
Полнотекстовая перекрестная ссылка | Академия Google
Jonckheere, L., Schelstraete, P., Van Simaey, L., Van Braeckel, E., Willekens, J., and Van Daele, S. F. (2018). Установление диагноза хронической колонизации Pseudomonas aeruginosa пациентов с муковисцидозом: сравнение европейских критериев консенсуса с генотипированием изолятов P. aeruginosa. J.Cyst.Fibrosis 17, 729–735.doi: 10.1016/j.jcf.2018.03.004
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Хосрави А.Д., Ховейзави Х., Мохаммадиан А., Фарахани А. и Дженаби А. (2016). Генотипирование полирезистентных штаммов Pseudomonas aeruginosa , выделенных из ожоговых и раневых инфекций методом ERIC-PCR. Acta Cir.Bras. 31, 206–211. дои: 10.1590/S0102-865020160030000009
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Кочинцова Д., Остлер, С.Л., Андерсон, Э.М., и Лам, Дж.С. (2012). Гены рамнозилтрансферазы migA и wapR регулируются дифференциальным образом, чтобы модулировать количество основных гликоформ олигосахаридов, продуцируемых Pseudomonas aeruginosa . J. Бактериол. 194, 4295–4300. doi: 10.1128/JB.05741-11
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Кортрайт, К. Э., Чан, Б. К., Кофф, Дж. Л., и Тернер, П. Э. (2019). Фаготерапия: новый подход к борьбе с устойчивыми к антибиотикам бактериями. Микроб-хозяин клетки 25, 219–232. doi: 10.1016/j.chom.2019.01.014
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Лам, Дж. С., Тейлор, В. Л., Ислам, С. Т., Хао, Ю., и Кочинкова, Д. (2011). Генетическое и функциональное разнообразие липополисахарида Pseudomonas aeruginosa . Фронт.Микробиол. 2:118. doi: 10.3389/fmicb.2011.00118
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Ле С., Хе С. С., Тан Ю.Л., Хуанг Г.Т., Чжан Л., Люкс Р. и соавт. (2013). Картирование хвостового волокна как рецептор-связывающего белка, ответственного за дифференциальную специфичность хозяина Pseudomonas aeruginosa бактериофагов PaP1 и JG004. PloS один 8:8. doi: 10.1371/journal.pone.0068562
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Ле С., Яо С., Лу С., Тан Ю., Рао С. и Ли М. (2014). Делеция хромосомной ДНК придает устойчивость к фагам Pseudomonas aeruginosa . науч. респ. 4, 4738. doi: 10.1038/srep04738
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Ли Г., Шен М., Ян Ю., Ле С., Ли М. и Ван Дж. (2018). Адаптация Pseudomonas aeruginosa к хищничеству фага PaP1 посредством мутации полимеразы O-антигена. Фронт.Микробиол. 9:1170. doi: 10.3389/fmicb.2018.01170
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Лопес-Косапе, К., Кэбот, Г., Дель Баррио-Тофино, Э.и Оливер, А. (2018). Универсальный мутационный резистом Pseudomonas aeruginosa . Фронт.Микробиол. 9:685. doi: 10.3389/fmicb.2018.00685
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Лу, С.Г., Ле, С., Тан, Ю.Л., Чжу, Дж.М., Ли, М., и Рао, X.C. (2013). Геномный и протеомный анализ терминально избыточного генома Pseudomonas aeruginosa Phage PaP1: установление рода PaP1-подобных фагов. PloS One 8:13.doi: 10.1371/journal.pone.0062933
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Лу, С., Ле, С., Ли, Г., Шен, М., Тан, Ю., и Чжао, X. (2015). Полная последовательность генома Pseudomonas aeruginosa PA1, выделенного от пациента с инфекцией дыхательных путей. Объявление генома. 3:e01453-15.
Академия Google
Мантинен С., Сандберг Л. Р. и Поранен М. М. (2018). Распознавание шести дополнительных цистовирусов: вирус Pseudomonas phi6 больше не является единственным видом семейства цистовирусов. Арх. Вирол. 163, 1117–1124. doi: 10.1007/s00705-017-3679-4
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Патерсон, С., Фогвилл, Т., Баклинг, А., Бенмайор, Р., Спирс, А. Дж., и Томсон, Н. Р. (2010). Антагонистическая коэволюция ускоряет молекулярную эволюцию. Природа 464, 275–278. doi: 10.1038/nature08798
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Пирес, Д. П., Мело, Л., Вилас, Боас Д., Силланкорва, С.и Азередо, Дж. (2017). Фаговая терапия как альтернативная или дополнительная стратегия профилактики и контроля инфекций, связанных с биопленками. Курс. мнение микробиол. 39, 48–56. doi: 10.1016/j.mib.2017.09.004
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Роуч, Д. Р., Леунг, С. Ю., Генри, М., Морелло, Э., Сингх, Д., и Ди Санто, Дж. П. (2017). Синергия между иммунной системой хозяина и бактериофагом необходима для успешной фаготерапии против острого респираторного патогена. Микроб-хозяин клетки 22, 38.e–47.e.
Академия Google
Роде, К., Реш, Г., Пирней, Дж. П., Бласдел, Б. Г., Дебарбье, Л., и Гельман, Д. (2018). Мнение экспертов по трем темам, связанным с фаговой терапией: устойчивость к бактериальным фагам, обучение фагам и профаги в бактериальных производственных штаммах. Вирусы 10:E178.
Академия Google
Шварц, Д. А., и Линделл, Д. (2017). Генетические препятствия ограничивают гонку вооружений между Prochlorococcus и инфицирующими их T7-подобными подовирусами. Исме Дж. 11, 1836–1851. doi: 10.1038/ismej.2017.47
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Шен М., Чжан Х., Шен В., Цзоу З., Лу С. и Ли Г. (2018). Pseudomonas aeruginosa MutL способствует образованию больших хромосомных делеций за счет негомологичного соединения концов для предотвращения хищничества бактериофагов. Рез. нуклеиновых кислот. 46, 4505–4514. doi: 10.1093/nar/gky160
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Шен, М.Ю., Ле С., Джин С. Л., Ли Г., Тан Ю. Л. и Ли М. (2016). Характеристика и сравнительный геномный анализ Pseudomonas aeruginosa Phage PaoP5: новые представители, относящиеся к PAK_P1-подобным вирусам. науч. респ. 6, 6. doi: 10.1038/srep34067
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Smith, E.E., Buckley, D.G., Wu, Z.N., Saenphimmachak, C., Hoffman, L.R., and D’Argenio, D.A. (2006). Генетическая адаптация Pseudomonas aeruginosa к дыхательным путям пациентов с муковисцидозом. Проц. Натл. акад. науч. США 103, 8487–8492.
Резюме PubMed | Академия Google
Sun, FJ, Shi, H.Q., Zhang, X.B., Fang, Y.D., Chen, YC, and Chen, J.H. (2013). Обнаружение генов, кодирующих карбапенемазы, среди клинических изолятов Pseudomonas aeruginosa в китайском ожоговом отделении. J. Burn Care Res. 34, 453–458. doi: 10.1097/BCR.0b013e3182700afd
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Уотерс, Э.M., Neill, D.R., Kaman, B., Sahota, J.S., Clokie, M.R.J., Winstanley, C., et al. (2017). Фаговая терапия высокоэффективна против хронических легочных инфекций с помощью Pseudomonas aeruginosa . Грудная клетка 72, 666–667. doi: 10.1136/thoraxjnl-2016-209265
Резюме PubMed | Полный текст перекрестной ссылки | Академия Google
Ян, Ю. Х., Лу, С. Г., Шен, В., Чжао, X., Шен, М. Ю., и Тан, Ю. Л. (2016). Характеристика первого двухцепочечного РНК-бактериофага, инфицирующего Pseudomonas aeruginosa . науч. респ. 6, 8.
Академия Google
Ингаляционная фаготерапия для лечения острых легочных инфекций, вызванных Pseudomonas aeruginosa
Abstract
Pseudomonas aeruginosa ( Psa ) легочные инфекции все труднее поддаются лечению из-за развития устойчивости к антибиотикам; бактериофаги (фаги) являются частью предусмотренных дополнительных/альтернативных методов лечения. В этом исследовании мы разработали фаговый коктейль для доставки в дыхательные пути и оценили его доклиническую эффективность и устойчивость к аэрозолизации.
Фаговый коктейль был протестирован против эталонной панели из 43 штаммов Psa , опубликованной в 2013 году. Его эффективность оценивалась in vivo на мышиной модели острой легочной инфекции Psa , полученной путем легочной инокуляции. Через два часа после заражения смесь фагов доставляли легочным путем; терапевтический ответ контролировали по выживаемости животных и количеству бактерий в легких. Наконец, фаговую суспензию распыляли с помощью 4 различных распылителей; Жизнеспособность аэрозольных фагов оценивали после сбора аэрозоля.
Фаговый коктейль показал эффективность 95% in vitro на эталонной панели. После легочного введения инфицированным мышам он обеспечил 90% выживаемость через 48 часов (по сравнению с 0% у необработанных животных) и снижение количества бактерий в легких. Исследование аэрозольного распыления показало, что распыление через сетку было менее вредным для фагов с жизнеспособностью 33,4% против 29,6% и 7,7% для ультразвукового и струйного распыления соответственно. Анализ суспензий фагов до и после распыления с помощью трансмиссионной электронной микроскопии показал, что потеря титра фага была вызвана механическим разрушением капсидов и хвостов.
В заключение мы разработали фаговый коктейль, эффективный против Psa , in vitro и in vivo . Кроме того, его распыление было связано с 1/3 жизнеспособности фага, что позволяло доставить большую дозу фагов. Оптимизация препарата и устройства может помочь улучшить стабильность фага.
Сноски
Цитируйте эту статью как: European Respiratory Journal 2018 52: Suppl. 62, PA2649.
Это реферат Международного конгресса ERS.Полнотекстовой версии нет. Дополнительные материалы, сопровождающие этот реферат, могут быть доступны на сайте www.ers-education.org (доступ только для членов ERS).
- Copyright © the authors 2018
Бактериофаговая терапия вентилятор-ассоциированной пневмонии и эмпиемы, вызванной Pseudomonas aeruginosa аденокарцинома доли с забором медиастинального узла.
Ее прошлый медицинский анамнез был значительным из-за курения 60 пачек в год и реакций гиперчувствительности на несколько антибиотиков (пенициллины, цефалоспорины, триметоприм-сульфаметоксазол и макролиды).
Удаление опухоли макроскопически завершено, межреберный катетер (ICC) с подводным уплотнением оставлен in situ . На вторые сутки после операции у пациентки было повышено количество лейкоцитов (18,1 × 10 9 /л) и С-реактивного белка (263 мг/л), развилась сильная плевритная боль в грудной клетке.Усиливающийся респираторный дистресс и сонливость (оценка комы Глазго 9) на 3-й день потребовали интубации, и >1,5 л содержимого желудка было аспирировано через орогастральный зонд. Рентген грудной клетки (CXR) показал коллапс/консолидацию в правой нижней доле, и пациенту было начато внутривенное введение моксифлоксацина и метронидазола по поводу предполагаемой аспирационной пневмонии. Были отмечены уровень прокальцитонина 25,7 мкг/мл и острое повреждение почек (оценочная скорость клубочковой фильтрации 32 мл/мин/1,73 м 2 ).
На 6-й день рентгенограмма подтвердила сохраняющуюся консолидацию правого легкого, но пневмоторакса не было, и ее ICC был удален. Культуры мокроты, взятые в день интубации (день 3), показали умеренный чистый рост P. aeruginosa , чувствительных к пиперациллин-тазобактаму, ципрофлоксацину и меропенему. Лихорадка поднялась до 38°C на 6-й день, и ее режим антибиотикотерапии был изменен на внутривенное введение меропенема по 1 г три раза в день.
Пациент страдал продолжающейся лихорадкой и прогрессирующим инфильтратом на рентгенограмме с явной паренхиматозной полостью в присутствии персистирующих культур P.aeruginosa из образцов мокроты и БАЛ (рис. 1). Количество лейкоцитов у нее оставалось повышенным, а персистирующий бронхоплеврокожный свищ в месте ИКК, приводивший к дальнейшей гипоксии и усугубляющемуся пневмотораксу, потребовал повторной установки плеврального дренажа на 11-й день.
После недели внутривенного введения меропенема не было клинических признаков других очагов инфекции, а посев крови почти ежедневно оставался отрицательным. Компьютерная томограмма грудной клетки на 13-й день продемонстрировала неоднородную консолидацию обоих легких (правое больше, чем левое) с множественными кавитациями и обширной подкожной эмфиземой правой грудной стенки с продолжающейся утечкой воздуха из предполагаемой бронхоплевральной фистулы (рис. 2).Пациент был оценен как слишком плохой для дальнейшего хирургического вмешательства. Ее течение осложнилось развитием плотного правостороннего гемипареза с признаками острого ишемического инсульта левой задней мозговой артерии при визуализации головного мозга.
На 16-й день пациент оставался в критическом состоянии с сохраняющейся лихорадкой, несмотря на антибактериальную терапию. При повторном БАЛ, гнойном отделяемом месте ICC и прямых мазках из плевральной полости культивировали P. aeruginosa , которые теперь были устойчивы к меропенему, имипенему и пиперациллин-тазобактаму in vitro (рис. 1).Меропенем был отменен, и она начала внутривенное введение ципрофлоксацина и гентамицина. Обзор инфекционных заболеваний в это время отметил тяжелое бремя легочных заболеваний с поражением плевры и развитием последовательной антибиотикорезистентности при терапии. AB-PA01 (AmpliPhi Biosciences Corporation), фаговый продукт четырех облигатно литических бактериофагов (два Myoviridae и два Podoviridae , каждый с концентрацией ∼1 × 10 9 бляшкообразующих единиц/мл) (10), полученный в в специализированном центре надлежащей производственной практики, было показано, что он обладает высокой активностью в отношении всех нескольких изолятов, представленных в AmpliPhi Biosciences для тестирования на чувствительность.Изоляты из пяти отдельных образцов были секвенированы (Paired-End 150 п.н.; Illumina NextSeq) и идентифицированы как ST875 (редко регистрируемый клональный тип, представляющий собой серотип 6). Все пять образцов различались на 34 SNP или менее, при этом наибольшее генетическое расстояние соответствовало двум наиболее удаленным во времени образцам, что соответствовало одному инфекционному штамму.
С информированного согласия и под эгидой Исследовательского комитета по этике человека нашего учреждения и Схемы специального доступа Австралийского управления терапевтических товаров, AB-PA01 был начат в качестве дополнительной терапии с 23-го дня.Ввиду отсутствия данных, гарантирующих нам, что для лечения дыхательных путей и грудной клетки будет достаточно любого пути, внутривенно (1 мл AB-PA01 в 100 мл физиологического раствора) и через небулайзер (4 мл AB-PA01, неразбавленный) фаги вводят два раза в день. В течение 3 дней оксигенация пациента улучшилась, седация была прекращена. На 27-й день (4-й день фаговой терапии) ее последний изолят P. aeruginosa из плевральной жидкости (собранный до начала фаготерапии) продемонстрировал устойчивость к фторхинолонам.Применение ципрофлоксацина было прекращено, а десенсибилизация цефтолозаном/тазобактамом началась на 28-й день, хотя в это время в записях пациента было зафиксировано, что пациент добился «заметного прогресса за последнюю неделю»: Sa O2 теперь составляет 90% на 2 л. /мин O 2 через назальные канюли.
Терапия бактериофагами была прекращена через 7 дней, и пациент был переведен из отделения интенсивной терапии в отделение интенсивной терапии. Она завершила 6-недельный курс внутривенного введения цефтолозана/тазобактама по 1,5 г три раза в день внутривенно, что не увеличивалось с улучшением функции почек, и мы отмечаем, что в настоящее время проводятся испытания, чтобы определить, требуется ли 3 г три раза в день при пневмонии (Clinicaltrials.gov NCT02387372). Она была выписана из больницы в учреждение по уходу за престарелыми примерно через 11 недель после ее первоначальной госпитализации без признаков инфекции. Ее последней положительной культурой P. aeruginosa был скудный рост из мокроты, взятой на 4-й день терапии бактериофагами (за 1 день до начала лечения цефтолозаном/тазобактамом), и после этого она оставалась отрицательной культурой, в том числе через 6 месяцев после завершения AB-PA01. терапия.
Это первый задокументированный случай клинического применения бактериофаговой терапии для лечения обширной, некротизирующей легочной псевдомонадной инфекции.Терапия бактериофагами, назначаемая в качестве дополнительной терапии к внутривенным антибиотикам, хорошо переносилась, побочных эффектов не было выявлено ни во время терапии, ни в последующем. В сочетании с противомикробными препаратами терапия бактериофагами была связана с разрешением инфекции и с очевидной эрадикацией колонизации Pseudomonas . Произошла ли бы успешная деколонизация в отсутствие лечения фагами, неясно, но кажется маловероятным, учитывая степень заболевания и последовательное развитие устойчивости к противомикробным препаратам, несмотря на соответствующую терапию (включая устойчивые к гентамицину изоляты, мокрота, собранная на 13-й день).





 Кожная симптоматика проявляется в виде пятен Рота, узелков Ослера и кровоизлияний. Увеличивается селезенка.
Кожная симптоматика проявляется в виде пятен Рота, узелков Ослера и кровоизлияний. Увеличивается селезенка.