Лечение силикоза: Лечение силикоза, особенности протекания профессионального заболевание легких
Лечение силикоза, особенности протекания профессионального заболевание легких
Силикоз входит в ряд профессиональных заболеваний органов дыхания. Это одна из разновидностей пневмокониозов, возникает от длительного вдыхания производственной пыли с содержанием высокой дозы свободной двуокиси кремния.
Виды и причины заболевания
Выявляется патологическое состояние преимущественно у работников горнодобывающие и металлообрабатывающие промышленности. Вредному воздействию фиброгенной кварцевой пыли подвергаются изготовители стекла, керамики, работники сталелитейной промышленности, пескоструйщики, резчики камня, стеклодувы, шахтеры, забойщики и проходчики.
Опасность представляют небольшие, до 3-5 нм микрочастицы кварца, кристобалита. Когда допустимая концентрация вредных веществ в воздухе превышена, происходит оседание мелкодисперсной пыли на бронхах и альвеолах легких.
По скорости развития разделяют несколько видов болезни:
- острая;
- хроническая;
- прогрессирующая;
- ускоренный вид.
Какую форму принимает патология, зависит от времени воздействия промышленной пыли, ее интенсивности, общего состояния организма и наличия сопутствующих заболеваний. Клинико-морфологические формы силикоза определяют как:
- узелковые;
- рассеянно-склеротические;
- комбинированные.
Острая форма фиброза прогрессирует даже после прекращения контакта с пылью. В целом лечение дает благоприятный прогноз.
Силикоз легких, симптомы
Длительное время болезнь никак не проявляет себя. Характерные признаки заболевания обнаруживаются значительно позже. К симптоматике фиброза легких относятся:
- диффузионная дыхательная недостаточность;
- сухой кашель постепенно переходит в мокрый с обилием мокротических выделений;
- колющая боль в загрудинной области;
- жесткое дыхание;
- сухие хрипы;
- ощущение нехватки воздуха;
- тахикардия;
- цианоз.

Поздние стадии осложняются бронхитом, астмой, пневмонией, туберкулезом, пневмотораксом, ревматоидным артритом, раком легких.
Лечение и профилактические меры
Для выявления патологических процессов на ранних стадиях проводятся профилактические медицинские осмотры на производстве. Выполняется рентгенодиагностика легких. Ряд исследовательских тестов на определение функции внешнего дыхания облегчают постановку диагноза. К ним относится спирометрия, пикфлоуметрия, пневмотахография, газоанализ внешнего дыхания. Много информации дают компьютерная томография и МРТ легких.
Если диагностируется силикоз, лечение назначает врач-пульмонолог или терапевт. Важно незамедлительно прекратить контакт с вредными веществами. Пациенту рекомендована белковая диета, прием витаминов и физиотерапия. Эффективны кислородные ингаляции и дыхательные упражнения. Проводится санация бронхиального дерева с применением антисептического раствора. Курение сильно усложняет терапевтические мероприятия и увеличивает риск осложнений. Необходимо отказаться от этой привычки. При тяжелых формах силикоза возможна трансплантация легких.
Необходимо отказаться от этой привычки. При тяжелых формах силикоза возможна трансплантация легких.
Мероприятия по лечению и профилактике проводятся в условиях стационара или в специальных профилакториях. Для предотвращения болезни рабочим на вредных производствах предоставлены индивидуальные и общие средства защиты. Регулярно проводятся профилактические медосмотры.
Страница не найдена |
Страница не найдена |404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Фев
Мар
Апр
Май
Июн
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
причины, симптомы, диагностика и лечение
Силикоз – профзаболевание, характеризующееся развитием тяжелого пневмофиброза вследствие продолжительного вдыхания пыли с высоким содержанием свободной двуокиси кремния. Симптоматика носит прогрессирующий характер: одышка сначала возникает при нагрузке, затем и в покое, периодическое покашливание сменяется постоянным кашлем, усиливается боль в груди, в поздних стадиях развивается легочно-сердечная недостаточность. Решающими критериями диагностики служат данные профессионального анамнеза в сочетании с типичными рентгенологическими признаками силикоза. Лечебные мероприятия включают бронхоальвеолярный лаваж, медикаментозную терапию, оксигенотерапию; в отдельных случаях – трансплантацию легких.
Симптоматика носит прогрессирующий характер: одышка сначала возникает при нагрузке, затем и в покое, периодическое покашливание сменяется постоянным кашлем, усиливается боль в груди, в поздних стадиях развивается легочно-сердечная недостаточность. Решающими критериями диагностики служат данные профессионального анамнеза в сочетании с типичными рентгенологическими признаками силикоза. Лечебные мероприятия включают бронхоальвеолярный лаваж, медикаментозную терапию, оксигенотерапию; в отдельных случаях – трансплантацию легких.
Общие сведения
Силикоз – форма пневмокониоза, развивающаяся при вдыхании и осаждении в легких фиброгенной пыли, содержащей кристаллический диоксид кремния (кремнезем). Наибольшее распространение силикоз получил в конце XIX — первой половине XX в.в. в связи с бурным развитием горнорудной промышленности, станко- и машиностроения, где рабочие подвергались воздействию пыли, содержащей свободную двуокись кремния. В настоящие дни заболевание уходит в прошлое, хотя занятость в отдельных отраслях производства по-прежнему связана с повышенным риском заболеваемости силикозом. В результате силикоза развивается массивный легочный фиброз, который может прогрессировать даже после прекращения воздействия фиброгенной пыли. Клиническим изучением силикоза занимается пульмонология и профпатология.
В результате силикоза развивается массивный легочный фиброз, который может прогрессировать даже после прекращения воздействия фиброгенной пыли. Клиническим изучением силикоза занимается пульмонология и профпатология.
Силикоз
Причины силикоза
Силикоз возникает вследствие вдыхания частиц свободного диоксида кремния в кристаллической форме, главным образом, кварцевой пыли, реже — кристобалита и тридимита. Силикоз может являться профессиональным заболеваниям для следующих отраслей производства: горнорудное дело (добыча полезных ископаемых из пород, содержащих кварц), машиностроение и металлургия, изготовление стекла, керамики, фарфора и др. Чаще других силикозом болеют шахтеры, проходчики, рабочие литейных цехов, пескоструйщики, стеклодувы, резчики по камню, гончары. У шахтеров может возникать смешанное заболевание, вызванное воздействием кварцевой и угольной пыли – силикоантракоз.
Скорость развития заболевания, распространенность и тяжесть поражения зависит от стажа работы, условий труда, интенсивности пылевого воздействия, индивидуальных свойств организма. От начала работы на вредном производстве до выявления силикоза может пройти от 3-5 до 15-20 лет. Существенное значение имеет размер пылевых частиц – для проникновения в альвеолы и межуточную ткань диаметр пылинок должен составлять менее 5 мкм. Обсуждается несколько теорий патогенеза силикоза. Наиболее ранняя из них – механическая объясняет патологические изменения механическим повреждением легочной ткани мелкодисперстной пылью. Согласно токсико-химической теории, кварцевая пыль растворяется в тканях с выделением кремниевой кислоты, оказывающей цитотоксическое действие. Однако эти и другие теории не могут до конца объяснить всех аспектов патогенеза.
От начала работы на вредном производстве до выявления силикоза может пройти от 3-5 до 15-20 лет. Существенное значение имеет размер пылевых частиц – для проникновения в альвеолы и межуточную ткань диаметр пылинок должен составлять менее 5 мкм. Обсуждается несколько теорий патогенеза силикоза. Наиболее ранняя из них – механическая объясняет патологические изменения механическим повреждением легочной ткани мелкодисперстной пылью. Согласно токсико-химической теории, кварцевая пыль растворяется в тканях с выделением кремниевой кислоты, оказывающей цитотоксическое действие. Однако эти и другие теории не могут до конца объяснить всех аспектов патогенеза.
В настоящее время наибольшей популярностью пользуется иммунологическая теория развития силикоза. В ней особое значение придается фагоцитозу кварцевых частиц альвеолярными макрофагами. Поглощенные частицы кремния вызывают повреждение лизосомальных мембран с выходом в цитоплазму ферментов и гибель макрофагов. Высвободившиеся из погибших клеток частицы кремния повторно захватываются другими макрофагами, снова и снова приводя к гибели фагоцитов. Одновременно при разрушении макрофагов в легочную ткань выделяются биологически активные вещества, среди которых — липоидный фиброгенный фактор, стимулирующий образование силикотических узелков. Кроме этого, адсорбируясь на поверхности легких, кремниевые пылинки изменяют свойства белковых частиц, в результате чего последние приобретают аутоантигенные свойства. В качестве аутоантигенов также могут выступать погибшие легочные макрофаги. Роль иммунного фактора в генезе силикоза позволяет некоторым авторам рассматривать это заболевание в ряду коллагенозов.
Одновременно при разрушении макрофагов в легочную ткань выделяются биологически активные вещества, среди которых — липоидный фиброгенный фактор, стимулирующий образование силикотических узелков. Кроме этого, адсорбируясь на поверхности легких, кремниевые пылинки изменяют свойства белковых частиц, в результате чего последние приобретают аутоантигенные свойства. В качестве аутоантигенов также могут выступать погибшие легочные макрофаги. Роль иммунного фактора в генезе силикоза позволяет некоторым авторам рассматривать это заболевание в ряду коллагенозов.
Классификация
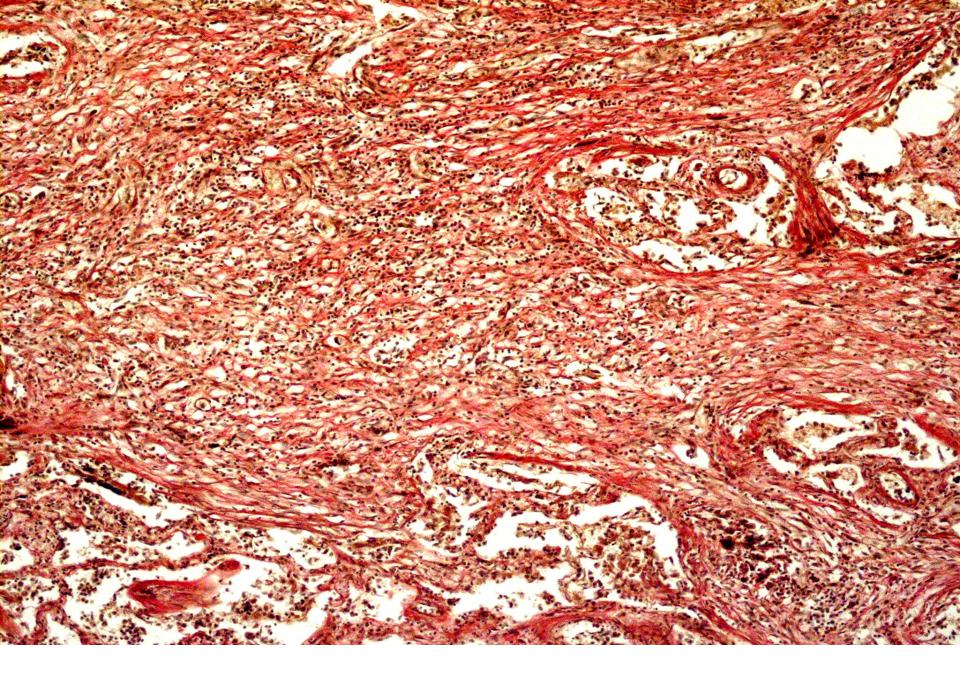
Различают три основные клинико-морфологические формы силикоза – узелковую, диффузно-склеротическую и смешанную. При узелковой форме силикоза в легких формируются силикотические гранулемы, представленные пучками соединительной ткани. Гранулемы могут располагаться концентрически или вихреобразно, иногда сливаются в крупный узел (узловая или опухолевидная форма силикоза). Узелки могут подвергаться некротическим изменениям и при прорыве в бронх образовывать силикотические каверны. Диффузно-склеротическая форма протекает с развитием межальвеолярного, периваскулярного и перибронхиального фиброза; формированием бронхоэктазов, эмфиземы, плевральных шварт. При смешанной форме силикоза на фоне распространенного склероза выявляются узелковые гранулемы.
Диффузно-склеротическая форма протекает с развитием межальвеолярного, периваскулярного и перибронхиального фиброза; формированием бронхоэктазов, эмфиземы, плевральных шварт. При смешанной форме силикоза на фоне распространенного склероза выявляются узелковые гранулемы.
Силикоз может протекать в острой, хронической (классической), прогрессирующей, ускоренной форме. Острый силикоз развивается при массивном воздействии кремниевой пыли в сроки менее 2-х лет. Протекает бурно с сильнейшей одышкой, общими симптомами (слабостью, потерей веса). Хронический силикоз обычно дает о себе знать через 15 и более лет после контакта с кремнеземом. Развивается асимптомно, исподволь, а усиление одышки и кашля часто списывается на другие заболевания или естественный процесс старения. Протекает в форме узелкового фиброза.
Для прогрессирующего массивного фиброза характерна усиленная одышка, кашель с мокротой, рецидивирующие гнойные бронхиты, выраженные нарушения легочной вентиляции. Типичными осложнениями данной формы силикоза служат пневмоторакс, туберкулез, легочное сердце. Ускоренный вариант силикоза возникает через 5-10 лет контакта с кварцевой пылью. Клинические проявления схожи с хронической формой, однако прогрессируют быстрее. Часто сочетается с микобактериальной инфекцией, аутоиммунными заболеваниями (склеродермией).
Типичными осложнениями данной формы силикоза служат пневмоторакс, туберкулез, легочное сердце. Ускоренный вариант силикоза возникает через 5-10 лет контакта с кварцевой пылью. Клинические проявления схожи с хронической формой, однако прогрессируют быстрее. Часто сочетается с микобактериальной инфекцией, аутоиммунными заболеваниями (склеродермией).
Симптомы силикоза
В большинстве случаев заболевание развивается постепенно, при этом субъективные клинические симптомы силикоза появляются позднее рентгенологических изменений в легких. На основании клинико-рентгенологических признаков выделяют три стадии силикоза.
На I стадии одышка присутствует только в условиях физического напряжения, больного беспокоит периодический сухой кашель, умеренные покалывающие боли в груди. Рентгенологически определяется усиление легочного рисунка, начальные признаки эмфиземы.
II стадия силикоза сопровождается одышкой при минимальной нагрузке, надсадным кашлем, постоянными болями в грудной клетке. Выслушиваются сухие рассеянные хрипы, жесткое дыхание. На снимках выявляются узелковые элементы, плевральные наслоения, буллезная эмфизема.
Выслушиваются сухие рассеянные хрипы, жесткое дыхание. На снимках выявляются узелковые элементы, плевральные наслоения, буллезная эмфизема.
На последней, III стадии силикоза одышка становится постоянной (в т. ч. в покое), беспокоит кашель с мокротой, кровохарканье, тахикардия; выявляется цианоз лица. В поздних стадиях развивается легочная гипертензия и сердечно-легочная недостаточность. Рентгенологические признаки включают массивный пневмофиброз, эмфизему, ателектазы, смещение средостения.
Течение силикоза часто отягощается обструктивным бронхитом, бронхиальной астмой, бактериальной пневмонией, бронхоэктатической болезнью, спонтанным пневмотораксом, раком легких. В случае осложнения силикоза суставным синдромом говорят о силикоартрите. В 30-80% случаев развивается туберкулез, что приводит к смешанной форме заболевания — силикотуберкулезу. Возможно одновременное сочетание силикоза, туберкулеза и ревматоидного артрита. Причиной гибели больных может послужить как сопутствующее заболевание, так и декомпенсация легочного сердца.
Диагностика
Достоверность диагноза «силикоз» подтверждается после уточнения профессионального маршрута, проведения рентгендиагностики, исследования ФВД, консультаций пациента профпатологом и пульмонологом. Аускультативные данные пестрые: над разными участками легкого может выслушиваться жесткое, ослабленное, бронхиальное дыхание, сухие трескучие и влажные хрипы, шум трения плевры.
Основными рентгенологическими признаками силикоза служат силикотические узелки – мелкоочаговые тени округлой формы размером от 1 до 10 мм, расположенные в верхних легочных полях; дополнительными – эмфизема, сетчатая или ячеистая структура легочного рисунка, утолщение плевры. КТ легких высокого разрешения или МСКТ обладают более высокой чувствительностью. Данные спирографии выявляют смешанные нарушения легочной вентиляции (снижение ЖЁЛ, ОФВ1, пробы Тиффно и др.). Контролировать динамику развития силикоза позволяет исследование газов крови, пульсоксиметрия. У некоторых пациентов выявляются антиядерные антитела, С-реактивный белок, положительный ревматоидный фактор.
У некоторых пациентов выявляются антиядерные антитела, С-реактивный белок, положительный ревматоидный фактор.
Дифдиагностику силикоза следует осуществлять с саркоидозом, гемосидерозом, антракозом, асбестозом, милиарным туберкулезом, метастатическим раком легкого, гранулематозом Вегенера, грибковыми поражениями легких. Отличить силикоз от перечисленных заболеваний помогает дополнительный комплекс исследований (анализ мокроты, бронхоскопия, туберкулиновая проба, ПЭТ и КТ грудной клетки).
Лечение силикоза
Радикальные методы лечения силикоза не разработаны. При подтверждении диагноза первоочередной мерой должно стать прекращение контакта с кварцевой пылью. Назначается белковое и витаминизированное питание, лечебная гимнастика, ходьба на расстояние. Основной целью терапии является торможение прогрессирования фиброзных изменений, предупреждение и устранение осложнений.
В части случаев лечение начинают с тотального бронхоальвеолярного лаважа – эта методика помогает снизить общее пылевое загрязнение легких. При быстром прогрессировании силикоза используются кортикостероидные гормоны (преднизолон). Положительный эффект отмечается от ингаляций протеолитических ферментов, улучшающих бронхиальную проходимость, и гиалуронидазы, увеличивающей проницаемость тканей для используемых медикаментов.
При быстром прогрессировании силикоза используются кортикостероидные гормоны (преднизолон). Положительный эффект отмечается от ингаляций протеолитических ферментов, улучшающих бронхиальную проходимость, и гиалуронидазы, увеличивающей проницаемость тканей для используемых медикаментов.
В комплексную терапию силикоза включаются бронхолитики (беротек, сальбутамол), отхаркивающие, антигистаминные средства, оксигенотерапия. В случае присоединения туберкулезного процесса показано лечение у фтизиатра. Меры физиотерапевтической реабилитации включают ультразвук, УФО, электрофорез, дыхательную гимнастику, санаторно-курортное лечение. Больным силикозом необходим категорический отказ от курения, профилактическая вакцинация против гриппа, пневмококка. При тяжелом, быстро прогрессирующем легочном фиброзе единственным спасением может служить трансплантация легких.
Прогноз и профилактика
Своевременно распознанный, неосложненный силикоз может не оказывать существенного влияния на качество и продолжительность жизни. Однако во всех случаях изменения в легких необратимы, а заболевание будет прогрессировать с той или иной скоростью. Неблагоприятные исходы регистрируются при быстро прогрессирующих и осложненных формах пневмокониоза.
Однако во всех случаях изменения в легких необратимы, а заболевание будет прогрессировать с той или иной скоростью. Неблагоприятные исходы регистрируются при быстро прогрессирующих и осложненных формах пневмокониоза.
Основу профилактических мероприятий составляет улучшение санитарно-технических условий (герметизация оборудования, автоматизация производственных процессов, вытяжная вентиляция, использование индивидуальных средств защиты и т. п.). Предупредительные меры медицинского характера включают периодические профосмотры с обязательным рентгенологическим исследованием легких. Лица, больные силикозом, освобождаются от работы на вредных производствах, в зависимости от тяжести расстройств им присваивается группа инвалидности.
Силикоз — лечение, симптомы, диагностика, последствия
Силикоз — это профессиональное заболевание, вызванное длительным вдыханием частиц пыли с высоким содержанием свободной двуокиси кремния. При этом происходит уплотнение легочной ткани, что приводит к развитию хронического воспалительного или дистрофического процесса. На начальном этапе заболевание не имеет симптомов, долго никак себя не проявляет. На второй стадии развития болезни появляется одышка при физической нагрузке, периодическое покашливание, незначительная боль в груди.
При этом происходит уплотнение легочной ткани, что приводит к развитию хронического воспалительного или дистрофического процесса. На начальном этапе заболевание не имеет симптомов, долго никак себя не проявляет. На второй стадии развития болезни появляется одышка при физической нагрузке, периодическое покашливание, незначительная боль в груди.
Постепенно прогрессируя, заболевание усиливается: беспокоит одышка в состоянии покоя, кашель усиливается, переходит в длительный, затяжной, боль в груди становится интенсивней. Болезнь вызывает легочно-сердечную недостаточность. Переход заболевания в хроническую форму зависит от длительности вредного воздействия пыли и индивидуальных особенностей организма. Распространенным является сочетание силикоза и других тяжелых заболеваний — туберкулеза, бронхита, астмы, ревматоидного артрита, рака легких. Различают несколько форм силикоза: классическая или хроническая, длительное время не имеет симптомов, прогрессирующая, ускоренная, острая.
Как лечить силикоз
Для лечения силикоза необходимо полностью исключить контакт с вредными веществами и кремниевой пылью, курение. Медикаментозная терапия подразумевает прием бронхолитиков, отхаркивающих средств, антигистаминных препаратов. Эффективны физиотерапия, ультразвуковое лечение, электрофорез, дыхательная гимнастика, кислородные ингаляции, санаторно-курортное лечение. Положительные результаты дают бронхоальвеолярный лаваж, гормональная и антибактериальная терапия.
При развитии необратимого процесса фиброз легочной ткани не всегда поддается лечению. Тяжелая форма заболевания требует хирургического вмешательства — трансплантации легких.
Медикаментозная терапия подразумевает прием бронхолитиков, отхаркивающих средств, антигистаминных препаратов. Эффективны физиотерапия, ультразвуковое лечение, электрофорез, дыхательная гимнастика, кислородные ингаляции, санаторно-курортное лечение. Положительные результаты дают бронхоальвеолярный лаваж, гормональная и антибактериальная терапия.
При развитии необратимого процесса фиброз легочной ткани не всегда поддается лечению. Тяжелая форма заболевания требует хирургического вмешательства — трансплантации легких.
Какую диагностику проходить при силикозе
Для контроля за общим состоянием легких работникам вредного производства рекомендуется ежегодно проходить рентгенографию, соблюдать профилактические меры при работе в пыльных помещениях.
Для диагностики силикоза пульмонолог назначает лабораторные исследования крови, рентген легких, УЗИ грудной клетки, МРТ. Иногда назначается биопсия тканей легкого. Особо важное диагностическое значение имеет анализ основных показателей работы органов дыхания.
Последствия силикоза
При отсутствии лечения силикоз прогрессирует, изменения легочной ткани становятся необратимыми. Проявляющиеся сопутствующие болезни дыхательных путей иногда приводят к летальному исходу. Особую опасность представляют быстропрогрессирующие и острые состояния.
Силикоз — признаки, причины, симптомы, лечение и профилактика
Диагностика
При появлении первых признаков недомогания и нарушений дыхательной функции необходимо незамедлительно записаться на прием к врачу-терапевту или профпатологу. Специалист проведет консультацию и первичный осмотр и при необходимости назначит следующие диагностические исследования: рентгенография органов грудной клетки, УЗИ грудины, определение жизненной емкости легких и их максимальной вентиляции, объема форсированного выдоха, выявление частоты дыхания и максимальной скорости воздушной струи при выдохе.
Лечение
Для лечения на ранней стадии назначают санаторно-курортный отдых, кумысолечение, различные физиотерапии, кислородные ингаляции, введение в бронхи нейтрального раствора, применение бронхолитиков, бронхоальвеолярного лаважа, отхаркивающих и обладающих широким спектром действия антибактериальных препаратов, сульфаниламидов, противотуберкулезных препаратов (при возникновении туберкулеза).
Для лечения тяжелой формы при присутствующем фиброзе необходима консультация у хирурга и оперативное вмешательство — проводят трансплантацию легких.
Считается, что такая патология не поддается полному лечению и представляет собой необратимый процесс.
В случае подтверждения диагноза следует полностью прекратить любые контакты с пылью для предотвращения ухудшения самочувствия.
Профилактика
Профилактические меры заключаются в ежегодном прохождении рентгена и пребывании в легко проветриваемых помещениях. На предприятиях с высоким уровнем вредности необходимо применять герметизацию пылеобразующих процессов, использовать системы пылеосаждения, включать вентиляции с функцией пылеулавливания.
Использование индивидуальных средств профилактики (шлемов и скафандров, респираторов) поможет обезопасить индивида и не дать развиться этому состоянию.
Тем, кто работает в условиях содержания в воздухе диоксида кремния, прохождение обязательного медицинского осмотра показано в первую очередь.
Литература и источники
Видео по теме:
причины, симптомы, диагностика, лечение, профилактика
Относится к группе пневмокониозов, ассоциированных с воздействием высокофиброгенной пыли с содержанием свободного диоксида кремния более 10%, обусловленного развитием диффузного легочного узелкового, интерстициального или узлового фиброза и нарушением дыхательной функции.
ПричиныРазвитие хронического силикоза наблюдается после того, как человек минимум в течение двадцати лет вдыхает пыль с низким содержанием диоксида кремния, который находится в несвязанном виде.
В этом случае альвеолярные макрофаги интенсивно поглощают мирочастицы диоксида, что сопровождается выработкой цитотоксичных ферментов, что обусловлено развитием воспалительного поражения с дальнейшим фиброзированием паренхимы легкого.
СимптомыВ начале заболевания больные жалуются на появление одышки, кашля с незначительным отделением мокроты, болей в грудной клетке, в межлопаточной и подлопаточной зонах.
Сначала боли могут появляться только иногда и усугубляются при вдохе и кашле, но по мере прогрессирования недуга они становятся постоянными. С течением времени у больных появляется нарастающая слабость, субфебрильная температура, усиливается потоотделение, снижается масса тела, наблюдается возникновение одышки и в состоянии покоя. При прогрессировании недуга возникает синюшность носогубной зоны, пальцы приобретают форму барабанных палочек, а ногтевые пластины – часовых стекол.
Затем развиваются симптомы недостаточности дыхания, наблюдается возникновение легочного сердца и гипертензии.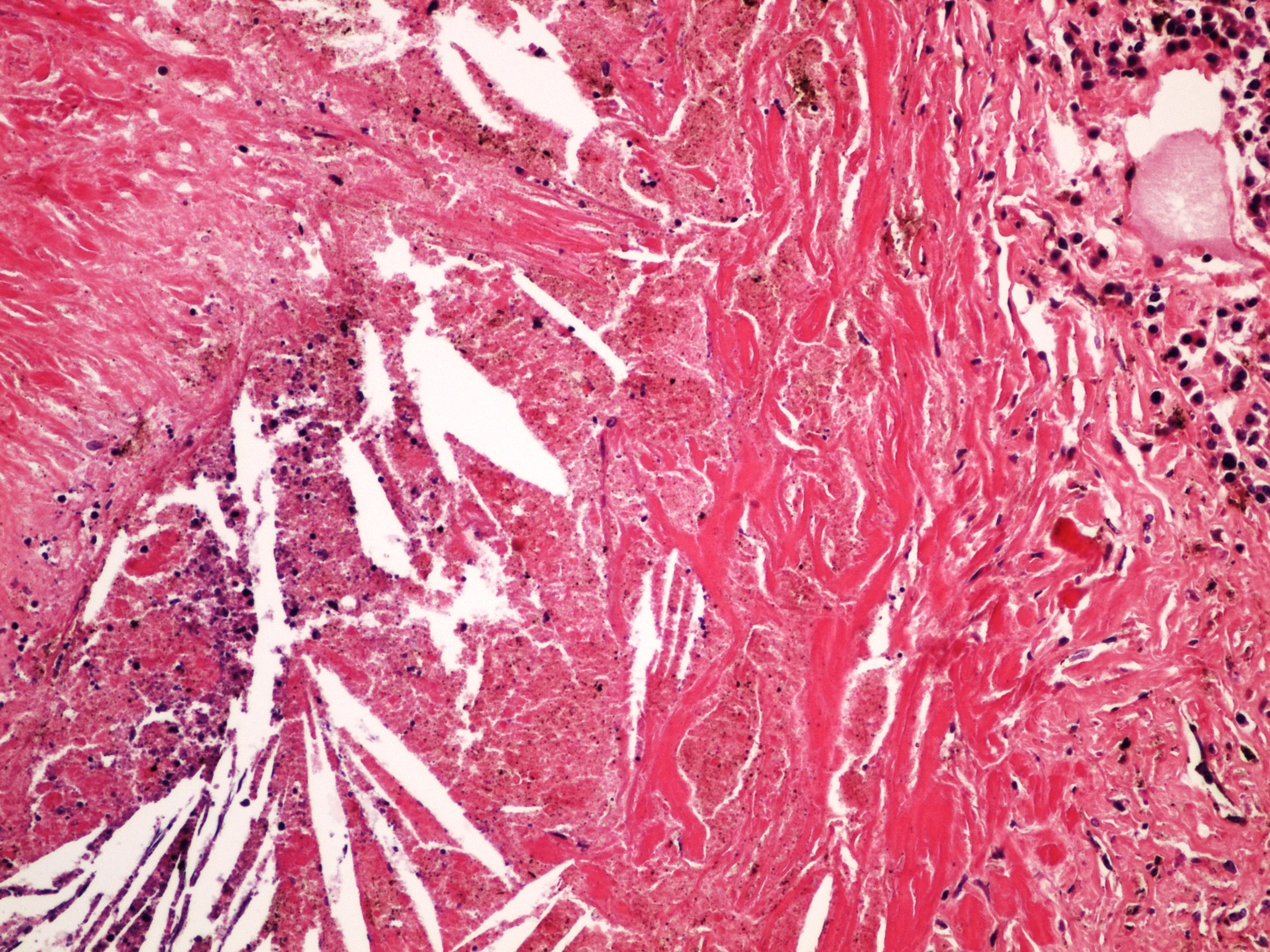 Иногда течение силикоза может осложняться присоединением туберкулезной инфекции либо развитием силикотуберкулеза, отягощенного эрозией легочных сосудов, склонностью к кровотечениям из легкого и образованием бронхиальных свищей.
Иногда течение силикоза может осложняться присоединением туберкулезной инфекции либо развитием силикотуберкулеза, отягощенного эрозией легочных сосудов, склонностью к кровотечениям из легкого и образованием бронхиальных свищей.
Течение заболевания может осложняться возникновением бронхоэктазов, внезапным пневмотораксом, ревматоидным артритом. Кроме этого, силикоз довольно часто осложняется возникновением альвеолярного либо бронхогенного рака легкого и развитием опухоли из мезотелиальных клеток плевры.
ДиагностикаПри проведении рентгенологического исследования на снимке может выявляться легочная диссеминация узелкового или интерстициального типа, также у некоторых больных наблюдается возникновение узловых образований, которые состоят из силикотических узелков, и кальцификация корней легкого.
При углубленном обследовании для уточнения характера и стадии заболевания таким больным может потребоваться проведением компьютерной томографии или биопсии легкого.
Для эффективного лечения потребуется прекратить контакт с пылью кремния, которая вызвала заболевание. При присоединении туберкулезной инфекции пациенту назначают корректное лечение. Во всех остальных случаях для улучшения самочувствия больным назначают дыхательную гимнастику и оксигенотерапию. При необходимости назначают фармакотерапию и физиотерапевтическое лечение.
ПрофилактикаПрофилактика силикоза основывается на комплексе мероприятий, направленных на улучшение условий труда, соблюдение всех необходимых правил личной безопасности при работе с кремниевой пылью и систематическом проведении медицинских осмотров.
Силикоз | fguz-volgograd.ru
Силикоз, давно известная чисто профессиональная болезнь легких, развивается у людей, которые много лет дышат песчаной пылью (название болезни происходит от латинского слова silicium — кварц, который является основной составляющей песка). Тесный контакт с песчаной пылью имеют шахтеры, добывающие металл, пескоструйщики и обработчики гранита, рабочие литейных цехов и гончары.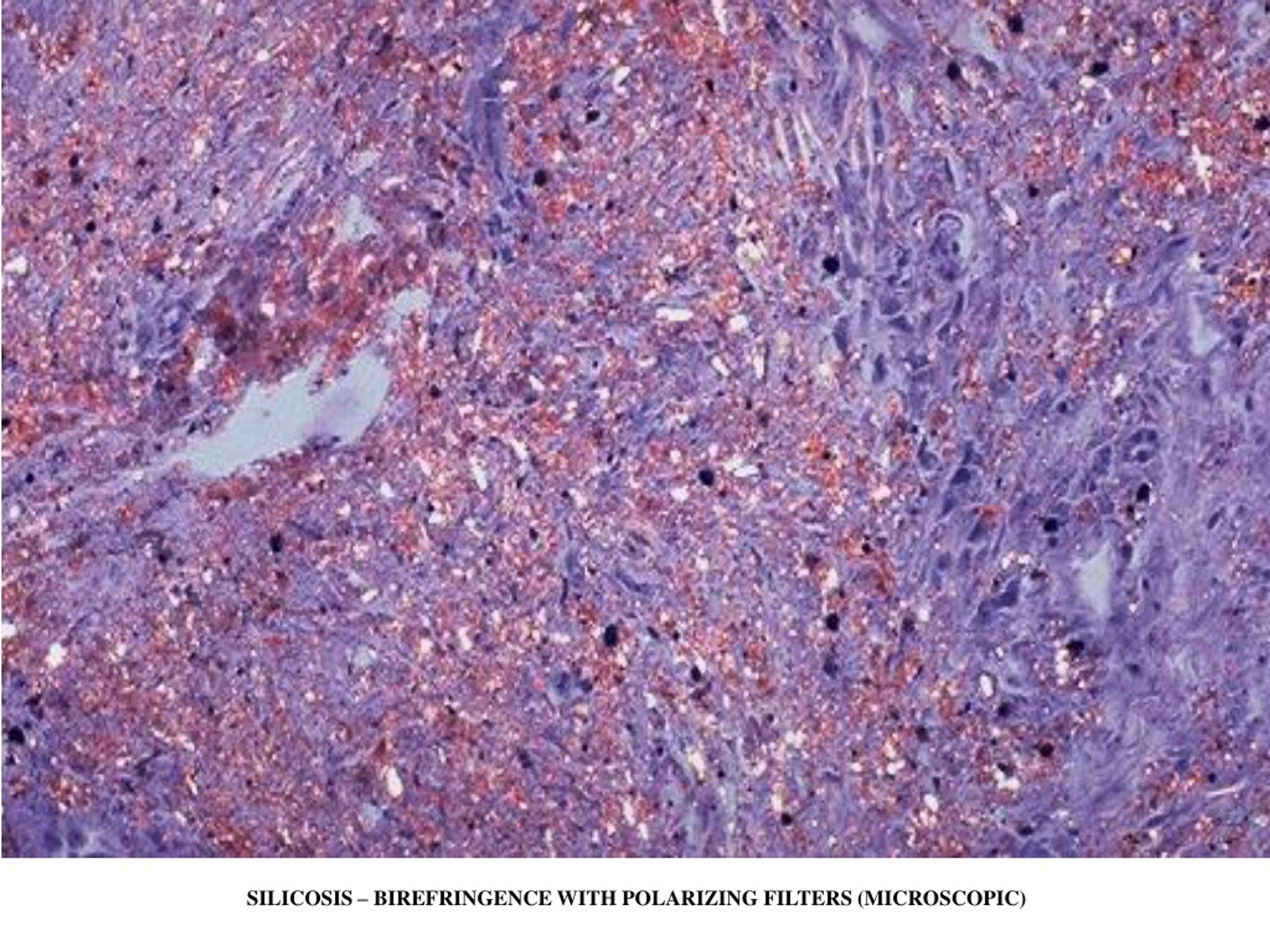 Обычно симптомы появляются только после 20-30 лет контакта с пылью. Однако у представителей ряда профессий (подрывников, туннельщиков и работников шлифовального производства), чьи условия труда предполагают контакт с песчаной пылью, содержащейся в воздухе в высоких концентрациях, могут появляться раньше чем через 10 лет.
Обычно симптомы появляются только после 20-30 лет контакта с пылью. Однако у представителей ряда профессий (подрывников, туннельщиков и работников шлифовального производства), чьи условия труда предполагают контакт с песчаной пылью, содержащейся в воздухе в высоких концентрациях, могут появляться раньше чем через 10 лет.
Чаще всего силикоз легких можно встретить у представителей таких видов промышленности:
- металлургической;
- горнорудной;
- машиностроительной;
- фарфорофаянсовой.
Самую серьезную опасность для организма человека представляет мелкая пыль с размером частиц около 2 нм. Такая пыль с легкостью просачивается в бронхиальное дерево, что способствует образованию фиброзов и ряда других патологий. Серьезность симптомов и осложнений зависят от длительности воздействия и количества соединений кремния, попавших в организм при дыхании. Если рабочие не снабжаются защитными средствами или не пользуются ими, то у них через несколько лет может развиться острый силикоз.
Течение заболевания отличается благоприятным исходом, однако, при лечении силикоза достаточно часто возникают проблемы с возникновением туберкулезного процесса. К тому же, при острых и хронический формах фиброза, прежние осложнения продолжают прогрессировать и мешать успешному лечению.
Симптомы силикоза
Первоначальная симптоматика достаточно скудная:
- одышка;
- сухой кашель;
- боли в груди;
- выделение мокроты.
С прогрессированием болезни симптомы проявляются все более ярко. Происходит усиление одышки, которая не покидает больного даже во время отдыха. Бывает, что силикоз легких определяется по сухому, хриплому дыханию. Иногда у больных наблюдается нарушение сердечной деятельности и кровохарканье.
Внешний вид больного визуально не изменяется, только при рентгенографическом исследовании заметно снижение подвижности краев легких, ослабление дыхания и начальные симптомы эмфиземы. Диагноз силикоза ставят пациенту, который работал с песком, на основании жалоб и соответствующих симптомов. На рентгеновском снимке грудной клетки можно обнаружить характерные признаки фиброза и узелки.
Диагноз силикоза ставят пациенту, который работал с песком, на основании жалоб и соответствующих симптомов. На рентгеновском снимке грудной клетки можно обнаружить характерные признаки фиброза и узелки.
К силикозу, как правило, присоединяются разные сопутствующие заболевания:
- хронический бронхит;
- бронхиальная астма.
Силикоз легких требует обязательного лечения, потому что он провоцирует возникновение многих сопутствующих заболеваний.
Силикоз нельзя вылечить. Однако если человек на ранней стадии болезни прекращает контакт с песком, прогрессирование силикоза может остановиться. При затруднении дыхания приносят пользу препараты, расширяющие дыхательные пути и облегчающие освобождение их от мокроты. Поскольку пациенты с силикозом имеют высокий риск развития туберкулеза, они должны проходить регулярные обследования, включающие кожную туберкулиновую пробу.
После консультации с врачом можно отправляться на отдых, на море, где для очищения легких предоставлены все уникальные природные и климатические условия.
Когда обратиться к врачу
- Лица, работающие в контакте с пылью, должны 2 раза в год посещать пульмонолога и 1 раз в год делать рентгенограмму грудной клетки даже при отсутствии симптомов.
- При хроническом кашле, сухом или с мокротой, одышке у лиц, длительное время работавших в условиях повышенной пылевой загрязненности.
- При боли в груди, чувстве давления в грудной клетке.
- При потере аппетита, усталости, постоянном кашле у лиц из группы риска.
Профилактика силикоза
Первейшим мероприятием по предотвращению легочных заболеваний (в том числе силикоза) являются действия по максимальному снижению концентрации пыли в воздух производственных помещений с помощью .
Кроме того, применяются индивидуальные средства защиты, что также способствует профилактике легочных заболеваний:
- специальные шлемы;
- респираторы;
- скафандры.
Лица, находящиеся в постоянном контакте с силикатной пылью, в профилактических целях должны проходить периодические медицинские осмотры. Всем работникам производства необходимо исследовать функцию дыхания и сделать флюорографию.
Всем работникам производства необходимо исследовать функцию дыхания и сделать флюорографию.
В профессиональных осмотрах должны принимать обязательное участие отоларинголог и терапевт.
Лечение и лечение силикоза | Американская ассоциация легких
Как лечится силикоз
Лекарства от силикоза нет, и после того, как нанесен ущерб, его нельзя обратить вспять. Лечение направлено на замедление прогрессирования заболевания и облегчение симптомов. Крайне важно избегать дальнейшего воздействия кремнезема и других раздражителей, таких как сигаретный дым. Тестирование на туберкулез важно, потому что у людей с силикозом болезнь протекает тяжелее.
Как только ваш врач определит степень повреждения легких, он сможет предоставить вам план лечения. Это может включать:
- Использование бронхолитиков для расслабления дыхательных путей и уменьшения воспаления.

- Как можно скорее бросить курить. Курение может увеличить ущерб, наносимый кремнеземом, и ускорить прогрессирование заболевания. Американская ассоциация легких предлагает проверенные и эффективные программы отказа от курения, чтобы дать людям, пытающимся бросить курить, необходимую им поддержку.
- Дополнительный кислород может быть назначен, чтобы помочь вам получить больше воздуха в легкие, когда это необходимо. Хотя он может понадобиться вам только во время тренировки в начале, по мере прогрессирования болезни он может понадобиться вам постоянно. Узнайте больше об кислородной терапии.
- Легочная реабилитация — это программа упражнений, разработанная для того, чтобы помочь всем пациентам с хроническими заболеваниями легких поддерживать оптимальный уровень активности.
- В очень тяжелых случаях врач может предложить операцию и направить вас к специалисту по трансплантации легких.
Лечение силикоза
Чтобы не допустить ухудшения состояния, всем больным силикозом необходимо исключить дальнейшее воздействие кремнезема. Также следует избегать других раздражителей легких, таких как загрязнение воздуха внутри и снаружи помещений, аллергены и дым.
Также следует избегать других раздражителей легких, таких как загрязнение воздуха внутри и снаружи помещений, аллергены и дым.
Ваш врач может помочь справиться с вашими симптомами, но вы также можете принять меры для поддержания своего здоровья, выполняя следующие действия:
- Поддерживайте вес и питание с помощью хорошо сбалансированной диеты.
- Оставайтесь как можно более активными, регулярно занимаясь спортом, но будьте осторожны и не перенапрягайтесь.
- Профилактика респираторных инфекций, которые могут ухудшить состояние легких. Ежегодно делайте прививку от гриппа и пневмококковой пневмонии в соответствии с рекомендациями врача.
- Будьте бдительны, следите за развитием туберкулеза или других инфекций и немедленно обратитесь к врачу, если они появятся.
- Разработайте план лечения вспышек болезни.
Рассмотрено и одобрено Научно-медицинской редакционной группой Американской ассоциации пульмонологов.
Последнее обновление страницы: 12 марта 2020 г.
Симптомы, причины, диагностика, лечение, профилактика
Силикоз — заболевание легких. Обычно это происходит на работах, где вы вдыхаете пыль, содержащую диоксид кремния. Это крошечный кристалл, найденный в песке, камне или минеральных рудах, таких как кварц.
Со временем кремнезем может накапливаться в легких и дыхательных путях. Это приводит к образованию рубцов, из-за которых становится трудно дышать.
Существует три типа:
- Острый : Симптомы проявляются от нескольких недель до 2 лет после воздействия большого количества кремнезема.
- Хронический : Проблемы могут не проявиться в течение десятилетий после того, как вы подверглись воздействию низких или умеренных количеств кремнезема. Это самый распространенный тип силикоза. Сначала симптомы могут быть легкими, а затем постепенно ухудшаться.

- Ускоренный : Вы заметите признаки примерно через 5-10 лет после интенсивного воздействия кремнезема.Они быстро ухудшатся.
Кто болеет силикозом?
Большинство людей заболевают силикозом, потому что на работе они подвергаются воздействию кремнеземной пыли. Работа в этих полях может поставить вас на более высокий риск:
- Майнинг
- Строительство
- Гипс или гипсокартон Установка
- Изготовление стекла
- Road Repair
- Sandblaily
- MASONRY
- кровельные
- сельское хозяйство
Каковы симптомы?
Если ваша работа подвергает вас опасности, у вас могут быть такие ранние симптомы, как:
Более поздние симптомы включают:
Что вызывает силикоз?
Силикоз — это реакция организма на скопление кремнеземной пыли в легких.
Когда вы вдыхаете кремнезем, мельчайшие частицы пыли оседают глубоко в ваших дыхательных путях. На легочной ткани образуются рубцовые пятна. Рубцы делают легкие жесткими и повреждают их, из-за чего становится трудно дышать.
На легочной ткани образуются рубцовые пятна. Рубцы делают легкие жесткими и повреждают их, из-за чего становится трудно дышать.
Как диагностируется силикоз?
Другие тесты, помогающие диагностировать силикоз, включают:
- Рентген грудной клетки или компьютерная томография: Этот тест проверяет ваши легкие на наличие рубцов.
- Бронхоскопия: Врач введет в ваши легкие длинную тонкую трубку с крошечной камерой на конце, чтобы проверить наличие повреждений.
- Биопсия: При биопсии легочной ткани врач вводит иглу через грудную клетку в легкие, чтобы взять образец узла. Его проверят под микроскопом на признаки силикоза.
- Анализ мокроты: Это поможет оценить другие заболевания легких, такие как туберкулез (ТБ).
Есть ли осложнения?
Если у вас хронический силикоз, вы подвержены повышенному риску заболеть туберкулезом, гриппом и пневмонией. Регулярно проходите тесты на туберкулез в кабинете врача, а также ежегодно делайте прививку от гриппа и пневмонии.
Силикоз также увеличивает ваши шансы заболеть этими серьезными легочными заболеваниями:
Как лечится силикоз?
Сейчас нет лекарства от силикоза. Лечение может помочь вам справиться с симптомами.
- Лекарства
- Кислородная терапия
- Этот небольшой портативный баллон дает вам дополнительный кислород, помогающий снизить усталость.
- Операция по пересадке легких
- Вам может понадобиться, если у вас серьезное повреждение легких.
Одно существенное изменение образа жизни может помочь вам справиться с этим заболеванием:
- Бросьте курить: Если у вас силикоз, это опасно. Это усугубляет повреждение легких. Получите помощь, чтобы бросить курить. По возможности избегайте пассивного курения и мест с большим количеством пыли, загрязненного воздуха и аллергенов.
Можно ли предотвратить силикоз?
Самые простые шаги включают:
- Ограничьте время воздействия кремнезема.

- Носите маску или другую защитную одежду во время работы.Ваш работодатель обязан предоставить надлежащее оборудование для обеспечения безопасности.
Другие способы предотвращения силикоза на рабочем месте:
- Используйте пескоструйные шкафы или надлежащую вентиляцию.
- Используйте влажные методы для резки, измельчения или измельчения материалов.
- Замена пескоструйного материала, содержащего диоксид кремния, на другие типы.
- Используйте респираторы, защищающие от вдыхания кремнезема.
- Не ешьте и не пейте рядом с кварцевой пылью.
- Мойте руки и лицо перед едой.
- Примите душ и переоденьтесь после работы.
Вопросы подхода, медицинская помощь, хирургическая помощь
Администрация по безопасности и гигиене труда. Информация об опасности для здоровья работников отрасли «Воздействие кристаллического кремнезема». Министерство труда США. Доступно на https://www. osha.gov/Publications/osha3176.html. Доступ: 4 декабря 2019 г.
osha.gov/Publications/osha3176.html. Доступ: 4 декабря 2019 г.
Американская ассоциация легких. Здоровье и болезни легких: узнайте о силикозе. Доступно по адресу https://www.lung.org/lung-health-and-diseases/lung-disease-lookup/silicosis/learn-about-silicosis.HTML. Обновлено: 13 марта 2018 г.; Доступ: 4 декабря 2019 г.
Млика М., Адигун Р., Госсман В.Г. Силикоз (пневмокониоз угольщиков). StatPearls [Интернет] . Январь 2019 г. [Medline]. [Полный текст].
Лопес А.Дж., Могами Р., Камило Г.Б., Мачадо Д.К., Мело П.Л., Карвалью А.Р. Взаимосвязь между показателями легочной денситометрии, полученными с помощью КТ, и параметрами методики вынужденных колебаний у больных силикозом. БрДж Радиол .2015 май. 88 (1049): 20150028. [Медлайн]. [Полный текст].
Фуджимура Н. Патология и патофизиология пневмокониозов. Curr Opin Pulm Med . 2000 г. 6 марта (2): 140-4. [Медлайн].
‘t Mannetje A, Steenland K, Attfield M, et al.Анализ «воздействие-реакция» и оценка риска смертности от кремнезема и силикоза в объединенном анализе шести когорт. Оккупай Энвайрон Мед . 2002 ноябрь 59 (11): 723-8. [Медлайн]. [Полный текст].
Рейли М.Дж., Тиммер С.Дж., Розенман К.Д. Бремя силикоза в Мичигане: 1988–2016 гг. Энн Ам Торак Соц . 15(12) декабря 2018 г.: 1404-1410. [Медлайн].
Гринберг М. И., Ваксман Дж., Кертис Дж. Силикоз: обзор. Дис пн .2007 авг. 53 (8): 394-416. [Медлайн].
И., Ваксман Дж., Кертис Дж. Силикоз: обзор. Дис пн .2007 авг. 53 (8): 394-416. [Медлайн].
Yang H, Yang L, Zhang J, Chen J. Естественное течение силикоза у рабочих, подвергающихся воздействию пыли. J Huazhong Univ Sci Technolog Med Sci . 2006. 26(2):257-60. [Медлайн].
Нг Т.П., Чан С.Л., Лам К.П. Рентгенологическое прогрессирование и функция легких при силикозе: десятилетнее последующее исследование. Br Med J (Clin Res Ed) . 1987 г., 18 июля. 295 (6591): 164-8. [Медлайн].
Schulte PA, Rice FL, Key-Schwartz-RJ, et al.Обзор опасности NIOSH: влияние на здоровье профессионального воздействия вдыхаемого кристаллического кремнезема. Публикация DHHS (NIOSH) № 2002–129. Цинциннати, Огайо: Министерство здравоохранения и социальных служб США, Национальный институт безопасности и гигиены труда; Апрель 2002 г. [Полный текст].
[Полный текст].
Верма Д.К., Вацек П.М., де Томбе К. и др. Оценка воздействия кремнезема в исследовании смертности рабочих, занимающихся гранитом в Вермонте. J Occup Environ Hyg . 2011 8 февраля (2): 71-9. [Медлайн].
Палабийк С.С., Гиргин Г., Туткун Э., Йылмаз О.Г., Байдар Т.Иммуномодуляция и окислительный стресс у работников пескоструйной обработки джинсовой ткани: изменения, вызванные воздействием кремнезема. Арх Хиг Рада Токсикол . 2013 1 сентября. 64 (3): 431-7. [Медлайн].
Чаудхури Н., Фатак А., Паливал Р., Райчаудхари С. Силикоз среди рабочих по обработке агата в Шакарпуре: анализ клинических данных. Лунг Индия . 2010 27 октября (4): 221-4. [Медлайн]. [Полный текст].
Коэн Р.А., Петсонк Э.Л., Роуз С., Янг Б. , Регьер М., Наджмуддин А. и др.Патология легких у американских угольщиков с быстро прогрессирующим пневмокониозом связана с кремнеземом и силикатами. Am J Respir Crit Care Med . 2016 15 марта. 193 (6): 673-80. [Медлайн]. [Полный текст].
, Регьер М., Наджмуддин А. и др.Патология легких у американских угольщиков с быстро прогрессирующим пневмокониозом связана с кремнеземом и силикатами. Am J Respir Crit Care Med . 2016 15 марта. 193 (6): 673-80. [Медлайн]. [Полный текст].
Линч КД. Вдыхаемая бетонная пыль — опасность силикоза в строительной отрасли. Appl Occup Environ Hyg . 2002 г. 17 марта (3): 209-21. [Медлайн].
Центры по контролю и профилактике заболеваний. Силикоз у зубных лаборантов — пять штатов, 1994–2000 гг. MMWR Morb Mortal Wkly Rep . 2004 12 марта. 53(9):195-7. [Медлайн].
Розенман К.Д., Рейли М.Дж., Калиновски Д.Дж., Ватт Ф.К. Силикоз в 1990-х гг. Сундук . 1997 март 111(3):779-86. [Медлайн].
Комитет Американского торакального общества Научной ассамблеи по охране окружающей среды и гигиены труда. Побочные эффекты воздействия кристаллического кремнезема. Am J Respir Crit Care Med . 1997 фев. 155 (2): 761-8. [Медлайн].
Побочные эффекты воздействия кристаллического кремнезема. Am J Respir Crit Care Med . 1997 фев. 155 (2): 761-8. [Медлайн].
Ng TP, Chan SL, Lee J. Предикторы смертности при силикозе. Респир Мед . 1992. 86(2):115-9. [Медлайн].
Ван В, Ю И, Сяо Дж, Гао И, Санг Л, Лянь И и др. Новый вариант десмоплакина потенциально связан с риском развития силикоза. ДНК клеточный биол . 2018. 37(11):925-31. [Медлайн].
Cohen C, Fireman E, Ganor E, Man A, Ribak J, Lerman Y. Ускоренный силикоз со смешанно-пылевым пневмокониозом в твердосплавной дробилке. J Occup Environ Med . 1999 июнь 41(6):480-5. [Медлайн].
Symanski H. Пневмокониоз песчаника с отсроченным началом. Am J Ind Med . 1981. 2(2):101-2. [Медлайн].
Паркс К.Г., Конрад К., Купер Г.С. Профессиональное воздействие кристаллического кремнезема и аутоиммунное заболевание. Перспектива охраны окружающей среды . 1999, октябрь 107, Приложение 5: 793-802. [Медлайн].
Каплан А., Пейн Р.Б., Уитли Дж.Л. Расширенное понятие синдрома Каплана, связанное с ревматоидным фактором. Грудная клетка . 17(3). 1962 г., сентябрь: 205–209. [Medline].
Hnizdo E, Vallyathan V. Хроническая обструктивная болезнь легких из-за профессионального воздействия кремнеземной пыли: обзор эпидемиологических и патологических данных. Оккупай Энвайрон Мед .2003 апрель 2003 апрель: 237-43. [Медлайн].
Стинланд К., Уорд Э. Силикагель: канцероген для легких. CA Рак J Clin . 2014 январь-февраль. 64 (1):63-9. [Медлайн]. [Полный текст].
[Руководство] Raymond LW, Wintermeyer S. Медицинское наблюдение за рабочими, подвергшимися воздействию кристаллического кремнезема.Заявление о позиции Американского колледжа медицины труда и окружающей среды (ACOEM). J Occup Environ Med . 2006 г., 48 января (1): 95–101. [Медлайн]. [Полный текст].
Рабочая группа IARC по оценке канцерогенных рисков для человека: диоксид кремния, некоторые силикаты, угольная пыль и параарамидные фибриллы. Лион, 15–22 октября 1996 г. IARC Monogr Eval Carcinog Risks Hum .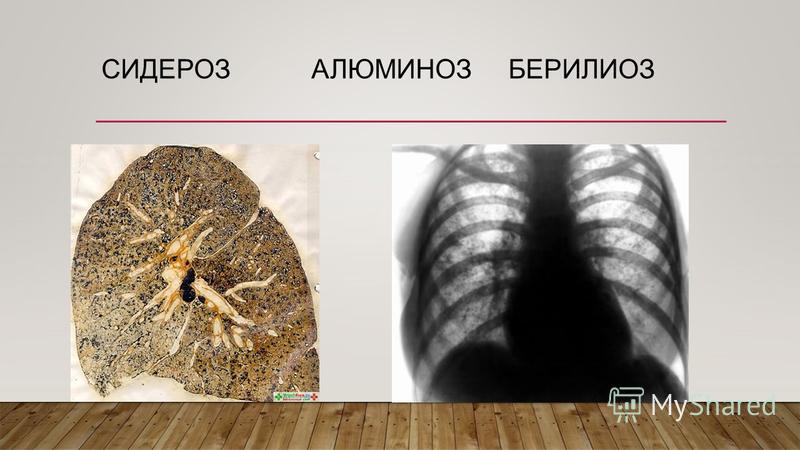 1997. 68:1-475. [Медлайн]. [Полный текст].
1997. 68:1-475. [Медлайн]. [Полный текст].
Стинланд К., Маннетье А., Боффетта П. и др. для Международного агентства по изучению рака.Объединенные анализы воздействия и реакции и оценка риска рака легких в 10 когортах рабочих, подвергшихся воздействию диоксида кремния: многоцентровое исследование IARC. Рак вызывает контроль . 2001 12 ноября (9): 773-84. [Медлайн].
Рапити Э., Сперати А., Мичели М., Форастиер Ф., Ди Лалло Д., Кавариани Ф. и др. Терминальная стадия почечной недостаточности у керамистов, подвергшихся воздействию кремнезема. Оккупай Энвайрон Мед . 1999 авг. 56(8):559-61. [Медлайн].
Харанат СП.Ресурсы для обучения пациентов: узнайте о силикозе. Фонд ГРУДЬ. Доступно по адресу https://foundation.chestnet.org/patient-education-resources/silicosis/. январь 2018 г.; Дата обращения: 1 декабря 2019 г.
Ситон А., Черри Дж.В. Воздействие кварца и тяжелый силикоз: роль прикорневых узлов. Оккупай Энвайрон Мед . 55(6). 1998 июнь: 383-6. [Медлайн].
Talini D, Paggiaro PL, Falaschi F, et al. Рентгенография грудной клетки и компьютерная томография высокого разрешения при обследовании рабочих, подвергшихся воздействию кварцевой пыли: связь с функциональными данными. Оккупай Энвайрон Мед . 1995 апр. 52 (4): 262-7. [Медлайн].
Кокс К.С., Роуз К.С., Линч Д.А. Современное состояние: Визуализация профессиональных заболеваний легких. Радиология . 2014 март 270(3):681-96. [Медлайн].
Duchange L, Brichet A, Lamblin C, Tillie I, Tonnel AB, Wallaert B. Острый силикоз. Клинические, рентгенологические, функциональные и цитологические характеристики бронхоальвеолярной жидкости. Наблюдения за 6 случаями. Rev Mal Respir .1998 Сентябрь 15 (4): 527-34. [Медлайн].
Наблюдения за 6 случаями. Rev Mal Respir .1998 Сентябрь 15 (4): 527-34. [Медлайн].
Kramer MR, Blanc PD, Fireman E, Amital A, Guber A, Rhahman NA, et al. Силикоз искусственного камня [исправлено]: всплеск болезни среди мастеров искусственного камня. Сундук . 2012 авг. 142(2):419-424. [Медлайн].
Ли С.Х., Ким Д.С., Ким Ю.В. и др. Связь между профессиональным воздействием пыли и прогнозом идиопатического легочного фиброза: национальное исследование Кореи. Сундук . 2015 февраль.147 (2): 465-74. [Медлайн].
Рен ML, Цзян XL. Выявление угольного силикоза радиоиммунным методом с использованием церулоплазмина. Chin J Ind Hyg Occup Dis . 1993. 11:145–6.
Тивари Р.Р., Сатвара Н.Г., Сайед Х.Н. Уровни меди в сыворотке среди рабочих по дроблению кварцевого камня: перекрестное исследование. Indian J Physiol Pharmacol . 2004 г., июль; 48 (3): 337–42. 48(3):337-42. [Медлайн].
Indian J Physiol Pharmacol . 2004 г., июль; 48 (3): 337–42. 48(3):337-42. [Медлайн].
Брокарт Ф., Бернард А.Секреторный белок клеток Clara (CC16): характеристики и перспективы в качестве периферического биомаркера легких. Clin Exp Allergy . 2000 апр;. 30(4):469-75. [Медлайн].
Bernard AM, Gonzalez-Lorenzo JM, Siles E, Trujillano G, Lauwerys R. Раннее снижение клеточного белка Clara в сыворотке у рабочих, подвергшихся воздействию кремнезема. Евр Респир J . 1994 7 ноября (11): 1932–1937. [Медлайн].
Сато Т., Такено М., Хонма К., Ямаути Х., Сайто Ю., Сасаки Т. и др.Гемоксигеназа-1, потенциальный биомаркер хронического силикоза, ослабляет повреждение легких, вызванное силикагелем. Am J Respir Crit Care Med . 2006 г., 15 октября. 174 (8): 906–14. [Медлайн].
Zhang YM, Zhang HT, Wang CY, Wang W, Wu J, Wang C. Долгосрочные терапевтические эффекты полного лаважа легких при лечении силикоза [китайский язык]. Чжунхуа Лао Дун Вэй Шэн Чжи Е Бин За Чжи . 2012 30 сентября (9): 690-3. [Медлайн].
Шарма С.К., Панде Дж.Н., Верма К. Эффект лечения преднизолоном при хроническом силикозе. Am Respir Respir Dis . 1991, апрель 143 (4 часть 1): 814-21.[Медлайн].
Zhang H, Sui JN, Gao L, Guo J.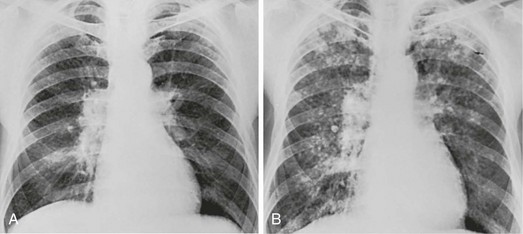 Подкожное введение фиброза легких, вызванного инфликсимабом, ослабленным диоксидом кремния. Int J Occup Med Environ Health . 2018 4 июля. 31(4):503-515. [Медлайн].
Подкожное введение фиброза легких, вызванного инфликсимабом, ослабленным диоксидом кремния. Int J Occup Med Environ Health . 2018 4 июля. 31(4):503-515. [Медлайн].
Петерс С., Рейд А., Фричи Л., де Клерк Н., Маск А.В. Отдаленные последствия вдыхания алюминиевой пыли. Оккупай Энвайрон Мед . 2013 Декабрь 70 (12): 864-8. [Медлайн].
Кастранова В. Сигнальные пути, контролирующие выработку медиаторов воспаления в ответ на воздействие кристаллического кремнезема: роль активных форм кислорода/азота. Свободный радикал Биол Мед . 2004 1 октября. 37 (7): 37 (7). [Медлайн].
Wollin L, Maillet I, Quesniaux V, Holweg A, Ryffel B. Антифибротическая и противовоспалительная активность ингибитора тирозинкиназы нинтеданиба в экспериментальных моделях фиброза легких. J Pharmacol Exp Ther . 2014 май. 349(2):209-20. [Медлайн].
2014 май. 349(2):209-20. [Медлайн].
Моралес М.М., Соуза С.А., Лойвос Л.П. и др. Пилотное исследование безопасности внутрибронхиальной инстилляции мононуклеарных клеток костного мозга у пациентов с силикозом. BMC Пульм Мед . 2015 11 июн. 15:66. [Медлайн]. [Полный текст].
Liu WW, Wang HX, Yu W, Bi XY, Chen JY, Chen LZ и др. Лечение силикоза аутологичными стромальными клетками костного мозга, модифицированными фактором роста гепатоцитов: нерандомизированное исследование с последующим наблюдением. Жене Мол Рез . 9 сентября 2015 г. 14(3):10672-81. [Медлайн].
Rosengarten D, Fox BD, Fireman E, Blanc PD, Rusanov V, Fruchter O, et al. Выживаемость после трансплантации легких при силикозе из искусственных камней по сравнению с идиопатическим легочным фиброзом. Am J Ind Med . 2017 март 60 (3): 248-254.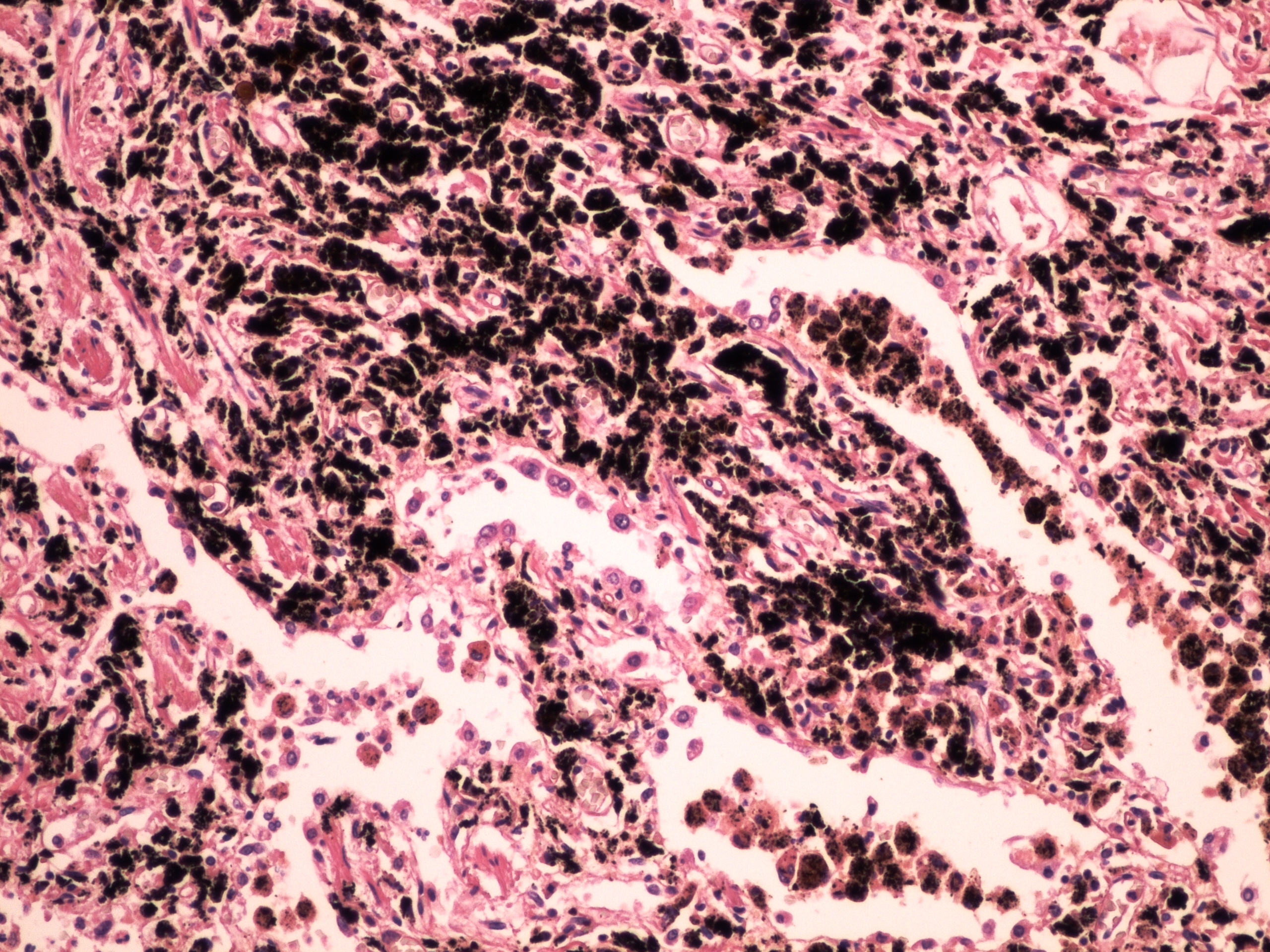 [Медлайн].
[Медлайн].
Центры по контролю и профилактике заболеваний (CDC). Смертность от силикоза среди молодых людей, США, 1968–1994 гг. MMWR Morb Mortal Wkly Rep . 1998 1 мая. 47 (16): 331-5. [Медлайн]. [Полный текст].
Линч К.Д., Гроус Д.В., Масгрейв К.Дж., Яйоски Р.А., Шорт С.Р., Паркер Дж.Е. Профилактика силикоза и смертности среди строительных рабочих. Публикация DHHS (NIOSH) № 96-112. Цинциннати, Огайо: Министерство здравоохранения и социальных служб США, Национальный институт безопасности и гигиены труда; 1996.[Полный текст].
Управление по безопасности и гигиене труда (OSHA). Защита органов дыхания: стандарты. Министерство труда США. Доступно по адресу https://www.osha.gov/SLTC/respiratoryprotection/standards.html. Доступ: 2 декабря 2019 г.
Ким Х.Р., Ким Б., Джо Б.С., Ли Дж.В. Воздействие диоксида кремния и оценка профессионального рака в Корее. Энн Оккупай Эннвайрон Мед . 2018. 30:4. [Медлайн]. [Полный текст].
Лечение силикоза | Как лечится силикоз?
Отзыв Cecile S. Rose, MD, MPHНет ни лекарства от силикоза, ни лекарств, которые могли бы обратить вспять уже нанесенное повреждение легких.Это означает, что уменьшение и контроль воздействия кремнеземной пыли является единственной эффективной защитой от болезней легких, связанных с кремнеземом.
Если вы подвергались воздействию кремнеземной пыли на работе, важно регулярно проходить обследование у своего лечащего врача. Чем раньше будет поставлен диагноз силикоза, тем полезнее он будет. По возможности следует избегать дальнейшего воздействия. Если это невозможно и ваша работа связана с контактом с кварцевой пылью, ваш работодатель обязан предоставить вам защитное оборудование.Вы всегда должны использовать его.
Чем раньше будет поставлен диагноз силикоза, тем полезнее он будет. По возможности следует избегать дальнейшего воздействия. Если это невозможно и ваша работа связана с контактом с кварцевой пылью, ваш работодатель обязан предоставить вам защитное оборудование.Вы всегда должны использовать его.
Лечение будет зависеть от ваших симптомов, поэтому оно будет индивидуальным для каждого человека. Лечение силикоза является поддерживающим и включает:
Своевременное лечение респираторных инфекций. Силикоз делает вас более восприимчивыми к инфекциям, поэтому важно следить за ними и сразу же обращаться к врачу, если они разовьются.
Наблюдение за микобактериальными инфекциями легких, аутоиммунными заболеваниями, раком легких и заболеваниями почек.
Прививки от гриппа и пневмококковой пневмонии. Важно ежегодно делать прививку от гриппа, а при наличии показаний – вакцину против пневмонии.
Дополнительный кислород в покое и/или при физической нагрузке, если это необходимо.
 По мере прогрессирования заболевания вам может потребоваться кислород во время физических упражнений или, в конечном итоге, в любое время.
По мере прогрессирования заболевания вам может потребоваться кислород во время физических упражнений или, в конечном итоге, в любое время.Отказ от курения. Если вы курильщик, одна из самых важных вещей, которые вы можете сделать для уменьшения симптомов силикоза, — это бросить курить.Курение повреждает легкие и усугубляет последствия силикоза. Избегайте пассивного курения и мест с большим количеством пыли.
Программа регулярных физических упражнений для поддержания общего состояния здоровья и силы дыхательных мышц
Легочная реабилитация
Ингаляторы, если исследование функции легких показывает, что лечение будет полезным
В некоторых случаях может рассматриваться вопрос о пересадке легких.
Силикоз — NHS
Силикоз — это хроническое заболевание легких, вызванное вдыханием большого количества пыли кристаллического кремнезема, обычно на протяжении многих лет.
Силикагель – это вещество, естественным образом встречающееся в некоторых типах камня, горных пород, песка и глины. При работе с этими материалами может образовываться очень мелкая пыль, которую можно легко вдохнуть.
Попадая в легкие, он вызывает отек (воспаление) и постепенно приводит к образованию участков затвердевшей и рубцовой легочной ткани (фиброз).Легочная ткань, поврежденная таким образом, не функционирует должным образом.
Люди, работающие в следующих отраслях, особенно подвержены риску:
- каменная кладка и резка камня, особенно песчаника
- строительство и снос, в результате воздействия бетона и материалов для мощения
- изготовление и установка столешниц
- производство гончарных изделий, керамики и стекла
- добыча полезных ископаемых
- пескоструйная обработка
Признаки и симптомы
Симптомы силикоза обычно развиваются в течение многих лет, и вы можете не замечать никаких проблем до тех пор, пока не перестанете работать с кварцевой пылью.
Симптомы могут продолжать ухудшаться, даже если вы больше не подвергаетесь воздействию.
Силикоз обычно развивается после воздействия кремнезема в течение 10-20 лет, хотя иногда он может развиться после 5-10 лет воздействия. Иногда это может произойти всего через несколько месяцев очень сильного воздействия.
Основные симптомы
Основные симптомы силикоза:
Если состояние продолжает ухудшаться, эти симптомы могут усилиться.
Некоторым людям в конечном итоге могут показаться очень трудными простые действия, такие как ходьба или подъем по лестнице, и они могут быть в основном ограничены своим домом или кроватью.
Состояние может в конечном итоге привести к летальному исходу, если легкие перестанут работать должным образом (дыхательная недостаточность) или разовьются серьезные осложнения, но в Великобритании это случается редко.
Дальнейшие проблемы
Силикоз также может увеличить риск возникновения других серьезных и потенциально опасных для жизни состояний, в том числе:
Когда обратиться к врачу общей практики
Обратитесь к своему терапевту, если вы считаете, что у вас может быть силикоз.
Вас спросят о симптомах и истории работы, а также прослушают ваши легкие с помощью стетоскопа.
Они захотят узнать о любых периодах, когда вы могли подвергаться воздействию кремнезема, и о том, выдавалось ли вам какое-либо защитное оборудование, например, маска для лица, во время работы.
При подозрении на силикоз вас могут направить к специалисту для проведения дополнительных анализов для подтверждения диагноза.
Анализы, которые вы можете пройти, включают:
- рентген грудной клетки для выявления аномалий в структуре легких
- компьютерную томографию (КТ) грудной клетки для получения более подробных изображений легких
- исследование функции легких (спирометрия), которая включает дыхание в прибор, называемый спирометром, для оценки того, насколько хорошо работают ваши легкие.

Также может быть рекомендован тест на туберкулез, поскольку у вас больше шансов заболеть туберкулезом, если у вас силикоз.
Лечение силикоза
Силикоз неизлечим, потому что повреждение легких необратимо. Лечение направлено на облегчение симптомов и улучшение качества жизни.
Состояние может продолжать ухудшаться, приводя к дальнейшему повреждению легких и серьезной инвалидности, хотя это может происходить очень медленно в течение многих лет.
Риск осложнений может быть снижен, если вы:
Вам может быть предложена длительная оксигенотерапия, если у вас затрудненное дыхание и низкий уровень кислорода в крови.
Бронходилататоры также могут быть назначены для расширения дыхательных путей и облегчения дыхания.
Вам будет назначен курс антибиотиков, если у вас разовьется бактериальная инфекция грудной клетки.
В очень тяжелых случаях вариантом может быть пересадка легкого, хотя существуют строгие медицинские требования, которые необходимо выполнить, прежде чем это будет рассмотрено.
Профилактика силикоза
Силикоз можно предотвратить, избегая длительного воздействия кремнеземной пыли.
В Великобритании все рабочие места должны соответствовать Положениям о контроле за веществами, опасными для здоровья, от 2002 г., которые устанавливают предел воздействия кремнезема на рабочем месте.
Ваш работодатель должен:
- предупредить вас о любых рисках для вашего здоровья
- убедиться, что вы знаете о правильных процедурах, позволяющих снизить риск воздействия кварцевой пыли
- предоставить вам необходимое оборудование для вашей защиты
Вы можете прочитать более подробную информацию о контроле воздействия кремнеземной пыли на веб-сайте Управления по охране труда и технике безопасности.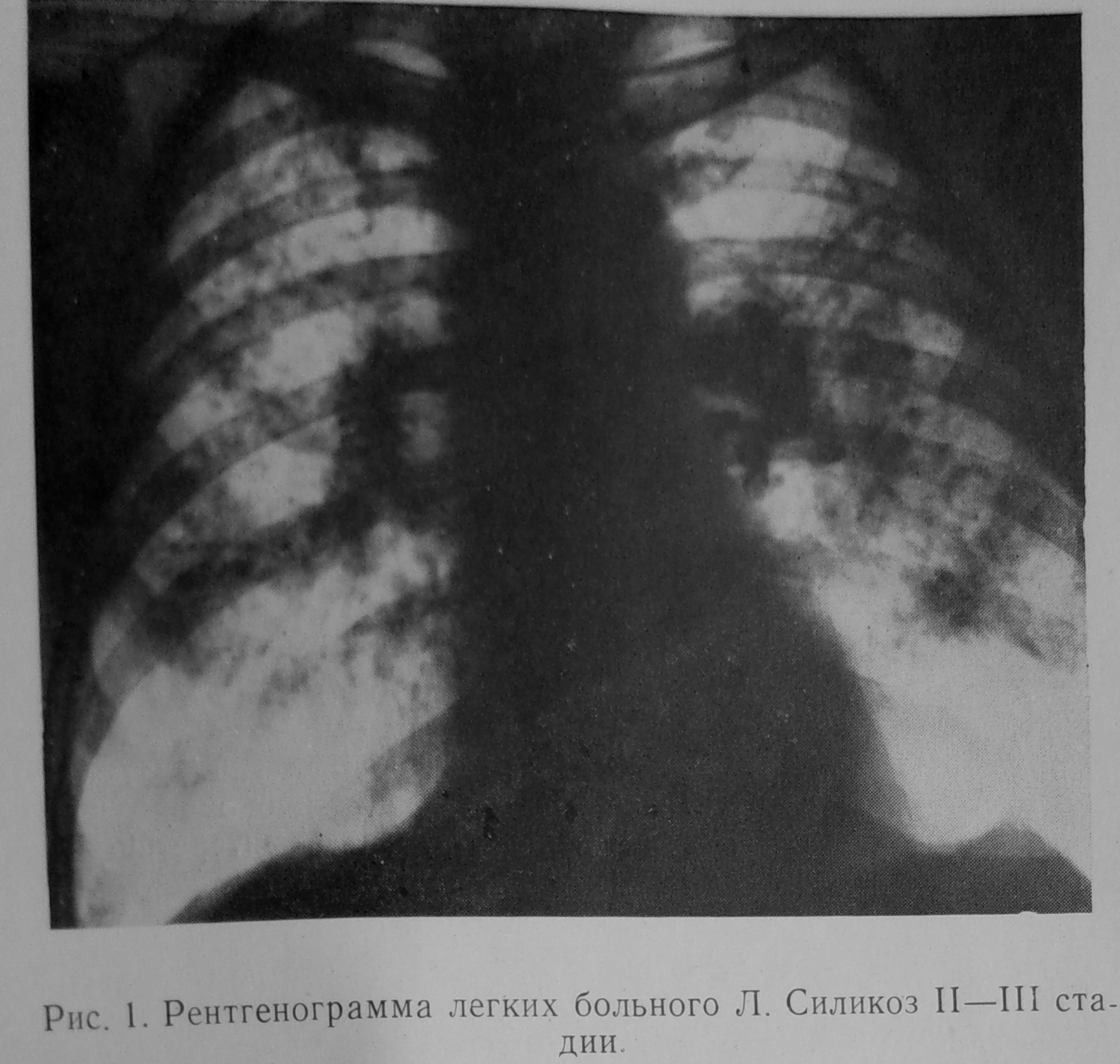
Требование компенсации
Если у вас диагностирован силикоз, вы можете потребовать компенсацию одним из следующих способов:
- пособие по инвалидности на производстве – денежная сумма, выплачиваемая еженедельно больным силикозом, которые подвергались работающим (но не самозанятым) и больным силикозом и раком легких
- предъявить гражданский иск о возмещении ущерба в судебном порядке (для этого потребуется консультация юриста)
- иск единовременное возмещение по Пневмокониозу и др.(Компенсация работникам) Закон 1979 г. — если у вас силикоз или вы находитесь на иждивении человека, который умер от этого заболевания, и вы не можете получить компенсацию через суд, потому что ответственный работодатель прекратил торговлю
Подробнее о пособиях по инвалидности в связи с производственными травмами можно прочитать на веб-сайте GOV. UK.
UK.
Последняя проверка страницы: 01 июля 2021 г.
Следующая проверка должна быть завершена: 01 июля 2024 г.
Клеточная терапия силикоза
Stem Cells Int.2016; 2016: 5091838.
Miquéias Lopes-Pacheco
Лаборатория клеточной и молекулярной физиологии, Институт биофизики Carlos Chagas Filho, Федеральный университет Рио-де-Жанейро, Рио-де-Жанейро, RJ, Бразилия
Elga Bandeira
Лаборатория клеточной и Молекулярная физиология, Институт биофизики Carlos Chagas Filho, Федеральный университет Рио-де-Жанейро, Рио-де-Жанейро, RJ, Бразилия
Marcelo M. Morales
Лаборатория клеточной и молекулярной физиологии, Институт биофизики Carlos Chagas Filho, Федеральный университет Рио де-Жанейро, Рио-де-Жанейро, RJ, Бразилия
Лаборатория клеточной и молекулярной физиологии, Институт биофизики Carlos Chagas Filho, Федеральный университет Рио-де-Жанейро, Рио-де-Жанейро, RJ, Бразилия
Академический редактор: Ciprian Tomuleasa
Получено 2015 20 ноября; Принято 16 февраля 2016 г.
Эта статья находится в открытом доступе и распространяется в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
Эта статья была процитирована другими статьями в PMC.Abstract
Силикоз является наиболее распространенным пневмокониозом во всем мире, с более высокой распространенностью и заболеваемостью в развивающихся странах. На сегодняшний день не существует эффективного лечения, позволяющего остановить или обратить вспять прогрессирование заболевания, вызванное повреждением легких, вызванным силикагелем.Необходимо добиться значительных успехов, чтобы снизить заболеваемость и смертность, связанные с силикозом. В этом обзоре мы выделили основные механизмы действия, которые вызывают повреждение легких частицами кремнезема, и обобщили данные о терапевтических перспективах клеточной терапии силикоза.
1. Введение
Процесс индустриализации неуклонно увеличивает профессиональную экспозицию рабочих к вдыхаемым частицам во многих рабочих средах. Среди этих частиц двуокись кремния, или кремнезем, играет важную роль в бремени респираторных профессиональных заболеваний.Вдыхание частиц кремнезема вызывает силикоз: стойкое воспаление с образованием гранулем, что приводит к ремоделированию тканей и нарушению функции легких [1]. Туберкулез, хронические обструктивные заболевания легких и ревматоидный артрит являются некоторыми распространенными осложнениями, связанными с силикозом [2–4]. Длительное воздействие кремнезема также может вызывать рак легких [5, 6]. На сегодняшний день доступное лечение силикоза сосредоточено на контроле сопутствующих симптомов и сопутствующих заболеваний, и никакая терапия не останавливает или не обращает вспять прогрессирование заболевания.В терминальной стадии болезни легких пациент умирает от дыхательной недостаточности [1].
За последние десятилетия было предпринято много усилий для предотвращения вдыхания рабочими пыли кремнезема; однако силикоз по-прежнему является проблемой общественного здравоохранения во всем мире с более высокой распространенностью в развивающихся странах [7].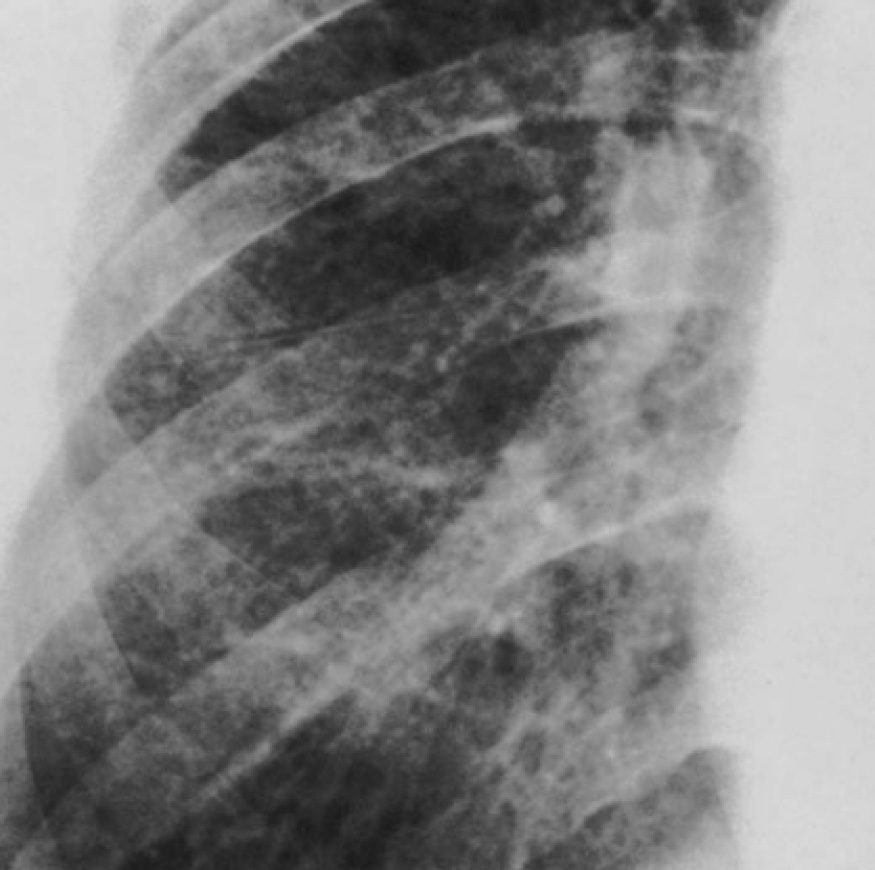 В Бразилии Холанда и его сотрудники показали распространенность силикоза у 33% землекопов в штате Сеара [8], и более 4500 случаев силикоза были связаны с золотодобытчиками в период с 1978 по 1988 год в штате Минас-Жерайс [9].В настоящее время ожидается, что более 6 миллионов рабочих ежедневно подвергаются воздействию кремнезема в различных сферах труда по всей стране [4, 10]. В Китае в период с 1991 по 1995 год было зарегистрировано более 500 000 больных силикозом, около 6 000 новых случаев и более 24 000 смертей в год [1]. В Индии 10 миллионов рабочих подвергаются воздействию кварцевой пыли с высоким риском развития заболевания [11].
В Бразилии Холанда и его сотрудники показали распространенность силикоза у 33% землекопов в штате Сеара [8], и более 4500 случаев силикоза были связаны с золотодобытчиками в период с 1978 по 1988 год в штате Минас-Жерайс [9].В настоящее время ожидается, что более 6 миллионов рабочих ежедневно подвергаются воздействию кремнезема в различных сферах труда по всей стране [4, 10]. В Китае в период с 1991 по 1995 год было зарегистрировано более 500 000 больных силикозом, около 6 000 новых случаев и более 24 000 смертей в год [1]. В Индии 10 миллионов рабочих подвергаются воздействию кварцевой пыли с высоким риском развития заболевания [11].
Силикоз также является проблемой гигиены труда в развитых странах. В период с 1990 по 1993 год в Европе более 3 миллионов рабочих подверглись воздействию частиц кремнезема, 600 000 из них — в Соединенном Королевстве [12].В Соединенных Штатах более 100 000 рабочих подвергались воздействию кварцевой пыли, и с 1987 по 1996 год ежегодно регистрировалось более 3 500 новых случаев [13]. Реализация защитных мероприятий позволила снизить количество новых случаев силикоза и уровень смертности. Тем не менее, силикоз по-прежнему неизлечим, и случаются новые вспышки, такие как заражение работников кварцевого конгломерата в Испании, где средний возраст когорты составлял 33 года [14]. Кроме того, увеличивается количество рабочих сред с потенциальным воздействием кварцевой пыли, таких как пескоструйная обработка джинсов и кварцевание.
Реализация защитных мероприятий позволила снизить количество новых случаев силикоза и уровень смертности. Тем не менее, силикоз по-прежнему неизлечим, и случаются новые вспышки, такие как заражение работников кварцевого конгломерата в Испании, где средний возраст когорты составлял 33 года [14]. Кроме того, увеличивается количество рабочих сред с потенциальным воздействием кварцевой пыли, таких как пескоструйная обработка джинсов и кварцевание.
Все больше статей показали эффективность как системного, так и интратрахеального введения стволовых клеток в нескольких животных моделях повреждения легких [15]. Среди них наиболее изучены клетки костного мозга. Они были способны способствовать реэпителизации легочной паренхимы, модулировать иммунный ответ и уменьшать ремоделирование тканей [16–19]. Силикоз имеет уникальный процесс патогенеза, при котором фагоцитоз и высвобождение частиц кремнезема в легочной ткани вызывают прогрессирование заболевания [20].В этом обзоре освещаются основные механизмы действия кварцевой пыли в альвеолярной среде и то, как клеточная терапия может помочь пациентам с силикозом, модулируя воспаление, уменьшая фиброз и, таким образом, улучшая функцию легких.
2. Патогенез: цикл повреждения легочной ткани
Частицы кремнезема, которые преодолевают мукоцилиарный защитный механизм в дыхательных путях и достигают дистальных отделов легких, начинают каскад патогенеза. Наиболее патогенными для человека являются частицы размером менее 10 мкм м, так как они обладают необходимой аэродинамикой для достижения бронхиол и альвеол [4, 21].
Силикоз обусловлен циклом фагоцитоза и высвобождением этих частиц, что приводит к повреждению эпителия, ремоделированию легких и уменьшению площади газообмена. Повреждение легких, вызванное кремнеземом, происходит по пяти основным механизмам (1) прямая цитотоксичность, (2) образование реактивных частиц, (3) продукция цитокинов и хемокинов, (4) фиброз и (5) гибель клеток в результате апоптоза. 22–25].
Силикозы патогенеза. Основными механизмами, которые управляют прогрессированием заболевания, вызванного повреждением легких, вызванным силикагелем, являются (1) прямая цитотоксичность, (2) продукция активных форм кислорода (АФК) и активных форм азота (РНС), (3) секреция воспалительных и фиброзных медиаторов. , (4) ремоделирование легких посредством отложения коллагена и эластина и (5) гибель клеток в результате апоптоза.
, (4) ремоделирование легких посредством отложения коллагена и эластина и (5) гибель клеток в результате апоптоза.
Частицы кремнезема обладают пьезоэлектрическим свойством, что означает, что при определенном приложенном давлении кристаллы приобретают электрическую полярность. Это обеспечивает способность кремнеземной пыли вызывать прямую цитотоксичность. Частицы реагируют с резидентными клетками и вызывают перекисное окисление липидов мембраны бронхоальвеолярных клеток. Вновь разрушенные частицы являются наиболее цитотоксичными, так как они могут генерировать больше свободных радикалов в водной среде, которые разрушают плазматическую мембрану и высвобождают лизосомальные ферменты, вызывая тем самым повреждение тканей [22, 26].
Активные формы кислорода (АФК) и активные формы азота (АЧА) представляют собой высокореакционноспособные химические вещества, часто производимые для системы биологической защиты от вредных агентов. Однако взаимодействие между альвеолярными макрофагами и частицами кремнезема вызывает респираторный взрыв с высоким потреблением кислорода, повышением уровня индуцируемого синтеза оксида азота (iNOS) и выработкой АФК, что повреждает клетки легких [27, 28]. Среди АФК/РНС оксид азота играет критическую роль в патогенезе силикоза.Оксид азота образуется в результате превращения аминокислоты L-аргинина в L-цитруллин в присутствии iNOS, который затем взаимодействует с супероксидом и образует пероксинитрит, повреждающий митохондрии и ДНК и инактивирующий некоторые белки [29–31].
Среди АФК/РНС оксид азота играет критическую роль в патогенезе силикоза.Оксид азота образуется в результате превращения аминокислоты L-аргинина в L-цитруллин в присутствии iNOS, который затем взаимодействует с супероксидом и образует пероксинитрит, повреждающий митохондрии и ДНК и инактивирующий некоторые белки [29–31].
Окислительный стресс активирует транскрипционные факторы, такие как ядерный фактор каппа B (NF- κ B) [31] и белок-активатор 1 (AP-1) [32]. Взаимодействие кремнезема с макрофагами и эпителиальными клетками транслоцирует NF- κ B из цитоплазмы в ядро, где он связывается с ДНК, запуская транскрипцию и трансляцию генов, участвующих в воспалительных и фиброгенных процессах.Высвобождение цитокинов, хемокинов, липидных медиаторов и факторов роста привлекает полиморфноядерные и мононуклеарные клетки в альвеолярные пространства и вокруг частиц кремнезема, что способствует образованию гранулем [22, 31, 33].
Лейкотриен B4 представляет собой липидный медиатор, вырабатываемый мастоцитами в ответ на стимуляцию кремнеземом. Лейкотриен В4 увеличивает количество нейтрофилов в очаге воспаления, а также участвует в онкогенезе [34]. Кроме того, воспалительный белок макрофагов (MIP-) 1 и MIP-2 представляют собой хемокины, которые увеличивают количество макрофагов в ответ на повреждение легких, вызванное силикагелем [29, 35].Макрофаги являются первыми клетками, которые взаимодействуют с частицами кремнезема, и это взаимодействие может активировать ряд внеклеточных сигналов, которые приводят к поляризации этих клеток [35]. Макрофаги M1 ответственны за противомикробные и воспалительные реакции, и клетки поляризованы по этому фенотипу в присутствии iNOS. Макрофаги поляризуются до фенотипа М2 в ответ на действие аргиназы, и в этом случае они участвуют в разрешении воспаления и восстановлении тканей [36-38].
В альвеолярных макрофагах рецепторы-мусорщики — (SR-) A и MARCO (макрофагальный рецептор с коллагеновой структурой) распознают и фагоцитируют частицы для удаления их из альвеол [24, 38].Тем не менее, нокаут MARCO увеличивает воспаление после воздействия кремнезема у мышей из-за повышенной пермеабилизации лизосомальной мембраны и активации воспаления [39]. Как только кремнезем активирует инфламмасому NLRP3 (NOD-подобный рецептор, пириновый домен, содержащий 3), происходит расщепление каспазы-1 и продукция цитокинов, таких как интерлейкин-(IL-) 18 и IL-1 β [39, 40]. ].
При воспалении, вызванном силикагелем, эпителиальные клетки и альвеолярные макрофаги секретируют IL-1 α и IL-1 β соответственно [26, 41].Оба цитокина участвуют в активации фибробластов и отложении коллагена. IL-1 α и IL-1 β являются агонистами, в то время как антагонист рецептора IL-1 (IL-1Ra) возникает естественным образом в ответ на воспаление и может ингибировать эффекты IL-1 [42, 43]. Кроме того, IL-1 β и фактор некроза опухоли- (TNF-) α повышают экспрессию IL-6, другого медиатора, участвующего в прогрессировании заболевания [44, 45].
Повышенная экспрессия TNF- α при силикозе приводит к рекрутированию и пролиферации фибробластов [31].TNF- α также может соединяться с рецептором гибели клеток и запускать каскад апоптоза. Нокаут лиганда Fas (FasL) у мышей и использование анти-TNF-антитела были способны предотвратить повреждение легких, вызванное силикагелем [46, 47].
После рекрутирования фибробластов в место повреждения трансформирующий фактор роста (TGF-) β индуцирует отложение коллагена [48], а также увеличивает выработку эластина [49]. Повышенная экспрессия металлопротеаз- (ММП-) 2 и ММП-9 и ингибирование тканевых ингибиторов металлопротеаз- (ТИМП-) 1 и ТИМП-2 вызывают перестройку легочной паренхимы по ходу заболевания [50, 51].Повышенное повреждение тканей, вызванное частицами кремнезема, деградация внеклеточного матрикса под действием ММР и усиление концентрического отложения коллагена ответственны за образование гранулем и ремоделирование легких, что ухудшает функцию легких.
Процесс апоптоза является результатом дисфункции митохондрий и повышенной экспрессии рецепторов смерти и их лигандов, таких как FasL и TNF [46, 47, 52]. Помимо окислительного стресса, частицы кремнезема приводят к потере потенциала митохондриальной мембраны, что сопровождается активацией каспазы-9 и каспазы-3 и фрагментацией ДНК [25].Клетки высвобождают хемотаксические факторы во время апоптоза, которые рекрутируют новые воспалительные клетки, усиливая воспаление. Важно отметить, что макрофаги, подвергающиеся апоптозу, также высвобождают частицы кремнезема обратно в паренхиму легких, где они снова фагоцитируются другими макрофагами, поддерживая цикл повреждения тканей [27].
3. Лечение силикоза: все еще неудовлетворенная потребность
Несмотря на изрядное возмущение по поводу эпидемиологической устойчивости силикоза, мало что было достигнуто с точки зрения разработки лечения.Исследования, направленные на удовлетворительную терапию силикоза, проводятся гораздо медленнее, чем в случае других хронических заболеваний легких. За последние 10 лет было завершено только два зарегистрированных клинических испытания по лечению силикоза [53, 54], в результате чего пробел должен быть восполнен специально развивающимися странами, такими как Бразилия, Индия и Китай, в которых распространенность силикоза облегчает доступность для клинических испытаний.
Лечение силикоза заключается в использовании бронходилататоров/лекарств от кашля, предотвращении воздействия раздражителей и тщательном наблюдении за респираторными инфекциями.Кортикостероидная терапия может использоваться для уменьшения бронхита и облегчения симптомов в качестве краткосрочного лечения, но ее долгосрочные положительные эффекты не доказаны; его недостатком является повышенный риск инфекций [55, 56]. Соединения на основе алюминия были тщательно изучены на предмет их способности покрывать частицы кремнезема, снижая реакционную способность кристаллов и, следовательно, защищая легочную ткань. Тем не менее, несмотря на хорошие результаты, полученные на экспериментальных моделях [57], клинические исследования не показали эффективности или устойчивого эффекта лечения алюминием у людей [58, 59].Поливинилпиридин-N-оксид (PVNO), полимер, способный усиливать цитопротекторное действие в моделях in vivo и in vitro фиброза, вызванного силикагелем, также широко тестировался. Профилактическое и терапевтическое применение PVNO дало положительные результаты на животных моделях [60], но малоэффективно у людей. PVNO замедлял прогрессирование фиброза у пациентов в одном небольшом клиническом исследовании, но не влиял на результат через три года после лечения [61] и имел ограниченный терапевтический эффект, зависящий от таких факторов, как возраст и тяжесть заболевания, в другом [62].Другим препаратом, который был протестирован для лечения силикоза, является травяной алкалоид тетрандрин. Он исторически использовался для лечения пневмокониоза в китайской медицине, и его терапевтическое использование при силикозе было одобрено Государственным управлением по лекарственным средствам Китая. Тетрандин сам по себе и в комбинации с другими препаратами был протестирован на животных и людях [63]. Тем не менее, необходимы надежные клинические испытания с объективными критериями, чтобы доказать его клиническую эффективность.
Из-за важной роли IL-1 β в патофизиологии силикоза, воздействие на этот цитокин может быть интересным вариантом лечения силикоза.В экспериментальных моделях ингибирование IL-1 приводило к снижению экспрессии TGF- β 1, коллагена I и фибронектина в легких [64], а также к уменьшению фиброза и воспаления в почках и сердце [65]. Использование антагониста рецептора IL-1 также уменьшало фиброз и размер фиброзных узелков у мышей [66]. В одном сообщении об использовании препарата анакинра — антагониста рецептора IL-1 — было показано улучшение респираторных симптомов и заметное улучшение рентгенологических изображений после шести месяцев лечения у 37-летнего мужчины [67].
Лаваж всего легкого, по-видимому, оказывает положительное влияние на лечение силикоза, улучшая прогноз пациентов и уменьшая легочную инфильтрацию, хотя нет никаких доказательств того, что этого подхода достаточно для предотвращения прогрессирования заболевания [68–70].
На экспериментальных моделях апробированы и другие подходы: использование гамма-интерферона [71], аскорбиновой кислоты [72], бета-аминопропионитрила [73], релаксина [74], супрессивных олигодезоксинуклеотидов [75], метилпальмитата [76], N-ацетилцистеина [77], дазатиниба [78] и нинтеданиба [79], антагонизма/блокировки IL-13 [80] и IL-17A [81], а также использования микроРНК miR- 486-5p [82] и генная терапия с помощью короткой шпилечной РНК для подавления β -катенина [83].Все эти положительные эффекты в моделях на животных, особенно уменьшение фиброза легких, до сих пор не были переведены в клинические испытания.
В качестве последнего средства трансплантация легких показана пациентам, у которых больше нет фармакологических вариантов. Тем не менее, долгосрочная выживаемость после трансплантации имеет неблагоприятный прогноз [84].
4. Клеточная терапия: от скамейки к постели
Первая трансплантация костного мозга была проведена в 1962 году с целью использования недавно открытых гемопоэтических стволовых клеток для восстановления правильной физиологии костного мозга пациента [85].
В 1981 году Эванс и Кауфман описали эмбриональные стволовые клетки как плюрипотентные клетки, полученные из внутренней массы эмбриона мыши, что изменило представление о потенциале стволовых клеток [86]. Совсем недавно стволовые клетки и стволоподобные клетки были обнаружены почти во всех тканях взрослого человека [87]. Трансплантацию клеток стали рассматривать как возможное лечение множества заболеваний из-за способности стволовых клеток дифференцироваться, заменяя поврежденные клетки в тканях-мишенях. Более того, клеточная трансплантация оказывала благотворное влияние на множественные модели заболеваний независимо от хоминга или дифференцировки клеток, что свидетельствует о паракринном/эндокринном эффекте клеток [88, 89].
Терапия на основе клеток имеет преимущества модуляции воспаления и одновременного воздействия на процесс ремоделирования, не проявляя токсичности или иммуносупрессии. Эти свойства делают клеточную терапию исключительно выгодным терапевтическим подходом к фиброзным заболеваниям легких, включая силикоз. В нескольких доклинических исследованиях использовался этот подход для лечения силикоза (1).
Таблица 1
Экспериментальные исследования с применением клеточной терапии при силикозе.
| Модель | Tyce | Tyce | Маршрут | Количество клеток | Содержимое | Ссылка | |
|---|---|---|---|---|---|---|---|
| C57BL / 6 | BMDC | I.T. | 2 × 10 6 | 30 и 60 дней | [96] | ||
| C57BL/6 | BMMC | i.v. i.т. | 2,5 × 10 6 | 15 дней | [98] | ||
| Sprague-Dawley | BMSC | 3 × 10 6 | 14 дн. | 2 дозы 2 × 10 6 | 60 дней | [36] | |
| C57BL/6 | BMSC | i.v. | 2 × 10 5 | 15 и 30 дней | [100] | ||
| C57BL/6 | BMMC | i.v. | 1 × 10 6 | 70 дней | [16] |
Наиболее широко изученным источником взрослых клеток для клеточной терапии является костный мозг. Костный мозг содержит множество клеток, находящихся на разных стадиях дифференцировки. Среди этих клеток гемопоэтические стволовые клетки имеют особое значение из-за их способности дифференцироваться в иммунные клетки и модулировать пролиферацию и активность иммунных клеток [90]. Тем не менее, пул клеток, присутствующих в клетках костного мозга, которые играют основную роль в поддержании, стимулировании роста и выживания других клеток, может иметь еще более сильный терапевтический потенциал.Эти клетки называются мезенхимальными стромальными клетками, и помимо своих стромальных свойств они также мультипотентны [91]. Было показано, что как пул мононуклеарных клеток, присутствующих в костном мозге, так и только стромальные клетки вызывают улучшение при широком спектре воспалительных заболеваний. Кроме того, клеточная терапия дала положительный эффект на моделях фиброзных заболеваний легких, таких как астма, ХОБЛ и фиброз легких, индуцированный блеомицином [92–94]. Продвигаются клинические испытания клеточной терапии заболеваний легких, зарегистрированы исследования в Европе, Бразилии, Австралии, Канаде и США [95].
В 2009 году наша группа опубликовала первую работу по использованию клеточной терапии на мышиной модели силикоза. Лассанс и др. использовали местную инфузию популяции прикрепленных мононуклеарных клеток (BMDC) и оценивали эффекты в двух временных точках. Результаты показали уменьшение воспалительного процесса через тридцать дней после лечения, что привело к улучшению функции легких; но эти положительные эффекты, казалось, исчезали в течение шестидесяти дней [96]. В 2013 году было опубликовано продолжение этого исследования, показывающее, что многократные дозы BMDC предотвращают прогрессирование заболевания.Две инфузии клеток костного мозга уменьшали воспаление (фракционная площадь гранулемы и количество общих макрофагов и макрофагов М1), ремоделирование легких (уровень TGF- β , отложение коллагена и эластических волокон) и апоптоз (уровень и количество каспазы-3). апоптотических клеток). Все эти эффекты приводят к улучшению параметров механики легких. Повышенный уровень IL-1Ra, по-видимому, играет роль в устойчивых эффектах клеточной терапии в течение более длительного времени на той же модели силикоза [36].
В 2011 году исследование с использованием всего пула мононуклеарных клеток костного мозга (BMMC) у мышей показало профилактические свойства в отношении повреждения легких, вызванного силикагелем.Системная инфузия BMMC снижала экспрессию мРНК каспазы-3, IL-1 β , IL-1 α и TGF- β [97]. Кроме того, терапевтическое лечение BMMC на поздних стадиях силикоза было способно уменьшить фиброз легких и улучшить функцию легких, но не помогло обратить вспять воспаление. Снижение количества макрофагов сопровождалось экспансией Т-регуляторных клеток, которые сохраняли клеточную инфильтрацию, хотя и переключались на другой профиль воспаления [16].BMMC предлагают преимущества аутологичной трансплантации, которые сводят к минимуму возможность отторжения, сбора и инфузии в один и тот же день без расширения культуры in vitro .
Эти результаты побудили нас перейти к фазе I клинических испытаний для проверки безопасности аутологичной трансплантации мононуклеарных клеток костного мозга у пациентов с силикотом. Пять пациентов подверглись инстилляции BMMC посредством бронхоскопии. Никаких побочных эффектов у этих пациентов не наблюдалось в течение года после лечения.Кроме того, после лечения наблюдалось раннее увеличение легочной перфузии [54].
Недостатками использования мононуклеарных клеток костного мозга являются инвазивность процедуры, особенно с учетом того, что для устойчивого эффекта могут потребоваться многократные дозы, и изменчивость конституции костного мозга. Хронические воспалительные заболевания могут влиять на соотношение популяций клеток костного мозга [101, 102], что делает аутологическую трансплантацию возможной гетерогенной для разных пациентов и стадий заболевания.
В качестве альтернативы мезенхимальные клетки могут представлять собой интересный вариант клеточной терапии при силикозе. Чжао и соавторы показали, что мезенхимальные клетки костного мозга (СККМ) способствуют ослаблению фиброза и воспалению в крысиной модели силикоза с возможными механизмами, аналогичными механизмам, связанным с терапией СККМ: подавление передачи сигналов ИЛ-1 через ИЛ-1 и снижение уровня ФНО. — экспрессия α [99].
Недавно были опубликованы результаты клинических испытаний с использованием мезенхимальных стромальных клеток и генетически модифицированной культуры мезенхимальных клеток [53].В данном исследовании введение МСК не вызывало побочных реакций, а через полгода насыщение оксигемоглобином в крови пациентов свидетельствует об улучшении газообмена в легких. У части пациентов также наблюдалось уменьшение количества кремнеземных узелков.
Другой взгляд на механизмы действия терапии мезенхимальными клетками при фиброзе легких, вызванном силикагелем, был предложен Choi et al. в 2014 г. Авторы предполагают, что внеклеточные везикулы, высвобождаемые СККМ, являются переносчиками терапевтического действия и сами по себе могут использоваться в качестве лечебного средства [100].
Кроме того, клеточная терапия эмбриональными клетками в качестве биоинженерного подхода к восстановлению поврежденного эпителия была исследована на модели повреждения, вызванного силикагелем, и смогла предотвратить фиброз и снизить смертность [98].
5. Заключение
В связи с отсутствием эффективных терапевтических вмешательств при силикозе клеточная терапия представляет собой многообещающее лечение силикоза. Ключевые эффекты этой терапии включают уменьшение вредных провоспалительных и профибротических процессов, уменьшение апоптоза и усиление репарации после повреждения легких.Эти положительные эффекты, по-видимому, не зависят от приживления клеток, а обусловлены паракринным/эндокринным действием (например, секрецией противовоспалительных, антифибротических медиаторов и внеклеточных везикул). Учитывая широкий спектр вариантов клеточной терапии, оптимизация протоколов клеточной терапии и успехи в клинических испытаниях могут привести к важному прорыву в лечении пациентов, страдающих этим стойким заболеванием.
Благодарности
Бразильский совет по научно-техническому развитию (CNPq), Координация по совершенствованию персонала высшего уровня (CAPES) и Государственный исследовательский фонд Карлос Чагас Филью в Рио-де-Жанейро (FAPERJ) поддержали эту работу.
Раскрытие информации
Спонсоры не участвуют в принятии решения о публикации или подготовке статьи.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Микейас Лопес-Пачеко и Эльга Бандейра внесли равный вклад в эту работу.
Ссылки
1. Leung C.C., Yu I.T.S., Chen W. Silicosis. Ланцет . 2012;379(9830):2008–2018. doi: 10.1016/s0140-6736(12)60235-9. [PubMed] [CrossRef] [Google Scholar]2.Хниздо Э., Мюррей Дж. Риск туберкулеза легких, связанный с силикозом и воздействием кремнеземной пыли у золотодобытчиков в Южной Африке. Медицина труда и окружающей среды . 1998;55(7):496–502. doi: 10.1136/oem.55.7.496. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]3. Hnizdo E., Vallyathan V. Хроническая обструктивная болезнь легких из-за профессионального воздействия кремнеземной пыли: обзор эпидемиологических и патологических данных. Медицина труда и окружающей среды .2003;60(4):237–243. doi: 10.1136/oem.60.4.237. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]4. Филью М. Т., Сантос У. Д. Э. П. Силикоз. Jornal Brasileiro de Pneumologia . 2006; 32:41–47. [PubMed] [Google Scholar]5. Браун Т. Воздействие кремнезема, курение, силикоз и комплексные взаимодействия рака легких. Медицина труда . 2009;59(2):89–95. doi: 10.1093/occmed/kqn171. [PubMed] [CrossRef] [Google Scholar]6. Ло Ре С., Якуб Ю., Девосс Р. и др. Разобщение между воспалительной и фиброзной реакцией на кремнезем: данные мышей с нокаутом MyD88. ПЛОС ОДИН . 2014;9(7) doi: 10.1371/journal.pone.0099383.e99383 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]7. Чен В., Лю Ю., Ван Х. и др. Длительное воздействие кремнеземной пыли и риск общей и причинной смертности китайских рабочих: когортное исследование. Медицина PLoS . 2012;9(4) doi: 10.1371/journal.pmed.1001206.e1001206 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]8. Холанда М. А., Холанда М. А., Мартинс М. П. С., Фелисмино П. Х., Пинейро В.Г. Ф. Силикоз у бразильских землекопов: взаимосвязь между воздействием пыли и рентгенологическими данными. Американский журнал промышленной медицины . 1995;27(3):367–378. doi: 10.1002/ajim.4700270306. [PubMed] [CrossRef] [Google Scholar]9. Карнейро А. П. С., Баррето С. М., Сикейра А. Л., Кавариани Ф., Форастьер Ф. Продолжение воздействия кремнезема после диагностики силикоза у бразильских золотодобытчиков. Американский журнал промышленной медицины . 2006;49(10):811–818. дои: 10.1002/аджим.20379. [PubMed] [CrossRef] [Google Scholar]10. Рибейро Ф.С.Н., Де Камарго Э.А., Альгранти Э., Вунш Филью В. Воздействие кремнезема на рабочем месте в Бразилии в 2001 г. Revista Brasileira de Epidemiologia . 2008;11(1):89–96. doi: 10.1590/S1415-790X2008000100008. [Перекрестная ссылка] [Академия Google] 11. Джиндал С.К. Силикоз в Индии: прошлое и настоящее. Текущее мнение в области пульмонологии . 2013;19(2):163–168. doi: 10.1097/MCP.0b013e32835bb19e. [PubMed] [CrossRef] [Google Scholar] 12. Кауппинен Т.Профессиональное воздействие канцерогенов в Европейском Союзе. Медицина труда и окружающей среды . 2000;57(1):10–18. doi: 10.1136/oem.57.1.10. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]13. Линч К. Д., Миллер В. Э., Альтхаус Р. Б., Гроус Д. В., Хейл Дж. М. Наблюдение за вдыхаемой пылью кристаллического кремнезема с использованием данных о соответствии OSHA (1979–1995) American Journal of Industrial Medicine . 1998;34(6):547–558. doi: 10.1002/(sici)1097-0274(199812)34:6lt;547::aid-ajim2>3.0.со;2-б. [PubMed] [CrossRef] [Google Scholar] 14. Перес-Алонсо А., Кордова-Донья Х.А., Милларес-Лоренцо Х.Л., Фигероа-Мурильо Э., Гарсия-Вадильо К., Ромеро-Морильо Х. Вспышка силикоза у рабочих испанского кварцевого конгломерата. Международный журнал гигиены труда и окружающей среды . 2014;20(1):26–32. doi: 10.1179/2049396713Y.0000000049. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]15. Вайс Д. Дж. Стволовые клетки, клеточная терапия и биоинженерия в биологии и заболеваниях легких.Всесторонний обзор новейшей литературы 2010–2012 гг. Анналы Американского торакального общества . 2013;10(5):S45–S97. doi: 10.1513/annalsats.201304-090aw. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]16. Лопес-Пачеко М., Вентура Т.Г., де Оливейра Х.Д. и др. Инфузия мононуклеарных клеток костного мозга уменьшает фиброз легких, но не воспаление на поздних стадиях мышиного силикоза. ПЛОС ОДИН . 2014;9(10) doi: 10.1371/journal.pone.0109982.e109982 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]17.Ортис Л. А., Гамбелли Ф., Макбрайд К. и др. Приживление мезенхимальных стволовых клеток в легких усиливается в ответ на воздействие блеомицина и ослабляет его фиброзные эффекты. Труды Национальной академии наук Соединенных Штатов Америки . 2003;100(14):8407–8411. doi: 10.1073/pnas.1432929100. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]18. Шуллер-Левис Г., Гордон Р. Э., Ван С., Парк С. Ю., Парк Э. Защита фиброза и воспаления, вызванного блеомицином, таурином. Международная иммунофармакология . 2009;9(7-8):971–977. doi: 10.1016/j.intimp.2009.04.003. [PubMed] [CrossRef] [Google Scholar] 19. Cruz F.F., Antunes M.A., Abreu S.C., et al. Защитные эффекты терапии мононуклеарными клетками костного мозга на легкие и сердце в модели эмфиземы, вызванной эластазой. Физиология дыхания и нейробиология . 2012;182(1):26–36. doi: 10.1016/j.resp.2012.01.002. [PubMed] [CrossRef] [Google Scholar] 20. Гамильтон Р.Ф., мл., Такур С.А., Холиан А.Связывание кремнезема и токсичность в альвеолярных макрофагах. Свободнорадикальная биология и медицина . 2008;44(7):1246–1258. doi: 10.1016/j.freeradbiomed.2007.12.027. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]21. Цуда А., Генри Ф. С., Батлер Дж. П. Перенос и осаждение частиц: основы физики кинетики частиц. Комплексная физиология . 2013;3(4):1437–1471. doi: 10.1002/cphy.c100085. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]22. Кастранова В. От шахтной пыли к кварцу: механизмы легочной патогенности. Ингаляционная токсикология . 2000;12(3):7–14. doi: 10.1080/08958378.2000.11463226. [PubMed] [CrossRef] [Google Scholar] 23. Кастранова В., Вальятан В. Силикоз и пневмокониоз угольщиков. Перспективы гигиены окружающей среды . 2000;108(4):675–684. doi: 10.1289/ehp.00108s4675. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]24. Huaux F. Новые разработки в понимании иммунологии при силикозе. Текущее мнение по аллергии и клинической иммунологии .2007;7(2):168–173. doi: 10.1097/aci.0b013e32802bf8a5. [PubMed] [CrossRef] [Google Scholar] 25. Джоши Г. Н., Кнехт Д. А. Фагоцитоз кремнезема вызывает апоптоз и некроз различными временными и молекулярными путями в альвеолярных макрофагах. Апоптоз . 2013;18(3):271–285. doi: 10.1007/s10495-012-0798-y. [PubMed] [CrossRef] [Google Scholar] 26. Гринберг М.И., Ваксман Дж., Кертис Дж. Силикоз: обзор. Болезнь в месяц . 2007;53(8):394–416. doi: 10.1016/j.disamonth.2007.09.020. [PubMed] [CrossRef] [Google Scholar] 27. Фубини Б., Хаббард А. Генерация активных форм кислорода (АФК) и активных форм азота (РНС) кремнеземом при воспалении и фиброзе. Свободнорадикальная биология и медицина . 2003;34(12):1507–1516. doi: 10.1016/s0891-5849(03)00149-7. [PubMed] [CrossRef] [Google Scholar] 28. Блэкфорд Дж. А., мл., Антонини Дж. М., Кастранова В., Дей Р. Д. Интратрахеальная инстилляция кремнезема повышает экспрессию гена индуцибельной синтазы оксида азота и увеличивает выработку оксида азота в альвеолярных макрофагах и нейтрофилах. Американский журнал респираторной клеточной и молекулярной биологии . 1994;11(4):426–431. doi: 10.1165/ajrcmb.11.4.7522485. [PubMed] [CrossRef] [Google Scholar] 29. Зейдлер П. К., Хаббс А., Баттелли Л., Кастранова В. Роль индуцибельного оксида азота, полученного синтазой оксида азота, в вызванном кремнеземом воспалении легких и фиброзе. Журнал токсикологии и гигиены окружающей среды — часть A . 2004;67(13):1001–1026. doi: 10.1080/152873904296. [PubMed] [CrossRef] [Google Scholar] 30. Портер Д.W., Millecchia L., Robinson V.A. и соавт. Повышенное образование и повреждение оксида азота и активных форм кислорода после вдыхания кремнезема. Американский журнал физиологии — клеточная и молекулярная физиология легких . 2002; 283(2):L485–L493. doi: 10.1152/ajplung.00427.2001. [PubMed] [CrossRef] [Google Scholar] 31. Ding M., Chen F., Shi X., Yucesoy B., Mossman B., Vallyathan V. Заболевания, вызванные кремнеземом: механизмы повреждения и развития болезни. Международная иммунофармакология .2002;2(2-3):173–182. doi: 10.1016/s1567-5769(01)00170-9. [PubMed] [CrossRef] [Google Scholar] 32. Дин М., Ши С., Донг З. и др. Свежерасколотый кристаллический кремнезем индуцирует активацию белка-1 активатора через ERK и p38 MAPK. Журнал биологической химии . 1999;274(43):30611–30616. doi: 10.1074/jbc.274.43.30611. [PubMed] [CrossRef] [Google Scholar] 33. Ди Джузеппе М., Гамбелли Ф., Хойл Г.В. и др. Системное ингибирование активации NF- κ B защищает от силикоза. ПЛОС ОДИН . 2009;4(5) doi: 10.1371/journal.pone.0005689.e5689 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]34. Сатпати С.Р., Джала В.Р., Боддулури С.Р. и др. Индуцированное кристаллическим кремнеземом лейкотриен-В4-зависимое воспаление способствует росту опухоли легких. Связь с природой . 2015;6, статья 7064 doi: 10.1038/ncomms8064. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]35. Миссон П., ван ден Брюле С., Барбарин В., Лисон Д., Хуаукс Ф. Маркеры дифференцировки макрофагов при экспериментальном силикозе. Журнал биологии лейкоцитов . 2004;76(5):926–932. doi: 10.1189/jlb.0104019. [PubMed] [CrossRef] [Google Scholar] 36. Лопес-Пачеко М., Ксисто Д. Г., Орнеллас Ф. М. и соавт. Повторное введение клеток костного мозга предотвращает прогрессирование заболевания при экспериментальном силикозе. Клеточная физиология и биохимия . 2013;32(6):1681–1694. doi: 10.1159/000356603. [PubMed] [CrossRef] [Google Scholar] 37. Полякович М., Портер Д.В., Миллеккиа Л. и др. Специфическое для клеток и изоформ увеличение экспрессии аргиназы при остром воспалении легких, вызванном силикагелем. Журнал токсикологии и гигиены окружающей среды A . 2007;70(2):118–127. doi: 10.1080/152873755075. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]38. Мурти С., Ларсон-Кейси Дж. Л., Райан А. Дж., Хе С., Кобзик Л., Картер А. Б. Альтернативная активация макрофагов и легочный фиброз модулируются рецептором мусорщика, рецептором макрофагов с коллагеновой структурой. Журнал FASEB . 2015;29(8):3527–3536. doi: 10.1096/fj.15-271304. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]39.Бисвас Р., Гамильтон Р. Ф., Холиан А. Роль лизосом в индуцированной кремнеземом активации воспаления и воспалении в отсутствие MARCO. Журнал иммунологических исследований . 2014;2014:10. doi: 10.1155/2014/304180.304180 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]40. Питерс П.М., Перкинс Т.Н., Воутерс Э.Ф.М., Моссман Б.Т., Рейнарт Н.Л. Силикагель индуцирует активацию инфламмасомы NLRP3 в эпителиальных клетках легких человека. Токсикология частиц и волокон . 2013;10, статья 3 doi: 10.1186/1743-8977-10-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]41. Шривастава К.Д., Ром В.Н., Джагирдар Дж., Тинг-Ан Ю.И.Э., Гордон Т., Чу-Вонг К.-М. Решающая роль интерлейкина-1 β и синтазы оксида азота в индуцированном кремнием воспалении и апоптозе у мышей. Американский журнал респираторной и интенсивной терапии . 2002;165(4):527–533. doi: 10.1164/ajrccm.165.4.2106009. [PubMed] [CrossRef] [Google Scholar]43. Юсесой Б., Вальятан В., Ландситтель Д.П. и др. Полиморфизмы генного комплекса ИЛ-1 у шахтеров, больных силикозом. Американский журнал промышленной медицины . 2001;39(3):286–291. doi: 10.1002/1097-0274(200103)39:3<286::AID-AJIM1016>3.0.CO;2-7. [PubMed] [CrossRef] [Google Scholar]44. Vanhee D., Gosset P., Boitelle A., Wallaert B., Tonnel AB. Цитокины и сеть цитокинов при силикозе и пневмокониозе угольщиков. Европейский респираторный журнал . 1995;8(5):834–842. [PubMed] [Google Scholar]45. Винн Т.А., Рамалингам Т.Р. Механизмы фиброза: терапевтический перевод фиброзного заболевания. Природная медицина . 2012;18(7):1028–1040. doi: 10.1038/nm.2807. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]46. Борхес В. М., Фалькао Х., Лейте-Жуниор Дж. Х. и соавт. Лиганд Fas вызывает силикоз легких. Журнал экспериментальной медицины . 2001;194(2):155–164. doi: 10.1084/jem.194.2.155. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]47. Борхес В. М., Лопес М. Ф., Фалькао Х. и др. Апоптоз лежит в основе иммунопатогенных механизмов при остром силикозе. Американский журнал респираторной клеточной и молекулярной биологии . 2002;27(1):78–84. doi: 10.1165/ajrcmb.27.1.4717. [PubMed] [CrossRef] [Google Scholar]48. Джагирдар Дж., Бегин Р., Дюфресн А., Госвами С., Ли Т.С., Ром В.Н. Трансформирующий фактор роста-бета (TGF-бета) при силикозе. Американский журнал респираторной и интенсивной терапии . 1996;154(4):1076–1081. doi: 10.1164/ajrccm.154.4.8887610. [PubMed] [CrossRef] [Google Scholar]49. Мариани Т.Дж., Крауч Э., Роби Дж.Д., Старчер Б., Пирс Р.А. Увеличение выработки эластина при экспериментальной гранулематозной болезни легких. Американский журнал патологии . 1995;147(4):988–1000. [Бесплатная статья PMC] [PubMed] [Google Scholar]50. Перес-Рамос Дж., Сегура-Вальдес М.Д.Л., Ванда Б., Сельман М., Пардо А. Матриксные металлопротеиназы 2, 9 и 13 и тканевые ингибиторы металлопротеиназ 1 и 2 при экспериментальном силикозе легких. Американский журнал респираторной и интенсивной терапии .1999;160(4):1274–1282. doi: 10.1164/ajrccm.160.4.9808006. [PubMed] [CrossRef] [Google Scholar]51. Скабиллони Дж. Ф., Ван Л., Антонини Дж. М., Робертс Дж. Р., Кастранова В., Мерсер Р. Р. Индукция матриксной металлопротеиназы при фиброзе и образовании фиброзных узелков из-за вдыхания кремнезема. Американский журнал физиологии: клеточная и молекулярная физиология легких . 2005; 288(4):L709–L717. doi: 10.1152/ajplung.00034.2004. [PubMed] [CrossRef] [Google Scholar]52. Яо С.-К., Рожанасакул Л.В., Чен З.-Ю., и др. Апоптоз альвеолярных макрофагов, опосредованный путем Fas/FasL, участвует в силикозе человека. Апоптоз . 2011;16(12):1195–1204. doi: 10.1007/s10495-011-0647-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]53. Liu W.W., Wang H.X., Yu W., et al. Лечение силикоза аутологичными стромальными клетками костного мозга, модифицированными фактором роста гепатоцитов: нерандомизированное исследование с последующим наблюдением. Генетика и молекулярные исследования . 2015;14(3):10672–10681. дои: 10.4238/2015.9.7 сентября. [PubMed] [CrossRef] [Google Scholar]54. Моралес М.М., Соуза С.А., Лойвос Л.П. и соавт. Пилотное исследование безопасности внутрибронхиальной инстилляции мононуклеарных клеток костного мозга у пациентов с силикозом. BMC Пульмонология . 2015;15, статья 66 doi: 10.1186/s12890-015-0061-8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]55. Шарма С.К., Панде Дж.Н., Верма К. Эффект лечения преднизолоном при хроническом силикозе. Американский обзор респираторных заболеваний .1991;143(4):814–821. doi: 10.1164/ajrccm/143.4_pt_1.814. [PubMed] [CrossRef] [Google Scholar]56. Гудман Г.Б., Каплан П.Д., Стахура И., Кастранова В., Пайлес В.Х., Лапп Н.Л. Острый силикоз, отвечающий на кортикостероидную терапию. Сундук . 1992;101(2):366–370. doi: 10.1378/сундук.101.2.366. [PubMed] [CrossRef] [Google Scholar]57. Дюбуа Ф., Бегин Р., Кантин А. и др. Вдыхание алюминия уменьшает силикоз на модели овец. Американский обзор респираторных заболеваний . 1988;137(5):1172–1179.doi: 10.1164/ajrccm/137.5.1172. [PubMed] [CrossRef] [Google Scholar]59. Кеннеди М. С. Ингаляции алюминиевой пудры при лечении силикоза гончарных рабочих и пневмокониоза шахтеров. Британский журнал промышленной медицины . 1956; 13 (2): 85–101. [Бесплатная статья PMC] [PubMed] [Google Scholar]60. Schlipköter H.W. Возможности этиотропной профилактики и терапии пневмокониозов. Архив гигиены окружающей среды . 1970;21(2):181–191. doi: 10.1080/00039896.1970.10667218. [PubMed] [CrossRef] [Google Scholar]61. Чжао Дж., Лю Дж., Ли Г. Долгосрочные наблюдения за терапевтическим эффектом PVNO при силикозе человека. Zentralblatt für Bakteriologie, Microbiologie und Hygiene Серия B . 1983; 178: 259–262. [PubMed] [Google Scholar]62. Идец-Садковска И., Анджейак Р., Антонович-Юхневич Ю., Качмарек-Вдовяк Б. Испытания случайного лечения силикоза. Медицина Праси . 2006;57(3):271–280. [PubMed] [Google Scholar]63. Се К.-М., Тан Х.-Ф., Чен Ж.-К., Биан Р.-Л. Фармакологическое действие тетрандрина при воспалительных заболеваниях легких. Acta Pharmacologica Sinica . 2002;23(12):1107–1113. [PubMed] [Google Scholar]64. Го Дж., Гу Н., Чен Дж. и др. Нейтрализация интерлейкина-1 бета ослабляет вызванное силикагелем воспаление легких и фиброз у мышей C57BL/6. Архивы токсикологии . 2013;87(11):1963–1973. doi: 10.1007/s00204-013-1063-z. [PubMed] [CrossRef] [Google Scholar] 65. Guo J., Shi T., Cui X. и др.Влияние воздействия диоксида кремния на сердечную и почечную воспалительную и фиброзную реакцию и антагонистическую роль интерлейкина-1 β у мышей C57BL/6. Архивы токсикологии . 2016;90(2):247–258. doi: 10.1007/s00204-014-1405-5. [PubMed] [CrossRef] [Google Scholar]66. Piguet P.F., Vesin C., Grau G.E., Thompson R.C. Антагонист рецептора интерлейкина 1 (IL-1ra) предотвращает или лечит легочный фиброз, вызванный у мышей блеомицином или диоксидом кремния. Цитокин . 1993;5(1):57–61.doi: 10.1016/1043-4666(93)
-Y. [PubMed] [CrossRef] [Google Scholar]67. Cavalli G., Fallanca F., Dinarello C.A., Dagna L. Лечение легочного силикоза путем блокирования интерлейкина 1. American Journal of Respiratory and Critical Care Medicine . 2015;191(5):596–598. doi: 10.1164/rccm.201412-2150le. [PubMed] [CrossRef] [Google Scholar]68. Стаффорд М., Каппа А., Вейант М. и др. Лечение острого силикопротеиноза лаважем всего легкого. Семинары по кардиоторакальной и сосудистой анестезии .2013;17(2):152–159. doi: 10.1177/1089253213486524. [PubMed] [CrossRef] [Google Scholar]69. Мейсон Г.Р., Абрахам Дж.Л., Хоффман Л., Коул С., Липпманн М., Вассерман К. Лечение смешанно-пылевого пневмокониоза промыванием всего легкого. Американский обзор респираторных заболеваний . 1982;126(6):1102–1107. [PubMed] [Google Scholar]70. Schuyler M.R., Gaumer HR, Stankus R.P., Kaimal J., Hoffmann E., Salvaggio J.E. Бронхоальвеолярный лаваж при силикозе: свидетельство гиперплазии клеток II типа. Легкое .1979;157(1):95–102. doi: 10.1007/BF02713602. [PubMed] [CrossRef] [Google Scholar]71. Чен Ю., Чен Дж., Донг Дж., Лю В. Антифибротический эффект гамма-интерферона на модели силикоза у крыс. Письма по токсикологии . 2005;155(3):353–360. doi: 10.1016/j.toxlet.2004.10.011. [PubMed] [CrossRef] [Google Scholar]72. Kaw JL, Zaidi SH Влияние аскорбиновой кислоты на легочный силикоз морских свинок. Архив гигиены окружающей среды . 1969;19(1):74–82. doi: 10.1080/00039896.1969.10666807.[PubMed] [CrossRef] [Google Scholar]73. Levene C.I., Bye I., Saffiotti U. Влияние бета-аминопропионитрила на силикотический легочный фиброз у крыс. Британский журнал экспериментальной патологии . 1968;49(2):152–159. [Бесплатная статья PMC] [PubMed] [Google Scholar]74. Ли С.-Ф., Ляо Дж., Синь З.-К., Лу В.-К., Лю А.-Л. Релаксин ослабляет индуцированный силикагелем легочный фиброз, регулируя коллаген I типа и MMP-2. Международная иммунофармакология . 2013;17(3):537–542. дои: 10.1016/j.intimp.2013.07.020. [PubMed] [CrossRef] [Google Scholar]75. Сато Т., Шимосато Т., Алворд В. Г., Клинман Д. М. Супрессивные олигодезоксинуклеотиды ингибируют воспаление легких, вызванное кремнеземом. Журнал иммунологии . 2008;180(11):7648–7654. doi: 10.4049/jиммунол.180.11.7648. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]76. Шарави М. Х., Эль-Агами Д. С., Шалаби А. А., Аммар Э.-С. М. Защитные эффекты метилпальмитата против индуцированного диоксидом кремния легочного фиброза у крыс. Международная иммунофармакология . 2013;16(2):191–198. doi: 10.1016/j.intimp.2013.04.007. [PubMed] [CrossRef] [Google Scholar]77. Чжан Л., Хе Ю., Ли К. и др. N-ацетилцистеин облегчал фиброз легких, вызванный силикагелем, у крыс путем подавления АФК и передачи сигналов митохондриального апоптоза. Механизмы и методы токсикологии . 2013;24(3):212–219. doi: 10.3109/15376516.2013.879974. [PubMed] [CrossRef] [Google Scholar]78. Cruz F.F., Horta L.F.B., Maia L.D.A., et al. Дазатиниб уменьшает воспаление легких и фиброз при остром экспериментальном силикозе. ПЛОС ОДИН . 2016;11(1) doi: 10.1371/journal.pone.0147005.e0147005 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]79. Воллин Л., Майе И., Кенио В., Хольвег А., Риффель Б. Антифибротическая и противовоспалительная активность ингибитора тирозинкиназы нинтеданиба в экспериментальных моделях фиброза легких. Журнал фармакологии и экспериментальной терапии . 2014;349(2):209–220. doi: 10.1124/jpet.113.208223. [PubMed] [CrossRef] [Google Scholar]80. Феррейра Т.П.T., De Arantes A.C.S., Do Nascimento C.V.M.F., et al. Иммунотоксин ИЛ-13 ускоряет разрешение патологических изменений в легких, вызванных частицами кремнезема у мышей. Журнал иммунологии . 2013;191(10):5220–5229. doi: 10.4049/jimmunol.1203551. [PubMed] [CrossRef] [Google Scholar]81. Чен Ю., Ли К., Венг Д. и др. Нейтрализация интерлейкина-17А задерживает прогрессирование вызванного силикагелем воспаления легких и фиброза у мышей C57BL/6. Токсикология и прикладная фармакология .2014;275(1):62–72. doi: 10.1016/j.taap.2013.11.012. [PubMed] [CrossRef] [Google Scholar]82. Ji X., Wu B., Fan J. и др. Антифибротические эффекты и механизмы микроРНК-486-5p при легочном фиброзе. Научные отчеты . 2015; 5 doi: 10.1038/srep14131.14131 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]83. Wang X., Dai W., Wang Y., Gu Q., Yang D., Zhang M. Блокирование пути Wnt/ β -катенина с помощью опосредованной лентивирусом РНК с короткой шпилькой, нацеленной на ген β -катенина, подавляет силика- индуцированный фиброз легких у мышей. Международный журнал экологических исследований и общественного здравоохранения . 2015;12(9):10739–10754. doi: 10.3390/ijerph2209. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]84. Хартерт М., Сенбаклавацин О., Горбандт Б., Фишер Б. М., Буль Р., Валд С.-Ф. Трансплантация легких: вариант лечения терминальной стадии заболевания легких. Deutsches Ärzteblatt International . 2014;111(7):107–116. doi: 10.3238/arztebl.2014.0107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]85.Томас Э. Д., Филлипс Дж. Х., Финч С. А. Восстановление после отказа костного мозга после изогенной инфузии костного мозга. Журнал Американской медицинской ассоциации . 1964; 188: 1041–1043. [PubMed] [Google Scholar]86. Эванс М.Дж., Кауфман М.Х. Установление в культуре плюрипотентных клеток из эмбрионов мыши. Природа . 1981;292(5819):154–156. дои: 10.1038/292154a0. [PubMed] [CrossRef] [Google Scholar]87. da Silva Meirelles L., Chagastelles P.C., Nardi N.B. Мезенхимальные стволовые клетки находятся практически во всех постнатальных органах и тканях. Журнал клеточной науки . 2006;119(11):2204–2213. doi: 10.1242/jcs.02932. [PubMed] [CrossRef] [Google Scholar]88. да Силва Мейреллес Л., Фонтес А.М., Ковас Д.Т., Каплан А.И. Механизмы, участвующие в терапевтических свойствах мезенхимальных стволовых клеток. Обзоры цитокинов и факторов роста . 2009;20(5-6):419–427. doi: 10.1016/j.cytogfr.2009.10.002. [PubMed] [CrossRef] [Google Scholar]89. Краузе Д.С. Клетки костного мозга и стволовые клетки при восстановлении легких. Труды Американского торакального общества .2008;5(3):323–327. doi: 10.1513/pats.200712-169DR. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]90. Ратайчак М. З. Фенотипическая и функциональная характеристика гемопоэтических стволовых клеток. Текущее мнение по гематологии . 2008;15(4):293–300. doi: 10.1097/moh.0b013e328302c7ca. [PubMed] [CrossRef] [Google Scholar]91. Каплан А. И. Мезенхимальные стволовые клетки. Журнал ортопедических исследований . 1991;9(5):641–650. doi: 10.1002/jor.11000
Клеточная терапия силикоза
Силикоз является наиболее распространенным пневмокониозом во всем мире, с более высокой распространенностью и заболеваемостью в развивающихся странах.На сегодняшний день не существует эффективного лечения, позволяющего остановить или обратить вспять прогрессирование заболевания, вызванное повреждением легких, вызванным силикагелем. Необходимо добиться значительных успехов, чтобы снизить заболеваемость и смертность, связанные с силикозом. В этом обзоре мы выделили основные механизмы действия, которые вызывают повреждение легких частицами кремнезема, и обобщили данные о терапевтических перспективах клеточной терапии силикоза.
1. Введение
Процесс индустриализации неуклонно увеличивает профессиональную экспозицию рабочих к вдыхаемым частицам во многих рабочих средах.Среди этих частиц диоксид кремния или кремнезем играет важную роль в бремени респираторных профессиональных заболеваний. Вдыхание частиц кремнезема вызывает силикоз: стойкое воспаление с образованием гранулем, что приводит к ремоделированию тканей и нарушению функции легких [1]. Туберкулез, хронические обструктивные заболевания легких и ревматоидный артрит являются некоторыми распространенными осложнениями, связанными с силикозом [2–4]. Длительное воздействие кремнезема также может вызывать рак легких [5, 6]. На сегодняшний день доступное лечение силикоза сосредоточено на контроле сопутствующих симптомов и сопутствующих заболеваний, и никакая терапия не останавливает или не обращает вспять прогрессирование заболевания.В терминальной стадии болезни легких пациент умирает от дыхательной недостаточности [1].
За последние десятилетия было предпринято много усилий для предотвращения вдыхания рабочими пыли кремнезема; однако силикоз по-прежнему является проблемой общественного здравоохранения во всем мире с более высокой распространенностью в развивающихся странах [7]. В Бразилии Холанда и его сотрудники показали распространенность силикоза у 33% землекопов в штате Сеара [8], и более 4500 случаев силикоза были связаны с золотодобытчиками в период с 1978 по 1988 год в штате Минас-Жерайс [9].В настоящее время ожидается, что более 6 миллионов рабочих ежедневно подвергаются воздействию кремнезема в различных сферах труда по всей стране [4, 10]. В Китае в период с 1991 по 1995 год было зарегистрировано более 500 000 больных силикозом, около 6 000 новых случаев и более 24 000 смертей в год [1]. В Индии 10 миллионов рабочих подвергаются воздействию кварцевой пыли с высоким риском развития заболевания [11].
Силикоз также является проблемой гигиены труда в развитых странах. В период с 1990 по 1993 год в Европе более 3 миллионов рабочих подверглись воздействию частиц кремнезема, 600 000 из них — в Соединенном Королевстве [12].В Соединенных Штатах более 100 000 рабочих подвергались воздействию кварцевой пыли, и с 1987 по 1996 год ежегодно регистрировалось более 3 500 новых случаев [13]. Реализация защитных мероприятий позволила снизить количество новых случаев силикоза и уровень смертности. Тем не менее, силикоз по-прежнему неизлечим, и случаются новые вспышки, такие как заражение работников кварцевого конгломерата в Испании, где средний возраст когорты составлял 33 года [14]. Кроме того, увеличивается количество рабочих сред с потенциальным воздействием кварцевой пыли, таких как пескоструйная обработка джинсов и кварцевание.
Все больше статей показали эффективность как системного, так и интратрахеального введения стволовых клеток в нескольких животных моделях повреждения легких [15]. Среди них наиболее изучены клетки костного мозга. Они были способны способствовать реэпителизации легочной паренхимы, модулировать иммунный ответ и уменьшать ремоделирование тканей [16–19]. Силикоз имеет уникальный процесс патогенеза, при котором фагоцитоз и высвобождение частиц кремнезема в легочной ткани вызывают прогрессирование заболевания [20].В этом обзоре освещаются основные механизмы действия кварцевой пыли в альвеолярной среде и то, как клеточная терапия может помочь пациентам с силикозом, модулируя воспаление, уменьшая фиброз и, таким образом, улучшая функцию легких.
2. Патогенез: цикл повреждения легочной ткани
Частицы кремнезема, которые преодолевают мукоцилиарный защитный механизм в дыхательных путях и достигают дистальных отделов легких, начинают каскад патогенеза. Наиболее патогенными для человека являются частицы размером менее 10 мкм м, так как они обладают необходимой аэродинамикой для достижения бронхиол и альвеол [4, 21].
Силикоз обусловлен циклом фагоцитоза и высвобождением этих частиц, что приводит к повреждению эпителия, ремоделированию легких и уменьшению площади газообмена. Повреждение легких, вызванное кремнеземом, происходит по пяти основным механизмам (рис. 1): (1) прямая цитотоксичность, (2) образование реактивных частиц, (3) продукция цитокинов и хемокинов, (4) фиброз и (5) гибель клеток апоптоз [22–25].
Частицы кремнезема обладают пьезоэлектрическим свойством, что означает, что при определенном приложенном давлении кристаллы приобретают электрическую полярность.Это обеспечивает способность кремнеземной пыли вызывать прямую цитотоксичность. Частицы реагируют с резидентными клетками и вызывают перекисное окисление липидов мембраны бронхоальвеолярных клеток. Вновь разрушенные частицы являются наиболее цитотоксичными, так как они могут генерировать больше свободных радикалов в водной среде, которые разрушают плазматическую мембрану и высвобождают лизосомальные ферменты, вызывая тем самым повреждение тканей [22, 26].
Активные формы кислорода (АФК) и активные формы азота (АЧА) представляют собой высокореакционноспособные химические вещества, часто производимые для системы биологической защиты от вредных агентов.Однако взаимодействие между альвеолярными макрофагами и частицами кремнезема вызывает респираторный взрыв с высоким потреблением кислорода, повышением уровня индуцируемого синтеза оксида азота (iNOS) и выработкой АФК, что повреждает клетки легких [27, 28]. Среди АФК/РНС оксид азота играет критическую роль в патогенезе силикоза. Оксид азота образуется в результате превращения аминокислоты L-аргинина в L-цитруллин в присутствии iNOS, который затем взаимодействует с супероксидом и образует пероксинитрит, повреждающий митохондрии и ДНК и инактивирующий некоторые белки [29–31].
Окислительный стресс активирует транскрипционные факторы, такие как ядерный фактор каппа B (NF- κ B) [31] и белок-активатор 1 (AP-1) [32]. Взаимодействие кремнезема с макрофагами и эпителиальными клетками транслоцирует NF- κ B из цитоплазмы в ядро, где он связывается с ДНК, запуская транскрипцию и трансляцию генов, участвующих в воспалительных и фиброгенных процессах. Высвобождение цитокинов, хемокинов, липидных медиаторов и факторов роста привлекает полиморфноядерные и мононуклеарные клетки в альвеолярные пространства и вокруг частиц кремнезема, что способствует образованию гранулем [22, 31, 33].
Лейкотриен B4 представляет собой липидный медиатор, вырабатываемый мастоцитами в ответ на стимуляцию кремнеземом. Лейкотриен В4 увеличивает количество нейтрофилов в очаге воспаления, а также участвует в онкогенезе [34]. Кроме того, воспалительный белок макрофагов (MIP-) 1 и MIP-2 представляют собой хемокины, которые увеличивают количество макрофагов в ответ на повреждение легких, вызванное силикагелем [29, 35]. Макрофаги являются первыми клетками, которые взаимодействуют с частицами кремнезема, и это взаимодействие может активировать ряд внеклеточных сигналов, которые приводят к поляризации этих клеток [35].Макрофаги M1 ответственны за противомикробные и воспалительные реакции, и клетки поляризованы по этому фенотипу в присутствии iNOS. Макрофаги поляризуются до фенотипа М2 в ответ на действие аргиназы, и в этом случае они участвуют в разрешении воспаления и восстановлении тканей [36-38].
В альвеолярных макрофагах рецепторы-мусорщики — (SR-) A и MARCO (макрофагальный рецептор с коллагеновой структурой) распознают и фагоцитируют частицы для удаления их из альвеол [24, 38].Тем не менее, нокаут MARCO увеличивает воспаление после воздействия кремнезема у мышей из-за повышенной пермеабилизации лизосомальной мембраны и активации воспаления [39]. Как только кремнезем активирует инфламмасому NLRP3 (NOD-подобный рецептор, пириновый домен, содержащий 3), происходит расщепление каспазы-1 и продукция цитокинов, таких как интерлейкин-(IL-) 18 и IL-1 β [39, 40]. ].
Во время воспаления, вызванного силикагелем, эпителиальные клетки и альвеолярные макрофаги секретируют IL-1 α и IL-1 β соответственно [26, 41].Оба цитокина участвуют в активации фибробластов и отложении коллагена. IL-1 α и IL-1 β являются агонистами, в то время как антагонист рецептора IL-1 (IL-1Ra) естественным образом возникает в ответ на воспаление и может ингибировать эффекты IL-1 [42, 43]. Кроме того, IL-1 β и фактор некроза опухоли- (TNF-) α повышают экспрессию IL-6, другого медиатора, участвующего в прогрессировании заболевания [44, 45].
Повышенная экспрессия TNF- α при силикозе приводит к рекрутированию и пролиферации фибробластов [31].TNF- α также может соединяться с рецептором клеточной гибели и запускать каскад апоптоза. Нокаут лиганда Fas (FasL) у мышей и использование анти-TNF-антитела были способны предотвратить повреждение легких, вызванное силикагелем [46, 47].
После рекрутирования фибробластов к месту повреждения трансформирующий фактор роста (TGF-) β индуцирует отложение коллагена [48], а также увеличивает выработку эластина [49]. Повышенная экспрессия металлопротеаз- (ММП-) 2 и ММП-9 и ингибирование тканевых ингибиторов металлопротеаз- (ТИМП-) 1 и ТИМП-2 вызывают перестройку легочной паренхимы по ходу заболевания [50, 51].Повышенное повреждение тканей, вызванное частицами кремнезема, деградация внеклеточного матрикса под действием ММР и усиление концентрического отложения коллагена ответственны за образование гранулем и ремоделирование легких, что ухудшает функцию легких.
Процесс апоптоза является результатом дисфункции митохондрий и повышенной экспрессии рецепторов смерти и их лигандов, таких как FasL и TNF [46, 47, 52]. Помимо окислительного стресса, частицы кремнезема приводят к потере потенциала митохондриальной мембраны, что сопровождается активацией каспазы-9 и каспазы-3 и фрагментацией ДНК [25].Клетки высвобождают хемотаксические факторы во время апоптоза, которые рекрутируют новые воспалительные клетки, усиливая воспаление. Важно отметить, что макрофаги, подвергающиеся апоптозу, также высвобождают частицы кремнезема обратно в паренхиму легких, где они снова фагоцитируются другими макрофагами, поддерживая цикл повреждения тканей [27].
3. Лечение силикоза: все еще неудовлетворенная потребность
Несмотря на изрядное возмущение по поводу эпидемиологической персистенции силикоза, мало что было достигнуто с точки зрения разработки лечения.Исследования, направленные на удовлетворительную терапию силикоза, проводятся гораздо медленнее, чем в случае других хронических заболеваний легких. За последние 10 лет было завершено только два зарегистрированных клинических испытания по лечению силикоза [53, 54], в результате чего пробел должен быть восполнен специально развивающимися странами, такими как Бразилия, Индия и Китай, в которых распространенность силикоза облегчает доступность для клинических испытаний.
Лечение силикоза заключается в использовании бронходилататоров/лекарств от кашля, предотвращении воздействия раздражителей и тщательном наблюдении за респираторными инфекциями.Кортикостероидная терапия может использоваться для уменьшения бронхита и облегчения симптомов в качестве краткосрочного лечения, но ее долгосрочные положительные эффекты не доказаны; его недостатком является повышенный риск инфекций [55, 56]. Соединения на основе алюминия были тщательно изучены на предмет их способности покрывать частицы кремнезема, снижая реакционную способность кристаллов и, следовательно, защищая легочную ткань. Тем не менее, несмотря на хорошие результаты, полученные на экспериментальных моделях [57], клинические исследования не показали эффективности или устойчивого эффекта лечения алюминием у людей [58, 59].Поливинилпиридин-N-оксид (PVNO), полимер, способный усиливать цитопротекторное действие в моделях in vivo и in vitro фиброза, вызванного силикагелем, также широко тестировался. Профилактическое и терапевтическое применение PVNO дало положительные результаты на животных моделях [60], но малоэффективно у людей. PVNO замедлял прогрессирование фиброза у пациентов в одном небольшом клиническом исследовании, но не влиял на результат через три года после лечения [61] и имел ограниченный терапевтический эффект, зависящий от таких факторов, как возраст и тяжесть заболевания, в другом [62].Другим препаратом, который был протестирован для лечения силикоза, является травяной алкалоид тетрандрин. Он исторически использовался для лечения пневмокониоза в китайской медицине, и его терапевтическое использование при силикозе было одобрено Государственным управлением по лекарственным средствам Китая. Тетрандин сам по себе и в комбинации с другими препаратами был протестирован на животных и людях [63]. Тем не менее, необходимы надежные клинические испытания с объективными критериями, чтобы доказать его клиническую эффективность.
В связи с важной ролью IL-1 β в патофизиологии силикоза нацеливание на этот цитокин может быть интересным вариантом лечения силикоза.В экспериментальных моделях ингибирование IL-1 приводило к снижению экспрессии TGF- β 1, коллагена I и фибронектина в легких [64], а также к уменьшению фиброза и воспаления в почках и сердце [65]. Использование антагониста рецептора IL-1 также уменьшало фиброз и размер фиброзных узелков у мышей [66]. В одном сообщении об использовании препарата анакинра — антагониста рецептора IL-1 — было показано улучшение респираторных симптомов и заметное улучшение рентгенологических изображений после шести месяцев лечения у 37-летнего мужчины [67].
Лаваж всего легкого, по-видимому, оказывает положительное влияние на лечение силикоза, улучшая прогноз пациентов и уменьшая легочную инфильтрацию, хотя нет никаких доказательств того, что этого подхода достаточно для предотвращения прогрессирования заболевания [68–70].
На экспериментальных моделях апробированы и другие подходы: использование гамма-интерферона [71], аскорбиновой кислоты [72], бета-аминопропионитрила [73], релаксина [74], супрессивных олигодезоксинуклеотидов [75], метилпальмитата [76], N-ацетилцистеина [77], дазатиниба [78] и нинтеданиба [79], антагонизма/блокировки IL-13 [80] и IL-17A [81], а также использования микроРНК miR- 486-5p [82] и генная терапия с помощью короткой шпилечной РНК для молчания β -катенина [83].Все эти положительные эффекты в моделях на животных, особенно уменьшение фиброза легких, до сих пор не были переведены в клинические испытания.
В качестве последнего средства трансплантация легких показана пациентам, у которых больше нет фармакологических вариантов. Тем не менее, долгосрочная выживаемость после трансплантации имеет неблагоприятный прогноз [84].
4. Клеточная терапия: от скамейки к постели
Первая трансплантация костного мозга была проведена в 1962 году с целью использования недавно открытых гемопоэтических стволовых клеток для восстановления правильной физиологии костного мозга пациента [85].
В 1981 году Эванс и Кауфман описали эмбриональные стволовые клетки как плюрипотентные клетки, полученные из внутренней массы эмбриона мыши, что изменило представление о потенциале стволовых клеток [86]. Совсем недавно стволовые клетки и стволоподобные клетки были обнаружены почти во всех тканях взрослого человека [87]. Трансплантацию клеток стали рассматривать как возможное лечение множества заболеваний из-за способности стволовых клеток дифференцироваться, заменяя поврежденные клетки в тканях-мишенях. Более того, клеточная трансплантация оказывала благотворное влияние на множественные модели заболеваний независимо от хоминга или дифференцировки клеток, что свидетельствует о паракринном/эндокринном эффекте клеток [88, 89].
Терапия на основе клеток имеет преимущества модуляции воспаления и одновременного воздействия на процесс ремоделирования, не проявляя токсичности или иммуносупрессии. Эти свойства делают клеточную терапию исключительно выгодным терапевтическим подходом к фиброзным заболеваниям легких, включая силикоз. Этот подход использовался для лечения силикоза в нескольких доклинических исследованиях (таблица 1).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BMDC: клетки костного мозга; BMMC: мононуклеарные клетки костного мозга; СККМ: костномозгово-мезенхимальные стромальные клетки; HUES: эмбриональные стволовые клетки человека; я.т.: интратрахеальный; в/в: внутривенно. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Наиболее широко изученным источником взрослых клеток для клеточной терапии является костный мозг. Костный мозг содержит множество клеток, находящихся на разных стадиях дифференцировки. Среди этих клеток гемопоэтические стволовые клетки имеют особое значение из-за их способности дифференцироваться в иммунные клетки и модулировать пролиферацию и активность иммунных клеток [90]. Тем не менее, пул клеток, присутствующих в клетках костного мозга, которые играют основную роль в поддержании, стимулировании роста и выживания других клеток, может иметь еще более сильный терапевтический потенциал.Эти клетки называются мезенхимальными стромальными клетками, и помимо своих стромальных свойств они также мультипотентны [91]. Было показано, что как пул мононуклеарных клеток, присутствующих в костном мозге, так и только стромальные клетки вызывают улучшение при широком спектре воспалительных заболеваний. Кроме того, клеточная терапия дала положительный эффект на моделях фиброзных заболеваний легких, таких как астма, ХОБЛ и фиброз легких, индуцированный блеомицином [92–94]. Продвигаются клинические испытания клеточной терапии заболеваний легких, зарегистрированы исследования в Европе, Бразилии, Австралии, Канаде и США [95].
В 2009 году наша группа опубликовала первую работу по использованию клеточной терапии на мышиной модели силикоза. Лассанс и др. использовали местную инфузию популяции прикрепленных мононуклеарных клеток (BMDC) и оценивали эффекты в двух временных точках. Результаты показали уменьшение воспалительного процесса через тридцать дней после лечения, что привело к улучшению функции легких; но эти положительные эффекты, казалось, исчезали в течение шестидесяти дней [96]. В 2013 году было опубликовано продолжение этого исследования, показывающее, что многократные дозы BMDC предотвращают прогрессирование заболевания.Две инфузии клеток костного мозга уменьшали воспаление (фракционная площадь гранулемы и количество общих макрофагов и макрофагов М1), ремоделирование легких (уровень TGF- β , отложение коллагена и эластических волокон) и апоптоз (уровень и количество каспазы-3). апоптотических клеток). Все эти эффекты приводят к улучшению параметров механики легких. Повышенный уровень IL-1Ra, по-видимому, играет роль в устойчивых эффектах клеточной терапии в течение более длительного времени на той же модели силикоза [36].
В 2011 году исследование с использованием всего пула мононуклеарных клеток костного мозга (BMMC) у мышей показало профилактические свойства в отношении повреждения легких, вызванного силикагелем.Системная инфузия BMMC снижала экспрессию мРНК каспазы-3, IL-1 β , IL-1 α и TGF- β [97]. Кроме того, терапевтическое лечение BMMC на поздних стадиях силикоза было способно уменьшить фиброз легких и улучшить функцию легких, но не помогло обратить вспять воспаление. Снижение количества макрофагов сопровождалось экспансией Т-регуляторных клеток, которые сохраняли клеточную инфильтрацию, хотя и переключались на другой профиль воспаления [16].BMMC предлагают преимущества аутологичной трансплантации, которые сводят к минимуму возможность отторжения, сбора и инфузии в один и тот же день без размножения культуры in vitro .
Эти результаты побудили нас перейти к фазе I клинических испытаний для проверки безопасности аутологичной трансплантации мононуклеарных клеток костного мозга у пациентов с силикотом. Пять пациентов подверглись инстилляции BMMC посредством бронхоскопии. Никаких побочных эффектов у этих пациентов не наблюдалось в течение года после лечения.Кроме того, после лечения наблюдалось раннее увеличение легочной перфузии [54].
Недостатками использования мононуклеарных клеток костного мозга являются инвазивность процедуры, особенно с учетом того, что для устойчивого эффекта могут потребоваться многократные дозы, и изменчивость конституции костного мозга. Хронические воспалительные заболевания могут влиять на соотношение популяций клеток костного мозга [101, 102], что делает аутологическую трансплантацию возможной гетерогенной для разных пациентов и стадий заболевания.
В качестве альтернативы мезенхимальные клетки могут представлять собой интересный вариант клеточной терапии при силикозе. Чжао и соавторы показали, что мезенхимальные клетки костного мозга (СККМ) способствуют ослаблению фиброза и воспалению в крысиной модели силикоза с возможными механизмами, аналогичными механизмам, связанным с терапией СККМ: подавление передачи сигналов ИЛ-1 через ИЛ-1 и снижение уровня ФНО. — выражение α [99].
Недавно были опубликованы результаты клинических испытаний с использованием мезенхимальных стромальных клеток и генетически модифицированной культуры мезенхимальных клеток [53].В данном исследовании введение МСК не вызывало побочных реакций, а через полгода насыщение оксигемоглобином в крови пациентов свидетельствует об улучшении газообмена в легких. У части пациентов также наблюдалось уменьшение количества кремнеземных узелков.
Другой взгляд на механизмы действия терапии мезенхимальными клетками при фиброзе легких, вызванном силикагелем, был предложен Choi et al. в 2014 г. Авторы предполагают, что внеклеточные везикулы, высвобождаемые СККМ, являются переносчиками терапевтического действия и сами по себе могут использоваться в качестве лечебного средства [100].
Кроме того, клеточная терапия эмбриональными клетками в качестве биоинженерного подхода к восстановлению поврежденного эпителия была исследована на модели повреждения, вызванного силикагелем, и смогла предотвратить фиброз и снизить смертность [98].
5. Заключение
В связи с отсутствием эффективных терапевтических вмешательств при силикозе клеточная терапия представляет собой многообещающее лечение силикоза. Ключевые эффекты этой терапии включают уменьшение вредных провоспалительных и профибротических процессов, уменьшение апоптоза и усиление репарации после повреждения легких.Эти положительные эффекты, по-видимому, не зависят от приживления клеток, а обусловлены паракринным/эндокринным действием (например, секрецией противовоспалительных, антифибротических медиаторов и внеклеточных везикул). Учитывая широкий спектр вариантов клеточной терапии, оптимизация протоколов клеточной терапии и успехи в клинических испытаниях могут привести к важному прорыву в лечении пациентов, страдающих этим стойким заболеванием.
Раскрытие информации
Спонсоры не участвуют в принятии решения о публикации или подготовке статьи.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Miquéias Lopes-Pacheco и Elga Bandeira внесли равный вклад в эту работу.
Благодарности
Бразильский совет по научно-техническому развитию (CNPq), Координация по улучшению кадров высшего звена (CAPES) и Государственный исследовательский фонд Карлос Чагас Филью в Рио-де-Жанейро (FAPERJ) поддержали эту работу.


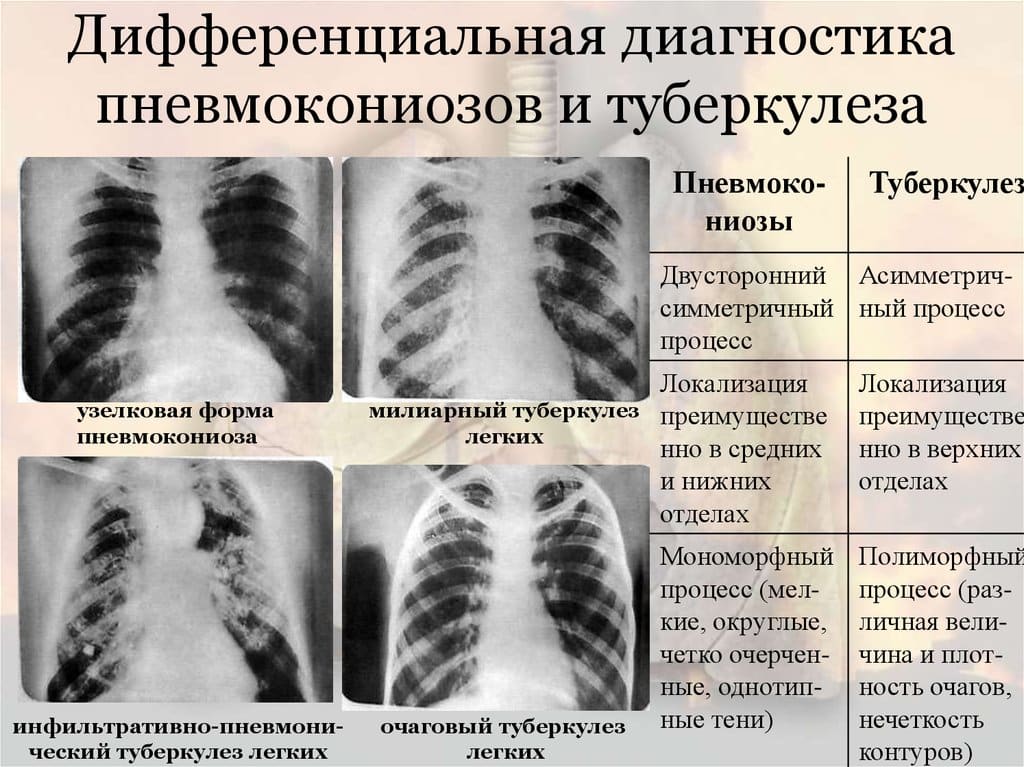


 По мере прогрессирования заболевания вам может потребоваться кислород во время физических упражнений или, в конечном итоге, в любое время.
По мере прогрессирования заболевания вам может потребоваться кислород во время физических упражнений или, в конечном итоге, в любое время.