Лимфокиста после удаления матки с придатками: Осложнения хирургического лечения у больных раком тела матки I стадии
Осложнения хирургического лечения у больных раком тела матки I стадии
Дунаева Е.А.**, Новикова Е.Г.**, Бойко А.В.*, Демидова Л.В.*, Телеус Т.А.*
Московский научно-исследовательский онкологический институт им. П.А. Герцена,
отделения лучевой терапии*, онкогинекологии**, Москва, Россия
Опубликовано: Журнал «Онкохирургия», 2012, том 4, №1.
Риск развития интра- и послеоперационных осложнений вследствие обширной лимфодиссекции вызывает дискуссию о необходимости дополнения экстирпации матки с придатками (ЭМП) регионарной лимфаденэктомией (ЛЭ) у больных раком тела матки (РТМ) I стадии. Изучение хирургических осложнений также крайне важно для возможности реализации 2 этапа комбинированного лечения – послеоперационного облучения, соблюдения сроков начала лучевой терапии.
Цели и задачи работы – определить частоту и структуру хирургических осложнений после различных объемов оперативного вмешательства у больных РТМ I стадии.
Материалы и методы. Исследование основано на ретроспективном анализе 221 истории болезни больных РТМ I стадии (FIGO 2003), которым выполнено хирургическое вмешательство в период с 1994 по 2003 гг. в МНИОИ им. П.А. Герцена. У 158 (71,5%) пациенток выполняли ЭМП, у 63 (28,5%) – ЭМП с 2-сторонней подвздошно-обтураторной ЛЭ. 66 больным РТМ I стадии в послеоперационном периоде проведена лучевая терапия в сроки от 2 до 4 недель.
Результаты. В группе ЭМП и ЭМП+ЛЭ не зафиксировано интраоперационной летальности. Осложнения во время проведения операции были минимальными как в группе с ЭМП (0,6%), так и в группе с ЭМП+ЛЭ (1,6%). Различия касались объема кровопотери и продолжительности операции. Так, средняя величина кровопотери в группе ЭМП и ЭМП+ЛЭ составила 554,7 мл и 800,0 мл соответственно. При этом отмечалась тенденция к увеличению объема теряемой крови при нарастании индекса массы тела в обеих группах. Выполнение ЛЭ удлинило время операции в среднем на 90 минут по сравнению с простой ЭМП.
Послеоперационные осложнения развились примерно одинаково в группах после ЭМП (7,0%) и ЭМП+ЛЭ (7,9%). Лимфокисты возникли в 7,9% (5/63) случаев с произведенной тазовой ЛЭ.
Из 72 больных, которым была рекомендована послеоперационная лучевая терапия, у 66 (91,7%) облучение начато в сроки 2-4 нед. Облучение не проведено всего у 6 (8,3%) больных. Только у 1 (1,4%) из них причиной к отказу от лучевой терапии послужило послеоперационное осложнение, у остальных 5 женщин 74-76 лет – тяжелая сопутствующая патология.
Выводы. Расширение объема оперативного вмешательства в целом незначительно утяжеляет общее состояние больных. У подавляющего большинства пациенток РТМ I стадии хирургические осложнения не требуют длительной реабилитации и позволяют, при имеющихся показаниях, провести послеоперационное облучение в рекомендованные сроки.
Ключевые слова: рак тела матки I стадии, интраоперационные и послеоперационные осложнения.
Введение
Основным методом лечения больных раком тела матки (РТМ) I стадии является хирургический. Следующие обстоятельства определяют это положение. Возросший уровень диагностики с использованием 3Д-ультрасонографии, цветного допплеровского картирования, обзорной цервикогистероскопии и прицельной биопсии материала для морфологического исследования позволяет выявить РТМ на ранних стадиях. Так, не являясь визуально доступной локализацией, РТМ у 78,6% больных определяются в I-II стадии [1, 2].
Более низкие показатели 5-летней безрецидивной и общей выживаемости после самостоятельной лучевой терапии (60-85%) по сравнению с хирургическим и комбинированным лечением также объясняет приоритет оперативного этапа [3, 4].
Качественно новый уровень анестезиологического пособия позволяет выполнить хирургическое вмешательство большинству больных. Вследствие тяжелой сопутствующей патологии операции не подвергается только 13% больных РТМ ранних стадий. Пожилой возраст сам по себе рассматривается как второстепенный фактор и не может быть причиной отказа в операции [5, 6].
Пожилой возраст сам по себе рассматривается как второстепенный фактор и не может быть причиной отказа в операции [5, 6].
Вместе с тем, вопрос об объеме хирургического вмешательства у пациенток РТМ I стадии остается дискутабельным как в силу целесообразности удаления лимфатического коллектора, так и технической возможности лимфаденэктомии у соматически отягощенного контингента больных РТМ [7-9].
Риск развития интра- и послеоперационных осложнений вследствие обширной лимфодиссекции вызывает дискуссию о необходимости дополнения экстирпации матки с придатками (ЭМП) регионарной лимфаденэктомией (ЛЭ) [7, 8, 10]. Изучение хирургических осложнений также крайне важно для возможности реализации 2 этапа комбинированного лечения – послеоперационного облучения, соблюдения сроков начала лучевой терапии.
Цели исследования – определить частоту и структуру хирургических осложнений после различных объемов оперативного вмешательства у больных РТМ I стадии.
Материалы и методы
Нами проведен ретроспективный анализ 221 истории болезни больных РТМ I стадии (FIGO 2003), которым выполнено хирургическое вмешательство в период с 1994 по 2003 гг. в МНИОИ им. П.А. Герцена. У 158 (71,5%) пациенток выполняли ЭМП, у 63 (28,5%) – ЭМП с 2-сторонней подвздошно-обтураторной ЛЭ.
На основании послеоперационного морфологического исследования у 17 (7,7%) пациенток диагностирована IА стадия (рТ1аN0М0), у 153 (69,2%) больных – IB стадия (Т1bN0M0), у 51 (23,1%) – IC стадия (T1cN0M0).Преобладающей гистологической структурой была эндометриоидная аденокарцинома (188/85,1%), различной степени дифференцировки: G1 – у 81 (43,1%), G2 – у 86 (45,7%) и G3 – у 21 (11,2%). На долю железисто-плоскоклеточного рака приходилось 10,4% (23). Светлоклеточная (мезонефральная) аденокарцинома встретилась у 10 больных (4,5%).
Большинству больных РТМ I стадии было выполнено хирургическое вмешательство в объеме простой ЭМП. Вместе с тем, с 1999 года отмечено увеличение частоты выполняемых операций и расширения объема с удалением тазового лимфатического барьера с 15,9% до 36,8%, т.е. в 2,3 раза (р=0,0007) (рис. 1).
Вместе с тем, с 1999 года отмечено увеличение частоты выполняемых операций и расширения объема с удалением тазового лимфатического барьера с 15,9% до 36,8%, т.е. в 2,3 раза (р=0,0007) (рис. 1).
В соответствии с классификацией ВОЗ основной контингент был представлен женщинами среднего и пожилого возрастов (50-69 лет) – 167 (75,6%) пациенток. В то же время аденокарцинома эндометрия у лиц репродуктивного возраста (до 44 лет) встретилась в 9,5%, возраст самой молодой пациентки – 18 лет. Средний возраст больных составил 57,1±3,3 года.
Средний возраст пациенток, которым произведена простая ЭМП и ЭМП+ЛЭ, был сопоставим (58,7±3,9 и 54,1±6,3 года соответственно). Однако при повозрастном делении больных оказалось, что женщинам до 60 лет достоверно чаще выполняли тазовую лимфаденэктомию (77,8% против 52,5%, р=0,0006), тогда как у больных старше 60 лет ограничивались простой ЭМП (47,5% против 22,2%) (табл. 1).
1).
| Возраст (лет) | Методы лечения, абс. ч. (%) | |
|---|---|---|
| ЭМП | ЭМП+ЛЭ | |
| <19 | – | 1 (1,6%) |
| 20-29 | 1 (0,6%) | – |
| 30-39 | 5 (3,2%) | 3 (4,8%) |
| 40-49 | 17 (10,7%) | 8 (12,7%) |
| 50-59 | 60 (38,0%) | 37 (58,7%) |
| 60-69 | 57 (36,1%) | 13 (20,6%) |
| 70-79 | 18 (11,4%) | 1 (1,6%) |
| Всего | 158 (100%) | 63 (100%) |
| Средний возраст (годы) | 58,7±3,9 | 54,1±6,3 |
Между тем, всего 28,5% (63/221) пациенток подверглись тазовой лимфодиссекции. Объясняется это, помимо отсутствия в определенных клинических ситуациях необходимости расширения объема операции, еще и отягощенным соматическим статусом больных РТМ (табл. 2).
Объясняется это, помимо отсутствия в определенных клинических ситуациях необходимости расширения объема операции, еще и отягощенным соматическим статусом больных РТМ (табл. 2).
Таблица 2. Общая характеристика сопутствующей патологии у больных РТМ.
| Сопутствующие заболевания | Число больных | % | |
|---|---|---|---|
| Гипертоническая болезнь (ГБ) или артериальная гипертензия (АГ) | 115 | 52,0 | |
| Ожирение I-II-III степени | 86 | 173 | 78,3 |
| Избыточная масса тела (предожирение) | 87 | ||
| Хронический холецистит, желчнокаменная болезнь (ЖКБ) | 72 | 32,6 | |
| Ишемическая болезнь сердца (ИБС) | 54 | 24,4 | |
| Сахарный диабет, нарушение толерантности к глюкозе (НТГ) | 31 | 14,0 | |
| Варикозная болезнь вен нижних конечностей | 41 | 18,6 | |
| Аппендэктомия | 17,2 | ||
| Хронические заболевания почек, мочекаменная болезнь, хронический цистит | 35 | 15,8 | |
| Патология щитовидной железы (струма Хашимото, узлы в щитовидной железе) | 29 | 13,1 | |
| Гепатиты А, В или С (в анамнезе) | 19 | 8,6 | |
| Хронический тонзиллит | 18 | 8,1 | |
| Язвенная болезнь 12-перстной кишки | 16 | 7,2 | |
| Хронический энтероколит, колит | 14 | 6,3 | |
Наиболее выраженными клиническими проявлениями эндокринно-обменных нарушений явились изменения со стороны жирового обмена. Так, превышение массы тела, определяемое по индексу массы тела (ИМТ), отмечено у 173 (78,3%) больных, из них у 86 (49,7%) пациенток – ожирение I-III ст.
Так, превышение массы тела, определяемое по индексу массы тела (ИМТ), отмечено у 173 (78,3%) больных, из них у 86 (49,7%) пациенток – ожирение I-III ст.
Ожирение (предожирение) сочеталось с гипертонической болезнью/артериальной гипертензией в 45,2% (100 больных).
Независимо от массы тела частота производимых лимфаденэктомий за два последних 5-летия увеличилась как в группе больных с нормальным весом (с 17,3% до 38,6%, т. е. в 2,2 раза; р=0,009), так и в группе с ожирением (с 13,9% до 34,0%, т. е. в 2,4 раза; р=0,03) (табл. 3).
Таблица 3. Динамика оперативной деятельности у больных РТМ I стадии
в зависимости от ИМТ (1994–1998 и 1999–2003 годы).
| ИМТ | 1994–1998 гг. | 1999–2003 гг. | ||
|---|---|---|---|---|
| ЭМП | ЭМП+ЛЭ | ЭМП | ЭМП+ЛЭ | |
| <30 n=135 |
43 (82,7%) |
9 (17,3%) |
51 (61,4%) |
32 (38,6%) |
| 52 | 83 | |||
| ≥30 n=86 |
31 (86,1%) |
5 (13,9%) |
33 (66,0%) |
17 (34,0%) |
| 36 | 50 | |||
| Всего, n=221 |
88 | 133 | ||
Сахарный диабет 2 типа или нарушение толерантности к глюкозе (НТГ) встретились у 31 (14,0%) пациентки с РТМ.
Простую ЭМП производили с соблюдением онкологических принципов. Для адекватной ревизии органов малого таза и брюшной полости использовали нижнюю срединную лапаротомию. По вскрытии брюшной полости обязательно выполняли смывы с брюшины поддиафрагмальной области, латеральных каналов и малого таза. После проведенной ревизии производили экстрафасциальную ЭМП. Поскольку опухоль у большинства больных была ограничена телом матки, верхнюю треть влагалища не удаляли. Также при выявлении подозрительных объемных образований выполняли биопсию или тотально подвергали их удалению [11].
Модифицированная расширенная ЭМП по Я.В. Бохману заключалась в тотальной экстирпации матки с придатками, небольшой влагалищной манжеткой и иссечением en bloc клетчатки с общими, наружными и внутренними подвздошными и обтураторными лимфатическими узлами. Так как вероятность прямого прорастания опухоли тела матки в клетчатку параметриев и паракольпиев невелика, то верхнюю треть влагалища и клетчатки паракольпиев не удаляли, что освобождало хирургов от необходимости выделения устьев мочеточников. Таким образом, ЭМП дополняли 2-сторонней подвздошно-обтураторной ЛЭ [12].
Таким образом, ЭМП дополняли 2-сторонней подвздошно-обтураторной ЛЭ [12].
Количество удаленных лимфатических узлов варьировало от 1 до 30 (среднее – 9,6).
Через 2-4 недели после операции 66 (29,9%) больным РТМ I стадии проведена лучевая терапия.
Результаты
Интраоперационные осложнения
В группе больных, которым выполнили ЭМП, интраоперационные осложнения наблюдали у 1 из 158 больных (0,6%). Ни одно из них не закончилось летальным исходом. У единственной пациентки произошло десерозирование сигмовидной кишки на 3 участках, без вскрытия просвета, потребовавшее наложение серозно-серозных швов.
В группе больных с ЭМП+ЛЭ интраоперационные осложнения наблюдали у 1 (1,6%) пациентки: потребовалось дополнительное лигирование сосудов стенки мочевого пузыря в связи с кровотечением. Летальных исходов не было.
Анализ величины кровопотери выявил прямую зависимость от масштаба хирургического вмешательства. При его расширении достоверно увеличивался объем теряемой крови. Так, средняя величина кровопотери в группах ЭМП и ЭМП+ЛЭ составила 554,7±402,4 мл (от 100 до 2500 мл) и 819,0±644,0 мл (от 100 до 3000 мл) соответственно (р=0,004).
При его расширении достоверно увеличивался объем теряемой крови. Так, средняя величина кровопотери в группах ЭМП и ЭМП+ЛЭ составила 554,7±402,4 мл (от 100 до 2500 мл) и 819,0±644,0 мл (от 100 до 3000 мл) соответственно (р=0,004).
Среди показателей функционального состояния больных, таких как ИМТ, сопутствующие заболевания, возраст, ECOG, влияющих на интраоперационную кровопотерю, достоверных различий не выявлено (р=0,25, 0,80, 0,24, 0,08 соответственно), однако отмечалась тенденция к возрастанию кровопотери с повышением ИМТ (рис. 2).
Рис. 2. Величина кровопотери в зависимости от ИМТ и объема оперативного вмешательства.
Аналогичная тенденция прослеживалась в зависимости от ECOG, когда у больных с понижением функционального состояния увеличивался объем кровопотери. В то же время при функциональном состоянии больных в 3 балла с целью максимального сокращения кровопотери и продолжительности хирургического вмешательства выполнение операций поручали высококвалифицированным хирургам и анестезиологам, поэтому у 8 больных с 3 степенью тяжести по ECOG объем теряемой крови был минимальный (100-400 мл).
Выполнение тазовой ЛЭ удлинило время операции в среднем на 90 минут по сравнению с ЭМП (157,9±28,2 и 68,0±21,1 мин. соответственно).
Послеоперационные осложнения
Мы учитывали все возникшие осложнения – от самых незначительных до серьезных, угрожавших жизни больных. Ни одно осложнение не привело к летальному исходу.
Послеоперационные осложнения развились примерно одинаково в группах после ЭМП и ЭМП+ЛЭ.
В группе больных, которым была выполнена ЭМП, осложнения возникли у 49 человек из 158 (31,0%). Общее количество осложнений – 53, удельный вес – 0,34. У 3 пациенток имело место по 2 осложнения.
У 63 больных, которым была произведена ЭМП+ЛЭ, осложнения наблюдались у 19 (30,2%). Общее количество послеоперационных осложнений (с учетом сочетания двух осложнений у трех пациенток) – 22 ,удельный вес – 0,35.
Структура послеоперационных осложнений представлена в табл. 4.
4.
Таблица 4. Характер и частота послеоперационных осложнений.
| Вид осложнений | ЭМП, n=158 | ЭМП+ЛЭ, n=63 | Всего | |||
|---|---|---|---|---|---|---|
| n | % | n | % | n | % | |
| Инфильтраты в малом тазу (осложненные)* | 20+1* | 13,3 | 11 | 17,4 | 32 | 14,5 |
| Лимфокисты | – | – | 2 | 3,2 | 2 | 0,9 |
| Гематома в малом тазу (осложненные)* | 3+1* | 2,5 | 2 | 3,2 | 6 | 2,7 |
| Культидиты | 2 | 1,3 | – | – | 2 | 0,9 |
| Диастаз п/о раны | 1 | 0,6 | – | – | 1 | 0,5 |
| Гематома и/или инфильтрат в п/о рубце | 3 | 1,9 | 2 | 3,2 | 5 | 2,3 |
| Внутрибрюшное кровотечение | 1 | 0,6 | – | – | 1 | 0,5 |
| Цистит | 3 | 1,9 | – | – | 3 | 1,4 |
| Острая почечная недостаточность | 3 | 1,9 | – | – | 3 | 1,4 |
| Пиелонефрит | 2 | 1,3 | – | – | 2 | 0,9 |
| Атония мочевого пузыря | 1 | 0,6 | – | – | 1 | 0,5 |
| Почечная колика | 1 | 0,6 | – | – | 1 | 0,5 |
| ТЭЛА | 2 | 1,3 | – | – | 2 | 0,9 |
| Острый тромбоз вен нижних конечностей/ острый тромбофлебит | 1 | 0,6 | 2 | 3,2 | 3 | 1,4 |
| Стрессовая язва 12-типерстной кишки | 1 | 0,6 | – | – | 1 | 0,5 |
| Гипертонический криз ± пароксизмальная тахикардия | 3 | 1,9 | 3 | 3,2 | 6 | 2,7 |
| Длительный субфебрилитет неясного генеза | 2 | 1,3 | – | – | 2 | 0,9 |
| Обострение хронического холецистита | 1 | 0,6 | – | – | 1 | 0,5 |
| Обострение хронического пиелонефрита | 1 | 0,6 | – | – | 1 | 0,5 |
| Общее число осложнений | 53 | 33,5 | 22 | 34,9 | 75 | 33,9 |
| Число больных с осложнениями | 49 | 31,0 | 19 | 30,2 | 68 | 30,8 |
Среди послеоперационных осложнений чаще наблюдались инфильтраты в малом тазу – у 32 (14,5%) больных. В основном они были небольших размеров, локализовались в прикультевых отделах и не требовали активной хирургической тактики, через 2 месяца при контрольном обследовании они не определялись. Только у 1 (0,6%) пациентки на 12-е сутки после ЭМП потребовалось дренирование воспалительного инфильтрата.
В основном они были небольших размеров, локализовались в прикультевых отделах и не требовали активной хирургической тактики, через 2 месяца при контрольном обследовании они не определялись. Только у 1 (0,6%) пациентки на 12-е сутки после ЭМП потребовалось дренирование воспалительного инфильтрата.
Возросший уровень ультразвуковой диагностики позволил дифференцировать послеоперационные инфильтраты от образований жидкостной природы. Гематомы в малом тазу выявлены в 6 (2,7%) наблюдениях. У 1 (0,5%) пациентки ее размеры составили 7х8х8 см. Благодаря развитию малоинвазивных методов лечения удалось избежать повторного оперативного вмешательства. Под контролем УЗИ на 11 сутки после ЭМП была произведена пункция и аспирация гематомы. У остальных 5 больных проведена консервативная противовоспалительная терапия с положительным эффектом.
Возникновение лимфокист в группе больных с ЭМП+ЛЭ наблюдалось всего у 2 (3,2%) из 63 больных на 6 и 8 сутки. В то же время инфильтратов в этой группе наблюдалось больше по сравнению с группой больных после простой ЭМП (17,4 и 13,3% соответственно). Возможно, что в первые годы становления ультрасонографии любые визуализируемые образования в малом тазу, в том числе и жидкостной природы, трактовались как инфильтраты. В последующие годы появились довольно четкие эхографические дифференциальные диагностические признаки лимфокист, гематом и инфильтратов. Вместе с тем, существуют и объективные трудности в интерпретации данных УЗИ, заключающиеся в наличии сопутствующего ожирения у преобладающего большинства больных РТМ, не позволяющего иногда визуализировать имеющуюся патологию в виде лимфоцеле. Примером служат 3 больных с ожирением, у которых послеоперационный период протекал без осложнений. Однако в сроки от 1 до 10 мес. (1, 5, 10 мес.) у них были диагностированы лимфокисты в малом тазу, причем у 2 из них больших размеров: 10-12 см и 8,9х6,1х4,4 см. Больные предъявляли жалобы на боли либо внизу живота, либо в соответствующей подвздошной области, но без нарушения физиологических отправлений и без температурной реакции.
В то же время инфильтратов в этой группе наблюдалось больше по сравнению с группой больных после простой ЭМП (17,4 и 13,3% соответственно). Возможно, что в первые годы становления ультрасонографии любые визуализируемые образования в малом тазу, в том числе и жидкостной природы, трактовались как инфильтраты. В последующие годы появились довольно четкие эхографические дифференциальные диагностические признаки лимфокист, гематом и инфильтратов. Вместе с тем, существуют и объективные трудности в интерпретации данных УЗИ, заключающиеся в наличии сопутствующего ожирения у преобладающего большинства больных РТМ, не позволяющего иногда визуализировать имеющуюся патологию в виде лимфоцеле. Примером служат 3 больных с ожирением, у которых послеоперационный период протекал без осложнений. Однако в сроки от 1 до 10 мес. (1, 5, 10 мес.) у них были диагностированы лимфокисты в малом тазу, причем у 2 из них больших размеров: 10-12 см и 8,9х6,1х4,4 см. Больные предъявляли жалобы на боли либо внизу живота, либо в соответствующей подвздошной области, но без нарушения физиологических отправлений и без температурной реакции. Потребовалась длительная противовоспалительная терапия. Исходом излечения явилась грубая рубцовая тяжистость в параметриях. Таким образом, всего лимфоцеле зарегистрировано у 7,9% (5/63) больных.
Потребовалась длительная противовоспалительная терапия. Исходом излечения явилась грубая рубцовая тяжистость в параметриях. Таким образом, всего лимфоцеле зарегистрировано у 7,9% (5/63) больных.
Следует отметить, что у больных с возникшими забрюшинными лимфокистами среднее значение ИМТ составило 30,8, при их отсутствии – 28,9.
Следующими по частоте осложнениями были различного рода урологические нарушения. Они наблюдались у 11 (5,0%) больных, причем у всех после ЭМП. В структуре урологических осложнений на долю послеоперационных циститов приходилось 3 наблюдения, острая почечная недостаточность развилась также у 3 больных. Частота пиелонефритов составила 3 наблюдения (1 – как обострение хронического заболевания). Атония мочевого пузыря диагностирована всего у 1 (0,5%) больной.
Высокий уровень анестезиологического и реанимационного ведения больных как в интра-, так и послеоперационном периоде подтвержден тем, что только у 6 (2,7%) больных после операции возникло обострение гипертонической болезни (артериальной гипертензии) в виде гипертонического криза, у 1 из них в сочетании с нарушением ритма по типу пароксизмальной тахикардии.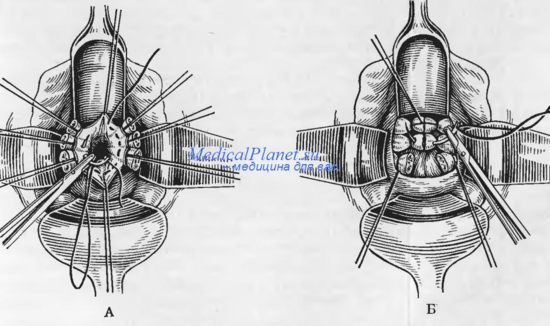 Ни в одном наблюдении не зафиксирован инфаркт миокарда, хотя каждая вторая (56,6%) пациентка имела сердечно-сосудистую патологию.
Ни в одном наблюдении не зафиксирован инфаркт миокарда, хотя каждая вторая (56,6%) пациентка имела сердечно-сосудистую патологию.
Такое грозное осложнение, как тромбоэмболия мелких ветвей легочной артерии (ТЭЛА), имело место всего у 2 (0,9%) пациенток на 1 и 3 сутки после операции. У одной больной в анамнезе было указание на варикозное расширение вен нижних конечностей. Вторая пациентка имела наследственную овалоцитарную гемолитическую анемию.
Серьезное послеоперационное осложнение в виде внутрибрюшного кровотечения возникло у 1 (0,6%) больной в 1-е сутки. При ревизионной релапаротомии в брюшной полости – около 1 л лизированной крови и 1,5 л сгустков. Источник кровотечения не установлен. На фоне профилактической гемостатической терапии у пациентки на следующий день (2-е сутки после операции) зарегистрирована ТЭЛА мелких ветвей. Данная больная на момент операции состояла на учете у гематолога по поводу сублейкемического миелоза. В связи с выявленным у нее РТМ по витальным показаниям рекомендовано оперативное лечение. Наличие сублейкемического миелоза у гематологических больных повышает риск развития кровотечения, даже при отсутствии хирургического вмешательства, на 25%. Поэтому возникшее осложнение у данной пациентки можно отнести к разряду ожидаемых. Пациентка жива, время наблюдения составляет 63 мес.
Наличие сублейкемического миелоза у гематологических больных повышает риск развития кровотечения, даже при отсутствии хирургического вмешательства, на 25%. Поэтому возникшее осложнение у данной пациентки можно отнести к разряду ожидаемых. Пациентка жива, время наблюдения составляет 63 мес.
Острая почечная недостаточность (ОПН) в послеоперационном периоде развилась у 3 (1,9%) больных. Быстро начатые реанимационные мероприятия купировали явления ОПН у 2 из них. У 1 пациентки исходом нарушения функции почек явилась хроническая почечная недостаточность. Пациентку наблюдает нефролог. Прослеженность – 49 мес. без прогрессирования основного заболевания.
Из 72 больных, которым была рекомендована послеоперационная лучевая терапия, у 66 (91,7%) пациенток облучение реализовано и начато в сроки от 2 до 4 нед. Лучевая терапия не проведена всего у 6 (8,3%) больных. Только у 1 (1,4%) из них причиной отказа от лучевой терапии послужил каскад послеоперационных осложнений (кровотечение в брюшной полости, релапаротомия, развитие ТЭЛА). У остальных 5 женщин 74-76 лет ограничением к облучению явилась тяжелая сопутствующая патология.
У остальных 5 женщин 74-76 лет ограничением к облучению явилась тяжелая сопутствующая патология.
Обсуждение
Осложнения, возникающие в результате агрессивного хирургического лечения, включающего удаление лимфатических узлов, по данным различных авторов, варьируют от 5% до 20%.
Так, J. Fanning сообщил о 265 пациентках РТМ I-II стадии, которые подверглись ЭМП и тазово-парааортальной ЛЭ (средний возраст – 68 лет, средний вес – 75,2 кг). 77% больных имели сопутствующие заболевания. Медиана наблюдения составила 4,4 года. Серьезные хирургические осложнения отмечены в 5% наблюдений, осложнения после лимфаденэктомии отсутствовали [13].
Другие авторы также утверждают, что осложнения после лимфодиссекции в руках квалифицированных хирургов-онкогинекологов редки [14]. При этом отмечается увеличение средней продолжительности времени операции (119 мин.) и потери крови (2000 мл).
Однако C. P. Morrow с соавт. в рамках протокола GOG-33 показали, что общая частота всех осложнений после ЭМП и селективной ЛЭ составляет почти 20%, около 6% осложнений являются тяжелыми [15].
P. Morrow с соавт. в рамках протокола GOG-33 показали, что общая частота всех осложнений после ЭМП и селективной ЛЭ составляет почти 20%, около 6% осложнений являются тяжелыми [15].
Результаты итальянского многоцентрового рандомизированного исследования по изучению частоты хирургических осложнений у 310 больных РТМ показали их увеличение в группе с тазово-парааортальной ЛЭ. Так, ранние и поздние послеоперационные осложнения зафиксированы в группе с ЛЭ в 16% и 15% соответственно, тогда как у больных без ЛЭ они отмечены в 6% и 8% [16].
К числу серьезных интраоперационных осложнений относится повреждение мочеточника. Возможно ранение мочевого пузыря, тонкой, толстой кишки. Во время операции опасно как артериальное, так и венозное кровотечение вследствие ранения сосудов при лимфаденэктомии или биопсии лимфатических узлов.
В структуре послеоперационных осложнений отмечаются вторичные кровотечения (0,4%), раневая инфекция (3,5-3,7%), тромбоэмболия легочной артерии (1,5%), развитие мочевых (1,7%) и кишечных свищей, кишечная непроходимость (1,0%) [17].
Повышение радикальности оперативного вмешательства на лимфатических путях приводит к характерному послеоперационному осложнению – образованию забрюшинных лимфатических кист.
Однако диагностические подходы к выявлению лимфокист у европейских и американских хирургов диаметрально противоположны. Так, онкогинекологи североамериканского континента редко встречаются с этим осложнением после расширенных операций. При этом обращает на себя внимание пребывание пациенток в стационаре в среднем от 3,3 до 7 дней [14]. УЗИ/КТ исследование органов малого таза в послеоперационном периоде врач назначает только в случае возникновения клинических симптомов: жалоб на боли внизу живота, повышение температуры тела [18].
Зарубежные коллеги из европейских стран и отечественные исследователи занимают активную позицию в отношении обнаружения лимфоцеле. Так, независимо от клинических симптомов, рекомендуется оценивать состояние малого таза по данным УЗИ, начиная с 7 дня после расширенной гистерэктомии или через 2-3 дня после удаления дренажа, т. е. в сроки образования лимфокист. Такое активное динамическое наблюдение предопределяет высокую частоту их выявления (от 11,3% до 83%) [19, 20].
е. в сроки образования лимфокист. Такое активное динамическое наблюдение предопределяет высокую частоту их выявления (от 11,3% до 83%) [19, 20].
В целом, можно заключить, что вариабельность частоты осложнений, вероятно, кроется как в сроках их оценки, так и в масштабах выполняемых манипуляций во время операции: от биопсии лимфоузлов до тазово-парааортальной ЛЭ.
Заключение
В группе ЭМП и ЭМП+ЛЭ не зафиксировано интраоперационной летальности. Осложнения во время проведения операции минимальны как в группе с ЭМП (0,6%), так и в группе с ЭМП+ЛЭ (1,6%). Различия касаются объема кровопотери и продолжительности операции. Так, средняя величина кровопотери в группе ЭМП и ЭМП+ЛЭ составила 554,7 и 800,0 мл соответственно. При этом отмечалась тенденция к увеличению объема теряемой крови при нарастании индекса массы тела в обеих группах. Выполнение ЛЭ удлинило время операции в среднем на 90 мин. по сравнению с простой ЭМП.
Послеоперационные осложнения развились примерно одинаково в группах после ЭМП и ЭМП+ЛЭ. Наиболее серьезные осложнения, наблюдаемые в группе ЭМП, возникли у 7,0% больных: ОПН – у 3, гипертонический криз – у 3, ТЭЛА – у 2, острый тромбоз вен нижних конечностей – у 1, внутрибрюшное кровотечение – у 1, атония мочевого пузыря – у 1 больной; в группе ЭМП+ЛЭ осложнения наблюдали в 7,9%: острый тромбоз вен нижних конечностей – у 2, гипертонический криз – у 3 пациенток.
Лимфокисты возникли у 7,9% больных с ЭМП+ЛЭ. Ни в одном случае эта клиническая ситуация не потребовала дополнительного хирургического пособия.
Таким образом, расширение объема оперативного вмешательства в целом незначительно утяжеляет общее состояние больных.
У подавляющего большинства пациенток РТМ I стадии хирургические осложнения не требуют длительной реабилитации и позволяют, при имеющихся показаниях, провести послеоперационное облучение в рекомендованные сроки.
Литература
- Чиссов В.И., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2010 году. М., 2011.
- Востров А.Н., Трофимова Е.Ю., Новикова Е.Г. и др. Комплексная ультразвуковая диагностика рака эндометрия: Пособие для врачей. М.: МНИОИ им. П.А. Герцена, 2004. 27 с.
- Крикунова Л.И. Лучевая терапия рака матки. Практическая онкология, 2004; 5(1): 33-40.
- Марьина Л.А., Чехонадский В.Н., Нечушкин М.И., Киселева М.В. Рак шейки и тела матки. Лучевая терапия с использованием калифорния-252, кобальта-60, цезия-137. М.: Вантана-Граф, 2004. 432 с.
- Lurian J.R. Uterine Cancer. Novak’s Gynecology (12th ed.). Williams & Wilkins. 1996. 1057-1092.
- Bergamini V., Cromi A., Ghezzi F. et al. Primary radical surgery for endometrial carcinoma in elderly patients. Int J Gynecol Cancer, 2004; 14(l): 136.
- Hernandez E. Endometrial adenocarcinoma: a primer for the generalist. Obstet Gynecol Clin North Am 2001; 28(4): 743-757.
- Franchi M, Ghezzi F., Riva C. et al. Postoperative complications after pelvic lymphadenectomy for the surgical staging of endometrial cancer. J Surg Oncol, 2001; 78: 232-237.
- Burke T.W., Eifel P.J., Muggia F.M. Cancers of the Uterine Body. In Cancer: Principles and Practice of Oncology (6th ed.). Lippincott Williams & Wilkins, 2001; 3235.
- Нечушкина В.М., Кузнецов В.В., Лазарева Н.И., Морхов К.Ю. Современные представления о лечении рака тела матки. Сибирский онкологический журнал, 2007. Прил. 1: 65-68.
- Атлас онкологических операций. Под ред. Б.Е. Петерсона, В.И. Чиссова, А.И. Пачеса. М.: Медицина, 1987. 536 с.
- Бохман Я.В. Руководство по онкогинекологии. СПб: Фолиант, 2002. 540 с.
- Fanning J. Long-term survival of intermediate risk endometrial cancer (stage IG3, IC, II) treated with full lymphadenectomy and brachytherapy without teletherapy. Gynecol Oncol, 2001; 82: 371-374.
- Rittenberg P.V.C., Lotocki R.J., Heywood M.S. et al. High-risk surgical stage I endometrial cancer: outcomes with vault brachytherapy alone. Gynecol Onco. 2003; 89: 288-294.
- Morrow C.P., Bundy B.N., Kurman R.J. et al. Relationship between surgical-pathological risk factors and outcome in clinical stage I and II carcinoma of the endometrium. A Gynecologic Oncology Group study. Gynecol Oncol, 1991; 40: 55-65.
- Benedetti-Panici P., Tateo S., Mangili G. et al. Complications of lymphadenectomy in endometrial cancer. Results of a prospective randomized multicentric clinical trial. Int J Gynecol Cancer, 2004; 14(l): 6.
- Orr J.W.J., Holimon J.L., Orr P.F. Stage I corpus cancer: is teletherapy necessary? Am J Obstet Gynecol, 1997; 176(4): 777-788; discussion 788-789.
- Eltabbakh G.H, Wong C. Commentary for Postoperative complications after pelvic lymphadenectomy for the surgical staging of endometrial cancer. J Surg Oncol, 2001; 78: 237-240.
- Олейник В.В., Максимов С.Я., Симонов Н.Н. и др. Лимфатические кисты после расширенных операций по поводу рака шейки и тела матки. Вопр. онкологии, 1997; 43(3): 335-339.
- Степанов С.О., Новикова Е.Г., Скрепцова Н.С. Ультразвуковая диагностика и тактика при лимфоцеле после онкогинекологических операций. Сибирский онкологический журнал, 2009; 2(32): 25-30.
Дренирование после тазовой лимфаденэктомии в сравнении с отсутствием дренирования для предотвращения образования лимфокист у женщин с раком женских половых органов
Актуальность
Это обновленная версия оригинального Кокрейновского обзора, опубликованного в Выпуске 6, 2014 года.
Тазовая лимфаденэктомия (удаление лимфатических узлов в области таза) является важным компонентом хирургического лечения гинекологического рака, чтобы узнать, распространился ли рак. Однако это может привести к осложнениям, особенно образованию лимфоцист (скопление лимфатической жидкости в малом тазу). Лимфоцисты могут привести к отекам в ногах, закупорке мочеточника (трубка, по которой моча из почки поступает в мочевой пузырь), болям в области таза, образованию тромбов в ноге и венах таза, нарушению моторики кишечника и инфекции. Без четких доказательств эффективности, для предотвращения подобных осложнений традиционно рекомендуют установку отсасывающего дренажа с целью удаления лимфатической жидкости, накапливающейся в зоне операции между брюшиной и задней брюшной стенкой.
Вопрос обзора
Целью этого обзора было сравнение эффектов дренирования с отсутствием дренирования в отношении предотвращения образования лимфоцист после тазовой лимфаденэктомии.
Основные результаты
Мы обновили поиск в основных базах данных в марте 2017 года. Для выявили четыре исследования (571 женщина) для включения в этот обзор. У женщин в основном был рак шейки матки и эндометрия, и только в одном исследовании также участвовали женщины с раком яичника.
Наши результаты показали, что размещение отсасывающего дренажа неэффективно в отношении предотвращения образования лимфоцист, особенно когда брюшина (внутренняя выстилка таза) остается открытой. На самом деле, такая практика увеличивает риск краткосрочного и долгосрочного формирования лимфоцист с соответствующими симптомами.
Качество доказательств
В окончательный анализ этого обзора были включены четыре клинических испытания с качеством доказательств от умеренного до высокого (риск смещения низкий или неясный).
Лимфатические осложнения в оперативной хирургии органов малого таза у женщин, их профилактика и лечение
1. Адамян Л.В. Лапароскопический и гистероскопический доступы при органосохраняющих операциях у больных миомой матки // Эндоскопия в диагностике и лечении патологии матки. 1997. — Ч 1. — С. 200-205
2. Адамян Л.В., Белоглазова С.В. Диагностическая и хирургическая гистероскопия в гинекологии // Методические рекомендации. М., 1997.
3. Азиев О.В. Лапароскопическая миомэктомия у пациенток репродуктивного возраста // Вестник Российской ассоциации акушеров-гинекологов. -1996.-№4.-С. 58-59.
4. Азиев О.В. Повреждение мочеточников при лапароскопической гистерэктомии // Вопросы гинекологии, акушерства и перинатологии. — 2004. -т. 3.-№5.-С. 85-88.
5. Аксель Е.М., Двойрин В.В., Трапезников Н.Н. Заболеваемость и смертность от злокачественных новообразований населения России и некоторых других стран СНГ в 1992 году. М., 1994. — 249 с.
6. Акушерство и гинекология. Достижения и пути развития в XXI веке. Сборник научных трудов под редакцией профессора С. Н. Гайдукова, посвященный 75-летию кафедры акушерства и гинекологии СПб ГПМА, СПб,: Издание ГПМА, 2002. — 224 с.
7. Аракелян B.C., Тутов Е.Г., Малинин А.А. Профилактика и лечение хи-лоторакса при операциях на грудной аорте. Тезисы 6-й сессии НЦССХ им.
8. A.Н. Бакулева 12-14 мая. Бюллетень НЦССХ им. А.Н. Бакулева 2002; 5: 3: 55.
9. Аскольская С.И., Данилов А.Ю. Различные типы гистерэктомии и качество жизни женщин. В сб.: «Новые технологии в гинекологии» под ред.
10. B.И. Кулакова и Л.В. Адамян. М.: «ПАНТОРИ», 2003. С. 32-33.
11. Баркаган З.С., Момот А.П. Диагностика и контролируемая терапия нарушений гемостаза, М:, 2001. — 296 с.
12. Батталова Г.Ю. Пограничные опухоли яичников: оптимизация методов лечения и медико-социальная реабилитация больных: Автореф. дис. . д-ра мед. наук 2005; 43.
13. Бауэр Г. Цветной атлас по кольпоскопии. Пер. с немецкого. Под ред.
14. C.И.Роговской. М: ГЭОТАР-МЕД; 2002. 287.
15. Биляшевич B.C. Сравнительная оценка реакции брюшины на тампоны и различные виды дренажей // Военно-медицинская академия им. С.М. Кирова: Науч. конф. слушателей академии: Тезисы докладов. Л., 1973. -С. 21—22
16. Биохимические основы патологических процессов. Под ред Е.С.Северина. М., 2000.
17. Борзяк Э.И., Бочаров В.Я., Сапин М.Р. и соавт. Анатомия человека. М.: Медицина, 1993.-т. 2. С. 158-159.
18. Борисов А.В. (ред.) Лимфангион (теория и практика). СПБ, 1995. С.110.
19. Борисов А.В. Теория лимфангиона: анатомические аспекты // Лимфангион (теория и практика) СПб.:Изд-во СПбГМА, 1995. — С. 3-11.118
20. Борисов А.В. Функциональная морфология лимфангиона // Лимфатический сосуд/ЛСГМИ. Л., 1984. — С. 5-13.
21. Борисов А.В., Лобов Г.И., Селин Ю.М. Зависимость между конструкцией лимфангиона, частотой и видом его сокращений // Морфология. — 1996. -Т. 109, №2.-С. 38-42.
22. Бородин Ю.И.,Сапин М.Р., Этинген Л.Е. и др. // Общая анатомия лимфатической системы. Новосибирск: Наука. Сиб.отд., 1990. — С. 66-107.
23. Ботвин М.А. Оперативное лечение миомы матки (консервативная мио-мэктомия) // Современная медицина. 1991. — № 10 — С.12-15
24. Ботвин М.А. Современные аспекты реконструктивно-пластических операций у больных миомой матки репродуктивного возраста: вопросы патогенеза, техника операций, система реабилитации, ближайшие и отдаленные результаты: Москва, 1999.
25. Бохман Я.В. Руководство по онкогинекологии. СПб: ООО Издательство Фолиант; 2002. С. 195-229.
26. Бохман Я.В. Лекции по онкогинекологии. М: Медицинское информационное агентство; 2007.
27. Бохман Я.В. Руководство по онкогинекологии. Ст-Петербург: Фолиант 2002; 280 с.
28. Бохман Я.В., Вихляева Е.М., Лившиц М.А. // В кн.: Опухоли яичников: Сборник научных трудов. Иркутск, 1990. — С. 16-26.
29. Бохман Я.В., Лившиц М.А., Винокуров В.Л. и др. Новые подходы к лечению гинекологического рака. СПб.: Гиппократ, 1993.
30. Брехман Г.И. Клиническое обоснование органосохраняющего направления в лечении больных миомой матки // Тезисы Всесоюзного симпозиума
31. Скрининг в раннем выявлении опухолей репродуктивной системы и проведение органосохраняющего лечения». г. Кострома, 1991. — С. 10-11.
32. Бубнова Н.А., Крупышев Г.В., Бухтеева Г.Е. Оценка сократительной активности лимфангионов при лимфограческом исследовании. Лимфангион (анатомия, физиология, патология). ЛСГМИ. Л., 1990. — С. 82-86.
33. Бугеренко А.Е, Штыров С.В., Конджария Г.Д. Выбор хирургического доступа при надвлагалищной ампутации матки больших размеров // Вопросы гинекологии, акушерства и перинатологии. — 2004. — т. 3. №5. — С. 21—24.
34. Бураева З.С., Саранцев А.Н., Аксенова С.Ю., Панова Н.П. Хирургическая анатомия лимфатической системы матки и ее придатков у женщин детородного и постклимактерического периода // Научно-практический журнал «Хирург», 2009. № 2. — С. 24-29.
35. Буянов В.М., Левин Ю.М., Саакян Н.Е. и др.//Всероссийская конф. хирургов: Тезисы докладов. Тула, 1984. — С. 177-178.
36. Винокуров В.Л. // Вопр. онкол. 1986. — Т. 32, № 3. — С. 44-49.
37. Винокуров В.Л. Рак яичников: закономерности метастазирования и выбор адекватного лечения больных. Ст-Петербург: Фолиант 2004; 336.
38. Вихляева Е.М. Руководство по диагностике и лечению лейомиомы матки. М.: МЕДпресс-информ, 2004. — 400 с.
39. Вишневская Е.Е. Рак шейки матки // Диагностика, хирургическое и комбинированное лечение. Минск: Беларусь, 1986. — С. 237.
40. Володин С.К. Хирургическое лечение миомы матки // Казанский медицинский журнал. 1995. — № 6. — С. 461-463.
41. Выренков Е.Я. О связи лимфатической системы внутренних органов // Хирургия. 1967. — N 8. — С. 87-88.
42. Выренков Е.Я. Лимфатическая система в норме и патологии. М., 1967. -С. 18-53.
43. Выренков Ю.Е. Теоретические аспекты клинической лимфоло-гии//Актуальные проблемы клинической лимфологии. Андижан, 1991. -С.27-28.
44. Выренков Ю.Е., Борисов А.В. // Вестник лимфологии. 2006. — № 2. -С. 20-25.
45. Выренков Ю.Е., Шевхужев З.А., Юсупов И.А., Мельников В.В., Паршин JI.C., Карандин В.И., Выренкова Н.Ю. Применение лимфологических методов в хирургии и интенсивной терапии. Учебно-методическое пособие. Краснодар, 2007. С. 61.
46. Гашев А.А., Орлов Р.С., Борисов А.В., Малафеева Е.Я. Типы сокращений лимфангионов // Российский физиол.ж., 1996, т. 82, № 1. С. 167-175.
47. Герасименко В.Н. Принципы восстановительного лечения онкологических больных / Герасименко В.Н., Артюшенко Ю.В. // Тез. Всесоюз. симп. «Совершенствование методов реабилитации онкологических больных». Л., 1978.-С. 30-31.
48. Гранов A.M., Винокуров В.Л. Лучевая терапия в онкогинекологии и онкоурологии. Ст-Петербург: Фолиант 2002; 103-118.
49. Грачева Г.Г. Клинические и топографо-анатомические аспекты интра-фасциальной экстирпации матки. Автореф. дисс. . канд. мед. наук. М., 2001. -29 с.
50. Губина О.В. Особенности клинического течения и лечения пограничных опухолей яичников: Автореф. дис. канд. мед. наук 1995; 22.
51. Давыдов А.И., Пашков В.М., Стрижакова М.А. и соавт. Комбинированное органосберегающее лечение больных миомой матки // Вопросы гинекологии, акушерства и перинатологии. 2004. — т. 3. — № 5. — С. 25-28.
52. Давыдов М.И., Аксель Е.М. Злокачественные новообразования в России и странах СНГ в 2000 г. М.: РОНЦ им. Н.Н.Блохина РАМН, 2002.
53. Дворин В.В., Бармина Н.М., Зайченко Н.М. Информативность показателей состояния онкологической помощи, рассчитанных по данным статистической отчетности. М.: ОНЦРАМН, 1995; 32 с.
54. Долганов, Е.Е. Опыт 10-летнего использования лазерного аппарата в оперативной эндоскопии у онкологических больных / Долганов Е.Е.,
55. B.А.Королев, М.ЛСтаханов // Вопросы онкологии. 2003. — Т. 49. — № 2.1. C. 186-188.
56. Ермолов А.С., Удовский Е.Е., Григорян А.Р. и др. // Клиническая лим-фология. Москва; Подольск, 1985. — С. 145-146.
57. Жорданиа К.И. Современная онкология 2000; 2: 2: 15-23.
58. Заболевания шейки матки, влагалища и вульвы. Клинические лекции. Под редакцией проф. В. Н. Прилепской. М: МЕДпресс; 2000. 133-138.
59. Злокачественные новообразования в России и странах СНГ в 2001 г. Под ред. М.И.Давыдова и Е.М.Аксель. Медицинское информативное агентство, 2003, С. 293.
60. Ищенко А.И., Бахвалова А.А., Чушков Ю.В. и соавт. Десятилетний опыт лапароскопической надвлагалищной ампутации матки // Вопросы гинекологии, акушерства и перинатологии. 2004. — т. 3. — №5. — С. 30-34.
61. Ищенко А.И., Николаев А.В., Грачева Г.Г. и соавт. Топографо-анатомические и клинические аспекты интрафасциальной экстирпации матки // Вопросы гинекологии, акушерства и перинатологии. 2003. — т. 2. — №1. -С. 25-31.
62. Кафаров И.Г. Эндометриоидная киста.: Автореф. дис. канд. мед. наук. -М., 1998.-22 с.
63. Киселева И. М. Повреждения мочевого пузыря при радикальной операции по поводу рака шейки матки. В кн.: Травматические повреждения мочевого пузыря, уретры и наружных половых органов. Челябинск, 1982. -С. 87-88.
64. Кондриков Н.И., Адамян Л.В., Беляева Л.А. и др. Морфологические и ультраструктурные особенности эндометриоидных кист яичников // Матер, межд. конгресса. М., 1996. — С. 162-166.122
65. Коханевич Е. В., Ганина К. П., Суменко В. В. Колыюцервикоскопия (атлас). Киев: Гидромакс; 2004.
66. Краевская И. С. Рак яичников. М.: Медицина, 1960.
67. Краснова И.А., Бреусенко В.Г. Диагностика и оперативное лечение миомы матки.// Акушерство и гинекология. 2003. — № 2. — С.45-50
68. Краснопольский В. И. Актуальные вопросы реабилитации в оперативной гинекологии. — В кн.: Реабилитация при акушерско-гинекологической патологии. М., 1980, С. 52-60.
69. Краснопольский В.И., Буянова С.Н., Щукина Н.А. Гнойная гинекология. М.: МЕДпресс, 2001. 288 с.
70. Краснопольский В.И., Логутова Л.С., Буянова С.Н. Репродуктивные проблемы оперированной матки. М., Миклош, 2006. — 157 с.
71. Кулаков В.И., Манухин И.Б., Савельева Г.М. Гинекология. Национальное руководство. М: ГЭОТАР-Медиа; 2007. С. 890-897.
72. Кулаков В.И., Адамян Л.В. Место тотальной лапароскопической гистерэктомии в оперативной гинекологии. В сб.: «Новые технологии в гинекологии» под ред. В.И. Кулакова и Л.В. Адамян. М.: «ПАНТОРИ», 2003. -С. 11-12.
73. Кулаков В.И., Адамян Л.В. Прогресс эндоскопии в акушерстве и гинекологии. В кн. Лапароскопия и гистероскопия в диагностике и лечении гинекологических заболеваний. Под ред. В.И. Кулакова и Л.В. Адамян. М., 1998, 17-26.
74. Кулаков В.И., Адамян Л.В., Киселев С.И. Диагностическая и хирургическая лапароскопия в гинекологии: методические рекомендации. М., 1997. -51 с.
75. Кулаков В.И., Гаспаров А.С., Косаченко А.Г. Ургентная гинекология: новый взгляд // Акуш. и женских болезней — том I — выпуск 3. 2001. -С. 15-18.
76. Кулаков В.И., Серов В.Н., Абубакирова A.M. Клиническая трансфу-зиология в акушерстве, гинекологии и неонатологии // М., 2001.-С. 199-201.123
77. Кулаков В.И., Шмаков Г.С. Миомэктомия и беременность. М.: МЕД-пресс-информ, 2001. — 344 с.
78. Кургузов О .П., Кузнецов Н.А., Артюхина Е.Г. Кисты брыжейки кишечника: обзор // Хирургия. 1991. — № 2. — С. 148-154.
79. Кустаров В.Н., Линде В.А., Аганезова Н.В. Миома матки. С.Петербург, СПб МАЛО, 2001. — 32 с.
80. Ланчинский В.И., Ищенко А.И., Ищенко А.А. Новые подходы к хирургическому лечению миомы матки // Вопросы гинекологии, акушерства и пе-ринатологии. 2004. — т. 3. — № 5. — С. 77-80.
81. Леваков С.А. Варианты развития миомы матки (простая и пролифери-рующая). Автореф. дисс. д-ра мед. наук. М., 2001.
82. Луговской, Э.А. Дренирование операционной раны после мастэктомий / Луговской Э.А., Тимофеев Ю.М. // Вопросы онкологии. 1981. — № 10. -С. 85-86.
83. Люлько А.В., Горев Б.С. Артифициальные повреждения мочеточников. — В кн.: Травматические повреждения мочевого пузыря, уретры и наружных половых органов. Челябинск, 1982. С. 94-96.
84. Мажбиц А. М. Оперативная урогинекология. Л.: Медицина, 1964.
85. Манухин И.Б., Высоцкий М.М., Авалиани Х.Д. Осложнения лапароскопической и «открытой» гистерэктомии: сравнительный анализ. В сб.: «Новые технологии в гинекологии» под ред. В.И. Кулакова и Л.В. Адамян. М.: «ПАНТОРИ», 2003. С. 37-38.
86. Марченко А.И., Воеводина М.Н., Шманаева И.И. Современный взгляд на инвазивные и неинвазивные методы лечения миомы матки (обзор литературы) // Научно-практический журнал «Хирург». 2008. — № 6. — С. 25-32.124
87. Михайленко О.Т., Федоров Г.И., Щекзон О.М. Регионарная лимфотроп-ная терапия воспалительных заболеваний придатков матки // Педиатрия, Акушерство и гинекология. 1991. — № 5. — С. 52-53.
88. Мороз М. А. Способ хирургического лечения пузырно-влагалищных свищей. Акуш. и гин., 1980, № 6. — С. 51-53.
89. Насиров М.Я., Алиев М.Ф., Ахундов И.Т. и др. // Всероссийская конф. «Новое в лимфологии: клиника, теория, эксперимент»: Тезисы докладов. — М., 1993.
90. Нечаева И.Д. Опухоли яичников. JL: Медицина, 1987. — 215 с.
91. Новикова Е.Г., Чиссов В.И., Чулкова О.В. и др. Органосохраняющее лечение в онкогинекологии. М: ВИДАР-М, 2000; 77-105.
92. Новикова Е.Г., Чиссов В.И., Чулкова О.В., Ронина Е.А., Антипов В.А. Органосохраняющее лечение в онкогинекологии. М.: Издательский дом ВИДАР-М, 2000; 112 с.
93. Овчинников А.В., Базаев А.В. Лечение отека нижних конечностей после бедренно-подколенного шунтирования. Хирургия 1990; 5: 86-89.
94. Панченков Р.Т., Выренков Ю.Е., Ярема И.В., Щербакова Э.Г. Эндо-лимфатическая антибиотикотерапия. -М., 1984.
95. Панченков Р.Т., Ярема И.В., Сильманович Н.Н. Лимфостимуляция. М.: Медицина. — 1986. — 226 с.
96. Петров С.В., Бубнова Н.А., Павлов С.А. Интраоперационные повреждения периферических лимфатических коллекторов // В сб. I съезда лимфологов; бюллетень НЦССХ им. А.Н.Бакулева., М. Т. 4, № 5, 2003. — С. 131.
97. Плеханов А.Н., Манухин И.Б. Опыт использования влагалищного доступа при выполнении миомэктомии / Материалы Первого Международного конгресса по репродуктивной медицине. Москва 08-12 июня 2006, под ред.-Адамян Л.В. М., 2006. С. 59-60.
98. Поташов JI.B., Бубнова Н.А., Орлов Р.С. Хирургическая лимфология.-СПб: ЛЭТИ, 2000. 270 с.
99. Привес М.Г. Рентгенография лимфатической системы.-Л. :Центр. рент, радиол, и раков, инт-т, 1948. 140 с.
100. Прилепская В.Н., Роговская С.И., Межевитинова Е. А. Кольпоскопия. Практическое руководство. М: Медицинское информационное агентство; 2001
101. Пытель Ю.А., Асламазов Э.Г., Казимиров В.Г., Караев К.Н. Восстановление тазового отдела мочеточника при его обширных дефектах. В кн.: Вопросы экспериментальной и клинической урологии. Оренбург, 1980, С. 89-91.
102. Рабкин И.Х., Крылов B.C., Миланов Н.О. и др. Лимфология // Вестник рентгенологии радиологии. 1980. — № 6. — С. 52-57.
103. Рябинский B.C., Колпаков И.С., Томкевич Б.А., Сарухонян А.Г. Хирургическое лечение посттравматических мочеполовых свищей у женщин. В кн.: Травматические повреждения мочевого пузыря, уретры и наружных половых органов. Челябинск, 1982. — С. 89-91.
104. Савельева Г.М., Азиев О.В. Современные представления о лапароскопических операциях повышенной сложности. Материалы Международного конгресса «Лапароскопия и гистероскопия в гинекологии и акушерстве». М., 2002. С. 505-508.
105. Савельева Г.М., Богинская Л.Н., Бреусенко В.Г. и др. Профилактика спаечного процесса после хирургического вмешательства у больных в репродуктивном возрасте // Акушерство и гинекология. 1995. — № 2. — С. 36.
106. Савицкий Г.А., Савицкий А.Г. Миома матки // СПБ.: «ЭЛБИ-СПб». -2000. С. 90-139.
107. Саидова Р.А., Макацария А.Д. Гемостаз в эндометрии // Вестник Российской ассоциации акушеров-гинекологов. 1995. № 2. — С. 27-38.
108. Сапин М.Р. О взаимоотношениях иммунной системы с лимфопрово-дящими путями // Труды института клинической и экспериментальной лим-фологии. Новосибирск, 1992. — т. 1. — С. 143-144.
109. Серебров А.И. Рак матки. М.: Медицина, 1968.
110. Сидорова И.С. Миома матки (современные проблемы этиологии, патогенеза, диагностики и лечения).- М.: Медицинское информационное агентство, 2003.-256 с.
111. Силуянова В.А., Кавторова Н.Е. Учебное пособие по лечебной физкультуре в акушерстве и гинекологии. -М.: Медицина, 1977.
112. Слепцова Н.И. Влияние объема оперативного вмешательства при миоме матки на гемодинамические показатели внутренних гениталий и качество жизни женщины: Автореф. дисс. .канд. Мед. Наук. -М., 1999. 23 с.
113. Спиридонов А.А., Абалмасов К.Г., Тутов Е.Г. и др. Лечение лимфатических осложнений после реконструктивных операций на магистральных сосудах. Анналы хир 1997; 1: 33-37.
114. Стрижаков А.Н., Давыдов А.И., Стрижакова М.А. Клиническая оценка результатов влагалищной гистерэктомии у больных без пролапса гениталий // Вопросы гинекологии, акушерства и перинатологии. 2004. т. 3. — №5. -С. 7-13.
115. Стрижаков А.Н., Давыдов А.И., Шахламова М.Н. Поперечная надлобковая мини-лапаротомия: малоинвазивный метод хирургического лечения гинекологических больных // Вопросы гинекологии, акушерства и перинато-логии. 2003. — т. 2. — № 5-6. — С. 21-26.
116. Стрижаков А.Н., Давыдов Л.Д., Белоцековцева Л.Д. Избранные лекции по акушерству и гинекологии. Ростов н/Д: Изд. «Феникс», 2000.
117. Стюрева Г.М., Ярема В.И., Данилевский Я.В. Физико-химические свойства центральной лимфы // Хирург. 2008. — № 3. — С. 25-37.
118. Сурков Н.А., Саранцев А.Н., Аксенова С.Ю., Панова Н.П. Особенности регионарной лимфодинамики передней брюшной стенки у пациентов до и после коррегирующих операций // Научно-практический журнал «Хирург», 2008.- № .11 стр. 21-31.
119. Сыроватко Ф. А., Перельман В. М., Лоран О. Б. Вагинография в диагностике мочеполовых свищей. — Акуш. и гин., 1972, № 2, с. 23-26.
120. Тихомиров А.Л., Лубнин Д.М. Роль микрососудистых изменений в механизме маточных кровотечений у больных лейомиомой матки // АГ-ИНФО. 2000.-№1.-С. 5-7.
121. Тихомиров А.Л., Серов В.Н. Современные принципы диагностики, лечения и профилактики лейомиомы матки // Русский Медицинский Журнал. — 2000. -№ 11. -С. 473-476
122. Трескунов К.А., Комаров Б.А. Способ лечения онкозаболеваний. Патент РФ № 2172634 от 20.01.1998.
123. Тюляндин С.А. Рак яичников. М., 1996. — 60 с.
124. Урманчеева А.Ф., Кутушева Г.Ф. Диагностика и лечение опухолей яичника: Пособие для врачей. СПб.: ООО «Издательство Н-Л», 2001.
125. Урманчеева А.Ф., Кутушева Г.Ф. Диагностика и лечение опухолей яичников. Ст-Петербург: Гиппократ, 2001; 48.
126. Филатова Е.И. Клиника, лечение и прогноз рака влагалища // Диссертация на соиск. уч. степени канд. мед. наук. Л., 1989.
127. Фокин А.А., Кузнецов А.Г., Орехова Л.А., Федин А.А. Лучевое лечение лимфореи в паховой области после артериальной реконструкции. Ангиол. и сосуд, хир., 2001; 7: 1: 96-98.
128. Фрумкин А. П. Цистоскопический атлас. — М.: Медгиз, 1954.
129. Черенков В.Г., Байдо С.В., Иванченко В.В., Субботина О.Ю. Хирургические аспекты лечения злокачественных опухолей яичников: Матер, науч.-практ. конф.: «Новые подходы к скринингу, диагностике и лечению опухолей яичников». Великий Новгород 2001; 112.
130. Чухриенко Д. П., Люлько А. В., Романенко Н. Т. Атлас урогинекологи-ческих операций. — Киев: Вища школа, 1981.
131. Шиляев А.Ю. Лейомиома матки // Гинекология. 2005. № 1. С. 65-70.
132. Ярема И.В., Байбородин А.Б., Саранцев А.Н., Ярема В.И., Марченко А.И., Панова Н.С., Данилевская О.В., Смирнова Ю.Ю. Трансвагинальная эн-довидеопельвиолимфоцистоскопия // Научно-практический журнал «Хирург», 2009. № 1. — С. 60-65.
133. Ярема И. В., Уртаев Б. М., Трансфузия лимфы и ее компонентов. -М.: ТОО «Журнал КЛМ», 1995. 240 с.
134. Abbes М., Julliard G. Lymphographic study of four postoperative pelvic lymphoceles. Int Surg 1969; 52: 6: 435-439.
135. Adolphs H., Weibach L. KHnik des weiblichem. Harnrdhrendivertikels. -Akt. Urol., 1981, Bd 12, N 3, s. 107-110.
136. Al Salman M.M.S., Schwanz M.A., Gloviczki Rabee H., Shibli S. Groin lymphorrhea postoperative nuisance. Int Surg 1997; 82: 60-62.
137. Andrade L.R., Gomes S., Carvalho A. Lymphatic complications after venous surgery in the lower limbs. J Lymph 2001; 9: 34: 97.
138. Becker C, Hidden G, Godart S, Maurage H, Pecking A. Free lymphatic transplant. EJLRP 1991; 2, 6: 75-77.
139. Blebea J., Choudry R. Thigh isosulfan blue injection in the treatment of postoperative lymphatic complications. J Vase Surg 1999; 30: 350-354.
140. Bonhomme A., Breeders A., Oyen R.H., Stas M., De Wever I., Baert A.L. Cystic lymphangioma of the retroperitoneum. Clin Radiol 2001;56:156-158.
141. Bray A.E., Harrison C.L., Colman P.D. Common Femoral Vein Compression by Lymphocoele after Femoropopliteal Bypass Surgery. Eur J Vase Surg 1994; 8: 747-749.
142. Bristow R.E. Curr Opin Oncol 2000; 12: 5: 474-480.
143. Broder M.S., Bovone S. Improving treatment outcomes with clinical pathway for hysterectomy and myomectomy // J. Reprod. Med. 2002. — vol. 47. -N12.-p. 999-1003.
144. Broder M.S., Kanouse D.E., Mittman B.S., Bernstein S.J. The appropriateness of recommendations for hysterectomy // Obstet. Gynecol. 2000. — vol. 95. -P. 199-205.
145. Bruhaut M.A., Canis, Mage G. et al. Second-look laparoscopy after laparoscopic cystectomy of large ovarian endometriomas // Fertil. Steril. 1992. -Vol. 58. — P. 617-619.
146. Bruna J. Indication for lymphography in the era of new imaging methods. Lymphology 1994; 27 (Suppl): 319-320.
147. Burbank В., Childbirth and myoma treatment by uterine artery occlusion: do they share a common biology? J. Am. Assoc. Gynecol. Laparosc. 2004. — vol. 11.-N2.-p. 138-152.
148. Cagiannos I, Karakiewicz P, Eastham JA, Ohori M, Rabbani F, Gerigk C, et al. A preoperative nomogram identifying decreased risk of positive pelvic lymph nodes in patients with prostate cancer. J Urol 2003;170:1798-803.
149. Campisi C, Boccardo F, Tacchella M. The present role of isotope lymphan-gioscintigraphy and conventional lymphography in delineating the status of lymphatic and chylous collectors. Lymphology, 1994; 27 (Suppl): 282-285.
150. Campisi C, Boccardo F. Linfedemas Tratamento por tecnicas microcimrgi-cas. In: Brito CJ, Duque A, Merlo I, Murilo R, Lauria FF, editores. Cirurgia Vascular. Rio de Janeiro: Revinter; 2002. p. 1246-77.
151. Carbone F., del Guercio L., Raimondi G. et al. Lymphoceles complicating arterial reconstructions of the lower limbs: outpatient conservative management. J Lymph 2001; 9: 34: 99.
152. Chekhonina E.M., Tsybikov N.N., Feligin G.A. Lymph reinfusion as a method of treating posttraumatic lymphorrhea from the thoracic duct in the neck. Vestn Otorhinolaryngol 1998; 3: 93-94.
153. Chen C.B., Buck G.M., Courey N.G. et al. Risk factors for uterine fibroids among women undergoing tubal sterilization // Amer. J. Epidemiol. 2001. -vol. 153.-Nl.-P. 20-26.
154. Choo J.J., Scudiere J., Bitterman P. et al. Vaginal lymphatic channel location and its implication for intracavitary brachytherapy treatment // Bracyitherapy. -2005. Vol. 4. — P. 236-240.
155. Clark T, Parekh DJ, Cookson MS, Chang SS, Smith ER Jr, Wells N, et al . Randomized prospective evaluation of extended versus limited lymph node dissection in patients with clinically localized prostate cancer. J Urol 2003;169:145-7.
156. Cooper J., Brady R. Intraoperative and early complications of operative hysterectomy // Obstet. Gynecol. Clin. North Am. 2000. — vol. 27. — p. 347-366.
157. Cooper J., Brady R. Late complications of operative hysterectomy // Obstet. Gynecol. Clin. North Am. 2000. — vol. 27. — p. 367-374.
158. Cooppola P., Cooppola M. Emergency department evaluation and treatment of pelvic fracture // Emerg. Med. Clin. Of Noth Amer. 2000. vol. 18. — N 1. -P. 231-235.
159. Croft RJ. Lymphatic fistula: a complication of arterial surgery Letter. Br Med J 1978; 2: 205.
160. Dicato M., Duhem C., Berchem G., Ries F. // Curr. Opin. Oncology. 2000. — vol. 12 (4): p. 297-302.
161. Donnez J., Nisolle M. Laparoscopic menegment of large ovarian endometrial cysts. // J. Gynecol. Surg. 1991. — Vol. 7. — P. 163-167.
162. Eastcott H.H.G. Complications of aorto-iliac reconstructions for occlusive disease. In: V. Bernhard, J Towne, eds. Complications in Vascular Surgery, New York City: Grune and Stratton 1980; 41-64.
163. Echtle D, Mueller E, Frohneberg D. Can extended lymph node dissection improve prognosis? Program and abstracts of the 21st Annual Congress of the European Association of Urology; April 5-8, 2006; Paris, France. Abstract 610.
164. Feng Q., Kiviat N.B. New and surprising insights into patogenesis of multicentric squamous cancers in the female lower getnital tract // J. Nat. Cancer. Inst. -2005. Vol. 97. — № 24. — P. 1798-1799.132
165. Frank S.J., Jhingran A., Levenback C. et al. Definitive radiation therapy for sqvamous cell carcinoma of the vagina // Int. J. Radiat. Oncol. Biol. Phys. 2005. — Vol. 62 (1). — P. 138-147.
166. Gokaslan H., Sismanoglu A., Pekin T. et al. Primary malignant melanoma of the vagina: a case report and review of the current treatment options // Europ. J. Obst. Gynecol. Rep. Biol. 2005. Vol. 121. P. 243-248.
167. Goldfarb H.A. Combining myoma coagulation with endometrial ablation/resection reduces subsequent surgery rate // J. SLS. 2001. vol. 5. N1. p. 97-98.
168. Gomes A., Scholl D., Fineberg S. Lymphangiography and ultrasound in management of lymphoceles. Urology 1999; 8: 1: 104-108.
169. Gomes S., Carvalho A. Lymphatic fistula treadet with high dose of diosmin. Eur J Lymph 2001; 9: 34: 80.
170. Hatch K., FuY. Cancer cervical and vaginal // In: Novak editor. Gynecology. 12th edition- New York: Williams&Wilkins, 1996. P. 1111-1144.
171. Heidenreich A, Varga Z, von Knobloch R. Extended pelvic lymphadenec-tomy in patients undergoing radical prostatectomy: High incidence of lymph node metastasis. J Urol 2002;167:1681-6.
172. Hricak H, Choyke PL, Eberhardt SC, Leibel SA, Scardino PT. Imaging prostate cancer: A multidisciplinary perspective. Radiology 2007;243:29-53.
173. Huth F., Bernhardt D. The anatomy of lymph vessels in relation to function// Lymphology, 1977. Vol. 10. — P. 54-61.
174. Jedrzejcak P., Pawelczyk L., Grewling K. et al. Ability to conceive and the coursc of pregnancy in women after laparoscopic myomectomy // Przegl Lek. -2004. vol. 61. — N 2. — P. 65-69.
175. Jeschke S, Nambirajan T, Leeb K, Ziegerhofer J, Sega W, Janetschek G. Detection of early lymph node metastases in prostate cancer by laparoscopic ra-dioguided sentinel lymph node dissection. J Urol 2005;173:1943-6.
176. Joshi V.V. Peripheral neuroblastic tumors: pathologic classification based on recommendations of international neuroblastoma pathology committee (modification of Shimada classification). Pediatr Dev Pathol 2000;3:184-199.
177. Judd E.S., Nix J.T. Spontaneous and traumatic lymph fistulas: data on 40 cases. Surg Clin North Am 1949; 29: 1035-1047.
178. Kattan MW, Potters L, Blasko JC, Beyer DC, Fearn P, Cavanagh W, et al . Pretreatment nomogram for predicting freedom from recurrence after permanent prostate brachytherapy in prostate cancer. Urology 2001;58:393-9.
179. Kennedy A.V. et al. // Proc ASCO. 2000; Abstr.1563.
180. Kizu H, Takayama T, Fukuda M, Egawa M, Tsushima H, Yamada M, et al . Fusion of SPECT and multidetector CT images for accurate localization of pelvic sentinel lymph nodes in prostate cancer patients. J Nucl Med Technol 2005; 33:7882.
181. Konen O, Rathaus V, Dlugy E, et al. Childhood abdominal cystic lymphangioma. Pediatr Radiol 2002; 32:88-94.
182. Lamoreaux W.T., Grigsby P.W., Dehdashti F. et al. FDG-PET evaluation of vaginal carcinoma // Int. J. Rad. Oncol. Biol. Phys. 2005. — Vol. 62 (3). -P. 733-737.
183. Leblanc E., Querleu D., Narducci F. Obstet Gynev Surv 2005; 60: 1: 31-32.
184. Leitner D.W., Sherwood R.C. Inguinal lymphocoele a complication of thighplasty. Plast Reconstr Surg 1983; 72: 878-881.
185. Lessey B. et al. // Molecul. Reprod. Dev. 2000. — Vol. 62. — P. 446-455.
186. Levenback C., Morris M., Burke T.W. et al. Gynec Oncol 1996; 62: 73-77.
187. Liebermann-Meffert D. Surg Clin Nortg Am 2000; 80: 1: 275-293.
188. Livingston W.D., Confer D.J., Smith R.B. Large lymphoceles resulting from retroperitoneal lymphadenectomy. J Urol 1980; 124: 543-546.
189. Lonergan G.J., Schwab C.M., Suarez E.S., Carlson C.L. Neuroblastoma, ganglioneuroblastoma, and ganglioneuroma: radiologic-pathologic correlation. Ra-dioGraphics 2002;22:911-934.
190. Lopez C., Balogun M., Ganesan R., Olliff J.F. MRI of vaginal conditions // Clinical Radiology. 2005. — Vol. 60. — P. 648-662.
191. Mabry H., Giuliano A.E. Sentinel node mapping for breast cancer: Progress to date and prospects for the future. Surg Oncol Clin N Am 2007;16:55-70.
192. Madalini V., Pisitano N., Bruttini G. et al. Angiographic nephrectomy as a non-surgical treatment of ureteral fistulas. Urol. Radiol., 1981, vol. 2, N 4, p. 249-251.
193. Magrina J.F., Tahery M.M., Heppell J., Cornelia J.L. J Laparoendosc Adv Surg Tech A 1997; 7: 191-193.
194. Marchionni M., Fambrini M., Zambelli V. et al. Reproductive perfomance befor and after abdominal myomectomy: a retrospective analysis // Fertil. Steril. -2004. vol. 82. — N 1. — P. 154-159.
195. Marconi G., Vilela M., Quintana R., Sueldo C. Laparoscopic ovarian cystectomy of endometriomas does not affect the ovarian response to gonadotropin stimulation. // Fertil Steril. 2002. — vol.78. — P. 876-878.
196. Martin D.C., Hubert G.D., Vander Zwaag R., El-Zeky F. Laparoscopic appearance of peritoneal endometriosis // Fertil. Steril. 1989. — vol. 51. — P. 63-67.
197. Maureen K.N. In the book: «Nutrition: Cancer answer 2», USA, 2002, PP 235-237
198. McCall A.R., Olson M.C., Potkul R.K. Cancer 1995; 1: 75: 2286-2288.
199. Menzin A.W., Gal D., Lorecchio J.L. Gynec Oncol 2000; 78: 1: 78-79.
200. Mercuriali F. The role of human recombinant erythropoietin in oncologic surgery // Tumori. 1997, Jul; 83 (4 Suppl. 2): S16-S19.
201. Meyers A.M., Levine E., Myburgh J.A., Goudie E. Diagnosis and management of lymphoceles after renal transplantation. Urology 1977; 10: 497-502.
202. Muller , Blumlein H., Lux В., Mai P. Ergebnisse nach interner Urethrotomic bei Harnrohrenstrikturen. —Akt. Urol., 1980, Bd 11, N 6, s. 395-400.
203. Nishie A, Yoshimitsu K, Honda H, et al. Presacral dermoid cyst with scanty fat component: usefulness of chemical shift and diffusion-weighted MR imaging. Comput Med Imaging Graph 2003;27: 293-296.
204. Ogose A, Hotta T, Sato S, Takano R, Highchi T. Presacral schwannoma with purely cystic form. Spine 2001; 26:1817-1819.
205. Oh В., Kwon D., Park K. Late presentation of ureteral injury after laparoscopic surgery // Obstet. Gynecol. 2000. — vol. 95. — p. 337-339.
206. Olszewski W.L. Physiology and microsurgery of lymphatic vessels in man. Lymphology 1981; 14: 44-60.
207. Olszewski WL. Bacteriological Studies of skin, tissue fluid and lymph in filarial lymphedema. Lymphology 1994; 27 (Suppl): 345-348.
208. Pardhoo S., Gehani S., Buscombe J. et al. Dynamic imaging & ultrastructure of spontaneous lymphocoele. J Lymph 2001; 9: 34: 94.
209. Parlin AW, Mangold LA, Lamm DM, Walsh PC, Epstein JI, Pearson JD. Contemporary update of prostate cancer staging nomogram (Partin Tables) for the new millennium. Urology 2001;58:843-8.
210. Pecking AP, Cluzan RV. Assessment of lymphatic function: 15 years experience using radionuclide methods. Lymphology 1994; 27 (Suppl): 301-304.
211. Plentl F.V., Friedman E.A. Lymphatic system of the female genitalia. Philadelphia: Saunders, 1971.
212. Rabee H.M. Sartorius Myoplasty for Groin Infections Following Prosthetic Vascular Graft. Kuwait Med J 2001; 33: 1: 29-32.
213. Radevich O.L., Nemchenko V.V., Clevatski G.G. Profuse lymphorrhea after appendectomy. Vestn Khir 1981; 127: 73.
214. Rao G., Skinner E., Gehrig P. et al. Obstet Gynec 2004; 104: 2: 261-306.
215. Rha SE, Byun JY, Jung SE, Chon HJ, Lee HG, Lee JM. Neurogenic tumors in the abdomen: tumor types and imaging characteristics. RadioGraphics 2003; 23:29-43.
216. Roberts J.R., Walters G.K., Zenilman M.E., Jones C.E. Groin Lymphorrhea Complicating Revascularization Involving the Femoral Vessels. Am J Surg 1993; 165:341-344.
217. Rouzier R., Pomel C. Curr Opin Obstet Gynec 2005; 17: 1: 77-82.
218. Ryu R.K., Chrisman H.B., Omary R.A. et al. The vascular impact of uterine artery embolization: Prospective sonographic assessment of ovarian arterial circulation // J. Vase. Interv. Radiol. 2001. — vol. 12. — P. 1071-1074.
219. Sahler L.G., Burgener F.A., Awender H.S. Massive inquinal lymfocele. Lympholodgy 1994; 27: 3:144-145.
220. Sakai K., Kamura Т., Hirakawa T. Gynec Oncol 1997; 65: 1: 164-168.
221. Sandmann W., Kremer K., Kleinschmidt F., Gunther D. Lymphabflu storun-gen nach Arterien-Operationen am Bein. Chirurg 1976; 47: 198-204.
222. Sawhney R., D’Agostino H.B., Zinck S., et al. Treatment of postoperative lymphoceles with percutaneous drainage and alcohol sclerotherapy. JVIR 1996; 7:241-245.
223. Sethi G.K., Scott S.M., Takaro T. Persistent lymphatic fistula Unusual complication of femoro-femoral arterial bypass. J Cardiovas Surg 1978; 19: 2: 155159.
224. Sheth S., Studd J. Vaginal hysterectomy. Martin Dunitz. 2002. — 75 p.
225. Shimotsuma M., Shields J.W., Simpson-Morgan M.W. Lymphology 1993; 26: 2: 90-101.
226. Skudder P.A., Geary J. Lymphatic drainage from the groin following surgery of the femoral artery. J Cardiovasc Surg 1987; 28: 4: 460-463.
227. Soots G., Mikati A., Warembourg H. et al. Treatment of lymphorrhea with exposed or infected vascular prosthetic grafts in the groin using sartorius myoplasty. J Cardiovasc Surg (Torino) 1988; 29: 42-45.
228. Spies J.B., Cooper J., Wornthington-Kirsch R. et al. Outcome from uterine embolization and hysterectomy for treatment of leiomyomas: results of multi-center comparative study // J. Vase. Interv. Radiol. 2003. — vol. 14(suppl).
229. Stanton S. L. Preface for problems associated with incontinent bladder. -Ann. Chir. Gynaec. Fenn., 1982, vol. 71, p. 185-188.
230. Stewart E.A., Faur A.M., Wisw L.A. et al. Predictors of subsecuent surgery for uterine leiomyomata after abdominal myomectomy // Obstet. Ginecol. — 2002. -№99 (3).-P. 426-432
231. Strand SE, Persson BR. Quantitative lymphoscintigraphy I: Basic concepts for optimal uptake of radiocolloids in the parasternal lymph nodes in rabbits. J Nucl Med 1979;10:1038-46.
232. Tsujimoto H., Hagiwara A., Shimotsuma M. et al. J Cancer Res Clin Oncol 1996; 122: 10: 590-595.
233. Tyndall S.H., Shepard A.D., Wilczewski J.M. et al. Groin lymphatic complications after arterial reconstruction. J Vase Surg 1994; 19: 5: 854—864.
234. Ueda K, Tsunoda A, Nakamura A, et al. Presacral epidermoid cyst: report of a case. Surg Today 1998; 28:665-668.
235. Ueno Т., Tanaka Y.O., Nagata M., et al. Spectrum of germ cell tumors: from head to toe. RadioGraphics 2004;24:387-404.138
236. Van Sonnenberg E., Wittich G.R., Casola G. et al. Lymphocoeles: imaging characteristics and percutaneous management. Radiology 1986; 161: 593-596.
237. Vollenhoven B.J., Lawrence A.S., Heally D.L. // Brit. J. Obstet. Gynecol. -1999. vol.97. — p. 285-288.
238. Vukic Z. Intra-pelvic sacrococcygeal teratoma. Acta Paediatr 2003;92:874-875.
239. Weber A.M., Mitchinson A.R., Gidwctni G.P. Uterine myomas and factors associated with hysterectomy in premenopausal women // Amer. J. Obstet. Gynecol. 1997. — Vol. 176, № 6. — P. 1213-1217.
240. Weckermann D, Dorn R, Trefz M, Wagner T, Wawroschek F, Harzmann R. Sentinel lymph node dissection for prostate cancer: Experience with more than 1,000 patients. J Urol 2007;177:916-20.
241. Winter W.E., Kucera P.R., Rodgers W. et al. Obstet Gynec 2002; 100: 4: 671-676.
242. Witte C, McNeill G, Witte M et al. Whole-body lymphangioscintigraphy: making the invisible easily visible. Progress in Lymphology XII, Elsevier Science Publishers B.V., 1999; 123.
243. Yang DM, Yoon MH, Kim HS, et al.37.
247. Zullo F., Palomba S., Corea D. et al. Bupivacaine plus epinephrine for laparoscopic myomectomy: a randomized placebo-controlled trial // Obstet. Gynecol. 2004. Aug. — vol. 104. — N2. — p. 243-249.
лечение и диагностика в Минске
Рак тела матки лечение 1, 2, 3 стадии. Симптомы, признаки, метастазы, прогноз.
Что такое рак тела матки?
Рак тела матки (рак эндометрия) – это злокачественная опухоль слизистой оболочки (эндометрия), изнутри выстилающей тело матки (со стороны полости матки).
Чаще всего рак тела матки возникает у женщин в постменопаузе (в постклимактерическом периоде), однако в последнее время имеется тенденция к его «омоложению». Все чаще рак тела матки встречается у женщин фертильного возраста до наступления климакса.
У большинства пациенток рак тела матки диагностируется в I стадии заболевания (72 %), на долю II стадии приходится 12 %, III стадии – 13 %, IV стадии – 3 %.
Что является причиной рака тела матки?
Причины возникновения рака тела матки (этиология) до конца не изучены. В большинстве случаев он развивается на фоне эстрогенизации организма женщины, т.е. на фоне избытка женских половых гормонов – эстрогенов. Это 1-й патогенетический тип рака тела матки. На его долю приходится 75 % всех случаев рака эндометрия.
Избыток эстрогенов является, с одной стороны, результатом гормональных нарушений, с другой, сам приводит к усугублению этих гормональных нарушений. На избыток эстрогенов слизистая матки реагирует определенным образом, развивается гиперплазия эндометрия.
Выделяют следующие варианты гиперплазии эндометрия:
- простая гиперплазия эндометрия без атипии;
- сложная (аденоматозная) гиперплазия эндометрия без атипии;
- простая атипическая гиперплазия эндометрия;
- сложная (аденоматозная) атипическая гиперплазия эндометрия.
Два первых варианта относят к фоновым заболеваниям тела матки (эндометрия), 3 и 4 – к предраковым. Причем особого внимания заслуживает сложная атипическая гиперплазия эндометрия, так как вероятность ее перерождения в рак составляет более 80 %.
Указанные варианты гиперплазии эндометрия и рак эндометрия представляют собой разные фазы процесса изменения эндометрия под влиянием избытка эстрогенов.
Таким образом, возможна такая цепь изменений:
- сложная (аденоматозная) гиперплазия эндометрия без атипии;
- сложная (аденоматозная) атипическая гиперплазия эндометрия;
- рак тела матки (эндометрия).
Помимо изменений в слизистой тела матки, 1-й патогенетический тип рак эндометрия характеризуется обменными нарушениями (метаболическим синдромом). Для него характерны:
- ожирение;
- сахарный диабет;
- артериальная гипертензия.
В жировой ткани женщины происходит образование эстрогенов, избыток жировой ткани приводит к избытку эстрогенов. Патологический круг замыкается.
Рак тела матки 1-го патогенетического типа
Рак тела матки, развивающийся по 1-му патогенетическому типу, как правило, выявляется на ранних стадиях и характеризуется благоприятным прогнозом.
Рак тела матки 2-го патогенетического типа
Второй патогенетический тип рака тела матки развивается на фоне нормального эндометрия без каких либо обменных и гормональных нарушений. На его долю приходится 25 % всех случаев рака тела матки. Опухоли при этом типе имеют высокий злокачественный потенциал. Этот тип рака характеризуется менее благоприятным прогнозом.
Рак тела матки 3-го патогенетического типа
В настоящее время описывают третий патогенетический тип рака эндометрия, который относится к генетически наследуемым формам. Такой рак передается по наследству и сочетается с неполипозным раком толстой кишки.
Симптомы рака тела матки?
Основными симптомами, которые вынуждают женщину обратиться к врачу-гинекологу, являются патологические выделения из половых путей.
Наиболее часто при раке тела матки – это кровянистые выделения различной интенсивности.
При наличии таких жалоб назначается раздельное диагностическое выскабливание слизистой тела и шейки матки или гистероскопия с биопсией патологического очага. Удаленный материал подвергается цитологическому и гистологическому исследованиям.
В большинстве случаев диагноз рака тела матки после указанных манипуляций трудностей не вызывает. После установления диагноза рака эндометрия пациентка должна быть направлена в специализированное онкологическое учреждение.
Если не обращаться за помощью, может ли рак тела матки пройти самостоятельно?
Нет. Самоизлечения от этой болезни не наступает. При отсутствии лечения болезнь будет прогрессировать, разовьются метастазы, которые будут поражать все большее число органов.
Лечение подавляющего большинства больных раком тела матки на ранних стадиях заболевания позволяет добиться полного излечения. И наоборот, затягивание с началом специального лечения сокращает шансы на полное выздоровление.
Что такое стадии рака тела матки?
В нашей стране общепринятыми для формулировки диагноза рака тела матки являются классификации Международного Противоракового Союза по системе TNM и классификация Международной Федерации акушеров и гинекологов (FIGO) по стадиям (см. раздел: алгоритмы диагностики и лечения больных злокачественными опухолями).
Стадирование осуществляется только во время хирургического вмешательства. До операции выставляется только предполагаемая стадия заболевания. После операции она может измениться. Окончательной является та стадия, которая выставлена после операции и получения планового морфологического ответа.
Диагностика рака тела матки
Стандартным набором исследований перед началом лечения являются:
- гинекологический осмотр;
- раздельное диагностическое выскабливание слизистой тела и шейки матки или гистероскопия с прицельной биопсией с последующим цитологическим и гистологическим исследованием полученного материала;
- ультразвуковое исследование органов малого таза и брюшной полости;
- рентгенография органов грудной клетки;
- общий анализ крови и мочи, биохимический анализ крови, коагулограмма.
Остальные исследования назначаются при наличии на это показаний:
- при наличии увеличенного надключичного лимфатического узла назначается ультразвуковое исследование шеи и надключичных областей и пункция увеличенного лимфоузла;
- при жалобах на наличие крови при мочеиспускании назначается цистоскопия (визуальное исследование слизистой мочевого пузыря при помощи оптических систем) и т.д.
Так как чаще рак тела матки встречается у женщин в постменопаузе и чаще это 1-й патогенетический тип, то у женщин могут быть сопутствующие, а иногда и конкурирующие заболевания (гипертоническая болезнь, сахарный диабет, ожирение, ишемическая болезнь сердца) – очень важно провести коррекцию этих заболеваний до начала лечения по поводу рака тела матки.
Перед оперативным вмешательством пациентка обязательно осматривается и консультируется терапевтом, при необходимости кардиологом, а также врачом-анестезиологом. Эти специалисты оценивают функциональное состояние пациентки и риск развития осложнений со стороны сердечно-сосудистой, дыхательной и других систем.
В том случае, если риск развития осложнений во время операции и после нее превышает риск самого рака эндометрия, пациенты направляются для лечения сопутствующей патологии и предоперационной подготовки в лечебные учреждения Республики.
Симультанные операции
Иногда у пациентки может быть два угрожающих жизни серьезных заболевания: рак тела матки и заболевание сердечно-сосудистой системы, требующее хирургической коррекции.
В такой ситуации онкологи не могут выполнить оперативное лечение онкологической патологии, так как возможны фатальные осложнения со стороны сердечно-сосудистой системы. Кардиохирурги не могут выполнить хирургическое лечение своей профильной патологии, так как во время операции и после нее они назначают таким больным антикоагулянтные препараты (препараты, предотвращающие свертывание крови и образование тромбов). При этом возможно развитие маточного, не поддающегося коррекции кровотечения из опухоли.
В этих случаях мы совместно с кардиохирургами прибегаем к симультанным операциям, то есть одновременно выполняем операцию по поводу рака тела матки и заболевания сердечно-сосудистой системы.
Полностью обследованная пациентка госпитализируется в Республиканский научно-практический центр «Кардиология», где назначается дата симультанной операции. В назначенный день онкологи своей операционной бригадой и хирургическим инструментарием прибывают в РНПЦ «Кардиология», выполняется симультанная операция. Послеоперационный период проходит в РНПЦ «Кардиология», затем пациентки направляются на раннюю реабилитацию.
После окончания периода лечения и реабилитации по поводу сердечной патологии больная должна обязательно прибыть в РНПЦ ОМР им. Н.Н. Александрова для рекомендаций по наблюдению или послеоперационному лечению.
Лечение рака тела матки
Лечение больных зависит от стадии заболевания и морфологической формы опухоли и проводится в соответствии с приказом № 258 Министра Здравоохранения Республики Беларусь от 2012 года об утверждении некоторых клинических протоколов: «Алгоритмы диагностики и лечения злокачественных новообразований» (см. соответствующий раздел).
Операция начинается с хирургического стадирования. В начале операции проводится тщательная ревизия органов брюшной полости и малого таза на предмет отсутствия или наличия метастазов.
Выполняются:
- смыв из брюшной полости;
- биопсия тазовых и забрюшинных лимфатических узлов.
Это необходимо для окончательного установления стадии заболевания и определения объема операции. После чего выполняется операция, включающая в себя удаление матки и придатков, по показаниям удаляются тазовые и забрюшинные лимфатические узлы, большой сальник. При наличии метастазов в брюшной полости по возможности все они удаляются.
Необходимость послеоперационного лечения зависит от окончательного гистологического ответа и распространенности опухолевого процесса.
Какие осложнения могут быть во время и после операции?
1. Одним из самых грозных осложнений послеоперационного периода является тромбоэмболия легочной артерии.
Наличие у больной онкологической патологии, оперативное вмешательство на органах малого таза, сопутствующая сердечно-сосудистая патология являются факторами, усугубляющими этот риск. Поэтому накануне операции больной начинается профилактика трмобэмболических осложнений (медикаментозная тромбопрофилактика). Она заключается в подкожном введении антикоагулянтов прямого действия (гепарин, низкомолекулярные гепарины). Тромбопрофилактика продолжается до периода активизации больной, но не менее 7 суток после операции.
2. Профилактика тромбов — использование противоэмболических чулков
Важным элементом тромбопрофилактики является использование противоэмболических чулков либо бинтование нижних конечностей эластическими бинтами непосредственно перед операцией, особенно у больных с варикозной болезнью сосудов нижних конечностей. Одним из элементов тромбопрофилактики является ранняя активизация больной. Мы разрешаем вставать больным уже на следующий день или через 1 день после операции.
3. Лимфокисты
После удаления тазовых или забрюшинных лимфатических узлов могут возникать лимфокисты. Как правило, они либо проходят самостоятельно, либо требуют проведения консервативной противовоспалительной терапии. Если консервативная терапия неэффективна, то под контролем ультразвукового исследования выполняется пункция, опорожнение и дренирование лимфокисты.
4. Кровянистые выделения
После операции могут быть кровянистые выделения из культи влагалища. Обычно это связано с образованием в области культи влагалища гематомы (скопления крови) и ее опорожнением. Раневая поверхность во время операции и после нее какое-то время незначительно кровоточит. Формируется гематома.
Ее формирование может сопровождаться повышением температуры тела до 38-39 градусов по шкале Цельсия. После адекватного дренирования гематомы температура снижается до нормальных цифр.
Повышение температуры тела в первые 5 дней после операции связано с реакцией организма больной на хирургическое вмешательство и не является признаком воспалительного процесса.
5. Нарушения мочеиспускания
Нарушения мочеиспускания (недержание мочи, неполное опорожнение мочевого пузыря – атоничный мочевой пузырь) в послеоперационном периоде связаны с тем, что во время операции, особенно при расширенных вмешательствах, когда необходимо вместе с маткой удалять рядом расположенные ткани (параметрии), приходится выделять мочеточники и отделять от шейки матки мочевой пузырь.
При этом нарушается иннервация мочевого пузыря и мочеточников, часть нервных волокон пересекается. Эти нарушения носят обратимый характер и проходят после восстановления иннервации. Длительное стояние катетера в мочевом пузыре после операции также способствуют развитию атонии мочевого пузыря. И в данном случае ранняя активизация пациентки является профилактикой нарушений мочеиспускания.
Вопросы пациентов
1. Если назначена после операции лучевая терапия, то каких осложнений от нее можно ожидать?
В настоящее время для проведения лучевой терапии в Центре используется новейшее оборудование, которое позволяет минимизировать лучевые реакции и осложнения.
Как правило, назначается дистанционная лучевая терапия на малый таз. Следовательно, возможны лучевые реакции и осложнения со стороны тех органов, которые попадают в зону облучения:
- мочевой пузырь;
- влагалище;
- прямая кишка.
При появлении неприятных ощущений, нарушении функций указанных органов необходимо обратиться к специалисту нашего отделения.
2. Можно ли во время операции не удалять яичники?
Нельзя. Яичники в обязательном порядке удаляют вместе с маткой. Это гормональный орган, который участвует в патологическом обмене веществ, приводящем к раку эндометрия. Помимо этого, яичники являются одним из основных органов-мишеней, в которые метастазирует рак эндометрия в первую очередь.
Иногда пациентки переживают из-за того, что они после удаления яичников «перестанут быть женщинами». Это не так. Вторичные половые признаки после удаления яичников не исчезнут. Женские половые гормоны все равно будут синтезироваться в организме, но не в таких количествах. Эту функцию на себя берут другие органы внутренней секреции, например, надпочечники.
После удаления яичников у женщин до наступления менопаузы развивается в той или иной степени климактерический (кастрационный) синдром. Как показывает практика, в большинстве случаев он переносится достаточно легко и через определенное время (1-2 месяца) проходит.
Проявляется он в виде вегетативных реакций:
- увеличение частоты сердечных сокращений;
- потливости;
- появления чувства жара или озноба, иногда страха;
- повышения артериального давления.
Эти реакции не несут никакой серьезной угрозы организму, но если они «не дают покоя», приводят к различным невротическим состояниям и снижению трудоспособности, то возможно назначение негормональных препаратов, какие обычно применяются при наступлении физиологического климакса. В таких случаях нужно посоветоваться и получить рекомендации онкогинеколога.
3. Можно ли жить половой жизнью при таком диагнозе?
Можно. В большинстве случаев такой вопрос волнует женщину после операции. Если в послеоперационном периоде не назначается лучевая терапия, то половой жизнью можно жить не ранее, чем через 1,5-2 месяца после операции. Перед этим желательно проконсультироваться у гинеколога.
Если в послеоперационном периоде назначена лучевая терапия, то половую жизнь следует начинать не ранее, чем утихнут лучевые реакции. Точных сроков назвать невозможно из-за того, что у организма каждой женщины свой порог переносимости лучевой терапии.
Перед началом половой жизни также необходимо проконсультироваться у гинеколога.
Гинекологические операции — Nutricia Advanced Medical Nutrition
Гинекологические операции
Если вам предстоит оперативное вмешательство, то вы, вероятно, волнуетесь, и это вполне естественно. Успокоиться поможет мысль о том, что необходимая операция, особенно сделанная вовремя,дает возможностьизбавиться от болезнии, нередко,спасает жизнь.А от того, как пройдет послеоперационный период, во многом зависит состояние здоровья в будущем, поэтому стоит сделать все возможное для восстановления сил. Особое значениена этом этапе имеет специализированное питание. Питание при миоме и других гинекологических заболеваниях должно быть сбалансированным и включать в себя комплекс питательных веществ, необходимых для того, чтобы хорошо подготовиться к операции, ведь любое хирургическое вмешательство — это стресс для организма, и важно удовлетворять его потребности, избегая излишних нагрузок.
Особое время
Женщины, перенесшие такие гинекологические операции, как удаление матки или яичников, иссечение миомы, кесарево сечение или аборт, могут довольно быстро восстановить здоровье и вернуться к обычной жизни. Но нужно помнить, что хирургическое вмешательство и наркоз вызывают в организме специфическую реакцию, другими словами – стресс, который необходимо преодолеть в течение послеоперационного периода.Несмотря на то, что операция вызывает не только местную, но и общую реакцию организма, она не меняет сути обменных процессов, влияя лишь на их активность и интенсивность.
Послеоперационный периодпринято делить на несколько этапов.В начале (с 1-го по 3-й день) организм мобилизует все свои силы для того, чтобыустранить негативные последствия операционной нагрузки и восстановить обменные процессы. Затем, в течение 3 — 5 дней, происходит защитная реакция, направленная на быструю доставку необходимых веществ в клетки, ведь после операции очень важно восполнять энергетические потери, поэтому питание после удаления матки или яичников и других гинекологических операций должно быть полноценным и сбалансированным.
Повышенный распад белка вызывает не только снижение мышечной массы и уменьшение количества соединительной ткани, но и дефицит ферментных белков. Стоит отметить, что на этом этаперастет уровень гормонов стресса и снижается уровень инсулина. Во время следующей фазы активируются метаболические процессы: усиливается синтез белка, жиров и других веществ, потерянных в период операции и на предыдущем этапе. За счет этого происходитчрезвычайно важный процесс роста и развития соединительной ткани. Также восстанавливаются функции сердечно-сосудистой и дыхательной систем, желудочно-кишечного тракта.
Существуют общие рекомендации специалистов, которым стоит следовать для того, чтобы послеоперационный период прошел успешно.Во-первых, для реабилитации женщине необходимо комплексное медикаментозное лечение. Оно включает антибактериальную, обезболивающую, успокаивающую терапию и общеукрепляющие препараты. Во-вторых, питание после удаления матки, кесарева сечения или аборта должно содержать оптимальное количество белков, жиров и углеводов, комплекс витаминов и минералов, а также омега 3 жирные кислоты. В-третьих, нужен комплекс восстанавливающей терапии, включающий физиотерапевтические процедуры и лечебную гимнастику.
Правильный рацион
Специализированное питание после удаления матки и других операций необходимо для того, чтобы снизить нагрузку на организм,способствовать нормализации обмена веществ, повысить сопротивляемость организма при воспалениях и интоксикации, ускорить заживление операционной раны. Еще одна важная задача такого питания -устранение дефицита белков и витаминов, который нередко развивается у прооперированных женщинпод влиянием таких факторов, как кровопотери, распад тканевых белков и лихорадка. Кроме того, после операции нужно запустить «стоячий» кишечник, проявлениями которого являются запоры, метеоризм.В связи с этим рекомендуется употреблятьмясные бульоны, кисломолочные продукты, свежие фрукты и овощи, рассыпчатые каши, растительное масло. Помните: диета должна состоять преимущественно из пищи, обладающей послабляющим действием. Дело в том, что после многих гинекологических операций, в частности, после удаления миомы, не разрешается тужиться, так как подобное напряжение — это угроза для швов, оставшихся на матке. Соответственно, нельзя допускать возникновения запоров. Они опасны еще и потому, что нерегулярная работа кишечника провоцирует воспаление в придатках и матке. Исключить из рациона стоит те продукты, которые замедляют работу кишечника. Это «слизистые» супы-пюре и каши, а также кисели и протертая пища. Не рекомендуется употреблять шоколад, крепкие чай и кофе, какао, творог и гранаты. Белый хлеб и кондитерские изделия также не желательны.
Питание после удаления матки должно быть дробным. Что касается калорийности блюд, ее увеличиваютпостепенно.Очень важно знать, что на этом этапе многие людиподвержены обезвоживанию. Суточная потребность в жидкости в послеоперационный период составляет от 2 до 4,5 литров в сутки, в зависимости от состояния пациента.Эти рекомендации необходимо соблюдатьв течение 2-4 месяцев, а затем можно переходить на обычный режим питания.
Восполняем потери
Во время послеоперационного периода организм интенсивно теряет белки. Восполнить их недостаток помогает специальное специализированное питание Нутридринк Компакт. Стоит заметить, что белок из этого продукта усваивается значительно лучше, чем, например, из творога. Белок в специализированном Нутридринк Компакт является легкоусвояемым.
Нутридринк Компакт — полноценное и сбалансированное питание, полностью удовлетворяющее потребности организма женщины после гинекологической операции. Этот продукт богат энергией, витаминами, микроэлементами и полиненасыщенными Омега-жирными кислотами. Последние, что особенно важно, способствуют уменьшению воспалительной реакции. Кроме того, Нутридринк Компакт можно использовать как дополнительное питание при миоме и многих других гинекологических заболеваниях.
Нутридринк Компакт дает заряд энергии, которая так необходима для восстановления сил после оперативного вмешательства.
Нутридринк Компакт не только полезный, но и очень вкусный продукт. Вы можете выбрать тот вариант вкуса, который вам больше нравится: клубника, ваниль, кофе.
Все статьи
Факторы риска лимфедемы нижних конечностей после лимфодиссекции у пациентов с карциномой яичников и матки
, 1 , 1 , 1 и 2Harue Tada
1 Дизайн клинического отдела и менеджмент, Центр трансляционных исследований, Университетская больница Киото, 54 Сёгоин Кавахара-чо, Сакё-ку, Киото, 606-8507, Япония
Сатоши Терамукай
1 Отдел клинических исследований и управления, Центр трансляционных исследований, Киото Университетская больница, 54 Shogoin Kawahara-cho, Sakyo-ku, Kyoto, 606-8507, Japan
Masanori Fukushima
1 Отдел клинических исследований и управления, Центр трансляционных исследований, Университетская больница Киото, 54 Shogoin Kawahara-cho , Сакё-ку, Киото, 606-8507, Япония
Хироши Сасаки
2 Кафедра акушерства и гинекологии, Университет Дзикей Ско ol of Medicine Kashiwa Hospital, 163-1 Kashiwashita, Kashiwa, Chiba, 277-8567, Japan
1 Отдел клинических исследований и управления, Центр трансляционных исследований, Университетская больница Киото, 54 Shogoin Kawahara-cho, Sakyo-ku , Киото, 606-8507, Япония
2 Отделение акушерства и гинекологии, Медицинская школа Университета Дзикей, Больница Касива, 163-1 Кашивашита, Касива, Тиба, 277-8567, Япония
Автор для переписки.Поступило 18 августа 2008 г .; Принято 5 февраля 2009 г.
Copyright © 2009 Tada et al; лицензиат BioMed Central Ltd. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http://creativecommons.org/licenses/by/2.0), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе, при условии правильного цитирования оригинальной работы. Эта статья цитировалась в других статьях в PMC.Abstract
Предпосылки
Диссекция лимфатических узлов доказала прогностические преимущества для пациентов с карциномой яичников или матки; однако одним из осложнений, связанных с этой процедурой, является лимфедема.Мы стремились определить факторы, которые связаны с возникновением лимфедемы после лимфодиссекции для лечения рака яичников или матки.
Методы
Ретроспективно были изучены 694 пациента с гистологически подтвержденным раком яичников (135 пациентов) или раком матки (258 с раком шейки матки, 301 с раком эндометрия), которым была выполнена лимфодиссекция. Анализ логистической регрессии использовался для определения факторов риска, связанных с возникновением лимфедемы.
Результаты
Среди пациентов с раком яичников и матки, перенесших расслоение тазовых лимфатических узлов, послеоперационная лучевая терапия (отношение шансов: 1,79; 95% доверительный интервал: 1,20–2,67; p = 0,006) статистически значимо ассоциировалась с возникновением лимфедемы.
Заключение
Не было никакой связи между какой-либо хирургической процедурой и возникновением лимфедемы у пациентов, перенесших тазовую лимфаденэктомию. Наши результаты подтверждаются здравым биологическим обоснованием, поскольку они предполагают, что лимфедема конечностей вызвана расслоением тазовых лимфатических узлов.
Предпосылки
После рака груди карциномы яичников и матки являются следующими по распространенности гинекологическими злокачественными новообразованиями в Японии [1]. Благодаря недавней разработке эффективных химиотерапевтических средств и схем лечения, некоторые случаи рака яичников в настоящее время излечимы с помощью комбинации хирургического вмешательства и химиотерапии, а выживаемость пациентов продолжает улучшаться [2]. При ранней стадии рака яичников стандартным лечением является полная хирургическая стадия с последующей абдоминальной гистерэктомией и двусторонней сальпингоофорэктомией с оментэктомией и селективной лимфаденэктомией.Рак матки также потенциально излечим с помощью следующих терапевтических подходов: (i) облучение, (ii) хирургическое вмешательство и (iii) химиотерапия [1]. По мере внедрения более эффективных методов лечения, таких как расширенное хирургическое удаление и лимфодиссекция, многие пациенты с карциномой яичников или матки были излечены, а выживаемость продолжала расти [3].
Однако важным, но иногда упускаемым из виду последствием этих методов лечения является лимфедема нижних конечностей [4]. Это хроническое неизлечимое заболевание, последствия которого включают отек конечностей и чувство тяжести, стеснения и боли [5].Лимфедема может иметь психологические последствия, когда пациенты испытывают такие симптомы, как тревога, депрессия и проблемы с адаптацией [6]. Следовательно, лимфедема может влиять на профессиональную, домашнюю, социальную и сексуальную жизнь пациентов и отрицательно влиять на их качество жизни [7]. Следовательно, профилактика лимфедемы стала важной проблемой в лечении пациентов, перенесших лимфаденэктомию.
В предыдущих исследованиях были выявлены факторы риска развития лимфедемы, включая удаление тазовых лимфатических узлов [8,9] после диагностики злокачественного новообразования, которое может препятствовать оттоку лимфатической жидкости из нижних конечностей [10 ].Кроме того, недавнее исследование показало, что пациенты, у которых было удалено 10 или более регионарных лимфатических узлов во время первоначальной операции, оказались в группе более высокого риска развития новой симптоматической лимфедемы конечностей [11]. Неясно, какие хирургические процедуры повышают риск лимфедемы нижних конечностей (ЛЛН) после лимфодиссекции по поводу гинекологических злокачественных новообразований. Мы провели ретроспективное исследование для выявления факторов риска, связанных с возникновением LLL после лимфодиссекции, для лечения рака яичников или матки.
Методы
В общей сложности 694 пациента с гистологически подтвержденным диагнозом рака матки (258 пациентов с раком шейки матки и 301 с раком эндометрия) или яичниковой (135 пациентов) карциномой, лечившихся с помощью лимфодиссекции в период с января 1997 года по декабрь 1998 года, были последовательно включены в 10 японских больницы (больница медицинского факультета университета Дзикей, больница медицинского университета Саппоро, больница онкологического центра Ниигата, медицинский центр для взрослых Хёго, онкологический центр Айти, центральная больница префектуры Тояма, национальный медицинский центр Куре, онкологический центр Сикоку, университет Нагасаки, больница университета Синсю ).Лимфаденэктомия была определена как операция по удалению более двадцати лимфатических узлов. Протокол этого исследования был одобрен этическим комитетом каждого учреждения. Информированное согласие было получено от каждого пациента во время их посещения после объяснения исследования и его методов, включая сбор данных из их прошлых медицинских карт.
Пациенты, у которых был другой активный рак во время операции, и / или пациенты, которые получали лечение от отдаленных метастазов, были исключены.Также мы исключили пациентов с LLL на исходном уровне.
Был проведен ретроспективный обзор медицинских карт всех участвовавших женщин. Собранные данные включали возраст, клиническую стадию FIGO до лечения (Международная федерация гинекологии и акушерства, 1995 г.), метастатический статус, количество беременностей и родов, послеоперационная гистопатологическая классификация (Международный союз против рака, TNM Классификация злокачественных опухолей) и тазовые заболевания. статус опухоли.
Собранная информация, относящаяся к лечению, включала дату операции, проведенные оперативные процедуры, проводилась ли диссекция тазовых и парааортальных лимфатических узлов или и то, и другое, а также какие предоперационные и послеоперационные адъювантные методы лечения применялись, включая химиотерапию и лучевую терапию.Мы определили предоперационную и послеоперационную адъювантную терапию как те, которые выполняются в течение шести месяцев до или после резекционной операции, соответственно.
Мы идентифицировали пациентов с лимфедемой на основании их медицинских карт или субъективных суждений пациентов относительно отека и тяжести в ногах. LLL был идентифицирован путем тщательного изучения всех доступных записей. Исследование было сосредоточено только на «симптоматической» лимфедеме конечностей. Весьма вероятно, что у некоторых пациентов в этом исследовании была минимальная или легкая лимфедема конечностей, которую можно было бы выявить только с помощью проспективных серийных измерений окружности конечностей или объема, которые не проводились в этом ретроспективном исследовании.Женщины описали симптоматический и стойкий отек на одной или обеих нижних конечностях, который развился после лечения ее рака и не мог быть объяснен какой-либо другой причиной.
Первичной конечной точкой этого исследования было наличие LLL. Заболеваемость лимфедемой была проверена с использованием точного теста Фишера в зависимости от типа рака в отношении хирургических факторов, которые могут повлиять на начало лимфедемы (забрюшинный доступ (открытие или закрытие), оментэктомия, энтерэктомия, гистерэктомия, сальпингоофорэктомия и лимфодиссекция. ), а также другие факторы, включая характеристики пациента и историю химиотерапии и / или лучевой терапии.Логистическая регрессия использовалась для оценки взаимосвязи между лимфедемой и лучевой терапией. SAS вер. 8.2 (Институт SAS, Кэри, Северная Каролина, США). Все представленные p-значения относятся к двусторонним статистическим тестам.
Результаты
Клинические характеристики пациентов и полученное лечение приведены в таблице. Практически всем пациентам (98%) была выполнена диссекция тазовых лимфатических узлов. Более чем половине пациентов выполнена двусторонняя сальпингоофорэктомия.
Таблица 1
Краткое изложение клинических характеристик пациентов, участвовавших в этом исследовании (N = 694; все женщины)
| Клинические характеристики | Рак яичников | Рак шейки матки | Рак эндометрия | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Общее количествопациенты | 135 | 258 | 301 | ||||||||||||||||
| Возраст (лет) | Медиана | 51 | 49 | 57 | 49 | 57 | 49 | 57 | 23–80 | 19–80 | |||||||||
| Стадия FIGO (N;%) | I | 64 | (47,4) | 171 | (66,3) | 196 | (65,19) | ||||||||||||
| II | 11 | (8.2) | 76 | (29,5) | 27 | (9,0) | |||||||||||||
| III-IV | 60 | (44,4) | 11 | (4,3) | 75 ) | ||||||||||||||
| Неизвестно | — | — | — | — | 3 | (1,0) | |||||||||||||
| Хирургическая процедура (N;%) | |||||||||||||||||||
| Закрытие | 80 | (59.3) | 184 | (71,3) | 205 | (68,1) | |||||||||||||
| Открытие | 32 | (23,7) | 16 | (6,2) | 33 | ||||||||||||||
| — | 23 | (17,0) | 58 | (22,5) | 63 | (20,9) | |||||||||||||
| + | 87 | (64.4) | 0 | (0,0) | 25 | (8,3) | |||||||||||||
| — | 48 | (35,6) | 258 | (100,0) | 276 | 276 | |||||||||||||
| Энтерэктомия | |||||||||||||||||||
| + | 9 | (6,7) | 9 | (6,7) | 10) | ||||||||||||||
| — | 126 | (93,3) | 257 | (99,6) | 301 | (100,0) | Salpingo-oopho11 | ||||||||||||
| Односторонний | 18 | (13,3) | 34 | (13,2) | 38 | (12,6) | |||||||||||||
| 133 | (51,6) | 203 | (67,4) | ||||||||||||||||
| — | 9 | (6,7) | 91 | (35,3) | 19460 | ||||||||||||||
| Диссекция тазовых лимфатических узлов | |||||||||||||||||||
| + | 133 | ||||||||||||||||||
| 9015 | 98.0) | ||||||||||||||||||
| — | 2 | (1,5) | 6 | (2,3) | 6 | (2,0) | |||||||||||||
| лимфодиссекция | |||||||||||||||||||
| + | 71 | (52,6) | 28 | (10,9) | 66 | (21,9) | 9011(47.4) | 230 | (89,1) | 235 | (78,1) | ||||||||
| Гистерэктомия | |||||||||||||||||||
| Всего | 93 | ||||||||||||||||||
| (6815,9) | 112 | (37,2) | |||||||||||||||||
| Модифицированный корень | 31 | (23,0) | 18 | (7,0) | 150 | (49,8) | |||||||||||||
| (2.2) | 230 | (89,1) | 39 | (13,0) | |||||||||||||||
| — | 8 | (5,9) | 4 | (1,6) | 0 | 0 | 0 | ||||||||||||
| Химиотерапия (N;%) | Неоадъювантная химиотерапия | ||||||||||||||||||
| + | 9 6159 | 8) | 6 | (2,0) | |||||||||||||||
| — | 126 | (93,3) | 238 | (92,2) | 295 | (98,0) | |||||||||||||
| + | 111 | (82,2) | 62 | (24,0) | 119 | 119 | 119 | 24 | (17.8) | 196 | (76,0) | 182 | (60,5) | ||||||
| Лучевая терапия (N;%) | Предоперационное облучение | + | 0 | (0,0) | 6 | (2,3) | 0 | (0,0) | |||||||||||
| — | 135 | (100,0) | 7) | 301 | (100,0) | ||||||||||||||
| Послеоперационное облучение | |||||||||||||||||||
| (41,5) | 29 | (9,6) | |||||||||||||||||
| — | 134 | (99,3) | 151 | (58,5) | 272 | 90енти — восемь пациенток с раком яичников (20.7%), у 78 пациентов с раком шейки матки (30,2%) и у 83 пациентов с раком эндометрия (27,6%) развилась лимфедема без статистически значимой разницы между процентами в трех группах (p = 0,130). Среднее время от операции до возникновения LLL составляло 4,6 месяца (диапазон: 0,1-40,2 месяца) для пациентов с раком яичников, 4,2 месяца (диапазон: 0,1-50,7 месяца) для пациентов с раком шейки матки и 6,8 месяца (диапазон: 0,1-45,3 месяца). ) для больных раком эндометрия (p = 0,258). Результаты однофакторного анализа пациентов, перенесших тазовую лимфатическую диссекцию (n = 680), представлены в таблице.Послеоперационная лучевая терапия (отношение шансов (OR): 1,79; 95% доверительный интервал (ДИ): 1,20–2,68; p = 0,006) была достоверно связана с возникновением LLL. Среди пациентов, перенесших тазовую лимфаденэктомию, не было корреляции между хирургической процедурой и LLL. Расслоение парааортальных лимфатических узлов (OR: 1,34; 95% ДИ: 0,91–19,6; p = 0,158) не было фактором риска LLL. Таблица 2Взаимосвязь между факторами и лимфедемой у больных раком яичников и матки, перенесших диссекцию тазовых лимфатических узлов (одномерный анализ; N = 680)Случаи лимфедемы | Заболеваемость лимфедемой (%) | Значение p * | |||||||||||
| Тип рака | Яичников | 133 | 28 | 21,1 | |||||||||||||||
| 29,8 | |||||||||||||||||||
| Эндометриал | 295 | 82 | 27,8 | 0,175 | |||||||||||||||
| 2 | |||||||||||||||||||
| ≥ 53 лет | 338 | 92 | 27,2 | 1.000 | |||||||||||||||
| Забрюшинный доступ ** Закрытие | |||||||||||||||||||
| Открытие | 79 | 24 | 30,4 | 0,789 | |||||||||||||||
| Оментэктомия | — | 5691 | |||||||||||||||||
| + | 111 | 25 | 22,5 | 0,245 | |||||||||||||||
| Энтерэктомия | — 670114 | + | 10 | 4 | 40,0 | 0,473 | |||||||||||||
| Сальпингоофорэктомия | — | 160 | 45 28 | 3||||||||||||||||
| Односторонний | 87 | 25 | 28,7 | ||||||||||||||||
| Двусторонний | 433 | 115 | 9 9011 9011 9011 9095 | — | 12 | 4 | 33,3 | ||||||||||||
| Итого | 206 | 53 | 25.7 | ||||||||||||||||
| Модифицированный радикал | 196 | 51 | 26,0 | ||||||||||||||||
| Радикал | 266 | 77 | 266 | 77 | 266 | 77 | 9095 Неоадъювантная химиотерапия— | 645 | 173 | 26,8 | |||||||||
| + | 35 | 12 | 34.3 | 0,334 | |||||||||||||||
| Адъювантная химиотерапия | — | 393 | 111 | 28,2 | |||||||||||||||
| Послеоперационное облучение | — | 548 | 136 | 24,8 | |||||||||||||||
| + | 132 | 49 37 | 10,006 | ||||||||||||||||
| Диссекция парааортальных лимфатических узлов | — | 516 | 133 | 25,8 | |||||||||||||||
| 0,158 | |||||||||||||||||||
| Всего | 680 | 185 | 27,2 | ||||||||||||||||
Учитывая, что разные типы рака требуют разных процедур гистерэктомии, мы рак эндометрия, перенесший менее радикальную гистерэктомию, и пациенты с раком шейки матки, перенесшие более радикальную гистерэктомию.Не было выявлено статистически значимого фактора риска для пациентов с раком яичников или эндометрия, но для пациентов с раком шейки матки послеоперационная лучевая терапия была статистически значимым фактором возникновения лимфедемы (OR: 1,77; 95% ДИ: 1,03–3,06; p = 0,049).
Обсуждение
Лимфедема обычно вызывается обструкцией или нарушением работы лимфатической системы, обычно в проксимальных сегментах конечностей в лимфатических узлах, из-за инфекции, злокачественного новообразования или рубцовой ткани [12].Основными участками обструкции являются тазовая и паховая группы узлов нижних конечностей [13]. Когда лимфатическая система была повреждена хирургическим вмешательством, ее способность поглощать лишнюю воду и клетки из интерстициального пространства снижается. Если транспортная способность лимфатической системы настолько снижена, что она не может справиться с увеличением лимфатической нагрузки, произойдет недостаточность лимфатической системы [6].
В этом исследовании мы обнаружили, что пациенты с раком яичников имели более низкую заболеваемость LLL, чем пациенты с раком матки.В предыдущем исследовании аналогичные результаты были получены в отношении частоты LLL (рак яичников: 7,1%; рак матки 17,7%; рак шейки матки: 17,5%) [14].
Большинству пациентов в настоящем исследовании выполнялась диссекция тазовых лимфатических узлов. Мы обнаружили, что у пациентов с раком яичников и матки, перенесших рассечение тазовых лимфатических узлов, послеоперационная лучевая терапия была значительно связана с возникновением LLL. В настоящем исследовании было обнаружено, что послеоперационная лучевая терапия является независимым фактором риска LLL, что подтверждает результаты предыдущих исследований [3,15-17].Из всех пациентов с раком яичников в настоящем исследовании только одна пациентка получила послеоперационную лучевую терапию по сравнению со 136 пациентами с раком матки. Более низкая частота LLL у пациентов с раком яичников может быть связана с тем, что эти пациенты обычно не получают лучевую терапию после операции.
В этом исследовании мы обнаружили, что для пациентов с раком яичников и матки расслоение парааортальных лимфатических узлов не является значительным фактором риска LLL. Это открытие имеет четкое биологическое обоснование, поскольку предполагает, что LLL вызывается диссекцией тазовых лимфатических узлов.
Дизайн исследования, использованный в настоящем исследовании, имел некоторые ограничения. Во-первых, возникновение LLL оценивалось субъективно, и не было измерения тяжести симптомов или степени связанного с ними функционального нарушения. Во-вторых, мы не собрали никакой информации ни о степени поражения лимфатических узлов, ни о количестве рассеченных лимфатических узлов, хотя предыдущие исследования показали, что количество хирургически удаленных лимфатических узлов и степень метастатического поражения лимфатических узлов являются факторами риска лимфедемы. [10].Учитывая, что мы не собирали эти данные, связь между заболеваемостью LLL и этими факторами не могла быть прояснена. Однако все учреждения, которые участвовали в этом исследовании, специализировались на хирургическом лечении рака яичников и матки, и в этих учреждениях двадцать или более тазовых и парааортальных лимфатических узлов обычно удаляются во время операции гинекологами-онкологами. Таким образом, пациентов, включенных в наше исследование, можно рассматривать как прошедших максимальную лимфодиссекцию.
Хотя на данном этапе нет подходящих альтернативных хирургических процедур, доступных для снижения риска LLL, наши результаты имеют клиническое значение в отношении того, когда следует или не следует проводить диссекцию тазовых лимфатических узлов.
Важно выявлять пациентов с риском лимфедемы на ранней стадии и как можно скорее начать профилактический мониторинг и инструктаж по уходу за собой. Роль медсестры в неотложной помощи и оказании помощи женщинам с риском развития LLL по месту жительства включает обеспечение того, чтобы выписываемые женщины знали о ранних признаках и симптомах лимфедемы нижних конечностей, а также о том, как получить доступ к квалифицированным специализированным терапевтам, чтобы можно было эффективно вести раннее лечение. инициирован [18].Следующие параметры, как сообщается, полезны для раннего выявления лимфедемы: отношение фактического веса к идеальному, размеры конечностей, способность выполнять повседневную деятельность, наличие в анамнезе сопутствующих факторов и сопутствующих заболеваний (как было ранее определено для пациентов с раком груди) [18,19].
Заключение
Было обнаружено, что послеоперационное облучение является фактором риска возникновения LLL у пациентов с раком матки, перенесших диссекцию тазовых лимфатических узлов.Однако не было никакой связи между какой-либо хирургической процедурой и возникновением лимфедемы у пациентов, перенесших тазовую лимфаденэктомию. Наши результаты имеют сильное биологическое обоснование, поскольку они предполагают, что лимфедема конечностей вызвана диссекцией тазовых лимфатических узлов.
Сокращения
LLL: лимфедема нижних конечностей; ИЛИ: отношение шансов; ДИ: доверительный интервал.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Вклад авторов
HT участвовал в разработке исследования, выполнял обработку данных и статистический анализ, а также составлял рукопись. ST участвовал в разработке исследования, выполнял статистический анализ и помогал в составлении рукописи. MF участвовал в разработке исследования и помогал составить рукопись. HS участвовал в проектировании и согласовании. Все авторы прочитали и одобрили окончательную рукопись.
Благодарности
Мы хотели бы поблагодарить Рюичи Кудо (больница медицинского университета Саппоро), Сёдзи Кодама (больница онкологического центра Ниигата), Рюичиро Нишимура (Медицинский центр для взрослых Хёго), Кадзуо Кудзуя (онкологический центр Аити), Хироши Фунамото (Тояма) Центральная больница префектуры), Цунео Фудзи (Национальный медицинский центр Куре), Масамичи Хиура (онкологический центр Сикоку), Хисайоши Накадзима, Синго Морияма (Университет Нагасаки) и Кадзуко Ито (Больница Университета Синсю) в группе изучения гинекологической лимфедемы; Синго Фудзи (больница Киотского университета) за критический обзор и полезные предложения.
Ссылки
- Секретариат министерства. Статистика естественного движения населения Японии, статистика и информация. Министерство здравоохранения, труда и социального обеспечения. 2003.
- Джемал А., Мюррей Т., Уорд Е., Сэмюэлс А., Тивари Р.С., Гафур А., Фойер Е.Дж., Тун М.Дж. Статистика рака, 2005. CA Cancer J Clin. 2005; 55: 10–30. DOI: 10.3322 / canjclin.55.1.10. [PubMed] [CrossRef] [Google Scholar]
- Суассон А.П., Сопер Дж. Т., Кларк-Пирсон Д. Л., Берчук А., Монтана Дж., Кризман В. Т.. Адъювантная лучевая терапия после радикальной гистерэктомии для пациентов с раком шейки матки IB и IIA стадии.Gynecol Oncol. 1990; 37: 390–395. DOI: 10.1016 / 0090-8258 (90)-Т. [PubMed] [CrossRef] [Google Scholar]
- MacKay HT. В: Нью-Йорк Текущая медицинская диагностика и лечение. Тирни Л. М. младший, Макфи С. Т., Пападакис М. А., редактор. Макгроу Хилл, Нью-Йорк; 2004 г. Гинекология; С. 701–702. [Google Scholar]
- Ньюман М.Л., Бреннан М., Пассик С. Лимфедема, осложненная болью и психологическим стрессом: случай, требующий комплексного лечения. J Управление симптомами боли. 1996; 12: 376–379. DOI: 10.1016 / S0885-3924 (96) 00187-X.[PubMed] [CrossRef] [Google Scholar]
- Rockson SG. Лимфедема. Am J Med. 2001; 110: 288–295. DOI: 10.1016 / S0002-9343 (00) 00727-0. [PubMed] [CrossRef] [Google Scholar]
- Картер Б.Дж. Женские переживания лимфедемы. Онкол Нурс Форум. 1997; 24: 875–882. [PubMed] [Google Scholar]
- Логманс А., Крюйт Р., де Брюин Х. Г., Кокс PH, Пиллэй М., Тримбос Дж. Б. Лимфедему и лимфоцисты после лимфаденэктомии можно предотвратить с помощью оментопластики: пилотное исследование. Gynecol Oncol. 1999. 75: 323–327.DOI: 10.1006 / gyno.1999.5624. [PubMed] [CrossRef] [Google Scholar]
- Иланчеран А., Монаган Дж. М.. Лимфоциста таза; 10-летний опыт работы. Gynecol Oncol. 1988. 29: 333–336. DOI: 10.1016 / 0090-8258 (88)-6. [PubMed] [CrossRef] [Google Scholar]
- Смит Дж. У., Конвей Х. Выбор подходящих хирургических процедур лимфедема. Введение шарнирной ножки. Пласт Reconstr Surg Transplant Bull. 1962; 30: 10–31. [PubMed] [Google Scholar]
- Абу-Рустум Н.Р., Алектиар К., Ясонос А., Лев Г., Сонода Й., Агаджанян С., Чи Д.С., Баракат Р.Р.Частота симптоматической лимфедемы нижних конечностей после лечения злокачественных новообразований тела матки: 12-летний опыт работы в Мемориальном онкологическом центре Слоуна-Кеттеринга. Gynecol Oncol. 2006; 103: 714–718. DOI: 10.1016 / j.ygyno.2006.03.055. [PubMed] [CrossRef] [Google Scholar]
- Бреннан MJ. Лимфедема после хирургического лечения рака груди: обзор патофизиологии и лечения. J Управление симптомами боли. 1992. 7: 110–116. DOI: 10.1016 / 0885-3924 (92)-X. [PubMed] [CrossRef] [Google Scholar]
- Мортимер PS.Патофизиология лимфедемы. Рак. 1998. 83: 2798–2802. DOI: 10.1002 / (SICI) 1097-0142 (19981215) 83: 12B + <2798 :: AID-CNCR28> 3.0.CO; 2-E. [PubMed] [CrossRef] [Google Scholar]
- Ryan M, Stainton MC, Slaytor EK, Jaconelli C, Watts S, Mackenzie P. Этиология и распространенность лимфедемы нижних конечностей после лечения гинекологического рака. Aust N Z J Obstet Gynaecol. 2003. 43: 148–151. DOI: 10.1046 / j.0004-8666.2003.00040.x. [PubMed] [CrossRef] [Google Scholar]
- Kragt H, Bouma J, Aalders JG.Антикоагулянты и образование лимфоцитов после тазовой лимфаденэктомии при гинекологических и онкологических операциях. Surg Gynecol Obstet. 1986; 162: 361–364. [PubMed] [Google Scholar]
- Werngren-Elgstrom M, Lidman D. Лимфедема нижних конечностей после операции и лучевой терапии рака шейки матки. Scand J Plast Reconstr Hand Surg. 1994; 28: 289–293. DOI: 10.3109 / 028443194014. [PubMed] [CrossRef] [Google Scholar]
- Чатани М., Нос Т., Масаки Н., Иноуэ Т. Адъювантная лучевая терапия после радикальной гистерэктомии рака шейки матки: факторы прогноза и осложнения.Strahlenther Onkol. 1998. 174: 504–509. [PubMed] [Google Scholar]
- Пассик С.Д., МакФональд М.В. Психосоциальные аспекты лимфедемы верхних конечностей у женщин, лечившихся от рака груди. Рак. 1998. 83: 2817–2820. DOI: 10.1002 / (SICI) 1097-0142 (19981215) 83: 12B + <2817 :: AID-CNCR32> 3.0.CO; 2-2. [PubMed] [CrossRef] [Google Scholar]
- Meek AG. Лучевая терапия груди и лимфедема. Рак. 1998. 83: 2788–2797. DOI: 10.1002 / (SICI) 1097-0142 (19981215) 83: 12B + <2788 :: AID-CNCR27> 3.0.CO; 2-I.[PubMed] [CrossRef] [Google Scholar]
Частота лимфедемы нижних конечностей и образования лимфоцитов в течение одного года после операции по поводу рака эндометрия: проспективное многоцентровое исследование
Основные моменты- •
At По крайней мере, у одной из шести женщин, перенесших операцию, включая лимфаденэктомию по поводу рака эндометрия, объективно развивается LLL.
- •
Частота LLL в течение одного года после операции существенно варьируется в зависимости от метода измерения от 11% до 24%.
- •
Для измерения LLL необходим метод «золотого стандарта», который будет полезен в клиническом и научном контекстах.
- •
Лимфатический асцит является обычным явлением в раннем послеоперационном периоде, но только 7% имеют инкапсулированные лимфоцисты через год.
Реферат
Цель
Целью исследования было определить заболеваемость лимфедемой нижних конечностей (ЛЛЛ) после операции по поводу рака эндометрия (ЭК) тремя методами, а также определить частоту лимфоцист через год.
Методы
Проспективное продольное многоцентровое исследование было проведено в 14 больницах Швеции. Были включены двести тридцать пять женщин с ЭК; 116 человек перенесли операцию, включающую лимфаденэктомию (+ LA), а 119 — без лимфаденэктомии (-LA). Лимфедема оценивалась объективно четыре раза; до операции, через 4-6 недель, шесть месяцев и один год после операции с использованием систематических измерений окружностей ног, позволяющих рассчитывать объемы ног и клиническую оценку LLL, а также субъективно по восприятию пациентом лимфедемы, измеряемой по качеству лимфедемы: инструмент жизни.Лимфоцисты оценивали с помощью УЗИ влагалища.
Результаты
Через год частота LLL после увеличения объема ноги с поправкой на индекс массы тела составила 15,8% у женщин с + LA и 3,4% у женщин с –LA. Соответствующие цифры для клинической классификации составили 24,1% и 11,8%, а для воспринимаемой LLL, о которой сообщили пациенты, — 10,7% и 5,1%. Согласие между модальностями выявило справедливую или умеренную корреляцию между LLL, сообщаемую пациентом, и клинической оценкой, но плохое согласие между увеличением объема и LLL, сообщаемым пациентом, или клинической оценкой.Через год лимфоцисты были обнаружены в 4,3% случаев.
Выводы
Хотя частота LLL и лимфоцист после операции по поводу EC, включая LA, кажется относительно высокой, исследование продемонстрировало значительные различия в частоте в зависимости от метода измерения. Это подчеркивает необходимость «золотого стандарта» измерения LLL в клинической практике и исследованиях.
Ключевые слова
Рак эндометрия
Заболеваемость
Нижняя конечность
Лимфедема
Методология
Онкология
Рекомендуемые статьи Цитирующие статьи (0)
Полный текст© 2020 Elsevier Inc.Все права защищены.
Рекомендуемые статьи
Цитирующие статьи
Отдаленные результаты лимфатического венозного анастомоза после тотальной гистерэктомии для предотвращения послеоперационной лимфедемы нижней конечности | BMC Surgery
Риск лимфедемы выше при наличии нескольких факторов риска, таких как ожирение, гиподинамия и венозная недостаточность. Таким образом, профилактические подходы обычно применяются к этой группе пациентов с повышенным риском [19,20,21]. В этом исследовании мы продемонстрировали, что лимфатический анастомоз представляет собой одну из эффективных процедур предотвращения лимфедемы в нижних конечностях после тотальной гистерэктомии с лимфодиссекцией.Следует отметить, что анастомоз между лимфатическим сосудом и венулой необходимо выполнять сразу после диссекции тазовых лимфатических узлов, чтобы сохранить структуру лимфатического сосуда.
В предыдущем отчете отмечен большой разрыв в частоте лимфедемы 1,2–39,1% [6, 22]. Одна из причин этого заключается в том, что частота лимфатических отеков уменьшается за счет выхода наружных паховых лимфатических узлов [2, 6]. Кроме того, причина, по которой предметом этого исследования является только рак тела матки, заключается в том, что внешний паховый лимфатический узел является первичным регионарным, и поэтому рассечение не может быть исключено.Положение, соединяющее лимфатический сосуд и кровеносный сосуд, — это то место, где находится внешний паховый лимфатический узел. До сих пор не существовало эффективного способа снизить частоту лимфедемы в случаях, когда приходилось извлекать внешний паховый лимфатический узел. Согласно результатам Todo et al., Лимфедема нижней конечности составляла менее 26,5% при оставлении наружного пахового лимфатического узла [2, 6, 22]. В нашей процедуре количество нежелательных явлений, превышающих степень 2, составило 6,5% (1/16), что почти сопоставимо с отчетом Abu-Rustum [23].Таким образом, наша процедура анастомоза полезна, когда нам нужно удалить лимфатические узлы на нижней конечности. Мы произвели анастомоз в области наружных паховых лимфатических узлов по двум причинам. Во-первых, повреждение или разрыв шва может не произойти, когда пациент двигает ногами после операции, потому что нагрузка на анастомотическую часть не прикладывается. Во-вторых, расслоение наружных паховых лимфатических узлов может вызвать тяжелую лимфедему [2, 6].
Сообщалось о нескольких факторах риска послеоперационной лимфедемы нижних конечностей [1, 2].Например, адъювантная лучевая терапия увеличивала частоту лимфедемы ног после тазовой лимфаденэктомии [24, 25]. Однако в нашем исследовании ни один из пациентов не проходил лучевую терапию, и поэтому оно остается менее убедительным. В качестве альтернативы, широкий спектр лимфаденэктомии может быть ответственным за увеличение риска лимфедемы нижних конечностей. Необходимо обсудить, должна ли диссекция лимфатических узлов при тотальной гистерэктомии распространяться даже на парааортальную область в дополнение к области таза.
Предполагается, что прямой лимфатический анастомоз с последующей гистерэктомией и лимфаденэктомией эффективен для предотвращения послеоперационной лимфедемы.Такой подход не только снижает риск лимфедемы, но и снижает риск лимфоцеле [26, 27]. Однако потенциальная проблема, которую мы осознали во время операции, заключается в том, что результаты операции в значительной степени зависят от каждого хирурга, использующего микроскоп. Поскольку микрохирургия является типичным подходом, ориентированным на технику, на то, чтобы стать квалифицированным врачом, может потребоваться много времени. Действительно, мы видели, что у каждого пластического хирурга была своя микрохирургическая техника. С этой точки зрения лимфатический анастомоз с использованием хирургической системы да Винчи (Intuitive Surgical, Inc., CA) может быть разумным и осуществимым средством решения. Стабильные движения манипуляторов в системе da Vinci позволяют хирургу работать с улучшенным зрением, точностью и контролем при лимфатико-венозном анастомозе. В нашем учреждении этот подход в качестве передового лечения был одобрен Министерством здравоохранения, труда и социального обеспечения Японии и продолжается. Результат этого клинического испытания будет опубликован в другом месте.
Ведение симптоматической лимфоцисты таза после радикальной тазовой или тазовой и парааортальной лимфаденэктомии по поводу рака шейки матки и эндометрия | Гинекологический кабинет
Двадцать три из 226 (10.2%) у пациентов диагностирована симптоматическая лимфоциста малого таза. Кроме того, у двух из 23 пациентов была лимфедема, у двух пациентов была лимфоцистная инфекция, у одного пациента был тромбоз глубоких вен, вызванный лимфоцистой 20 см, и у одного пациента был стеноз мочеточника, вызванный лимфоцистой 20 см.
Мы проанализировали, были ли определенные факторы риска связаны с возникновением лимфоцист или лимфоцист-ассоциированных осложнений после тазовой и парааортальной лимфаденэктомии, сравнивая различные факторы у пациентов с осложнениями и без них.Анализируемыми факторами риска были средний возраст, рост, вес, индекс массы тела (ИМТ), количество рассеченных лимфатических узлов, тип гистерэктомии, количество забрюшинного дренажа и послеоперационное облучение таза.
Средний возраст, рост, вес и индекс массы тела (ИМТ) были сходными у пациентов с симптоматической лимфоцистой и у пациентов без лимфоцист или связанных с лимфоцистами осложнений.
Пятнадцать пациентов с симптоматической лимфоцистой имели рак эндометрия; 11 из них подверглись только тазовой лимфаденэктомии, а четырем из них — тазовой и парааортальной лимфаденэктомии.Стадия TNM была 1b G2 n = 11, 1b G3 n = 3, 1c n = 1. Всем этим пациенткам была выполнена лапароскопическая вагинальная гистерэктомия.
У восьми пациентов с симптоматической лимфоцистой был рак шейки матки; Всем им была выполнена только тазовая лимфаденэктомия. Стадия TNM: 1a2 n = 1, 1b1 n = 4, 1b2 n = 3. Один пациент перенес трахелэктомию; остальным семи пациенткам была выполнена радикальная вагинальная гистерэктомия с помощью лапароскопии Piver II.
Гистологический диагноз, среднее количество удаленных лимфатических узлов, среднее количество пациентов с положительными узлами, среднее число положительных узлов и число пациентов с метастатическими парааортальными узлами существенно не различались между пациентами; Тип гистерэктомии и послеоперационное облучение не были связаны с высокой значимостью симптоматических лимфоцист или лимфоцист-ассоциированных осложнений по сравнению с пациентами без симптоматических лимфоцист или лимфоцист-ассоциированных осложнений.
У трех пациентов лимфоциста была диагностирована непосредственно (через 2 недели) после операции. У пяти пациентов лимфоциста была диагностирована в первые два послеоперационных месяца во время лучевой терапии; у 12 пациентов лимфоциста диагностировалась в среднем через 8 месяцев, а у трех пациентов — в среднем через 13 месяцев после операции. У семи пациентов лимфоциста располагалась в левом тазу, а у 16 - в правом тазу. У девяти пациентов размер был менее 10 см; у восьми пациентов размер составлял 10–20 см; а у шести пациентов — более 20 см.
Лапароскопическая резекция лимфоцисты и дренирование прошли успешно у 22 пациентов. У одного пациента через 6 месяцев после операции потребовалась повторная лапароскопия из-за рецидива лимфоцисты.
У двух пациентов была лихорадка и высокий показатель инфекции крови. У обоих пациентов показатели температуры и инфекций крови нормализовались после резекции лимфоцисты и назначения антибактериальной терапии в течение 14 дней.
Клиническая лимфедема наблюдалась у двух пациентов. У двух пациентов лимфоциста и лимфедема были на одной стороне.После резекции лимфоцисты лимфедема исчезла у обоих пациентов.
У одного пациента с окклюзией мочеточника, вызванной лимфоцистой размером 20 см, состояние полностью нормализовалось после резекции лимфоцисты.
У одного пациента на 14-й день после операции развился хилезный асцит, который потребовал повторной лапароскопии с идентификацией цистерны хили и коагуляции.
У всех 226 пациентов лимфоцисты в парааортальной области не обнаружены.
Радикальная гистерэктомия с тазовой лимфаденэктомией: показания, методика и осложнения
Радикальная гистерэктомия с тазовой лимфаденэктомией остается методом выбора для женщин со стадиями IA 2 и IB 1 карцинома шейки матки II и некоторых пациентов рак эндометрия.Улучшение хирургической техники, назначение профилактических антибиотиков, профилактика тромбоэмолий и достижения в области интенсивной терапии привели к снижению операционной заболеваемости, связанной с этой процедурой. Серьезные осложнения со стороны мочевыводящих путей, такие как повреждение мочеточника или пузырно-влагалищный свищ, сейчас крайне редки (1%). Пятилетняя выживаемость после этой процедуры варьируется в зависимости от ряда клинических и гистологических переменных и может достигать 90% у женщин без метастазов в лимфатические узлы.
1. Введение
Число пациентов с раком шейки матки на ранней стадии неуклонно растет благодаря широкому использованию теста Папаниколау для скрининга. По оценкам, в 2009 году в Соединенных Штатах будет 11 070 новых случаев рака шейки матки и почти 500 000 новых случаев во всем мире. Ожидается, что примерно 85% впервые диагностированного рака шейки матки в промышленно развитых странах имеют локализованное или региональное заболевание [1, 2]. В связи с тенденцией к раннему выявлению у большего числа пациентов с инвазивным раком шейки матки диагностируется ранняя стадия заболевания, и они являются кандидатами на первичное хирургическое лечение с радикальной гистерэктомией и тазовой лимфаденэктомией.
В 1898 году Эрнст Вертхайм из Вены описал операцию радикальной гистерэктомии, включающую удаление параметрия и тазовых лимфатических узлов. В 1905 году Вертхайм сообщил об исходах первых 270 пациентов, пролеченных радикальной гистерэктомией, которые включали коэффициент операционной смертности 18% и уровень основной заболеваемости 31%. С тех пор радикальная гистерэктомия с тазовой лимфаденэктомией с модификациями хирургической техники выполнялась как основное хирургическое лечение ранней стадии инвазивного рака шейки матки [3, 4].Использование профилактических антибиотиков, профилактика тромбоэмболии, введение препаратов крови и достижения в послеоперационной медицине и медицине интенсивной терапии снизили операционную заболеваемость и увеличили выживаемость пациентов с раком шейки матки, которым была проведена эта операция.
2. Показания
Первичным показанием к радикальной гистерэктомии с тазовой лимфаденэктомией является инвазивный рак шейки матки I. Ранний инвазивный рак шейки матки разделен Международной федерацией гинекологии и акушерства (FIGO) на стадию IA 1 , которая включает поражения, проникающие в строму шейки матки на глубину 3 мм или меньше и максимальное горизонтальное распространение 7 мм. и Стадия IA 2 , которая включает поражения со стромальной инвазией 3-5 мм и максимальным горизонтальным распространением 7 мм [5].Эти диагнозы могут быть поставлены только после тщательной гистологической оценки образца конизации с помощью окулярного микрометра для определения глубины стромальной инвазии. Пациенты со стадией IB 1 рака шейки матки имеют микроскопические доказательства инвазии стромы 5 мм, горизонтального распространения 7 мм или клинически видимого поражения шейки матки диаметром 4,0 см. Пациентам с раком шейки матки стадии IA 1 по классификации FIGO и отсутствием признаков инвазии лимфатических сосудов (LVSI) целесообразна консервативная терапия с конизацией шейки матки или простой гистерэктомией [6–11].Однако пациенты со стадией IA 2 или IB 1 рака шейки матки имеют значительный риск распространения лимфатических узлов и нуждаются в лечении радикальной гистерэктомией и тазовой лимфаденэктомией. Пациенты с раком шейки матки стадии IB 2 или стадией IIA лечатся химиолучевой или комбинированной терапией во многих учреждениях. Однако отдельных пациентов с раком шейки матки стадии IB 2 или IIA можно лечить с помощью радикальной гистерэктомии и тазовой лимфаденэктомии [12–14].
Радикальная гистерэктомия также может рассматриваться при лечении рецидивирующего рака шейки матки. Эта процедура подходит только для пациентов с небольшими центральными рецидивами после первичного облучения на ранней стадии заболевания. Maneo и его коллеги, например, сообщили, что радикальная гистерэктомия является безопасной альтернативой экзентерации таза у пациентов с раком шейки матки стадии IB / IIA, получавших первичную лучевую терапию, у которых наблюдается рецидив диаметром 4 см без признаков обструкции мочеточника или поражения параметрия [15 ].
Наконец, радикальная гистерэктомия с тазовой лимфаденэктомией показана пациентам с раком эндометрия и эндоцервикальным поражением (стадия II болезни FIGO). Бенте проанализировал клинические, хирургические и гистопатологические данные 202 пациентов с аденокарциномой эндометрия и поражением шейки матки и сообщил о преимуществе выживаемости для пациентов, получавших радикальную гистерэктомию с тазовой лимфаденэктомией, по сравнению с тотальной абдоминальной гистерэктомией. Это преимущество было наиболее заметно у пациентов с множественными факторами высокого риска [16].Радикальная гистерэктомия с тазовой лимфаденэктомией может быть терапевтической у отдельных пациентов с раком эндометрия II стадии, что позволяет избежать осложнений, связанных с комбинированной терапией [17].
3. Предоперационное обследование
Перед проведением радикальной гистерэктомии пациенты должны пройти тщательное обследование, чтобы убедиться в отсутствии серьезных медицинских противопоказаний к операции. Анестезиолог должен знать о возможности кровопотери у пациентов, подвергающихся этой процедуре, и должен подготовиться к доступу к центральным венам, а также к наличию должным образом типизированной и сопоставимой крови.Профилактический антибиотик, обычно цефалоспорин первого поколения, вводится в течение 30 минут после разреза кожи [18]. Гепарин 5000 ЕД вводят подкожно перед операцией и трижды в день в послеоперационном периоде для профилактики тромбоэмболии. Кроме того, устройства последовательной компрессии (SCD) помещаются на обе нижние конечности непосредственно перед операцией и остаются на месте до тех пор, пока пациент не будет ходить [19].
4. Хирургическая техника
(1) Пациентку помещают в положение лежа на спине и готовят брюшную полость и влагалище.Катетер Фолея помещается в мочевой пузырь пациента, а SCD помещаются на обе нижние конечности. (2) Вертикальный разрез по средней линии делается на 3 см выше пупка и продолжается ниже до лонного симфиза. Устанавливается ретрактор Bookwalter, и используются прямоугольные ретракторы или ретракторы стенок тела для втягивания боковых стенок таза. (3) Перед началом операции на тазе вся брюшная полость оценивается на предмет наличия метастазов. Это включает все поверхности печени и диафрагмы, чревное сплетение, сальник, поверхности тонкой и толстой кишки, а также брыжейку.Тазовые и парааортальные лимфатические узлы пальпируются, любые увеличенные или подозрительные узлы иссекаются и отправляются на гистологическое исследование. (4) Кишечник уплотняется в верхней части живота с помощью теплых влажных губок для лапаротомии. Два 8-дюймовых зажима Келли помещаются на рог матки для ретракции. (5) Правая круглая связка зажимается, разрезается и перевязывается на правой боковой стенке таза (рис. 1). Передний листок правой широкой связки надрезают снизу вдоль боковой стенки таза на расстояние примерно 3 см.(6) Задний лист правой широкой связки надрезан вверх по боковой стенке таза до уровня воронко-лоханочной связки (Рисунок 2). (7) Если правый яичник должен быть сохранен, задний лист правой широкой связки связка дополнительно рассекается параллельно и ниже воронко-лоханочной и маточно-яичниковой связок. Затем правая маточно-яичниковая связка зажимается, разрезается и перевязывается, и яичник помещается в правую подвздошную ямку (Рисунок 3). (8) Если правый яичник должен быть иссечен, правая воронко-лоханочная связка зажимается, разрезается. , и дважды лигировали на боковой стенке таза.Затем правая маточно-яичниковая связка зажимается, разрезается и накладывается шов, а правая трубка и яичник удаляются. (9) Затем шаги (5) — (8) повторяются с левой стороны. (10) Правое забрюшинное пространство пространство вводится вдоль боковой стенки таза, тем самым обнажая общую подвздошную, внешнюю подвздошную и внутреннюю подвздошные артерии и связанную ткань лимфатических узлов. (11) Мочеточник идентифицируется, и два шелковых шва накладываются на прилегающую медиальную брюшину, тем самым натягивая мочеточник кнутри от подвздошных сосудов (рис. 4).(12) Диссекцию лимфатических узлов начинают с резкого иссечения всей лимфатической узловой ткани, окружающей правую общую подвздошную, внешнюю подвздошную и внутреннюю подвздошные артерии. Боковая протяженность тазовых лимфатических узлов определяется бедренно-бедренным нервом (рис. 5). Наружные подвздошные и общие подвздошные артерии втягиваются латерально, а ткань лимфатических узлов, окружающая общую подвздошную, внешнюю подвздошную и внутреннюю подвздошные вены, удаляется резким рассечением. Ткань лимфатических узлов каждого из основных анатомических участков (т.е.е., общая подвздошная, наружная подвздошная, внутренняя подвздошная) помещается в отдельные контейнеры и отправляется на гистологический анализ. (13) Идентифицируется передний отдел внутренней подвздошной артерии, и маточная артерия изолирована, лигируется шелком 2-0 связи, и рассечены. Верхняя пузырная артерия сохраняется (рис. 6). (14) Ретрактор вены помещается на медиальной стороне внешней подвздошной артерии и вены, и определяется запирательный нерв. Всю ткань лимфатических узлов удаляют из запирательной ямки резким рассечением (рис. 7), помещают в отдельный контейнер и отправляют на гистологический анализ.(15) Шаги (10) — (14) повторяются с левой стороны. (16) Правое параректальное пространство и паравезикальное пространство определяются тупым рассечением, а латеральная сторона кардинальной связки, содержащей сосудистую перепонку, зажимается, разрезается и лигировали шелковыми завязками 2-0 (рис. 8 и 9). Перевязка левой сосудистой сети выполняется таким же образом. (17) Правый мочеточник отделяется от медиальной брюшины на уровне маточно-крестцовой связки (Рисунок 10), и вокруг мочеточника помещается дренаж Пенроуза диаметром 3/8 дюйма. (Рисунок 11).Мочеточник отсекают латерально от параметриального канала с помощью зажимов под прямым углом (рис. 12). Сосудистая сеть параметрия перевязывается, и мочеточник выкатывается латерально из туннеля. Правый мочеточник отделяется от окружающих тканей до входа в мочевой пузырь (рис. 13). Затем таким же образом отделяют левый мочеточник от левого параметрия. (18) Мочевой пузырь резко отделяется от переднего отдела влагалища и разрезается брюшина между маткой и прямой кишкой.Передняя стенка прямой кишки отражается от задней стенки влагалища. (19) Матка приподнята, а маточно-крестцовые связки зажаты, перерезаны и перевязаны (рис. 14). Передние, задние и боковые прикрепления матки и параметрия перевязаны. Паравагинальная ткань на нижнем крае рассечения зажимается, разрезается и перевязывается с помощью изогнутых зажимов Lainz (Рисунок 15). (20) Влагалище рассекается примерно на 3 см ниже шейки матки, и изолированные участки кровотечения на влагалищной манжете перевязывают с помощью лигатуры. Викриловый шов 2-0.Влагалище закрывают непрерывным блокирующим швом из викрила 0 (Рисунок 16). (21) Закрытые отсасывающие дренажи могут быть размещены в обоих забрюшинных пространствах по усмотрению хирурга. Эти дренажи выводятся через переднюю брюшную стенку в каждом нижнем квадранте и подшиваются к коже шелковой нитью 2-0. (22) Если яичники остаются, их подвешивают к боковой стенке таза с помощью пролена 2-0, и титановые зажимы помещают на место шва для будущей идентификации. (23) Затем брюшную полость закрывают слоями, используя непрерывную 0-петлевую PDS по модифицированной технике Смида-Джонса.
1. Дисфункция мочевого пузыря и образование лимфоцитов являются одними из наиболее частых осложнений радикальной гистерэктомии и, по последним сообщениям, встречаются в 5–15% случаев.Дисфункция мочевого пузыря возникает в результате обширного рассечения мочеточников у основания мочевого пузыря и перерезки маточно-крестцовых связок, что прерывает снабжение мочевого пузыря вегетативными нервами. В целом, более радикальное рассечение приводит к более высокой частоте дисфункции мочевого пузыря. Однако сохранение верхней пузырной артерии и кровоснабжения дистального отдела мочеточника привело к значительному снижению частоты пузырно-влагалищных и уретеровагинальных свищей после радикальной гистерэктомии.
