Плазмаферез дискретный: ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ ЗДРАВООХРАНЕНИЯ ТВЕРСКОЙ ОБЛАСТИ «ОБЛАСТНАЯ КЛИНИЧЕСКАЯ БОЛЬНИЦА»
Дискретный плазмаферез при ишемической болезни сердца
Все экстракорпоральные методы лечения, используемые при атеросклерозе и ишемической болезни сердца (ИБС), направлены на элиминацию крупномолекулярных соединений. В последние годы предпочтение отдается селективным методам экстракорпоральной терапии (ЭКТ), позволяющим удалять из крови атерогенные фракции холестерина (ХС) [1].
Между тем методом экстракорпорального воздействия, эффективно элиминирующим крупномолекулярные структуры, является плазмаферез (ПАФ). Вопрос о целесообразности его применения при атеросклеротических окклюзиях сосудов различного диаметра является спорным. Специалисты, использующие в терапии атеросклероза методы реофереза, решают эту проблему однозначно отрицательно [2, 3]. Между тем нельзя полностью отрицать эффективность обменного ПАФ при наследственных гиперлипидемиях, доказанную G. Thompson [4, 5], а также однозначно положительные результаты исследований, выполненных в нашей стране [6-8].
Целью настоящего исследования явилось обоснование целесообразности и эффективности дискретного ПАФ в комплексе лечебных мероприятий при ИБС.
Материалы и методы
Представлен опыт лечения 91 больного (82 мужчин и 9 женщин) в возрасте 30-80 (58±4) лет (табл. 1) с клиническими проявлениями стенокардии напряжения и покоя III-IV функционального класса у 77, из них с нестабильной и прогрессирующей стенокардией — у 11. Острый инфаркт миокарда перенесли 82 (90%) пациента из 91. Из сопутствующих заболеваний отмечены гипертоническая болезнь 2-й степени у 65 (72%) больных, ожирение II-II степени — у 45 (50%), сахарный диабет — у 12 (13%). У 30 пациентов наблюдались резистентные к медикаментозной терапии нарушения ритма сердца — пароксизмальная мерцательная аритмия (у 24), желудочковая и наджелудочковая экстрасистолия.
Курс ЭКТ состоял из 3-7 сеансов дискретного ПАФ с удалением 1,5-4,0 л плазмы (60-110% объема циркулирующей плазмы — ОЦП) и замещением коллоидными и кристаллоидными растворами в соотношении 2:1. Использовали коллоидные заменители плазмы из группы гидроксиэтилкрахмалов в 6% концентрации — инфукол и волювен.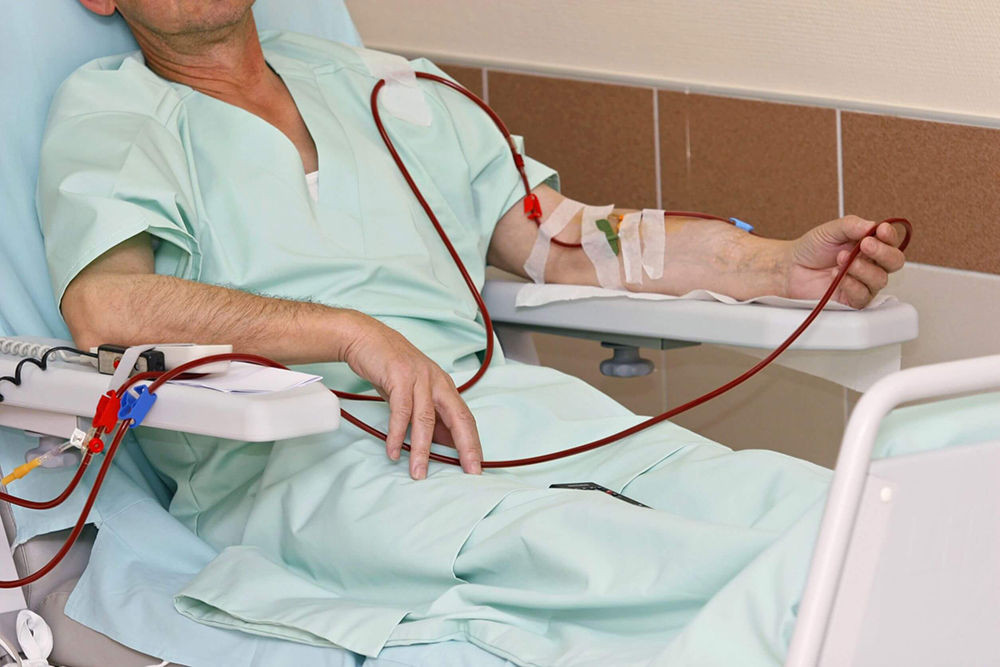
Эффективность ПАФ оценивали на основании динамики клинической картины и лабораторных показателей, выполненных по принятым в Центре методикам.
Статистическую обработку полученных данных проводили методами параметрической статистики с помощью программы Biostat. Достоверность различия признаков оценивали по критерию Стьюдента. Различия считали достоверными при р≤0,05.
Результаты
На фоне стандартной базисной медикаментозной терапии проведение курса процедур ПАФ у больных со стенокардией привело к существенному сокращению приема нитроглицерина. В 4 случаях число таблеток нитроглицерина уменьшилось с 15-20 до 4-5. У 10 из 11 больных с нестабильной стенокардией удалось добиться стабилизации процесса.
Уровень систолического и диастолического артериального давления в начале курса составлял соответственно 127±14 и 78±6 мм рт.ст., после курса ЭК лечения 115±12 и 71±9 мм рт. ст., т.е. снизился на 10% от исходного.
ст., т.е. снизился на 10% от исходного.
Из 30 больных с нарушениями ритма, резистентными к медикаментозной терапии, курс ПАФ был эффективен у 19 (63,3%) [9]. По данным суточного холтеровского мониторирования электрокардиограммы отмечено уменьшение числа желудочковых экстрасистол на 97%, наджелудочковых — на 82,5%. У 15 пациентов с пароксизмальной мерцательной аритмией отмечено урежение пароксизмов, укорочение их длительности, более легкая переносимость и купируемость. Продолжительность эффекта составила от 0,5 до 16 мес. У 7 пациентов отмечено полное отсутствие пароксизмов на протяжении от 1 до 5 мес.
У 7 пациентов без клинических проявлений стенокардии после аортокоронарного шунтирования (АКШ) на фоне процедур ПАФ отмечено отсутствие рецидива заболевания в течение 3-12 лет после операции; 7 больных после рентгенэндоваскулярной дилатации коронарных артерий наблюдались в течение 6 мес — 2 лет также без рецидива заболевания. У 9 пациентов с рецидивом стенокардии, не подлежащих повторному хирургическому лечению, после ПАФ удалось подобрать адекватную медикаментозную терапию, частично восстановить трудоспособность.
Влияние ПАФ на лабораторные показатели. По содержанию фракций ХС в крови до начала лечения 55 (60%) больных отнесены к группе риска, 27 (30%) из них — к группе повышенного риска. Средний уровень ОХС составлял 5,9±0,3 ммоль/л. Дислипидемия, определяемая по величине коэффициента атерогенности (средний показатель — 4,02±0,05), наблюдалась у 85% (77) больных.
Оценка динамики липидного состава крови проведена после 70 курсов ПАФ у 58 больных. Средний уровень ОХС снизился с 5,9±0,3 до 4,5±0,25 ммоль/л, что составило 75,5% от исходного уровня (р<0,01) (табл. 2).
Концентрация ТГ к концу курса ПАФ изменялась на 10% (р>0,05). Если больному предстояло АКШ, то для получения аутоплазмы без видимых признаков хилеза объем замещения плазмы увеличивали до 120% ОЦП и в ходе операции использовали последние две порции плазмы.
Уровень ХС ЛПНП после ПАФ снижался на 36% (р<0,01), т.е. практически до нормы. ХС ЛПВП снижался на 15% (р>0,05).
КА, определяемый по соотношению фракций ХС ЛПНП и ХС ЛПВП, снижался на 18%. Корригирующий эффект ПАФ наблюдался у 70% больных с дислипидемией и ИБС. Оценивая полученные результаты по всей группе пролеченных больных, мы получили достоверное снижение только уровня ОХС и ХС ЛПНП (см. табл. 2). Удаление 60-80% ОЦП, рекомендуемое некоторыми авторами [7], при использовании дискретного метода достоверного результата не дало ни по одному из рассмотренных показателей. Достоверное улучшение параметров липидного состава крови наблюдали только после элиминации 100% расчетного ОЦП.
При проведении 60 курсов ПАФ изучали динамику показателей гемокоагуляции. Для сравнения аналогичные показатели изучали у 25 здоровых доноров. Основным показателем гемокоагуляции считали фибриноген, концентрация которого является одним из биохимических маркеров риска у больных ИБС [10], так как во многом определяет общую и плазменную вязкость крови.
У всех обследованных больных наблюдали активацию тромбоцитарного и плазменного звеньев гемостаза (табл.
Активность АТIII была на 25% ниже, чем у здоровых доноров. Снижение фибринолитической активности крови отмечено у 60% больных.
После сеансов ПАФ выявлено снижение концентрации фибриногена на 18%, в то время как добиться изолированного снижения его уровня с помощью только медикаментозных средств не представляется возможным. Отмечено достоверное снижение содержания ПДФ на 22% и активности ХIII фактора на 17%. При этом содержание в крови антитромбина III не менялось.
После удаления 1 ОЦП содержание общего белка достоверно (р<0,01) снижалось за счет крупнодисперсных фракций (циркулирующие иммунные комплексы — ЦИК, циркулирующие антитела, факторы свертывания и др.
Изучено содержание токсинов средней молекулярной массы в сыворотке крови 25 больных с клинической картиной стенокардии до и после сеансов ПАФ. Исходное содержание молекул средней молекулярной массы (СММ) составляло 0,36±0,01 ед., что в 1,5 раза превышало допустимые значения (0,24 ед.). После курса лечения содержание молекул токсинов СММ составляло 0,23±0,09 ед. (р<0,01). Нормализация уровня молекул СММ, очевидно, способствовала разблокированию клеточных рецепторов и, таким образом, повышению чувствительности к используемым лекарственным препаратам, что частично объясняется действие ПАФ при состояниях, рефрактерных к медикаментозной терапии.
Учитывая важную роль процессов перекисного окисления липидов (ПОЛ) в развитии патологических изменений в организме, в том числе атерогенеза, у 25 пациентов с клиническими проявлениями стенокардии изучены уровень малонового диальдегида (МДА) и интенсивность хемилюминесценции (ИХЛ) до и после сеансов ПАФ. Оба показателя, характеризующие интенсивность процессов ПОЛ, исходно имели тенденцию к росту и недостоверно (р=0,034) снижались после курса лечения. Концентрация МДА колебалась от 2,2 до 3,3 (2,6±0,02) нмоль/л до ПАФ и от 2,07 до 2,9 (2,3±0,01) нмоль/л после лечения, т.е. содержание МДА снижалось на 17%. ИХЛ исходно колебался от 40 до 59 (46±3) мв/с, после процедур ПАФ — от 35 до 55 (43±3) мв/с (р>0,1). Коэффициент хемилюминесценции изменялся недостоверно (р>0,1) и составил 0,29±0,06 и 0,28±0,05 с – после лечения.
Оба показателя, характеризующие интенсивность процессов ПОЛ, исходно имели тенденцию к росту и недостоверно (р=0,034) снижались после курса лечения. Концентрация МДА колебалась от 2,2 до 3,3 (2,6±0,02) нмоль/л до ПАФ и от 2,07 до 2,9 (2,3±0,01) нмоль/л после лечения, т.е. содержание МДА снижалось на 17%. ИХЛ исходно колебался от 40 до 59 (46±3) мв/с, после процедур ПАФ — от 35 до 55 (43±3) мв/с (р>0,1). Коэффициент хемилюминесценции изменялся недостоверно (р>0,1) и составил 0,29±0,06 и 0,28±0,05 с – после лечения.
Состояние реологических параметров крови пациентов с ИБС влияет на многие функциональные показатели: скорость кровотока, сосудистое сопротивление, производительность работы сердца. Исходно гематокрит больных колебался от 41 до 52% (44,1±0,5%) после ПАФ он составил 41,0±0,3% (р<0,05). Динамика вязкости цельной крови (ВЦК) под влиянием ПАФ изучена при скоростях сдвига 200 и 50 с– . При скорости сдвига 200 с– ВЦК до ПАФ составила 4,4±0,2 мПа·с, после лечения она достоверно снизилась до 3,65±0,3 мПа·с (р<0,05). При скорости сдвига 50 с– ВЦК изменялась от 5,5±0,3 до 3,9±0,3 мПа·с (р<0,05). Положительные сдвиги реологических параметров крови связаны с удалением фибриногена и других грубодисперсных структур (глобулиновых фракций белка, липопротеидов, ЦИК и т.д.)
При скорости сдвига 50 с– ВЦК изменялась от 5,5±0,3 до 3,9±0,3 мПа·с (р<0,05). Положительные сдвиги реологических параметров крови связаны с удалением фибриногена и других грубодисперсных структур (глобулиновых фракций белка, липопротеидов, ЦИК и т.д.)
Положительные эффекты в лабораторных анализах, достигнутые после курса ПАФ, сохранялись в течение 3 мес, затем постепенно возвращались к исходному уровню.
Обсуждение
Существует мнение, что риск развития атеросклероза и нарушений кровообращения растет с увеличением концентрации ХС в крови свыше 5,2 ммоль/л [11]. Снижение уровня ХС замедляет прогрессирование атеросклероза в коронарных артериях [7]. Высокие стабильные результаты получены у больных с семейной гиперхолестеринемией при использовании селективных методов элиминации ХС ЛПНП [12-15].
Помимо атерогенных фракций ХС в патогенезе атерогенеза и стенокардии задействовано более 30 гуморальных факторов различной природы и свойств [16-21]. Среди них тканевый фактор и его ингибитор, фибринопептид А, тканевый активатор фибриногена и его ингибитор, комплекс плазмин-антиплазмин, ПДФ и фибриногена, эндотелин, ангиотензинпревращающий фермент, брадикинин, антифосфолипидные антитела, интерлейкины 1, 2, 6, 8 и др. Основными механизмами атерогенеза являются гиперкоагуляция в коронарных артериях, дефицит факторов фибринолиза, активация тромбоцитов, повреждение интимы коронарных сосудов, дисфункция эндотелиальных клеток, снижение продукции NO. Активация всех факторов атерогенеза происходит в острой фазе заболевания. Очевидно, что ПАФ, элиминирующий многие патогенные вещества, оказывает выраженный клинический эффект у пациентов с нестабильной и стенокардией.
Среди них тканевый фактор и его ингибитор, фибринопептид А, тканевый активатор фибриногена и его ингибитор, комплекс плазмин-антиплазмин, ПДФ и фибриногена, эндотелин, ангиотензинпревращающий фермент, брадикинин, антифосфолипидные антитела, интерлейкины 1, 2, 6, 8 и др. Основными механизмами атерогенеза являются гиперкоагуляция в коронарных артериях, дефицит факторов фибринолиза, активация тромбоцитов, повреждение интимы коронарных сосудов, дисфункция эндотелиальных клеток, снижение продукции NO. Активация всех факторов атерогенеза происходит в острой фазе заболевания. Очевидно, что ПАФ, элиминирующий многие патогенные вещества, оказывает выраженный клинический эффект у пациентов с нестабильной и стенокардией.
Не исключена вероятность развития атеросклероза и ИБС у лиц с формально нормальным или низким уровнем ОХС [22]. Отсутствие у отдельных пациентов повышенного уровня ХС (40% наблюдений), нормальная величина КА свидетельствуют о наличии и других механизмов коронарного синдрома, в частности о преобладании в спектре частиц ЛПНП мелких, легко окисляющихся форм или о повышении уровня липопротеида(а). Спорным остается утверждение о роли инфекционных факторов в развитии и дестабилизации атеросклеротической бляшки в коронарных артериях. В патогенезе развития атеросклеротических поражений сосудов не исключается роль хронического воспаления, которое индуцируется и поддерживается разнообразными инфекционными агентами. По современным представлениям, локальное (в атеросклеротической бляшке) и системное воспаление играет важную роль в развитии атеросклероза и его осложнений [23-25].
Спорным остается утверждение о роли инфекционных факторов в развитии и дестабилизации атеросклеротической бляшки в коронарных артериях. В патогенезе развития атеросклеротических поражений сосудов не исключается роль хронического воспаления, которое индуцируется и поддерживается разнообразными инфекционными агентами. По современным представлениям, локальное (в атеросклеротической бляшке) и системное воспаление играет важную роль в развитии атеросклероза и его осложнений [23-25].
Таким образом, при ведущей роли атерогенных фракций ХС, в механизме атерогенеза задействованы вещества с различной молекулярной массой — низко, средне-, крупномолекулярные. В основном это факторы гемокоагуляции и системного воспалительного ответа. Многофакторность процессов, участвующих в атерогенезе, дает основание рассматривать атеросклероз как полиэтиологичное заболевание и подчеркивает патогенетическую обоснованность ПАФ как метода выбора экстракорпоральной гемокоррекции.
Исследование показало, что дискретный малообъемный ПАФ, выполняемый курсами, как и высокообъемный, воздействует практически на все звенья гомеостаза. При удалении за курс лечения не менее 1 ОЦП достоверно снижает количество циркулирующего ХС, хотя, по данным литературы, это почти не влияет на его тканевые запасы [3]. При этом ПАФ оказывает позитивное воздействие на другие звенья гомеостаза, задействованные в патогенезе и клинических проявлениях атеросклеротических расстройств — гемореологию и микроциркуляцию.
При удалении за курс лечения не менее 1 ОЦП достоверно снижает количество циркулирующего ХС, хотя, по данным литературы, это почти не влияет на его тканевые запасы [3]. При этом ПАФ оказывает позитивное воздействие на другие звенья гомеостаза, задействованные в патогенезе и клинических проявлениях атеросклеротических расстройств — гемореологию и микроциркуляцию.
В процессе атерогенеза важен также дисбаланс между факторами свертывания и фибринолиза, как количественный, так и функциональный, поэтому нормализующее влияние на параметры гемокоагуляции однозначно имеет существенное значение. Кроме того, процесс атерогенеза напрямую связан с антифосфолипидным синдромом, общепринятым эффективным методом лечения которого является плазмаферез [26, 27].
Заключение
ПАФ является патогенетически обоснованным и эффективным методом коррекции гомеостаза у пациентов с ИБС. Он может быть также рекомендован и в комплексе хирургического лечения этого заболевания:
— при нарушениях липидного обмена, гиперкоагуляции и гипервязкости трудно поддающихся медикаментозной коррекции;
— в курсе подготовки к оперативному вмешательству при выраженной триглицеридемии для получения аутоплазмы без признаков видимого хилеза;
— для профилактики рецидива стенокардии после АКШ и эндоваскулярных вмешательств;
— при поражении дистального коронарного русла;
— при неэффективности медикаментозной терапии или наличии сопутствующих заболеваний, резистентных к медикаментозной терапии (артериальная гипертония и/или нарушения ритма сердца).
Весьма важно, что дискретный ПА позволяет преимущественно элиминировать те биохимические вещества и метаболиты, исходное содержание которых в крови было повышено, и не оказывает негативного воздействия на концентрацию веществ, содержание которых изначально было нормальным или пониженным (ХС ЛПВП, антитромбин III, альбумин).
Что такое плазмаферез? Опасен ли плазмаферез, противопоказания, как делается
Еще десять лет назад плазмаферез считался исключительно медицинской процедурой и назначался только при определенных заболеваниях. Сегодня его предлагают на каждом углу и называют «чисткой крови». С помощью плазмафереза нас обещают омолодить, избавить от «шлаков» и, вообще, «очистить на глубоком клеточном уровне».
Для чего, на самом деле, нужен плазмаферез? Насколько эта процедура универсальна? Насколько безопасна? На эти другие вопросы отвечает Кузьмин Юрий Александрович, врач-анестезиолог высшей квалификационной категории, специалист по плазмаферезу.
Заблуждение 1. Плазмаферез – это чистка крови от шлаков
К нам часто звонят с вопросом: «Вы чистите кровь?». Я в таких случаях отвечаю: «Я не занимаюсь очисткой крови, я делаю медицинскую процедуру – плазмаферез». Это, во-первых. Во-вторых, понятия «шлаки» в медицине не существует. И чистить от них кровь, как минимум странно.
Что же такое плазмаферез?
Эта методика основана на фильтрации плазмы (жидкой части крови пациента) через специальную мембрану. Мембрана имеет определенный калибр отверстий, и слишком большие белковые молекулы, которые содержат на себе токсические вещества или воспалительные элементы, остаются в фильтре.
Их можно увидеть?
Да. При каждой процедуре я показываю пациенту фильтр «до» (девственно белый) и «после», чтобы реально увидеть то, что на нем осело.
Заблуждение 2. Плазмаферез простейшая процедура, которую можно делать даже в обеденный перерыв
Юрий Александрович, расскажите, пожалуйста, как проводят плазмаферез.
Для проведения плазмафереза используется специальный аппарат – я работаю на Гемос-ПФ. Он является базовым аппаратом МЧС для оказания помощи при чрезвычайных ситуациях.
Пациент ложится на кушетку, в вену на его руке врач устанавливает пластиковый катетер, через который будет осуществляться забор крови.
Задействуется только одна вена?
Существуют разные методики: в каких-то задействуется одна вена, в каких-то – две, допустим, периферическая и центральная. Методика мембранного плазмафереза, которую провожу я, задействует только одну вену. Как говорят медики – это минимальная инвазия.
Катетер поставлен – что дальше?
Дальше кровь пациента «прогоняется» через аппарат.
Вся?
Возвращается то количество крови, которое забирается. У каждого человека свой объем крови. Поэтому количество крови, которое «прогоняется» за один сеанс, для каждого пациента врач рассчитывает индивидуально с учетом клинического анализа крови, массы тела и роста. Существует компьютерная программа для такого расчета.
Существует компьютерная программа для такого расчета.
Сколько по времени длится процедура?
Около часа. В течение этого времени идет мониторирование состояния пациента: измеряется артериальное давление, частота дыхания, пульс и насыщение крови кислородом. То есть пациент находится не только под контролем врача, но и под контролем аппаратуры.
Плазмаферез можно делать амбулаторно?
Да.
Прямо в обеденный перерыв?
Плазмаферез не настолько простая процедура, чтобы проводить ее в обеденный перерыв. Это не укол: укололи — и пошел. Люди по разному переносят плазмаферез, поэтому есть определенный период времени после процедуры (от получаса до часа), в течение которого я наблюдаю за состоянием пациента. Если все показатели стабильны – человек может идти домой.
Заблуждение 3. Плазмаферез опасен
Давайте поговорим про безопасность плазмафереза, а то сейчас пошли страшилки-пугалки, что от этого люди умирают…
Синдром Турчинского, так его назвали журналисты.
Да!
Наверное, я вас разочарую – плазмаферез тут ни при чем. Владимир Турчинский умер совсем от другого. У него были гормональные проблемы, которые привели к тромбозу и инфаркту. Скажу больше, плазмаферез является профилактикой тромбоза и инфаркта, поскольку в ходе процедуры удаляется «густая» часть плазмы, в результате кровь разжижается, кровообращение становится гораздо лучше.
То есть синдром Турчинского…
— это миф.
И все-таки давайте остановимся на безопасности плазмафереза.
-
Во-первых, при проведении этой процедуры используются одноразовые медицинские инструменты. Я при каждом пациенте раскрываю одноразовый комплект и показываю, что это все конкретно для него.
-
Во-вторых, еще раз заострю ваше внимание на том, что плазмаферез – это не конвейер, когда врач подключил аппарат и ушел. Я постоянно общаюсь с пациентом во время процедуры и после, контролирую его самочувствие.
 Поскольку у меня стаж работы в реанимации больше тридцати лет, я серьезно подхожу к таким вещам.
Поскольку у меня стаж работы в реанимации больше тридцати лет, я серьезно подхожу к таким вещам.
-
В-третьих, плазмаферез не вызывает никаких неприятных ощущений, потому что весь процесс идет в физиологическом режиме работы сердца. В систолу определенный объем крови изгоняется из сердца, в диастолу идет расслабление — кровь возвращается. При плазмаферезе сохраняются все характеристики нормального кровотока.
-
В-четвертых, в ходе процедуры не применяются никакие медикаменты, только физиологический раствор для промывания магистралей, по которым протекает кровь, чтобы она не сворачивалась. Более того, если пациент «перекормлен» гормональными лекарствами, то они включаются в белковые комплексы плазмы и тоже оседают на фильтре. То есть мы убираем лишние гормоны, которые пациент применял в ходе лечения.
При плазмаферезе используется донорская плазма? Многие этого боятся.
Нет. Мембранный плазмаферез, который делаем мы в Скандинавской центре здоровья, не подразумевает использования донорской плазмы. Видимо, вы имеете в виду каскадный плазмаферез, при котором забирается от 400 до 800 мл плазмы и замещается кровезаменителями. Эту методику я не использую.
У мембранного плазмафереза есть противопоказания?
Абсолютное противопоказание — язвенная болезнь желудка с кровотечением. Нестабильность системы свертывания крови является относительным противопоказанием. Кроме того, я не буду настаивать на проведении плазмафереза пациенту, у которого слабо развита периферическая венозная сеть.
Вену сложно найти?
Да, по этой причине.
Заблуждение 4. Плазмаферез универсален, он помогает от всех болезней
Сейчас в сети много рекламных объявлений, в которых говорится, что плазмаферез необходим всем жителям мегаполиса, что он помогает бороться с отрицательным влиянием на организм стресса и плохой экологии. А еще с его помощью можно омолодиться. Это так?
А еще с его помощью можно омолодиться. Это так?
Вы шутите? Плазмаферез – медицинская процедура, которая дополняет основное лечение заболевания. Назначить ее может только врач, если для этого есть показания. Делать плазмаферез всем подряд бессмысленно.
В каких случаях врач может назначить плазмаферез?
Его назначают в качестве дополнительного метода при некоторых заболеваниях в тех случаях, когда основное лечение было малоэффективным.
Юрий Александрович, а можно конкретнее? При каких, например, кожных заболеваниях рекомендуется плазмаферез?
При неэффективности медикаментозной терапии плазмаферез применяется при аллергических дерматитах, фурункулезе, псориазе и т.п.
Любые кожные заболевания – это проблема не одного дня. Эффект от лечения наступает не сразу. Чаще всего в терапии кожных заболеваний переходят от простых методов – имеются в виду мази, препараты – к более сложным. Одним из следующих этапов при неэффективности «таблеточной» терапии является плазмаферез – способ, когда непосредственно из крови удаляются факторы, вызывающие проявления болезни.
Одним из следующих этапов при неэффективности «таблеточной» терапии является плазмаферез – способ, когда непосредственно из крови удаляются факторы, вызывающие проявления болезни.
Сколько нужно сеансов, чтобы состояние кожи улучшилось? Одного достаточно?
Количество процедур, которое потребуется пациенту, врач рассчитывает индивидуально в зависимости от болезни, ее длительности, общего самочувствия. По статистическим данным, которыми я располагаю, при кожных заболеваниях в среднем необходимо от 5 до 7 процедур. Хотя при аллергических дерматитах эффект бывает заметен уже после 1-2 сеансов.
Давайте представим такую ситуацию: человек прочитал статью про плазмаферез, решил, что он ему необходим, и пришел к вам.
Сначала я пообщаюсь с пациентом – для этого и существует первичная консультация врача, проводящего плазмаферез, выясняю, что у него за заболевание, как он лечился, почему не было положительного эффекта.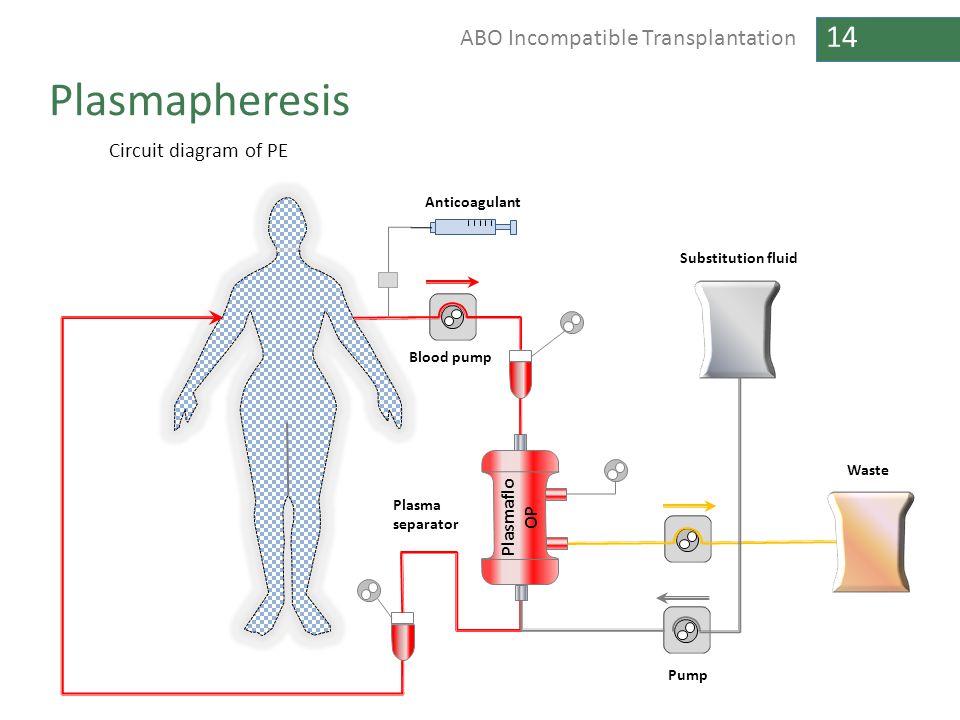 Затем мы вместе распланируем тактику дальнейших действий: либо стоит начать с обычного лечения у дерматолога, либо, если возможности медикаментозного лечения исчерпаны и дерматолог рекомендует, делать плазмаферез.
Затем мы вместе распланируем тактику дальнейших действий: либо стоит начать с обычного лечения у дерматолога, либо, если возможности медикаментозного лечения исчерпаны и дерматолог рекомендует, делать плазмаферез.
А если человек пришел к вам не лечиться, а «почиститься» и помолодеть?
Плазмаферез – не волшебство, а «чистая» кровь – не показатель здоровья. Я считаю, что для того чтобы хорошо себя чувствовать нужен не плазмаферез, а здоровый образ жизни
Плазмаферез
ПлазмаферезРазмер шрифта Цветовая схема Изображения
ГАУЗ «КРАЕВОЙ КЛИНИЧЕСКИЙ ЦЕНТР
СПЕЦИАЛИЗИРОВАННЫХ ВИДОВ МЕДИЦИНСКОЙ ПОМОЩИ»
Единый телефон регистратуры
8 (423) 240-66-69 и 89910699217
Плазмаферез — это современный, безопасный, безболезненный и атравматичный способ очищения крови.
Плазмаферез — это разделение крови с последующим удалением жидкой фракции- плазмы с накопившимися шлаками, возвратом клеточных элементов и возмещением, удаленного объема, плазмозаменителями. Он включается в комплекс лечения при неэффективности общепринятой терапии заболеваний, вызванных нарушениями иммунитета, обмена веществ, интоксикацией.
Вследствие нарушения кровообращения, повышения концентрации в крови токсинов (шлаков), антител и иммунных комплексов возникает «блокада» естественных систем «очищения» и защиты: печени, почек, легких, системы иммунитета. Токсические вещества попадают в лимфатическую систему, в кровеносное русло и в большом количестве циркулируют в крови (в плазме). Далее они откладываются в тканях, вызывая повреждение органов. Плазмаферез позволяет остановить этот процесс. Шлаки удаляются сначала из крови, затем из тканей (дренирующий эффект). При возмещении удаленной плазмы достигается разведение крови. Уменьшается застой в капиллярах (мелких сосудах), усиливается поступление жидкости из тканей, что способствует улучшению кровообращения и тканевого дыхания во всех органах.
Лечебное действие плазмафереза включает иммуностимулирующий, противовоспалительный, детоксицирующий эффекты за счет:
- удаления циркулирующих иммунных комплексов, уменьшения концентрации антигенов, антител;
- удаления микробов, токсинов, конечных продуктов обмена веществ (шлаков) с плазмой;
- удаления факторов воспаления — простагландинов, тромбоксанов, лимфокинов;
- удаления прокоагулянтов, криоглобулинов – веществ, повышающих свертываемость крови;
- восстановления чувствительности клеточных рецепторов к гормонам, лекарствам – снижение дозы принимаемых лекарств для достижения нужного эффекта,
- нормализации микроциркуляции и реологии крови и восстановления нарушенного обмена веществ.
В нашем кабинете плазмаферез выполняется двумя основными методами:
- Дискретный (ручной) плазмаферез проводится с помощью центрфуги и стерильных одноразовых пластиковых контейнеров с консервантом.
 Производится забор крови, контейнеры центрифугируются, затем плазма удаляется, а клетки крови после разведения физ. раствором возвращаются пациенту. Параллельно вливаются, возмещающие объем удаленной плазмы, солевые растворы. При необходимости вводятся лекарства. Всего за один сеанс плазмафереза удаляется 300-600 мл плазмы. Это наиболее доступный метод, длительность 1 сеанса – 2-2,5 часа.
Производится забор крови, контейнеры центрифугируются, затем плазма удаляется, а клетки крови после разведения физ. раствором возвращаются пациенту. Параллельно вливаются, возмещающие объем удаленной плазмы, солевые растворы. При необходимости вводятся лекарства. Всего за один сеанс плазмафереза удаляется 300-600 мл плазмы. Это наиболее доступный метод, длительность 1 сеанса – 2-2,5 часа. - Автоматический(аппаратный) метод основан на разделении непрерывного потока забираемой крови в сепараторе аппарата Hаemonetics PCS-2 (USA) в сочетании с автоматической подачей антикоагулянта, автоотбором плазмы и возвратом в венозное русло клеток. Аппаратный плазмаферез наиболее комфортен для пациента и имеет свои преимущества:
- небольшой объем заполнения системы для крови
- непрерывный цикл взятия, разделения крови и возвращения клеток
- минимальная травматизация клеток крови
- удобство в эксплуатации, значительная быстрота.

Оба метода осуществляются по одноигольной методике (пункция одной периферической вены) с использованием расходных систем только однократного применения.
Эффект плазмафереза проявляется уже после первого сеанса. Значительно снижается концентрация патологических продуктов, однако, уже через несколько часов содержание их в крови приближается к исходному уровню. Это говорит о том что в сосудистое русло поступили вещества, находившиеся до того во внеклеточном межтканевом пространстве, или в клетках. Последующие сеансы плазмафереза способствуют удалению и этих веществ, что приводит к более полноценной санации всей внутренней среды, учитывая, что основная часть вредных продуктов находится во вне сосудистых пространствах. Для стойкого положительного эффекта необходимо 3-6 сеансов, с удалением в общей сложности 1-1,5 объемов циркулирующей плазмы. Удаляемая плазма достаточно эффективно возмещается солевыми растворами. Таким образом, включение плазмафереза в комплекс лечебных мероприятий способствует более благоприятному течению заболеваний, особенно трудно поддающихся медикаментозной терапии, добиться значительного улучшения состояния пациентов и уменьшить им лекарственную нагрузку.
Таким образом, включение плазмафереза в комплекс лечебных мероприятий способствует более благоприятному течению заболеваний, особенно трудно поддающихся медикаментозной терапии, добиться значительного улучшения состояния пациентов и уменьшить им лекарственную нагрузку.
ПОКАЗАНИЯ
- Аллергические и аутоиммунные заболевания: бронхиальная астма, ревматоидный артрит, системная красная волчанка, склеродермия, дерматомиозит, аутоиммунный тириоидит (зоб Хашимото), поллинозы, отек Квинке, острая крапивница, бактериальный эндокардит, гломерулонефрит и другие.
- Болезни кожи: экзема, псориаз, нейродермит, атопический дерматит, фурункулез, угревая болезнь
- Неврологические заболевания: миастения, в т.ч. миастенические кризы – приступы мышечной слабости, рассеянный склероз в начальной стадии, боковой амиотрофический склероз, синдром Гийена-Барре (демиелинизирующая воспалительная полинейропатия), особенно в острой, начальной стадии, синдром хронической усталости.

- Сердечно-сосудистые заболевания: ишемическая болезнь сердца, гипертоническая болезнь, атеросклероз сосудов нижних конечностей, мозга, повышенный уровень холестерина (в т.ч. семейная гиперхолестеринемия), синдром повышенной вязкости крови, болезни сосудов (облитерирующий эндартериит, тромбоангиит, узелковый артериит, геморрагический васкулит)
- Заболевания печени: токсический гепатит, гепатоз, цирроз печени, НЕинфекционные желтухи, болезнь Жильбера
- Болезни обмена веществ: сахарный диабет, подагра, порфирия, болезнь Вильсона, гемохроматоз
- Акушерскогинекологические заболевания: хронические инфекции передающиеся половым путем(хламидиоз, уреаплазмоз и т.д.), хронические воспалительные заболевания придатков матки, бесплодие, невынашивание беременности, токсикозы (гестозы) беременных, наследственная тромбофилия, АФС-синдром, аутосинсибилизация к ХГЧ, профилактика резус- конфликтной беременности, климактерический синдром.
- Урологические заболевания: хронический простатит, хр.
 пиелонефрит, хроническая почечная недостаточность, половые расстройства у мужчин.
пиелонефрит, хроническая почечная недостаточность, половые расстройства у мужчин. - Болезни крови: тромбоцитопеническая пурпура, криоглобулинемия, миеломная болезнь, макроглобулинемия Вальденстрема, аутоиммунная гемолитическая анемия
- Токсикологические состояния: снятие токсических проявлений при различных отравлениях, в том числе наркотической и алкогольной интоксикации.
ПРОТИВОПОКАЗАНИЯ
- Кровотечения (язвы, опухоли желудочно-кишечного тракта, легких, мочеполовой системы и т.д.).
- Острая стадия инфекционных и гнойно-воспалительных процессов
- Гипертермия.
- Артериальная гипотония, шок (АД<90 ммрс).
- Истощение, общий белок крови <55 г/л
- Анемия (Нb<90г/л
Последние новости
ВСЕМИРНЫЙ ДЕНЬ БЕЗОПАСНОСТИ ПАЦИЕНТОВ — 17 СЕНТЯБРЯ
30.06.2022 — День борьбы со Сколиозом
Врачи Приморья удалили гигантскую кисту у девочки-подростка
Горячая линия
Круглосуточная горячая линия по вопросам доступности
и качества бесплатной медицинской помощи.
Терапевтический плазмообмен | Терапевтический аферез
UT Southwestern предлагает терапевтический плазмообмен для пациентов в районе Даллас-Форт-Уэрт и за его пределами.
Наша команда стремится предоставлять высококачественный уход в безопасной и комфортной обстановке.
Эффективное удаление и лечение плазмы крови
Терапевтический плазмообмен (ТПО), также известный как плазмаферез, удаляет и заменяет плазму крови пациента для лечения определенных заболеваний.
UT Southwestern является признанным лидером в области афереза, предлагая как стационарные, так и амбулаторные услуги семь дней в неделю. Наша преданная команда врачей, поставщиков передовых практик, дипломированных медсестер и сертифицированных специалистов по аферезу обеспечивает самый передовой уход и поддерживает миссию нашего учреждения по обеспечению высочайшего уровня качества, безопасности и обслуживания.
Состояния, которые мы лечим с помощью терапевтического плазмафереза
ТПЭ используется для лечения различных аутоиммунных заболеваний, состояний, при которых организм распознает часть себя как чужеродную и вырабатывает белки (называемые аутоантителами), которые атакуют часть тела. Эти белки находятся в плазменном компоненте крови.
Эти белки находятся в плазменном компоненте крови.
Целью ТПО является удаление большого количества болезнетворных агентов, таких как эти антитела, которые атакуют организм и вызывают симптомы.
Заболевания, которые мы лечим с помощью ТПО, включают:
- Тромботическую тромбоцитопеническую пурпуру : редкое заболевание крови, вызывающее образование тромбов по всему телу тела
- Острая воспалительная демиелинизирующая полинейропатия (синдром Гийена-Барре) : Редкое заболевание, при котором иммунная система организма атакует нервы
- Опосредованный антителами быстро прогрессирующий гломерулонефрит : синдром, характеризующийся прогрессирующей потерей функции почек Трансплантация Отторжение твердых органов (почек, сердца, легких)
- Синдром гипервязкости : Состояние, при котором кровь не может свободно течь по артериям
- Рецидивирующий фокально-сегментарный гломерулосклероз : Состояние, которое может возникнуть после трансплантации почки и может привести к терминальной стадии почечной недостаточности
- Рассеянный склероз : Распространенное заболевание центральной нервной системы : Иммунологическое заболевание, которое может поражать головной и спинной мозг
- Криоглобулинемия : Присутствие аномальных белков в крови, которое влияет на приток крови к органам
- Аутоиммунный энцефалит : Заболевание, при котором иммунная система организма атакует мозг
- Аутоиммунная невропатия : Состояние, при котором иммунная система организма атакует части нервов вызывающее ригидность мышц
- Другие редкие заболевания
Терапевтический плазмообмен: чего ожидать
Во время этой терапии небольшое количество крови постепенно удаляется через вставленную иглу или катетер центральной линии и циркулирует через аппарат, который разделяет кровь на эритроциты, лейкоциты, тромбоциты и плазму.
Часть плазмы крови удаляется и заменяется заменителем плазмы, а затем снова добавляется к клеткам (эритроцитам, лейкоцитам и тромбоцитам) и, наконец, возвращается через внутривенный или центральный венозный катетер. Удаленную плазму выбрасывают.
Одна процедура обычно удаляет от 65% до 70% болезнетворных белков (антител) в плазме. Как правило, для достижения клинического улучшения требуется несколько процедур.
Плазмаферез — безопасная процедура с несколькими возможными побочными эффектами.
Перед ТПО
Перед процедурой мы рекомендуем пациентам пить большое количество негазированных безалкогольных напитков в течение нескольких дней. Мы также рекомендуем поесть перед запланированной процедурой.
Во время TPE
Если будут установлены внутривенные катетеры (IV), руки пациентов будут опираться на подушки, и их попросят сжать кулак, чтобы улучшить кровоток. Пациенты могут испытывать синяки или дискомфорт в местах размещения капельниц. Если вместо этого используется более крупный катетер или порт, пациенты могут свободно пользоваться руками во время процедуры.
Если вместо этого используется более крупный катетер или порт, пациенты могут свободно пользоваться руками во время процедуры.
Процедура обычно длится от двух до трех часов, но может быть короче или длиннее в зависимости от множества факторов.
После начала процедуры пациенты могут испытывать легкое онемение, покалывание, головокружение или тошноту. Сотрудник афереза, который специализируется на этой процедуре, будет находиться с пациентом в течение всего лечения. Пациенты должны сообщать медсестре о любых побочных эффектах или симптомах, которые они ощущают.
После ТПО
После завершения процедуры пациенты могут ощущать усталость до конца дня. Мы рекомендуем пить много жидкости после процедуры. Мы также рекомендуем, чтобы члены семьи или друзья подвезли пациентов домой.
Как направить пациента на аферез
Наша амбулаторная программа предлагает простой процесс направления пациентов из Техаса и соседних штатов. Наша команда поможет с оформлением страховки и координацией ухода.
В рамках лечения мы регулярно проводим обследование периферических вен, чтобы избежать доступа к центральным венам. Кроме того, наши врачи, занимающиеся аферезом, всегда готовы проконсультироваться и сотрудничать с лечащим врачом для разработки плана лечения.
Пожалуйста, обращайтесь в нашу клинику афереза по телефону 214-633-3190 с понедельника по пятницу с 8:00 до 17:00.
Терапевтический плазмаферез очищает циркулирующие растворимые PD-L1 и PD-L1-положительные внеклеточные везикулы
Текст статьи
Меню статьи
- Статья
Текст - Артикул
информация - Цитата
Инструменты - Поделиться
- Быстрое реагирование
- Артикул
метрика - Оповещения
Клиническая/трансляционная иммунотерапия рака
Оригинальное исследование
Терапевтический плазмаферез очищает циркулирующие растворимые PD-L1 и PD-L1-положительные внеклеточные везикулы
- Фабрис Люсьен-Маттеони3,
- Хизер Дейл4,
- Эдвин Бургсталер4,
- Susan M Harrington3,
- Matthew K Ball4,
- Aaron S Mansfield1,
- Sean S Park5,
- Mathew S Block1,
- Svetomir N Markovic1,
- Yiyi Yan1,
- Haidong Dong3,
- Roxana S Дронка6 и
- Джеффри Л.
 Уинтерс4
Уинтерс4
- 1 Отделение медицинской онкологии, клиника Майо, Рочестер, Миннесота, США
- 2 Отделение акушерства и гинекологии, клиника Майо, Рочестер, Миннесота, США
- 3 Отделение урологии, клиника Майо, Рочестер, Миннесота, США
- 4 Отделение лабораторной медицины и патологии, клиника Майо, Рочестер, Миннесота, США
- 5 Отделение радиационной онкологии, клиника Майо, Рочестер, Миннесота, США
- 6 Отделение гематологии и онкологии, клиника Майо, Флорида, Джексонвилл, Флорида, США
- Связь с доктор Джейкоб Дж. Орм; orme.jacob{at}mayo.edu
Реферат
История вопроса Трансактивный лиганд запрограммированной смерти 1 (PD-L1) происходит из злокачественных клеток в трех известных формах. Высокие уровни секретируемого сплайс-варианта PD-L1 (sPD-L1), ADAM10/ADAM17-shed sPD-L1 и PD-L1-позитивных внеклеточных везикул (evPD-L1) предсказывают плохой прогноз и ограниченный ответ на PD-(L) Ингибиторы контрольной точки 1 при раке. Насколько нам известно, ни одно клиническое вмешательство не уменьшило ни одну из этих циркулирующих форм внеклеточного PD-L1. Здесь мы исследуем терапевтический плазмаферез (ТПО) в качестве лечения для снижения циркулирующего внеклеточного PD-L1.
Высокие уровни секретируемого сплайс-варианта PD-L1 (sPD-L1), ADAM10/ADAM17-shed sPD-L1 и PD-L1-позитивных внеклеточных везикул (evPD-L1) предсказывают плохой прогноз и ограниченный ответ на PD-(L) Ингибиторы контрольной точки 1 при раке. Насколько нам известно, ни одно клиническое вмешательство не уменьшило ни одну из этих циркулирующих форм внеклеточного PD-L1. Здесь мы исследуем терапевтический плазмаферез (ТПО) в качестве лечения для снижения циркулирующего внеклеточного PD-L1.
Результаты У пациентов с меланомой уровни sPD-L1 выше 0,277 нг/мл предсказывали худшую общую выживаемость. У пациентов, перенесших ТПО по доброкачественным показаниям, каждый сеанс ТПО удалял в среднем 70,8% sPD-L1 и 73,1% evPD-L1, обнаруживаемых в плазме. TPE также уменьшал общее количество и ADAM10-положительные внеклеточные везикулы.
Заключение Здесь мы сообщаем о первом известном клиническом вмешательстве по удалению либо sPD-L1, либо evPD-L1 из плазмы in vivo. TPE снижает sPD-L1 и evPD-L1 в плазме in vivo и может играть роль в лечении иммунотерапией. TPE также может оказаться полезным у пациентов с другими состояниями, связанными с внеклеточными везикулами.
TPE снижает sPD-L1 и evPD-L1 в плазме in vivo и может играть роль в лечении иммунотерапией. TPE также может оказаться полезным у пациентов с другими состояниями, связанными с внеклеточными везикулами.
- иммунотерапия
- запрограммированная гибель клеток 1 рецептор
- рецепторы, иммунологические
- трансляционное медицинское исследование
- побег опухоли
http://creativecommons.org/licenses/by-nc/4 получить доступ к статье, распространяемой в соответствии с некоммерческой лицензией Creative Commons Attribution (CC BY-NC 4.0), которая позволяет другим распространять, ремикшировать, адаптировать, строить на основе этой работы в некоммерческих целях и лицензировать свои производные работы на других условиях, при условии, что оригинальная работа правильно цитируется, указывается соответствующий адрес, указываются любые внесенные изменения, а использование является некоммерческим. См. http://creativecommons. org/licenses/by-nc/4.0/.
org/licenses/by-nc/4.0/.
http://dx.doi.org/10.1136/jitc-2020-001113
Статистика с сайта Altmetric.com
Запрос разрешений
направит вас к службе RightsLink Центра защиты авторских прав. Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.
- иммунотерапия
- программируемая гибель клеток 1 рецептор
- рецепторы, иммунологические
- трансляционное медицинское исследование
- побег опухоли
Введение
Преодоление начальной или приобретенной резистентности к ингибиторам контрольных точек иммунного лиганда 1 (PD-(L)1) является основной областью неудовлетворенной потребности при многих видах рака.1 Хотя полный спектр механизмов резистентности к этим методам лечения еще предстоит определить, различные формы внеклеточного PD-L1 опухоли были связаны с резистентностью в многочисленных клинических исследованиях.
Злокачественные клетки продуцируют транс-действующий внеклеточный PD-L1 в трех различных формах. Во-первых, опухолевые клетки транскрибируют и секретируют растворимые сплайс-варианты PD-L1 (sPD-L1). Во-вторых, ферменты ADAM10 и ADAM17 сбрасывают эктодомен sPD-L1 непосредственно с поверхности опухолевых клеток. 6, 7 Обе формы sPD-L1 несут известную гомодимеризацию. домены и могут быть обнаружены с помощью ELISA. sPD-L1 может превосходить ингибиторы PD-(L)1, убивать CD8+ Т-клетки и ограничивать способность здоровых мононуклеарных клеток периферической крови убивать опухолевые клетки in vitro. ПД-Л1.8 9PD-L1-положительные EV (evPD-L1) проявляют сходные свойства с sPD-L1 в системном кровотоке.9 Каждый тип транс-действующего внеклеточного PD-L1 коррелирует с плохой выживаемостью в многочисленных клинических испытаниях (дополнительная онлайн-таблица 1). Хотя было показано, что фармакологические ингибиторы широкого спектра действия и генетические манипуляции снижают высвобождение этих форм PD-L1 в культуре или на животных моделях, ни один из них не подходит для клинического использования.
Во-первых, опухолевые клетки транскрибируют и секретируют растворимые сплайс-варианты PD-L1 (sPD-L1). Во-вторых, ферменты ADAM10 и ADAM17 сбрасывают эктодомен sPD-L1 непосредственно с поверхности опухолевых клеток. 6, 7 Обе формы sPD-L1 несут известную гомодимеризацию. домены и могут быть обнаружены с помощью ELISA. sPD-L1 может превосходить ингибиторы PD-(L)1, убивать CD8+ Т-клетки и ограничивать способность здоровых мононуклеарных клеток периферической крови убивать опухолевые клетки in vitro. ПД-Л1.8 9PD-L1-положительные EV (evPD-L1) проявляют сходные свойства с sPD-L1 в системном кровотоке.9 Каждый тип транс-действующего внеклеточного PD-L1 коррелирует с плохой выживаемостью в многочисленных клинических испытаниях (дополнительная онлайн-таблица 1). Хотя было показано, что фармакологические ингибиторы широкого спектра действия и генетические манипуляции снижают высвобождение этих форм PD-L1 в культуре или на животных моделях, ни один из них не подходит для клинического использования. На сегодняшний день мы не знаем ни о каком клиническом вмешательстве, которое безопасно и надежно устраняло бы любую из этих форм иммунодепрессивного системного внеклеточного PD-L1.
На сегодняшний день мы не знаем ни о каком клиническом вмешательстве, которое безопасно и надежно устраняло бы любую из этих форм иммунодепрессивного системного внеклеточного PD-L1.
Терапевтический плазмаферез (ТПЭ) представляет собой процедуру, при которой кровь пропускают через аппарат для афереза, отделяющий плазму от клеточных компонентов. Удаленную плазму удаляют и заменяют либо коллоидом (например, альбумином), либо кристаллоидами и коллоидными растворами. В отличие от диализа, при котором небольшие ионы удаляются путем диффузии, ТФЭ удаляет ограниченные в плазме вещества, такие как антитела, размер которых слишком велик для быстрой диффузии. В среднем каждый сеанс ТПО удаляет приблизительно 65–70% крупных неклеточных внутрисосудистых компонентов, ограниченных плазмой.10
Неизвестно, являются ли sPD-L1 (примерно 35 кДа) или PD-L1-положительные EV (50–500 нм) ограниченными в плазме, не диффундирующими и несвязанными. Если это так, мы предположили, что TPE может эффективно удалять эти вещества из крови пациентов.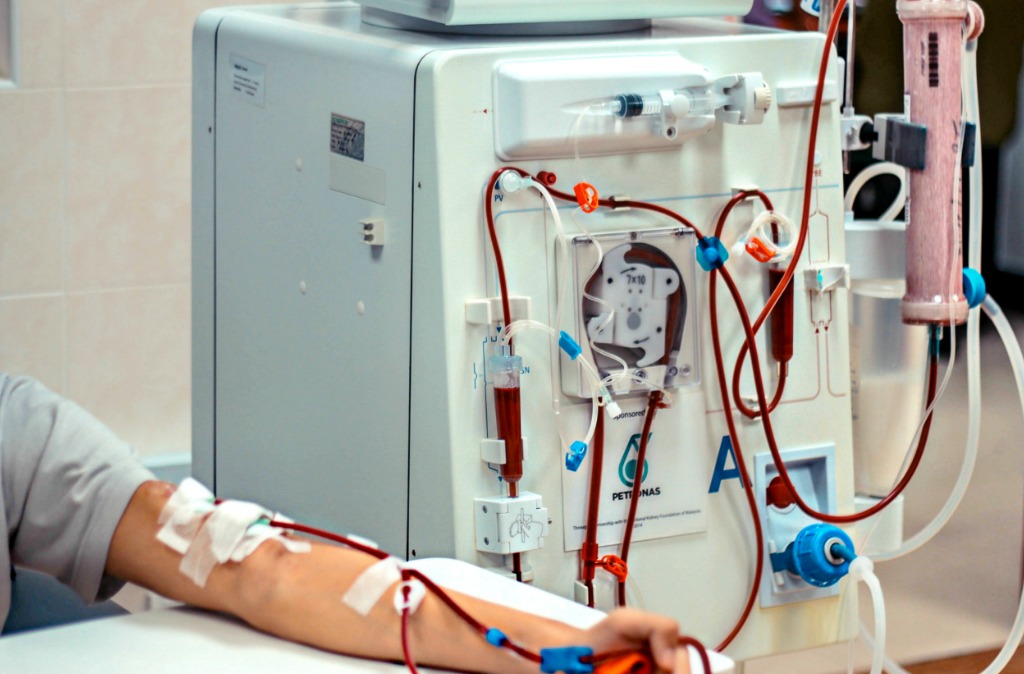 Такое вмешательство могло бы, если бы оно было эффективным, улучшить ответ на иммунотерапию.
Такое вмешательство могло бы, если бы оно было эффективным, улучшить ответ на иммунотерапию.
Результаты
Уровни sPD-L1 предсказывают общую выживаемость у пациентов с меланомой
Каждая форма внеклеточного PD-L1 действует in trans как системный иммунодепрессант посредством передачи сигналов PD-1 (рис. 1А, дополнительная онлайн-таблица 1).4–9Чтобы подтвердить клиническое влияние sPD-L1 в плазме, мы измерили уровни sPD-L1 в ретроспективной группе из 276 пациентов с меланомой. Исследовательский анализ общей выживаемости (ОВ) определил рабочее пороговое значение sPD-L1 (≥0,277 нг/мл), а исходные характеристики на момент включения в исследование были схожими (дополнительная онлайн-таблица 2). Пациенты с высокими уровнями sPD-L1 в плазме имели более низкую медианную ОВ по сравнению с пациентами с низкими уровнями sPD-L1 в плазме (рисунок 1B, 12,1 против 18,5 месяцев, p = 0,005). По сравнению со здоровыми людьми того же возраста у пациентов с меланомой средний показатель sPD-L1 в плазме был выше (рисунок 1C, 1,72 нг/мл против 0,77 нг/мл, p<0,001). В многофакторном анализе пропорциональных рисков Кокса высокий уровень sPD-L1 до лечения предсказывал худшую выживаемость (ОР 1,49).; 95% ДИ от 1,06 до 2,09; р=0,025) при учете пожилого возраста (незначимо), пола (незначимо), поздней стадии (р=0,002) и высокого уровня ЛДГ в сыворотке (р=0,01; онлайн-дополнительная таблица 3).
В многофакторном анализе пропорциональных рисков Кокса высокий уровень sPD-L1 до лечения предсказывал худшую выживаемость (ОР 1,49).; 95% ДИ от 1,06 до 2,09; р=0,025) при учете пожилого возраста (незначимо), пола (незначимо), поздней стадии (р=0,002) и высокого уровня ЛДГ в сыворотке (р=0,01; онлайн-дополнительная таблица 3).
Рисунок 1
Растворимый лиганд запрограммированной смерти 1 (PD-L1) подавляет противоопухолевый иммунитет и предсказывает общую выживаемость у пациентов с меланомой. (A) Модель трех известных внеклеточных форм PD-L1, происходящих из опухоли: (1) evPD-L1, (2) расщепленный ADAM10/ADAM17 растворимый эктодомен PD-L1 (sPD-L1) и (3) секретируемый сплайс-вариант. sPD-L1, которые подавляют противоопухолевый иммунитет и предотвращают реакцию на ингибирование PD-(L)1. (B) График Каплана-Мейера показывает значительно худшую общую выживаемость для пациентов с меланомой, проявляющих высокие (≥0,277 нг/мл) по сравнению с низкими (<0,277 нг/мл) уровнями sPD-L1 в плазме (p = 0,005). (C) У пациентов с меланомой средний уровень sPD-L1 в плазме был выше (1,72 нг/мл) по сравнению со здоровым контролем (0,773 нг/мл). ***р<0,001.
(C) У пациентов с меланомой средний уровень sPD-L1 в плазме был выше (1,72 нг/мл) по сравнению со здоровым контролем (0,773 нг/мл). ***р<0,001.
ТЭП значительно снижает уровни sPD-L1 в плазме
Мы предположили, что ТЭП может удалять внеклеточный PD-L1 в его различных формах (рис. 2А). Чтобы ответить на этот вопрос, мы проспективно зарегистрировали пациентов, подвергающихся плановой ТПО (рис. 2В). Критериям включения соответствовали 28 пациентов, из которых 25 дали информированное согласие. Исходные характеристики пациентов приведены в таблице 1. Один пациент был исключен для использования биотинсодержащих добавок, поскольку биотин мешает установленному анализу обнаружения sPD-L1. Остальным 24 пациентам был проведен плазмаферез и сбор образцов до и после процедуры, как описано. Также собирали образцы плазмы, выброшенные из мешка для отходов устройства TPE для каждого сеанса. sPD-L1 измеряли в каждом образце, и у большинства пациентов, перенесших ТПО, уровни sPD-L1 превышали клинически значимый пороговый уровень 0,277 нг/мл из ретроспективного исследования меланомы.
Таблица 1
Исходные характеристики пациентов
Рисунок 2
Терапевтический плазмаферез (ТПЭ) значительно снижает уровни растворимого в плазме лиганда запрограммированной смерти 1 (sPD-L1). (A) Модель процедуры TPE, в которой плазма пациента отделяется и заменяется для извлечения неклеточных веществ, содержащихся в плазме. (B) Схема настоящего исследования, в котором 24 пациента проходят плазмаферез. (C) Все уровни sPD-L1 в плазме нанесены непосредственно до (до) и после (после) TPE с использованием жидкости для замены альбумина. TPE значительно снижал уровни sPD-L1 в плазме пациентов по знаковому ранговому критерию Уилкоксона (p<0,0001). (D) В типичной временной шкале уровни sPD-L1 у пациентов снижаются с каждым последующим сеансом ТПО (серые столбцы). См. также таблицу 2, дополнительные онлайн-рисунки 2–3.
У большинства пациентов, перенесших ТПО, не было активного диагноза рака. Исходные уровни sPD-L1 у всех пациентов сравнивали с соответствующими нормальными контрольными группами и пациентами с меланомой (дополнительный онлайн-рис. 1), и у некоторых пациентов уровень sPD-L1 превышал клинически значимый пороговый уровень, определенный в ретроспективной когорте меланомы. Пациенты с высоким исходным уровнем sPD-L1 были значительно более анемичными, чем пациенты с более низким исходным уровнем sPD-L1, даже с учетом большего числа женщин в группе с высоким уровнем sPD-L1 (среднее значение Hgb только для женщин 11,4 против 14,1, p = 0,04). ; только у мужчин средний Hgb 11,8 против 14,3, p = 0,03). В остальном группы были похожи. TPE значительно снижал уровни sPD-L1 в плазме у пациентов, получавших заместительную жидкость только с альбумином (т. е. без СЗП) (рис. 2C, p<0,0001). Удаленный sPD-L1 был обнаружен в соответствующих образцах плазмы из мешка для отходов процедуры TPE. Каждый сеанс ТПО удалял в среднем 70,8% обнаруживаемого sPD-L1 в плазме; средняя регенерация sPD-L1 между сеансами составила 33,8% (таблица 2). Сеансы ТПО обычно разделяли на 1–3 дня.
1), и у некоторых пациентов уровень sPD-L1 превышал клинически значимый пороговый уровень, определенный в ретроспективной когорте меланомы. Пациенты с высоким исходным уровнем sPD-L1 были значительно более анемичными, чем пациенты с более низким исходным уровнем sPD-L1, даже с учетом большего числа женщин в группе с высоким уровнем sPD-L1 (среднее значение Hgb только для женщин 11,4 против 14,1, p = 0,04). ; только у мужчин средний Hgb 11,8 против 14,3, p = 0,03). В остальном группы были похожи. TPE значительно снижал уровни sPD-L1 в плазме у пациентов, получавших заместительную жидкость только с альбумином (т. е. без СЗП) (рис. 2C, p<0,0001). Удаленный sPD-L1 был обнаружен в соответствующих образцах плазмы из мешка для отходов процедуры TPE. Каждый сеанс ТПО удалял в среднем 70,8% обнаруживаемого sPD-L1 в плазме; средняя регенерация sPD-L1 между сеансами составила 33,8% (таблица 2). Сеансы ТПО обычно разделяли на 1–3 дня.
Таблица 2
Снижение и регенерация растворимого лиганда запрограммированной смерти 1 (sPD-L1) за обмен
Также показан репрезентативный индивидуальный курс лечения пациента, показывающий снижение sPD-L1 в течение четырех последовательных сеансов TPE (рис. 2D). Все индивидуальные курсы ТПО для пациентов, включая сеансы с использованием продуктов донорской крови (например, свежезамороженной плазмы или СЗП), показаны на дополнительном онлайн-рисунке 2. Также показаны уровни sPD-L1 до и после ТПО для всех сеансов (онлайн). дополнительный рис 3). TPE значительно снижал sPD-L1 в плазме, даже когда были включены сеансы, требующие донорской FFP (p<0,0001).
2D). Все индивидуальные курсы ТПО для пациентов, включая сеансы с использованием продуктов донорской крови (например, свежезамороженной плазмы или СЗП), показаны на дополнительном онлайн-рисунке 2. Также показаны уровни sPD-L1 до и после ТПО для всех сеансов (онлайн). дополнительный рис 3). TPE значительно снижал sPD-L1 в плазме, даже когда были включены сеансы, требующие донорской FFP (p<0,0001).
СЗП иногда вводят во время ТПО пациентам с повышенным риском кровотечения. Мы наблюдали, что у некоторых пациентов, получавших СЗП с низким исходным уровнем sPD-L1, наблюдалось быстрое повышение уровня sPD-L1 после ТПО, предположительно пассивно полученное из донорской плазмы, поскольку этого не наблюдалось у пациентов, получавших только заместительную терапию альбумином. sPD-L1 не был обнаружен в плазме, выброшенной после процедуры у этих пациентов. Мы наблюдали умеренную связь между повышением уровня sPD-L1 после инфузии СЗП и группой крови реципиента, в основном у пациентов с группой крови О. Лица с группой крови О- являются универсальными реципиентами продуктов СЗП и универсальными донорами клеточных продуктов из-за отсутствия антигенов группы АВО и наличия предварительно сформированных анти-А и анти-В антител соответственно. Реципиенты СЗП обычно получают смесь совместимой плазмы от нескольких доноров. Чтобы определить, связана ли группа крови у доноров СЗП с содержанием sPD-L1 в СЗП, мы измерили sPD-L1 с помощью ИФА в плазме от нескольких доноров СЗП (дополнительный онлайн-рисунок 4). О-отрицательные доноры плазмы показали более высокие уровни sPD-L1, чем доноры с большинством других групп крови.
Лица с группой крови О- являются универсальными реципиентами продуктов СЗП и универсальными донорами клеточных продуктов из-за отсутствия антигенов группы АВО и наличия предварительно сформированных анти-А и анти-В антител соответственно. Реципиенты СЗП обычно получают смесь совместимой плазмы от нескольких доноров. Чтобы определить, связана ли группа крови у доноров СЗП с содержанием sPD-L1 в СЗП, мы измерили sPD-L1 с помощью ИФА в плазме от нескольких доноров СЗП (дополнительный онлайн-рисунок 4). О-отрицательные доноры плазмы показали более высокие уровни sPD-L1, чем доноры с большинством других групп крови.
TPE эффективно снижает уровень EV в плазме in vivo
Мы постулировали, что TPE может удалять PD-L1-положительные EV (evPD-L1) из крови пациентов. Чтобы ответить на этот вопрос, мы измерили общие уровни EV и evPD-L1 в каждом образце с помощью проточной цитометрии. Мы также определили влияние TPE на тромбоцитарные CD61-положительные EV, одну из самых распространенных субпопуляций EV в крови (CD61 является маркером тромбоцитов), и ADAM10-положительные EV низкой плотности (ADAM10 был вовлечен в экзосомную нагрузку и патогенез). ).11–13
).11–13
TPE значительно снижал общую концентрацию частиц в плазме (фигура 3A, в среднем 33,5% на обмен, p<0,0001). Сеансы ТПО, требующие СЗП или другого продукта человеческой крови, были исключены из анализа, оставив 44 пары сеансов. PD-L1-положительные (evPD-L1) и ADAM10-положительные EV были значительно уменьшены с помощью TPE (рис. 3B, C, p = 0,028 и p <0,0001 соответственно) и были обнаружены в отработанной плазме (данные не показаны). Каждый сеанс ТПО с использованием заместительной жидкости на основе альбумина с уровнями до ТПО выше одного миллиона удалял в среднем 73,1% обнаруживаемых PD-L1-положительных ЭВ у пациентов (дополнительная онлайн-таблица 4). Тромбоцитарные CD61-положительные EV, хотя и в большом количестве, не были значительно уменьшены за счет плазмафереза (рис. 3D).
Рисунок 3
Плазмаферез эффективно снижает общий уровень внеклеточных везикул (EV) с положительным лигандом программируемой смерти 1 (PD-L1) и ADAM10-положительным уровнем in vivo. Уровни общего количества EV в плазме нанесены непосредственно до (до) и после (после) терапевтического плазмафереза (TPE). TPE значительно снижал (A) общее количество (p<0,0001), (B) PD-L1-положительных (p=0,028) и (C) ADAM10-положительных (p<0,0001), но не (D) CD61-положительных EV (p =0,94) по критерию знакового ранга Уилкоксона. См. также дополнительные онлайн-рисунки 5–7 и дополнительную онлайн-таблицу 4.
Уровни общего количества EV в плазме нанесены непосредственно до (до) и после (после) терапевтического плазмафереза (TPE). TPE значительно снижал (A) общее количество (p<0,0001), (B) PD-L1-положительных (p=0,028) и (C) ADAM10-положительных (p<0,0001), но не (D) CD61-положительных EV (p =0,94) по критерию знакового ранга Уилкоксона. См. также дополнительные онлайн-рисунки 5–7 и дополнительную онлайн-таблицу 4.
Индивидуальные курсы лечения пациентов, показывающие уровни общего плазменного, PD-L1-позитивного, ADAM10-позитивного и CD61-позитивного EV до и после каждого сеанса TPE показаны на дополнительном онлайн-рис. 5 с иллюстративными графиками нанопотока на дополнительном онлайн-рис. 6. Три последовательных Сеансы TPE постоянно истощали общее количество PD-L1-положительных и ADAM10-положительных (но не CD61-положительных) EV. Эти тенденции были менее выражены, когда были включены сеансы, в которые пациенты получали донорскую СЗП (онлайн-дополнение, рис. 7). У нормальных контрольных доноров СЗП группа крови не коррелировала с концентрацией EV в плазме (дополнительный онлайн-рисунок 8).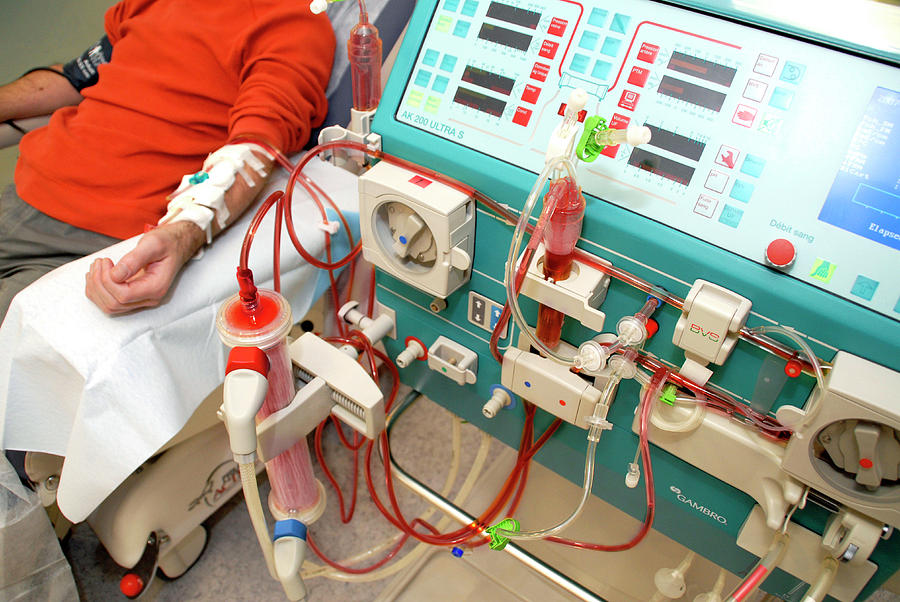
Обсуждение
Внеклеточный PD-L1 — в форме сплайс-варианта sPD-L1, ADAM10/ADAM17-расщепленного эктодомена sPD-L1 или evPD-L1-позитивных EV (evPD-L1) — опосредует устойчивость к PD-(L ингибиторы )1.4–9 Эти формы устойчивы к клинически проверенным комбинациям химиотерапии и иммунотерапии in vitro и на животных моделях и связаны с неблагоприятным прогнозом при многих типах рака. В настоящем исследовании мы обнаружили, что TPE надежно снижает sPD-L1 и evPD-L1. Это снижение было наиболее выраженным примерно в течение трех последовательных сеансов лечения одним объемом плазмы. Учитывая резкое снижение sPD-L1 и evPD-L1, TPE может обеспечить новый подход к борьбе с этими механизмами резистентности.
Несмотря на то, что данное исследование было многообещающим, оно было ограничено пациентами, получавшими ТПО в основном по неонкологическим показаниям в течение короткого промежутка времени. У одного пациента, участвовавшего в исследовании, была меланома, получавшая пембролизумаб, и у него был высокий уровень evPD-L1 до TPE, который снижался при лечении. У другого пациента была нейроэндокринная опухоль матки, получавшая атезолизумаб, и у него был высокий уровень sPD-L1 до ТПО, который снижался при лечении. Однако целью ТПО во всех случаях было притупление паранеопластического аутоиммунитета или лечение какого-либо другого сопутствующего аутоиммунного заболевания, а не основного злокачественного новообразования. Ни у одного из этих пациентов не наблюдалось улучшения аутоиммунитета после ТПО. Источник sPD-L1 и evPD-L1 в этих случаях неясен, поскольку в настоящее время нет анализов, позволяющих дифференцировать PD-L1 опухолевого и неопухолевого происхождения. Мы заметили, что эти формы иммуносупрессивного внеклеточного PD-L1 существуют в природе, хотя и на более низких уровнях у здоровых людей, чем у больных раком, что предполагает потенциально полезную иммунорегуляторную роль. Хотя мы наблюдали некоторую регенерацию как sPD-L1, так и evPD-L1 между сеансами TPE, неизвестно, в какой степени злокачественные клетки могут регенерировать и поддерживать внеклеточный гомеостаз PD-L1.
У другого пациента была нейроэндокринная опухоль матки, получавшая атезолизумаб, и у него был высокий уровень sPD-L1 до ТПО, который снижался при лечении. Однако целью ТПО во всех случаях было притупление паранеопластического аутоиммунитета или лечение какого-либо другого сопутствующего аутоиммунного заболевания, а не основного злокачественного новообразования. Ни у одного из этих пациентов не наблюдалось улучшения аутоиммунитета после ТПО. Источник sPD-L1 и evPD-L1 в этих случаях неясен, поскольку в настоящее время нет анализов, позволяющих дифференцировать PD-L1 опухолевого и неопухолевого происхождения. Мы заметили, что эти формы иммуносупрессивного внеклеточного PD-L1 существуют в природе, хотя и на более низких уровнях у здоровых людей, чем у больных раком, что предполагает потенциально полезную иммунорегуляторную роль. Хотя мы наблюдали некоторую регенерацию как sPD-L1, так и evPD-L1 между сеансами TPE, неизвестно, в какой степени злокачественные клетки могут регенерировать и поддерживать внеклеточный гомеостаз PD-L1. Соответственно, неясно, как другие вещества плазмы, удаляемые ТПО, могут влиять на ответ на иммунотерапию или, в более широком смысле, на иммунитет против рака в целом. Также неизвестно, на каком уровне удаление sPD-L1 и/или PD-L1-позитивных EV станет клинически значимым. Эти аспекты будут проверены в будущих исследованиях.
Соответственно, неясно, как другие вещества плазмы, удаляемые ТПО, могут влиять на ответ на иммунотерапию или, в более широком смысле, на иммунитет против рака в целом. Также неизвестно, на каком уровне удаление sPD-L1 и/или PD-L1-позитивных EV станет клинически значимым. Эти аспекты будут проверены в будущих исследованиях.
Резистентность к иммунотерапии широко распространена и обходится дорого. В большинстве случаев ингибиторы PD-(L)1, такие как пембролизумаб, ниволумаб, атезолизумаб, дурвалумаб и авелумаб, используются в ситуациях, когда ожидается ответ менее половины опухолей. Из пациентов, которые получают пользу, многие не испытывают устойчивого устойчивого ответа. Эти процедуры представляют собой крупные инвестиции; стоимость блокады контрольной точки PD-(L)1 обычно достигает нескольких сотен тысяч долларов в течение курса терапии.
Насколько нам известно, это первый отчет о вмешательстве, направленном на последовательное и быстрое снижение sPD-L1 или PD-L1-положительных EV в клинических условиях. TPE безопасен и часто назначается. Таким образом, ТПО перед иммунотерапией может бороться с резистентностью к иммунотерапии. В свете больших инвестиций, которые влечет за собой анти-PD-(L)1 терапия, дополнительные затраты на ТПО у отдельных пациентов могут быть практичными. настоящее исследование предполагает, что этот подход требует дальнейшего изучения.
TPE безопасен и часто назначается. Таким образом, ТПО перед иммунотерапией может бороться с резистентностью к иммунотерапии. В свете больших инвестиций, которые влечет за собой анти-PD-(L)1 терапия, дополнительные затраты на ТПО у отдельных пациентов могут быть практичными. настоящее исследование предполагает, что этот подход требует дальнейшего изучения.
Помимо evPD-L1, это также, насколько нам известно, первое известное вмешательство для надежного истощения EV в клинических условиях. ЭВ участвуют в онкогенезе и метастазировании посредством переноса миРНК и прямой передачи сигналов белка независимо от PD-L1.15 16 Помимо рака, ЭВ также участвуют в аутоиммунитете, 17 старении/нейродегенерации, 18 инфекциях, 19 ожирении, 20 и сердечных заболеваниях. 21 Селективное удаление ADAM10-позитивных (т.е., вероятно, иммунного происхождения) по сравнению с CD61-позитивных (т.е., вероятно, тромбоцитарного происхождения) EV в этом исследовании предполагает, что гибкое, селективное истощение EV может быть как возможным, так и целесообразным при других показаниях. Настоящее исследование является лишь доказательством концепции, и необходимы дополнительные поисковые исследования в этих областях.
Настоящее исследование является лишь доказательством концепции, и необходимы дополнительные поисковые исследования в этих областях.
Таким образом, ТФЭ снижает внеклеточные формы PD-L1, связанные с резистентностью к ингибитору контрольной точки PD-(L)1. В будущих исследованиях будет изучена потенциальная роль TPE в улучшении иммунотерапии рака.
Методы
Дизайн ретроспективного исследования исходов меланомы
В ретроспективном анализе исходные образцы крови от 276 пациентов с меланомой до лечения в одном из трех клинических испытаний, проведенных Северной центральной группой по лечению рака: N057e,22 N0775,23 и N087924 в период с 2006 по 2014 год были протестированы на sPD-L1. У 82% пациентов была диагностирована меланома кожи, и ни один из них не получал лечения иммунотерапией. Также была протестирована кровь 86 здоровых добровольцев, сдавших кровь в клинике Майо.
План проспективного исследования ТПО
В открытом одноцентровом обсервационном исследовании, инициированном исследователем, с декабря 2019 г. по март 2020 г. проводились исследования взрослых, подвергавшихся ТПО. для процедуры собирали в вакутейнеры ACD (BD). В каждом случае первые 8 мл крови отбрасывали, чтобы избежать загрязнения, после чего последовательно получали образец объемом 8 мл. Плазму выделяли центрифугированием. Образец крови был получен после завершения процедуры. Кроме того, были собраны соответствующие образцы плазмы, выброшенной из мешка для отходов процедуры. Образцы были получены от четырех последовательных процедур для каждого пациента. Если пациент перенес менее четырех процедур ТПО, образцы брали из максимально возможного количества процедур.
по март 2020 г. проводились исследования взрослых, подвергавшихся ТПО. для процедуры собирали в вакутейнеры ACD (BD). В каждом случае первые 8 мл крови отбрасывали, чтобы избежать загрязнения, после чего последовательно получали образец объемом 8 мл. Плазму выделяли центрифугированием. Образец крови был получен после завершения процедуры. Кроме того, были собраны соответствующие образцы плазмы, выброшенной из мешка для отходов процедуры. Образцы были получены от четырех последовательных процедур для каждого пациента. Если пациент перенес менее четырех процедур ТПО, образцы брали из максимально возможного количества процедур.
Включенные пациенты были взрослыми, способными дать согласие и подвергшимся ТПО по поводу различных гематологических, неврологических и почечных заболеваний, как указано в опубликованных руководствах Американского общества афереза (ASFA) или в соответствии с медицинским заключением лечащих врачей.25 Пациенты, принимающие добавки с биотином, были исключены из исследования из-за влияния биотина на результаты анализа sPD-L1 ELISA. Процедуры проводились с использованием сепараторов клеток на основе центрифугирования, либо Fenwal Amicus (Fresenius KABI USA LLC, Лейк-Цюрих, Иллинойс, США), либо Spectra Optia (Terumo BCT, Лейквуд, Колорадо, США). Для каждого пациента производился обмен одного объема плазмы с использованием либо периферического внутривенного введения (предпочтительно), либо центрального катетера для сосудистого доступа. Для этого исследования, из-за возможности присутствия sPD-L1 или PD-L1-позитивных EV в донорской плазме, в расчеты были включены только сеансы TPE без использования донорской плазмы (т. е. свежезамороженной плазмы, FFP) в замещающей жидкости. Антикоагулянтная терапия состояла из 500 мл кислого раствора цитрата декстрозы А (ACD-A) или 500 мл ACD-A с 5000 единицами нефракционированного гепарина. Соотношение антикоагулянта и крови составляло 1:13 при использовании ACD-A и 1:26 при использовании ACD-A/гепарин. Пациенты не получали рутинную замену электролитов, но 10 мл 10% глюконата кальция вводили медленным внутривенным введением для выявления признаков и симптомов гипокальциемии, связанной с антикоагулянтом ACD-A, у одного пациента.
Процедуры проводились с использованием сепараторов клеток на основе центрифугирования, либо Fenwal Amicus (Fresenius KABI USA LLC, Лейк-Цюрих, Иллинойс, США), либо Spectra Optia (Terumo BCT, Лейквуд, Колорадо, США). Для каждого пациента производился обмен одного объема плазмы с использованием либо периферического внутривенного введения (предпочтительно), либо центрального катетера для сосудистого доступа. Для этого исследования, из-за возможности присутствия sPD-L1 или PD-L1-позитивных EV в донорской плазме, в расчеты были включены только сеансы TPE без использования донорской плазмы (т. е. свежезамороженной плазмы, FFP) в замещающей жидкости. Антикоагулянтная терапия состояла из 500 мл кислого раствора цитрата декстрозы А (ACD-A) или 500 мл ACD-A с 5000 единицами нефракционированного гепарина. Соотношение антикоагулянта и крови составляло 1:13 при использовании ACD-A и 1:26 при использовании ACD-A/гепарин. Пациенты не получали рутинную замену электролитов, но 10 мл 10% глюконата кальция вводили медленным внутривенным введением для выявления признаков и симптомов гипокальциемии, связанной с антикоагулянтом ACD-A, у одного пациента.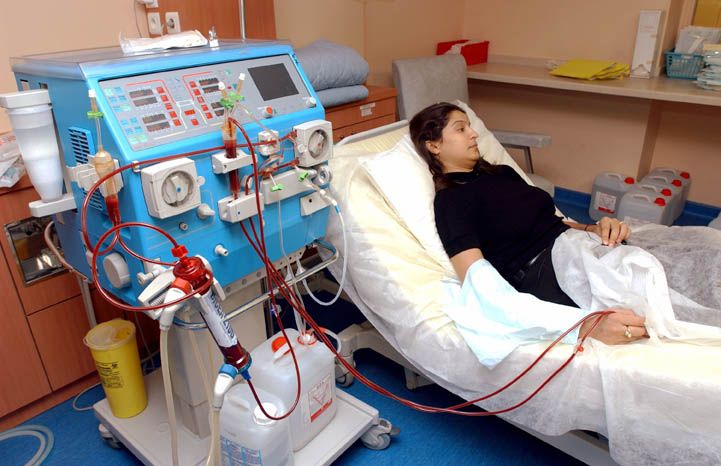
ELISA
ELISA выполняли, как было опубликовано ранее.26 С помощью этого ELISA надежно обнаруживаются как секретируемый сплайс-вариант, так и потерянный sPD-L1. Вкратце, парные клоны мышиных моноклональных антител IgG2 h2A и B11 против внеклеточного человеческого PD-L1 использовали в анализе захвата-обнаружения на планшетах с использованием биотинилирования и обнаружения HRP-стрептавидина. Этот анализ специфичен для sPD-L1 и не проявляет перекрестной реактивности ни с другими гомологами B7-H, ни с evPD-L1. Концентрации определяли путем измерения оптической плотности вдоль известной стандартной кривой рекомбинантного человеческого PD-L1. ELISA проводился членами команды, которые не знали идентичности образцов.
Проточная цитометрия
Проточная цитометрия для ЭВ проводилась, как было опубликовано ранее.27 Вкратце, образцы плазмы дважды центрифугировали при 2000g для истощения тромбоцитов. Полученную свободную от тромбоцитов плазму анализировали с помощью наноразмерного проточного цитометра A60-Micro Plus (Apogee FlowSystems) со стробированием для рассеяния света под углом средней интенсивности и представляющих интерес маркеров. Антитела против PD-L1 (Genentech: атезолизумаб), ADAM10 (R&D Systems: клон 163003) и CD61 (BioLegend: клон VI-PL2) конъюгировали с флуорофорами (Life Technologies: Alexa-647, PE фикоэритрин и Alexa-488). ) и титруют перед использованием. Калибровка наноразмерного проточного цитометра выполнялась с использованием стандартной эталонной смеси гранул, как было опубликовано ранее. Проточная цитометрия выполнялась членами команды, не имевшими представления об идентичности образцов.
Антитела против PD-L1 (Genentech: атезолизумаб), ADAM10 (R&D Systems: клон 163003) и CD61 (BioLegend: клон VI-PL2) конъюгировали с флуорофорами (Life Technologies: Alexa-647, PE фикоэритрин и Alexa-488). ) и титруют перед использованием. Калибровка наноразмерного проточного цитометра выполнялась с использованием стандартной эталонной смеси гранул, как было опубликовано ранее. Проточная цитометрия выполнялась членами команды, не имевшими представления об идентичности образцов.
Статистический анализ
Все статистические анализы были выполнены с использованием R Statistical Software (R Foundation). Ретроспективная выживаемость без прогрессирования была проанализирована с использованием моделирования пропорциональных рисков Каплана-Мейера и Кокса. Оптимальные пороговые значения для уровней sPD-L1 были определены с использованием пакета greyzoneSurv для R. Критерий знакового ранга Уилкоксона использовался для сравнения уровней sPD-L1 и EV в парных образцах пациентов до и после TPE, как указано. Исходные клинические характеристики для исследования сравнивали с помощью критерия Крускала-Уоллиса для непрерывных переменных и критерия Пирсона χ 2 проверка дискретных переменных, как указано. В противном случае группы сравнивали по непарному двустороннему критерию Стьюдента. На рисунках, состоящих из блочных диаграмм, показаны значения квартилей и отдельные точки данных. Средние значения и 95% ДИ указаны в соответствующих дополнительных онлайн-рисунках и таблицах. Р <0,05 считалось статистически значимым. На рисунках значения р обозначены <0,05 знаком *, <0,01 знаком ** и <0,001 знаком ***.
Исходные клинические характеристики для исследования сравнивали с помощью критерия Крускала-Уоллиса для непрерывных переменных и критерия Пирсона χ 2 проверка дискретных переменных, как указано. В противном случае группы сравнивали по непарному двустороннему критерию Стьюдента. На рисунках, состоящих из блочных диаграмм, показаны значения квартилей и отдельные точки данных. Средние значения и 95% ДИ указаны в соответствующих дополнительных онлайн-рисунках и таблицах. Р <0,05 считалось статистически значимым. На рисунках значения р обозначены <0,05 знаком *, <0,01 знаком ** и <0,001 знаком ***.
Благодарности
Статистическое руководство было щедро предоставлено Натаном Фостером из Центра клинических и трансляционных исследований клиники Мэйо. Некоторые иллюстрации были созданы с использованием шаблонов Servier Medical Art, которые находятся под лицензией Creative Commons Attribution 3.0 Unported License; https://smart.servier.com. Дополнительные иллюстрации были предоставлены Mayo Clinic Media Services. Авторы благодарят Дэниела Саммерфилда, доктора медицинских наук, за использование его подобия на рис. 2А.
Авторы благодарят Дэниела Саммерфилда, доктора медицинских наук, за использование его подобия на рис. 2А.
Ссылки
- ↵
- О’Доннелл Дж. С. ,
- Длинный ГВ ,
- Скайер Р.А. , и другие
. Устойчивость к ингибированию контрольной точки PD1/PDL1. Лечение рака, ред. , 2017 г.; 52:71–81.doi:10.1016/j.ctrv.2016.11.007 пмид: http://www.ncbi.nlm.nih.gov/pubmed/27951441
- ↵
- Андо К. ,
- Хамада К. ,
- Ватанабэ М , и другие
. Уровни растворимого PD-L1 в плазме коррелируют с регрессией опухоли у пациентов с раком легких и желудка, получавших ингибиторы иммунных контрольных точек. Anticancer Res 2019;39:5195–201.doi:10.21873/anticanres.13716 пмид: http://www.ncbi.nlm.nih.gov/pubmed/31519633
- ↵
- Вентилятор Y ,
- Че Х ,
- Ку Дж , и другие
.
 Экзосомальный PD-L1 сохраняет иммунодепрессивную активность и связан с прогнозом рака желудка. Ann Surg Oncol 2019;26:3745–55.doi:10.1245/s10434-019-07431-7
пмид: http://www.ncbi.nlm.nih.gov/pubmed/31087180
Экзосомальный PD-L1 сохраняет иммунодепрессивную активность и связан с прогнозом рака желудка. Ann Surg Oncol 2019;26:3745–55.doi:10.1245/s10434-019-07431-7
пмид: http://www.ncbi.nlm.nih.gov/pubmed/31087180 - ↵
- Чжоу Дж. ,
- Махони КМ ,
- Джобби-Хердер А. , и другие
. Растворимый PD-L1 как биомаркер злокачественной меланомы, леченной блокадой контрольных точек. Cancer Immunol Res 2017; 5:480–92.doi:10.1158/2326-6066.CIR-16-0329 пмид: http://www.ncbi.nlm.nih.gov/pubmed/28522460
- ↵
- Махони КМ и другие
. «Секретируемый вариант сплайсинга PD-L1, который ковалентно димеризуется и опосредует иммуносупрессию». Cancer Immunol Immunother 2018:1–12.
- ↵
- Орм Джей Джей ,
- Джазие К.А. ,
- Се Т , и другие
.
 ADAM10 и ADAM17 расщепляют PD-L1, опосредуя устойчивость к ингибитору PD-(L)1. Онкоиммунология 2020;9:1744980. дои: 10.1080/2162402X.2020.1744980
пмид:32363112
ADAM10 и ADAM17 расщепляют PD-L1, опосредуя устойчивость к ингибитору PD-(L)1. Онкоиммунология 2020;9:1744980. дои: 10.1080/2162402X.2020.1744980
пмид:32363112 - ↵
- Ромеро Ю. ,
- Мудрый Р ,
- Жолкевская А
. Протеолитический процессинг PD-L1 протеазами ADAM в клетках рака молочной железы. Cancer Immunol Immunother 2020;69:43–55.doi:10.1007/s00262-019-02437-2 пмид: http://www.ncbi.nlm.nih.gov/pubmed/31796994
- ↵
- Чен Г ,
- Хуан АС ,
- Чжан В , и другие
. Экзосомальный PD-L1 способствует иммуносупрессии и связан с анти-PD-1 ответом. Природа 2018;560:382–6.doi:10.1038/s41586-018-0392-8 пмид: http://www.ncbi.nlm.nih.gov/pubmed/30089911
- ↵
- Поджо М ,
- Хижина ,
- Пай CC , и другие
.
 Подавление экзосомального PD-L1 индуцирует системный противоопухолевый иммунитет и память. Cell 2019;177:414–27.doi:10.1016/j.cell.2019.02.016
пмид: http://www.ncbi.nlm.nih.gov/pubmed/30951669
Подавление экзосомального PD-L1 индуцирует системный противоопухолевый иммунитет и память. Cell 2019;177:414–27.doi:10.1016/j.cell.2019.02.016
пмид: http://www.ncbi.nlm.nih.gov/pubmed/30951669 - ↵
- Дерксен Р.Х. ,
- Шурман Х.Дж. ,
- Мейлинг Ф.Х. , и другие
. Эффективность плазмафереза при удалении компонентов плазмы. J Lab Clin Med 1984;104:346–54.pmid:http://www.ncbi.nlm.nih.gov/pubmed/6206173
- ↵
- Беркманс Р.Дж. ,
- Ньюланд Р ,
- Бёинг А.Н. , и другие
. Микрочастицы клеточного происхождения циркулируют в организме здорового человека и способствуют образованию тромбина низкой степени. Thromb Haemost 2001;85:639–46.pmid:http://www.ncbi.nlm.nih.gov/pubmed/11341498
- ↵
- Крешителли Р.
 ,
, - Лессер С ,
- Джанг СК , и другие
. Субпопуляции внеклеточных везикул из ткани метастатической меланомы человека, идентифицированные с помощью количественной протеомики после оптимизированной изоляции. J Внеклеточные везикулы 2020;9:1722433. дои: 10.1080/20013078.2020.1722433 пмид: http://www.ncbi.nlm.nih.gov/pubmed/32128073
- Крешителли Р.
- ↵
- Коваль Дж. ,
- Аррас Г ,
- Коломбо М , и другие
. Протеомное сравнение определяет новые маркеры для характеристики гетерогенных популяций подтипов внеклеточных везикул. Proc Natl Acad Sci USA 2016;113:E968–77.doi:10.1073/pnas.1521230113 пмид: http://www.ncbi.nlm.nih.gov/pubmed/26858453
- ↵
- Уинтерс Дж.Л. ,
- Браун Д ,
- Опасность E , и другие
.
 Анализ минимизации затрат прямых затрат на ТПО и ВВИГ при лечении синдрома Гийена-Барре. BMC Health Serv Res 2011; 11:1–8.doi:10.1186/1472-6963-11-101
Анализ минимизации затрат прямых затрат на ТПО и ВВИГ при лечении синдрома Гийена-Барре. BMC Health Serv Res 2011; 11:1–8.doi:10.1186/1472-6963-11-101 - ↵
- Ли Джей Си ,
- Чжао Джей-Ти ,
- Гундара Дж. , и другие
. Экзосомы папиллярного рака щитовидной железы содержат микроРНК-146b и микроРНК-222. J Surg Res 2015;196:39–48.doi:10.1016/j.jss.2015.02.027 пмид: http://www.ncbi.nlm.nih.gov/pubmed/25819770
- ↵
- Ян Дж. ,
- Вэй Ф ,
- Шафер С , и другие
. Обнаружение мРНК и белка, специфичных для опухолевых клеток, в экзосомоподобных микровезикулах крови и слюны. PLoS One 2014;9:e110641. doi:10.1371/journal.pone.0110641 пмид: http://www.ncbi.nlm.nih.gov/pubmed/25397880
- ↵
- Накао Р ,
- Хасэгава Х ,
- Очиай К , и другие
.
 Везикулы наружной мембраны Porphyromonas gingivalis вызывают иммунный ответ слизистой оболочки. PLoS One 2011;6:e26163. doi:10.1371/journal.pone.0026163
пмид: http://www.ncbi.nlm.nih.gov/pubmed/22022548
Везикулы наружной мембраны Porphyromonas gingivalis вызывают иммунный ответ слизистой оболочки. PLoS One 2011;6:e26163. doi:10.1371/journal.pone.0026163
пмид: http://www.ncbi.nlm.nih.gov/pubmed/22022548 - ↵
- Томпсон АГ и другие
. «Внеклеточные везикулы при нейродегенеративных заболеваниях от патогенеза до биомаркеров», Nature Reviews Neurology. Nature Publishing Group 2016;12:346–57.
- ↵
- Марсилла А ,
- Мартин-Жаулар Л. ,
- Трелис М , и другие
. Внеклеточные везикулы при паразитарных заболеваниях. J Внеклеточные везикулы 2014;3, :25040.doi:10.3402/jev.v3.25040 пмид: http://www.ncbi.nlm.nih.gov/pubmed/25536932
- ↵
- Хуанг-Доран I ,
- Чжан С.И. ,
- Видаль-Пуч А.
.
 «Внеклеточные везикулы: новые медиаторы клеточной коммуникации при метаболических заболеваниях», Тенденции в эндокринологии и метаболизме. Elsevier Inc 2017; 28:3–18.
«Внеклеточные везикулы: новые медиаторы клеточной коммуникации при метаболических заболеваниях», Тенденции в эндокринологии и метаболизме. Elsevier Inc 2017; 28:3–18. - ↵
- Буланже СМ ,
- Лойер Х ,
- Рауто ЧП , и другие
. «Внеклеточные везикулы при ишемической болезни сердца», Nature Reviews Cardiology. Издательская группа Nature 2017;14:259–72.
- ↵
- Котчаде, Лос-Анджелес ,
- Суман виджей ,
- Аматруда Т , и другие
. Испытание фазы II наб-паклитаксела (ABI-007) и карбоплатина у пациентов с нерезектабельной меланомой стадии IV: Северо-центральное исследование группы лечения рака, N057E(1). Рак 2011;117:1704–10.doi:10.1002/cncr.25659 пмид: http://www.ncbi.nlm.nih.gov/pubmed/21472717
- ↵
- Котчаде, Лос-Анджелес ,
- Суман виджей ,
- Перес Д.
 Г.
, и другие
Г.
, и другие
. Рандомизированное исследование фазы 2 темозоломида и бевацизумаба или наб-паклитаксела, карбоплатина и бевацизумаба у пациентов с нерезектабельной меланомой IV стадии: исследование North Central Cancer Treatment Group, N0775. Рак 2013;119:586–92.doi:10.1002/cncr.27760 пмид: http://www.ncbi.nlm.nih.gov/pubmed/22915053
- ↵
- Маквильямс РР ,
- Оллред Дж.Б. ,
- Слостад JA , и другие
. NCCTG N0879 (Alliance): рандомизированное совместное групповое исследование 2 фазы карбоплатина, паклитаксела и бевацизумаба ± эверолимуса при метастатической меланоме. Рак 2018;124:537–45.doi:10.1002/cncr.31072 пмид: http://www.ncbi.nlm.nih.gov/pubmed/2
96 - ↵
- Падманабхан А ,
- Коннелли-Смит Л. ,
- Акви Н , и другие
.
 Руководство по использованию терапевтического афереза в клинической практике — основанный на фактических данных подход от Писательского комитета Американского общества афереза: восьмой специальный выпуск. J Clin Apher 2019;34:171–354.doi:10.1002/jca.21705
пмид: http://www.ncbi.nlm.nih.gov/pubmed/31180581
Руководство по использованию терапевтического афереза в клинической практике — основанный на фактических данных подход от Писательского комитета Американского общества афереза: восьмой специальный выпуск. J Clin Apher 2019;34:171–354.doi:10.1002/jca.21705
пмид: http://www.ncbi.nlm.nih.gov/pubmed/31180581 - ↵
- Фригола Х ,
- Инман Б.А. ,
- Лозе КМ , и другие
. Идентификация растворимой формы B7-h2, которая сохраняет иммунодепрессивную активность и связана с агрессивным почечно-клеточным раком. Clin Cancer Res 2011;17:1915–23.doi:10.1158/1078-0432.CCR-10-0250 пмид: http://www.ncbi.nlm.nih.gov/pubmed/21355078
- ↵
- Гомес Дж. ,
- Люсьен Ф ,
- Купер ТТ , и другие
. Аналитические соображения в наномасштабной проточной цитометрии внеклеточных везикул для достижения линейности данных.
 Thromb Haemost 2018;118:1612–24.doi:10.1055/s-0038-1668544
пмид: http://www.ncbi.nlm.nih.gov/pubmed/30112749
Thromb Haemost 2018;118:1612–24.doi:10.1055/s-0038-1668544
пмид: http://www.ncbi.nlm.nih.gov/pubmed/30112749
Сноски
Twitter @JakeOrmeMDPhD
Авторы JO выдвинула гипотезы, разработала исследование, наблюдала за экспериментами, провела анализ и написала статью. EALE провела ретроспективный когортный анализ меланомы. FL-M выполнила нанопроточную цитометрию. HD и EB контролировали и выполняли регистрацию в исследовании TPE, сбор/обработку образцов и ослепление. SMH провела ИФА. MB, AM, SP, MB, SNM, YY, HD, RD и JLW помогли разработать гипотезы, предоставили клинические образцы и реагенты, а также оказали поддержку и надзор.
Финансирование R21 5R21CA197878-02 Роль Bim и растворимого B7-h2 в мониторинге ответов Т-клеток на терапию анти-PD-1 при меланоме (HD и RD) L30 CA231541-01 Растворимый B7h2 в качестве контрольной точки PD1 «Дистанционное управление» in Cancer (JJO) U10 CA180790 (EE) K12 CA0 (YY) Семейный фонд Ричарда М.
 Шульце (HD и RD).
Шульце (HD и RD).Конкурирующие интересы Заявка на интеллектуальную собственность была зарегистрирована в отношении открытий, раскрытых в этой рукописи. Авторы сообщают об отсутствии других соответствующих конфликтов интересов.
Согласие пациента на публикацию получено.
Утверждение этики Все протоколы исследований с участием людей были одобрены Наблюдательным советом клиники Мэйо, и все люди дали письменное информированное согласие.
Происхождение и рецензирование Не введен в эксплуатацию; рецензируется внешними экспертами.
Заявление о доступности данных Данные доступны в общедоступном хранилище с открытым доступом. Все данные будут доступны для загрузки в Open Science Framework по адресу https://osf.io/qtskd/.
Прочитать полный текст или скачать PDF:
Подписаться
Войти под своим именем пользователя и паролем
Для личных счетов ИЛИ управляющих корпоративными счетами
Имя пользователя *
Пароль *
Забыли данные для входа? Зарегистрировать новую учетную запись?
Забыли имя пользователя или пароль?
Двусторонняя диффузная увеальная меланоцитарная пролиферация с положительным офтальмоскопическим и визуальным ответом на плазмаферез | Офтальмологическая визуализация | ДЖАМА Офтальмология
Исследовательское письмо
Сентябрь 2011 г.
Ребекка Б. Метс, MD, MPH ; Памела Голчет, MD ; Гражина Адамус, доктор философии ; и другие Роберто Анитори, доктор философии ; Дэвид Уилсон, MD ; Джон Шоу, MD ; Ли М. Джампол, MD
Принадлежности авторов Информация о статье
Принадлежности авторов: Кафедра офтальмологии, Медицинская школа Фейнберга, Северо-Западный университет (доктор Метс, Голчет и Джампол) и Ассоциация гематологии и онкологии (д-р Шоу), Чикаго, Иллинойс; и Глазной институт Кейси, Орегонский университет медицинских наук, Портленд (доктор Адамус, Анитори и Уилсон). Доктор Метс сейчас работает в отделении офтальмологии Детской больницы Колорадо Университета Колорадо, Аврора.
Арка Офтальмол. 2011;129(9):1235-1238. doi:10.1001/archophthalmol.2011.277
Двусторонняя диффузная увеальная меланоцитарная пролиферация (BDUMP) представляет собой паранеопластический синдром, приводящий к глубокой двусторонней потере зрения; в мировой литературе описано около 30 случаев. В 1990 г. Gass et al. 1 описали 5 характерных признаков заболевания: множественные субретинальные круглые красные пятна в пигментном эпителии сетчатки (ПЭС), раннее свечение этих очагов на флюоресцентной ангиографии, множественные приподнятые пигментированные и непигментированные увеальные меланоцитарные опухоли с диффузным увеальный тракт, экссудативная отслойка сетчатки и быстрое развитие катаракты. Гистопатологические данные включают диффузную инфильтрацию сосудистой оболочки доброкачественными гипопигментированными веретенообразными клетками и редкими эпителиоидными клетками. Имеется очаговая инфильтрация хориоидеи сильно пигментированными меланоцитами с сохранением хориокапилляров. 1 -4 Разрушение ПЭС происходит в участках, лежащих выше инфильтрата. 1
В 1990 г. Gass et al. 1 описали 5 характерных признаков заболевания: множественные субретинальные круглые красные пятна в пигментном эпителии сетчатки (ПЭС), раннее свечение этих очагов на флюоресцентной ангиографии, множественные приподнятые пигментированные и непигментированные увеальные меланоцитарные опухоли с диффузным увеальный тракт, экссудативная отслойка сетчатки и быстрое развитие катаракты. Гистопатологические данные включают диффузную инфильтрацию сосудистой оболочки доброкачественными гипопигментированными веретенообразными клетками и редкими эпителиоидными клетками. Имеется очаговая инфильтрация хориоидеи сильно пигментированными меланоцитами с сохранением хориокапилляров. 1 -4 Разрушение ПЭС происходит в участках, лежащих выше инфильтрата. 1
Лечение BDUMP в значительной степени не увенчалось успехом. Методы включали кортикостероиды, глазную хирургию, глазное облучение и лечение основного злокачественного новообразования. 1 -3,5 В то время как у некоторых наблюдалось временное улучшение или стабилизация зрения, мы описываем новое лечение этого визуально разрушительного состояния, которое привело к улучшению и стабильности зрения при продолжении лечения до смерти пациента.
1 -3,5 В то время как у некоторых наблюдалось временное улучшение или стабилизация зрения, мы описываем новое лечение этого визуально разрушительного состояния, которое привело к улучшению и стабильности зрения при продолжении лечения до смерти пациента.
Отчет о случае
У мужчины 72 лет в течение 1 месяца отмечалось двустороннее снижение, нечеткость зрения. За четыре месяца до этого у него был диагностирован метастатический бронхогенный рак, по поводу которого он принимал сорафениб.
Острота зрения с максимальной коррекцией составила 20/40 +2 OD и 20/50 +2 OS. Результаты исследования переднего отрезка были в норме. Расширенное исследование выявило прозрачные среды, нормальный диск и ослабленные артериолы в каждом глазу. На правом глазу было небольшое пигментное поражение, локальная экссудативная отслойка сетчатки и участок оранжево-коричневой пигментации жирафа. На левом глазу присутствовало 7 слегка приподнятых пигментных пятен с обширной пигментацией жирафового типа. Овальные пятна в пигментации типа жирафа выглядели слегка гиперпигментированными и были гипоаутофлуоресцентными на аутофлуоресцентной фотографии глазного дна и гиперфлуоресцентными на флуоресцентной ангиографии в обоих глазах. Пигментированные опухоли казались темными при ангиографии с индоцианином зеленым. Оптическая когерентная томография выявила субретинальную жидкость в области нижневисочной отслойки сетчатки, которая распространялась на фовеа правого глаза. В левом глазу также была субфовеальная жидкость (рис. 1). B-сканирование показало диффузное утолщение хориоидеи и дискретные узелки со средней и высокой внутренней отражательной способностью. Результаты электроретинографии были нормальными. В полях зрения Гольдмана были обнаружены скотомы, соответствующие пигментированным опухолям, и общее уменьшение периферического поля зрения.
Овальные пятна в пигментации типа жирафа выглядели слегка гиперпигментированными и были гипоаутофлуоресцентными на аутофлуоресцентной фотографии глазного дна и гиперфлуоресцентными на флуоресцентной ангиографии в обоих глазах. Пигментированные опухоли казались темными при ангиографии с индоцианином зеленым. Оптическая когерентная томография выявила субретинальную жидкость в области нижневисочной отслойки сетчатки, которая распространялась на фовеа правого глаза. В левом глазу также была субфовеальная жидкость (рис. 1). B-сканирование показало диффузное утолщение хориоидеи и дискретные узелки со средней и высокой внутренней отражательной способностью. Результаты электроретинографии были нормальными. В полях зрения Гольдмана были обнаружены скотомы, соответствующие пигментированным опухолям, и общее уменьшение периферического поля зрения.
Находки были диагностическими для BDUMP. Лечение сорафенибом продолжалось. Поскольку мы считали, что циркулирующий фактор роста может быть ответственен за результаты BDUMP, плазмаферез был начат 3 раза в неделю для лечения офтальмологических аномалий.
После 12 сеансов максимально скорректированная острота зрения составила 20/20 -2 OD и 20/25 -2 OS. Отмечалось исчезновение серозных отслоек, истончение сосудистой оболочки, уменьшение пигментации по типу жирафов и усиление видимости подлежащих пигментированных опухолей. Плазмаферез был сокращен до одного раза в неделю. После 17 сеансов зрительные симптомы полностью исчезли, а острота зрения с максимальной коррекцией составила 20/20 OD и 20/25 +2 ОС (рисунок 2).
Через семь месяцев после первого визита к офтальмологу пациенту стало слишком плохо, чтобы продолжать лечение плазмаферезом. Острота зрения 20/20 OU. После прекращения плазмафереза наблюдался рецидив аномалий глазного дна и возврат субретинальной жидкости; За 1 мес до смерти пациента максимально корригированная острота зрения снизилась до 20/200 OD и 20/30 OS. Смерть наступила через 13 месяцев после появления зрительных симптомов.
Были сделаны срезы глазных яблок и исследованы с помощью гематоксилин-эозина (рис.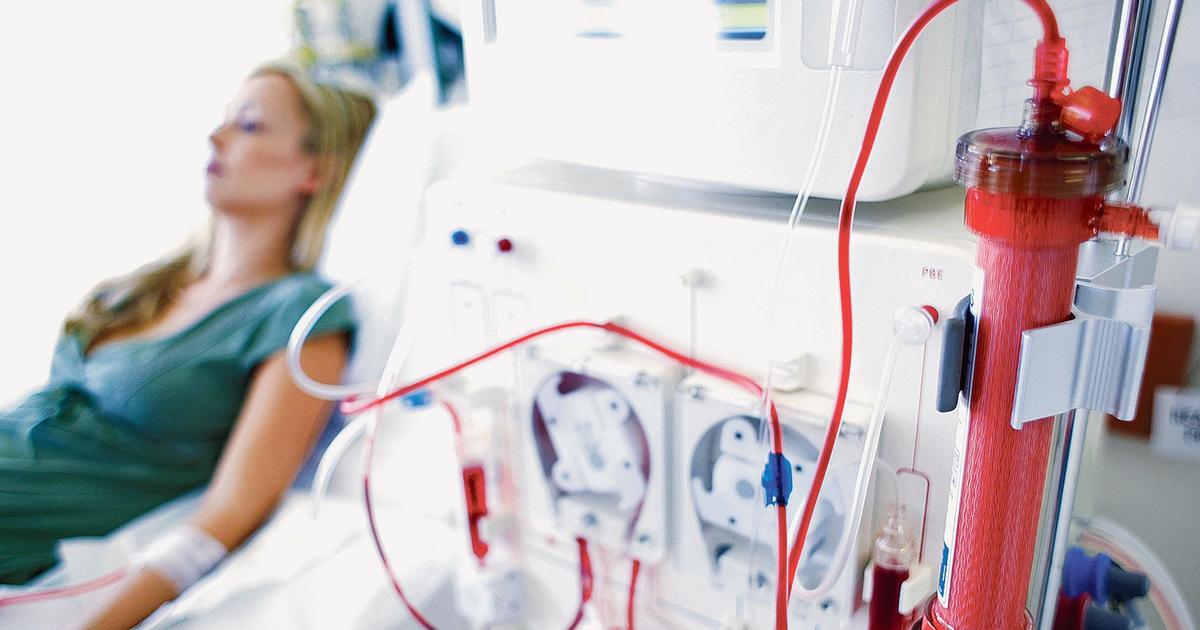 2). Сыворотку тестировали на антиретинальные аутоантитела с помощью вестерн-блоттинга, и она дала положительный результат на аутоантитела против белков сетчатки человека молекулярной массой 33 и 34 кДа. Эти аутоантитела были протестированы против белков, выделенных из опухоли легкого пациента, и не было отмечено специфического окрашивания. На целых срезах глаза крысы они показали положительное окрашивание фоторецепторов (особенно наружных сегментов), некоторых ганглиозных клеток и цитоплазмы некоторых клеток хориоидеи и радужной оболочки.
2). Сыворотку тестировали на антиретинальные аутоантитела с помощью вестерн-блоттинга, и она дала положительный результат на аутоантитела против белков сетчатки человека молекулярной массой 33 и 34 кДа. Эти аутоантитела были протестированы против белков, выделенных из опухоли легкого пациента, и не было отмечено специфического окрашивания. На целых срезах глаза крысы они показали положительное окрашивание фоторецепторов (особенно наружных сегментов), некоторых ганглиозных клеток и цитоплазмы некоторых клеток хориоидеи и радужной оболочки.
Комментарий
Почти все пациенты с BDUMP лечились от основного злокачественного новообразования, но наш случай является первым, насколько нам известно, демонстрирующим успешное лечение глазных заболеваний с возвращением к исходному уровню остроты зрения и исчезновением зрительных симптомов.
Несмотря на редкость, BDUMP постоянно приводил к разрушительным визуальным последствиям. Обычно в течение года, предшествующего смерти, у пациентов с этим паранеопластическим синдромом наблюдается выраженная двусторонняя потеря зрения. Снижение зрения связывают с разрушением фоторецепторов и лежащим в их основе RPE, серозной отслойкой сетчатки и, позднее, катарактой. 1 -3 У нашего пациента катаракта не развилась, субретинальная жидкость и утолщение хориоидеи исчезли, а острота зрения улучшилась до 20/20 после плазмафереза. Поскольку плазмаферез работает путем удаления белков из крови, положительная реакция нашего пациента предполагает, что причиной могут быть циркулирующие антитела или факторы роста.
Снижение зрения связывают с разрушением фоторецепторов и лежащим в их основе RPE, серозной отслойкой сетчатки и, позднее, катарактой. 1 -3 У нашего пациента катаракта не развилась, субретинальная жидкость и утолщение хориоидеи исчезли, а острота зрения улучшилась до 20/20 после плазмафереза. Поскольку плазмаферез работает путем удаления белков из крови, положительная реакция нашего пациента предполагает, что причиной могут быть циркулирующие антитела или факторы роста.
Гистопатологические данные соответствовали BDUMP, за исключением областей гипертрофии RPE вместо более типичной потери RPE. 1 ,3 ,5 Гипертрофия РПЭ с делением, накоплением и миграцией клеток в субретинальное пространство может происходить, когда присутствует субретинальная жидкость, и РПЭ приобретает липофусцин по мере того, как клетки фагоцитируют наружные сегменты фоторецепторов. Мы предполагаем, что гипертрофия RPE может соответствовать пигментации типа жирафа; однако у нас нет точечного сравнения между гистопатологическими образцами и фотографиями глазного дна.
Как сообщалось в других случаях BDUMP, 1 ,5 у нашего пациента были циркулирующие антиретинальные аутоантитела. Значение 33- и 34-кДа белков сетчатки нашего пациента, на которые реагируют эти аутоантитела, неизвестно. Многое еще предстоит узнать в области антиретинальных аутоантител, но это повышает вероятность того, что пациенты с BDUMP могут иметь такие антитела и что эти антитела могут быть, по крайней мере, частично ответственны за потерю фоторецепторов. 4
У нашего пациента мы полагаем, что циркулирующий фактор роста или антитела могли быть ответственны за стимуляцию патологических изменений, отмеченных при BDUMP. Это мнение подтверждается восстановлением хорошей остроты зрения, рассасыванием субретинальной жидкости и уменьшением утолщения хориоидеи во время лечения плазмаферезом, а также рецидивом этих нарушений после прекращения плазмафереза.
Мы сообщаем о новом методе лечения, который может улучшить и стабилизировать зрение при заболевании, которое приводит к двусторонней потере зрения, предшествующей смерти у пациентов с системным злокачественным новообразованием. Плазмаферез следует рассматривать у пациентов с BDUMP.
Плазмаферез следует рассматривать у пациентов с BDUMP.
Наверх
Информация о статье
Для переписки: д-р Метс, отделение офтальмологии, отделение офтальмологии, Детская больница Колорадо, Университет Колорадо, 13123 E 16th Ave, Box B430, Aurora, CO 80045 ([email protected]).
Раскрытие финансовой информации: Не сообщалось.
Финансирование/поддержка: Эта работа была частично поддержана неограниченным грантом от Исследования по предотвращению слепоты и грантом EY13053 от Национальных институтов здравоохранения.
использованная литература
1.
Гасс Дж. Д., Гизер Р. Г., Уилкинсон С. П., Беам Д. Э., Паутлер С. Э. Двусторонняя диффузная увеальная меланоцитарная пролиферация у пациентов со скрытой карциномой. Арка Офтальмол . 1990;108(4):527-5332322154PubMedGoogle ScholarCrossref
1990;108(4):527-5332322154PubMedGoogle ScholarCrossref
2.
Barr CC, Zimmerman LE, Curtin VT, Font RL. Двусторонние диффузные меланоцитарные увеальные опухоли, связанные с системными злокачественными новообразованиями: недавно признанный синдром. Арка Офтальмол . 1982;100(2):249-2557065942PubMedGoogle ScholarCrossref
3.
Gass JD, Glatzer RJ. Приобретенная пигментация, имитирующая синдром Пейтца-Егерса: начальное проявление диффузной увеальной меланоцитарной пролиферации. Br J Офтальмол . 1991;75(11):693-6951751469PubMedGoogle ScholarCrossref
4.
Ritland JS, Eide N, Tausjø J. Двусторонняя диффузная увеальная меланоцитарная пролиферация и рак матки: клинический случай. Acta Ophthalmol Scand . 2000;78(3):366-36810893075PubMedGoogle ScholarCrossref
5.

 Поскольку у меня стаж работы в реанимации больше тридцати лет, я серьезно подхожу к таким вещам.
Поскольку у меня стаж работы в реанимации больше тридцати лет, я серьезно подхожу к таким вещам.
 Производится забор крови, контейнеры центрифугируются, затем плазма удаляется, а клетки крови после разведения физ. раствором возвращаются пациенту. Параллельно вливаются, возмещающие объем удаленной плазмы, солевые растворы. При необходимости вводятся лекарства. Всего за один сеанс плазмафереза удаляется 300-600 мл плазмы. Это наиболее доступный метод, длительность 1 сеанса – 2-2,5 часа.
Производится забор крови, контейнеры центрифугируются, затем плазма удаляется, а клетки крови после разведения физ. раствором возвращаются пациенту. Параллельно вливаются, возмещающие объем удаленной плазмы, солевые растворы. При необходимости вводятся лекарства. Всего за один сеанс плазмафереза удаляется 300-600 мл плазмы. Это наиболее доступный метод, длительность 1 сеанса – 2-2,5 часа.
 пиелонефрит, хроническая почечная недостаточность, половые расстройства у мужчин.
пиелонефрит, хроническая почечная недостаточность, половые расстройства у мужчин. Уинтерс4
Уинтерс4 Экзосомальный PD-L1 сохраняет иммунодепрессивную активность и связан с прогнозом рака желудка. Ann Surg Oncol 2019;26:3745–55.doi:10.1245/s10434-019-07431-7
пмид: http://www.ncbi.nlm.nih.gov/pubmed/31087180
Экзосомальный PD-L1 сохраняет иммунодепрессивную активность и связан с прогнозом рака желудка. Ann Surg Oncol 2019;26:3745–55.doi:10.1245/s10434-019-07431-7
пмид: http://www.ncbi.nlm.nih.gov/pubmed/31087180  ADAM10 и ADAM17 расщепляют PD-L1, опосредуя устойчивость к ингибитору PD-(L)1. Онкоиммунология 2020;9:1744980. дои: 10.1080/2162402X.2020.1744980
пмид:32363112
ADAM10 и ADAM17 расщепляют PD-L1, опосредуя устойчивость к ингибитору PD-(L)1. Онкоиммунология 2020;9:1744980. дои: 10.1080/2162402X.2020.1744980
пмид:32363112  Подавление экзосомального PD-L1 индуцирует системный противоопухолевый иммунитет и память. Cell 2019;177:414–27.doi:10.1016/j.cell.2019.02.016
пмид: http://www.ncbi.nlm.nih.gov/pubmed/30951669
Подавление экзосомального PD-L1 индуцирует системный противоопухолевый иммунитет и память. Cell 2019;177:414–27.doi:10.1016/j.cell.2019.02.016
пмид: http://www.ncbi.nlm.nih.gov/pubmed/30951669  ,
, Анализ минимизации затрат прямых затрат на ТПО и ВВИГ при лечении синдрома Гийена-Барре. BMC Health Serv Res 2011; 11:1–8.doi:10.1186/1472-6963-11-101
Анализ минимизации затрат прямых затрат на ТПО и ВВИГ при лечении синдрома Гийена-Барре. BMC Health Serv Res 2011; 11:1–8.doi:10.1186/1472-6963-11-101  Везикулы наружной мембраны Porphyromonas gingivalis вызывают иммунный ответ слизистой оболочки. PLoS One 2011;6:e26163. doi:10.1371/journal.pone.0026163
пмид: http://www.ncbi.nlm.nih.gov/pubmed/22022548
Везикулы наружной мембраны Porphyromonas gingivalis вызывают иммунный ответ слизистой оболочки. PLoS One 2011;6:e26163. doi:10.1371/journal.pone.0026163
пмид: http://www.ncbi.nlm.nih.gov/pubmed/22022548  «Внеклеточные везикулы: новые медиаторы клеточной коммуникации при метаболических заболеваниях», Тенденции в эндокринологии и метаболизме. Elsevier Inc 2017; 28:3–18.
«Внеклеточные везикулы: новые медиаторы клеточной коммуникации при метаболических заболеваниях», Тенденции в эндокринологии и метаболизме. Elsevier Inc 2017; 28:3–18. 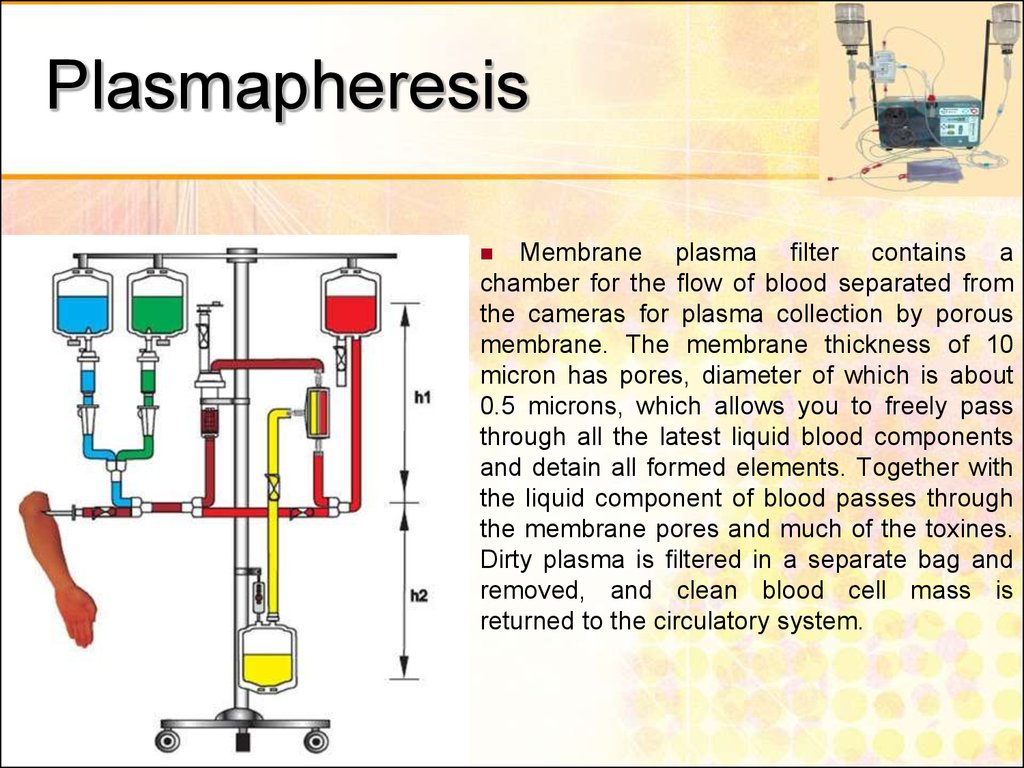 Г.
, и другие
Г.
, и другие Руководство по использованию терапевтического афереза в клинической практике — основанный на фактических данных подход от Писательского комитета Американского общества афереза: восьмой специальный выпуск. J Clin Apher 2019;34:171–354.doi:10.1002/jca.21705
пмид: http://www.ncbi.nlm.nih.gov/pubmed/31180581
Руководство по использованию терапевтического афереза в клинической практике — основанный на фактических данных подход от Писательского комитета Американского общества афереза: восьмой специальный выпуск. J Clin Apher 2019;34:171–354.doi:10.1002/jca.21705
пмид: http://www.ncbi.nlm.nih.gov/pubmed/31180581  Thromb Haemost 2018;118:1612–24.doi:10.1055/s-0038-1668544
пмид: http://www.ncbi.nlm.nih.gov/pubmed/30112749
Thromb Haemost 2018;118:1612–24.doi:10.1055/s-0038-1668544
пмид: http://www.ncbi.nlm.nih.gov/pubmed/30112749 Шульце (HD и RD).
Шульце (HD и RD).