Рак наследственное заболевание или нет: Рак — это наследственное? Как узнать, что у меня его нет? Отвечаем на вопросы читателей «Медузы» об онкологических заболеваниях — Meduza
СМИ о нас
ГлавнаяПресс-центрСМИ о насСМИ о нас
Доктор Питер Как удалить хеликобактер пилори из организма, рассказала гастроэнтеролог Успенская
До 75% рака желудка и не менее 60% гастрита и язвенной болезни желудка связаны с хеликобактерной инфекцией
29.03.2023
МИР 24 От диагностики до роботов в операционной: медики представили свои наработки на форуме в Петербурге
Новые методы диагностики и лечения, современные технологии в медицине и профилактика заболеваний.
23.03.2023
DOCTORPITER Профессор НМИЦ онкологии назвала единственный способ поднять иммунитет для борьбы с опухолями
Ирина Балдуева рассказала о действии современных иммуноонкологических препаратов
02. 03.2023
03.2023
ГТРК «Санкт-Петербург» «Мифы о раке». Программа «Школа для родителей»
Г. В. Зиновьев, зав. отделением опухолей костей, мягких тканей и кожи НМИЦ имени Петрова в гостях Радио России
28.02.2023
Известия – IZ.RU Ученые разработали новый метод лечения саркомы у детей
Метод позволит повысить выживаемость пациентов на треть
28.02.2023
MR-7.ru В День детей, больных раком, маленьким пациентам Центра Петрова разрешили рисовать на стенах
Малыши и подростки раскрасили коридор
15. 02.2023
02.2023
МИР 24 Прививка от рака: как российские ученые создают индивидуальные противоопухолевые вакцины?
Такие вакцины могут спасти пациентов даже на терминальных стадиях
13.02.2023
ONCO TV Рак печени. Современные методы лечения: абляция, электропорация 07.02.2023
Радио России Почти две трети россиян – 68% – не считают нужным проходить профилактические обследования на предмет выявления онкологических заболеваний 07.02.2023
Вести.Ru Специалисты помогли пациенту с редким диагнозом победить рак и сохранить ногу
Алексею был необходим индивидуальный протез
04. 02.2023
02.2023
Известия Свет вместо скальпеля
Онколог Сергей Новиков — о развитии и перспективах лучевой терапии, а также о новых методах лечения рака
04.02.2023
Stimul.online Биобанкинг для антираковой вакциныУченые создали технологию получения индивидуальных клеточных вакцин против рака благодаря биобанку
31.01.2023
Газета.Ru Выделения из родинок, кровотечения, боли: как распознать у себя меланому
Онколог З.А. Раджабова рассказала, на какие родинки следует обратить внимание
24. 01.2023
01.2023
Доктор Питер Будто мошку вдохнул: в НМИЦ онкологии им. Н. Н. Петрова объяснили, как по кашлю отличить рак гортани
Кашель — вечный спутник простудных заболеваний — может быть и первым признаком рака гортани.
23.01.2023
ONCO TV Вакцина против рака. Иммунотерапия, перспективы лечения
Ирина Балдуева объяснила, при каких видах рака показана иммунотерапия, есть ли к ней противопоказания и какая эффективность у этого метода лечения
20.01.2023
Наследственные формы рака
Онкогеномика. Мастер-класс проф. Д.В. Залетаева
Классическим примером гена-супрессора, осуществляющего негативную регуляцию клеточного цикла, является ген RB1.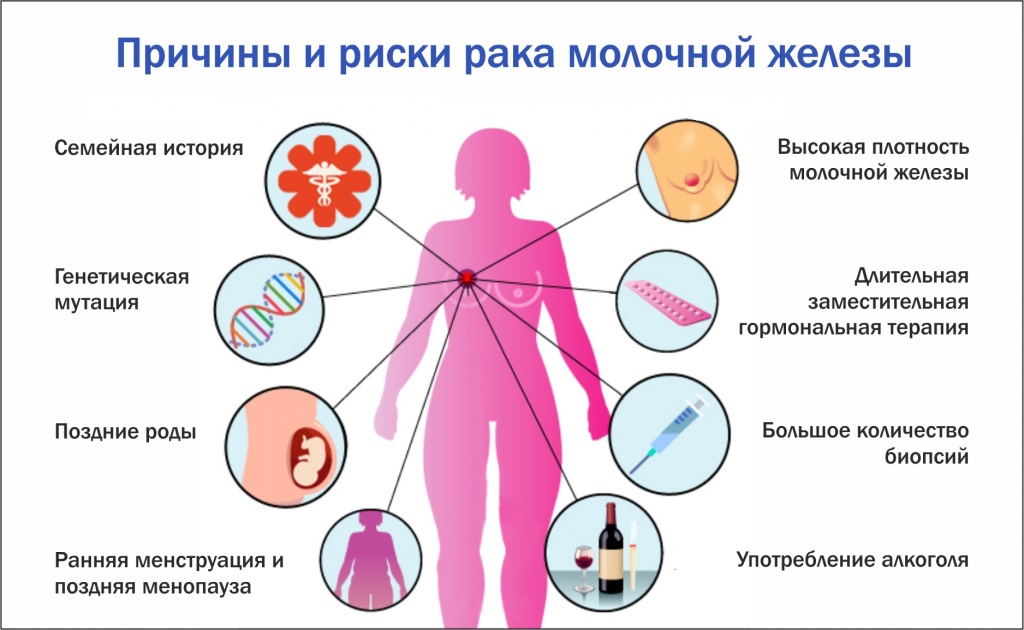 Наследственные формы рака молочной железы составляют около 5%. Мутации двух генов, BRCA1 и BRCA2, участвующих в репарации двухцепочечных разрывов, имеют практически равноценный вклад. Кроме рака молочной железы, герминальные мутации BRCA1 повышают риск возникновения рака яичников, а мутации BRCA2 предрасполагают к раку молочной железы у мужчин и раку поджелудочной железы. В то же время соматические мутации этих генов довольно редки при указанных новообразованиях. Спектр мутаций показывает, что их основная масса приводит к потери функции гена и представлена небольшими делециями и инсерциями, в том числе и в регуляторных областях генов. Две мутации BRCA1, 185delAG и 5382insC, составляют 20%, а мутации 617delT и 997del5 гена BRCA2 составляют почти 33%. Все мутации BRCA2, определяющие высокий риск развития рака яичников, локализуются в 3,3 т.п.н. экзона 11.
Наследственные формы рака молочной железы составляют около 5%. Мутации двух генов, BRCA1 и BRCA2, участвующих в репарации двухцепочечных разрывов, имеют практически равноценный вклад. Кроме рака молочной железы, герминальные мутации BRCA1 повышают риск возникновения рака яичников, а мутации BRCA2 предрасполагают к раку молочной железы у мужчин и раку поджелудочной железы. В то же время соматические мутации этих генов довольно редки при указанных новообразованиях. Спектр мутаций показывает, что их основная масса приводит к потери функции гена и представлена небольшими делециями и инсерциями, в том числе и в регуляторных областях генов. Две мутации BRCA1, 185delAG и 5382insC, составляют 20%, а мутации 617delT и 997del5 гена BRCA2 составляют почти 33%. Все мутации BRCA2, определяющие высокий риск развития рака яичников, локализуются в 3,3 т.п.н. экзона 11.
Наследственная форма неполипозного рака толстой кишки развивается в результате мутаций в генах MSh3 и MLh2, участвующих в образовании репарационных комплексов. Наиболее характерным признаком заболевания является нестабильность микросателлитных последовательностей. У женщин, имеющих герминальную мутацию в одном из этих генов, чаще всего возникают рак яичников и эндометрия. Среди мутаций MSh3 наиболее часто обнаруживается замена A→T в донорном сайте сплайсинга, приводящая к делеции 5 экзона. Для MLh2 преимущественного типа мутаций не показано, но установлено, что основным механизмом инактивации гена в опухолях является метилирование его промоторного района.
Наиболее характерным признаком заболевания является нестабильность микросателлитных последовательностей. У женщин, имеющих герминальную мутацию в одном из этих генов, чаще всего возникают рак яичников и эндометрия. Среди мутаций MSh3 наиболее часто обнаруживается замена A→T в донорном сайте сплайсинга, приводящая к делеции 5 экзона. Для MLh2 преимущественного типа мутаций не показано, но установлено, что основным механизмом инактивации гена в опухолях является метилирование его промоторного района.
Предрасположенность к возникновению ретинобластомы обусловлена герминальной мутацией в одном из аллелей гена RB1, передающейся потомству по аутосомно-доминантному типу наследования с варьированием экспрессивности и неполной (90%) пенетрантностью. Опухоль развивается при инактивации неповрежденного аллеля гена, происходящей с высокой вероятностью в клетках сетчатки у детей в раннем возрасте или даже внутриутробно. Так как мишенью возникновения второй мутации могут быть и другие соматические клетки, то у пациентов, несущих герминальную мутацию в RB1, существует большой риск развития таких опухолей, как остеосаркома, лимфолейкоз, МРЛ, РМЖ, опухоли половых органов, поэтому за больными с наследственной формой заболевания необходимо наблюдение. Соматические мутации гена вызывают только ретинобластому, хотя нарушения функции RB1 обнаруживают во многих других опухолях, но уже как вторичные, являющиеся признаком дестабилизации генома опухолевой клетки.
Так как мишенью возникновения второй мутации могут быть и другие соматические клетки, то у пациентов, несущих герминальную мутацию в RB1, существует большой риск развития таких опухолей, как остеосаркома, лимфолейкоз, МРЛ, РМЖ, опухоли половых органов, поэтому за больными с наследственной формой заболевания необходимо наблюдение. Соматические мутации гена вызывают только ретинобластому, хотя нарушения функции RB1 обнаруживают во многих других опухолях, но уже как вторичные, являющиеся признаком дестабилизации генома опухолевой клетки.
Наследственные формы меланомы, синдрома диспластического невуса и атипичных родинок в ряде случаев вызываются герминальными мутациями гена-супрессора CDKN2A/p16. В семьях, несущих мутацию CDKN2A, кроме меланомы обнаруживаются опухоли поджелудочной железы, ОГШ. В то же время функциональная и структурная инактивация гена, обеспечивающего негативную регуляцию клеточного цикла путем ингибирования циклин-зависимых киназ, обнаруживается в различных типах опухолей, но преимущественно в мезотелиомах, спорадических меланомах и глиобластомах. Почти треть соматических мутаций гена представлена делециями, в то время как среди герминальных мутаций делеции и инсерции составляют не более 5%.
Почти треть соматических мутаций гена представлена делециями, в то время как среди герминальных мутаций делеции и инсерции составляют не более 5%.
Нефробластома – генетически гетерогенное заболевание, но около трети случаев – результат инактивации гена-супрессора WT1.
Гемизиготные делеции хромосомного района 11p13 вызывают синдром WAGR, при котором кроме опухоли Вильмса обнаруживаются аномалии развития мочеполового тракта, аниридия и задержка физического и умственного развития.
Точковые мутации в 7-10 экзонах, кодирующих мотив цинковых пальцев, определяются у больных с синдромом Дениса-Драша, для которого характерна прогрессирующая нефропатия, псевдогермафродитизм, нефро— и гонадобластомы. Соматические точковые и структурные мутации гена выявлены в мезотелиомах, десмопластических мелко-кругло-клеточных опухолях и при острых лейкозах.
К хранителям клеточного цикла относятся оба гена NF1 и NF2, вызывающие нейрофиброматоз I и II типов, но выполняющие в геноме различную функцию. Первый обеспечивает негативную регуляцию онкогена Ras, второй стабилизирует клеточные контакты. Мутации и структурные перестройки первого гена вызывают шванномы периферической нервной системы, а второго – шванномы ЦНС и менингиомы. Изменений этих генов не обнаружено в опухолях другого происхождения.
Синдромы множественной эндокринной неоплазии I и II типов (МЭН 1, МЭН 2) возникают в результате мутаций в гене-супрессоре MEN1 и протоонкогене RET соответственно. В случае синдрома МЭН 1 могут развиваться карциноидные опухоли, ангиофибромы лица, липомы, коллагеномы, гастриномы и инсулиномы.
Герминальные миссенс-мутации RET выявлены у пациентов с синдромом МЭН 2A (медуллярный рак щитовидной железы, феохромоцитома, гиперплазия паращитовидных желез, ганглионейромы слизистой ротовой полости) и семейной формой медуллярного РЩЖ, причем мутации в основном затрагивают пять цистеиновых кодонов в 10 и 11 экзонах и на них приходится 97% и 85% всех мутаций в этих экзонах соответственно.
Спорадические мутации в тирозинкиназном домене гена более характерны для синдрома МЭН 2В, отличающегося от типа 2А более агрессивным течением и отсутствием гиперплазии паращитовидных желез и ганглионейром, а точковая мутация в экзоне 16 (T918C) была идентифицирована в 93% случаев.
Синдром фон Хиппель-Линдау наследуется аутосомно-доминантно с частотой 1 на 36 тыс. Среди злокачественных новообразований, являющихся диагностическим признаком и позволяющих выделить 4 типа заболевания, наиболее часто встречаются гемангиобластомы ЦНС, карциномы почки, феохромоцитомы и опухоли поджелудочной железы. При заболевании обнаруживаются мутации в гене VHL, клонированном в коротком плече хромосомы 3p25.5. Мутации представлены большими делециями, мутациями сдвига рамки считывания и миссенс-мутациями, повреждающими преимущественно 1 и 3 экзоны. Соматические мутации, повреждающие 1 и 2 экзоны гена, выявлены только в светлоклеточном раке почки. Почти в 20% опухолей обнаружено аномальное метилирование промоторной области гена.
Почти в 20% опухолей обнаружено аномальное метилирование промоторной области гена.
Семейный аденоматозный полипоз желудочно-кишечного тракта – аутосомно-доминантное заболевание, вызываемое мутациями в гене APC. Вариантом заболевания является синдром Гарднера, при котором преимущественно поражается толстый кишечник. При заболевании достаточно часто выявляются гепатоцеллюлярный рак, опухоли щитовидной железы, медуллобластомы, фибромы и другие опухоли. Основным типом мутаций являются делеции и нонсенс-мутации, приводящие к преждевременной терминации синтеза белка. Герминальные мутации преимущественно повреждают первую половину гена, причем обнаружено два «горячих» кодона – 1061 и 1309. Мутации последнего кодона приводят к раннему появлению полипов и быстрой малигнизации. Соматические мутации в основном локализуются в районе кодонов 1286-1513, с преимущественным повреждением кодонов 1309 и 1450.
Синдром Горлина или базально-клеточных невусов – редкое аутосомно-доминантное заболевание (частота 1:57000), возникает в результате мутаций в гене-супрессоре PTC1, представленных в 86% делециями и инсерциями, равномерно распределенными по длине гена. Проявляется множественными аномалиями развития, невусами и различными новообразованиями, наиболее частыми среди которых являются базально-клеточные рак кожи, медуллобластомы, астроцитомы, фибромы и аденокарциномы яичников. Во всех опухолях у синдромальных пациентов и в спорадических базально-клеточных карциномах обнаруживается потеря гетерозиготности по маркерам района хромосомы 9q22.3.
Проявляется множественными аномалиями развития, невусами и различными новообразованиями, наиболее частыми среди которых являются базально-клеточные рак кожи, медуллобластомы, астроцитомы, фибромы и аденокарциномы яичников. Во всех опухолях у синдромальных пациентов и в спорадических базально-клеточных карциномах обнаруживается потеря гетерозиготности по маркерам района хромосомы 9q22.3.
Целая группа синдромов – Ковдена, Банаяна-Зонана, Банаяна-Райли-Рувалкаба и часть случаев ювенильного полипоза характеризуется сходными фенотипическими аномалиями и предрасположенностью к злокачественным новообразованиям. Причиной всех заболеваний является патология гена-супрессора PTEN. У больных наиболее часто встречаются рак молочной железы, предстательной железы, яичников, эндометрия, щитовидной железы. Мутации равномерно повреждают весь ген и представляют полный спектр. Только при синдроме Ковдена установлено, что 43% мутаций повреждают 5 экзон, а в экзонах 1, 4 и 9 мутаций не описано. Соматические делеции и мутации PTEN обнаружены в глиобластомах, раках простаты, молочной железы и неходжкинских лимфомах.
Соматические делеции и мутации PTEN обнаружены в глиобластомах, раках простаты, молочной железы и неходжкинских лимфомах.
Герминальные миссенс-мутации гена-супрессора p53, участвующего в задержке клеточного цикла необходимой для репарации ДНК, приводят к довольно редкому синдрому Ли-Фраумени, при котором типичными являются опухоли мозга, саркомы костей и мягких тканей, лейкозы и РМЖ. Выявлена кластеризация мутаций в районе 14 кодонов (245-258). В то же время различные повреждения гена выявляют практически во всех типах опухолей. Частота миссенс-мутаций гена составляет 74%, сдвига рамки считывания – 11%, нонсенс-мутаций – 7%, мутаций сайта сплайсинга – 4%. Определено 7 «горячих» точек, повреждаемых мутациями: кодоны 130-142, 151-164, 171-181, 193-200, 213-223, 234-258 и 270-286, причем все они локализованы в эволюционно консервативном ДНК-связывающем домене, кодируемом экзонами 5-8. Мутации кодонов 157 и 179 наиболее часто выявляются при раке легкого, кодона 175 – при раке толстой кишки, кодона 248 – при плоскоклеточном раке головы и шеи, кодона 249 – при гепатоцеллюлярном раке и кодона 278 – при опухолях кожи.
Атаксия-телангиоэктазия – аутосомно-рецессивное заболевание, сопровождающееся ломкостью хромосом, причем ионизирующее излучение повышает нестабильность кариотипа. При заболевании наиболее часто обнаруживаются Т-клеточные лейкозы, В-лимфомы, медуллобластомы и глиомы. Причиной являются гомозиготные мутации или делеции гена ATM, регулирующего клеточный цикл, причем делеции составляют основную массу патологии. У гетерозиготных носителей герминальных мутаций часто возникают карциномы молочной железы. Основным типом являются мутации, приводящие к преждевременной терминации синтеза белка.
Недавно клонирован еще один ген, участвующий в репарации двухцепочечных разрывов ДНК. Герминальные мутации гена NBS1 приводят к синдрому Ниджмиген – очень редкому аутосомно-рецессивному заболеванию, основными признаками которого являются аномалии фенотипа, иммунодефицит, предрасположенность к возникновению опухолей (лимфома, лимфолейкоз, нейробластома) и нестабильность хромосом, чувствительных к ионизирующему излучению. Наиболее характерными мутациями гена являются делеции и инсерции, преимущественно повреждающие 6 и 7 экзоны, а мутация 675del5 выявлена у 90% пациентов.
Наиболее характерными мутациями гена являются делеции и инсерции, преимущественно повреждающие 6 и 7 экзоны, а мутация 675del5 выявлена у 90% пациентов.
Клонирование генов, вовлеченных в развитие наследственных онкологических заболеваний, практически полностью изменило тактику медико-генетического консультирования, определение конкретной мутации конкретного гена в семье позволяет эффективно проводить пренатальную диагностику.
Генетика рака — NCI
Является ли рак генетическим заболеванием?
Увеличить
Генетические изменения, вызывающие рак, могут передаваться по наследству или возникать в результате определенных воздействий окружающей среды. Генетические изменения также могут происходить из-за ошибок, возникающих при делении клеток.
Кредит: Национальный институт рака Да, рак — это генетическое заболевание. Это вызвано изменениями в генах, которые контролируют рост и размножение клеток. Клетки являются строительными блоками вашего тела. В каждой клетке есть копия ваших генов, которые действуют как руководство по эксплуатации.
Клетки являются строительными блоками вашего тела. В каждой клетке есть копия ваших генов, которые действуют как руководство по эксплуатации.
Гены — это участки ДНК, несущие инструкции по созданию белка или нескольких белков. Ученые обнаружили сотни ДНК и генетических изменений (также называемых вариантами, мутациями или изменениями), которые способствуют формированию, росту и распространению рака.
Генетические изменения, связанные с раком, могут возникать, потому что:
- случайных ошибок в нашей ДНК, когда наши клетки размножаются
- наша ДНК изменяется под воздействием канцерогенов в окружающей среде, таких как химические вещества в табачном дыме, ультрафиолетовые лучи солнца и вирус папилломы человека (ВПЧ)
- они были унаследованы от одного из наших родителей
Изменения ДНК, вызванные случайной ошибкой или канцерогеном, могут происходить на протяжении всей нашей жизни и даже в утробе матери. Хотя большинство генетических изменений сами по себе не вредны, накопление генетических изменений в течение многих лет может превратить здоровые клетки в раковые. Подавляющее большинство раковых заболеваний возникает случайно в результате этого процесса с течением времени.
Подавляющее большинство раковых заболеваний возникает случайно в результате этого процесса с течением времени.
Является ли рак наследственным?
Увеличить
Определение риска рака молочной железы: открытие генных мутаций BRCA1 и BRCA2 улучшило скрининг и принятие решений о лечении рака груди и яичников.
Рак сам по себе не может передаваться от родителей к детям. И генетические изменения в опухолевых клетках не могут передаваться по наследству. Но генетическое изменение, повышающее риск развития рака, может быть передано (унаследовано), если оно присутствует в родительской яйцеклетке или сперматозоидах.
Например, если родитель передает своему ребенку мутантный ген BRCA1 или BRCA2 , у ребенка будет гораздо более высокий риск развития рака молочной железы и некоторых других видов рака.
Вот почему иногда кажется, что рак передается по наследству. До 10% всех случаев рака могут быть вызваны наследственными генетическими изменениями.
До 10% всех случаев рака могут быть вызваны наследственными генетическими изменениями.
Наследование генетического изменения, связанного с раком, не означает, что вы обязательно заболеете раком. Это означает, что у вас повышен риск заболеть раком.
Что такое синдром семейного рака?
При некоторых семейных онкологических синдромах люди склонны к развитию рака в раннем возрасте или имеют другие нераковые состояния здоровья.
Например, семейный аденоматозный полипоз (САП) представляет собой семейный раковый синдром, вызванный определенными наследственными изменениями в гене APC . Люди с FAP имеют очень высокий риск развития колоректального рака в раннем возрасте, а также подвержены риску развития других видов рака.
Но не все виды рака, которые, по-видимому, «передаются по наследству», вызваны семейными синдромами рака. Общая среда или привычки, такие как воздействие загрязненного воздуха или употребление табака, могут стать причиной развития одного и того же вида рака у членов семьи.
Кроме того, у нескольких членов семьи могут случайно развиться распространенные виды рака, такие как рак предстательной железы. Рак также может передаваться в семье, если члены семьи имеют комбинацию многих генетических вариантов, каждый из которых имеет очень небольшой риск развития рака.
Должен ли я пройти генетическое тестирование на риск развития рака?
Определенные генетические тесты могут показать, унаследовали ли вы генетическое изменение, повышающее риск развития рака. Это исследование обычно проводится с небольшим образцом крови, но иногда его можно проводить со слюной, клетками изнутри щеки или клетками кожи.
Генетические тесты могут помочь семьям с раком груди и яичников в анамнезе принять решение о скрининге и лечении.
Не всем нужно проходить генетическое тестирование на риск развития рака. Ваш врач или поставщик медицинских услуг может помочь вам решить, следует ли вам пройти тестирование на генетические изменения, повышающие риск развития рака. Они, вероятно, спросят, есть ли у вас определенные особенности в вашей личной или семейной истории болезни, такие как рак в необычно молодом возрасте или несколько родственников с таким же видом рака.
Если ваш врач рекомендует генетическое тестирование, беседа с консультантом-генетиком поможет вам оценить потенциальные риски, преимущества и недостатки генетического тестирования в вашей ситуации. После тестирования консультант по генетическим вопросам, врач или другой медицинский работник, прошедший подготовку в области генетики, может помочь вам понять, что результаты теста означают для вас и членов вашей семьи.
Хоть и можно заказать генетический тест на дому самостоятельно, эти тесты имеют много недостатков и , а не обычно рекомендуется как способ узнать, унаследовали ли вы генетическое изменение, которое увеличивает риск развития рака.
Для получения дополнительной информации о том, какие тесты доступны и кто может захотеть их рассмотреть, см. Генетическое тестирование синдромов наследственной предрасположенности к раку.
Как узнать, какие генетические изменения связаны с моим раком?
Если у вас рак, другой тип генетического теста, называемый биомаркерным тестом, может выявить генетические изменения, которые могут вызывать рост вашего рака. Эта информация может помочь вашим врачам решить, какая терапия лучше всего подходит для вас, или можете ли вы зарегистрироваться в конкретном клиническом испытании. Для получения дополнительной информации см. Тестирование биомаркеров для лечения рака. Тестирование биомаркеров также может называться профилированием опухоли или молекулярным профилированием.
Тестирование биомаркеров отличается от генетического тестирования, которое используется, чтобы выяснить, есть ли у вас наследственное генетическое изменение, повышающее вероятность развития рака. Тестирование биомаркеров проводится с использованием образца ваших раковых клеток — либо небольшого кусочка опухоли, либо образца вашей крови.
Тестирование биомаркеров проводится с использованием образца ваших раковых клеток — либо небольшого кусочка опухоли, либо образца вашей крови.
В некоторых случаях результаты теста на биомаркеры могут свидетельствовать о том, что у вас есть наследственная мутация, повышающая риск развития рака. Если это произойдет, вам может потребоваться пройти еще один генетический тест, чтобы подтвердить, действительно ли у вас есть унаследованная мутация, которая увеличивает риск развития рака.
Кто может видеть результаты моего генетического теста?
Ваш консультант-генетик, врачи и другие медицинские работники могут ознакомиться с результатами вашего генетического теста. Кроме того, ваша медицинская страховая компания имеет законный доступ к вашим медицинским записям.
Средства правовой защиты предотвращают дискриминацию на основании результатов генетических тестов, включая Закон о недискриминации генетической информации от 2008 года (GINA) и Правило конфиденциальности Закона о переносимости и подотчетности медицинской информации от 19 года. 96 (ХИПАА).
96 (ХИПАА).
Как генетические изменения вызывают рак?
Исследованиепомогает объяснить, как формируется рак яичников
Полученные данные потенциально могут помочь врачам обнаружить рак раньше.
Генетические изменения могут привести к раку, если они изменят способ роста и распространения ваших клеток. Большинство изменений ДНК, вызывающих рак, происходят в генах, которые являются участками ДНК, содержащими инструкции по созданию белков или специализированных РНК, таких как микроРНК.
Например, некоторые изменения ДНК повышают уровень белков, которые заставляют клетки продолжать расти. Другие изменения ДНК снижают уровень белков, которые сообщают клеткам, когда им следует прекратить рост. А некоторые изменения в ДНК останавливают белки, которые приказывают клеткам самоуничтожаться, когда они повреждены.
Ученые считают, что для того, чтобы здоровая клетка превратилась в раковую, должно произойти более одного изменения ДНК. Людям, унаследовавшим связанные с раком генетические изменения, требуется меньше дополнительных изменений для развития рака. Однако они могут никогда не развить эти изменения или заболеть раком.
Людям, унаследовавшим связанные с раком генетические изменения, требуется меньше дополнительных изменений для развития рака. Однако они могут никогда не развить эти изменения или заболеть раком.
По мере того как раковые клетки делятся, со временем они приобретают все больше изменений ДНК. Две раковые клетки в одной и той же опухоли могут иметь разные изменения ДНК. Кроме того, каждый больной раком имеет уникальную комбинацию изменений ДНК при раке.
Для получения дополнительной информации о биологических изменениях, которые делают клетки раковыми, см. Что такое рак? Различия между раковыми клетками и нормальными клетками.
Какие виды генетических изменений вызывают рак?
Увеличить
Белки слияния, которые могут возникать при соединении частей разных хромосомных областей, могут способствовать развитию многих видов рака у детей.
Авторы и права: Шеннон МакАрдел, доктор философии. Блог Гарвардского университета SITN, июнь 2017 г. CC BY-NC-SA 4.0.
Блог Гарвардского университета SITN, июнь 2017 г. CC BY-NC-SA 4.0.
Несколько видов генетических изменений могут привести к раку. Одно генетическое изменение, называемое мутацией ДНК или генетическим вариантом, представляет собой изменение кода ДНК, подобное опечатке в последовательности букв ДНК.
Некоторые варианты затрагивают только одну букву ДНК, называемую нуклеотидом. Нуклеотид может отсутствовать или быть заменен другим нуклеотидом. Такие мутации называются точечными.
Например, около 5% людей с раком имеют точечную мутацию в гене KRAS , которая заменяет букву ДНК G на A. Это изменение одной буквы создает аномальный белок KRAS, который постоянно заставляет клетки расти.
Генетические изменения, вызывающие рак, также могут происходить, когда сегменты ДНК, иногда очень большие, перестраиваются, удаляются или копируются. Они называются хромосомными перестройками.
Например, большинство хронических миелогенных лейкозов (разновидность рака крови) вызываются хромосомной перестройкой, при которой часть 9Ген 0035 BCR рядом с геном ABL . Эта перестройка создает аномальный белок, называемый BCR-ABL, который заставляет клетки лейкемии бесконтрольно расти.
Эта перестройка создает аномальный белок, называемый BCR-ABL, который заставляет клетки лейкемии бесконтрольно расти.
Некоторые вызывающие рак изменения ДНК происходят вне генов, в участках ДНК, которые действуют как переключатели «вкл» или «выкл» для близлежащих генов. Например, некоторые раковые клетки головного мозга имеют несколько копий «включателей» рядом с генами, которые управляют ростом клеток.
Другие изменения ДНК, известные как эпигенетические изменения, также могут вызывать рак. В отличие от генетических вариантов, эпигенетические изменения (иногда называемые эпимутациями) могут быть обратимыми и не влияют на код ДНК. Вместо этого эпигенетические изменения влияют на то, как ДНК упаковывается в ядро. Изменяя способ упаковки ДНК, эпигенетические изменения могут изменить количество белка, производимого геном.
Некоторые вещества и химические вещества в окружающей среде, которые вызывают генетические изменения, могут также вызывать эпигенетические изменения, например, табачный дым, тяжелые металлы, такие как кадмий, и вирусы, такие как вирус Эпштейна-Барр.
семейных раковых синдромов | Американское онкологическое общество
Когда в семье происходит изменение гена, которое значительно увеличивает риск развития рака, его часто называют семейным раковым синдромом . Другие термины, которые вы можете услышать, включают синдром наследственного рака 9.0082 или синдром генетического рака .
Важно понимать, что не каждый рак, который, как кажется, встречается в семье, вызван синдромом семейного рака. Примерно у каждого третьего человека в Соединенных Штатах в течение жизни разовьется рак, поэтому нередки случаи, когда в семье бывает много больных раком. Иногда рак может быть более распространенным в определенных семьях, потому что члены семьи разделяют определенное поведение или воздействия, которые повышают риск рака, например курение, или из-за других факторов, которые могут иметь место в некоторых семьях, таких как ожирение.
Но иногда рак может быть вызван аномальным геном, который передается из поколения в поколение. Хотя эти виды рака часто называют унаследованными видами рака, на самом деле наследуется аномальный ген, который может привести к раку, а не сам рак. Известно, что только от 5% до 10% всех видов рака тесно связаны с дефектами генов (так называемые мутации ), унаследованными от родителей.
Хотя эти виды рака часто называют унаследованными видами рака, на самом деле наследуется аномальный ген, который может привести к раку, а не сам рак. Известно, что только от 5% до 10% всех видов рака тесно связаны с дефектами генов (так называемые мутации ), унаследованными от родителей.
Чтобы узнать о роли генов и о том, как мутации могут привести к раку, см. раздел Гены и рак.
Как распознать унаследованный или семейный раковый синдром?
Определенные факторы повышают вероятность того, что рак в семье вызван семейным раковым синдромом, например:
- Многие случаи одного и того же типа рака (особенно если это необычный или редкий тип рака)
- Рак, возникающий в более молодом возрасте, чем обычно (например, рак толстой кишки у 20-летнего человека)
- Более одного типа рака у одного человека (например, у женщины с раком груди и яичников)
- Рак, поражающий оба органа (например, оба глаза, обе почки или обе груди)
- Более одного детского рака у братьев и сестер (например, саркома у брата и сестры)
- Рак, поражающий половые органы, обычно не поражаемые (например, рак молочной железы у мужчин)
- Рак, возникающий во многих поколениях (например, у дедушки, отца и сына)
При попытке определить, может ли быть рак в вашей семье, сначала соберите некоторую информацию. Для каждого случая рака см.:
Для каждого случая рака см.:
- У кого рак? Как вы связаны? На какой стороне семьи они (матери или отца)?
- Какой это тип рака? Это редко?
- Сколько лет было этому родственнику, когда ему поставили диагноз?
- Был ли у этого человека более одного типа рака?
- Были ли у них какие-либо известные факторы риска для их типа рака (например, курение для рака легких)?
- Проходил ли генетическое тестирование кто-либо в семье с раком или без него? , и показало ли это тестирование какие-либо аномальные гены?
Рак у близкого родственника, например, у родителя или брата или сестры (брата или сестры), скорее всего, вызовет у вас беспокойство, чем рак у более дальнего родственника. Даже если рак у дальнего родственника был вызван генной мутацией, вероятность того, что аномальный ген будет передан вам, меньше, чем у более близкого родственника.
Также важно рассматривать каждую сторону семьи отдельно. Наличие двух родственников, больных раком, вызывает больше беспокойства, если они находятся на одной стороне семьи. Например, если оба родственника являются братьями вашей матери (поскольку у них одни и те же гены), более важно, чем если бы один был братом вашего отца, а другой – братом вашей матери.
Наличие двух родственников, больных раком, вызывает больше беспокойства, если они находятся на одной стороне семьи. Например, если оба родственника являются братьями вашей матери (поскольку у них одни и те же гены), более важно, чем если бы один был братом вашего отца, а другой – братом вашей матери.
Тип рака тоже имеет значение. Более тревожно, если у многих родственников один и тот же тип рака, чем если у них несколько разных видов рака. Тем не менее, при некоторых семейных синдромах рака существует повышенный риск различных видов рака. Например, риск рака молочной железы и рака яичников повышен (а также некоторых других видов рака) в семьях с наследственным синдромом рака молочной железы и яичников. Риск рака толстой кишки и эндометрия повышен при синдроме Линча (также известном как наследственный неполипозный колоректальный рак или HNPCC).
Точно так же более одного случая одного и того же редкого рака вызывает больше беспокойства, чем случаи более распространенного рака. Для некоторых редких видов рака риск синдрома семейного рака относительно высок даже в одном случае.
Для некоторых редких видов рака риск синдрома семейного рака относительно высок даже в одном случае.
Также важен возраст человека, у которого был диагностирован рак. Например, рак толстой кишки редко встречается у людей моложе 30 лет. Наличие у близких родственников моложе 30 лет рака толстой кишки может быть признаком семейного синдрома рака. С другой стороны, рак предстательной железы очень часто встречается у пожилых мужчин, поэтому, если и у вашего отца, и у его брата был обнаружен рак предстательной железы, когда им было за 80, это менее вероятно, что это связано с наследственным раковым синдромом.
Некоторые виды доброкачественных (не раковых) опухолей и заболеваний иногда также являются частью синдрома семейного рака. Например, люди с множественной эндокринной неоплазией, синдромом II типа (МЭН II) имеют высокий риск развития определенного типа рака щитовидной железы. У них также могут развиться доброкачественные опухоли паращитовидных желез, а также опухоли в надпочечниках, называемые феохромоцитомами, которые обычно являются доброкачественными.
Если у многих родственников один и тот же тип рака, важно отметить, может ли рак быть связан с фактором риска, таким как курение. Например, рак легких обычно вызывается курением, поэтому наличие нескольких случаев рака легких в семье, где все курят, скорее всего, связано с курением, а не с наследственным или семейным раковым синдромом.
Примеры семейных раковых синдромов
Существует много семейных раковых синдромов. Некоторые из них кратко обсуждаются здесь в качестве примеров, но это не полный список. Ознакомьтесь с нашей информацией о конкретных типах рака, чтобы узнать больше об их возможных причинах.
Синдром наследственного рака груди и яичников (HBOC)
В семьях с синдромом наследственного рака груди и яичников (HBOC) есть члены семьи, у которых развился рак груди и/или рак яичников. Часто эти виды рака обнаруживаются у женщин моложе обычного возраста, и у некоторых женщин может быть более одного вида рака (например, рак молочной железы в обеих грудях или рак молочной железы и яичников).
Чаще всего HBOC вызывается наследственной мутацией либо в ген BRCA1 или BRCA2 . Некоторые семьи имеют HBOC на основании истории рака, но не имеют мутаций ни в одном из этих генов. Ученые полагают, что могут быть и другие гены, которые могут вызывать HBOC, но пока неизвестные.
Риск рака молочной железы и яичников очень высок у женщин с мутациями BRCA1 или BRCA2 . Этот синдром также может привести к раку фаллопиевых труб, первичному раку брюшины, раку молочной железы у мужчин, раку поджелудочной железы и раку предстательной железы, а также некоторым другим заболеваниям. У некоторых людей может быть более одного рака. Например, у женщины может быть рак обеих грудей или рак молочной железы и яичников, а у мужчины может быть рак поджелудочной железы и простаты. Рак молочной железы у мужчин, рак поджелудочной железы и рак предстательной железы могут наблюдаться при мутациях в обоих генах, но чаще встречаются у людей с Мутации BRCA2 . В США мутации в генах BRCA чаще встречаются у людей еврейского происхождения ашкенази, чем у населения в целом.
В США мутации в генах BRCA чаще встречаются у людей еврейского происхождения ашкенази, чем у населения в целом.
Женщины с сильным семейным анамнезом рака молочной железы и/или рака яичников могут выбрать генетическое консультирование, чтобы оценить риск наличия у них мутации в одном из генов BRCA . Специалист-генетик может оценить риск на основе истории рака человека, истории рака в его семье и других факторов. Если у них высокий риск, они могут пройти тестирование на Мутации BRCA (см. Общие сведения о генетическом тестировании рака). При наличии мутации BRCA у женщины высок риск развития рака молочной железы и рака яичников (а также некоторых других видов рака). Затем она может подумать о том, чтобы предпринять шаги для раннего обнаружения рака с помощью скрининговых тестов и снизить риск заболеть раком.
Поскольку рак молочной железы у мужчин встречается редко, мужчинам с этим раком часто предлагают генетическое консультирование и тестирование на мутации BRCA . Имея BRCA 9Мутация 0036 также может влиять на риск возникновения у мужчин некоторых других видов рака, таких как рак предстательной железы и поджелудочной железы. Близким родственникам мужчины также может быть полезно знать, что у него есть мутация и что они могут подвергаться риску.
Имея BRCA 9Мутация 0036 также может влиять на риск возникновения у мужчин некоторых других видов рака, таких как рак предстательной железы и поджелудочной железы. Близким родственникам мужчины также может быть полезно знать, что у него есть мутация и что они могут подвергаться риску.
Если у кого-то есть мутация BRCA , это означает, что его близкие родственники (родители, братья, сестры и дети) также имеют 50-процентную вероятность наличия мутации. Эти родственники могут захотеть пройти тестирование на мутацию или даже без тестирования могут захотеть начать скрининг на определенные виды рака на ранней стадии или принять другие меры предосторожности, чтобы снизить риск развития рака.
HBOC — не единственный семейный раковый синдром, который может вызывать рак молочной железы или яичников. Для получения информации о других генах и синдромах, повышающих риск этих видов рака, см. Рак груди и рак яичников.
Синдром Линча (наследственный неполипозный колоректальный рак)
Наиболее распространенным наследственным раковым синдромом, повышающим риск развития рака толстой кишки, является синдром Линча, также называемый наследственным неполипозным колоректальным раком (HNPCC). Люди с этим синдромом подвержены высокому риску развития колоректального рака. Эти виды рака чаще развиваются в более раннем возрасте, часто до 50 лет.
Люди с этим синдромом подвержены высокому риску развития колоректального рака. Эти виды рака чаще развиваются в более раннем возрасте, часто до 50 лет.
Синдром Линча также приводит к высокому риску развития рака эндометрия (рак слизистой оболочки матки), а также рака яичников, желудка, тонкой кишки, поджелудочной железы, почек, головного мозга, кожи, молочной железы, предстательной железы, мочеточников ( трубки, несущие мочу из почек в мочевой пузырь), и желчные протоки.
Синдром Линча вызывается мутацией в любом из нескольких генов восстановления несоответствия (MMR), включая MLh2 , MSh3 , MSH6 , PMS2 и EPCAM. Обычно эти гены участвуют в восстановлении поврежденной ДНК. Когда один из этих генов не работает, в ДНК клеток могут возникать ошибки, которые могут привести к мутациям других генов и, в конечном итоге, к раку.
Врачи и специалисты-генетики могут проверить наличие у вас синдрома Линча на основании вашей личной и семейной истории рака, используя определенные критерии, известные как Амстердамские критерии, и пересмотренные рекомендации Bethesda. Они подробно обсуждаются в разделе «Генетическое тестирование, скрининг и профилактика для людей с сильным семейным анамнезом колоректального рака». Мутации в генах, которые вызывают синдром Линча, затем можно проверить с помощью генетического тестирования.
Они подробно обсуждаются в разделе «Генетическое тестирование, скрининг и профилактика для людей с сильным семейным анамнезом колоректального рака». Мутации в генах, которые вызывают синдром Линча, затем можно проверить с помощью генетического тестирования.
Людям с колоректальным раком, раком эндометрия или другим раком, связанным с синдромом Линча, раковые клетки можно проверить на микросателлитную нестабильность (MSI). Наличие MSI означает, что один из генов MMR, вероятно, не работает должным образом. Наличие нормальных результатов (отсутствие изменений генов MSI или MMR) предполагает, что у человека, вероятно, нет синдрома Линча. Но если тесты MSI показывают, что некоторые гены MMR не работают, у человека может быть синдром Линча, и его следует направить на генетическое консультирование и возможное тестирование. Для получения дополнительной информации о генетическом тестировании см. раздел Что нужно знать перед прохождением генетического тестирования? .
Людям, о которых известно, что они являются носителями генной мутации, связанной с синдромом Линча, может быть рекомендовано начать скрининг колоректального рака в более молодом возрасте (например, в возрасте 20 лет) или принять другие меры, чтобы попытаться снизить риск развития колоректального рака. (более подробно обсуждается в Колоректальный рак). Женщинам с синдромом Линча может быть рекомендовано начать скрининг на рак эндометрия или предпринять другие шаги, чтобы попытаться снизить риск этого рака. Более подробно они обсуждаются в разделе «Рак эндометрия».
(более подробно обсуждается в Колоректальный рак). Женщинам с синдромом Линча может быть рекомендовано начать скрининг на рак эндометрия или предпринять другие шаги, чтобы попытаться снизить риск этого рака. Более подробно они обсуждаются в разделе «Рак эндометрия».
Если у кого-то есть синдром Линча, это означает, что его близкие родственники (родители, братья, сестры и дети) также имеют 50%-й шанс иметь вызывающую его мутацию. Они могут захотеть пройти тестирование или даже без тестирования начать раннее обследование на определенные виды рака или принять другие меры предосторожности, чтобы снизить риск развития рака.
Синдром Ли-Фраумени
Синдром Ли-Фраумени (также называемый синдромом рака молочной железы, лейкемии и надпочечников [SBLA])
это редкий наследственный синдром, который может привести к повышенному риску развития ряда видов рака, включая саркому (например, остеосаркому и саркому мягких тканей), лейкемию, рак головного мозга (центральной нервной системы), рак коры надпочечников и рак молочной железы. . Эти виды рака часто развиваются у относительно молодых людей или даже у детей.
. Эти виды рака часто развиваются у относительно молодых людей или даже у детей.
У людей с синдромом Ли-Фраумени может развиться более одного вида рака в течение жизни. У них также более высокий риск заболеть раком в результате радиационного облучения, поэтому врачи, лечащие таких пациентов, могут по возможности избегать лучевой терапии.
Этот синдром чаще всего вызывается унаследованными мутациями в гене TP53 , который является геном-супрессором опухоли. Нормальный ген TP53 производит белок, который помогает остановить рост аномальных клеток.
Если у кого-то есть синдром Ли-Фраумени, его близкие родственники (особенно их дети) также имеют повышенный риск наличия мутации. Близкие родственники могут захотеть пройти тестирование, или даже без тестирования они могут захотеть начать скрининг на определенные виды рака как можно раньше или принять другие меры предосторожности, чтобы снизить риск развития рака.
Другие семейные раковые синдромы
Вы можете узнать больше о семейных синдромах рака, перечисленных выше, а также о других наследственных синдромах и генных мутациях, которые могут повлиять на риск развития рака у человека, прочитав:
- Генетическое консультирование и тестирование на риск рака молочной железы: синдром наследственного рака молочной железы и яичников (HBOC), Мутации BRCA1 и BRCA2 , и другие специфические генные мутации
- Генетическое тестирование, скрининг и профилактика для людей с сильным семейным анамнезом колоректального рака: синдром Линча, семейный аденоматозный полипоз (САП) и другие специфические генные мутации
- Генетическое консультирование и тестирование людей с высоким риском развития меланомы: специфические генные мутации
- Факторы риска рака яичников: наследственный синдром рака молочной железы и яичников (HBOC), синдром Линча, синдром Пейтца-Егерса, MUTYH-ассоциированный полипоз, мутации BRCA1 и BRCA2 , и другие специфические мутации генов
- Факторы риска ретинобластомы: наследственная ретинобластома
- Факторы риска развития рака почки: болезнь Гиппеля-Линдау, синдром Каудена, синдром Берта-Хогга-Дюба (BHD)
- Факторы риска сарком мягких тканей: нейрофиброматоз, туберозный склероз, синдром Горлина
Генетическое консультирование и тестирование
Люди с сильным семейным анамнезом рака могут захотеть узнать больше о своих генах.
