Расшифровка онкологического диагноза: Как расшифровать диагноз “рак” правильно? Примеры расшифровки онкологических кодов гистологии
Определение стадии рака по системе TNM
Стадирование опухоли основано на трех критериях: глубина врастания опухоли в стенку кишки (Т), наличие распространения опухолевых клеток по лимфатическим узлам (N) и, наконец, наличие или отсутствие метастазов (M). Эти три составляющих образуют систему TNM для стадирования колоректального рака (см. таблицы ниже).
Стадия Т (tumor) – глубина врастания опухоли в стенку кишки. Чем меньше значение это стадии, тем менее инвазивный рост опухоли. Опухоль стадии Т0 можно еще считать достаточно доброкачественной, так как рост этой опухоли ограничен только слизистой оболочкой кишки. Опухоль стадии Т4 обозначает то, что опухоль проросла не только все слои кишечной стенки, но и соседние с ней органы.
Стадия N (lymphnodes) – обозначает количество лимфатических узлов, в которых были обнаружены раковые клетки. Стадия N0 обозначает, что при патологоанатомическом исследовании ни в одном из лимфатических узлов не были обнаружены клетки рака.
Стадия М (metastases) – обозначает, имеются ли у опухоли отдаленные отсевы – метастазы.
Стадия опухоли по системе TNM
| T | N | M |
| is – рост опухоли в пределах слизистой | 0 – нет данных за поражение лимфатических узлов | 0 – нет данных за наличие отдаленных метастазов |
| 1 опухоль врастает, но не прорастает подслизистый слой кишки | 1 поражение от 1 до 3 лимфатических узлов | 1 наличие отдаленных метастазов опухоли |
| 2 опухоль врастает, но не прорастает мышечный слой кишки | 2 поражение больше, чем 3 лимфатических узлов | х неизвестно, имеются ли метастазы |
| 3 опухоль прорастает через мышечный слой в окружающие ткани | х неизвестно, поражены ли лимфатические узлы | |
| 4 опухоль врастает в окружающие органы |
Общая стадия опухоли
| T | N | M | |
|---|---|---|---|
| Стадия | 1,2 | 0 | 0 |
| Стадия | 3,4 | 0 | 0 |
| Стадия | Любая | 1,2 | 0 |
| Стадия | Любая | Любая | 1 |
 В каждом столбце имеются цифры или слово «любая». Вторая строка в таблице соответствует стадии I, в столбцах имеются следующие данные: стадия Т 1 или 2, стадии Nи M – 0. Это означает, что если опухоль врастает только в стенку кишки (стадия Т1 или Т2) и ни в одном лимфоузле нет раковых клеток (стадия N0), и нет отдаленных метастазов (стадия M0), то опухоль будет классифицироваться, как рак I стадии. Опухоль, которая прорастает через кишечную стенку (стадия Т3 или T4), но при этом нет пораженных лимфатических узлов и отдаленных метастазов, имеет стадию II, и так далее.
В каждом столбце имеются цифры или слово «любая». Вторая строка в таблице соответствует стадии I, в столбцах имеются следующие данные: стадия Т 1 или 2, стадии Nи M – 0. Это означает, что если опухоль врастает только в стенку кишки (стадия Т1 или Т2) и ни в одном лимфоузле нет раковых клеток (стадия N0), и нет отдаленных метастазов (стадия M0), то опухоль будет классифицироваться, как рак I стадии. Опухоль, которая прорастает через кишечную стенку (стадия Т3 или T4), но при этом нет пораженных лимфатических узлов и отдаленных метастазов, имеет стадию II, и так далее.Стадирование играет очень важную роль для определения тактики лечения. Для лечения опухолей I стадии обычно достаточно только хирургической операции, а опухоли III стадии обычно лечат, применяя и операцию, и химиотерапию. Таким образом, стадирование опухоли – это очень важный этап предоперационной диагностики. Для того, чтобы определить стадию до операции, может потребоваться выполнение многих исследований. Компьютерная томография (КТ), рентген грудной клетки, ультразвуковое исследование (УЗИ), магнитно-резонансная томография (МРТ) и позитронно-эмиссионная томография (ПЭТ) являются очень информативными исследованиями, помогающими определить степень распространения опухоли.
Очень важно, чтобы пациенты понимали принципы определения стадии опухоли, и имели представление о том, как это делается, чтобы грамотно обсуждать варианты и прогноз лечения с врачом.
Ученые «расшифровали» раковые клетки и обещают революцию в лечении. Суть открытия в 100 и 500 словах
- Николай Воронин
- Корреспондент по вопросам науки
Автор фото, Science Photo Library
Международная команда ученых впервые полностью расшифровала генетическую информацию 38 видов раковых клеток, составив исчерпывающий каталог мутаций ДНК, приводящих к развитию онкологических заболеваний.
Беспрецедентное по масштабу исследование «Анализ полного генома всех видов рака» (PCAWG) заняло более 10 лет. В работе приняли участие около 1300 генетиков из 37 стран, а ее результаты были опубликованы в четверг сразу в двух десятках научных журналов.
В работе приняли участие около 1300 генетиков из 37 стран, а ее результаты были опубликованы в четверг сразу в двух десятках научных журналов.
По словам самих ученых, причины возникновения рака можно сравнить с пазлом, состоящим из 100 тысяч кусочков. До сегодняшнего дня мы пытались собрать общую картину, имея на руках лишь каждый сотый фрагмент, и лишь теперь можем взглянуть на нее целиком.
«С помощью собранной информации о происхождении и развитии опухолей мы можем разработать новые способы ранней диагностики рака, более направленные методы терапии — и лечить пациентов с большим успехом», — заявил член координационного комитета PCAWG Линкольн Стайн.
Русская служба Би-би-си коротко (в 100 словах) и чуть подробнее (в 500 словах) объясняет, в чем суть этой беспрецедентной работы и как она может произвести революцию в онкологии.
Причина любого рака — мутации в ДНК. Однако ученым мало известно о том, где именно и почему происходит поломка генетического кода, ведущая к возникновению раковой опухоли.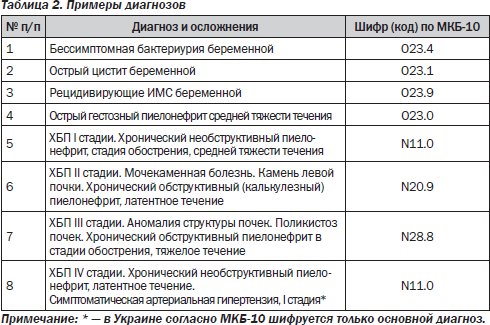
Участники проекта PCAWG полностью расшифровали генетическую информацию раковых клеток почти 2800 пациентов, страдающих от 38 разных видов онкологических заболеваний.
Автор фото, Getty Images
В результате было сделано несколько десятков открытий — от количества и точного расположения так называемых драйверных мутаций (то есть ведущих к развитию опухоли) до неожиданных генетических совпадений у раковых клеток различных тканей.
В том числе выяснилось, что предрасположенность к некоторым видам рака может сформироваться за несколько десятилетий до постановки диагноза — иногда в детском возрасте.
Рак — это не одно заболевание, возникающее в разных органах, а общее название для двух сотен различных болезней, протекающих по одной и той же схеме. Одна из клеток ткани мутирует — и начинает быстро и бесконтрольно делиться, формируя опухоль.
Поломка происходит на генном уровне, но до сегодняшнего дня, пытаясь понять ее возможные причины, ученые в основном анализировали лишь «полезную ДНК» — ту часть генома, в которой закодированы белки и которая составляет лишь около 2% всей наследственной информации.
Оставшаяся часть генетического кода, известная как «мусорная ДНК», не вызывала особого интереса, поскольку заключенная в ней информация не отвечает за производство белков — строительных материалов клетки — и вообще долгое время считалась рудиментарной (то есть накопившейся в процессе эволюции, но утратившей полезные функции).
Термин «мусорная ДНК» был введен около 50 лет назад и позже признан не вполне корректным, когда обнаружилось, что некоторые фрагменты «бесполезного» генома выполняют другие важнейшие функции для поддержания жизни клетки.
Было решено расшифровать генетическую информацию раковых клеток целиком, чтобы отследить и изменения в некодирующих генах.
Автор фото, Getty Images
В результате ученые обнаружили тысячи генетических мутаций и описали более 80 процессов, ведущих к поломке генетического кода. Одни из них вызваны возрастными изменениями, другие передаются по наследству, третьи могут быть связаны с вредными привычками или диетой.
Одно из главных открытий состоит в том, что один и тот же вид рака могут вызывать абсолютно разные наборы мутаций. В клетках рака легких было обнаружено до 100 тысяч мутировавших генов, а в некоторых образцах детского рака мутации можно было пересчитать по пальцам.
«Самое удивительное открытие — это то, насколько сильно раковый геном одного пациента отличается от генома раковых клеток другого», — заявил член координационного комитета PCAWG Питер Кэмпбелл.
Однако были выявлены и неожиданные совпадения — например, одна и та же драйверная мутация может привести к развитию рака груди у женщин или рака простаты у мужчин. А значит, методы лечения, разработанные для рака груди, могут оказаться эффективными и в лечении рака простаты.
Некоторые сделанные открытия дают возможность значительно более ранней диагностики заболевания — в частности, выяснилось, что некоторые виды рака начинают формироваться на генетическом уровне задолго до развития опухоли, иногда за несколько лет или даже десятилетий.
«Это показывает, что у нас есть намного больше возможностей раннего вмешательства [в ситуацию], чем мы думали раньше», — уверяет Кэмпбелл.
Кроме того, составленный по итогам исследования каталог мутаций поможет избежать постановки неверного диагноза, что иногда случается из-за совпадения симптомов разных видов заболевания.
Однако в 5% образцов раковых клеток вообще не было выявлено драйверных мутаций — а это значит, что точное место критической поломки генетического кода еще предстоит установить.
«Если мы поймем, что происходит с нашими здоровыми органами по мере старения, что заставляет мутации накапливаться, почему некоторые клоны бесконечно размножаются, а некоторые угасают, как на этот баланс влияет образ жизни — тогда мы сможем придумать способы раннего вмешательства, чтобы предотвратить или замедлить развитие неизлечимых видов рака», — заключает профессор Кэмпбелл.
Диагностика
Мне поставили диагноз РМЖ.
 Я умру?
Я умру? Современные методы позволяют добиться отличных результатов даже в тех случаях, которые еще 10 лет назад считались неизлечимыми. Эффективность терапии зависит от стадии заболевания, вида рака (биологического подтипа опухоли), общего состояния здоровья пациентки. Чем раньше начато лечение, тем больше шансов на успех.
Конечно, такой диагноз выбивает из привычной жизни. Но обращение в специализированное медицинское учреждение, соблюдение плана обследования и лечение — самое важное с момента возникновения подозрения на онкологическое заболевание. Ни в коем случае не обращайтесь к знахарям или народным целителям. Не теряйте времени зря! Только комплексное лечение, включающее операцию, курсы химио- (лекарственной) и/или лучевой терапии, может гарантировать успех.
Мне поставили диагноз РМЖ. Это может быть ошибкой?
Вероятность ошибки существует.
Это может зависеть от того, какие проведены исследования и на основании чего выставлен диагноз. Окончательно диагноз рака молочной железы ставят на основании цитологического и гистологического исследования ткани опухоли в патоморфологической лаборатории специализированного медицинского учреждения. Выявление опухолевых образований при маммографии или УЗИ молочной железы требует обязательного дополнительного обследования.
Но ошибка все-таки возможна. Стекла с образцами могут перепутать, при биопсии могут взять кусочек ткани не с того участка, да и патоморфолог может ошибиться.
Чтобы избежать неправильного диагноза и, как следствие, некорректного лечения, необходимо показать гистологические блоки второму специалисту.
Любые решения, связанные со здоровьем, нужно принимать только после того, как вы узнаете все возможное о своем диагнозе, прогнозах и доступных методах лечения.
Как убедиться в правильности диагноза?
Диагноз «рак молочной железы» устанавливают после проведения комплексного обследования.
На первом этапе оно может включать маммографию, УЗИ молочной железы и лимфоузлов, дополнительно может быть назначена компьютерная томография или магнитно-резонансная томография. В зависимости от результатов проводят биопсию опухоли и (или) лимфоузлов. При этой процедуре забирают образец ткани опухоли для дальнейшего гистологического и при необходимости иммуногистохимического исследования, а полученный из лимфоузла материал — для цитологического исследования. Эти исследования должны выявить наличие раковых клеток и установить их вид (биологический подтип), и именно эти результаты позволяют поставить точный диагноз.
Чтобы избежать неправильного диагноза и, как следствие, некорректного лечения, необходимо показать гистологические блоки второму специалисту.Как проводят диагностику?
При выявлении уплотнения или образования в груди при самообследовании или на врачебном осмотре обязательно проводят маммографию, УЗИ молочных желез.
В некоторых случаях, возможно, сразу направят на МРТ молочных желез.
При проведении УЗИ и МРТ проверяют лимфатические узлы (подмышечные, под- и надключичные). Если результаты подтверждают наличие опухоли или обнаружены изменения в лимфатических узлах, врач проведет биопсию опухоли и лимфоузлов, чтобы точно поставить диагноз.
Биопсия — это процедура забора ткани из опухоли или из лимфоузла для дальнейшего исследования. Из опухоли материал берут с помощью специальной иглы, которая позволяет взять фрагмент ткани или жидкости для исследования.
На гистологическом исследовании ткани опухоли будут изучать под микроскопом, чтобы выяснить, злокачественная она или нет. Если подозрение подтвердится, потребуется сделать иммуногистохимическое исследование, чтобы узнать конкретный подвид опухоли.
Что такое уточняющая диагностика после постановки диагноза?
Если диагноз подтвердится, могут потребоваться дополнительные лабораторные анализы, а в некоторых случаях — рентгенологические или радиоизотопные исследования, чтобы оценить распространенность опухолевого процесса и выбрать оптимальную тактику лечения.
Это могут быть анализы крови, включая биохимию, КТ грудной или брюшной полости, сцинтиграфию костей. Один из самых современных методов — ПЭТ-КТ.
В некоторых случаях нужно провести генетический анализ, чтобы выявить наличие мутации генов ДНК BRCA.
Таким образом, для получения точного диагноза и подбора индивидуальной программы лечения необходимо не только выявить опухоль и оценить ее размеры, но и установить вид раковых клеток, определить их гистохимические характеристики, выяснить, вовлечены ли в процесс региональные лимфоузлы и есть ли отдаленные метастазы.
Каковы симптомы рака?
Прежде всего надо подчеркнуть, что на самых ранних стадиях симптомов скорее всего вообще нет.А именно на ранних стадиях наиболее высоки шансы на полное излечение и удается удалить опухоль, сохранив молочную железу.
Именно поэтому женщинам после 50 лет рекомендуют проводить маммографию регулярно, а более молодым, но имеющим повышенный риск развития опухоли, — УЗИ или МРТ молочной железы.
К врачу надо идти и при изменении формы молочной железы, появлении непривычного дискомфорта или болезненности, локальном шелушении или воспалении кожи, изменении формы соска (втяжение вглубь железы или, наоборот, припухлость или увеличение в размере), изменении кожи над железой (если появилась бугристость, изменились цвет, толщина, температура кожного покрова), необычных выделениях из соска и безболезненном увеличении подмышечных лимфоузлов.
В запущенных случаях могут проявляться общие симптомы злокачественного новообразования — выраженная слабость, бледность, боли в костях, потеря веса.
Я живу в регионе, надо ли мне ехать на лечение в Москву?
Необходимости ехать обязательно в Москву нет. Но к выбору центра, в котором проходить все обследования, а затем и лечиться, стоит подойти очень серьезно.Нужно узнать именно про специализированное медицинское учреждение онкологического профиля: какие исследования они проводят, делают ли иммуногистохимические исследования, какие оперативные методики, какие программы лучевой терапии выполняют.
Сейчас во многих городах есть очень квалифицированные врачи и учреждения оснащенные по последнему слову медицины. Узнайте, что делают в вашем городе или в соседнем. Ищите медицинский центр, в котором есть не только квалифицированные специалисты (химиотерапевты, хирурги, лучевые терапевты), но и все необходимое оборудование.
Посмотрите информацию в интернете, поговорите с врачами. Возможно, все необходимое есть по соседству, и вы легко сможете получить второе мнение, проверить стекла или сделать дополнительное исследование.
Слышала о высоком проценте ошибки при цитологии и гистологии, иммуногистохимии. Это правда?
Получение точного результата при исследовании биопсийного материала чрезвычайно важно.Без гистологического подтверждения не ставят диагноз злокачественного новообразования (его только предполагают), а без проведения иммуногистохимического анализа нельзя судить о типе опухолии соответственно правильно определить тактику лечения. Это сложные методики и выполняются они в специализированных лабораториях.
Это сложные методики и выполняются они в специализированных лабораториях.
В небольших населенных пунктах их могут просто не проводить. Следовательно, материал будут пересылать в другие учреждения.
И, к сожалению, ошибки при выполнении этих исследований случаются. Стекла с образцами могут перепутать, при биопсии могут взять кусочек ткани не с того участка, да и патоморфолог может ошибиться. Чтобы избежать неправильного диагноза и, как следствие, некорректного лечения, нужно постараться найти специализированный онкологический медицинский центр, имеющий патоморфологическую лабораторию. Если есть возможность, важно показать гистологические блоки второму специалисту.
Как понять, что лаборатории и клинике можно доверять?
Вызывающая доверие клиника будет выполнять различные типы операций (в том числе сохраняющие молочную железу) и будет иметь не только квалифицированных специалистов (химиотерапевтов, хирургов, лучевых терапевтов), но и все необходимое оборудование, специализированное отделение лучевой терапии с современными аппаратами для дистанционной радиотерапии.
Это позволит свести возможность ошибки к минимуму. Да и лечение в таком центре будет соответствовать современным стандартам. Конечно, лучше выбрать тот, который расположен максимально близко к месту жительства. Туда можно и переслать стекла, если исследование уже было проведено, чтобы свести возможность ошибки к минимуму. Стекла нужно обязательно сохранять. Но и затягивать с началом лечения из-за чрезмерного контроля над результатами исследований тоже не нужно.
Время, затраченное на перепроверку, может обойтись очень дорого: лечение не следует откладывать.
Какие виды обследования бесплатны, а какие не входят в ОМС?
Граждане РФ должны получать лечение онкологических заболеваний бесплатно, так как оно входит в программу обязательного медицинского страхования.Большинство исследований также должно быть проведено бесплатно: УЗИ, маммография, МРТ, КТ, анализы крови и биопсия с последующим исследованием полученного материала (включая иммуногистохимические). ПЭТ-КТ и генетическое обследование на мутацию BRСA входят в эту программу.
ПЭТ-КТ и генетическое обследование на мутацию BRСA входят в эту программу.
Если время ожидания высокотехнологичных исследований достаточно велико и у вас есть возможность, можно получить эти услуги и платно, однако выбирать место, где вы сделаете это за деньги и почти без очереди, также надо очень внимательно.
Это должно быть специализированное учреждение, в котором есть отделения по лечению и диагностике злокачественных новообразований.
МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: V РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
V РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
ДИАГНОСТИКА РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Р.А. Керимов
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Реальный путь улучшения результатов лечения опухолей молочных желез — ранняя, а в ряде случаев, доклиническая диагностика. Решить эту проблему можно только при условии применения комплексных методов диагностики.
Диагностика рака молочной железы состоит из двух этапов: первичная и уточненная диагностика. К первичной диагностике относятся самообследование пациенток и индивидуальный осмотр врачами различных специальностей. При изучении анамнеза необходимо выяснить сроки появления первых признаков заболевания и темп их развития. Дисгормональные гиперплазии, послеродовые маститы и травмы, первичное бесплодие, раннее начало менструаций и позднее наступление менопаузы, позднее начало половой жизни и ее нерегулярность, первые роды в зрелом возрасте, отягощенная наследственность, гинекологические заболевания, гипотиреоз, ожирение играют значительную роль в развитии рака молочной железы.
При самообследовании и осмотре следует обращать внимание на симметричность, размеры и форму молочных желез, уровень стояния сосков, деформации молочной железы, состояние кожи, соска и ареолы молочной железы. Наличие втяжения соска, его деформации, мацерация или эрозия соска и ареолы (при раке Педжета), кровянистые выделения из соска, наличие деформации молочной железы, втяжения кожи на различных участках молочной железы (симптом «умбиликации»), частичный или тотальный отек кожи (симптом «лимонной» или «апельсинной корки»), гиперемия ее, уплотнение ткани молочной железы (инфильтрация) должны сразу же насторожить саму пациентку или врача на предмет наличия злокачественной опухоли молочной железы. Осмотр следует проводить при опущенных руках, затем при отведенных руках и руках, закинутых за голову.
Осмотр следует проводить при опущенных руках, затем при отведенных руках и руках, закинутых за голову.
Вслед за осмотром производится пальпация, причем следует одинаково тщательно прощупывать обе молочные железы, а не только железу с выявленными при осмотре изменениями, так как весьма нередки случаи двухстороннего поражения молочных желез раком. Вначале ощупывают молочные железы в положении стоя. Изучают состояние сосков и ареол, утолщение или уплотнение, наличие или отсутствие выделений из сосков, их характер. Особенное внимание следует обратить на кровянистые выделения из соска, которые являются патогномоничным симптомом для внутрипротоковой папилломы и рака молочной железы. Осторожно собирая кожу молочной железы в складки, выявляют наличие либо отсутствие кожных симптомов — патологической морщинистости, «площадки» или умбиликации. После поверхностной пальпации более глубоко изучают состояние молочных желез. При этом ткань молочных желез последовательно захватывают между пальцами во всех отделах, а также производят исследование кончиками пальцев. Это дает возможность выявить ограниченный участок уплотнения или опухоль в молочной железе. При обнаружении уплотнения или опухоли этот участок молочной железы придавливают ладонью к грудной стенке (удобнее при этом стоять позади больной). Если уплотнение не исчезает, это свидетельствует о наличии рака или фиброаденомы (симптом Кенига). В положении больной стоя определяются форма, размеры, консистенция, поверхность, отношение опухоли к окружающим тканям, ее подвижность, болезненность.
Это дает возможность выявить ограниченный участок уплотнения или опухоль в молочной железе. При обнаружении уплотнения или опухоли этот участок молочной железы придавливают ладонью к грудной стенке (удобнее при этом стоять позади больной). Если уплотнение не исчезает, это свидетельствует о наличии рака или фиброаденомы (симптом Кенига). В положении больной стоя определяются форма, размеры, консистенция, поверхность, отношение опухоли к окружающим тканям, ее подвижность, болезненность.
После исследования в вертикальном положении больную следует уложить на кушетку и повторить осмотр в положении на спине и на боку в той же последовательности. Уменьшение или исчезновение уплотнения в молочной железе свидетельствуют о его доброкачественной природе (симптом Кенига). Смещение опухоли вслед за соском при потягивании за последний говорит о злокачественной природе опухоли (симптом Прибрама).
После тщательного исследования молочных желез производятся осмотр и пальпация регионарных зон (подмышечных, надключичных и подключичных областей) с обеих сторон с целью выявления возможно существующих метастазов в лимфатические узлы.
В первичной диагностике рака молочной железы следует помнить о нескольких его клинических формах: узловая, диффузная и болезнь Педжета. Наиболее часто встречается узловая форма опухоли, которая может быть уницентрической (наличие одного узла в молочной железе) и мультицентрической (наличие двух и более узлов). Для этой формы характерны наличие четко определяемого узла (узлов) в молочной железе, как правило, безболезненного, плотная консистенция опухоли, ограниченная подвижность или неподвижность опухоли в молочной железе, нечеткие контуры опухоли, патологическая морщинистость или втяжение кожи над опухолью, определяемые при сдвигании кожи над узлом. В подмышечной области с той же стороны могут пальпироваться один или несколько плотных подвижных лимфатических узлов округлой формы. В более поздних стадиях могут иметь место втяжение и фиксация соска, определяемая на глаз умбиликация кожи над опухолью, явления лимфостаза, т.е. симптом «лимонной корки» над опухолью или за ее пределами, изъязвление или прорастание кожи опухолью, утолщение соска и складки ареолы (симптом Краузе), уменьшение или увеличение размеров молочной железы, подтягивание ее вверх, фиксация к грудной стенке. При этом могут отмечаться боли в молочной железе. В подмышечной области — большие неподвижные лимфатические узлы, которые могут сливаться между собой в массивные конгломераты.
При этом могут отмечаться боли в молочной железе. В подмышечной области — большие неподвижные лимфатические узлы, которые могут сливаться между собой в массивные конгломераты.
Диффузный рак объединяет отечно-инфильтративную, панцирную, рожеподобную и маститоподобную формы. Эти формы характеризуются быстрым развитием процесса как в самой молочной железе, так и в окружающих тканях, обширным лимфогенным и гематогенным метастазированием, чрезвычайной злокачественностью, крайне плохим прогнозом. Из всех диффузных форм наиболее торпидно протекает панцирный рак.
Отечно-инфильтративный рак встречается чаще в молодом возрасте, нередко при беременности и лактации. Характеризуется диффузным уплотнением части, а иногда и всей ткани молочной железы. Кожа молочной железы, сосок и ареола пастозны и отечны, выражены гиперемия и симптом «лимонной корки». Пальпируется инфильтрат без четких контуров, занимающий большую часть или всю молочную железу. Отек обусловливается блокадой лимфатических путей самой молочной железы метастатическими эмболами или их сдавлением опухолевым инфильтратом. Отечно-инфильтративный рак следует дифференцировать от узловой формы рака молочной железы, сопровождающейся значительным вторичным лимфостазом, обусловленным метастазами в регионарных зонах.
Отечно-инфильтративный рак следует дифференцировать от узловой формы рака молочной железы, сопровождающейся значительным вторичным лимфостазом, обусловленным метастазами в регионарных зонах.
Панцирный рак характеризуется опухолевой инфильтрацией как самой ткани молочной железы, так и покрывающей ее кожи. Иногда процесс выходит за пределы молочной железы и распространяется на грудную стенку, противоположную молочную железу. Кожа становится плотной, плохо смещаемой, может быть пигментирована. Характерны множественные внутрикожные опухолевые узлы, некоторые из них могут изъязвляться и покрываться корочками. Молочная железа сморщивается, подтягивается кверху, уменьшается в размерах.
Рожеподобный рак сопровождается выраженной гиперемией кожи с неровными, языкообразными краями, которые могут распространяться на кожу грудной стенки. Кожа железы покрыта красными пятнами, что обусловлено распространением опухолевых клеток по капиллярам и лимфатическим сосудам (карциноматозный лимфангит). Чаще заболевание протекает остро, с высокой температурой (39-40°С). Эта форма рака плохо поддается лечению. Еще более бурным течением характеризуется маститоподобная форма рака, при котором молочная железа значительно увеличена в размерах, напряжена, плотная, ограниченно подвижна, выражены гиперемия и гипертермия кожи. В глубине железистой ткани пальпируются диффузные уплотнения. Процесс распространяется быстро, часто сопровождается лихорадкой.
Чаще заболевание протекает остро, с высокой температурой (39-40°С). Эта форма рака плохо поддается лечению. Еще более бурным течением характеризуется маститоподобная форма рака, при котором молочная железа значительно увеличена в размерах, напряжена, плотная, ограниченно подвижна, выражены гиперемия и гипертермия кожи. В глубине железистой ткани пальпируются диффузные уплотнения. Процесс распространяется быстро, часто сопровождается лихорадкой.
Диффузные формы рака, особенно воспалительные, следует дифференцировать от острых форм мастита.
Болезнь Педжета составляет до 5 % всех случаев рака молочной железы. Начинается с покраснения и утолщения соска, появления сухих и мокнущих корочек и струпиков. При их отпадении обнаруживается влажная, зернистая поверхность. В процесс медленно вовлекается ареола. Постепенно сосок уплощается, изъязвляется, процесс распространяется за пределы ареолы на кожу молочной железы. Одновременно идет распространение опухоли по протокам вглубь молочной железы. Рак Педжета характеризуется относительно торпидным течением и относительно благоприятным прогнозом. Следует дифференцировать с псориазом или экземой соска.
Рак Педжета характеризуется относительно торпидным течением и относительно благоприятным прогнозом. Следует дифференцировать с псориазом или экземой соска.
Таким образом, первичная диагностика клинических форм рака молочной железы при внимательной и тщательной трактовке выявленных изменений позволяет у большинства больных поставить правильный диагноз. Однако в ряде случаев, правильная клиническая оценка диагноза бывает затруднена. В этом случае на помощь клиницисту приходят инструментальные и лабораторные методы исследования, то есть проводится уточняющая диагностика.
Одним из ведущих методов диагностики различных форм рака молочной железы является рентгенологическое исследование — маммография. Исследование проводят в двух проекциях: прямой и боковой. При маммографии различают первичные и вторичные признаки злокачественности. Первичными и основными рентгенологическими признаками рака молочной железы является наличие опухолевой тени и микрокальцинатов. Наиболее четко тень опухоли дифференцируется у женщин старшей возрастной группы на фоне инволютивно измененной ткани молочной железы. Тень опухоли, как правило, неправильной, звездчатой или амебовидной формы, с неровными нечеткими контурами, характерной радиарной тяжистостью. Очень часто опухолевый узел сопровождается «дорожкой» к соску и втяжением последнего, утолщением кожи железы, иногда с ее втяжением. Однако следует отметить, что некоторые формы ограниченно растущего узлового рака (медуллярный, слизистый) могут давать на маммограммах округлую овальную тень с четкими, но полициклическими контурами, а иногда и без таковых. В этих случаях весьма затруднена дифференциальная диагностика между раком, фиброаденомами, и ограниченно растущими саркомами молочной железы.
Наиболее четко тень опухоли дифференцируется у женщин старшей возрастной группы на фоне инволютивно измененной ткани молочной железы. Тень опухоли, как правило, неправильной, звездчатой или амебовидной формы, с неровными нечеткими контурами, характерной радиарной тяжистостью. Очень часто опухолевый узел сопровождается «дорожкой» к соску и втяжением последнего, утолщением кожи железы, иногда с ее втяжением. Однако следует отметить, что некоторые формы ограниченно растущего узлового рака (медуллярный, слизистый) могут давать на маммограммах округлую овальную тень с четкими, но полициклическими контурами, а иногда и без таковых. В этих случаях весьма затруднена дифференциальная диагностика между раком, фиброаденомами, и ограниченно растущими саркомами молочной железы.
Одним из наиболее достоверных и ранних признаков рака является наличие микрокальцинатов, являющихся отображением отложения солей в стенке протока. Иногда микрокальцинаты являются единственным рентгенологическим проявлением раннего рака молочной железы. Обычно микрокальцинаты имеют мелкоклеточный характер (размерами <1 мм), напоминая песчинки. Чем их больше и чем они мельче, тем больше вероятность рака. Микрокальцинаты могут встречаться и при мастопатии и даже в норме, однако, их характер значительно отличается от вышеописанного: их немного, они значительно крупнее (> 3-5 мм.), более бесформенные и глыбчатые.
Обычно микрокальцинаты имеют мелкоклеточный характер (размерами <1 мм), напоминая песчинки. Чем их больше и чем они мельче, тем больше вероятность рака. Микрокальцинаты могут встречаться и при мастопатии и даже в норме, однако, их характер значительно отличается от вышеописанного: их немного, они значительно крупнее (> 3-5 мм.), более бесформенные и глыбчатые.
К вторичным (косвенным) рентгенологическим признакам рака молочной железы относят симптомы со стороны кожи, соска, окружающей ткани молочной железы, усиление васкуляризации и т.д.
Несмотря на эффективность рентгенологического метода, разрешающая способность маммографии у ряда больных резко снижается: при выраженных диффузных формах мастопатии, у молодых пациенток с плотными молочными железами, при наличии имплантатов, выраженных воспалительных изменениях, отеке железы и фоновых заболеваниях типа фиброаденоматоза. В этом случае на помощь врачу приходит ультразвуковое исследование (УЗИ) молочных желез. УЗИ — абсолютно безвредный метод исследования, что позволяет применять его многократно в процессе мониторинга и скрининга. При УЗИ опухоль выявляется в виде гиперэхогенной зоны округлой формы с неровными контурами. Однако в самостоятельном виде УЗИ обладает сравнительно низкой информативностью, особенно при минимальных размерах опухоли, поэтому его следует применять в комплексе с другими методами диагностики, особенно у молодых женщин с плотными молочными железами и выраженными фоновыми заболеваниями.
УЗИ — абсолютно безвредный метод исследования, что позволяет применять его многократно в процессе мониторинга и скрининга. При УЗИ опухоль выявляется в виде гиперэхогенной зоны округлой формы с неровными контурами. Однако в самостоятельном виде УЗИ обладает сравнительно низкой информативностью, особенно при минимальных размерах опухоли, поэтому его следует применять в комплексе с другими методами диагностики, особенно у молодых женщин с плотными молочными железами и выраженными фоновыми заболеваниями.
Высоко информативным и быстро развивающимся методом диагностики является радиоизотопное исследование молочных желез — сцинтимаммография. Метод основан на избирательной способности радиофармпрепарата (РФП) 99mTc-SestaMIBI и его производных накапливаться в повышенных по сравнению со здоровыми тканями количествах в злокачественных опухолях, причем концентрация РФП одинакова в первичных опухолях и в регионарных метастазах. В ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России используется отечественный РФП Технетрил-99mTc. На сцинтимаммограммах злокачественные опухоли, а также метастазы проявляются в виде очагов гиперфиксации РФП. На процесс накопления РФП не влияют размеры опухоли, состояние ткани молочных желез, фоновые заболевания. При сцинтимаммографии возможно выявление непальпируемых опухолей, мультицентричности роста, опухолей малых размеров, а также возможно одновременное выявление регионарных метастазов.
На сцинтимаммограммах злокачественные опухоли, а также метастазы проявляются в виде очагов гиперфиксации РФП. На процесс накопления РФП не влияют размеры опухоли, состояние ткани молочных желез, фоновые заболевания. При сцинтимаммографии возможно выявление непальпируемых опухолей, мультицентричности роста, опухолей малых размеров, а также возможно одновременное выявление регионарных метастазов.
В последнее время весьма широко используется метод СВЧ-радиотермосканирования (СВЧ-РТС) молочных желез, основанный на оценке градиента температуры ткани на глубине 7-14 см в дециметровом диапазоне волн. В формировании диагностической картины патологического очага лежит не количественное соотношение нормальной и патологической ткани, а качественные изменения, за счет которых и происходит изменение разности температур, связанное с формированием новой сосудистой сети, усилением метаболического обмена при злокачественных новообразованиях. При злокачественных опухолях интегральная температура резко возрастает и достоверно отличается от показателей при доброкачественных опухолях и дисгормональных гиперплазиях. СВЧ-РТС молочных желез обладает высокой чувствительностью и специфичностью, абсолютно безвредно, занимает минимум времени и может широко использоваться при массовых профосмотрах, а также в процессе мониторинга за леченными больными.
СВЧ-РТС молочных желез обладает высокой чувствительностью и специфичностью, абсолютно безвредно, занимает минимум времени и может широко использоваться при массовых профосмотрах, а также в процессе мониторинга за леченными больными.
Такие методы исследования как инфракрасная термография молочных желез, изотопная диагностика с помощью радиоактивного фосфора 32P, прямая цветная лимфография, радиоизотопная лимфосцинтиграфия, диафаноскопия молочных желез не получили широкого применения из-за сравнительно низкой диагностической эффективности.
Весьма перспективным и высокоинформативным методом диагностики является магнитно-резонансная томография (МРТ), однако из-за высокой дороговизны исследования у нас в стране она не получила широкого распространения.
И, наконец, завершающим этапом уточняющей диагностики является морфологическое (цитологическое и/или гистологическое) исследование. Морфологическая верификация рака необходима при любом подозрении на злокачественный процесс в молочной железе. Материал для цитологического исследования получают при пункции опухоли, выделениях из соска, соскобе с соска при раке Педжета. Цитологическое исследование позволяет верифицировать диагноз у 90% больных. Однако в 1,5-9,6% случаев отмечаются ошибки в цитологической диагностике. Тогда на помощь приходит гистологическое исследование, материал для которого получают при трепанобиопсии опухоли или секторальной резекции молочной железы. Это наиболее точный метод диагностики рака молочной железы. Практически во всех клиниках гистологическое исследование наиболее точно верифицирует истинную природу заболевания. Показаниями к гистологическому исследованию являются: отсутствие цитологической верификации рака, подозрение на злокачественное новообразование, выявление на маммограммах непальпируемых новообразований, подозрительных на рак.
Материал для цитологического исследования получают при пункции опухоли, выделениях из соска, соскобе с соска при раке Педжета. Цитологическое исследование позволяет верифицировать диагноз у 90% больных. Однако в 1,5-9,6% случаев отмечаются ошибки в цитологической диагностике. Тогда на помощь приходит гистологическое исследование, материал для которого получают при трепанобиопсии опухоли или секторальной резекции молочной железы. Это наиболее точный метод диагностики рака молочной железы. Практически во всех клиниках гистологическое исследование наиболее точно верифицирует истинную природу заболевания. Показаниями к гистологическому исследованию являются: отсутствие цитологической верификации рака, подозрение на злокачественное новообразование, выявление на маммограммах непальпируемых новообразований, подозрительных на рак.
Таким образом, диагностика рака молочной железы, хотя и не представляет значительных трудностей, должна строиться на всесторонней и полной оценке всех клинических, лабораторных, инструментальных и морфологических данных, что позволит выработать адекватную лечебную тактику и максимально улучшит непосредственные и отдаленные результаты терапии.
Ученые оценили методы исследования опухолей при раке молочной железы
https://ria.ru/20200826/bfu-1576303595.html
Ученые оценили методы исследования опухолей при раке молочной железы
Ученые оценили методы исследования опухолей при раке молочной железы — РИА Новости, 26.08.2020
Ученые оценили методы исследования опухолей при раке молочной железы
Ученые Балтийского федерального университета им. И. Канта (БФУ им. И. Канта) определили, при каких видах опухолей рака молочной железы больше подходит… РИА Новости, 26.08.2020
2020-08-26T09:00
2020-08-26T09:00
2020-08-26T09:00
наука
балтийский федеральный университет
навигатор абитуриента
университетская наука
рак груди
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/07e4/08/19/1576303560_0:158:3077:1889_1920x0_80_0_0_a3dd58f5c33d975b258064c0989efe55.jpg
МОСКВА, 26 авг — РИА Новости. Ученые Балтийского федерального университета им. И. Канта (БФУ им. И. Канта) определили, при каких видах опухолей рака молочной железы больше подходит визуальный или цифровой метод исследования; это поможет врачам выбрать оптимальный способ лечения. Результаты исследования опубликованы в научном журнале «Акушерство и гинекология».Количественная оценка маркера пролиферации Ki-67, который отражает интенсивность деления опухолевых клеток и скорость роста опухоли, имеет крайне важное значение для больных раком при многих онкопатологиях, в том числе и при раке молочной железы у женщин. Точное определение этого показателя необходимо для назначения адекватной терапии и прогноза онкологического заболевания. Величины Ki-67 в нормальной ткани молочной железы обычно не превышают 5%. При раке молочной железы они имеют разные значения: встречаются опухоли с низкими показателями и относительно благоприятным прогнозом – Ki-67 менее порогового значения 14%. В других опухолях этот показатель может превышать 14-20%, а в отдельных случаях – достигать 80-90%.
Ученые Балтийского федерального университета им. И. Канта (БФУ им. И. Канта) определили, при каких видах опухолей рака молочной железы больше подходит визуальный или цифровой метод исследования; это поможет врачам выбрать оптимальный способ лечения. Результаты исследования опубликованы в научном журнале «Акушерство и гинекология».Количественная оценка маркера пролиферации Ki-67, который отражает интенсивность деления опухолевых клеток и скорость роста опухоли, имеет крайне важное значение для больных раком при многих онкопатологиях, в том числе и при раке молочной железы у женщин. Точное определение этого показателя необходимо для назначения адекватной терапии и прогноза онкологического заболевания. Величины Ki-67 в нормальной ткани молочной железы обычно не превышают 5%. При раке молочной железы они имеют разные значения: встречаются опухоли с низкими показателями и относительно благоприятным прогнозом – Ki-67 менее порогового значения 14%. В других опухолях этот показатель может превышать 14-20%, а в отдельных случаях – достигать 80-90%. На сегодняшний день существует проблема определения уровня экспрессии Ki-67. Показатель варьируется при подсчете в различных лабораториях, в зависимости от методики проведения иммуногистохимической реакции для его выявления, а также от используемых реагентов и метода подсчета. В то же время, точный подсчет показателя определяет постановку правильного диагноза и назначение соответствующего лечения. Поэтому так важно унифицировать методику определения Ki-67.Традиционный, визуальный метод оценки уровня пролиферации состоит в том, что врач-патоморфолог при помощи микроскопа исследует микропрепараты опухоли после их специального иммуногистохимического окрашивания. Этот метод не всегда достаточно эффективен и может быть связан с субъективным фактором. Поэтому большие надежды ученые возлагают на цифровую микроскопию, которая позволяет провести объективную морфологическую диагностику. Исследователи Лаборатории иммуногистохимической, патологоанатомической и клинической диагностики БФУ им. И. Канта провели сравнительный анализ традиционного способа визуальной количественной оценки маркера Ki-67 врачом-патоморфологом и методики с использованием цифровой микроскопии в клетках рака молочной железы у пациенток Калининградской области.
На сегодняшний день существует проблема определения уровня экспрессии Ki-67. Показатель варьируется при подсчете в различных лабораториях, в зависимости от методики проведения иммуногистохимической реакции для его выявления, а также от используемых реагентов и метода подсчета. В то же время, точный подсчет показателя определяет постановку правильного диагноза и назначение соответствующего лечения. Поэтому так важно унифицировать методику определения Ki-67.Традиционный, визуальный метод оценки уровня пролиферации состоит в том, что врач-патоморфолог при помощи микроскопа исследует микропрепараты опухоли после их специального иммуногистохимического окрашивания. Этот метод не всегда достаточно эффективен и может быть связан с субъективным фактором. Поэтому большие надежды ученые возлагают на цифровую микроскопию, которая позволяет провести объективную морфологическую диагностику. Исследователи Лаборатории иммуногистохимической, патологоанатомической и клинической диагностики БФУ им. И. Канта провели сравнительный анализ традиционного способа визуальной количественной оценки маркера Ki-67 врачом-патоморфологом и методики с использованием цифровой микроскопии в клетках рака молочной железы у пациенток Калининградской области. При оценке показателя Ki-67 врачом подсчет проводится в так называемых «горячих точках», т.е. в участках опухоли с максимально выраженной пролиферативной активностью. Подсчет с помощью цифровой микроскопии проводится в выбранных врачом идентичных по площади участках ткани, т.е. используется несколько иной принцип подсчета. Ученые пришли к выводу, что цифровая микроскопия более эффективна в однородных по строению тканях, а в опухолях с относительно низким уровнем пролиферации, различающихся по строению, предпочтителен традиционный метод исследования опытным патоморфологом.Полученные данные стали одним из результатов многолетних исследований методом цифровой микроскопии с использованием программного обеспечения QuantCenter 3DHISTECH. Этот метод продемонстрировал высокую эффективность оценки экспрессии Ki-67 при раке молочной железы. Научный коллектив планирует продолжить исследования максимально идентичных участков опухоли, что особенно важно в случаях опухолей с неоднородной структурой.
При оценке показателя Ki-67 врачом подсчет проводится в так называемых «горячих точках», т.е. в участках опухоли с максимально выраженной пролиферативной активностью. Подсчет с помощью цифровой микроскопии проводится в выбранных врачом идентичных по площади участках ткани, т.е. используется несколько иной принцип подсчета. Ученые пришли к выводу, что цифровая микроскопия более эффективна в однородных по строению тканях, а в опухолях с относительно низким уровнем пролиферации, различающихся по строению, предпочтителен традиционный метод исследования опытным патоморфологом.Полученные данные стали одним из результатов многолетних исследований методом цифровой микроскопии с использованием программного обеспечения QuantCenter 3DHISTECH. Этот метод продемонстрировал высокую эффективность оценки экспрессии Ki-67 при раке молочной железы. Научный коллектив планирует продолжить исследования максимально идентичных участков опухоли, что особенно важно в случаях опухолей с неоднородной структурой.
https://ria.ru/20200730/1575144222.html
https://ria.ru/20200720/1574587183.html
https://ria.ru/20200619/1573210676.html
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/07e4/08/19/1576303560_174:0:2903:2047_1920x0_80_0_0_5dea4d42dfc4215e363f248d3fb120ea.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
балтийский федеральный университет, навигатор абитуриента, университетская наука, рак груди
МОСКВА, 26 авг — РИА Новости. Ученые Балтийского федерального университета им. И. Канта (БФУ им. И. Канта) определили, при каких видах опухолей рака молочной железы больше подходит визуальный или цифровой метод исследования; это поможет врачам выбрать оптимальный способ лечения. Результаты исследования опубликованы в научном журнале «Акушерство и гинекология».Количественная оценка маркера пролиферации Ki-67, который отражает интенсивность деления опухолевых клеток и скорость роста опухоли, имеет крайне важное значение для больных раком при многих онкопатологиях, в том числе и при раке молочной железы у женщин. Точное определение этого показателя необходимо для назначения адекватной терапии и прогноза онкологического заболевания.
Величины Ki-67 в нормальной ткани молочной железы обычно не превышают 5%. При раке молочной железы они имеют разные значения: встречаются опухоли с низкими показателями и относительно благоприятным прогнозом – Ki-67 менее порогового значения 14%. В других опухолях этот показатель может превышать 14-20%, а в отдельных случаях – достигать 80-90%.
30 июля 2020, 09:13
ИИ поможет московским врачам выявлять онкологию при анализе маммограммНа сегодняшний день существует проблема определения уровня экспрессии Ki-67. Показатель варьируется при подсчете в различных лабораториях, в зависимости от методики проведения иммуногистохимической реакции для его выявления, а также от используемых реагентов и метода подсчета. В то же время, точный подсчет показателя определяет постановку правильного диагноза и назначение соответствующего лечения. Поэтому так важно унифицировать методику определения Ki-67.
Традиционный, визуальный метод оценки уровня пролиферации состоит в том, что врач-патоморфолог при помощи микроскопа исследует микропрепараты опухоли после их специального иммуногистохимического окрашивания. Этот метод не всегда достаточно эффективен и может быть связан с субъективным фактором. Поэтому большие надежды ученые возлагают на цифровую микроскопию, которая позволяет провести объективную морфологическую диагностику.
Этот метод не всегда достаточно эффективен и может быть связан с субъективным фактором. Поэтому большие надежды ученые возлагают на цифровую микроскопию, которая позволяет провести объективную морфологическую диагностику.
Исследователи Лаборатории иммуногистохимической, патологоанатомической и клинической диагностики БФУ им. И. Канта провели сравнительный анализ традиционного способа визуальной количественной оценки маркера Ki-67 врачом-патоморфологом и методики с использованием цифровой микроскопии в клетках рака молочной железы у пациенток Калининградской области.
20 июля 2020, 12:07НаукаУченые создали препарат, убивающий клетки рака молочной железыПри оценке показателя Ki-67 врачом подсчет проводится в так называемых «горячих точках», т.е. в участках опухоли с максимально выраженной пролиферативной активностью. Подсчет с помощью цифровой микроскопии проводится в выбранных врачом идентичных по площади участках ткани, т.е. используется несколько иной принцип подсчета.
Ученые пришли к выводу, что цифровая микроскопия более эффективна в однородных по строению тканях, а в опухолях с относительно низким уровнем пролиферации, различающихся по строению, предпочтителен традиционный метод исследования опытным патоморфологом.
«Мы установили, что метод цифровой микроскопии эффективен при определении средних показателей экспрессии Ki-67. В отдельных случаях, особенно при низкой степени экспрессии Ki-67, были выявлены различия показателей, зависящие от выбора методики: традиционной или с использованием цифровой микроскопии. Это крайне важно для определения молекулярного субтипа опухоли и назначения последующего лечения», — рассказала РИА Новости заведующая Лаборатории иммуногистохимической, патологоанатомической и клинической диагностики БФУ им. И. Канта, доктор медицинских наук, профессор Лариса Волкова.
Полученные данные стали одним из результатов многолетних исследований методом цифровой микроскопии с использованием программного обеспечения QuantCenter 3DHISTECH. Этот метод продемонстрировал высокую эффективность оценки экспрессии Ki-67 при раке молочной железы. Научный коллектив планирует продолжить исследования максимально идентичных участков опухоли, что особенно важно в случаях опухолей с неоднородной структурой.
19 июня 2020, 20:23
Врач рассказала, когда боль в груди говорит о ракеШкала Глисона — Docrates
Критерием классификации по Глисону является изменение структуры предстательной железы, объем изменения в соотношении к строению предстательной железы в норме. Чем выше суммарный показатель по Глисону, тем злокачественнее т.е. агрессивнее рак. Четко дифференцированное, приближенное к норме строение предстательной железы говорит о низкой степени злокачественности заболевания и низкодифференцированное, т.е. значительно измененное строение наоборот говорит об агрессивном заболевании. Степень изменения, вызванного раком простаты оценивают по пятибалльной шкале (1-5), при этом, по взятому при биопсии материале классифицируют 2 характерные области по отдельности. После чего оба показателя суммируют в показатель Глисона (к примеру, 3+5).
Теоретически шкала Глисона могла бы составлять суммарный показатель от 2 до 10, с наихудшим показателем 10. Современные технологии патологических исследований показывают, что низкие показатели по Глисону (Глисон-1 и Глисон-2) на практике не означают наличие рака предстательной железы. Соответственно, рассматриваются показатели Глисона между 6-10, причем, показатель по Глисону 6 обычно говорит о раке простаты с хорошими прогнозами. Самые высокие показатели Глисона 8-10 говорят об агрессивном заболевании. Эта информация чрезвычайно важна при индивидуальном планировании лечения для пациента.
Соответственно, рассматриваются показатели Глисона между 6-10, причем, показатель по Глисону 6 обычно говорит о раке простаты с хорошими прогнозами. Самые высокие показатели Глисона 8-10 говорят об агрессивном заболевании. Эта информация чрезвычайно важна при индивидуальном планировании лечения для пациента.
Еще несколько лет назад считалось, что рак простаты с Глисоном 6 хорошо вылечиваются при любых методах лечения, а рак простаты с Глисоном 8, 9 и 10 невозможно вылечить. Рак простаты с Глисоном 8-10 изначально может выглядеть как местный рак, но при его лечении возникает ряд сложностей, вызванных тем, что при таком диагнозе раковые клетки могут распространиться за пределы предстательной железы уже на ранних стадиях. В тоже время, различные исследования и клинический опыт доказывают, что такие виды рака можно лечить эффективнее и в большинстве случаев рака простаты с Глисоном 8-10 возможно вылечить полностью. Для этого при лечении рака простаты с Глисоном 8-10 нужно лечить раковые клетки, которые с большой вероятностью находятся за пределами железы и не визуализируются. На практике это возможно при правильной комбинации лучевой терапии и медикаментозного лечения с другими формами лечения, как и при современном лечении других видов онкологии.
На практике это возможно при правильной комбинации лучевой терапии и медикаментозного лечения с другими формами лечения, как и при современном лечении других видов онкологии.
Примерно в 70% случаев, при показателях Глисона 6 или ниже рак простаты является местным. По опыту нашей клиники, заболевание на начальной стадии, при степени Глисона 6 чаще всего не визуализируется при МРТ исследовании. Когда же показатель Глисона 8-10 чаще всего рак простаты уже распространен на момент его обнаружения. Показатель Глисона при местном раке простаты – это всего лишь один источник, определяющий прогноз лечения. Помимо Глисона, необходимо: следить за изменениями показателя ПСА; определить местное распространение рака простаты, которое видно при мультипараметрическом МРТ; определить распространение за пределы капсулы предстательной железы с помощью исследований ПЭТ-КТ со специальными маркерами рака простаты.
Что делать, если поставлен диагноз рака молочной железы
Для начала необходимо установить стадию процесса.
Деление на стадии — выражение, используемое для описания различных исследований, обычно производимых после того, как поставлен диагноз далеко развившегося рака, чтобы определить, локализована ли еще болезнь или уже распространилась на другие области тела. Например, операция по извлечению нескольких подмышечных лимфоузлов производится для определения стадии рака.
Когда речь идет о раке молочной железы, деление на стадии производится для определения стадии рака. Основная цель врача в этой ситуации состоит в том, чтобы удалить рак пока он еще остается в пределах груди (если в другой груди обнаруживается еще одна опухоль, это обычно «новый первичный рак», а не метастаз первого). Если уже известно, что рак присутствует в других частях тела, удаление молочной железы имеет разве что ограниченное значение, если только она не болезненна, инфицирована или изъязвлена. Необходимость установления стадии, если выявлен запущенный рак — еще одна причина для отделения диагноза от лечения: чтобы не оперировать больше, чем необходимо.
Индикаторы прогноза или «маркеры» риска рецидива
В большинстве случаев подозрительные симптомы вызваны доброкачественными образованиями. Но одна- две из каждых десяти биопсий влечет диагноз рака. После этого от образца потребуется информация для принятия решения о немедленном первичномлечении или, если необходимо, последующем вспомогательномлечении, дополняющем главное, — об операции. Информация поступает от «маркеров», или прогностических индикаторов риска возврата первичного рака, который был удален. Следует знать о «маркерах» до диагностической биопсии, даже если она покажет, что уплотнение является раковой опухолью.
Анализ на рецептор гормона
Один из важнейших лабораторных анализов — это анализ на рецептор эстрогена (РЭ). Определение числа рецепторов женского гормона эстрогена в клетках опухоли — это косвенный способ определения, зависит ли раковая опухоль от этого гормона при своем росте. При этом обычно определяется и другой показатель — рецептор прогестерона (РП).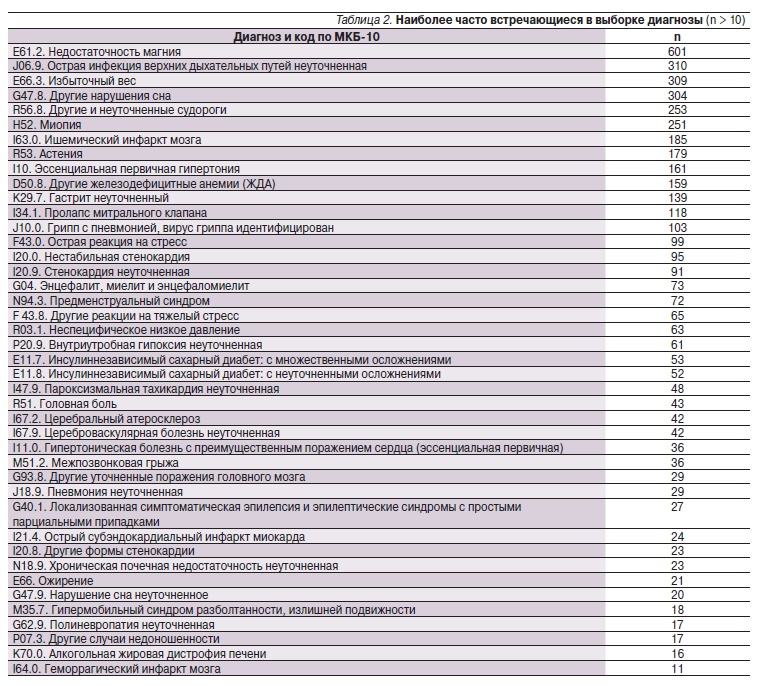
Если большинство клеток содержит много рецепторов, опухоль называется РЭ-богатой, или РЭ-позитивной. Опухоль, клетки которой содержат мало рецепторов — РЭ-бедна, или РЭ-негативна. Все раковые опухоли молочной железы содержат некоторое число клеток с рецепторами эстрогена, и вопрос состоит в том, как много рецепторов эстрогена содержится в заданном объеме клеточного материала. Если присутствуют также рецепторы прогестерона, их количество важно для предсказания реакции организма на гормональную терапию.
Другие маркеры риска рецидива
Определения рецепторов эстрогена и прогестерона стали рядовыми анализами. Один из них, доля S-фазы, может принести пользу в предсказании агрессивности рака. Этот показатель в буквальном смысле означает долю клеток, которые находятся в «синтетической» стадии процесса деления на дочерние клетки. Высокая доля S-фазы указывает, что клетки активно делятся, опухоль быстро растет.
Другой показатель — плоидия, которая описывает, насколько раковыми являются клетки опухоли по сравнению со здоровыми клетками молочной железы. Изучая это, специалисты могут оценить, насколько раковые клетки отклонились от нормальных клеток молочной железы и, соответственно, насколько агрессивной может быть опухоль.
Изучая это, специалисты могут оценить, насколько раковые клетки отклонились от нормальных клеток молочной железы и, соответственно, насколько агрессивной может быть опухоль.
Доля S-фазы и плоидия, наряду с состоянием подмышечных узлов, размером опухоли, гистологическим типом, содержанием рецепторов эстрогена и прогестерона, могут вносить свой вклад в картину маркеров, которая помогает онкологам рекомендовать при необходимости вспомогательную терапию или другое лечение после первичной операции.
Амплификация онкогена, определение наличия онкогена HER-2 — это пример другого исследования, проводимого для определения числа экземпляров определенного аномального гена в клетке опухоли. Этот метод активно используется, данные, накопленные о нем и о других новых маркерах, достаточно убедительны для того, чтобы рекомендовать эти анализы как стандартные.
Варианты лечения рака молочной железы
Если поставлен диагноз рака молочной железы, в первую очередь лечению должна подвергаться грудь, где обнаружена опухоль. Следующая задача — определить, надо ли и, если надо, как лечить весь организм в целом, если есть сильное подозрение, что рак мог распространиться за пределы молочной железы.
Следующая задача — определить, надо ли и, если надо, как лечить весь организм в целом, если есть сильное подозрение, что рак мог распространиться за пределы молочной железы.
Операция, независимо от того, следует ли за ней радиотерапия, является первичным местным лечением. Мероприятия вспомогательной терапии проводятся в дополнение к первичной терапии, чтобы уничтожить раковые клетки, оставшиеся в молочной железе или в отдаленных областях тела женщины. Такова цель химиотерапии и гормональной терапии.
Принятие решений начинается с того, может ли грудь быть сохранена или же безопаснее удалить всю ткань молочной железы путем мастэктомии. Затем, если ее решено сохранить, делать ли в дальнейшем облучение. Следующая проблема: нужна ли вспомогательная терапия и какая будет наиболее эффективна. Рекомендации, даваемые хирургом, базируются на том, что дали многие годы исследований вариантов лечения, применявшихся тысячами врачей в тщательно контролируемых клинических испытаниях.
Первичное лечение
Первичное лечение будет заключаться либо в том или ином варианте мастэктомии (удаления молочной железы), либо в частичной операции по удалению только опухоли (иссечение уплотнения). После иссечения уплотнения обычно применяется облучение сохраненной груди высокой дозой ионизирующего излучения.
Раковые клетки могут развиться либо из клеток, выстилающих протоки (рак протока) или в дольках (рак долек).
Рак протоков
Карцинома протока in situ (DCIS). Эти раковые клетки развиваются из ткани протоков и остаются в протоках. Этот тип рака, ранее считавшийся редким, по современным оценкам составляет от 15 до 25% всех вновь диагностируемых случаев рака молочной железы. Если рак обнаружен на этой стадии, шансы на излечение очень высоки.
Рак долек
Карцинома долек in situ. По существующим оценкам только у 30-50% женщин с этим типом рака в течение ближайших 10 лет развивается истинный инвазивный рак молочной железы./Ukr/24/2.jpg)
Инвазивный рак долек молочный железы
Этот рак способен метастазировать и распространяться по всему телу. Лечение такое же, как при инвазивном раке протока.
Сорокапроцентная частота рецидива местного рака свидетельствует в пользу утверждения о том, что рак молочной железы — мультицентричное заболевание. Другими словами, женщины, у которых возникла в груди одна опухоль, с высокой вероятностью имеют и другие очаги рака. Когда проводится сохраняющая грудь операция, вероятность рецидива является поводом для немедленного завершающего лечения радиацией, чтобы искоренить остающиеся в груди очаги рака.
Новые достижения в лечении рака молочной железы
Варианты вспомогательной терапии:
Химиотерапия использует цитотоксичные (убивающие клетки) препараты, обычно в определённых сочетаниях.
Гормональная терапия может помочь женщинам, у которых рост раковой опухоли зависит от концентрации эстрогенов.
Восстановление груди после мастэктомии
Пластическая операция, создающая искусственную выпуклость груди в случае, если настоящая грудь удалена после хирургического лечения рака, называется «восстановительной маммопластикой». Также разработаны специальные импланты, которые привели к тому, что искусственная грудь стала ближе к настоящей по форме и упругости.
Расшифровка рака — типы, стадии и степени
Мир рака может быть чрезвычайно пугающим и трудным для многих, независимо от того, болели ли вы или ваш близкий рак. Существует более 100 видов рака, и все они имеют разные системы классификации и подтипы, а это означает, что если у вас действительно рак, вам будет поставлен очень длительный диагноз, который вы не можете полностью понять. После этого следует длительный и сложный непрерывный процесс выбора и оценки вариантов лечения, о некоторых из которых вы, возможно, никогда не слышали до того, как у вас диагностировали рак. Мы уже писали о различных типах конкретных видов рака, от рака груди до рака поджелудочной железы и обо всем, что между ними. В рамках этого мы коснулись вопросов степени рака и некоторых методов лечения. Однако мы никогда не писали сообщений о типах, методах лечения и терминологии, лежащей в основе рака в целом, и считаем, что это может быть очень полезным ресурсом, если вы находитесь на ранних стадиях диагностики и не уверены, что означают эти термины и что впереди с точки зрения вариантов лечения. Это будет серия сообщений в блоге, состоящая из двух частей. Сегодняшняя публикация будет посвящена диагностике рака, а на следующей неделе — лечению.Если у вас нет рака, мы по-прежнему призываем вас обучать себя с помощью этих кратких сводных сообщений в блогах, поскольку вы никогда не знаете, когда эта информация может оказаться полезной для вас или вашего любимого человека, а с нашим собственным здоровьем знания — сила.
Мы уже писали о различных типах конкретных видов рака, от рака груди до рака поджелудочной железы и обо всем, что между ними. В рамках этого мы коснулись вопросов степени рака и некоторых методов лечения. Однако мы никогда не писали сообщений о типах, методах лечения и терминологии, лежащей в основе рака в целом, и считаем, что это может быть очень полезным ресурсом, если вы находитесь на ранних стадиях диагностики и не уверены, что означают эти термины и что впереди с точки зрения вариантов лечения. Это будет серия сообщений в блоге, состоящая из двух частей. Сегодняшняя публикация будет посвящена диагностике рака, а на следующей неделе — лечению.Если у вас нет рака, мы по-прежнему призываем вас обучать себя с помощью этих кратких сводных сообщений в блогах, поскольку вы никогда не знаете, когда эта информация может оказаться полезной для вас или вашего любимого человека, а с нашим собственным здоровьем знания — сила.
Что такое рак?
Давайте начнем с основного определения рака в целом. Рак на самом деле относится к клеткам в организме, поэтому он может поражать любой орган или часть тела, даже кровь. Некоторые клетки начинают расти ненормально и неконтролируемо, и затем они считаются злокачественными, со способностью распространяться и атаковать окружающие области тела и даже перемещаться в разные части тела.
Рак на самом деле относится к клеткам в организме, поэтому он может поражать любой орган или часть тела, даже кровь. Некоторые клетки начинают расти ненормально и неконтролируемо, и затем они считаются злокачественными, со способностью распространяться и атаковать окружающие области тела и даже перемещаться в разные части тела.
Рак не следует путать с опухолями. Хотя большинство видов рака связано со злокачественной (агрессивной) опухолью, которая способна распространяться, сами опухоли не обязательно являются злокачественными, а доброкачественная (неагрессивная) опухоль не способна распространяться и разрушать соседние клетки.
Различные виды рака
Стадия, классификация и метастазирование — это термины, о которых вы, возможно, слышали, когда речь идет о раке. Все они относятся к системам, которые помогают классифицировать рак, и большинство видов рака вписываются в эту структуру.В рамках этих терминов есть и другие подсистемы, так что вы можете представить, что это может очень быстро стать довольно сложным, и это без вовлечения конкретного рака, который у вас есть, например рак простаты. Мы разбили основные термины, которые вы услышите, и в нижней части этого сообщения будут ссылки, указывающие на дополнительную информацию.
Мы разбили основные термины, которые вы услышите, и в нижней части этого сообщения будут ссылки, указывающие на дополнительную информацию.
Стадия — TNM
Очень важная часть диагностики рака включает определение стадии рака, и это определяет, как далеко он распространился, насколько велик рак и насколько вероятно его распространение на другие части тела.Чтобы запутать ситуацию, врачи могут использовать две основные системы, поэтому мы объясним обе, начиная с системы TNM. Это расшифровывается как опухоль, узлы, метастазы.
- T — Часть опухоли относится к размеру новообразования, где это применимо — для видов рака, где нет опухоли, например рака крови, это не всегда актуально. Это классифицируется по шкале от 1 до 4, где 1 — небольшая опухоль.
- N — Узлы относятся к лимфатическим узлам, которые представляют собой бобовидные структуры в нескольких областях тела, которые несут ответственность за перенос веществ по всему телу, чтобы помочь иммунной системе, а также отфильтровывать вредные вещества из организма.
 Если раковые клетки обнаруживаются в лимфатических узлах, это указывает на то, что рак начал распространяться, поскольку они обычно первыми обнаруживают раковые клетки из первичного местоположения. В промежуточной системе TNM используется шкала от 0 до 3, где 0 означает, что клетки лимфатических узлов не являются злокачественными.
Если раковые клетки обнаруживаются в лимфатических узлах, это указывает на то, что рак начал распространяться, поскольку они обычно первыми обнаруживают раковые клетки из первичного местоположения. В промежуточной системе TNM используется шкала от 0 до 3, где 0 означает, что клетки лимфатических узлов не являются злокачественными. - M — Термин «метастаз» означает, что нарост распространился на совершенно другую часть тела, а не только на соседние клетки или близлежащие лимфатические узлы. Это говорит о том, что рак находится далеко в своем прогрессе и его сложнее лечить, поскольку он поражает несколько частей тела.Эта часть стадии просто 1 или 2 — не распространилась на другую часть тела или распространилась соответственно.
Используя эту систему, при получении диагноза вы можете увидеть, что он записан примерно так: T2 N1 M1, что означает, что у вас опухоль немного больше самой маленькой опухоли, но все еще маленькая, с низким количеством раковых клеток в лимфе. узлы, и рак еще не распространился на другую область тела.
узлы, и рак еще не распространился на другую область тела.
Постановка — номера
Эта система стадирования похожа, но немного упрощена, поэтому вы услышите, о чем большинство людей говорят при обсуждении своего диагноза рака. E.г. «У меня рак груди III стадии». В нем используются цифры 1–4, но обычно пишется римскими цифрами:
- Стадия I. Это означает, что рак небольшой и находится только в органе, который возник. Опять же, для таких видов рака, как рак крови, стадия немного отличается, и мы уже писали о раке крови раньше.
- Стадия II — Рак немного больше, чем на стадии I, но еще не распространился на соседние ткани. При некоторых формах рака стадия II может означать, что рак в небольшой степени распространился на лимфатические узлы, но при других случаях это означает, что он еще не распространился вовсе
- Стадия III — Раковый рост теперь большой и распространился на соседние ткани и близлежащие лимфатические узлы.
- Стадия IV — высшая стадия рака, это относится к раку, который распространился на совершенно другую часть тела, и также известен как вторичный рак, поскольку он переместился из первичной области, в которой начался.
 Вы можете услышать это также называется метастатическим раком, поскольку это относится к M в системе TNM выше.
Вы можете услышать это также называется метастатическим раком, поскольку это относится к M в системе TNM выше.
Оценка
Некоторые могут предположить, что стадия и градация — взаимозаменяемые термины, но на самом деле градация — это еще один шаг в диагностическом процессе рака.Оценка важна, потому что она рассматривает отдельные раковые клетки на микроскопическом уровне и оценивает то, как они выглядят и ведут себя. Система оценок может незначительно отличаться для разных видов рака, но наиболее часто используемая система включает числа 1-3, хотя у некоторых видов рака есть дополнительные числа. Вообще говоря:
- Уровень 1 — раковые клетки растут очень медленно и очень похожи на нормальные клетки
- Уровень 2 — клетки выглядят не совсем нормально и растут быстрее, чем обычно.
- Класс 3 — клетки растут очень быстро и выглядят крайне ненормально
- GX — Иногда клетки не могут быть оценены либо потому, что образца недостаточно, либо они не уверены в том, как клетки ведут себя.
 Это также известно как неопределенная оценка.
Это также известно как неопределенная оценка.
Может показаться, что эти системы определения стадии и классификации предназначены только для того, чтобы напугать вас и дать представление о том, насколько серьезен ваш рак, но на самом деле это очень важный шаг, который сообщает, как можно вылечить рак. На следующей неделе мы рассмотрим эти различные методы лечения в широком смысле, чтобы вы знали, какие термины и методы лечения могут быть предложены вам, если вам поставят диагноз «рак».
Полезные ссылки
Мы разместили несколько полезных ссылок на наши сообщения в блогах о конкретных раковых заболеваниях, а также на некоторые другие веб-сайты, которые могут помочь вам больше узнать о раковых заболеваниях и терминах, используемых при диагностике:
Рак крови
Рак кишечника
Рак груди
Рак шейки матки
Рак яичников
Рак поджелудочной железы
Онкологическое исследование, Великобритания
Американское онкологическое общество
Genentech: Расшифровка рака
Питер Фонг
Заместитель директора по развитию онкологического бизнеса
Великая наука всегда была в основе Genentech, как и в любой передовой биотехнологической компании или ведущей академической лаборатории. И поскольку сотрудничество часто имеет решающее значение для великой науки, партнерство является ключевым аспектом нашей культуры. Превращение новаторских изобретений в трансформирующие лекарства требует коллективных усилий многих людей, работающих вместе, чтобы гарантировать, что технология получит все ресурсы и обширный опыт, необходимые для управления сложностями разработки лекарств.
И поскольку сотрудничество часто имеет решающее значение для великой науки, партнерство является ключевым аспектом нашей культуры. Превращение новаторских изобретений в трансформирующие лекарства требует коллективных усилий многих людей, работающих вместе, чтобы гарантировать, что технология получит все ресурсы и обширный опыт, необходимые для управления сложностями разработки лекарств.
BioNTech вносит в это партнерство потенциально первую в своем классе персонализированную противораковую вакцину (PCV) с существующим сквозным процессом от секвенирования опухоли до производства мРНК и рецептуры доставки лекарств.* Кроме того, его ученые продемонстрировали, что их вакцина может вызывать опухолеспецифический иммунный ответ. Они продумали иммунологические сложности своей системы так же, как и мы, если бы столкнулись с теми же проблемами.
Genentech предлагает надежный и разнообразный конвейер для интеграции PCV от BioNTech, а также производственный и нормативный опыт, необходимый для реализации такого новаторского подхода. Мы также привносим передовой опыт в области переноса лечения рака из лаборатории в клинику и предлагаем глобальную коммерческую онкологическую организацию для продвижения вакцины на рынок, как только она будет готова.
Мы также привносим передовой опыт в области переноса лечения рака из лаборатории в клинику и предлагаем глобальную коммерческую онкологическую организацию для продвижения вакцины на рынок, как только она будет готова.
Наши партнеры ценят то, что мы приложим все усилия для создания новейших и высококачественных научных достижений. Терапевтическая новизна нас не пугает; это движет нами. В работе с BioNTech наша общая цель — создать оптимизированный процесс, в котором каждая персонализированная противораковая вакцина может быть создана в течение нескольких недель после получения образца опухоли человека. Мы надеемся превратить ПКВ в клиническую реальность и продвинуть нашу многолетнюю приверженность преобразованию лечения рака.
* Завершение этого соглашения зависит от обычных условий закрытия, включая разрешение в соответствии с Законом об улучшении антимонопольного законодательства Hart-Scott-Rodino, и ожидается, что это произойдет в четвертом квартале 2016 года.
Расшифровка рака
«Если мы можем отправить человека на Луну, почему мы не можем найти лекарство от рака?»
Это знакомый вопрос, который олицетворяет коллективное разочарование американцев по поводу отсутствия лекарства от рака. Немногие болезни затрагивают столько же жизней, и никакой диагноз не вызывает большего страха.
Только в этом году, по оценкам Американского онкологического общества, более 1,6 миллиона человек в США будут диагностированы с раком, и примерно полмиллиона умрут от этого заболевания.
Несмотря на то, как публикуются эти статистические данные, теперь ученые понимают, что рак — это не одно заболевание. Есть типы, такие как рак груди или простаты, и есть их подтипы. Опухолевые клетки людей одного подтипа могут иметь разные генетические отпечатки пальцев. Точно так же сама опухоль человека состоит из разных типов клеток.
При таком большом разнообразии, можем ли мы когда-нибудь надеяться выиграть войну, которую президент Никсон объявил раку более 40 лет назад?
Если мы продолжим лечить рак просто на основании органа или ткани его происхождения, ответ будет «вероятно, нет». (Ученые теперь узнают, что существует подтип рака груди, опухолевые клетки которого больше напоминают клетки подтипа рака легких.) Если мы сможем адаптировать лечение на основе генетического отпечатка конкретного типа рака у человека, тогда, возможно, только ответ будет «да».
(Ученые теперь узнают, что существует подтип рака груди, опухолевые клетки которого больше напоминают клетки подтипа рака легких.) Если мы сможем адаптировать лечение на основе генетического отпечатка конкретного типа рака у человека, тогда, возможно, только ответ будет «да».
Благодаря завершению проекта «Геном человека» в 2003 году (с помощью исследователей Калифорнийского университета в Санта-Крус) и более быстрой и дешевой технологии секвенирования ДНК, цель персонализации диагностики и лечения рака, наконец, кажется достижимой.
Каталог дефектов
Чтобы воплотить эту мечту в реальность, ученые создают Атлас генома рака (TCGA), каталог генетических дефектов, которые приводят к каждому конкретному типу рака.
«Рак — это заболевание, вызываемое мутациями в клетках, которые заставляют их бесконтрольно расти», — сказал Дэвид Хаусслер, выдающийся профессор биомолекулярной инженерии Калифорнийского университета в Санта-Крус и член центрального координационного комитета исследовательской сети TCGA. «Поскольку рак — это генетическое заболевание, принципиально важно понимать, что это за мутации.У нас никогда раньше не было технологий, чтобы делать это в больших масштабах ».
«Поскольку рак — это генетическое заболевание, принципиально важно понимать, что это за мутации.У нас никогда раньше не было технологий, чтобы делать это в больших масштабах ».
TCGA — это комплексная совместная работа, финансируемая Национальным институтом рака и Национальным исследовательским институтом генома человека, которые входят в состав Национальных институтов здравоохранения. В нем участвуют 150 исследователей из более чем двух десятков учреждений по всей стране, включая UCSC. Они начали с 20 наиболее распространенных видов рака и недавно секвенировали свой тысячный опухолевый геном.
Хаусслер и его коллеги надеются, что, подобно женщинам с положительным результатом теста на амплификацию гена HER2 и леченным препаратом Герцептин, все больные раком однажды получат лечение, направленное на их конкретный рак.Они предсказывают, что TCGA изменит практику медицины рака и наше понимание основ биологии рака.
«TCGA — крупнейший в мире проект по геномике рака. Нет ничего подобного, — сказал Кристофер Бенц, профессор и программный директор Института исследований старения Бака в Новато.
Нет ничего подобного, — сказал Кристофер Бенц, профессор и программный директор Института исследований старения Бака в Новато.
Бенц провел большую часть своей карьеры в Калифорнийском университете в Сан-Франциско, где он создал свою первую лабораторию, посвященную изучению рака груди у человека, и где он продолжает лечить пациентов с раком груди.Теперь, вместе с Хаусслером, он является одним из главных исследователей Центра анализа геномных данных UCSC-Buck Institute TCGA, одного из семи таких центров в сети.
«Вместе мы обладаем уникальным синергетическим опытом», — сказал он о своем сотрудничестве с партнерами UCSC. Его работа — помочь идентифицировать изменения генома, которые имеют клиническое значение. «Собравшись вместе, мы сможем прийти к правильным выводам о том, что заставляет эти виды рака тикать и как мы можем атаковать их с помощью нашего терапевтического арсенала.”
Новаторская биоинформатика
В то время как Бенц привносит в команду клиническую перспективу, Хаусслер специализируется на применении компьютерных наук и информационных технологий в области биологии и медицины — области, называемой биоинформатикой. Команда Хаусслера создала компьютерные методы для создания первого рабочего проекта генома человека. Они также создали UCSC Genome Browser, онлайн-инструмент с открытым исходным кодом, который используют генетики, молекулярные биологи и врачи, а также студенты и преподаватели эволюции для доступа к геномной информации.
Команда Хаусслера создала компьютерные методы для создания первого рабочего проекта генома человека. Они также создали UCSC Genome Browser, онлайн-инструмент с открытым исходным кодом, который используют генетики, молекулярные биологи и врачи, а также студенты и преподаватели эволюции для доступа к геномной информации.
Сегодня Хаусслер и коллеги из UCSC внедряют новые методы в биоинформатике для TCGA, чтобы исследователи могли передавать, получать доступ и хранить 300 гигабайт данных, которые генерируются для каждого опухолевого генома.
«Простое перемещение этих файлов из одного учреждения в другое подавляет стандартный Интернет», — пояснил Хаусслер. «Мы создаем инфраструктуру, которая позволит персонализированной медицине в целом и лечению рака в частности стать реальностью», — сказал Хаусслер, который также является исследователем Медицинского института Говарда Хьюза.
Команда UCSC TCGA также придумывает новые способы анализа данных, которые они и другие генерируют. «Одна из больших трудностей внедрения геномики рака в клинику заключается в том, что мы можем считывать мутации, но не можем их понять», — сказал Хаусслер.
«Одна из больших трудностей внедрения геномики рака в клинику заключается в том, что мы можем считывать мутации, но не можем их понять», — сказал Хаусслер.
С этой целью Джош Стюарт из UCSC потратил год на написание кода для программного обеспечения, которое ищет в данных генома опухоли только те комбинации мутаций, которые имеют биологическое значение, то есть те, которые могут превратить нормальную клетку в раковую.
«В течение многих лет биологи накапливали знания о том, как гены взаимодействуют вместе в так называемых генетических путях. Недавно люди начали создавать базы данных на основе этих знаний », — сказал Стюарт, доцент кафедры биомолекулярной инженерии. «Наш вклад состоит в том, что мы придумали компьютерную программу, которая использует данные образца пациента, чтобы выяснить, какие генетические пути отклоняются от их нормального функционирования».
Тестовый пример
После того, как они идентифицировали мутации, которые могут приводить к определенному раку, исследователи надеются идентифицировать существующие лекарства или разработать новые, которые мешают клеточным или молекулярным изменениям, вызванным мутациями.
Стюарт, Хаусслер, Бенц и их сотрудники из TCGA протестировали эту новую программу, изучив данные 316 пациентов с раком яичников. Исследование TCGA, опубликованное в журнале Nature в июне, показало, что в опухолях больных раком яичников характерно нарушение определенного метаболического пути.
«Пока мы не рассмотрели данные таким образом, никто по-настоящему не оценил важность этого конкретного пути», — пояснил Стюарт. Дальнейший анализ подтвердил существование четырех различных подтипов заболевания и выявил 68 генов, которые могут быть нацелены на существующие одобренные Управлением по контролю за продуктами и лекарствами США или экспериментальные терапевтические соединения, большинство из которых уже одобрены для лечения других заболеваний.
Назад к основам
Такой геномный подход к раку не только привел к неожиданным открытиям в отношении отдельных видов рака, но и обещает повлиять на направление фундаментальных исследований рака.
Джереми Сэнфорд из UCSC — молекулярный биолог, изучающий, как работают генные регуляторы, называемые белками, связывающими РНК. Сэнфорд получил грант от Santa Cruz Cancer Benefit Group на исследование активности связывающего РНК белка, который связан с распространенным раком поджелудочной железы.
Сэнфорд получил грант от Santa Cruz Cancer Benefit Group на исследование активности связывающего РНК белка, который связан с распространенным раком поджелудочной железы.
«Мы хотим идентифицировать РНК-мишени белка, понять, на какие пути он влияет, и посмотреть, как удаление белка влияет на биологию раковой клетки», — сказал Сэнфорд, доцент кафедры молекулярных, клеточных исследований и развития. (MCD) биология.
Сэнфорд сказал, что его исследование основано на данных, полученных Хаусслером и его коллегами. «Они идентифицируют вариации. Это приводит к проверяемым гипотезам ». Он сказал, что решать эти гипотезы должны такие ученые, как он сам.
И точно так же, как фундаментальные ученые обращаются к TCGA за ключом к разгадке того, как работают нормальные клетки, будущее персонализированной медицины зависит от прогресса фундаментальной науки, — сказал Дуг Келлог, профессор биологии MCD.
Келлог изучает молекулярные механизмы, которые контролируют деление клеток, механизмы, которые ученые еще не полностью понимают. «Нам действительно необходимо определить механизмы, контролирующие деление клеток», — сказал Келлог. «Нам нужны способы атаковать опухоли, а это требует более фундаментальных основ биологии.”
«Нам действительно необходимо определить механизмы, контролирующие деление клеток», — сказал Келлог. «Нам нужны способы атаковать опухоли, а это требует более фундаментальных основ биологии.”
Революция в медицине рака
В дополнение к более фундаментальной биологии на рабочем месте, геномная эра также потребует изменений у постели больного, сказал Бенц.
Эти изменения включают — но не ограничиваются этим — новый способ распределения пациентов в группы клинических испытаний на основе их геномики рака и новые способы поиска пациентов для этих испытаний, которые не ставят под угрозу конфиденциальность.
«Нам нужен эквивалент реестра трансплантатов для образцов опухолей.Мы должны стать организованными и разрушить барьеры, чтобы мы могли свободно распространять информацию по стране », — сказал Бенц.
По словам Хаусслера, тестирование методов лечения различных подтипов рака также будет сложной задачей. «Существующая система клинических испытаний проверяет только одну вещь за раз. Процесс слишком громоздкий. TCGA доказывает, что почти каждая опухоль имеет различную комбинацию мутаций. Слишком много комбинаций, чтобы тестировать их по одной ».
Процесс слишком громоздкий. TCGA доказывает, что почти каждая опухоль имеет различную комбинацию мутаций. Слишком много комбинаций, чтобы тестировать их по одной ».
TCGA представляет собой не что иное, как революцию в медицине.«Подобные большие революции создают стрессы и напряжения», — сказал Хаусслер.
Но изменения, которые необходимы, чтобы сделать индивидуальное лечение рака правилом, а не исключением, того стоят, предсказал Хаусслер.
«Мы можем представить себе мир, в котором мы сможем разработать лечение любой комбинации мутаций в опухоли человека», — сказал он. «Мы должны сделать этот мир реальностью».
Для получения дополнительной информации или поддержки геномных исследований в UCSC посетите веб-сайт Центра биомолекулярной науки и инженерии или свяжитесь со Стивом Бурдоу.
Камилла Мохика Рей — научный писатель-фрилансер из Сан-Хосе. Она выпускница программы научных коммуникаций UCSC.
Эта статья опубликована в осеннем выпуске журнала Review за 2011 год.
Расшифровка рака: диагностика, стадии, степень и лечение
Доктор Ананатбхушан Ранаде, онколог (онколог), больница Локманья, бывший президент Индийского общества медицинской и детской онкологии
Рак, слово «C» пугает, потому что очень часто мы не понимаем используемых в нем медицинских слов.Эти слова так часто используются при диагностике, лечении и последующем наблюдении. Здесь мы делаем попытку расшифровать этот широко используемый медицинский жаргон.
Диагноз рака обычно ставится, когда раковые клетки видны под микроскопом. Редко диагноз ставится без этого. Диагноз ставится либо с помощью «FNAC», либо с помощью биопсии. Цитология тонкой иглы с аспирацией (FNAC) — это простейшая процедура, при которой небольшая игла вводится в опухоль / железу / уплотнение, а жидкость, содержащая раковые клетки, аспирируется и рассматривается под микроскопом.Это имеет множество ограничений, наиболее важным из которых является недопущение попадания раковых клеток в аспират, а отрицательный FNAC не исключает наличия рака.
Диагностика
«Биопсия» означает удаление небольшого кусочка опухоли. Это гораздо лучший способ поставить диагноз, и образец, если он адекватен, может дать нам гораздо больше информации о раке при дальнейшей обработке. Когда вся опухоль или узел удаляются полностью, процедура называется «эксцизионная биопсия».После получения образца диагноз ставится путем просмотра образца (после обработки) под микроскопом. Отчет, созданный после этого, называется отчетом гистопатологии. Возбудители рака видят клетки и диагностируют рак.
Как узнать о типе и происхождении рака?
Чаще всего требуется дополнительная информация относительно точного типа и места происхождения. Это достигается путем проведения ИГХ или иммуно-гистохимии, при которой образец подвергается воздействию различных химических красителей и выясняется тип происхождения всех раковых клеток.Когда эти тесты выполняются путем выделения циркулирующих опухолей из клеток крови, процедура называется жидкостной биопсией. Это позволяет избежать более болезненных процедур по извлечению части опухоли из тела. В последнее время образец опухоли и / или кровь подвергается генным исследованиям или «генетическому анализу», где анализируются изменения в генах и отмечаются точные молекулярные изменения в раковых клетках. Еще одна медицинская терминология, которая обычно используется при составлении отчетов, — это репрезентативная выборка.Чтобы понять это, мы должны знать, что во время взятия биопсии может случиться так, что удаленный кусок или образец был взят не из того места или опухоли, и тогда очевидно, что опухолевые клетки не собираются. Такой образец не обнаруживает раковых клеток. Это называется нерепрезентативной выборкой, поскольку она собирается не в желаемом месте.
Это позволяет избежать более болезненных процедур по извлечению части опухоли из тела. В последнее время образец опухоли и / или кровь подвергается генным исследованиям или «генетическому анализу», где анализируются изменения в генах и отмечаются точные молекулярные изменения в раковых клетках. Еще одна медицинская терминология, которая обычно используется при составлении отчетов, — это репрезентативная выборка.Чтобы понять это, мы должны знать, что во время взятия биопсии может случиться так, что удаленный кусок или образец был взят не из того места или опухоли, и тогда очевидно, что опухолевые клетки не собираются. Такой образец не обнаруживает раковых клеток. Это называется нерепрезентативной выборкой, поскольку она собирается не в желаемом месте.
Степень опухоли
Когда получен отчет гистопатологии, он также показывает «степень» опухоли. Непрофессионалы нередко думают, что это «стадия» опухоли или рака.Уровень и Стадия — это две разные сущности. Оценка говорит нам о скорости, с которой раковые клетки удваиваются, или о скорости, с которой раковые клетки растут.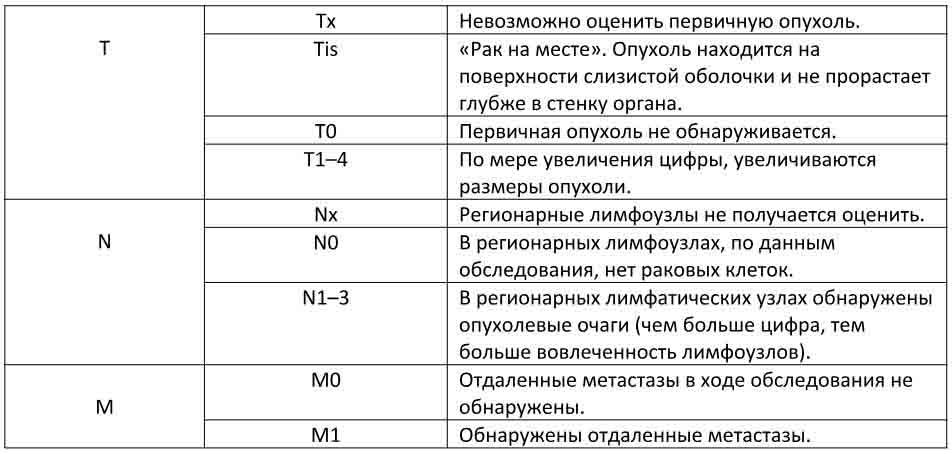 Чем короче время, необходимое одной раковой клетке, чтобы стать двумя выше, — это класс. Иногда также упоминается степень дифференцировки клеток. Хорошо дифференцированная опухоль означает медленно растущую опухоль, а плохо дифференцированная опухоль означает быстрорастущую опухоль. Между ними находится умеренно дифференцированная опухоль.Таким образом, степень III, а степень I — медленнорастущая или хорошо дифференцированная опухоль.
Чем короче время, необходимое одной раковой клетке, чтобы стать двумя выше, — это класс. Иногда также упоминается степень дифференцировки клеток. Хорошо дифференцированная опухоль означает медленно растущую опухоль, а плохо дифференцированная опухоль означает быстрорастущую опухоль. Между ними находится умеренно дифференцированная опухоль.Таким образом, степень III, а степень I — медленнорастущая или хорошо дифференцированная опухоль.
Степень III — быстрорастущая или малодифференцированная опухоль, промежуточная между двумя опухолями II степени или умеренно дифференцированной опухолью.
Стадии рака
После того, как патологическая идентификация раковых клеток завершена с классификацией и IHC, начинается следующая часть определения стадии. Стадия обозначает степень или географическое распространение рака. Существует 4 стадии рака, на первой стадии рак очень мал и ограничен небольшим местом, на второй и третьей стадиях он продолжает увеличиваться в размерах и начинает распространяться на близлежащие области и может распространяться на соответствующие небольшие региональные участки. лимфатический узел.Лимфатические узлы — это структуры системы кровообращения, которые пытаются убить рак, управляя различными механизмами организма. Когда рак начинает раздражать их, он атакует лимфатические узлы той же области.
лимфатический узел.Лимфатические узлы — это структуры системы кровообращения, которые пытаются убить рак, управляя различными механизмами организма. Когда рак начинает раздражать их, он атакует лимфатические узлы той же области.
Когда раковые клетки выходят за пределы лимфатических узлов, попадают в кровоток и достигают других органов, стадия называется четвертой стадией. Следовательно, важно диагностировать рак на ранней стадии. Не следует пренебрегать или относиться легкомысленно к различным симптомам рака.Ранняя диагностика — ключ к излечению. Определение стадии рака осуществляется либо радиологическими методами, такими как компьютерная томография, МРТ, сонография, либо ядерным сканированием (сканирование ПЭТ). В настоящее время операции по поводу стадии рака проводятся очень редко. Лечение определяется типом рака и стадией. В первую очередь существуют местные методы лечения опухоли в этом месте. Это хирургия и облучение.
Другие виды лечения применяются ко всему телу для полного уничтожения раковых клеток. Это химиотерапия, гормональная терапия, таргетная терапия, иммунотерапия и генетическая терапия.
Это химиотерапия, гормональная терапия, таргетная терапия, иммунотерапия и генетическая терапия.
Расшифровка признаков ответа на иммунотерапию рака
Иммунотерапия удаляет блоки на Т-клетках (красный цвет), которые затем могут атаковать опухоли. Кредит: Библиотека научных фотографий / Алами
Лечение рака, активирующее иммунную систему, показало замечательные результаты для многих пациентов. Ингибиторы иммунных контрольных точек (ICI) работают, вмешиваясь в механизм, который раковые клетки используют для уклонения от иммунного ответа хозяина.Лекарства, которые блокируют цитотоксический белок 4, связанный с Т-лимфоцитами (CTLA-4), белок запрограммированной гибели клеток 1 (PD-1) и лиганд запрограммированной смерти 1 (PD-L1), активируют Т-клетки, убивающие рак, которые были подавлены. ICI могут уменьшить опухоли и повысить выживаемость даже для пациентов, у которых другие методы лечения рака не помогли.
Только 20-40% пациентов отвечают на иммунотерапию 1 и, поскольку эти препараты могут активировать широкий спектр иммунных клеток, они могут иногда вызывать тяжелые аутоиммунные реакции. Если врачи могут предсказать, кто не ответит на лечение, они сэкономят на лечении и избавят пациентов от побочных эффектов.
Если врачи могут предсказать, кто не ответит на лечение, они сэкономят на лечении и избавят пациентов от побочных эффектов.
Технологии секвенирования следующего поколения (NGS) начинают выявлять признаки реакции на лечение. Анализы, которые измеряют генетический профиль опухолей и иммунную активность хозяина, помогают принимать решения о лечении в клинических испытаниях с новыми иммуноонкологическими препаратами или комбинированной терапией, и они находят свое применение в повседневной клинической практике.
С 2017 года FDA одобрило два комплексных диагностических теста, основанных на технологии NGS для характеристики генетического профиля любого типа солидной опухоли, без привязки к какому-либо конкретному лекарству. Виктор Вейгман, директор по трансляционной геномике в Q 2 Solutions, поставщик лабораторных услуг для глобальных клинических испытаний из Северной Каролины, считает эти тесты началом новой эры NGS в клинике. «Гибкость NGS для предоставления отчетов по множеству аналитов создает сильную тягу к его использованию в иммуноонкологии. ”
”
Отказ от использования одного теста для одного препарата по одному показанию дает огромные преимущества с точки зрения стоимости и клинической пользы, и это ускоряет усилия по разработке новых тестов. «Поле продвигается с огромной скоростью; всего несколько лет назад казалось невозможным, что NGS сможет многое рассказать нам о реакции пациентов на иммунотерапию », — говорит Тимоти Чан, директор платформы иммуногеномики и точной онкологии в Мемориальном онкологическом центре им. Слоуна Кеттеринга в Нью-Йорке. Йорк Сити.«Сегодня эти геномные анализы дают действенные результаты, и доказательства их клинической применимости растут».
Количественная оценка нескольких биомаркеров рака
Многие больницы и клиники проводят тестирование одного биомаркера для диагностики рака. Генетический скрининг на наличие мутаций в генах BRCA1 , EGFR или KRAS помогает онкологам определить риск развития у пациента определенных видов рака или лекарственной устойчивости.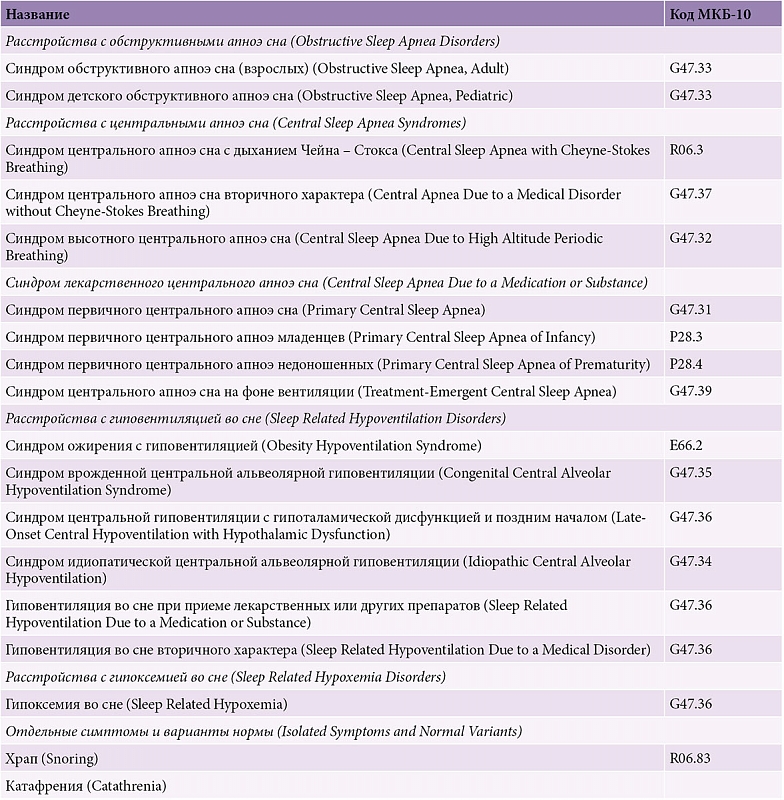 Тесты, которые оценивают уровни экспрессии PD-L1, также помогают определить вероятность клинической пользы от препаратов анти-PD-1 / PD-L1 и предоставить информацию о вариантах лечения.
Тесты, которые оценивают уровни экспрессии PD-L1, также помогают определить вероятность клинической пользы от препаратов анти-PD-1 / PD-L1 и предоставить информацию о вариантах лечения.
Однако тесты с одним биомаркером не могут охватить всю генетическую сложность опухоли. Генетическое профилирование раковой ткани с помощью целевых NGS — это экономичный и быстрый способ одновременного анализа нескольких мишеней, который позволяет исследователям идентифицировать новые биомаркеры. В последнее время исследовательские усилия были сосредоточены на использовании NGS для количественной оценки количества мутаций в раковых клетках (бремя мутаций опухоли — TMB) и выявления генетических паттернов, которые нарушают механизмы репарации ДНК и вызывают накопление мутаций (микросателлитная нестабильность — MSI).TMB и MSI важны, потому что раковые клетки, несущие большое количество мутаций, с большей вероятностью будут производить белки, которые иммунная система распознает как чужеродные, и, следовательно, с большей вероятностью будут восприимчивы к иммунному ответу. Было показано, что высокий TMB 2 или высокий уровень MSI 3 коррелируют с лучшим прогнозом для пациентов с различными типами рака, подвергающихся лечению ICI.
Было показано, что высокий TMB 2 или высокий уровень MSI 3 коррелируют с лучшим прогнозом для пациентов с различными типами рака, подвергающихся лечению ICI.
Комбинаторный подход
Хотя в настоящее время MSI одобрен в качестве биомаркера рака для доступа к пембролизумабу ICI, все еще остаются нерешенными некоторые вопросы, касающиеся использования TMB и MSI в качестве рутинных биомаркеров.Существует множество способов измерения TMB, и его значение может варьироваться в зависимости от типа опухоли, что подчеркивает необходимость согласованных стандартов для измерения и установления пороговых значений TMB для конкретных заболеваний.
Исследование генома рака может выявить его слабые места. (Обратите внимание, что показанное оборудование предназначено только для исследовательских целей. Не для диагностических процедур). Кредит: Библиотека научных фотографий / Алами
Первоначально TMB определяли путем секвенирования всех кодирующих белок областей в геноме рака. Чтобы сократить затраты и время выполнения, большинство анализов нацелены на панель из нескольких сотен генов для измерения TMB. Отсутствие стандартизации для расчета TMB и отчетности привело к таким инициативам, как проект по гармонизации TMB друзей исследований рака, целью которого является создание универсального эталонного стандарта с использованием технологий NGS и выявление источников вариабельности оценок TMB, полученных из различных целевых панелей.
Чтобы сократить затраты и время выполнения, большинство анализов нацелены на панель из нескольких сотен генов для измерения TMB. Отсутствие стандартизации для расчета TMB и отчетности привело к таким инициативам, как проект по гармонизации TMB друзей исследований рака, целью которого является создание универсального эталонного стандарта с использованием технологий NGS и выявление источников вариабельности оценок TMB, полученных из различных целевых панелей.
Корреляция между высоким TMB и благоприятным ответом на ICI не наблюдается у всех пациентов, получающих иммунотерапию, что позволяет предположить, что нельзя полагаться на одно универсальное определение высокого TMB 2 .Кроме того, исследование различных микросателлитно-стабильных опухолей, в котором учитывались особенности генома, выходящие за рамки мутационной нагрузки, выявило роль специфических генов или сигнальных путей в реакции на иммунотерапию 4 .
Фактически, результаты фазы II испытания атезолизумаба, терапевтического антитела против PD-L1, у пациентов с метастатическим уротелиальным раком, показали, что биомаркеры, такие как экспрессия PD-L1 и TMB, предоставляют независимую и дополнительную информацию об опухолях. ответ на лечение 5 .Складывается картина, что для прогнозирования реакции пациента потребуется комбинация маркеров. Гаррет Хэмптон, старший вице-президент по клинической геномике в Illumina, Inc, ведущем поставщике технологий секвенирования из Сан-Диего, говорит, что «использование комбинаторных биомаркеров, вероятно, обеспечит более точные измерения преимуществ, связанных с иммунотерапией».
ответ на лечение 5 .Складывается картина, что для прогнозирования реакции пациента потребуется комбинация маркеров. Гаррет Хэмптон, старший вице-президент по клинической геномике в Illumina, Inc, ведущем поставщике технологий секвенирования из Сан-Диего, говорит, что «использование комбинаторных биомаркеров, вероятно, обеспечит более точные измерения преимуществ, связанных с иммунотерапией».
Рассечение взаимодействия рака и иммунитета
Не только генетический профиль опухоли может повлиять на иммунотерапевтический ответ.Несколько исследований подчеркнули роль исходного иммунного ответа хозяина в определении эффективности лечения 6 — и необходимость лучшего понимания взаимодействия между клетками в микроокружении опухоли.
В частности, повышенная инфильтрация Т-клеток в опухоли, по-видимому, связана с выживаемостью пациентов и ответом на иммунотерапию. Но факторы, определяющие, имеет ли опухоль высокий («горячий») или низкий («холодный») уровень инфильтрации Т-клеток, только начинают изучаться.
Чан провел большой генетический анализ пациентов с меланомой и раком легких, получавших ингибиторы контрольных точек. 7 . Его команда обнаружила связь между ответом на лечение и генами лейкоцитарного антигена человека (HLA). Подобно предыдущим результатам у пациентов, инфицированных ВИЧ, гепатитом В или малярией, определенные профили HLA связаны с лучшими исходами при раке. «Люди, у которых больше вариаций в генах HLA, имеют большую способность распознавать, что есть« я », а что нет», — говорит он.
Чтобы лучше понять механизмы, управляющие или предотвращающие проникновение Т-клеток в опухоли, исследователи изучают изменения экспрессии генов в Т-клетках и раковых клетках. Секвенирование транскриптома рака в единичных клетках (scRNA-seq) дает ценную информацию об изменениях экспрессии генов, специфичных для определенного типа клеток, которые не могут быть установлены с помощью общего анализа тканей.
«В отличие от массовых подходов, scRNA-seq позволяет нам выйти за рамки простого определения клеточного состава опухоли и охарактеризовать динамику, функциональные состояния и перекрестные связи между популяциями клеток микроокружения опухоли», — объясняет Джеки Шилдс, руководитель группы в онкологическом отделении MRC Кембриджского университета.
С помощью компьютерных моделей исследования scRNA-Seq выявили злокачественные клеточные программы экспрессии генов, которые связаны с исключением Т-клеток и их дисфункцией, и которые могут быть использованы для прогнозирования устойчивости к иммунотерапии. В своем последнем исследовании 8 Шилдс и его коллеги идентифицировали три различных типа связанных с раком фибробластов в меланоме мыши, которые могут модулировать иммунный ответ по мере прогрессирования опухоли.
«Что действительно интересно в scRNA-seq, так это то, что он позволяет нам идентифицировать новые или редкие популяции, которые часто« подавляются »при массовых подходах, и изучать их вклад в развитие болезни», — говорит она.«ScRNA предоставила платформу для значительного улучшения нашего понимания взаимодействия между опухолью и клетками-хозяевами с беспрецедентным разрешением».
От исследований к клиническим условиям
Разработчики лекарств и лаборатории клинических испытаний обычно используют анализы на основе NGS как для проспективного выявления пациентов, которые с наибольшей вероятностью получат пользу от текущих клинических испытаний, так и для ретроспективной оценки генетических признаков, которые предсказывают благоприятный ответ к лечению.
Секвенирование нового поколения может быть использовано для анализа ДНК ракового происхождения в крови. Кредит: iStock / Getty Images Plus
«Вместо того, чтобы полагаться на клинические параметры, мы можем отфильтровать пациентов, которые с большей вероятностью ответят на лечение, на основе набора конкретных биомаркеров», — говорит Вейгман. Разработчики лекарств быстро взяли на вооружение этот подход для продвижения кандидатов на лекарства и комбинированных методов лечения во все более и более загруженной сфере. Это также помогает предотвратить неудачи клинических испытаний из-за отсутствия реакции пациентов.
Еще предстоит решить некоторые технические проблемы, прежде чем NGS сможет широко применяться в клинической практике. Достижения в методах секвенирования направлены на решение проблем, связанных с размером и качеством образцов опухолевой ткани, получаемых в клинике, а также с сокращением времени обработки, что имеет решающее значение для пациентов с агрессивными опухолями.
Захватывающим достижением является использование NGS для жидких биопсий для анализа ДНК, полученной из рака, которая может присутствовать в крови, циркулирующих раковых клетках или Т-клетках.Как активированные циркулирующие Т-клетки 9, , так и TMB, измеренные с использованием выделения ДНК из опухолевых клеток 10 , коррелируют с ответом пациентов на иммунотерапию рака. Возможность получения полезной информации о реакции на лечение на основе простого анализа крови предоставляет новые возможности для мониторинга и принятия решений о лечении.
Weigman с оптимизмом смотрит в будущее диагностики на основе NGS в клинической практике. «В течение следующих четырех-пяти лет терапевтические решения в клинике будут приниматься на основе тестов на геномные биомаркеры», — говорит он.
Учитывая, что все большее количество лекарств одобрены со связанным биомаркером (почти каждый четвертый в США) и что сопутствующие диагностические средства доказали свою эффективность в продажах и рецептах 11 , спрос на такие тесты как никогда высок ..gif) «Четко определенная клиническая применимость и короткое время выполнения работ будут ключевыми для любой технологии NGS, которая будет принята для рутинного тестирования», — говорит Вейгман.
«Четко определенная клиническая применимость и короткое время выполнения работ будут ключевыми для любой технологии NGS, которая будет принята для рутинного тестирования», — говорит Вейгман.
Чтобы помочь вступить в эту новую эру, Illumina в партнерстве с фармацевтическими и диагностическими компаниями разрабатывает сопутствующие диагностические версии тестов на основе NGS.«Мы очень рады, что в этом исследовании используется ряд продуктов Illumina», — говорит Хэмптон. Такие тесты, в конечном итоге, позволят нам больше узнать о раке и большему количеству пациентов получить пользу от иммунотерапии.
границ | Прогресс исследования неинвазивной визуализации и радиомики для расшифровки фенотипов и риска рецидива рака мочевого пузыря
Введение
Рак мочевого пузыря (BCa) является шестым по распространенности злокачественным новообразованием и девятым по частоте причиной смерти от рака среди мужчин во всем мире (1–3 ).По оценкам, в 2020 году во всем мире произошло 573 278 новых случаев заболевания и 212 536 новых случаев смерти (3, 4). BCa чаще встречается у мужчин, чем у женщин, и частота случаев увеличивается с возрастом (1, 4, 5). Между тем у него высокая частота рецидивов (5–7). Ранняя диагностика с индивидуальным подходом к лечению и последующее наблюдение за пациентами имеют решающее значение для благоприятного исхода.
BCa чаще встречается у мужчин, чем у женщин, и частота случаев увеличивается с возрастом (1, 4, 5). Между тем у него высокая частота рецидивов (5–7). Ранняя диагностика с индивидуальным подходом к лечению и последующее наблюдение за пациентами имеют решающее значение для благоприятного исхода.
BCa обычно происходит из эпителия (5, 7). Поскольку карциномы поражают мышцу детрузора, они классифицируются как мышечно-инвазивные BCa (MIBC, стадия ≥ T2) и с большей вероятностью метастазируют в лимфатические узлы или другие органы (5, 6).Приблизительно 75% пациентов при первоначальном диагнозе имеют немышечноинвазивный РМЖП (NMIBC, стадия ≤ T1), а у остальных — MIBC (6, 8–10). Около 50% вновь диагностированных НМРМВ имеют низкую степень злокачественности, в то время как большинство МИРМБ имеют высокую степень злокачественности (7, 11). Согласно рекомендациям Европейской ассоциации урологов (EAU) (10, 12), патологические фенотипы, такие как степень, стадия и инвазивный статус в мышцах (MIS), являются важными предикторами рецидива BCa и имеют огромное значение для принятия решений о лечении и прогноза. Следовательно, предоперационное определение гистопатологического фенотипа и риска рецидива BCa имеет решающее значение для пациентов с BCa.
Следовательно, предоперационное определение гистопатологического фенотипа и риска рецидива BCa имеет решающее значение для пациентов с BCa.
Клиническим эталоном первой линии для предоперационной диагностики гистопатологического фенотипа BCa является цистоскопическая резекция подозрительного поражения во время биопсии (6, 8–10, 13, 14). Учитывая, что опухоли мочевого пузыря неоднородны, результаты местной биопсии могут не быть типичными для всей опухолевой массы, а диагностические ошибки неизбежны (5, 7, 15–19). Многие исследования показали, что от 9 до 49% пациентов с BCa неправильно диагностируют стадию опухоли (14, 20–23), что приводит к неправильному решению о лечении и неблагоприятному прогнозу.Повторные цистоскопические резекции считаются практическим способом снизить количество ошибочных диагнозов, но они нежелательны из-за инвазивного, неудобного, трудоемкого и дорогостоящего процесса (21, 24–27). Кроме того, они могут легко вызвать инфекцию или уретральное кровотечение (6, 8–10, 28–30). Следовательно, разработка неинвазивного подхода для точного прогнозирования гистопатологического фенотипа BCa и дальнейшей стратификации риска его рецидива до операции имеет решающее значение для лечения и ведения пациентов (16, 31–35).
Следовательно, разработка неинвазивного подхода для точного прогнозирования гистопатологического фенотипа BCa и дальнейшей стратификации риска его рецидива до операции имеет решающее значение для лечения и ведения пациентов (16, 31–35).
В современной клинической практике легкодоступные и неинвазивные инструменты визуализации, такие как КТ органов малого таза и многопараметрическая МРТ (mpMRI), оказывают огромную помощь клиницистам в предоперационной диагностике фенотипов BCa (24, 30, 36–43). КТ в основном выполняется для оценки верхних мочевых путей и прогнозирования метастазов BCa в лимфатические узлы (40, 42, 43). Когда клиницисты идентифицируют MIS, CT имеет недостатки из-за ограниченного контраста мягких тканей (40, 42, 43). Кроме того, еще одной проблемой является радиационное облучение (40, 42–44).MPMRI, включая обычные последовательности, такие как T2-взвешенное изображение (T2WI) и функциональные последовательности, такие как диффузионно-взвешенное изображение (DWI) с соответствующими картами кажущегося коэффициента диффузии (ADC) и динамическое изображение с усилением контраста (DCE), вполне могут преодолеть эти недостатки. и повысить диагностическую эффективность (рисунок 1) (30, 39, 40, 44).
и повысить диагностическую эффективность (рисунок 1) (30, 39, 40, 44).
Рис. 1 Применение КТ и mpMRI для предоперационного прогнозирования статуса инвазии в мышцы BCa. Поражение пациента, подтвержденное NMIBC, различимо на КТ с контрастным усилением (CECT) (A) , но границы и базальная часть этого поражения редко различимы.MpMRI (B) , включая T2WI, DCE, DWI и соответствующую карту ADC, может предоставить более важные признаки и информацию, такие как ножка у основания опухоли и линейное усиление подслизистой оболочки (SLE), для точной диагностики инвазивного статуса мышц (MIS ) BCa (38).
T2WI имеет возможность проиллюстрировать подробную структурную информацию о поражении и стенке мочевого пузыря, таким образом, потенциально может отражать глубину проникновения BCa в стенку мочевого пузыря. Однако это может привести к завышению стадии, поскольку воспаление, связанное с опухолью, имеет такой же вид с низкой интенсивностью сигнала, что и собственная мышечная мышца (20, 37, 40, 44). DWI и ADC обладают благоприятной способностью отражать различия в интенсивности сигналов между мышцами, перитуморальным воспалением и фиброзом (36, 38, 44–47). Обнаружение утолщенной гипоинтенсивной подслизистой оболочки под NMIBC (признак или стебель дюймового червя) на DWI является важной вехой для идентификации и прогноза MIS (13, 30, 41, 48). Подслизистое линейное усиление (SLE) в базальной части опухоли на изображениях DCE в настоящее время признано еще одним признаком точного определения MIS (13, 30, 38, 39, 47), но его диагностическая эффективность является спорной (47, 49, 50).
DWI и ADC обладают благоприятной способностью отражать различия в интенсивности сигналов между мышцами, перитуморальным воспалением и фиброзом (36, 38, 44–47). Обнаружение утолщенной гипоинтенсивной подслизистой оболочки под NMIBC (признак или стебель дюймового червя) на DWI является важной вехой для идентификации и прогноза MIS (13, 30, 41, 48). Подслизистое линейное усиление (SLE) в базальной части опухоли на изображениях DCE в настоящее время признано еще одним признаком точного определения MIS (13, 30, 38, 39, 47), но его диагностическая эффективность является спорной (47, 49, 50).
Обобщая все эти важные клинические данные, Panebianco et al. предложила систему визуализации и данных пузырей (VI-RADS), которая использует морфологические признаки опухоли, стебли и СКВ на mpMRI для получения пятибалльной рейтинговой оценки для оценки MIS (30, 39, 40, 51–53) . Тем не менее, это полуколичественная оценка, которая также больше всего зависит от визуального восприятия опытных радиологов, что делает ее зависимым от экспертов инструментом для диагностики BCa. Кроме того, модель VI-RADS вместе с существующими неинвазивными инструментами визуализации все еще неспособна предсказать рецидив BCa.
Кроме того, модель VI-RADS вместе с существующими неинвазивными инструментами визуализации все еще неспособна предсказать рецидив BCa.
За последние 20 лет область компьютерного анализа медицинских изображений резко выросла, что привело к множеству успешных применений в неинвазивно точной диагностике и прогнозировании таких видов рака, как рак груди, колоректальный рак и рак легких (54–57) . Эти достижения побудили к попытке выделения высокопроизводительных количественных характеристик изображения, а именно, radiomics , для характеристики различных свойств тканей и накопления определенных стратегий для диагностики фенотипов BCa и прогнозирования риска рецидива (24, 26, 58–61).Однако большинство этих стратегий радиомики фокусируются только на области опухоли, независимо от области нормальной стенки и базовой части области опухоли, которые также могут предоставить обширную информацию для этой задачи (57, 59, 60, 62). Автоматическое и точное определение областей интереса (ROI), включая опухоль, ее базальную часть и область нормальной стенки, является важным шагом на пути к диагностике и прогнозированию рака мочевого пузыря на основе радиомики. С ростом развития радиомики систематический анализ этих множественных областей на неинвазивных изображениях мочевого пузыря позволит лучше понять болезнь и поддержать более индивидуализированные подходы к лечению.Таким образом, этот обзор направлен на широкое обсуждение инструментов визуализации на основе КТ и МРТ и радиомики для декодирования фенотипов BCa и риска рецидива, вдохновляя методологический прогресс и расширяя их клиническое применение в ближайшем будущем.
С ростом развития радиомики систематический анализ этих множественных областей на неинвазивных изображениях мочевого пузыря позволит лучше понять болезнь и поддержать более индивидуализированные подходы к лечению.Таким образом, этот обзор направлен на широкое обсуждение инструментов визуализации на основе КТ и МРТ и радиомики для декодирования фенотипов BCa и риска рецидива, вдохновляя методологический прогресс и расширяя их клиническое применение в ближайшем будущем.
Критерии поиска
В этом исследовании мы систематически извлекали рецензируемые статьи, опубликованные с 2000 по 2021 год (последний запрос 20.04.2020). Если исследование появляется в нескольких публикациях, анализировалась только последняя версия. Термины запроса, которые мы использовали в базе данных PubMed, были такими:
(((((((((((((((рак мочевого пузыря [Название / Аннотация)) ИЛИ (опухоль мочевого пузыря [Название / Аннотация))) И ( КТ [Заголовок / Аннотация])) ИЛИ (МРТ [Заголовок / Аннотация])) ИЛИ (многопараметрическая МРТ [Заголовок / Аннотация]) ИЛИ (радиомика [Заголовок / Аннотация])) ИЛИ (биомаркер [Заголовок / Аннотация])) ИЛИ (экзосома [Заголовок / Реферат])) ИЛИ (VI-RADS [Заголовок / Реферат])) ИЛИ (радиомика [Заголовок / Реферат]) И (оценка [Заголовок / Реферат])) ИЛИ (оценка [Заголовок / Реферат]) ) ИЛИ (стадия [Заголовок / Аннотация])) ИЛИ (стадия [Заголовок / Реферат])) ИЛИ (мышечно-инвазивный рак мочевого пузыря [Заголовок / Аннотация])) ИЛИ (рецидив [Заголовок / Аннотация]).
Мы исключили статьи по следующим критериям: i) исследования, посвященные нечеловеческим предметам; ii) исследования, предназначенные для повторной проверки ранее разработанных инструментов или важных выводов; iii) исследования, опубликованные в трудах конференций или в ответах на статьи. Для каждой зачисленной статьи год публикации, цели исследования, группы пациентов, методологии, результаты и ограничения были специально проанализированы для извлечения ценной информации, которая нам нужна, чтобы очертить основную тему прогресса исследования в области неинвазивной визуализации и радиомики для декодирования фенотипа и риска рецидива. BCa.
Общий рабочий процесс
Согласно предыдущим исследованиям, общий рабочий процесс неинвазивного декодирования фенотипов BCa и риска рецидива показан на рисунке 2. В настоящее время широко используемые инструменты визуализации для диагностики BCa в основном включают КТ, КТ с контрастным усилением (CECT) и mpMRI (42, 51, 52), по которым радиологи могут наблюдать важные визуализирующие признаки, такие как неоднородность распределения интенсивности опухоли, стебель и СКВ для интерпретации изображений. После этого два радиомических конвейера, а именно Path2 и Path 2 на рисунке 2, широко используются для извлечения высокопроизводительных функций, которые хорошо отражают свойства опухоли для прогнозирования фенотипа BCa и оценки риска рецидива (59, 60, 62) .
После этого два радиомических конвейера, а именно Path2 и Path 2 на рисунке 2, широко используются для извлечения высокопроизводительных функций, которые хорошо отражают свойства опухоли для прогнозирования фенотипа BCa и оценки риска рецидива (59, 60, 62) .
Рисунок 2 Общий рабочий процесс радиомической стратегии для декодирования фенотипа BCa и риска рецидива.
Очевидные различия между этими двумя конвейерами заключаются в стратегиях многорегиональной сегментации ROI, включая область опухоли, ее базальную часть и область нормальной стенки. Ручная сегментация многорегиональных рентабельности инвестиций BCa является первым выбором для многих исследователей. Однако это утомительный процесс с огромной нагрузкой. Более практичным способом становится изучение методов автоматической сегментации, основанных на конкретных математических теоремах (методах, управляемых моделями), таких как наборы уровней и марковские случайные поля (MRF).Тем не менее, из-за внутренних математических ограничений, большинство этих методов просто сосредоточены на точной сегментации внутренней границы (IB) и внешней границы (OB) мочевого пузыря, неспособные сегментировать мультиобласть мочевого пузыря на изображениях. Следовательно, некоторые люди обращаются к использованию управляемых данными стратегий, таких как модифицированный фрейм UNet с модулем сверточной нейронной сети (CNN) в Path 2 , чтобы справиться с этой проблемой.
Следовательно, некоторые люди обращаются к использованию управляемых данными стратегий, таких как модифицированный фрейм UNet с модулем сверточной нейронной сети (CNN) в Path 2 , чтобы справиться с этой проблемой.
После сегментации изображения следующим важным шагом является извлечение признаков.В настоящее время обычно используются три вида радиомических характеристик, включая морфологические особенности, особенности, основанные на интенсивности, и особенности текстуры (59, 63–72). Кроме того, постепенно развивались и другие характеристики, такие как глубина инвазии BCa, которая количественно измеряет относительную глубину инвазии опухоли в стенку мочевого пузыря (73). Учитывая, что избыточность между функциями может серьезно повлиять на производительность прогнозирования, выбор функций необходим для разработки оптимального режима прогнозирования.Статистический анализ в сочетании с другими высокоуровневыми стратегиями выбора, такими как рекурсивное исключение признаков на основе машины опорных векторов (SVM) (SVM-RFE), оператор наименьшего абсолютного сжатия и выбора (LASSO), максимальная релевантность и минимальная избыточность (mRMR). ), широко используются (26, 61, 74, 75). С выбранными функциями многие классификаторы машинного обучения, такие как SVM, случайный лес (RF) и логистическая регрессия, могут использоваться для разработки модели прогнозирования (24, 58, 74–76). Эти шаги в Paths 1 и 2 представляют собой традиционные радиомические конвейеры для неинвазивного прогнозирования фенотипа BCa и риска рецидива.
), широко используются (26, 61, 74, 75). С выбранными функциями многие классификаторы машинного обучения, такие как SVM, случайный лес (RF) и логистическая регрессия, могут использоваться для разработки модели прогнозирования (24, 58, 74–76). Эти шаги в Paths 1 и 2 представляют собой традиционные радиомические конвейеры для неинвазивного прогнозирования фенотипа BCa и риска рецидива.
Учитывая быстрое развитие методов глубокого обучения (DL) в определении и идентификации заболеваний, мы также проиллюстрируем новый конвейер радиомики в Path 3 для этой задачи. Он включает в себя два основных этапа, в том числе i) этап сегментации, который автоматически сегментирует мультирегиональные области интереса BCa из исходных изображений с помощью специального модуля CNN и ii) этап диагностики , который вычисляет глубокие характеристики из этих многорегиональных областей интереса для разработки классификатор для диагностики с помощью другого модуля CNN. Из-за природы «черного ящика» и сложных процедур, используемых при построении моделей, этот конвейер еще предстоит всесторонне исследовать. Мы считаем, что с появлением объяснимого искусственного интеллекта (ИИ) Path 3 получит гораздо больше внимания и исследований в будущем.
Из-за природы «черного ящика» и сложных процедур, используемых при построении моделей, этот конвейер еще предстоит всесторонне исследовать. Мы считаем, что с появлением объяснимого искусственного интеллекта (ИИ) Path 3 получит гораздо больше внимания и исследований в будущем.
Экстракция мультирегиональных областей интереса
Согласно предыдущим исследованиям (77–82), стенка мочевого пузыря и области опухоли содержат много информации для диагностики и прогноза BCa. Недавнее исследование (74) показало, что базальная часть опухолей мочевого пузыря на МРТ имеет потенциал для определения MIS (Рисунок 3).Следовательно, точное определение многорегиональных областей интереса на изображениях мочевого пузыря, за исключением использования ручных аннотаций, является важным шагом на пути к диагностике BCa на основе радиомики (83, 84).
Рис. 3 Структурная диаграмма мультиобласти мочевого пузыря на неинвазивном изображении.
Точная сегментация изображений мочевого пузыря полна проблем, включая эффекты частичного объема, которые обычно возникают, когда несколько тканей вносят вклад в один пиксель изображения и вызывают размытые границы тканей, изменение формы мочевого пузыря, артефакты движения в области мочи и стенке мочевого пузыря , и сложные распределения интенсивности внешней стенки (83, 84).При дальнейшем рассмотрении точной сегментации опухолей в просвете мочевого пузыря проблема становится еще более сложной (83). Для решения этих проблем с 2004 г. было предложено множество алгоритмов (83, 85, 86), как показано в таблице 1. Li et al. (85, 86) впервые применили марковское случайное поле для извлечения IB мочевого пузыря и уменьшения эффектов частичного объема. Гарнье и др. (87) приняли стратегию роста активной области в деформируемой модели, чтобы реализовать сегментацию как IB, так и OB.Однако его эффективность для сегментации акушерства далека от удовлетворительной из-за сложного распределения тканей, окружающих мочевой пузырь (83).
Таблица 1 Связанные исследования и методология сегментации изображений мочевого пузыря на основе КТ / МРТ за последние 20 лет.
Практически одновременно с этим были введены методы на основе набора уровней для извлечения как IB, так и OB (77, 79, 80, 88, 89, 93). Дуан и др. (80, 93) впервые предложили структуру связанных уровней с модифицированной моделью Чана – Весе для определения местоположения IB и OB из T1-взвешенного изображения (T1WI) в виде двухмерных (2D) срезов.Основываясь на достоинствах этого метода сегментации IB, Duan et al. (78, 79) далее предложили схему настройки адаптивного окна с функциями на основе объема для извлечения опухолей на IB. Вскоре после этого Ма и др. (88) ввели схему активного геодезического контура (GAC) в модель Чан-Весе, чтобы реализовать управляемую по форме деформацию как IB, так и OB на T2WI. Ограничением этого подхода является смещение интенсивности, вызванное опухолями внутри просвета мочевого пузыря, что легко приводит к утечке сегментации IB.Чтобы преодолеть это ограничение, Qin et al. (77) предложили адаптивный алгоритм предварительного набора уровней с ограничениями, который одновременно развивает как IB, так и OB из T2WI, значительно повышая точность сегментации IB и OB. Однако методы на основе набора уровней зависят от модальности и не могут свободно применяться среди различных последовательностей или модальностей. Кроме того, ни один из этих методов не может реализовать одновременное расположение и эволюцию областей IB, OB и опухоли.
В последнее время стратегии DL на основе CNN стали мощными инструментами для семантической сегментации КТ-изображений просвета мочевого пузыря (90–92).В течение 2018 года наша группа (83) предложила модифицированную структуру UNet с прогрессивным расширенным модулем CNN, впервые реализовав одновременную сегментацию IB, OB и BCa на T2WI. Средний коэффициент Дайса (DSC) для IB и OB составлял 0,9836 и 0,8391, соответственно, но для области опухоли был только 0,6856 (83).
Учитывая, что различные последовательности изображений могут предоставить дополнительную информацию для диагностики BCa, то, как реализовать одновременную сегментацию нескольких целевых областей на изображениях мочевого пузыря mpMRI, становится конечной целью рабочего процесса (рис. 1).С этой целью мы разрабатываем структуру автоматической мультирегиональной сегментации мочевого пузыря на рисунке 4, которая основана на стратегии слияния Mask-R-CNN (94) и mpMRI (95) с несколькими метками для реализации мультирегиональной сегментации изображений мочевого пузыря mpMRI.
Рисунок 4 Будущая структура одновременной сегментации многоцелевых областей из mpMRI мочевого пузыря. Gt_class_id, Gt_boxes и Gt_masks представляют основную истину многорегиональной анатации, положение регионов, которые должны быть обнаружены и сфокусированы, и маску сегментации (94).
Радиомическая диагностика фенотипа BCa
Оценка BCa
Гистологическая степень BCa является критическим фактором для принятия решения о лечении и прогноза (96). Цистоскопическая резекция и биопсия остаются стандартными эталонами для классификации BCa (76), но могут легко вызвать диагностическую ошибку из-за гетерогенности опухолевых тканей (76).
С развитием неинвазивной визуализации признаки визуализации, отражающие степень BCa, были последовательно обнаружены (96–102).Например, сначала сообщалось, что увеличение времени пика в первую минуту (E max / 1 ) после введения контраста и самый крутой наклон DCE тесно связаны с ангиогенезом опухоли (97). Значения АЦП, включая среднее значение АЦП и нормализованное значение АЦП, полученное из DWI, продемонстрировали свою полезность для градации BCa (98–103). В частности, Rosenkrantz et al. (37) использовали количественные показатели, извлеченные из области опухоли на T2WI и DWI, включая диаметр опухоли, нормализованную интенсивность сигнала T2 и среднее значение ADC, для оценки степени опухоли, как показано в таблице 2.Хотя статистический анализ показал, что только среднее значение ADC было значимым предиктором, площадь под кривой (AUC) 0,804 была достигнута для оценки BCa (37), что можно было признать эмбриональной формой концепции радиомики mpMRI для диагностики BCa. .
Таблица 2 Связанные исследования и стратегии оценки BCa на основе КТ / МРТ за последние 20 лет.
В 2017 году наша группа предложила структуру радиомики и исследовала ее применимость для классификации BCa (25).Для количественного описания свойств опухоли мы использовали 102 радиомических функции, включающие функции гистограммы и функции на основе матрицы совместной встречаемости (GLCM) из карт DWI и ADC. Затем U-критерий Манна – Уитни и SVM-RFE были приняты для выбора характеристик и разработки диагностической модели. Результаты, основанные на 61 пациенте, показали, что диагностическая модель достигла благоприятных результатов для классификации BCa с AUC 0,861, что было значительно лучше, чем при использовании только средних значений ADC.Позже Ван и др. (76) исследовали эффективность использования стратегии радиомики с картами T2WI, DWI и ADC для оценки BCa, достигнув более благоприятных диагностических характеристик с AUC 0,9276 (76).
Кроме того, в нескольких исследованиях была предпринята попытка извлечь особенности текстуры из области опухоли на КТ-изображениях для оценки BCa. Особенности текстуры первого порядка, такие как среднее значение, стандартное отклонение (SD), энтропия, среднее значение положительных пикселей (MPP), асимметрия и эксцесс, а также функции второго порядка, такие как функции GLCM и матрица длин серий на уровне серого ( GLRLM), обычно используются и достигают наивысшего значения AUC, равного 0.83 (107–109).
MIS Prediction and Staging
Точное прогнозирование стадии и MIS BCa также имеет решающее значение при принятии решений о лечении (37, 47, 105, 106). Патологическое исследование образцов трансуретральной резекции опухоли мочевого пузыря (ТУР мочевого пузыря) является первоочередным ориентиром для предоперационного определения стадии РМЖ (38, 44, 47, 49, 51, 110). Однако это может вызвать диагностические ошибки, такие как занижение стадии, введение врачей в заблуждение при принятии решений (38, 44, 47, 51, 110, 111). В предыдущем исследовании сообщалось, что частота ошибок при предоперационном определении стадии BCa варьируется от 20 до 80% (20).
В современной клинической практике инструменты неинвазивной визуализации, такие как КТ и МРТ, также широко используются для определения стадии BCa и прогнозирования MIS (15, 49, 51, 52, 112). Однако точность и надежность использования этих инструментов визуализации неудовлетворительны из-за проблем с различением между подслизистой инвазией и мышечной инвазией, а также между мышечной инвазией и перивезикальной пролиферацией жира с помощью визуального восприятия (15, 47, 50, 51, 112).
В 2000 году Hayashi et al. (49) наблюдали, что визуальный знак СКВ часто появляется на изображениях DCE пациентов NMIBC (50).Это открытие, несомненно, является важной вехой в диагностике стадии BCa и MIS на основе изображений. Впоследствии Takeuchi et al. (44, 50) сообщили о другом важном признаке, называемом подслизистым стеблем, или знаком «дюймового червя», обнаруженном среди большинства NMIBC на DWI, что повышает точность и надежность диагностики стадии BCa и MIS на основе изображений (49). Затем многие исследования показали, что значения ADC, полученные для опухолей мочевого пузыря высокой стадии (≥ T2) на DWI, были значительно ниже, чем значения для опухолей мочевого пузыря низкой стадии (≤ T1), и, таким образом, могли использоваться для количественной диагностики стадии BCa и MIS с AUC примерно между 0.65 и 0,96 (37, 38, 47, 49, 52, 104, 105, 110), как показано в Таблице 3.
Таблица 3 Связанные исследования и стратегии определения стадии BCa на основе КТ / МРТ и прогнозирования MIS во время последние 20 лет.
Путем интеграции всех этих визуализационных знаков Panebianco et al. (114) предложили VI-RADS для количественной оценки этих признаков на mpMRI и дальнейшей стандартизации диагностических процедур на основе изображений для прогнозирования MIS (44, 45, 114). Затем эффективность оценивалась тремя группами, при этом AUC варьировалась от 0.873 и 0,94 (39, 40, 51, 111). Хотя VI-RADS интегрировал все существующие признаки визуализации, такие как неоднородность интенсивности опухоли, стебель и СКВ, в систему баллов для прогнозирования MIS, это все еще полуколичественный и зависимый от экспертов процесс. Радиомические модели, основанные на высокопроизводительных количественных характеристиках изображений для автоматического прогнозирования фенотипов опухолей, считаются более практичным методом.
Фактически, до того, как был предложен VI-RADS, мы сообщили о первой радиомической стратегии для MIS-прогнозирования BCa (24).Эта стратегия использовала 63 радиомических функции, включая особенности на основе гистограмм и особенности GLCM, извлеченные из исходного T2WI и его производных карт высокого порядка для характеристики опухоли, достигая AUC 0,861 при прогнозировании MIS (24). Вскоре после этого мы извлекли функции GLCM и GLRLM из изображений T2WI, DWI и ADC и добились значительного улучшения производительности в прогнозировании MIS с AUC 0,9756 (26). Затем Zhang et al. (30) творчески включили как область опухоли, так и базальную часть с номограммой радиомики, предложенной Wu (29, 113), что указывает на то, что базальная часть опухолей мочевого пузыря также имеет решающее значение для прогнозирования BCa MIS.
Все эти радиомические исследования основывались на данных одного центра. В 2020 году мы собрали базу данных mpMRI с двойным центром, включающую 106 подходящих пациентов, и приняли пять категорий характеристик текстуры и клинических факторов для разработки новой модели номограммы для прогнозирования MIS, достигнув значений AUC 0,924 и 0,877 как в обучающей, так и в проверочной когортах. соответственно (115).
Радиомная стратификация риска рецидива BCa
Отличительным эпидемиологическим свойством BCa является высокая частота рецидивов.Частота рецидивов у пациентов с NMIBC, перенесших ТУР в течение одного года, достигала 70% (8, 10, 112). Однако у 50% пациентов с МРМР, перенесших радикальную цистэктомию (РЦ) с двусторонней лимфодиссекцией и подвздошными кондуитами, в течение следующих 24 месяцев развивается местный или метастатический рецидив (61, 116, 117). Предоперационное прогнозирование риска рецидива у пациентов с BCa имеет решающее значение для облегчения соответствующих стратегий адъювантного лечения и ведения пациентов.
В настоящее время EAU предоставил рекомендации по разделению пациентов с BCa на разные группы, чтобы рекомендовать более специфическую адъювантную терапию (8, 10, 15, 29, 112), как показано на рисунке 5.В соответствии с таблицей риска Европейской организации по исследованию и лечению рака (EORTC) в рекомендациях пациенты с NMIBC классифицируются по группам низкого, среднего и высокого риска рецидива и рекомендуют ТУРМТ + внутрипузырную химиотерапию (ВВХ), ТУРМГ + одногодичный бацилл. Кальмет-Герен (BCG) и RC. Тем не менее, эта таблица риска просто учитывает шесть преобладающих клинических и гистопатологических факторов, включая количество опухолей, размер опухоли, частоту предшествующих рецидивов, стадию Т, степень и наличие сопутствующих опухолей in situ (Tis), для достижения количественного прогноза. риска рецидива (10, 29).
Рис. 5 Рекомендации по лечению пациентов с BCa на основе MIS, степени и стратификации риска рецидива.
Затем Клуб Urológico Español de Tratamiento Oncológico (CUETO) разработал новую таблицу рисков для прогнозирования краткосрочных и долгосрочных рисков рецидива для пациентов с NMIBC после послеоперационного лечения БЦЖ (15). Впоследствии во многих исследованиях сообщалось, что точность таблиц риска EORTC и CUETO была гораздо менее чем удовлетворительной при стратификации риска рецидива NMIBC, с индексом C Харрелла в диапазоне от 0.51 и 0,77 (8, 10, 35, 48, 118–122), как показано в таблице 4. В других исследованиях также сообщалось, что участки опухоли в шейке мочевого пузыря и / или тригоне, степень и стадия являются независимыми факторами риска для прогнозирования Повторение BCa (48, 117, 123). В 2019 году Yajima et al. (48) обнаружили, что стебель опухоли (признак дюймового червя) на DWI является важным признаком прогноза BCa.
Таблица 4 Связанные исследования и стратегии прогнозирования риска рецидива BCa за последние 20 лет.
Учитывая, что высокопроизводительные радиомические особенности основной области опухоли могут отражать неоднородность опухоли и микросреду, которые тесно связаны с рецидивом опухоли, полное использование этих функций может обеспечить более точное прогнозирование риска Повторение BCa.
Исходя из этого предположения, наша группа ретроспективно собрала предоперационные изображения T2WI, DWI, ADC и DCE у 71 пациента, у которых были подтверждены NMIBC или MIBC, которые лечились с помощью TURBT или RC соответственно, и наблюдались в течение 2 лет (61). Затем 1872 радиомических признака были извлечены из областей опухоли их предоперационной mpMRI, включая особенности гистограммы, особенности GLCM, особенности GLRLM, особенности соседней матрицы разницы в оттенках серого (NGTDM) и функции матрицы размеров зон на уровне серого (GLSZM).После этого эти характеристики в сочетании с важными клиническими факторами риска, такими как возраст, пол, степень, MIS, стебель, SLE, размер опухоли, количество поражений и выбор операции (TURBT или RC), были использованы для разработки радиомико-клинической номограммы. . Производительность модели номограммы получила значения AUC 0,915 и 0,838 для когорт обучения и проверки, соответственно. Эти результаты предполагают, что стратегия радиомики имеет отличный потенциал в предоперационном прогнозировании рецидива BCa.
Обсуждение и перспективы на будущее
Рак мочевого пузыря — очень распространенное заболевание среди мужчин пожилого возраста (1–3).Точная диагностика фенотипов опухолей и риска рецидива служит «краеугольным камнем» соответствующей клинической терапевтической стратегии и имеет жизненно важное значение для последующего ведения пациентов с РМЖ. Стандартным эталоном для предоперационной диагностики фенотипов BCa является цистоскопическая биопсия, которая представляет собой инвазивную процедуру, сопряженную с определенным риском перфорации мочевого пузыря (30). Что еще более важно, может возникнуть значительный риск ошибочного диагноза, такой как занижение или завышение стадии, что приводит к неправильной оценке риска рецидива на основе EORTC и задерживает надлежащее радикальное лечение (8, 10, 13, 30).
В последние годы считывание предоперационных рентгенографических изображений, полученных с помощью КТ, КЭКТ, ПЭТ, мпМРТ или УЗИ, играет важную роль в неинвазивной диагностике и прогнозировании рецидивов РМЖ, в которых стратегии радиомики также продемонстрировали свою огромную силу в выявлении сложных паттернов. точно, эффективно и стабильно (124). Ожидается, что объединение стратегий радиомики с неинвазивной визуализацией в клинических условиях предоставит урологу более ценную дополнительную информацию для диагностики и прогноза BCa до операции.
Однако клиническое применение неинвазивных методов радиомики на основе визуализации для предоперационной расшифровки фенотипов BCa и риска рецидива все еще находится в зачаточном состоянии. В этом исследовании мы рассмотрели быстрый прогресс в этой области за последние 20 лет, суммируя весь трубопровод стратегии радиомики, включая определение области интереса, извлечение радиомических признаков, прогнозирование фенотипа опухоли и стратификацию риска рецидива, искренне надеясь на дальнейшее продвижение массовых исследований. клиническое применение инструментов неинвазивной радиомики для предоперационной диагностики и прогноза BCa в ближайшем будущем.
В этом разделе мы особо остановились на текущих подводных камнях, проблемах и возможностях в этой области.
Общедоступные наборы данных визуализации для BCa
Сбор данных — это первый шаг к внедрению радиомических стратегий для прогнозирования фенотипа BCa и риска рецидива. В настоящее время существует несколько общедоступных баз данных для исследований BCa, в том числе Национальная база данных по раку (NCDB), база данных по надзору, эпидемиологии и конечным результатам Национального института рака (SEER) (125) и The Cancer Imaging. Архив базы данных (TCIA).Хотя первые две базы данных содержат около 100 тысяч пациентов с BCa, большинство из них содержат только клинические диагнозы, методы лечения и конечные результаты без прикрепленных наборов данных визуализации. Целью TCIA является деидентификация и размещение большого архива медицинских изображений рака, доступных для публичного исследования. Однако он содержит всего 139 медицинских изображений пациентов с BCa. Следовательно, текущие общедоступные наборы данных очень ограничены для разработки радиомической модели с достаточным обучением и тестированием для задачи прогнозирования.
Одновременная сегментация нескольких областей из мультимодальных изображений мочевого пузыря
Точная сегментация нескольких областей мочевого пузыря на изображениях, включая области опухоли, базальные части и области стенок мочевого пузыря, является важным шагом на пути к дальнейшему извлечению признаков для прогнозирования фенотипа опухоли. В нескольких предыдущих исследованиях была принята двухэтапная стратегия: сначала сегментировать смешанную область между IB и OB на исходном изображении, а затем отделить опухолевое поражение от области прикрепленной к нему стенки (78, 79, 81).Эта стратегия не только снижает точность сегментации, но также увеличивает сложность и затраты времени.
До сих пор только в одном исследовании применялась одновременная сегментация IB, OB и опухолевых областей из изображений мочевого пузыря (83), но его эффективность для сегментации опухоли была неудовлетворительной. Как показано на рисунке 4, ожидается, что сквозная структура, основанная на сетях DL, может способствовать повышению производительности сегментации (126–129). В частности, с большим количеством первичных доменов, таких как распределение толщины стенки мочевого пузыря, изменение формы и механизм внимания интегрированной целевой области (13, 30, 39, 53), могут быть созданы более точные и надежные модели на основе DL для улучшения точность и эффективность мультирегиональной сегментации мочевого пузыря из мультимодальных изображений, таких как mpMRI.
Количественное определение глубины инвазии для определения стадии BCa
Почти все предыдущие исследования были сосредоточены на области опухоли для выделения признаков (24, 107, 109, 130, 131). В настоящее время только одно исследование рассматривает как область опухоли, так и базальную часть для расчета радиомических признаков, и в нем сообщается о превосходстве этой новой стратегии для определения стадии и прогнозирования MIS (74). Учитывая, что область стенки мочевого пузыря также содержит полезную информацию, такую как толщина стенки мочевого пузыря (BWT), для обнаружения и диагностики BCa (81, 132), ожидается, что будет разработано больше функций для определения стадии BCa и прогнозирования MIS.Например, используя локализацию опухоли и BWT, распределенные в области стенки, инвазивная глубина BCa ( D в ) может быть определена энтропией минимального BWT ( BWT мин ) раковой области и среднее значение BWT ( BWT , среднее значение ), отличное от раковой области, как показано на рисунке 6.
Рисунок 6 Возможное определение глубины инвазии опухоли мочевого пузыря на основе распределения BWT в области стенки мочевого пузыря.
Полное использование VI-RADS для прогнозирования фенотипа BCa и стратификации риска рецидива
В течение последних 20 лет mpMRI все чаще используется в диагностике перед ТУРМР, обеспечивая высокую точность определения стадии BCa и дифференциации NMIBC и MIBC (30, 39, 40). Несмотря на неоспоримые достижения в области мпМРТ для визуализации мочевого пузыря, отсутствие стандартизации протоколов визуализации и базы отчетов становится основной причиной различий в производительности. С этой целью система оценки VI-RADS определяет стандартизованный подход к визуализации и отчету о mpMRI для BCa (39).Тем не менее, в большинстве предыдущих исследований основное внимание уделялось эффективности использования VI-RADS для различения пред-ТУРПТ между NMIBC и MIBC (13, 30, 51, 53), независимо от другой ценной диагностической информации, которую VI-RADS может содержать для терапевтической стратегии. (133, 134).
Del Giudice et al. (135, 136) недавно сообщили, что i) VI-RADS может предоставить ценную информацию для отбора пациентов, которые являются кандидатами на повторную ТУРМР, среди случаев высокого риска NMIBC; ii) VI-RADS может быть действительным и надежным для различения пациентов с BCa с экстрапузырным заболеванием и пациентов с BCa, ограниченными мышцами, до TURBT, а оценка VI-RADS 5 может использоваться для независимого прогнозирования значительной задержки времени до цистэктомии от других клинико-патологических факторов.Учитывая, что инвазивный статус мышц в значительной степени связан с рецидивом BCa, VI-RADS, которые хорошо отражают разницу в визуализации между NMIBC и MIBC, могут иметь потенциал для стратификации риска рецидива у пациентов с BCa.
Кроме того, в связи с тем, что многие хирургические узлы, включая урологию, приостановили выборные услуги и отложили выполнение многих срочных операций в разгар пандемии COVID-19, стадия BCa считается приоритетной из-за потенциально агрессивного поведения этого заболевания ( 137).VI-RADS в настоящее время может помочь урологу значительно сократить количество плановых процедур и получить точную оценку стадии опухоли на основе одного обследования, обеспечивая прогностический критерий для корректировки приоритета онкологического класса среди переполненных списков ожидания (137).
Интеграция «неглубоких» элементов с «глубокими» для диагностики фенотипа BCa
В настоящее время принятые радиомические элементы в основном включают морфологические элементы, описывающие геометрические свойства целевой области, и элементы текстуры, отображающие глобальную, локальную и региональную интенсивность шаблоны распределения целевой области (74, 115), которые разработаны на основе определенных физических или математических теорий распределения интенсивности пикселей, охарактеризованных на исходных изображениях, и поэтому могут рассматриваться как ручные или « мелкие, ».В последние годы радиомические особенности, извлеченные с помощью сетей глубокого обучения на основе CNN, все чаще используются для характеристики глубинных свойств опухолей для диагностики рака (126, 138, 139). Из-за того, что сети CNN являются черными ящиками, выбранная функция « deep » и разработанная модель кажутся трудно объяснимыми, что ограничивает их применение в клиниках. Ожидается, что с улучшением интерпретируемости глубоких особенностей интеграция мелких и глубоких особенностей обеспечит более точную предоперационную диагностику фенотипа BCa.
Макромезо-микро-мультиомное объединение информации для более точного и объяснимого прогнозирования рецидивов BCa
Хотя таблицы рисков EORTC и CUETO широко используются в качестве клинических справочных данных для стратификации риска рецидива NMIBC (10), их прогностическая эффективность намного ниже чем удовлетворительное (29, 120, 121, 140–142). Учитывая, что большинство характеристик в этих двух таблицах риска являются макроскопическими клиническими факторами, они могут плохо описывать скрытые свойства BCa, которые тесно связаны с рецидивом.До сих пор только одно исследование (61) воспроизводило осуществимость и эффективность радиомической стратегии для прогнозирования риска рецидива BCa, в рамках которой были приняты вручную извлеченные или неглубокие особенности из мезоскопической точки зрения.
В настоящее время принято считать, что опухоли мочевого пузыря неоднородны на уровне метаболомики и геномики (5). Например, специфические белки и РНК экзосом в моче можно использовать в качестве неинвазивных биомаркеров для скрининга BCa и прогнозирования фенотипа (143–149).Карциномы низкой степени злокачественности могут быть охарактеризованы на молекулярном уровне потерей гетерозиготности (LOH) хромосомы 9 и активационными мутациями генов, кодирующих рецептор 3 фактора роста фибробластов (FGFR3) и обратную транскриптазу теломеразы (TERT), в то время как считается, что возникает MIBC через плоскую дисплазию и ТИС (5). Сообщалось о сверхэкспрессии рецептора-2 эпидермального фактора роста человека (HER2) среди агрессивных BCa в течение последнего десятилетия, предполагая, что этот биомаркер может помочь в стратификации риска пациентов и выборе лечения (150, 151).Ферро и др. сообщили, что абсолютное количество базофилов тесно связано со временем до рецидива у пациентов с BCa высокой степени злокачественности, получавших БЦЖ после ТУР (152). Остается неизвестным, можно ли использовать эти биомаркеры для прогнозирования рецидива BCa. Таким образом, в будущем считается, что слияние макро-мезо-микроинформации, мультиомных характеристик и мультидисциплинарных знаний позволит значительно повысить эффективность прогнозирования риска рецидива.
Заключение
Технологии неинвазивной визуализации, такие как КТ, КТ с контрастным усилением и многопараметрическая МРТ, а также радиомные стратегии могут повысить общую эффективность фенотипической диагностики и прогнозирования риска рецидива для пациентов с раком мочевого пузыря.
Вклад авторов
XX и HW собрали и проанализировали литературу. XX и HW написали рукопись. XX, HL и YL помогли с дизайном письма и отредактировали рукопись. YG, XZ, BL и PD предоставили содержательные комментарии и предложения по рукописи. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Работа частично поддержана Национальным фондом естественных наук Китая (гранты № 81
8, 81871424, 61976248 и 82071989), Фондом военной науки и технологий (грант №BLB19J0101 и Young Eagle Plan of High Ambition Project в рамках гранта № 2020CYJHXXP.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
1. Брей Ф., Ферли Дж., Сурджоматарам И., Сигель Р.Л., Торре Л.А., Джемаль А. Глобальная статистика рака 2018 г .: Глобальные оценки заболеваемости и смертности от 36 раковых заболеваний в 185 странах по всему миру. CA: Рак J Clin (2018) 68 (6): 349–424. doi: 10.3322 / caac.21492
CrossRef Полный текст | Google Scholar
3. Сунг Х., Ферлей Дж., Сигель Р.Л., Лаверсанн М., Сурджоматарам И., Джемал А. и др. Глобальная статистика рака 2020: GLOBOCAN оценки заболеваемости и смертности по всему миру для 36 видов рака в 185 странах. CA Cancer J Clin (2021) 71 (3): 209–49. doi: 10.3322 / caac.21660
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5.Санли О., Добрух Дж., Ноулз М.А., Бургер М., Алемозаффар М., Нильсен М.Э. и др. Рак мочевого пузыря. Nat Rev Dis Primers (2017) 13 (3): 17022. doi: 10.1038 / nrdp.2017.22
CrossRef Полный текст | Google Scholar
6. Burger M, Catto JW, Dalbagni G, Grossman HB, Herr H, Karakiewicz P, et al. Эпидемиология и факторы риска уротелиального рака мочевого пузыря. Eur Urol (2016) 34 (3): 124–33. doi: 10.1016 / j.eururo.2012.07.033
CrossRef Полный текст | Google Scholar
8.Альфред Витьес Дж., Лебрет Т., Комперат Э.М., Коуэн Н.С., Де Сантис М., Брюинз Х.М. и др. Обновленные рекомендации ЕАУ по мышечно-инвазивному и метастатическому раку мочевого пузыря 2016 г. Eur Urol (2017) 71 (3): 462–75. doi: 10.1016 / j.eururo.2016.06.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Антони С., Ферлей Дж., Сурджоматарам И., Знаор А., Джемал А., Брей Ф. Заболеваемость и смертность от рака мочевого пузыря: глобальный обзор и последние тенденции. Eur Urol (2017) 71 (1): 96–108.doi: 10.1016 / j.eururo.2016.06.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Бабжук М., Боле А., Бургер М., Капун О., Коэн Д., Comperat EM, et al. Рекомендации ЕАУ по неинвазивной уротелиальной карциноме мочевого пузыря: обновление 2016 г. Eur Urol (2017) 71 (3): 447–61. doi: 10.1016 / j.eururo.2016.05.041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Мох Х, Хамфри П., Улбрайт Т., Рейтер В. Опухоли мочевыводящих путей.В: Классификация опухолей мочевыделительной системы и мужских половых органов, Всемирная организация здравоохранения, , 4-е изд. IARC Press (2016). п. 77–133.
Google Scholar
12. Витжес Дж. А., Брюинз Х. М., Катомас Р., Комперат Е. М., Коуэн Н. С., Гакис Г. и др. Рекомендации Европейской ассоциации урологов по мышечно-инвазивному и метастатическому раку мочевого пузыря: Краткое изложение рекомендаций 2020 г. Eur Urol (2020). doi: 10.1016 / j.eururo.2020.03.055
CrossRef Полный текст | Google Scholar
13.Уэно Ю., Такеучи М., Тамада Т., Софуэ К., Такахаши С., Камишима Ю. и др. Точность диагностики и соглашение между наблюдателями для системы визуализации сосудов и данных о мышечно-инвазивном раке мочевого пузыря: многопоточное валидационное исследование. Eur Urol (2019) S0302-2838 (19): 30198–8.
Google Scholar
14. Соукуп В., Капун О, Коэн Д., Эрнандес В., Бургер М., Комперат Э. и др. Инструменты стратификации риска и прогностические модели при немышечно-инвазивном раке мочевого пузыря: критическая оценка, проведенная Европейской ассоциацией урологов группы рекомендаций по немышечно-инвазивному раку мочевого пузыря. Eur Urol Focus (2018).
Google Scholar
15. Фернандес-Гомес Дж., Мадеро Р., Сольсона Э., Унда М., Мартинес-Пинейро Л., Гонсалес М. и др. Прогнозирование рецидива и прогрессирования немышечно-инвазивного рака мочевого пузыря у пациентов, получавших лечение Bacillus Calmette-Guerin: оценочная модель CUETO. Дж. Урол (2009) 182 (5): 2195–203. doi: 10.1016 / j.juro.2009.07.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Каффенбергер С.Д., Миллер Д.К., Нильсен МЭ.От редакции: Упрощение лечения и уменьшение рецидивов для пациентов с раком мочевого пузыря на ранней стадии. JAMA (2018) 319 (18): 1864–5. DOI: 10.1001 / jama.2018.4656. (18): 1864-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Вукоманович И., Колович В., Солдатович И., Хаджи-Джокич Дж. Прогностическое значение локализации опухоли при неинвазивном раке мочевого пузыря высокой степени злокачественности. Med Oncol (2012) 29 (3): 1916–20. doi: 10.1007 / s12032-011-9999-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18.Aerts HJ, Velazquez ER, Leijenaar RT, Parmar C, Grossmann P, Carvalho S и др. Расшифровка фенотипа опухоли с помощью неинвазивной визуализации с использованием подхода количественной радиомики. Нац Коммун (2014) 5: 4006. doi: 10.1038 / ncomms5644
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Тюркер П., Бостром П.Дж., Вроцлавски М.Л., ван Рейн Б., Кортекангас Х., Кук С. и др. Повышение уровня уротелиального рака во время радикальной цистэктомии: факторы, связанные с повышением степени и его влияние на исход. BJU Int (2012) 110 (6): 804–11. doi: 10.1111 / j.1464-410X.2012.10939.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. van Rhijn BW, Burger M, Lotan Y, Solsona E, Stief CG, Sylvester RJ, et al. Рецидив и прогрессирование заболевания при немышечно-инвазивном раке мочевого пузыря: от эпидемиологии к стратегии лечения. Eur Urol (2009) 56 (3): 430–42. doi: 10.1016 / j.eururo.2009.06.028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23.Макрам М., Микаэль П., Марк З., Джиллали С., Бернард Д. Значение второй трансуретральной резекции в оценке пациентов с опухолями мочевого пузыря. Eur Urol (2003) 43 (3): 241–5. DOI: 10.1016 / S0302-2838 (03) 00040-X
PubMed Реферат | CrossRef Полный текст | Google Scholar
24. Xu X, Liu Y, Zhang X, Tian Q, Wu Y, Zhang G и др. Предоперационное прогнозирование мышечной инвазивности рака мочевого пузыря с радиомными особенностями на традиционной МРТ и ее производных картах высокого порядка. Абдоминальная радиология (2017) 42 (7): 1896–905. doi: 10.1007 / s00261-017-1079-6
CrossRef Полный текст | Google Scholar
25. Zhang X, Xu X, Tian Q, Li B, Wu Y, Yang Z и др. Радиомическая оценка степени рака мочевого пузыря с использованием характеристик текстуры из диффузно-взвешенной визуализации. J Магнитно-резонансная томография: JMRI (2017) 46 (5): 1281–8. doi: 10.1002 / jmri.25669
CrossRef Полный текст | Google Scholar
26. Xu X, Zhang X, Tian Q, Wang H, Cui LB, Li S, et al.Количественная идентификация немышечно-инвазивных и мышечно-инвазивных карцином мочевого пузыря: многопараметрический радиомический анализ МРТ. J Магнитно-резонансная томография: JMRI (2019) 49 (5): 1489–98. doi: 10.1002 / jmri.26327
CrossRef Полный текст | Google Scholar
27. Сватек Р.С., Холленбек Б.К., Холманг С., Ли Р., Ким С.П., Стензл А. и др. Экономика рака мочевого пузыря: стоимость и аспекты лечения этого заболевания. Eur Urol (2014) 66 (2): 253–62. DOI: 10.1016 / j.eururo.2014.01.006
PubMed Реферат | CrossRef Полный текст | Google Scholar
28. Burger M, van der Aa MN, van Oers JM, Brinkmann A, van der Kwast TH, Steyerberg EC, et al. Прогнозирование прогрессирования немышечно-инвазивного рака мочевого пузыря по классификации ВОЗ за 1973 и 2004 годы и по статусу мутации FGFR3: проспективное исследование. Eur Urol (2008) 54 (4): 835–43. doi: 10.1016 / j.eururo.2007.12.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29.Камбье С., Сильвестр Р.Дж., Коллетт Л., Гонтеро П., Браузи М.А., ван Андел Г. и др. Номограммы EORTC и группы риска для прогнозирования рецидивов, прогрессирования, специфического заболевания и общей выживаемости у пациентов с уротелиальным раком мочевого пузыря Ta-T1 неинвазивной стадии, получавших лечение в течение 1-3 лет поддерживающей терапии Bacillus Calmette-Guerin. Eur Urol (2016) 69 (1): 60–9. doi: 10.1016 / j.eururo.2016.01.055
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Панебианко В., Наруми Ю., Баркетти Дж., Монтирони Р., Катто Дж.В.Ф.Следует ли выполнять многопараметрическую магнитно-резонансную томографию мочевого пузыря перед трансуретральной резекцией мочевого пузыря? Пора пересмотреть правила. Eur Urol (2019) 76 (1): 57–8. doi: 10.1016 / j.eururo.2019.03.046
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Ван дер Пол CB, Chung A, Lim C, Gandhi N, Tu W, McInnes MDF, et al. Обновленная информация о многопараметрической МРТ рака мочевого пузыря. J Магнитно-резонансная томография: JMRI (2018) 48 (4): 882–96. DOI: 10.1002 / jmri.26294
CrossRef Полный текст | Google Scholar
32. Маккирнан Дж., Асафу-Аджеи Д. Преодоление гендерного разрыва: рак мочевого пузыря более опасен для женщин, чем для мужчин, и нуждается в изменениях. Nature (2017) S39: 1–2. doi: 10.1038 / 551S39a
CrossRef Полный текст | Google Scholar
33. Фахми О., Хайрул-Асри М.Г., Шуберт Т., Реннингер М., Малек Р., Кублер Х. и др. Систематический обзор и метаанализ отдаленных онкологических результатов после тримодальной терапии и радикальной цистэктомии с неоадъювантной химиотерапией или без нее при мышечно-инвазивном раке мочевого пузыря. Urologic Oncol (2018) 36 (2): 43–53. doi: 10.1016 / j.urolonc.2017.10.002
CrossRef Полный текст | Google Scholar
34. Rais-Bahrami S, Pietryga JA, Nix JW. Современная роль расширенной визуализации для определения стадии рака мочевого пузыря. Urologic Oncol (2016) 34 (3): 124–33. doi: 10.1016 / j.urolonc.2015.08.018
CrossRef Полный текст | Google Scholar
35. Ким HS, Jeong CW, Kwak C, Kim HH, Ku JH. Новые номограммы для прогнозирования рецидива и прогрессирования первичного немышечно-инвазивного рака мочевого пузыря: подтверждение прогностической эффективности в сравнении с системой балльной оценки Европейской организации исследований и лечения рака. World J Urol (2019) 37 (9): 1867–77. doi: 10.1007 / s00345-018-2581-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Ван Х, Пуй М., Гуо Й, Ян Д., Пан Б., Чжоу Х. МРТ с диффузионно-взвешенной структурой при карциноме мочевого пузыря: различие между рецидивом опухоли и доброкачественными изменениями после резекции. Абдоминальная визуализация (2014) 39 (1): 135–41. doi: 10.1007 / s00261-013-0038-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37.Розенкранц А.Б., Хагхиги М., Хорн Дж., Наик М., Харди А.Д., Сомберг М.Б. и др. Использование количественных показателей МРТ для оценки стадии и степени уротелиальной карциномы мочевого пузыря: предварительные результаты. AJR Am J Roentgenol (2013) 201 (6): 1254–9. doi: 10.2214 / AJR.12.10348
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Ван Х., Пуй М.Х., Гуань Дж., Ли С., Лин Дж., Пан Б. и др. Сравнение раннего подслизистого усиления и опухолевого стебля при стадировании уротелиальной карциномы мочевого пузыря. AJR-Am J Roentgenol (2016) 207 (4): 797–803. doi: 10.2214 / AJR.16.16283
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Панебианко В., Наруми Ю., Алтун Е., Бохнер Б. Х., Эфстатиу Дж. А., Хафиз С. и др. Многопараметрическая магнитно-резонансная томография рака мочевого пузыря: разработка VI-RADS (системы визуализации и данных пузырей). Eur Urol (2018) 74 (3): 294–306. doi: 10.1016 / j.eururo.2018.04.029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40.Thoeny HC, Bellin MF, Comperat EM, Thalmann GN. Система визуализации и обработки данных сосудов (VI-RADS): дополнительная ценность для ведения пациентов с раком мочевого пузыря? Eur Urol (2018) 74 (3): 307–8. doi: 10.1016 / j.eururo.2018.06.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Такеучи М., Сасаки С., Ито М., Окада С., Такахаши С., Кавай Т. и др. Рак мочевого пузыря: диффузионно-взвешенная МРТ — точность диагностики стадии T и оценки гистологической степени тяжести1. Радиология (2009) 251 (1): 112–21. doi: 10.1148 / radiol.2511080873
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Ренар-Пенна Р., Роше Л., Рой С. и др. Протоколы визуализации для КТ урографии: результаты согласованной конференции Французского общества визуализации мочеполовой системы. Eur Radiol (2020) 30 (3): 1387–96. doi: 10.1007 / s00330-019-06529-6
PubMed Реферат | CrossRef Полный текст | Google Scholar
43. Molen AJVD, Cowan NC, Mueller-Lisse UG, Nolte-Ernsting CCA, Takahashi S, Cohan RH, et al.КТ урография: определение, показания и методы. Руководство по клинической практике Eur Radiol (2008) 18: 4–17. doi: 10.1007 / s00330-007-0792-x
CrossRef Полный текст | Google Scholar
44. Ганди Н., Кришна С., Бут С.М., Бро Р.Х., Флуд Т.А., Морган С.К. и др. Диагностическая точность магнитно-резонансной томографии для определения стадии рака мочевого пузыря: систематический обзор и метаанализ. BJU Int (2018) 122 (5): 744–53. doi: 10.1111 / bju.14366
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45.Woo S, Suh CH, Kim SY, Cho JY, Kim SH. Диагностическая эффективность МРТ для прогнозирования мышечной инвазивности рака мочевого пузыря: систематический обзор и метаанализ. Eur J Radiol (2017) 95: 46–55. doi: 10.1016 / j.ejrad.2017.07.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Zhang N, Wang X, Wang C, Chen S, Wu J, Zhang G и др. Диагностическая точность многопараметрической магнитно-резонансной томографии для определения стадии рака мочевого пузыря: метаанализ. Передний Oncol (2019) 9: 981. doi: 10.3389 / fonc.2019.00981
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Bollineni VR, Kramer G, Liu Y, Melidis C, deSouza NM. Литературный обзор ассоциации между диффузионно-взвешенным коэффициентом диффузии, полученным с помощью МРТ, и агрессивностью опухоли при раке таза. Лечение рака Ред. (2015) 41 (6): 496–502. doi: 10.1016 / j.ctrv.2015.03.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48.Ядзима С., Йошида С., Такахара Т., Арита Ю., Танака Х., Васеда Ю. и др. Полезность знака Inchworm на DWI для прогнозирования прогрессирования рака мочевого пузыря Pt1. Eur Radiol (2019) 29 (7): 3881–8. doi: 10.1007 / s00330-019-06119-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Хаяси Н., Точиги Х., Шираиши Т., Такеда К., Кавамура Дж. Новый критерий стадии рака мочевого пузыря с использованием магнитно-резонансной томографии с усилением гадолиния с эндоректальной поверхностной катушкой: сравнение с ультразвуковым исследованием. BJU Int (2000) 85 (1): 32–6. doi: 10.1046 / j.1464-410x.2000.00358.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Текес А., Камель И., Имам К., Шарф Г., Шенберг М., Насир К. и др. Динамическая МРТ рака мочевого пузыря: оценка точности постановки. AJR Am J Roentgenol (2005) 184 (1): 121–7. doi: 10.2214 / ajr.184.1.01840121
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Баркетти Дж., Симоне Дж., Сераволо I, Сальво В., Кампа Р., Дель Джудис Ф. и др.Многопараметрическая МРТ мочевого пузыря: согласие между наблюдателями и точность с помощью системы визуализации и данных пузырей (VI-RADS) в едином справочном центре. Eur Radiol (2019) 29 (10): 5498–506. doi: 10.1007 / s00330-019-06117-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Луо Ц., Хуанг Б., Ву И, Чен Дж, Чен Л. Использование системы визуализации и данных пузырей (VI-RADS) для обнаружения инвазии в мышцу рака мочевого пузыря: диагностический мета-анализ. Eur Radiol (2020) 30 (8): 4606–14. doi: 10.1007 / s00330-020-06802-z
PubMed Реферат | CrossRef Полный текст | Google Scholar
53. Ван Х, Ло Ц., Чжан Ф., Гуань Дж., Ли С., Яо Х и др. Многопараметрическая МРТ для рака мочевого пузыря: проверка VI-RADS для обнаружения инвазии детрузора. Радиология (2019) 291 (3): 668–74. doi: 10.1148 / radiol.2019182506
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Zhu X, Dong D, Chen Z, Fang M, Zhang L, Song J, et al.Радиомная сигнатура как диагностический фактор для гистологической классификации подтипов немелкоклеточного рака легкого. Eur Radiol (2018) 28 (7): 1–7. doi: 10.1007 / s00330-017-5221-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Башир Ю., Кава Б., Сиддик М., Мак С.М., Наир А., Маклин Е. и др. Неинвазивная классификация немелкоклеточного рака легкого: сравнение между случайными моделями леса с использованием радиомических и семантических характеристик. Br J Radiol (2019) 92 (201
): 1–8.doi: 10.1259 / bjr.201
CrossRef Полный текст | Google Scholar
56. Ли Х, Чжу Й., Бернсайд Э.С., Хуанг Э., Друккер К., Хоадли К.А. и др. Количественная радиомика МРТ в прогнозировании молекулярных классификаций подтипов рака молочной железы в наборе данных TCGA / TCIA. NPJ Рак молочной железы (2016) 2: 16012. doi: 10.1038 / npjbcancer.2016.12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Хуанг YQ, Liang CH, He L, Tian J, Liang CS, Chen X и др.Разработка и проверка радиомической номограммы для предоперационного прогнозирования метастазов лимфатических узлов при колоректальном раке. J Clin Oncol: Off J Am Soc Clin Oncol (2016) 34 (18): 2157–64. doi: 10.1200 / JCO.2015.65.9128
CrossRef Полный текст | Google Scholar
58. Xu X, Zhang X, Tian Q, Zhang G, Liu Y, Cui G и др. Особенности трехмерной текстуры из карт интенсивности и производных высокого порядка для различения опухолей мочевого пузыря и тканей стенки с помощью МРТ . Int J Comput Assisted Radiol Surg (2017) 12 (4): 645–56. doi: 10.1007 / s11548-017-1522-8
CrossRef Полный текст | Google Scholar
59. Lambin P, Leijenaar RTH, Deist TM, Peerlings J, de Jong EEC, van Timmeren J, et al. Радиомика: мост между медицинской визуализацией и персонализированной медициной. Нат Рев Клин Онкол (2017) 14 (12): 749–62. doi: 10.1038 / nrclinonc.2017.141
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Xu X, Wang H, Du P, Zhang F, Li S, Zhang Z, et al.Прогностическая номограмма для индивидуальной стратификации рецидивов рака мочевого пузыря с использованием многопараметрической МРТ и клинических факторов риска. J Magn Reson Imaging (2019) 50 (6): 1893–904. doi: 10.1002 / jmri.26749
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Lambin P, Rios-Velazquez E, Leijenaar R, Carvalho S, van Stiphout RGPM, Granton P, et al. Радиомика: извлечение дополнительной информации из медицинских изображений с помощью расширенного анализа функций. Eur J Cancer (Oxfo Engl: 1990) (2012) 48 (4): 441–6.doi: 10.1016 / j.ejca.2011.11.036
CrossRef Полный текст | Google Scholar
63. Майтнер Т., Свобода Д. Вторая международная конференция по 3D-изображениям, моделированию, обработке, визуализации и передаче, 2012 г. , IEEE (2012): 301–7. doi: 10.1109 / 3DIMPVT.2012.61
CrossRef Полный текст | Google Scholar
64. Sun C, Wee WG. Соседняя матрица зависимости уровня серого для классификации текстур. Процесс графического изображения Compute Vision (1983) 23: 341–52.doi: 10.1016 / 0734-189X (83)
- -4
CrossRef Полный текст | Google Scholar
65. Galloway MM. Анализ текстуры с использованием длин серого. Обработка изображений компьютерной графики (1975) 4: 172–9. doi: 10.1016 / S0146-664X (75) 80008-6
CrossRef Полный текст | Google Scholar
66. Ван X, Альбрегтсен Ф., Фойн Б. Особенности текстуры из матрицы длины зазора на уровне серого. MVA’94 Семинар IAPR по приложениям машинного зрения . Кавасаки, Япония (1994).
Google Scholar
67.Тибо Дж., Ангуло Дж., Мейер Ф. Расширенные статистические матрицы для характеристики текстуры: применение к классификации хроматина ДНК и сети микротрубочек. В: Международная конференция IEEE по обработке изображений . IEEE (2011). п. 53–6. doi: 10.1109 / ICIP.2011.6116401
CrossRef Полный текст | Google Scholar
68. Тибо Дж., Ангуло Дж., Мейер Ф. Расширенные статистические матрицы для описания текстуры: приложение к классификации клеток. В: Транзакции IEEE по биомедицинской инженерии .(2014) т. 61 (3). п. 630–7.
Google Scholar
69. Амадасун М., Кинг Р. Текстурные особенности, соответствующие тканевым свойствам. В: Транзакции IEEE о системах, человеке и кибернетике . (1989) т. 19 (5). п. 1264–74.
Google Scholar
70. Харалик Р.М., Шанмугам К., Динштейн И.Х. Текстурные особенности для классификации изображений. В: Транзакции IEEE о системах, человеке и кибернетике . (1973) т. СМЦ-3 (6). п. 610–21.
Google Scholar
71.Тамура Х, Мори С., Ямаваки Т. Текстурные особенности, соответствующие визуальному восприятию. В: Транзакции IEEE о системах, человеке и кибернетике . (1978) т. SMC-8. (1978). п. 460–73.
Google Scholar
72. Тибо Дж., Фертил Б., Наварро С., Перейра С., Леви Н., Секейра Дж. И др. Применение текстурных индексов и матрицы зон размера серого к классификации ядер клеток. В: Распознавание образов и обработка информации (PRIP) . Минск, Беларусь (2009). п.140–5.
Google Scholar
73. Лю И, Чжэн Х, Сюй Х, Чжан Х, Ду П, Лян Дж. И др. Измерение глубины инвазии рака мочевого пузыря с помощью 2-взвешенной магнитно-резонансной томографии. Biomed Eng Online (2020) 19 (1): 92. doi: 10.21203 / rs.2.22984 / v4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Zheng J, Kong J, Wu S, Li Y, Cai J, Yu H и др. Разработка неинвазивного инструмента для предоперационной оценки мышечной инвазивности рака мочевого пузыря с использованием радиомического подхода. Рак (2019) 125 (24): 4388–4398.
PubMed Аннотация | Google Scholar
75. Wu S, Zheng J, Li Y, Wu Z, Shi S, Huang M, et al. Разработка и проверка радиомической сигнатуры на основе МРТ для предоперационного прогнозирования метастазов лимфатических узлов при раке мочевого пузыря. EBioMedicine (2018) 34: 76–84. doi: 10.1016 / j.ebiom.2018.07.029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Ван Х., Ху Д., Яо Х., Чен М., Ли С., Чен Х и др.Радиомический анализ многопараметрической МРТ для предоперационной оценки патологической степени злокачественных опухолей мочевого пузыря. Eur Radiol (2019) 29 (11): 6182–90. doi: 10.1007 / s00330-019-06222-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Цинь X, Ли X, Лю И, Лу Х, Ян П. Наборы уровней с предварительными ограничениями адаптивной формы для сегментации МР-изображений мочевого пузыря. IEEE J OF Biomed AND Health Informatics (2014) 18 (5): 1707–16. doi: 10.1109 / JBHI.2013.2288935
CrossRef Полный текст | Google Scholar
78.Дуань Ц., Юань К., Лю Ф., Сяо П., Ур Г, Лян З. Функции на основе объема для обнаружения аномальных областей стенки мочевого пузыря с помощью цистографии MR. IEEE Trans Biomed Eng (2011) 58 (9): 2506–12. doi: 10.1109 / TBME.2011.2158541
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. Дуань К., Юань К., Лю Ф., Сяо П., Ур. Г., Лян З. Адаптивная схема установки окна для сегментации поверхности опухоли мочевого пузыря с помощью MR-цистографии . IEEE Trans Inf Technol Biomed: Publ IEEE Eng Med Biol Soc (2012) 16 (4): 720–9.doi: 10.1109 / TITB.2012.2200496
CrossRef Полный текст | Google Scholar
80. Дуань Ц., Лян З., Бао С., Чжу Х., Ван С., Чжан Г. и др. Структура набора сопряженных уровней для сегментации стенки мочевого пузыря с применением в МР-цистографии. IEEE Trans Med Imaging (2010) 29 (3): 903–15. doi: 10.1109 / TMI.2009.2039756
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81. Xiao D, Zhang G, Liu Y, Yang Z, Zhang X, Li L и др. 3D-обнаружение и извлечение опухолей мочевого пузыря с помощью виртуальной цистоскопии MR. Int J Comput Assisted Radiol Surg (2016) 11 (1): 89–97. doi: 10.1007 / s11548-015-1234-x
CrossRef Полный текст | Google Scholar
82. Цинь X, Лу Х, Тиан Й, Ян П. Сегментация стенки мочевого пузыря, ограниченная частичной разреженной формой, управляемая сектором. Mach Vision Appl (2015) 26 (5): 593–606. doi: 10.1007 / s00138-015-0684-z
CrossRef Полный текст | Google Scholar
83. Dolz J, Xu X, Jeo R, Yuan J, Liu Y, Granger E, et al. Мультирегиональная сегментация структур рака мочевого пузыря в МРТ с прогрессивными расширенными сверточными сетями. Med Phys (2018) 45 (12): 5482–93. doi: 10.1002 / mp.13240
PubMed Аннотация | CrossRef Полный текст | Google Scholar
84. Xu X, Zhang X, Liu Y, Tian Q, Zhang G, Yang Z и др. Одновременная сегментация нескольких областей в трехмерной МРТ мочевого пузыря путем эффективной выпуклой оптимизации связанных поверхностей. Изображение Графика (2017) 10667. doi: 10.1007 / 978-3-319-71589-6_46
CrossRef Полный текст | Google Scholar
85. Li L, Liang Z, Wang S, Lu H, Wei X, Wagshul M, et al.Сегментация мультиспектральных МРТ-изображений мочевого пузыря с коррекцией неоднородности для виртуальной цистоскопии. Proc SPIE — Int Soc Optical Eng (2008) 6916: 69160U-U-5. doi: 10.1117 / 12.769914
CrossRef Полный текст | Google Scholar
86. Li L, Wang Z, Xiang L, Wei X, Adler HL, Wei H, et al. Новый подход к сегментации частичного объема для извлечения стенки мочевого пузыря для компьютерного обнаружения в виртуальной цистоскопии. Proc SPIE — Int Soc Optical Eng (2004). DOI: 10.1117 / 12.535913
CrossRef Полный текст | Google Scholar
87. Garnier C, Ke W, Dillenseger JL. Сегментация мочевого пузыря на МРТ-изображениях с использованием модели роста активной области. Int Conf IEEE Eng Med Biol Soc (2011), 5702–5. doi: 10.1109 / IEMBS.2011.60
CrossRef Полный текст | Google Scholar
88. Ма З., Хорхе Р.Н., Маскареньяс Т., Таварес Дж.М.С.С. Новый подход к сегментации внутренней и внешней границ стенки мочевого пузыря на T2-взвешенных изображениях магнитного резонанса. Энн Биомед Eng (2011) 39 (8): 2287–97.doi: 10.1007 / s10439-011-0324-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89. Хан Х, Ли Л., Дуань Ц., Чжан Х, Чжао Ю., Лян З. Унифицированный ЭМ-подход к сегментации стенки мочевого пузыря с ограничениями, связанными со связанными уровнями. Med Image Anal (2013) 17 (8): 1192–205. doi: 10.1016 / j.media.2013.08.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
90. Ча К., Хаджиски Л., Чан Х.П., Каойли Е.М., Кохан Р.Х., Чжоу К. Урография с компьютерной томографией: сегментация мочевого пузыря с использованием CLASS с уточнением локального контура. Phys Med Biol (2014) 59 (11): 2767. doi: 10.1088 / 0031-9155 / 59/11/2767
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91. Гордон М.Н., Хаджийски Л.М., Ча К.Х., Самала Р.К., Чан Х.П., Кохан Р.Х. и др. Сверточная нейронная сеть с глубоким обучением: сегментация внутренней и внешней стенки мочевого пузыря в КТ урографии. Med Phys (2019) 46 (2): 634–48. doi: 10.1002 / mp.13326
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92. Ma X, Hadjiiski LM, Wei J, Chan HP, Cha KH, Cohan RH, et al.Сегментация мочевого пузыря с глубоким обучением на основе U-Net в КТ урографии. Med Phys (2019) 46 (4): 1752–65. doi: 10.1002 / mp.13438
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Chi JW, Brady M, Moore NR, Schnabel JA. Сегментация стенки мочевого пузыря с использованием методов сопряженных уровней. IEEE Int Symposium Biomed Imaging: Nano to Macro (2011). doi: 10.1109 / ISBI.2011.5872721
CrossRef Полный текст | Google Scholar
94. Zhao X, Xie P, Wang M, Li W, Pickhardt PJ, Xia W и др.Полностью автоматизированное обнаружение и сегментация лимфатических узлов на основе многопараметрической МРТ для рака прямой кишки: многоцентровое исследование. EBioMedicine (2020) 56: 102780. doi: 10.1016 / j.ebiom.2020.102780
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Trebeschi S, van Griethuysen JJM, Lambregts DMJ, Lahaye MJ, Parmar C, Bakers FCH, et al. Глубокое обучение для полностью автоматизированной локализации и сегментации рака прямой кишки на многопараметрической МРТ. Sci Rep (2017) 7 (1): 5301.doi: 10.1038 / s41598-017-05728-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96. Киркали З., Чан Т., Манохаран М., Алгаба Ф., Буш С., Ченг Л. и др. Рак мочевого пузыря: эпидемиология, стадия и классификация, диагностика. Урология (2005) 66 (6 Приложение 1): 4–34. doi: 10.1016 / j.urology.2005.07.062
PubMed Реферат | CrossRef Полный текст | Google Scholar
97. Tuncbilek N, Kaplan M, Altaner S, Atakan IH, Süt N, Inci O, et al. Значение динамического контраста МРТ и корреляция с опухолевым ангиогенезом при раке мочевого пузыря. AJR Am J Roentgenol (2009) 192 (4): 949–55. doi: 10.2214 / AJR.08.1332
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Avcu S, Koseoglu MN, Ceylan K, Dbulut M, Unal O. Значение диффузно-взвешенной МРТ в диагностике злокачественных и доброкачественных поражений мочевого пузыря. Br J Radiol (2011) 84 (2011): 875–82. doi: 10.1259 / bjr / 305
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99. Кобаяси С., Кога Ф., Йошида С., Масуда Х., Исии К., Танака Х. и др.Диагностические характеристики диффузно-взвешенной магнитно-резонансной томографии при раке мочевого пузыря: потенциальная полезность кажущихся значений коэффициента диффузии как биомаркера для прогнозирования клинической агрессивности. Eur Radiol (2011) 21 (10): 2178–86. doi: 10.1007 / s00330-011-2174-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Грин Д.А., Дюран М., Гумпени Н., Ринк М., Ча Е.К., Каракевич П.И. и др. Роль магнитно-резонансной томографии при раке мочевого пузыря: текущее состояние и новые методы. BJU Int (2012) 110 (10): 1463–70. doi: 10.1111 / j.1464-410X.2012.11129.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
101. Bihan DL. Видимый коэффициент диффузии и не только: что диффузионная МРТ-визуализация может рассказать нам о структуре ткани. Радиология (2013) 268 (2): 318–22. doi: 10.1148 / radiol.13130420
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102. Wang HJ, Pui MH, Guo Y, Li SR, Liu MJ, Guan J, et al. Значение нормализованного коэффициента видимой диффузии для оценки гистологической степени злокачественности пузырной уротелиальной карциномы. Clin Radiol (2014) 69 (7): 727–31. doi: 10.1016 / j.crad.2014.03.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
103. Suo S, Chen X, Ji X, Zhuang Z, Wu L, Yao Q, et al. Исследование негауссовских свойств диффузии воды при раке мочевого пузыря с использованием визуализации диффузного эксцесса: предварительное исследование. J Томог с помощью компьютеров (2015) 39: 281–5. doi: 10.1097 / RCT.0000000000000197
CrossRef Полный текст | Google Scholar
104.Кобаяси С., Кога Ф., Кадзино К., Йошита С., Исии С., Танака Х. и др. Кажущееся значение коэффициента диффузии отражает инвазивный и пролиферативный потенциал рака мочевого пузыря. J Магнитно-резонансная томография: JMRI (2014) 39 (1): 172–8. doi: 10.1002 / jmri.24148
CrossRef Полный текст | Google Scholar
105. Севченко С., Понхольд Л., Хайнц-Пер Дж., Файкович Х., Хайтель А., Сусани М. и др. Проспективная оценка диффузно-взвешенной МРТ мочевого пузыря как биомаркера для прогнозирования агрессивности рака мочевого пузыря. Urologic Oncol (2014) 32 (8): 1166–71. doi: 10.1016 / j.urolonc.2014.04.019
CrossRef Полный текст | Google Scholar
106. Севченко С., Хайтель А., Понхольд Л., Сусани М., Файкович Х., Шариат С.Ф. и др. Количественные измерения кажущегося коэффициента диффузии, полученные с помощью 3-тесла МРТ, коррелируют с биомаркерами пролиферативной активности рака мочевого пузыря. PloS One (2014) 9 (9): 1–6. doi: 10.1371 / journal.pone.0106866
CrossRef Полный текст | Google Scholar
107.Чжан Г-М-И, Сун Х, Ши Би, Цзинь Цзы-И, Сюэ Х-Д. Количественный анализ текстуры КТ для оценки гистологической степени уротелиальной карциномы. Абдоминальная радиология (2017) 42 (2): 561–8. doi: 10.1007 / s00261-016-0897-2
CrossRef Полный текст | Google Scholar
108. Маммен С., Кришна С., Куон М., Шабана В.М., Хаким С.В., Флуд Т.А. и др. Диагностическая точность качественного и количественного компьютерного томографического анализа для диагностики патологической степени и стадии уротелиально-клеточной карциномы верхних трактов. Дж. Томог с помощью компьютеров (2017) 42 (2): 204–10. doi: 10.1097 / RCT.0000000000000664
CrossRef Полный текст | Google Scholar
109. Zhang G, Xu L, Zhao L, Mao L, Li X, Jin Z, et al. Радиомика на основе КТ для прогнозирования патологической степени рака мочевого пузыря. Eur Radiol (2020) 30 (12): 6749–56. doi: 10.1007 / s00330-020-06893-8
PubMed Реферат | CrossRef Полный текст | Google Scholar
110. Хуанг Л., Конг К., Лю З., Ван Дж, Кан З., Чжу Ю. Диагностическая ценность МРТ в дифференциации Т-стадии рака мочевого пузыря: метаанализ. Радиология (2017) 286 (2): 171028. doi: 10.1148 / radiol.2017171028
CrossRef Полный текст | Google Scholar
111. Hassanien OA, Abouelkheir RT, El-Ghar MIA, Badawy ME, Gamal S-h, El-Hamid MA. Динамическая контрастно-усиленная магнитно-резонансная томография как диагностический инструмент в оценке ангиогенеза опухоли при раке мочевого пузыря. Can Assoc Radiol J (2019) 70 (3): 254–63. doi: 10.1016 / j.carj.2018.11.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
112.Сильвестр Р., Мейден А., Остерлинк В., Витжес Дж., Буффиу С., Денис Л. и др. Прогнозирование рецидива и прогрессирования у отдельных пациентов с раком мочевого пузыря стадии Ta T1 с использованием таблиц рисков EORTC: комбинированный анализ 2596 пациентов из семи исследований EORTC. Eur Urol (2006) 49 (3): 466–75. doi: 10.1016 / j.eururo.2005.12.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
113. Ван И, Шен Й, Ху Х, Ли З, Фэн Ц., Ху Д. и др. Применение R2 * и коэффициента кажущейся диффузии для оценки степени злокачественности опухоли и категории T рака мочевого пузыря. AJR Am J Roentgenol (2020) 214 (2): 383–9. doi: 10.2214 / AJR.19.21668
PubMed Аннотация | CrossRef Полный текст | Google Scholar
114. Панебианко В., Берардинис Э.Д., Баркетти Дж., Симоне Дж., Леонардо С., Громпоне М.Д. и др. Оценка морфологических и функциональных многопараметрических последовательностей МРТ при классификации немышечного и мышечно-инвазивного рака мочевого пузыря. Eur Radiol (2017) 27 (9): 3759–66. doi: 10.1007 / s00330-017-4758-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
115.Ван Х, Сюй Х, Чжан Х, Лю И, Оуян Л., Ду П и др. Разработка многопоследовательной радиомической сигнатуры на основе МРТ для предоперационного прогнозирования мышечно-инвазивного статуса рака мочевого пузыря: двухцентровое исследование. Eur Radiol (2020) 30 (9): 4816–27. doi: 10.1007 / s00330-020-06796-8
PubMed Реферат | CrossRef Полный текст | Google Scholar
116. Ha HK, Koo PJ, Kim SJ. Диагностическая точность ПЭТ / КТ F-18 FDG для предоперационного определения стадии лимфатических узлов у недавно диагностированных пациентов с раком мочевого пузыря: систематический обзор и метаанализ. Онкология (2018) 95 (1): 31–8. doi: 10.1159 / 000488200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
117. Fujii Y, Fukui I, Kihara K, Tsujii T., Ishizaka K, Kageyama Y, et al. Значение вовлечения шейки мочевого пузыря в прогрессирование поверхностного рака мочевого пузыря. Eur Urol (1998) 33: 464–8. doi: 10.1159 / 000019636
PubMed Аннотация | CrossRef Полный текст | Google Scholar
118. Wang Y, Hu D, Yu H, Shen Y, Tang H, Kamel IR, et al.Сравнение диагностической ценности моноэкспоненциальной, биэкспоненциальной и растянутой экспоненциально-взвешенной МРТ для дифференциации стадии опухоли и гистологической степени рака мочевого пузыря. Acad Radiol (2018) 26 (2): 239–46. doi: 10.1016 / j.acra.2018.04.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
119. Кодзимото Й., Кусумото Х., Нисидзава С., Киккава К., Кодама Й., Ко М. и др. Внешняя валидация Европейской организации по исследованию и лечению рака и Испанского урологического клуба для моделей оценки онкологического лечения для прогнозирования рецидива и прогрессирования у японских пациентов с немышечно-инвазивным раком мочевого пузыря, леченных с помощью Bacillus Calmette – Guérin. Int J Urol (2014) 21 (12): 1201–7. doi: 10.1111 / iju.12572
PubMed Аннотация | CrossRef Полный текст | Google Scholar
120. Xu T, Zhu Z, Zhang X, Wang X, Zhong S, Zhang M и др. Прогнозирование рецидива и прогрессирования у китайских пациентов с немышечно-инвазивным раком мочевого пузыря с использованием скоринговых моделей EORTC и CUETO. Урология (2013) 82 (2): 387–93. DOI: 10.1016 / j.urology.2013.04.007
PubMed Реферат | CrossRef Полный текст | Google Scholar
121.Xylinas E, Kent M, Kluth L, Pycha A, Comploj E, Svatek RS и др. Точность таблиц рисков EORTC и модели оценки CUETO для прогнозирования исходов при неинвазивной уротелиальной карциноме мочевого пузыря. Br J Cancer (2013) 109 (6): 1460–6. doi: 10.1038 / bjc.2013.372
PubMed Аннотация | CrossRef Полный текст | Google Scholar
122. Со К.В., Ким Б.Х., Пак С.Х., Ким С.И., Чанг Х.С. Эффективность системы оценки EORTC и таблиц риска для прогнозирования рецидива и прогрессирования немышечно-инвазивного рака мочевого пузыря после внутрипузырной инстилляции Bacillus Calmette-Guerin. Korean J Urol (2010) 51 (3): 165–70. doi: 10.4111 / kju.2010.51.3.165
PubMed Аннотация | CrossRef Полный текст | Google Scholar
123. Fujii Y, Fukui I, Kihara K, Tsujii T., Kageyama Y, Oshima H. Поздние рецидивы и прогрессирование после длительного периода без опухолей при первичном раке мочевого пузыря Ta и T1. Eur Urol (1999) 36: 309–13. doi: 10.1159 / 000020010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
124. Ge L, Chen Y, Yan C, Zhao P, Zhang P, Runa A, et al.Изучение прогресса радиомики с машинным обучением для точной медицины в лечении рака мочевого пузыря. Передний Oncol (2019) 9: 1296. doi: 10.3389 / fonc.2019.01296
PubMed Аннотация | CrossRef Полный текст | Google Scholar
125. Ван Дж, Ву Й, Хе В., Ян Б., Гоу Х. Номограмма для прогнозирования общей выживаемости пациентов с раком мочевого пузыря: популяционное исследование. Int J Biol Markers (2020) 35 (2): 1724600820. doi: 10.1177 / 17246008205
CrossRef Полный текст | Google Scholar
126.Ли Х., Юн С., Мансури М., Ким М., Таймир С.Х., Герье С.Э. и др. Объяснимый алгоритм глубокого обучения для обнаружения острого внутричерепного кровоизлияния на основе небольших наборов данных. Nat Biomed Eng (2019) 3 (3): 173–82. doi: 10.1038 / s41551-018-0324-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
127. Ямамото Ю., Цузуки Т., Акацука Дж., Уэки М., Морикава Х., Нумата Ю. и др. Автоматизированное получение объяснимых знаний из неаннотированных гистопатологических изображений. Нац Коммун (2019) 10 (1): 5642. doi: 10.1038 / s41467-019-13647-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
128. Арриета А., Родригес Н., Дель Сер Дж., Беннетот А., Табик С., Гонсалес А. и др. Объяснимый искусственный интеллект (XAI): концепции, таксономии, возможности и проблемы на пути к ответственному искусственному интеллекту. Inf Fusion (2020) 58: 82–115. doi: 10.1016 / j.inffus.2019.12.012
CrossRef Полный текст | Google Scholar
129. Агиус Р., Бригель К., Андерсен М.А., Пирсон А.Т., Ледергербер Б., Коззи-Лепри А. и др.Машинное обучение может выявлять недавно диагностированных пациентов с ХЛЛ с высоким риском заражения. Нац Коммуна (2020) 11 (1): 363. doi: 10.1038 / s41467-019-14225-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
130. Ли Х, Лю Л., Дин Л., Чжан З, Чжан М. Количественная оценка рака мочевого пузыря отражает степень и рецидив: сравнение трех методов определения области интереса для измерений АЦП при диффузионно-взвешенной МРТ. Acad Radiol (2019) 26: 1148–53.doi: 10.1016 / j.acra.2018.10.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
131. Wu S, Zheng J, Li Y, Yu H, Shi S, Xie W, et al. Радиомическая номограмма для предоперационного прогнозирования метастазов лимфатических узлов при раке мочевого пузыря. Clin Cancer Res (2017) 23 (22): 6904–11. doi: 10.1158 / 1078-0432.CCR-17-1510
PubMed Реферат | CrossRef Полный текст | Google Scholar
132. Чжан X, Лю И, Ян З, Тянь Кью, Чжан Г, Сяо Д. и др. Количественный анализ толщины стенки мочевого пузыря для магнитно-резонансной цистоскопии. IEEE Trans ON Biomed Eng (2015) 62 (10): 2402–9. doi: 10.1109 / TBME.2015.2429612
CrossRef Полный текст | Google Scholar
133. Панебианко В., Пекораро М., Дель Джудис Ф., Такеучи В., Мулья В., Мессина В. и др. VI-RADS для рака мочевого пузыря: текущие приложения и будущие разработки. J Магнитно-резонансная томография: JMRI (2020). doi: 10.1002 / jmri.27361
CrossRef Полный текст | Google Scholar
134. Вонг Б.С., Дюран К., Уильямс С.Б. Система отчетов и данных визуализации сосудов (VI-RADS) и влияние на определение глубины инвазии с последующим лечением у пациентов с раком мочевого пузыря: готовы к лучшему? Перевод Андрол Урол (2020) 9 (6): 2467–70.doi: 10.21037 / tau-20-839
PubMed Аннотация | CrossRef Полный текст | Google Scholar
135. Del Giudice F, Leonardo C, Simone G, Pecoraro M, Berardinis E, Cipollari S, et al. Предоперационное обнаружение системы визуализации и данных пузырей (VI-RADS) Оценка 5 надежно выявляет экстравазикальное распространение уротелиальной карциномы мочевого пузыря и прогнозирует значительную задержку времени до цистэктомии: время пересмотреть необходимость первичной глубокой трансуретральной резекции опухоли мочевого пузыря Случаи местнораспространенного заболевания? BJU Int (2020) 126 (5): 610–9.doi: 10.1111 / bju.15188
PubMed Аннотация | CrossRef Полный текст | Google Scholar
136. Del Giudice F, Barchetti G, De Berardinis E, Pecoraro M, Salvo V, Simone G, et al. Проспективная оценка системы отчетов и данных визуализации сосудов (VI-RADS) и ее клиническое влияние на ведение пациентов с неинвазивным раком мочевого пузыря с высоким риском, кандидатом на повторную трансуретральную резекцию. Eur Urol (2020) 77 (1): 101–9. doi: 10.1016 / j.eururo.2019.09.029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
137.Панебианко В., Дель Джудиче Ф, Леонардо С., Скиарра А., Каталано С., Катто JWF. Критерии оценки VI-RADS для альтернативных стратегий, адаптированных к риску, при лечении рака мочевого пузыря во время пандемии COVID-19. Eur Urol (2020) 78 (1): e18–20. doi: 10.1016 / j.eururo.2020.04.043
PubMed Аннотация | CrossRef Полный текст | Google Scholar
138. Fellous JM, Sapiro G, Rossi A, Mayberg H, Ferrante M. Объясняемый искусственный интеллект для нейробиологии: поведенческая нейростимуляция. Front Neurosci (2019) 13: 1346. doi: 10.3389 / fnins.2019.01346
PubMed Аннотация | CrossRef Полный текст | Google Scholar
139. Патель-Мюррей Н.Л., Адам М., Хьюн Н., Васи Б.Т., Милани П., Френкель Э. Интерпретируемая модель машинного обучения с множеством омиков раскрывает способы действия малых молекул. Научный журнал (2020) 10 (1): 954. doi: 10.1038 / s41598-020-57691-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
140. Dalkilic A, Bayar G, Kilinc M.Сравнение таблиц рисков EORTC и CUETO с точки зрения прогнозирования рецидива и прогрессирования у всех пациентов с неинвазивным раком мочевого пузыря. J Urol (2019) 16 (1): 37–43. doi: 10.22037 / uj.v0i0.4091
CrossRef Полный текст | Google Scholar
141. Кодзимото Й., Кусумото Х., Нисидзава С., Киккава К., Кодама Й., Ко М. и др. Внешняя валидация Европейской организации по исследованию и лечению рака и Испанского урологического клуба для моделей оценки онкологического лечения для прогнозирования рецидива и прогрессирования у японских пациентов с немышечно-инвазивным раком мочевого пузыря, леченных с помощью Bacillus Calmette-Guerin. Int J Urol (2014) 21 (12): 1201–7. doi: 10.1111 / iju.12572
PubMed Аннотация | CrossRef Полный текст | Google Scholar
142. Веддер М.М., Маркес М., де Беккер-Гроб Е.В., Калле М.Л., Дирскет Л., Кожевинас М. и др. Показатели прогнозирования риска рецидива и прогрессирования немышечно-инвазивного рака мочевого пузыря: международная проверка первичных опухолей. PloS One (2014) 9 (6): e96849. doi: 10.1371 / journal.pone.0096849
PubMed Аннотация | CrossRef Полный текст | Google Scholar
143.Валади Х., Экстром К., Боссиос А., Шостранд М., Ли Дж. Дж., Лотвалл Дж. Опосредованный экзосомами перенос мРНК и микроРНК является новым механизмом генетического обмена между клетками. Nat Cell Biol (2007) 9 (6): 654–9. doi: 10.1038 / ncb1596
PubMed Аннотация | CrossRef Полный текст | Google Scholar
144. Идзуми К., Чжэн Ю., Хсу Дж., Чанг С., Миямото Х. Сигналы рецепторов андрогенов регулируют UDP-глюкуронозилтрансферазы в мочевом пузыре: потенциальный механизм индуцированного андрогенами канцерогенеза мочевого пузыря. Mol Carcinog (2013) 52 (2): 94–102. doi: 10.1002 / mc.21833
PubMed Аннотация | CrossRef Полный текст | Google Scholar
145. Beckham CJ, Olsen J, Yin PN, Wu CH, Ting HJ, Hagen FK, et al. Экзосомы рака мочевого пузыря содержат EDIL-3 / Del1 и способствуют прогрессированию рака. Дж. Урол (2014) 192 (2): 583–92. doi: 10.1016 / j.juro.2014.02.035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
146. Армстронг Д.А., Грин BB, Сень Дж. Д., Schned AR, Marsit CJ.Молекулярный профиль микроРНК из подобранной опухоли и биожидкостей при раке мочевого пузыря. Молочный рак (2015) 14: 194. doi: 10.1186 / s12943-015-0466-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
147. Braicu C, Cojocneanu-Petric R, Chira S, et al. Клинические и патологические последствия миРНК при раке мочевого пузыря. Int J Nanomedicine (2015) 10: 791–800. doi: 10.2147 / IJN.S72904
PubMed Аннотация | CrossRef Полный текст | Google Scholar
148.Чимадамор А., Гаспаррини С., Сантони М., Ченг Л., Лопес-Бельтран А., Баттелли Н. и др. Биомаркеры агрессивности при опухолях мочеполовой системы с акцентом на рак почек, мочевого пузыря и простаты. Expert Rev Mol Diagn (2018) 18 (7): 645–55. DOI: 10.1080 / 14737159.2018.14
PubMed Аннотация | CrossRef Полный текст | Google Scholar
149. Рингет Гуле С., Бернар Дж., Трембле С., Шабо С., Болдук С., Пулио Ф. Экзосомы вызывают дифференцировку фибробластов в ассоциированные с раком фибробласты посредством передачи сигналов TGFbeta. Mol Cancer Res (2018) 16 (7): 1196–204. doi: 10.1158 / 1541-7786.MCR-17-0784
PubMed Реферат | CrossRef Полный текст | Google Scholar
150. Sanguedolce F, Russo D, Mancini V, Selvaggio O, Calo B, Carrieri G, et al. Прогностическая и терапевтическая роль экспрессии HER2 при микропапиллярной карциноме мочевого пузыря. Mol Clin Oncol (2019) 10 (2): 205–13. doi: 10.3892 / mco.2018.1786
PubMed Аннотация | CrossRef Полный текст | Google Scholar
151.Sanguedolce F, Russo D, Mancini V, Selvaggio O, Calo B, Carrieri G и др. Рецептор эпидермального фактора роста человека 2 при немышечно-инвазивном раке мочевого пузыря: проблемы в методах оценки и его роль в качестве прогностического / прогностического маркера и предполагаемой терапевтической мишени: всесторонний обзор. Urologia Int (2019) 102 (3): 249–61. doi: 10.1159 / 000494359
CrossRef Полный текст | Google Scholar
152. Ферро М., Ди Лоренцо Дж., Вартоломей М.Д., Брюцзезе Д., Кантиелло Ф., Лукарелли Дж. И др.Абсолютное количество базофилов связано со временем до рецидива у пациентов с раком мочевого пузыря высокой степени T1, получивших Bacillus Calmette-Guerin после трансуретральной резекции опухоли мочевого пузыря. World J Urol (2020) 38 (1): 143–50. doi: 10.1007 / s00345-019-02754-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Использование ДНК и РНК для лечения рака | Michigan Health Lab
Модель для лечения
Мелия Миллер, которой сейчас 6 лет, живет со своими родителями и младшим братом в небольшом городке в Огайо, в двух часах езды от Анн-Арбора.Она родилась преждевременно, с поражением на левом запястье и предплечье. Биопсия, проведенная вскоре после ее рождения, оказалась безрезультатной. К тому времени, когда ей исполнилось 2 года, рана разрослась. У Мелии была диагностирована фибросаркома, категория рака мягких тканей, в возрасте 26 месяцев.
Она прошла почти восемь месяцев химиотерапии и два с половиной месяца лучевой терапии в Колумбусе, штат Огайо. Лечение привело к атрофии ее руки и настолько ослабило ее иммунную систему, что ее родители наняли няню, чтобы не рисковать заболеть в детском саду.Тем не менее, рак рос. В конце концов, Мелиа ампутировала левое предплечье.
Через три месяца после второго курса химиотерапии врачи обнаружили, что рак распространился на ее левое легкое. Ее мать, Ли Энн Миллер, затем обратилась в UM, связавшись с Моди в августе 2013 года.
«Он хотел сразу же провести геномное тестирование», — говорит Ли Энн Миллер.
Мелия продолжала проходить внутривенную химиотерапию, в то время как исследователи UM анализировали ее ДНК и РНК.
Геномное тестирование, по-прежнему являющееся важным мероприятием, остается одной из основных проблем при расширении программы точной медицины для всех онкологических больных.Технологические усовершенствования помогают. Чиннайян говорит, что, когда в 2011 году началась программа точной медицины, на секвенирование опухоли пациента и сопоставление тканей требовалось от шести до восьми недель. В течение следующего года срок выполнения работ составит менее двух недель.
«Это очень важно, если учесть, что на расшифровку первого генома человека потребовалось более десяти лет и более 3 миллиардов долларов. И мы сможем исправить это примерно за неделю или две, а стоимость обычно составляет около 5000 долларов », — говорит Чиннайян.
После секвенирования генов начинается анализ.
В 14:00 Каждую вторую пятницу ученые собираются в конференц-зале онкологического центра на заседание совета по анализу опухолей в области точной медицины. Участвует широкий круг специалистов: патологи, онкологи, биоинформатики и биоэтики. Встречи также привлекают медицинских ординаторов и лабораторных исследователей. В течение двух часов участники обсуждают от восьми до двенадцати случаев, связанных как с педиатрическими, так и с взрослыми пациентами.В каждом случае ученые обсуждают, какая мутация может вызвать рак и какие существуют возможные методы лечения.
После этого команда создает отчет для каждого пациента, который включает оценку — один, два или три — того, насколько исследователи уверены в том, что они изолировали молекулярную причину рака.
«В некоторых случаях [мы находим то, что] уже было связано как вызывающий рак ген с помощью множества исследований, клеточных линий и моделей мышей… поэтому мы можем быть очень уверены, что это мутация-драйвер», — говорит Чиннайян.«Тогда бывают случаи, когда существуют правдоподобные теории… основанные на нашем понимании того, как работают определенные типы мутаций».
Именно здесь становится критически важным наличие большого пула данных. Полезные данные включают генетический анализ в сочетании с обширными историями здоровья пациентов, проверенными методами лечения и последними результатами. Поскольку этот тип генетического секвенирования все еще находится в зачаточном состоянии, ограниченные данные означают, что исследователи не могут часто сделать вывод о том, что является движущей силой рака.
«Требуются дополнительные исследования и в как можно большем количестве других учреждений», — говорит Чиннайян.Одна из его текущих областей исследований направлена на улучшение обмена данными, чтобы помочь врачам лучше интерпретировать последовательность определения опухоли пациента.
Когда несколько лет назад впервые были придуманы фразы «персонализированная медицина» и «точная медицина», многие университеты поспешили объявить о планах, «которые были очень амбициозными и много обещали, но не были очень успешными», — говорит Марк Рубин, доктор медицины. директор Института точной медицины Англии при Медицинском колледже Вейл Корнелл, который является соавтором исследовательских работ с Чиннайяном.
Университет штата Мэриленд, где Рубин когда-то был доцентом патологии, стал лидером, по его словам, в проведении фундаментальных исследований и одновременном применении этих открытий в клинической практике.
«Университет усовершенствовал многое из того, что необходимо сделать, выровняв секвенирование следующего поколения, чтобы современную молекулярную геномику можно было [использовать] в реальном времени с клинической помощью», — говорит он.

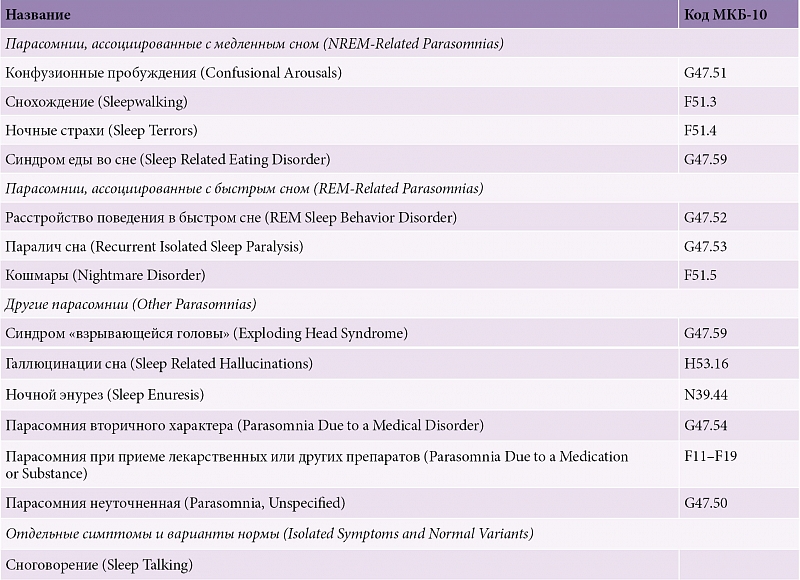 Если раковые клетки обнаруживаются в лимфатических узлах, это указывает на то, что рак начал распространяться, поскольку они обычно первыми обнаруживают раковые клетки из первичного местоположения. В промежуточной системе TNM используется шкала от 0 до 3, где 0 означает, что клетки лимфатических узлов не являются злокачественными.
Если раковые клетки обнаруживаются в лимфатических узлах, это указывает на то, что рак начал распространяться, поскольку они обычно первыми обнаруживают раковые клетки из первичного местоположения. В промежуточной системе TNM используется шкала от 0 до 3, где 0 означает, что клетки лимфатических узлов не являются злокачественными. Вы можете услышать это также называется метастатическим раком, поскольку это относится к M в системе TNM выше.
Вы можете услышать это также называется метастатическим раком, поскольку это относится к M в системе TNM выше. Это также известно как неопределенная оценка.
Это также известно как неопределенная оценка.