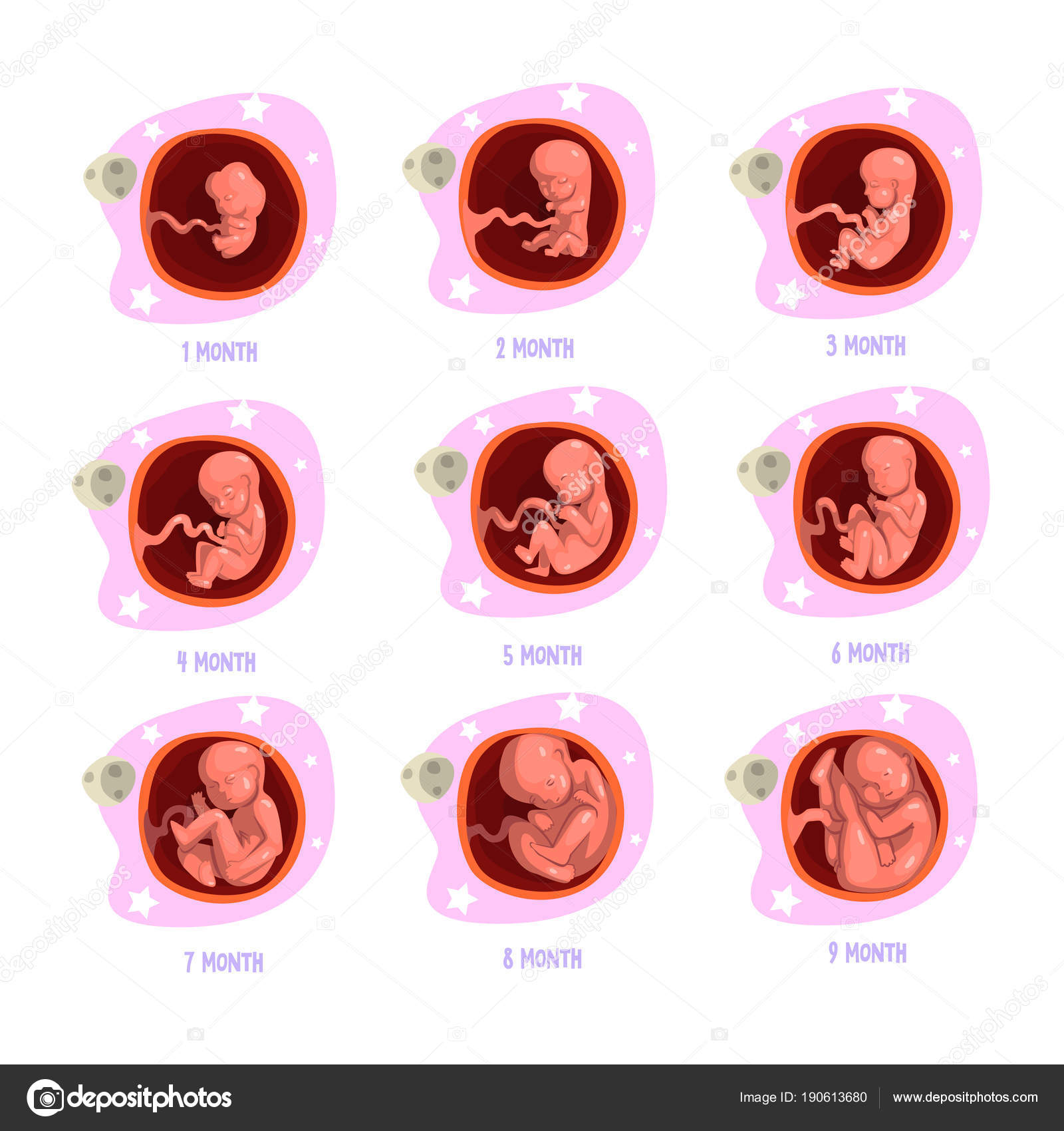
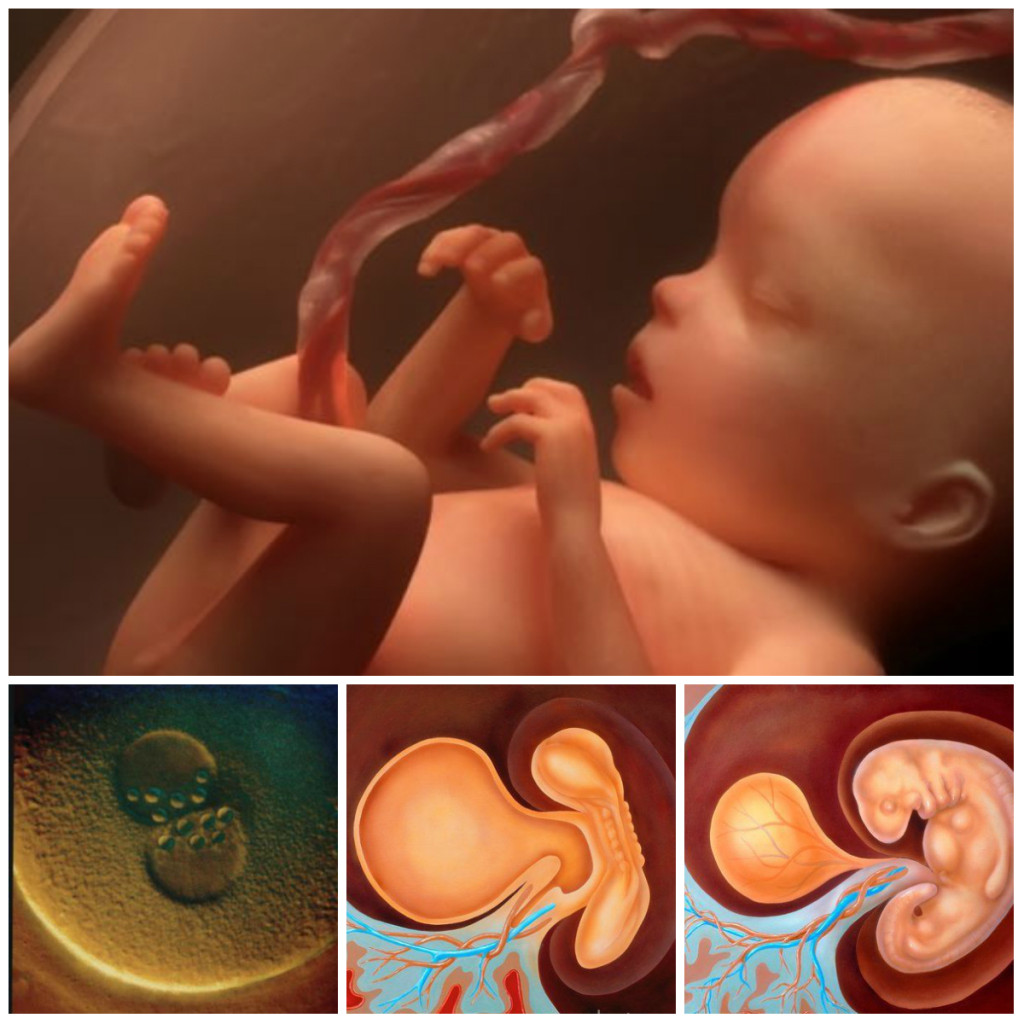
Развитие эмбриона по дням от зачатия эко: когда происходит подсадка, как растет плод?
Тонкий эндометрий – фактор бесплодия и неэффективности ЭКО
Эндометрий – это внутренний слизистый слой матки, к которому крепится эмбрион при развитии беременности. Истончение этого слоя называется “тонким” эндометрием. Состояние препятствует адекватной фиксации оплодотворенной яйцеклетки. Причин развития проблемы множество, но основная – хроническое воспаление. Успешная диагностика и лечение “тонкого” эндометрия возможны только в условиях современной клиники. Правильный подход к проблеме позволяет зачать и выносить здорового ребенка.
Причины тонкого эндометрия у женщины
Общепринятого понятия «тонкий эндометрий» не существует. В медицине принято рассматривать разные параметры толщины эндометрия в качестве неблагоприятного критерия для вынашивания беременности. Авторы в литературе утверждают, что толщина ткани менее 8 мм минимизирует шанс на успешную имплантацию эмбриона в полость матки, а эффективность ЭКО при этом параметре составляет всего лишь 15 %.
Основные причины уменьшения толщины эндометрия:
- Хроническое воспаление в ткани эндометрия
- Воспалительные заболевания органов малого таза
- Аутоиммунный эндометрит как следствие перенесенного воспаления
- Изменение гормонального баланса
- Перенесенные травмы
- Фолликулярная киста яичника
- Поликистоз яичников
- Дефекты развития матки
- Перенесенные инструментальные аборты
- Спайки (синехии) в полости матки
- Врачебные ошибки в анамнезе и хирургические вмешательства на матке
До сих пор активно изучаются причины и лечение “тонкого” эндометрия для формирования наиболее эффективных протоколов по устранению бесплодия и успешности ЭКО.
В клинике «Лейб Медик» применяют только проверенные, современные методики терапии “тонкого” эндометрия.
Диагностика тонкого эндометрия
Истончение эндометрия может не проявляться симптоматически. Клинические проявления во многом зависят от причин развития проблемы. При гормональных сбоях будет отмечаться задержка месячных, при воспалении – умеренные периодические боли, при ановуляции – аменорея (отсутствие месячных).
Клинические проявления во многом зависят от причин развития проблемы. При гормональных сбоях будет отмечаться задержка месячных, при воспалении – умеренные периодические боли, при ановуляции – аменорея (отсутствие месячных).Заподозрить гипоплазию эндометрия позволяет ультразвуковое исследование. Однако только его недостаточно. На УЗИ врач определит несоответствие толщины эндометрия фазе менструального цикла.
Золотой стандарт диагностики тонкого эндометрия – гистероскопия с последующей биопсией. Врач проводит визуальный осмотр матки с помощью специального аппарата и выборочно проводит забор участков ткани. После гистероскопии материал исследуется патоморфологом, чья главная задача: обнаружить или исключить признаки хронического воспаления. С помощью современных методов проводится оценка количества рецепторов эндометрия, распознающих гормоны, и количества выпячиваний (пиноподий), распознающих эмбрион.
Эффективные методы лечения тонкого эндометрия
Единого подхода к лечению пациенток с тонким эндометрием нет.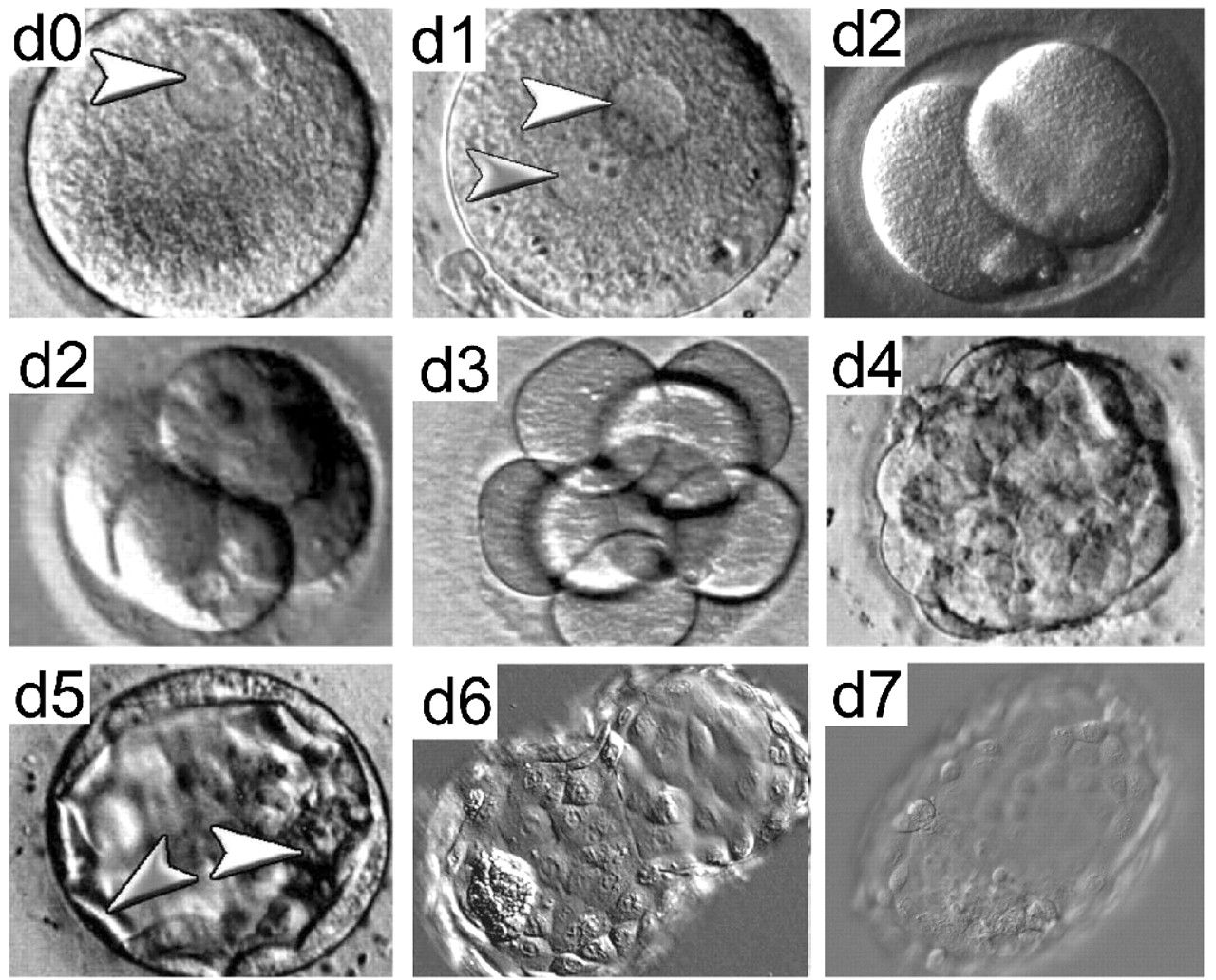 Разнообразие методов терапии указывает на недостаточную мировую изученность проблемы.
Разнообразие методов терапии указывает на недостаточную мировую изученность проблемы.
В клинике «Лейб Медик» применяются группы препаратов, доказавших свою эффективность:
- Антибактериальные
- Иммуностимуляторы
- Препараты эстрогенов
- Стимуляторы кровообращения
Подход к пациенткам индивидуален и направлен на устранение причины истончения эндометрия. Девушки с ановуляцией (не формируется яйцеклетка) имеют толщину ткани 5-6 мм, но при решении вопроса о возобновлении физиологической овуляции ткань утолщается и возвращает способность фиксации эмбриона.
Как нарастить эндометрий для зачатия?
Поиски четкого ответа на вопрос: как нарастить тонкий эндометрий – до сих пор продолжаются, но некоторые эффективные приемы уже доступны в современных клиниках репродуктивного здоровья.
В нормальном менструальном цикле толщина эндометрия постоянно изменяется. Это учитывается в ходе лечения.
Нормальные показатели толщины эндометрия в разных фазах менструального цикла
| Фаза цикла | Изменения в ткани эндометрия | День цикла | Нормальные значения толщины (мм) |
| Фолликулярная фаза | Кровотечение | 1-2 | — |
| 3-4 | 1-3 | ||
| Пролиферация | 5-7 | 4-6 | |
| 8-10 | 5-10 | ||
| Лютеиновая фаза | 11-14 | 8-14 | |
| 15-18 | 10-15 | ||
| 19-23 | 10-15 | ||
| 24-28 | 10-15 |
Подход к наращиванию эндометрия должен быть комплексным. Терапия проводится в 2 этапа:
Терапия проводится в 2 этапа:
- Выявление причин и их устранение. Чаще всего приходится бороться с хроническим воспалением ткани и применять препараты: антибиотики, иммуномодуляторы, противовоспалительные. Средства используются как системно, так и местно. В случае гормональных изменений выясняется причина проблемы. Спайки, кисты, гормонпродуцирующие опухоли устраняются хирургическим путем.
- Восстановление функциональности эндометрия. Длительная фаза, на которую может уйти 2-3 месяца. Традиционно этот этап включает физиотерапию. Она способствует усилению кровообращения, ускорению обменных процессов, быстрой регенерации, а так же рефлексотерапию и гирудотерапию.
Можно ли забеременеть с тонким эндометрием?
Беременность и тонкий эндометрий – понятия совместимые, так как нельзя сказать, что данная проблема полностью исключает возможность имплантации эмбриона в ткань матки. Однако даже прикрепление оплодотворенной яйцеклетки к тонкому эндометрию не гарантирует нормального протекания беременности с успешными родами, то же касается и ЭКО.
Основные осложнения, которые могут возникнуть у беременных с тонким эндометрием:
- Самопроизвольный аборт на ранних сроках
- Преждевременные роды на поздних сроках
- Задержка физического развития плода
- Плацентарная недостаточность
Это значит, что при установлении диагноза «тонкий эндометрий» лучше не рисковать, а перед планированием беременности пройти курс лечения.
Видео
Тонкий эндометрий до сих пор остается не до конца изученной проблемой, требующей проведения клинических исследований и экспериментов. Однако достоверно известно, что недостаточность толщины ткани значительно снижает вероятность успешной беременности и родоразрешения, а также увеличивает риск неудачного ЭКО. Поэтому при подозрении на тонкий эндометрий необходимо проведение комплексного обследования и лечения, цель которого – развитие беременности, вынашивание и рождение здорового малыша.
Развитие эмбриона по дням: ЭКО под микроскопом
Человеческому любопытству нет предела. Даже о самых обыденных вещах хочется знать в мельчайших подробностях. Что уж говорить о проведении экстракорпорального оплодотворения. Хочется понимать как можно больше, особенно тем, кому предстоит с этим столкнуться. В этой статье – детальная информация о том, как происходит развитие эмбриона по дням после ЭКО.
Эмбриологический этап
Главным действующим лицом на этом этапе становится врач-эмбриолог. Эмбриологический этап – самый важный в циклах экстракорпорального оплодотворения. От его правильности зависит успешноcть всей процедуры.
Для культивирования яйцеклеток и эмбрионов нужны особые условия – оптимальное соотношение:
- влажности;
- температуры;
- газового состава.
Сочетание заданных условий возможно только в специальных инкубаторах. Выбранные параметры в них поддерживаются автоматически. В период до 5 дней эмбрионы будут развиваться в инкубаторе.
К средам, в которых культивируются эмбрионы, тоже жесткие требования. Они должны имитировать внутреннюю среду женского организма.
Во время трансвагинальной пункции эмбриолог занят поиском ооцит-кумулюсных комплексов, в которых и находятся сами яйцеклетки. Фолликулярную жидкость, после изучения под микроскопом, переливают в чашки Петри. Даже невооруженным взглядом можно рассмотреть эти комплексы, содержащие яйцеклетку. Это слизистые комочки, диаметром 5–10 мм. До момента оплодотворения они содержатся в специальной питательной среде.
Параллельно в это время происходит обработка спермы. Задача при обработке спермы – выделить фракцию самых активных, морфологически нормальных, подвижных сперматозоидов, наиболее способных к оплодотворению.
На эмбриологическом этапе проводится оплодотворение, как правило, спустя 4–6 часов после трансвагинальной пункции. В чашку Петри с яйцеклеткой добавляется концентрат сперматозоидов в количестве 100000 на 1 яйцеклетку. При неудачных предыдущих попытках ЭКО и аномалиях сперматозоидов у супруга доктор рекомендует ИКСИ.
Развитие эмбрионов после ЭКО по дням
День первый
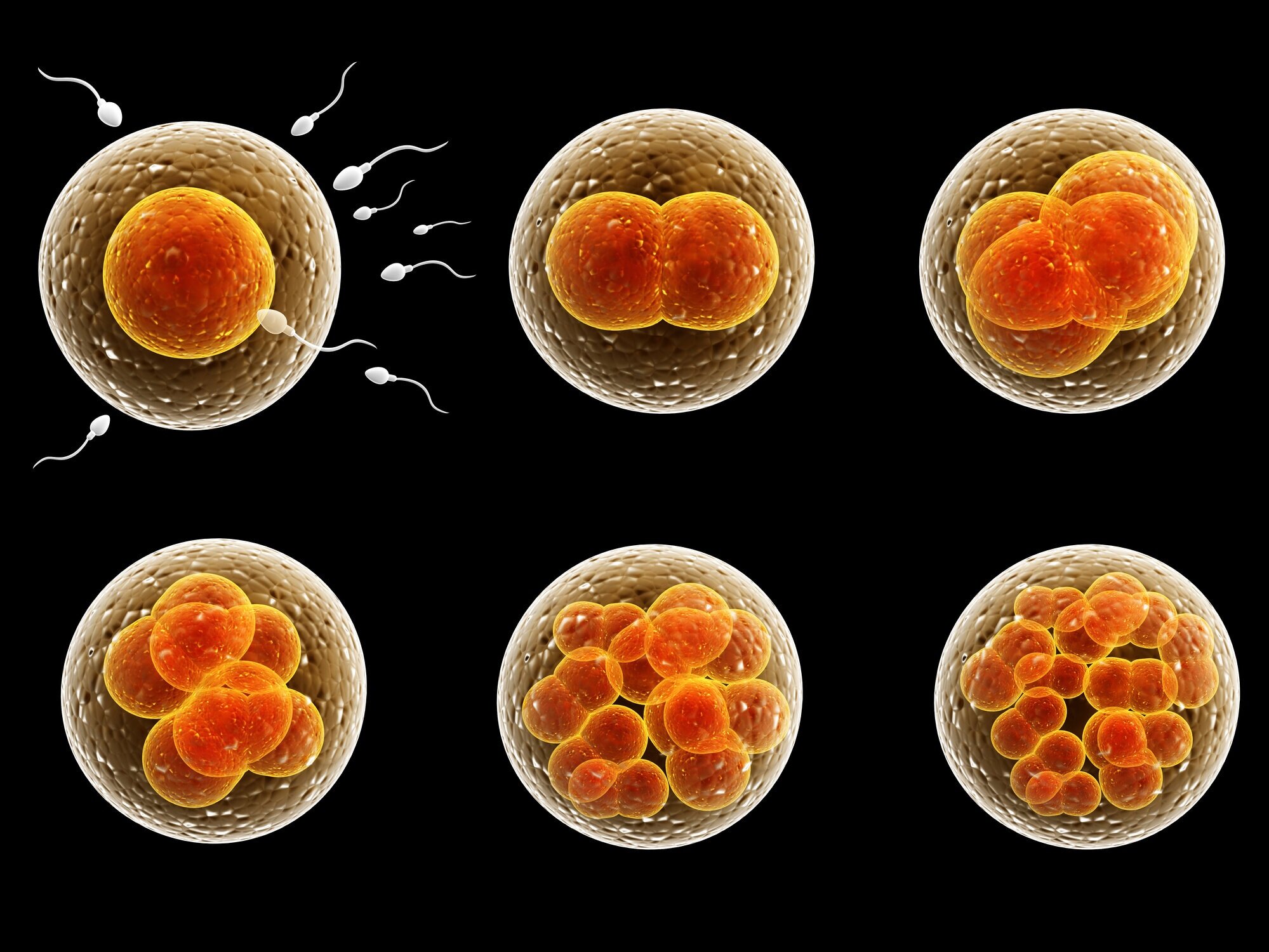
День проведения пункции и извлечения женских половых клеток считается нулевым. Через 12–16 часов после оплодотворения можно наблюдать стадию зиготы – ооцита с двумя пронуклеусами (клеточными ядрами): женским и мужским.
Зигота имеет уже двойной набор хромосом – присутствуют гены от маминого и папиного организма. Наличие двух клеточных ядер расценивается так, что оплодотворение произошло успешно. Остальные клетки, не соответствующие этому критерию отбраковываются.
День второй
На вторые сутки клетки эмбриона делятся и называются бластомерами. В норме на вторые сутки должно быть от 2 до 4 бластомеров.
Каждый день эмбриологом ведется наблюдение и фиксация показателей качества эмбрионов. Все его недостатки и достоинства описываются в протоколе. Это помогает эмбриологу выбрать «правильный» эмбрион и время переноса.
День третий
На третьи сутки эмбрион, продолжая развиваться, уже имеет 6-8 бластомеров.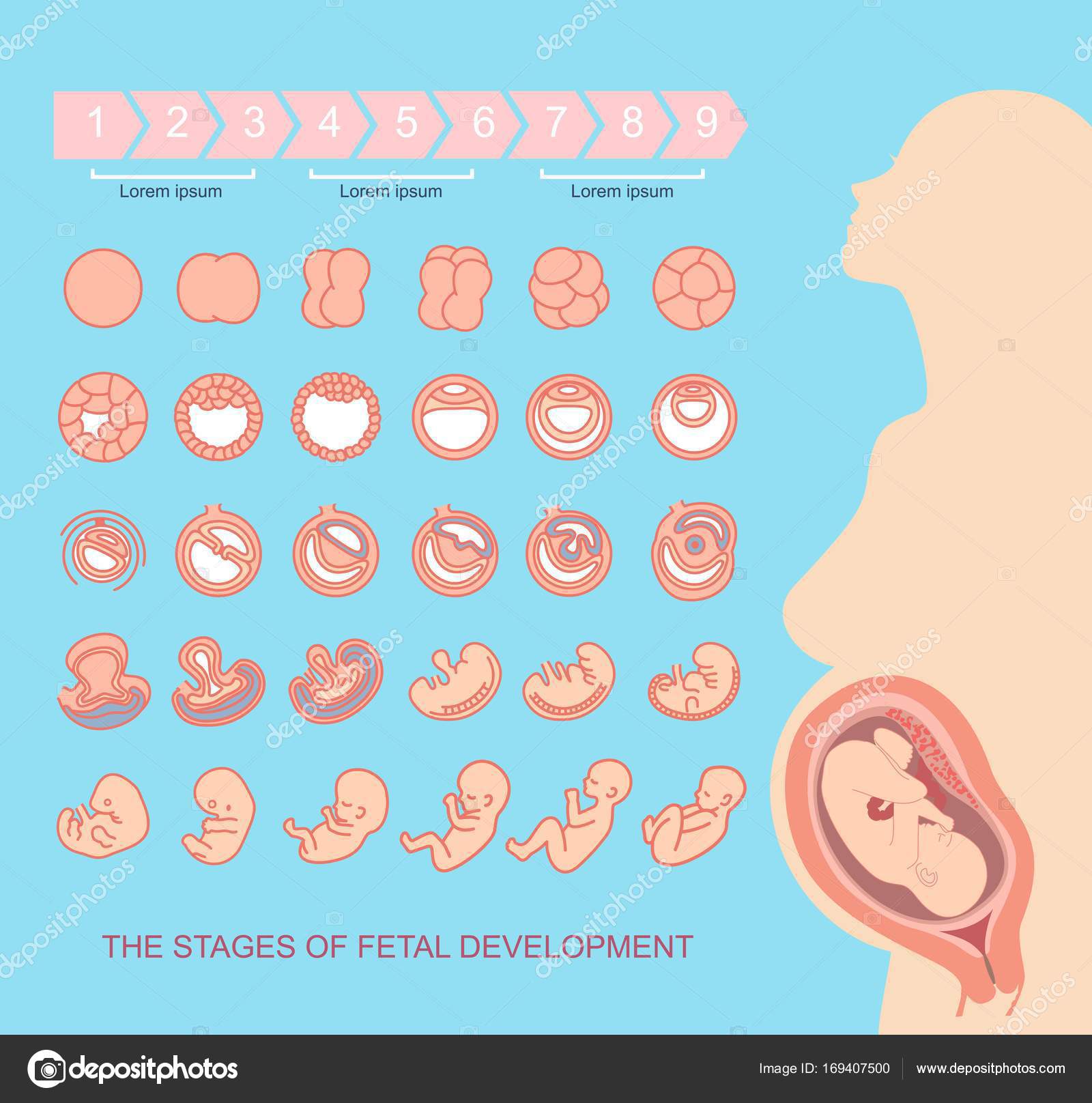
День четвертый
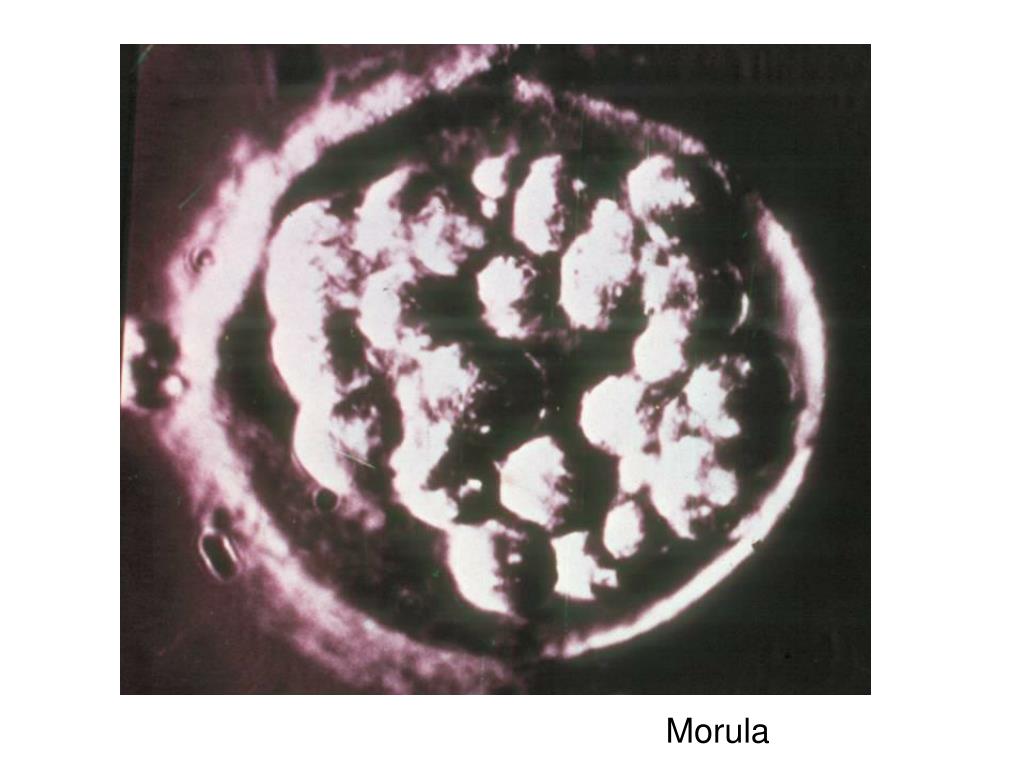
На четвертые сутки развития эмбрион состоит из 10-16 бластомеров. Начинается процесс компактизации: межклеточные связи становятся плотнее, форма ровнее. Наступает стадия морулы. В норме в женском организме именно на этом этапе эмбрион попадает из трубы в матку. К концу четвертых суток развития внутри морулы начинает формироваться полость и инициируется процесс кавитации – разделение клеток на две группы, каждая из которых будет выполнять свою функцию.
С того момента, как полость занимает более 50% объема эмбриона, стадия называется бластоциста.
День пятый
Продленное культивирование до 5-6х суток часто рекомендуется докторами. Цель такого культивирования – достижение эмбрионами стадии бластоцисты. Доказано, что при переносе бластоцисты значительно увеличивается шанс имплантации. Это дает возможность врачу выделить один самый качественный эмбрион и избежать многоплодия.
Цель такого культивирования – достижение эмбрионами стадии бластоцисты. Доказано, что при переносе бластоцисты значительно увеличивается шанс имплантации. Это дает возможность врачу выделить один самый качественный эмбрион и избежать многоплодия.
Когда полость достигает значительного размера, оболочка истончается и начинается процесс хетчинга – эмбрион покидает свою защитную оболочку. После чего он уже готов к имплантации. Внешне этот процесс напоминает «вылупление» птенца из яйца. В ситуации, когда хетчинг естественным путем не происходит, эмбрион лишен способности к имплантации, рекомендуется процедура вспомогательного хетчинга.
Качество эмбрионов при ЭКО
Перенос эмбрионов реализуется на 2, 3 или 5, 6 сутки. Это зависит от количества и качества эмбрионов. При ЭКО на перенос выбираются эмбрионы отличного и хорошего качества.
Морфологические критерии отбора:
- количество клеток, соответствующее дню развития;
- отсутствие или минимальный процесс фрагментации;
- сферичные и равные по размеру бластомеры.

На самом деле критериев определения качества эмбрионов при ЭКО больше. Нами приведены самые основные.
О том, как развиваются эмбрионы после переноса, уже в полости матки, можно узнать в этой статье.
Статьи по теме:
Как происходит имплантация эмбрионов после ЭКО?
Развитие эмбрионов в матке или что определяет результат?
Нормальные и патологические выделения после переноса эмбрионов при ЭКО
Базальная температура после ЭКО выше 37
Когда делать тест после переноса эмбрионов дома?
Качество эмбрионов для переноса: классификация для 3-дневных эмбрионов и бластоцист (5-дневок)
Почему не приживаются эмбрионы в матке после подсадки при ЭКО?
Актуальное видео
Развитие эмбриона до 6 дня под микроскопом
App Store: Беременность +
Установите приложение № 1 в мире о беременности.
Прекрасные интерактивные иллюстрации к каждой неделе беременности! Более 50 миллионов женщин пользуются этим приложением для отслеживания своей беременности неделя за неделей. Присоединяйтесь!
Приложением Беременность+ также могут пользоваться папы, дедушки, бабушки и другие члены семьи.
Все, что нужно – в одном приложении!
— ЕЖЕДНЕВНАЯ информация о беременности
— Цветные иллюстрации и снимки УЗИ
— Персональный дневник
— Персональный журнал веса
— Журнал визитов к врачу
— Сведения о питании, физкультуре и родах
— Счетчик толчков малыша
— Таймер схваток
— Список необходимых покупок
— Тысячи имен для будущего ребенка
— Наглядная иллюстрация размеров ребенка
— Информация о беременности неделя за неделей
— И многое другое!
—————————————————
Политика конфиденциальности: https://info.health-and-parenting.com/PrivacyNotice?locale=ru&country=RU
Условия использования: https://info. health-and-parenting.com/TermsOfUse?locale=ru&country=RU
health-and-parenting.com/TermsOfUse?locale=ru&country=RU
—————————————————
Беременность+ синхронизируется с приложением Здоровье от компании Apple, но не может читать его базу данных или вносить в нее изменения, пока вы не разрешите это.
Приложение не предназначено для медицинского применения и не заменит консультации квалифицированного врача. Компания Philips Consumer Lifestyle B.V. не несет ответственности за решения, принятые на основании информации в Приложении, которое предоставляется исключительно в качестве общих сведений, а не в качестве замены индивидуальной медицинской консультации. Если у вас возникнут вопросы, касающиеся вашей беременности, немедленно проконсультируйтесь с вашим врачом или акушеркой.
Команда Беременность+ желает вам здоровой доношенной беременности и благополучных родов.
Эмбриологические этапы ЭКО
ЭКО — это зачастую последняя надежда для семейных пар, попытки которых зачать ребенка оказываются неудачными.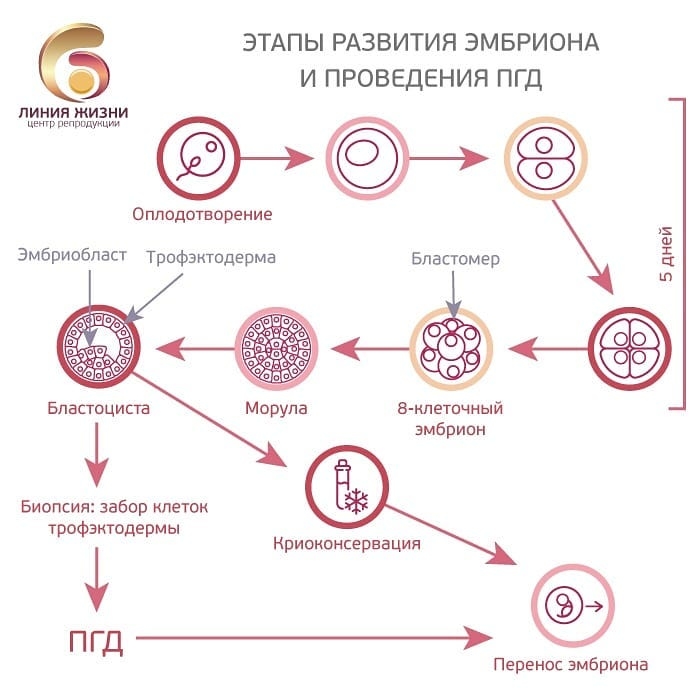
В СССР первый успешный протокол ЭКО состоялся в 1985 году. В Москве, а затем и в Ленинграде, на свет появились двое детей, зачатых в пробирке и затем подсаженных матерям, — девочка и мальчик. Далее программа ЭКО была признана на государственном уровне и указом Президента РФ включена в программу развития демографии. На нее стали давать квоты, экстракорпоральное оплодотворение по показаниям теперь можно делать по полису обязательного медицинского страхования.
Многие пациенты, вступающие в протокол ЭКО, задаются вопросом: «Что это такое, как происходит оплодотворение вне тела?». Ответы на эти и другие вопросы Вы найдёте в этой статье.
Итак, что же такое ЭКО?
ЭКО — экстракорпоральное, т. е. происходящее вне тела человека, оплодотворение. Часто можно услышать словосочетание «дети из пробирки», что не совсем верно, т. к. оплодотворение ооцитов и дальнейшее культивирование эмбрионов происходит не в пробирке в буквальном смысле, а в специальных чашках. В зависимости от способа культивирования эмбрионы могут расти в лунках, где специальной среды достаточно большое количество, либо в каплях, количество жидкости в которых едва ли достигает нескольких микролитров. Таким образом, культивирование в каплях даёт нам прекрасную возможность создавать для каждого эмбриона свой «домик», свой микромир, в котором он живёт и усиленно развивается от трёх до пяти дней. Затем эмбриолог выбирает самый красивый и жизнеспособный эмбрион для переноса, и дальнейшее его развитие происходит уже в полости матки женщины.
В зависимости от способа культивирования эмбрионы могут расти в лунках, где специальной среды достаточно большое количество, либо в каплях, количество жидкости в которых едва ли достигает нескольких микролитров. Таким образом, культивирование в каплях даёт нам прекрасную возможность создавать для каждого эмбриона свой «домик», свой микромир, в котором он живёт и усиленно развивается от трёх до пяти дней. Затем эмбриолог выбирает самый красивый и жизнеспособный эмбрион для переноса, и дальнейшее его развитие происходит уже в полости матки женщины.
Итак, рассмотрим, какие этапы включает в себя эмбриологическая часть программ ВРТ?
1. Трансвагинальная пункция фолликулов — это слаженная работа всего персонала. Врач-репродуктолог выполняет саму манипуляцию забора фолликулярной жидкости через специальную иглу, а эмбриолог при помощи микроскопа находит в фолликулярной жидкости ооцит-кумулюсные комплексы. Ооцит-кумулюсный комплекс представляет собой сам ооцит, окружённый клетками кумулюса.
Вот такими мы их видим в окулярах микроскопа. Эти клетки очень плотно облепляют ооцит и называются «корона радиата». Они защищают и питают ооцит, а на гиалуроновую кислоту, которая содержится в них, бегут зрелые сперматозоиды. Таким образом, ооцит, можно сказать, защищается от оплодотворения некачественным сперматозоидом.
По завершении пункции фолликулов наступает следующий этап:
2. Исследование эякулята и его обработка в специальном градиенте плотности. Эта манипуляция делается для того, чтобы выделить в осадок подвижные жизнеспособные сперматозоиды и очистить их от других компонентов эякулята. Вот так, например, выглядит образец эякулята до обработки (здесь мы можем наблюдать сами сперматозоиды различного качества, клетки сперматогенеза, единичные лейкоциты) и вот образец после обработки (чистые и красивые сперматозоиды).
В зависимости от качества исходного эякулята эмбриолог принимает решение о проведении классического ЭКО или ИКСИ.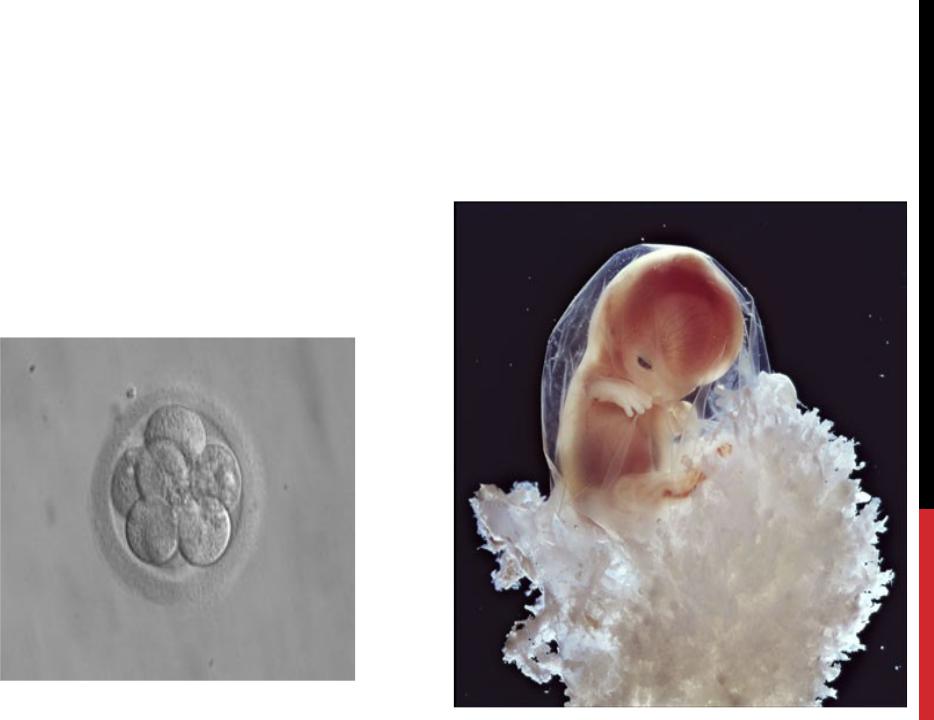
При обычном ЭКО семенная жидкость добавляется в чашку с яйцеклетками и сперматозоиды самостоятельно оплодотворяют ооциты. Но бывают тяжёлые формы мужского бесплодия, когда мы имеем в наличии единичные сперматозоиды. Иногда даже приходится работать с биоптатом яичка при невозможности получить материал естественным путем. В таких случаях эмбриолог проводит процедуру ИКСИ, вводя с помощью специального микроинъектора единичный сперматозоид в яйцеклетку.
Через 16-18 часов после процедуры оценивается оплодотворение.
3. Культивирование эмбрионов.
С момента оплодотворения это уже не 2 отдельные клетки, а эмбрион. Далее — дробление, морула, бластоциста, выход бластоцисты, так называемый хетчинг. Самостоятельный хетчинг не всегда происходит до переноса, чаще эмбрион покидает оболочку, уже находясь в матке. Но все же иногда эмбриону хорошего качества требуется проведение вспомогательного рассечения блестящей оболочки перед переносом в полость матки. Особенно это касается девитрифицированных (размороженных) эмбрионов, оболочка которых может становиться менее растяжимой.
4. Перенос эмбриона теоретически может осуществляться на любой стадии развития эмбриона. Мы стараемся культивировать по возможности эмбрионы до 5-6 суток для лучшей селекции. В «свежих» циклах переносим как правило один эмбрион, оставшиеся витрифицируем. Витрификация — метод мгновенной заморозки. В своей работе мы используем качественные, проверенные среды, которые обеспечивают весьма успешную разморозку. % удачно размороженных эмбрионов в нашей лаборатории достигает 99.
После процедуры переноса эмбриона женщина находится несколько минут в положении лежа, а затем отправляется домой. В последующие дни следует вести обычный образ жизни, исключая тяжелые физические нагрузки и вредные привычки.
Об успешности проведенной программы ВРТ можно судить по положительным тестам на беременность, проводимым дома, и лабораторному анализу на B- ХГЧ.
ХГЧ, Хорионический гонадотропин человека, показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер.
Хорионический гонадотропин человека (ХГЧ, β-ХГЧ, бета-ХЧГ, Human Chorionic Gonadotropin): показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Хорионический гонадотропин – гормон, вырабатываемый внешней оболочной зародыша, и в норме определяется в крови и моче женщины только при наступлении беременности.
Хорионический гонадотропин состоит из двух субъединиц – альфа и бета. Бета-субъединица (β-ХГЧ), использующаяся для иммунометрического определения гормона — уникальна. Для наблюдения за течением беременности используют определение бета-субъединицы ХГЧ. Уровень бета-ХГЧ крови уже на 6 — 8 день после зачатия позволяет диагностировать беременность (концентрация β-ХГЧ в моче достигает диагностического уровня на 1 — 2 дня позже, чем в сыворотке крови).
Бета-субъединица (β-ХГЧ), использующаяся для иммунометрического определения гормона — уникальна. Для наблюдения за течением беременности используют определение бета-субъединицы ХГЧ. Уровень бета-ХГЧ крови уже на 6 — 8 день после зачатия позволяет диагностировать беременность (концентрация β-ХГЧ в моче достигает диагностического уровня на 1 — 2 дня позже, чем в сыворотке крови).
Введение ХГЧ в организм небеременных стимулирует овуляцию и синтез половых гормонов, необходимых для зачатия. У мужчин этот гормон усиливает образование семенной жидкости, активизирует выработку гонадостероидов.
На ранних сроках беременности и до 2-го триместра β-ХГЧ поддерживает продукцию необходимых для сохранения беременности гормонов, а у плодов мужского пола стимулирует клетки, отвечающие за формирование и развитие мужской половой системы.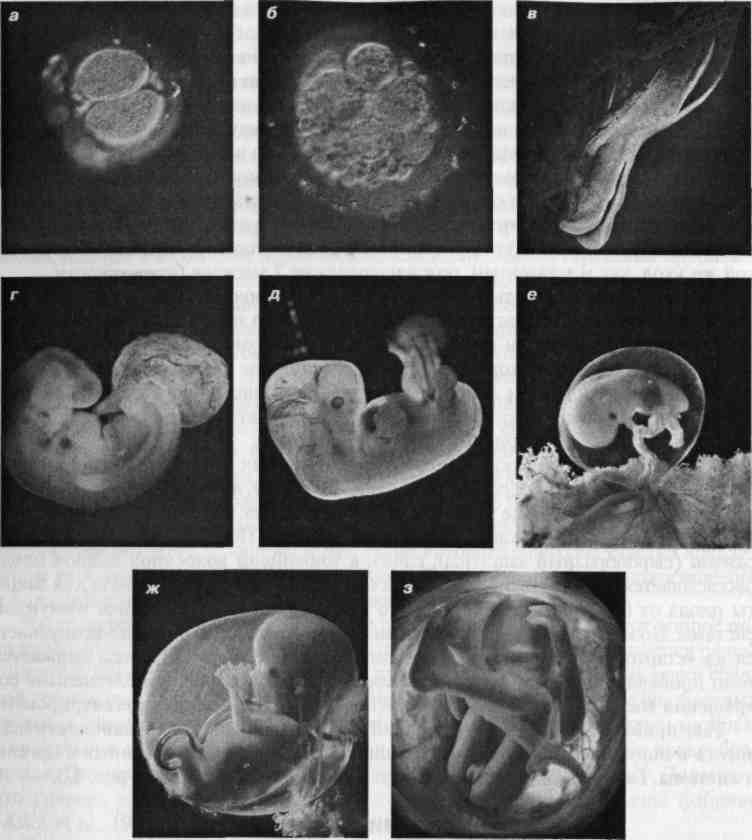
Определение уровня гормона проводят при ранней диагностике беременности, при проведении пренатального скрининга с целью выявления риска аномалий развития плода (в комплексе с тестами на альфа-фетопротеин и свободным эстриол на 15-20-й неделях беременности). Кроме этого, ХГЧ используется в лабораторной диагностике как онкомаркер опухолей трофобластной ткани и герминативных клеток яичников и семенников, секретирующих хорионический гонадотропин.
Показания для определения уровня ХГЧ у женщин
- Отсутствие менструаций (аменорея).
- Исключение/подтверждение беременности, в том числе эктопической (внематочной).
- Диагностика состояния плода на разных сроках беременности.
- Оценка состояния плаценты на разных сроках беременности.
- Динамическое наблюдение за развитием плода во время беременности, в том числе в диагностике пороков развития.

- Подозрение на наличие опухолевых заболеваний половой системы, таких как пузырный занос (редкая патология плодного яйца, при которой вместо развития эмбриона происходит разрастание ворсин хориона), хорионэпителиома (злокачественная опухоль, развивающаяся из эпителия ворсин плодного яйца).
- Проведение искусственного прерывания беременности.
Показания для определения уровня ХГЧ у мужчин:
Наличие подозрений на опухоли яичек.
Срок исполнения данного исследования – 1 рабочий день, исключая день взятия биоматериала.
Правила подготовки к сдаче анализа крови для определения уровня ХГЧ
неспецифичны: достаточно накануне процедуры воздержаться от курения и употребления алкоголя, ограничить стрессовые воздействия и интенсивную физическую нагрузку в течение недели; сдача крови проводится натощак.
Определение ХГЧ в крови возможно уже на 6-8-й день после зачатия. Применение мочевых тест-систем (экспресс-тестов на беременность) будет информативным, начиная с 7-го дня после оплодотворения яйцеклетки. Для подтверждения результата рекомендуется повторное определение уровня гормона через несколько дней после первого анализа.
Применение мочевых тест-систем (экспресс-тестов на беременность) будет информативным, начиная с 7-го дня после оплодотворения яйцеклетки. Для подтверждения результата рекомендуется повторное определение уровня гормона через несколько дней после первого анализа.
Сдать анализ крови на ХГЧ (тиреотропный гормон, тиротропин, Thyroid StimulatingHormone, TSH) вы можете в ближайшем медицинском офисе ИНВИТРО. Список офисов, где принимается биоматериал для лабораторного исследования, представлен в разделе «Адреса».
Причины, ведущие к высокому уровню β-ХГЧ
- Многоплодная беременность.
- Неверно установленные сроки наступления беременности.
- Патологически протекающая беременность: появление отеков, повышение артериального давления, потеря белка с мочой (гестоз), судороги (эклампсия), токсикоз.
- Наличие у беременной хронических заболеваний (например, сахарного диабета).

- Множественные пороки развития плода (в такой ситуации используется определение уровня β-ХГЧ совместно с другими показателями, так называемый «тройной тест». Это исследование применяют в качестве скринингового, а не для постановки диагноза.).
Причины, при которых фиксируют понижение уровня β-ХГЧ
- Неверно установленные сроки беременности.
- Внематочная беременность.
- Замершая беременность.
- Угроза выкидыша.
- Патологии плода или плаценты (в том числе плацентарная недостаточность).
- Внутриутробная гибель плода (в данном случае информативно определение уровня гормона в первый и второй триместры).
Определение уровня ХГЧ, кроме установления факта наступления беременности на ранних сроках, входит в состав скринингового обследования беременных в первом триместре наряду с проведением УЗИ.
Качество и оценка эмбрионов ЭКО, развитие и изображения эмбрионов 3-го дня
Изображение эмбриона «идеального» 8-клеточного эмбриона (эмбрион 3-го дня)
Фрагментация зародыша отсутствует, клетки очень ровные, правильные и одинаковые по размеру
Мы называем это эмбрионом третьего дня «высокого качества»
Оценка эмбриона: 8-ми клеточная, 4-я степень
Как проводится оценка качества эмбрионов на 3-й день развития?
Существует много систем оценки эмбрионов, которые различаются по способу присвоения оценок и по тому, указывает ли оценка с низким числом на лучший или наихудший эмбрион.Мы оцениваем «качество» эмбрионов в результате экстракорпорального оплодотворения, тщательно оценивая и оценивая некоторые аспекты их внешнего вида.
Мобильный
Эмбрионы должны иметь от 2 до 4 клеток через 48 часов после извлечения яиц и предпочтительно от 7 до 10 клеток через 72 часа. Клетки эмбриона также называют «бластомерами».
Клетки эмбриона также называют «бластомерами».
Клеточная регулярность — степень регулярности размеров бластомеров
Как правило, лучше, если размер отдельных клеток (называемых бластомерами) в эмбрионах будет одинаковым.Если это не так, лучше, если они будут близко к того же размера, по сравнению с очень разными по размеру.
Степень фрагментации
Фрагментация, также называемая пузырчаткой, представляет собой процесс, при котором части клеток эмбриона отламываются и теперь отделены от зародышевой части клетки. Желательно, чтобы фрагментация была минимальной или отсутствовала.
Однако фрагментация человеческих эмбрионов является довольно распространенным явлением, и многие красивые дети появились в результате имплантации эмбрионов с фрагментами.Многие лаборатории ЭКО, включая наши, оценивают и регистрируют процент фрагментации в эмбрионе на третий день. Эмбрионы с фрагментацией более 25% имеют низкий имплантационный потенциал.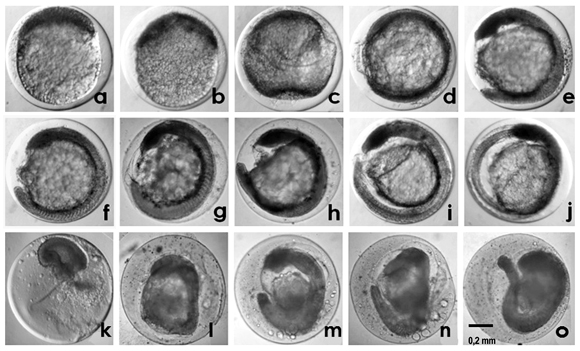
Наличие многоядерности
Эмбрион является многоядерным, если в любой отдельной клетке можно увидеть более одного ядра либо на 2-й, либо на 3-й день. После 3-го дня чрезвычайно трудно определить наличие многоядерности. Было показано, что подавляющее большинство многоядерных эмбрионов имеют хромосомные аномалии.
Однако иногда многоядерные эмбрионы имплантируются и приводят к здоровой беременности и рождению нормального ребенка. Эти эмбрионы обычно переносятся в матку только в том случае, если они единственные доступные.
Дополнительные факторы, влияющие на классификацию эмбрионов и отбор для переноса
Также отмечаются другие аспекты микроскопического вида эмбрионов, включая наличие вакуолей, зернистость, толщину внешней оболочки (или блестящей оболочки) и т. Д.
Слегка фрагментированный 8-клеточный эмбрион
Выполняется вспомогательный хетчинг
Пипетка для удержания находится слева
Сперма хорошо видна в 7 часов (эта сперма проиграла гонку)
Этот эмбрион высокого качества, потому что у него оптимальное количество клеток, клетки довольно регулярного размера и минимальная фрагментация.
Оценка эмбрионов: 8 клеток, степень 3
Этот 5-клеточный эмбрион умеренно фрагментирован и имеет клетки неравномерного размера (неправильной формы)
Ожидается, что у этого эмбриона будет значительно более низкая вероятность имплантации, потому что он несколько «медленный» (предпочтительно более 5 клеток на 3-й день) и из-за значительной фрагментации и неравномерности клеток.
Оценка эмбрионов: 5 клеток, 2 степень
Этот эмбрион сильно фрагментирован и имеет клетки разного размера
Эмбрион 3-го дня плохого качества
У этого эмбриона, вероятно, не так много шансов имплантироваться и произвести жизнеспособную беременность.
Оценка эмбрионов: 6 клеток, 1 степень
Фотография сильно фрагментированного и очень плохого качества эмбриона 3-го дня
Этот эмбрион по существу нежизнеспособен и дегенерирует
Он не сможет продолжить нормальное развитие и имплантировать
Оценка эмбрионов: 2 ячейки, 0 степень
Многоядерный двухклеточный эмбрион
Множественные ядра (круглые структуры, похожие на лунные кратеры) в обеих ячейках
У этого эмбриона нет долгосрочной жизнеспособности.
Обычно определение «качества» проводится не ранее чем через 48 часов после извлечения яиц. Однако некоторые лаборатории ЭКО тщательно оценивают эмбрионы в первый день после извлечения яйцеклеток на стадии зиготы или одноклеточного эмбриона. Они используют морфологические параметры пронуклеусов в первый день как часть общей оценки качества эмбриона, а также как часть своих критериев отбора лучших эмбрионов для переноса. Эта оценка в первый день — интересный инструмент, но не было доказано, что она одинаково действительна в разных лабораториях.
К 48 часам («день 2») эмбрионы должны достигнуть как минимум 2 клеток — иначе они «арестованы» .Мы предпочитаем, чтобы к тому времени хотя бы некоторые из них находились на стадии 3 или 4 клетки.
К 72 часам («день 3») мы хотели бы видеть по крайней мере 6 ячеек — и предпочтительно около 8 ячеек. Мы видели детей, рожденных от 4-х клеточных эмбрионов на 3-й день, но шансы на беременность значительно увеличиваются с увеличением количества клеток.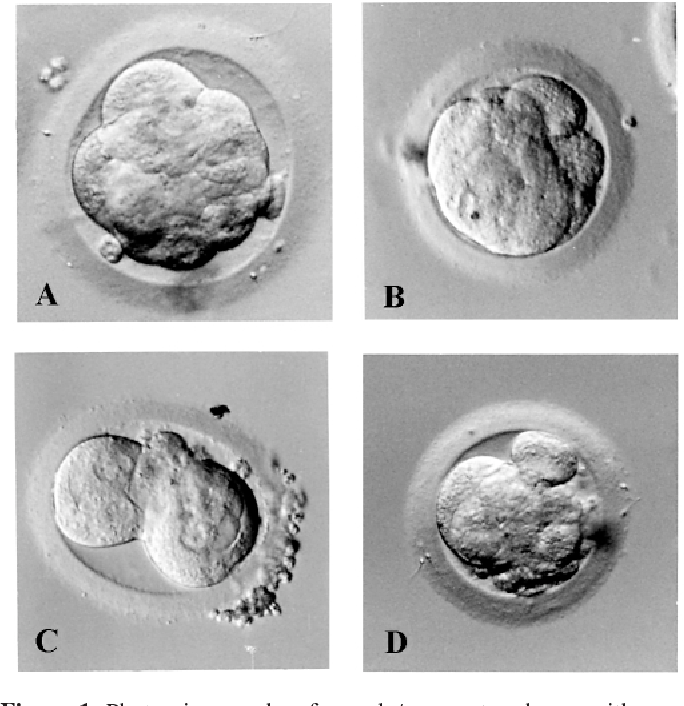
Эмбрионы с большим количеством клеток, с правильным внешним видом и небольшой фрагментацией или без нее имеют более высокий общий шанс имплантации, чем другие эмбрионы с меньшим количеством клеток, большей неравномерностью и значительной фрагментацией.
Качество эмбрионов, которое мы видим под микроскопом в лаборатории ЭКО, дает нам разумную возможность предсказать шансы на беременность после процедуры переноса эмбриона . Однако, поскольку есть много других факторов, которые мы не можем увидеть или измерить, обобщения о «качестве», сделанные на основе оценки эмбрионов, часто бывают неточными.
Мы видим, что некоторые циклы терпят неудачу после переноса 3-х идеально выглядящих эмбрионов, а также мы видим красивых младенцев, рожденных после переноса только одного «низкосортного» эмбриона.Истинный генетический потенциал эмбриона для продолжения нормального развития очень трудно точно измерить, если мы не используем доимплантационный генетический скрининг (PGS) для отбора хромосомно нормальных эмбрионов для переноса.
Хромосомное тестирование с помощью PGS проводится на нескольких клетках, которые удаляются из эмбрионов на стадии разрастания бластоцисты с помощью биопсии трофэктодермы. Когда выполняется PGS, эмбрионы замораживаются после биопсии, потому что результаты генетического тестирования не возвращаются достаточно скоро, чтобы можно было перенести свежий эмбрион.В этих случаях мы делаем перенос замороженных эмбрионов примерно через 4 недели.
- Скорость имплантации эмбрионов значительно выше для эмбрионов с нормальными результатами теста PGS по сравнению с неотсортированными эмбрионами
- Следовательно, истинное качество эмбриона в значительной степени зависит от хромосомной нормальности
- Эмбрион может получить высокую «оценку» по морфологии.
- Однако нормальное хромосомное состояние гораздо важнее в определении его судьбы
Важной переменной, которую часто упускают из виду, является метод переноса эмбриона . Плавный перенос без травмы слизистой оболочки эндометрия необходим для того, чтобы дать эмбрионам наилучшие шансы на имплантацию и продолжение нормального развития.
Плавный перенос без травмы слизистой оболочки эндометрия необходим для того, чтобы дать эмбрионам наилучшие шансы на имплантацию и продолжение нормального развития.
В конечном счете, истинная проверка качества эмбриона заключается в том, имплантируется ли он, нормально ли развивается и в конечном итоге идет домой из больницы с мамой и папой . Другими словами, системы оценки эмбрионов несовершенны, и нам всегда нужен тест на беременность и окончательный результат беременности, чтобы рассказать нам о «качестве эмбриона» больше, чем когда-либо может выявить микроскоп.
Большинство клиник ЭКО «оценивают» каждый эмбрион, используя одну из многих систем оценки. К сожалению, нет никакого соглашения о том, какую систему использовать. Мы все думаем, что у нас есть лучший вариант — и что остальной мир должен использовать нашу систему — в мире ЭКО много больших эго.
Пациенты часто спрашивают, могут ли эмбрионы, получившие оценку эмбриолога «низко», вызвать проблемы с ребенком. Насколько нам известно, дети, рожденные от низкосортных эмбрионов, такие же милые, умные, сильные и т. Д.как рожденные от эмбрионов высокого качества. Единственная разница, по-видимому, заключается в шансе эмбриона (ов) привести к беременности.
Насколько нам известно, дети, рожденные от низкосортных эмбрионов, такие же милые, умные, сильные и т. Д.как рожденные от эмбрионов высокого качества. Единственная разница, по-видимому, заключается в шансе эмбриона (ов) привести к беременности.
Качество эмбриона в значительной степени определяется качеством яйца, из которого он начался. Тесты овариального резерва, такие как оценка гормона ФСГ на 3-й день и подсчет антральных фолликулов, могут дать нам полезную информацию о количестве яйцеклеток, но бесполезны для прогнозирования качества яйцеклеток.
Если бы мы могли улучшить качество яиц, с которых мы начали ЭКО, у нас было бы больше шансов на успешный результат.Однако по большей части качество яиц предопределено, и «мы получаем то, что она дает».
Качество яйца в основном определяется хромосомной и генетической компетентностью отдельного яйца. Не существует лечения для исправления хромосомных или генетических дефектов. Поэтому мы стараемся изо всех сил с яйцами, которые мы извлекаем, или мы проверяем эмбрионы на стадии бластоцисты на хромосомный статус перед переносом.
При получении большого количества яиц у нас больше шансов получить одно или несколько яйцеклеток «высокого качества» — другими словами, яйцо, которое полностью способно оплодотворять, нормально развиваться, имплантироваться и стать здоровым ребенком. .
Узнайте, как количество яйцеклеток, извлеченных с помощью ЭКО, влияет на шанс на успех
Качество процесса стимуляции яичников и качество самой лаборатории ЭКО также являются очень важными переменными, которые влияют на качество получаемых эмбрионов.
Этапы развития эмбриона
После извлечения и оплодотворения яйцеклетки процесс развития эмбриона до момента переноса эмбриона или биопсии эмбриона остается загадкой для большинства пациентов. Действительно, биология развития эмбриона сложна, но она не должна быть полным черным ящиком для пациентов, с нетерпением ожидающих результатов.
Во время извлечения ооцитов игла используется для аспирации развивающихся фолликулов яичников, в которых ооциты (яйца) развивались в течение предыдущих дней. Механика развития фолликулов с самого начала стимуляции яичников — также сложная тема, которую лучше оставить для другого эссе, но разумно сравнить картину событий с нормальным менструальным циклом. Например, так же, как естественные менструальные циклы будут варьироваться по продолжительности от человека к человеку и, кроме того, от одного цикла к другому, время процедуры извлечения яйцеклеток может варьироваться от человека к человеку и от цикла к циклу.
Механика развития фолликулов с самого начала стимуляции яичников — также сложная тема, которую лучше оставить для другого эссе, но разумно сравнить картину событий с нормальным менструальным циклом. Например, так же, как естественные менструальные циклы будут варьироваться по продолжительности от человека к человеку и, кроме того, от одного цикла к другому, время процедуры извлечения яйцеклеток может варьироваться от человека к человеку и от цикла к циклу.
Время извлечения яйцеклеток может быть критически важным для успешного лечения. Может быть полезна аналогия: представьте, что все плоды с яблони нужно собрать одновременно. Чтобы максимально увеличить урожай наибольшего количества созревших плодов и свести к минимуму потери (перезрелые или недозрелые плоды), очень важно принять решение о времени сбора плодов. Чтобы расширить аналогию, измерение размеров яблок было бы полезным для оптимизации вероятности принятия правильного решения.Если бы все яблоки были очень маленькими, вероятно, что большая часть фруктов недозрелые; слишком большой, и плоды могли испортиться на дереве.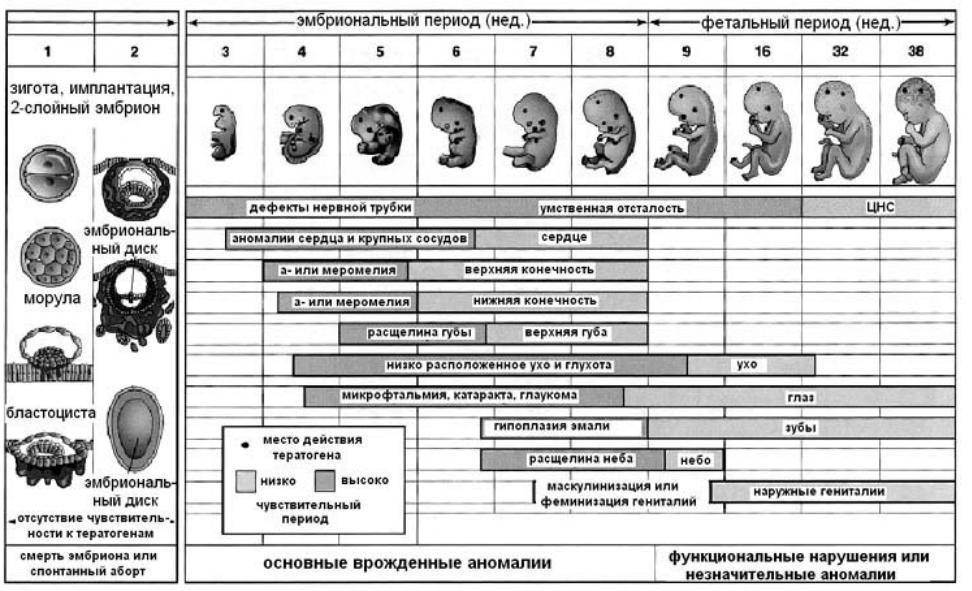 Точно так же размер фолликулов яичников является полезным показателем того, когда яйца внутри должны созреть, чтобы оптимизировать выход зрелых яиц хорошего качества.
Точно так же размер фолликулов яичников является полезным показателем того, когда яйца внутри должны созреть, чтобы оптимизировать выход зрелых яиц хорошего качества.
После извлечения яйцеклеток эмбриологическая лаборатория получит ооциты и должна оценить их зрелость. Существует несколько стадий созревания ооцитов, которые называются по-разному и имеют сокращенные обозначения, такие как «GV», «MI» и «MII».«Это дескрипторы биологической стадии развития. Достаточно сказать, что только ооциты MII являются зрелыми и способны к успешному оплодотворению. MI — это шаг, предшествующий MII, а GV перед MI. Также возможно наличие «постзрелых» ооцитов, которые не функционируют должным образом, как вышеупомянутый перезрелый плод. Некоторые ооциты MI могут созревать в лабораторных условиях, но GV редко продвигается на два шага после извлечения. То есть, однажды собранный плод, как правило, перестает созревать.Не зная, как пациент отреагирует на лечение, репродуктивные эндокринологи должны сделать обоснованное предположение о подходящем времени для «сбора» ооцитов. Выполнено слишком рано, и будет много незрелых ооцитов, а слишком поздно — слишком много постзрелых, недостаточно эффективных ооцитов. Будущие циклы лечения могут быть адаптированы к личной реакции пациента, как только некоторые конкретные данные об этом человеке станут доступны из опыта лечения. Однако для большинства пациентов в этом нет необходимости.Примечательно, что иногда есть другие причины незрелых ооцитов, а не слишком раннее извлечение ооцитов, но эти редкие случаи выходят за рамки текущего обсуждения.
Выполнено слишком рано, и будет много незрелых ооцитов, а слишком поздно — слишком много постзрелых, недостаточно эффективных ооцитов. Будущие циклы лечения могут быть адаптированы к личной реакции пациента, как только некоторые конкретные данные об этом человеке станут доступны из опыта лечения. Однако для большинства пациентов в этом нет необходимости.Примечательно, что иногда есть другие причины незрелых ооцитов, а не слишком раннее извлечение ооцитов, но эти редкие случаи выходят за рамки текущего обсуждения.
После извлечения зрелые ооциты подвергаются воздействию сперматозоидов, чтобы произошло оплодотворение. Оплодотворение — это не просто попадание сперматозоида в яйцеклетку, а скорее биологическая реакция, которая происходит после этого события. День извлечения яйцеклеток называется «День 0», а затем «День 1» — это когда ооциты оцениваются, чтобы определить, какие из них стали эмбрионами.Эмбриологи могут оценить это, исследуя эмбрионы под микроскопом и определяя клеточные структуры, которые появляются только в результате успешного оплодотворения. Это не означает, что эмбрионы нормальные, потому что еще не идентифицированные генетические ошибки могут все еще скрываться незамеченными. Типичный уровень оплодотворения может составлять примерно 70-80% извлеченных зрелых яиц.
Это не означает, что эмбрионы нормальные, потому что еще не идентифицированные генетические ошибки могут все еще скрываться незамеченными. Типичный уровень оплодотворения может составлять примерно 70-80% извлеченных зрелых яиц.
После оплодотворения начинается деление клеток. Мы называем эти эмбрионы в первые несколько дней развития эмбрионами на стадии «дробления», потому что мы можем подсчитать количество делений (дроблений) под микроскопом.Классически стадия расщепления длится до «3-го дня» после извлечения. Изучение количества клеточных делений и других характеристик, наблюдаемых под микроскопом, может дать возможность оценить один эмбрион как более склонный к беременности, чем другой. Начиная с 3-го дня, когда у идеального эмбриона есть 8 отдельных клеток, клеточная активность становится значительно более сложной, поскольку активируются дополнительные гены для дальнейшего развития этих клеток.
На 4-й день эмбрионы входят в стадию «морулы» — уплотненной массы клеток. (Морула происходит от латинского слова «шелковица».) И на 5-й день эмбрион повторно расширяется, как взорвавшийся воздушный шар, в эмбрион на стадии «бластоцисты». Эмбрионы бластоцисты имеют две отдельные группы клеток: внутреннюю клеточную массу, прикрепленную к внутренней части шара из внешних клеток. Эти два типа клеток сейчас являются «дифференцированными» клетками, тогда как раньше они не были таковыми. Ранние эмбриональные клетки являются «стволовыми клетками» в том смысле, что они не совершили превращения в клетки определенного типа, такие как мышцы или волосы, но это обязательство называется дифференцировкой.После начала дифференцировки клетка не может снова стать клеткой другого типа, даже несмотря на то, что каждая клетка с ядром содержит в своей ДНК полный план для создания каждого типа клеток и для выполнения каждой метаболической функции. У эмбрионов бластоцисты есть внутренняя клеточная масса, которая может стать любым из типов клеток плода, которая окружена клетками трофэктодермы, образующими шар вокруг него.
(Морула происходит от латинского слова «шелковица».) И на 5-й день эмбрион повторно расширяется, как взорвавшийся воздушный шар, в эмбрион на стадии «бластоцисты». Эмбрионы бластоцисты имеют две отдельные группы клеток: внутреннюю клеточную массу, прикрепленную к внутренней части шара из внешних клеток. Эти два типа клеток сейчас являются «дифференцированными» клетками, тогда как раньше они не были таковыми. Ранние эмбриональные клетки являются «стволовыми клетками» в том смысле, что они не совершили превращения в клетки определенного типа, такие как мышцы или волосы, но это обязательство называется дифференцировкой.После начала дифференцировки клетка не может снова стать клеткой другого типа, даже несмотря на то, что каждая клетка с ядром содержит в своей ДНК полный план для создания каждого типа клеток и для выполнения каждой метаболической функции. У эмбрионов бластоцисты есть внутренняя клеточная масса, которая может стать любым из типов клеток плода, которая окружена клетками трофэктодермы, образующими шар вокруг него. Клетки трофэктодермы могут стать только будущими клетками плаценты, но не будущими клетками плода.Точно так же клетки внутренней клеточной массы не могут повернуть вспять, чтобы стать плацентарными клетками.
Клетки трофэктодермы могут стать только будущими клетками плаценты, но не будущими клетками плода.Точно так же клетки внутренней клеточной массы не могут повернуть вспять, чтобы стать плацентарными клетками.
Важно понимать, что этот график, от оплодотворения до стадии бластоцисты, является идеализированным прогрессом. Некоторые эмбрионы могут развиваться немного медленнее или немного быстрее, чем это предусмотрено. Скорость этого прогрессирования также влияет на вероятность успеха: медленно растущие эмбрионы часто реже имплантируются; однако медленно растущий эмбрион не обязательно является ненормальным. И из-за случайной генетической ошибки некоторые эмбрионы начнут расти, но затем «остановятся» или перестанут расти, потому что они ненормальны.
Эмбрионы бластоцисты можно описать по их «стадии» развития. По мере того, как особенности становятся более очевидными и эмбрион буквально расширяется, стадия увеличивается, начиная со стадии 1. «Расширенная» бластоциста обычно находится на стадии 3 или 4, тогда как одна начинает вырываться из своей скорлупы (да, у человеческих яиц тоже есть скорлупа! ), это стадия 5, а полностью заштрихованная — стадия 6. На расширенных стадиях (начиная со стадии 3), внутренние и внешние группы клеток можно увидеть отдельно при наблюдении под микроскопом, что позволяет эмбриологам дать каждому оценку. опишите их качество.Более высокие оценки качества связаны с более высокой частотой имплантации. В нашей лаборатории эмбрионам на стадии расширенной бластоцисты присваивается номер стадии и две буквенные категории, первая оценка соответствует массе внутренних клеток, а вторая — внешним клеткам. Например, бластоциста стадии 5AB вылупляется, имеет внутреннюю клеточную массу класса A и внешние клетки, которые имеют степень B. В нашей лаборатории обе группы клеток оцениваются от A до D, как в школе. Второй класс — это не модификатор первого, а скорее отдельный класс, опять же, как два разных предмета в школе, скажем, математика и история.Есть нюансы клеточного строения, которые эмбриологи используют для присвоения буквенных оценок. С точки зрения качества также имеет значение скорость развития эмбриона, поэтому 5AA дня 5 с большей вероятностью имплантируется, чем 5AA дня 7, даже если они находятся на той же стадии и имеют одинаковые оценки.
На расширенных стадиях (начиная со стадии 3), внутренние и внешние группы клеток можно увидеть отдельно при наблюдении под микроскопом, что позволяет эмбриологам дать каждому оценку. опишите их качество.Более высокие оценки качества связаны с более высокой частотой имплантации. В нашей лаборатории эмбрионам на стадии расширенной бластоцисты присваивается номер стадии и две буквенные категории, первая оценка соответствует массе внутренних клеток, а вторая — внешним клеткам. Например, бластоциста стадии 5AB вылупляется, имеет внутреннюю клеточную массу класса A и внешние клетки, которые имеют степень B. В нашей лаборатории обе группы клеток оцениваются от A до D, как в школе. Второй класс — это не модификатор первого, а скорее отдельный класс, опять же, как два разных предмета в школе, скажем, математика и история.Есть нюансы клеточного строения, которые эмбриологи используют для присвоения буквенных оценок. С точки зрения качества также имеет значение скорость развития эмбриона, поэтому 5AA дня 5 с большей вероятностью имплантируется, чем 5AA дня 7, даже если они находятся на той же стадии и имеют одинаковые оценки.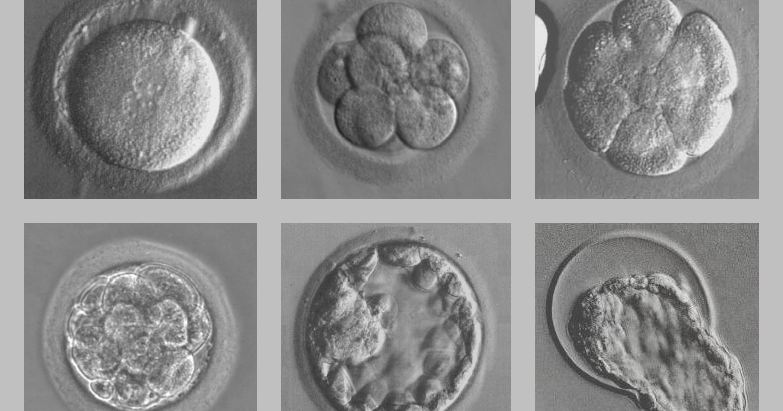 Мы знаем эти различия, наблюдая за результатами лечения наших пациентов при использовании разных эмбрионов. Многие эмбриологические лаборатории не культивируют эмбрионы до 7-го дня, а вместо этого останавливаются на 6-м, но у нас есть данные, подтверждающие их использование.Только эмбрионы, отвечающие минимальным критериям, переживут криоконсервацию эмбрионов и последующее размораживание; есть также минимальные критерии для определения того, когда эмбрион может быть биопсирован.
Мы знаем эти различия, наблюдая за результатами лечения наших пациентов при использовании разных эмбрионов. Многие эмбриологические лаборатории не культивируют эмбрионы до 7-го дня, а вместо этого останавливаются на 6-м, но у нас есть данные, подтверждающие их использование.Только эмбрионы, отвечающие минимальным критериям, переживут криоконсервацию эмбрионов и последующее размораживание; есть также минимальные критерии для определения того, когда эмбрион может быть биопсирован.
Сравнение эмбрионов на стадии дробления с эмбрионами бластоцисты сродни сравнению яблок и апельсинов, как гласит пословица, потому что они очень различаются по уровню развития. Преимущества расширенного культивирования эмбриона до стадии бластоцисты — тема другой статьи, но достаточно сказать, что чем больше информации можно узнать об эмбрионе, тем лучше будет сделан выбор, чтобы максимизировать вероятность того, что выбранный эмбрион будет привести к успешной беременности.
Поделиться этим постомПроцесс ЭКО: оплодотворение и развитие эмбриона
Шаг четвертый: Внесение удобрений
До развития эмбриона сначала должно произойти оплодотворение. После сбора, сортировки и подготовки яйцеклеток и спермы специально обученная команда эмбриологов Shady Grove Fertility начинает процесс оплодотворения. Для внесения удобрений используются два метода:
После сбора, сортировки и подготовки яйцеклеток и спермы специально обученная команда эмбриологов Shady Grove Fertility начинает процесс оплодотворения. Для внесения удобрений используются два метода:
Обычное оплодотворение
Обычное оплодотворение — это стандартная форма оплодотворения, используемая в процессе ЭКО и часто применяемая в таких случаях, как закупорка маточных труб или необъяснимое бесплодие.Эмбриолог начинает с «промывания спермы», позволяя ему / ей выделить здоровые сперматозоиды, которые затем помещаются вокруг каждой яйцеклетки, чтобы могло произойти оплодотворение.
Интрацитоплазматическая инъекция сперматозоидов (ИКСИ)
ИКСИ используется в случаях, когда количество или качество сперматозоидов низкое и, следовательно, не может эффективно проникнуть в яйцеклетку самостоятельно. Эмбриолог выбирает один сперматозоид и вводит его прямо в центр каждой яйцеклетки. Поскольку для оплодотворения требуется только один здоровый сперматозоид, ИКСИ стал одним из самых невероятных достижений в лечении тяжелого бесплодия по мужскому фактору.
Решение о том, какой метод использовать, зависит от качества спермы. Для тестирования спермы анализ спермы выполняется как часть начального основного обследования фертильности для диагностики перед лечением, а затем снова, когда образец спермы предоставляется в день забора яйцеклеток. Если результаты этого анализа не соответствуют параметрам, необходимым для обычного оплодотворения, эмбриолог примет решение перейти на ИКСИ, чтобы цикл продолжал производить эмбрионы и увеличивал ваши шансы на успех.Клиническая бригада сообщит вам, рекомендуется ли незапланированная процедура ИКСИ.
Развитие эмбриона
Развитие эмбриона начинается, когда оплодотворенные яйца помещаются в инкубатор на ночь. Затем каждое утро в течение следующих 3-5 дней эмбриолог исследует развивающиеся эмбрионы каждого пациента. Эмбриолог делает записи о том, что произошло со вчерашнего дня, и добавляет их в электронную карту пациента.
Цель состоит в том, чтобы увидеть медленное и устойчивое развитие 4-клеточного эмбриона на второй день развития в 8-клеточный эмбрион на третий день..jpg) После 8-клеточной стадии клеточные линии начинают размываться, и эмбрион переходит в так называемую стадию бластоцисты на 5 или 6 день. Бластоциста имеет защитную гелеобразную оболочку, называемую блестящей оболочкой, и определенные области клеток внутри нее. Организация того, что называется «внутренней клеточной массой», является ключевым показателем вероятности имплантации эмбриона.
После 8-клеточной стадии клеточные линии начинают размываться, и эмбрион переходит в так называемую стадию бластоцисты на 5 или 6 день. Бластоциста имеет защитную гелеобразную оболочку, называемую блестящей оболочкой, и определенные области клеток внутри нее. Организация того, что называется «внутренней клеточной массой», является ключевым показателем вероятности имплантации эмбриона.
IVF.net — Развитие эмбрионов
Домашняя страница / УчебникиОтзывы посетителей | Добавить в избранное | Обратитесь к друзьям
Стадии яйцеклетки
Зародышевые пузырьки (незрелые)
Зародышевый пузырек, обозначенный стрелкой, показывает, что это яйцо находится в профазе I первого мейотического деления.
(Обратите внимание, что яйца и эмбрионы обычно окружены слоем коронарных ячеек, они выглядят как ореол вокруг яйца в разложенном виде. Кумулюсные клетки распространяются еще дальше и обычно имеют вид пушистого облака. Кучевые облака часто можно увидеть без микроскопа. Яйцо вместе с этими клетками иногда называют комплексом ооцит-кумулюс-корона. На многих рисунках ниже кучевые и корональные клетки были удалены, оставив голое яйцо / эмбрион.Кучевые и коронарные клетки удаляются перед ИКСИ, чтобы можно было оценить зрелость и обеспечить хорошее уплотнение между яйцом и удерживающей пипеткой для ИКСИ. Фермент, используемый для удаления кумулюсных и коронарных клеток, — это гиалуронидаза. В случае обычного оплодотворения — сперматозоиды добавляют в среду и позволяют естественным образом проникнуть в яйцеклетку — кумулюс и коронковые клетки перевариваются спермой, а оставшиеся клетки удаляются при проверке оплодотворения)
Яйцо вместе с этими клетками иногда называют комплексом ооцит-кумулюс-корона. На многих рисунках ниже кучевые и корональные клетки были удалены, оставив голое яйцо / эмбрион.Кучевые и коронарные клетки удаляются перед ИКСИ, чтобы можно было оценить зрелость и обеспечить хорошее уплотнение между яйцом и удерживающей пипеткой для ИКСИ. Фермент, используемый для удаления кумулюсных и коронарных клеток, — это гиалуронидаза. В случае обычного оплодотворения — сперматозоиды добавляют в среду и позволяют естественным образом проникнуть в яйцеклетку — кумулюс и коронковые клетки перевариваются спермой, а оставшиеся клетки удаляются при проверке оплодотворения)
Метафаза 1 (незрелая)
Зародышевый пузырек больше не виден, а полярное тельце еще не экструдировано.
Метафаза 2 (зрелая)
На этих снимках ясно видно полярное тело, обозначенное стрелкой. Полярное тельце является признаком того, что яйцеклетка достигла метафазы 2 в своем развитии, и что яйцеклетка созрела и готова к оплодотворению либо традиционными методами оплодотворения (добавление спермы в среду, окружающую яйцо), либо ИКСИ (инъекция спермы непосредственно в яйцеклетку). центр яйца).
центр яйца).
Стадии эмбриона
2PN Stage (Нормальное оплодотворение — 1 день после осеменения)
Ниже мы видим нормально оплодотворенное яйцо.Стрелкой обозначены два кружка (пронуклеусы), содержащие маленькие точки (ядрышки). Один из пронуклеусов содержит генетическую информацию от яйцеклетки, другой — от сперматозоидов. Считается, что полярность пронуклеусов и равномерное распределение ядрышек между двумя пронуклеусами указывает на потенциальное качество развивающегося эмбриона. Пронуклеусы обычно проверяются через 16-18 часов после добавления спермы в яйцеклетку.
2PN в конечном итоге исчезнет с объединением двух гамет, известным как Syngamy.Теперь зигота превращается в эмбрион.
День 2 после осеменения (2–4-клеточный эмбрион)
Через 24 часа после появления 2PN эмбрион уже начал делиться. Бластомеры часто делятся равномерно, хотя и асинхронно, поэтому нередко эмбрионы имеют нечетное количество клеток и неравномерные бластомеры. Мы также можем видеть различные индикаторы более низкого качества в эмбрионе, такие как фрагменты или множественные образования бластомеров.
Мы также можем видеть различные индикаторы более низкого качества в эмбрионе, такие как фрагменты или множественные образования бластомеров.
День 3 после осеменения (8-ми клеточный эмбрион)
Примерно через 72 часа после первого осеменения яйца обычно достигают стадии 8 клеток.В программе ЭКО на этом этапе обычно переносят лучшие эмбрионы из цикла лечения обратно в матку.
День 4 после осеменения (Морула)
Эмбрион продолжает делиться, клеточная адгезия увеличивается до тех пор, пока расстояние между бластомерами не становится трудно различимым. Эмбрион на этой стадии называется морула.
День 5 после осеменения (бластоциста)
Морула продолжит развиваться, и начнется кавитация.Эмбрион начинает превращаться в полый шар клеток, известный как бластоциста. Бластоциста состоит из двух основных частей: области, более плотной с клетками, называемой внутренней клеточной массой (ICM), которая в конечном итоге сформирует плод, и трофэктодермы, которая станет плацентой. На снимке показаны две бластоцисты, одна слева — это увеличенная бластоциста, одна справа — расширилась и вылупляется из оболочки (пеллюцидная зона) и готовится к имплантации.
На снимке показаны две бластоцисты, одна слева — это увеличенная бластоциста, одна справа — расширилась и вылупляется из оболочки (пеллюцидная зона) и готовится к имплантации.
Дополнительные фотографии
Отзывы клиентов (4)
написать обзор санат кумар сатапати 8 декабря 2012 г.язык и изображения
Язык объяснения вещей с изображениями отличный, что делает его очень простым для понимания.
vinay kumar 14 мая 2011
очень хорошо
очень хорошо проработано с изображениями четкости, и это легко понять ..
chipkar varsha 12 декабря 2008 г.
отличные
хорошие картинки и материя хорошая и легкая для понимания лучше
santanu 14 августа 2007 г.
диаграммы и фотографии отличного качества … было бы очень полезно для понимания ЭКО … thnx
Развитие эмбрионов при ЭКО — Wilcox Fertility
При прохождении процесса экстракорпорального оплодотворения (ЭКО) ваши яйцеклетки извлекаются, и следующий этап вашего пути к фертильности будет происходить, только сейчас, в лаборатории. Многим интересно, что происходит в эмбриологической лаборатории и что эмбриологи ищут при развитии эмбрионов. Команда Wilcox Fertility стремится обучать пациентов и предоставлять им как можно больше информации. Ниже показано, что происходит после извлечения яиц.
Многим интересно, что происходит в эмбриологической лаборатории и что эмбриологи ищут при развитии эмбрионов. Команда Wilcox Fertility стремится обучать пациентов и предоставлять им как можно больше информации. Ниже показано, что происходит после извлечения яиц.
После извлечения яйцеклеток ваши яйца будут отделены от фолликулярной жидкости, промыты, оценены на предмет ядерной зрелости и помещены в инкубаторы с низким давлением кислорода. В течение четырех часов после извлечения яйцеклетка (яйцеклетки) и сперма объединяются, или в случае интрацитоплазматической инъекции сперматозоидов (ИКСИ) в яйцеклетку вводится один сперматозоид.Эмбриолог будет искать признаки оплодотворения через четырнадцать — девятнадцать часов после оплодотворения. Это включает поиск двух пронуклеусов и экструзию второго полярного тельца. Слишком много или слишком мало пронуклеусов приведет к аномальному оплодотворению эмбриона. Все зиготы, которые демонстрируют правильное развитие, переносят в чистую чашку и культивируют в «непрерывной» среде, содержащей все необходимые субстраты и аминокислоты для поддержки роста и развития эмбриона до стадии бластоцисты.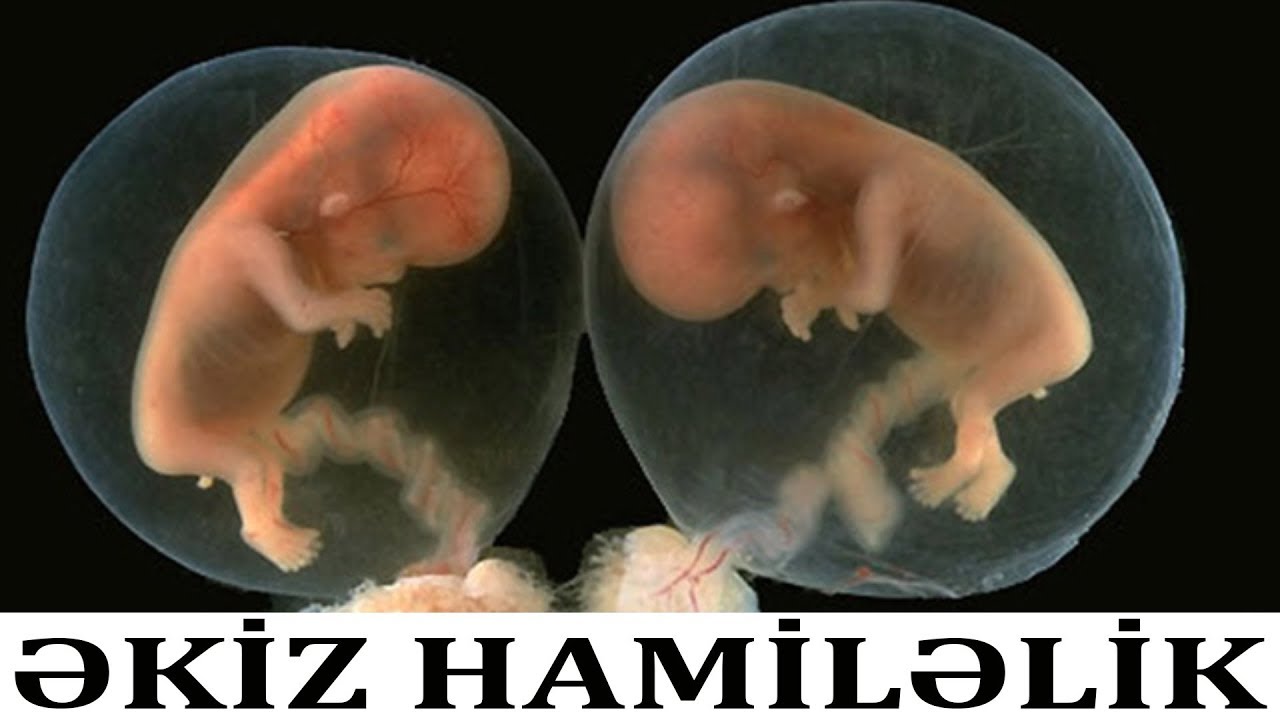 Ваши эмбрионы выращиваются в инкубаторах с низким содержанием кислорода (которые имитируют естественную среду) до 5 дня их жизни. В этот период мы не вынимаем эмбрионы из инкубатора. Мы твердо настроены поддерживать как можно более «свободную от стресса» среду для развивающихся эмбрионов, тем самым устраняя необходимость постоянного извлечения эмбрионов из инкубатора.
Ваши эмбрионы выращиваются в инкубаторах с низким содержанием кислорода (которые имитируют естественную среду) до 5 дня их жизни. В этот период мы не вынимаем эмбрионы из инкубатора. Мы твердо настроены поддерживать как можно более «свободную от стресса» среду для развивающихся эмбрионов, тем самым устраняя необходимость постоянного извлечения эмбрионов из инкубатора.
Надеемся, что на пятый день эмбрион достигнет стадии бластоцисты. Не все эмбрионы дойдут до этой стадии.Это одно из преимуществ длительного культивирования, поскольку сами эмбрионы выбираются самостоятельно. Другими словами, отбираются эмбрионы, которые задерживаются в процессе. В общем, бластоциста состоит из двух частей: трофэктодермы (TE), которая в конечном итоге дает начало плаценте, и внутренней клеточной массы (ICM), которой суждено стать вашим ребенком. Для успешной беременности нам нужны оба компонента. Бластоцисты обладают еще одним преимуществом, поскольку их можно использовать для генетического тестирования эмбрионов. Сегодня мы удаляем примерно пять клеток (из более чем 100 TE-клеток в бластоцисте) из слоя трофэктодермы для генетического анализа. ICM не беспокоил. В нашей практике большинство бластоцист остекловываются (процедура криоконсервации с использованием процесса быстрого замораживания) после биопсии эмбриона. Стекловая эмбрионы, мы позволяем телу отдыхать и можем перенести только эуплоидный (нормальный) эмбрион в последующий, более «естественный» цикл. Таким образом, сочетая длительную культуру / бластоцисты с генетическим тестированием и витрификацией, мы оптимизируем вашу цель рождения ребенка.
Сегодня мы удаляем примерно пять клеток (из более чем 100 TE-клеток в бластоцисте) из слоя трофэктодермы для генетического анализа. ICM не беспокоил. В нашей практике большинство бластоцист остекловываются (процедура криоконсервации с использованием процесса быстрого замораживания) после биопсии эмбриона. Стекловая эмбрионы, мы позволяем телу отдыхать и можем перенести только эуплоидный (нормальный) эмбрион в последующий, более «естественный» цикл. Таким образом, сочетая длительную культуру / бластоцисты с генетическим тестированием и витрификацией, мы оптимизируем вашу цель рождения ребенка.
Любое лечение бесплодия может истощить эмоционально и физически. Вот почему Wilcox Fertility считает, что чем больше вы узнаете о процедуре, тем комфортнее и оптимистичнее будете себя чувствовать.
Если у вас есть какие-либо вопросы или проблемы, мы рекомендуем вам продолжить и изучить другие разделы нашего сайта и либо , свяжитесь с нами через нашу онлайн-форму , либо просто позвоните нам по телефону 626.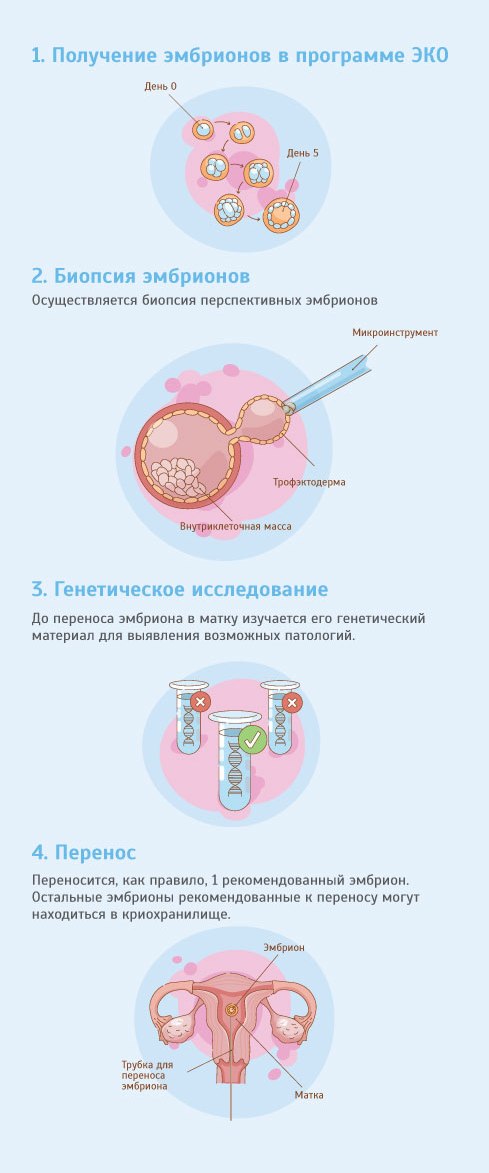 657.9327 . Мы с нетерпением ждем возможности помочь вам начать ваше путешествие.
657.9327 . Мы с нетерпением ждем возможности помочь вам начать ваше путешествие.
Исходы беременностей при свежем зачатии ЭКО после переноса эмбрионов на разных стадиях раннего эмбрионального развития
Цель: Сравнить исходы беременности между беременностями на 2-й, 3-й и 5-6-й дни переноса свежих эмбрионов (ЭТ). Методы: Ретроспективное когортное исследование, включающее все беременности после циклов ЭКО свежего ЭКО / интрацитоплазматической инъекции сперматозоидов (ИКСИ), проведенных в период с января 2014 года по декабрь 2015 года в отделении фертильности и в отделении экстракорпорального оплодотворения (ЭКО) медицинского центра Университета Сорока.Группы исследования состояли из 48, 72, 120 и 144 часовых эмбрионов. Беременность подтверждена измерением бета-хорионического гонадотропина человека в сыворотке крови. Данные, касающиеся истории болезни пациентов, обследования бесплодия, характеристик лечения бесплодия и исхода, а также акушерских исходов, были собраны из медицинских карт пациентов и базы данных лаборатории ЭКО. Были построены модели множественной регрессии для контроля искажающих факторов. Пациенты, прошедшие лечение для сохранения фертильности, циклы донорства ооцитов или ооцитов созревания in vitro, ооцитов, а также случаи преимплантационного генетического тестирования были исключены. Результаты: Всего 534 беременности после свежего ЭКО / ИКСИ ЭТ на 2 день ( n, = 189, 35,4%), день 3 ( n, = 200, 37,5%) и дни 5 или 6 ( n. = 145, 27,2%). Коэффициент живорождения продемонстрировал линейную связь со стадией развития при ЭТ с самыми высокими показателями в бластоцистах и постепенно снижался на 3-й и 2-й день ЭТ (79,2, 65,8 и 60,6% соответственно, p = 0,001). Также наблюдалась положительная линейная связь между возрастом ET и частотой клинической беременности (77.3, 87,5 и 90,3% для 2, 3 и 5/6 дней соответственно, p = 0,002), а также с комбинированной частотой осложнений беременности (29, 37,3 и 43,3%, p =. 026). Однако с использованием модели многомерной логистической регрессии, контролирующей возраст ET, возраст матери, курение, ожирение, начальный уровень ХГЧ и пиковый уровень E2, частота живорождений была сопоставима между исследуемыми группами независимо от возраста ET.
Были построены модели множественной регрессии для контроля искажающих факторов. Пациенты, прошедшие лечение для сохранения фертильности, циклы донорства ооцитов или ооцитов созревания in vitro, ооцитов, а также случаи преимплантационного генетического тестирования были исключены. Результаты: Всего 534 беременности после свежего ЭКО / ИКСИ ЭТ на 2 день ( n, = 189, 35,4%), день 3 ( n, = 200, 37,5%) и дни 5 или 6 ( n. = 145, 27,2%). Коэффициент живорождения продемонстрировал линейную связь со стадией развития при ЭТ с самыми высокими показателями в бластоцистах и постепенно снижался на 3-й и 2-й день ЭТ (79,2, 65,8 и 60,6% соответственно, p = 0,001). Также наблюдалась положительная линейная связь между возрастом ET и частотой клинической беременности (77.3, 87,5 и 90,3% для 2, 3 и 5/6 дней соответственно, p = 0,002), а также с комбинированной частотой осложнений беременности (29, 37,3 и 43,3%, p =. 026). Однако с использованием модели многомерной логистической регрессии, контролирующей возраст ET, возраст матери, курение, ожирение, начальный уровень ХГЧ и пиковый уровень E2, частота живорождений была сопоставима между исследуемыми группами независимо от возраста ET. Осложнения беременности были сопоставимы между группами; тем не менее, совокупная переменная осложнений беременности была выше при беременностях с бластоцистами по сравнению с беременностями с дробным эмбрионом. Выводы: Обычный подход к переносу бластоцисты, так как эмбрион высокого качества не доказал свою эффективность с точки зрения коэффициента живорождения. Более того, эмбрионы на стадии дробления не были связаны с неблагоприятными перинатальными исходами. Текущие данные показывают, что возраст матери не влияет на рождение живого ребенка.
Осложнения беременности были сопоставимы между группами; тем не менее, совокупная переменная осложнений беременности была выше при беременностях с бластоцистами по сравнению с беременностями с дробным эмбрионом. Выводы: Обычный подход к переносу бластоцисты, так как эмбрион высокого качества не доказал свою эффективность с точки зрения коэффициента живорождения. Более того, эмбрионы на стадии дробления не были связаны с неблагоприятными перинатальными исходами. Текущие данные показывают, что возраст матери не влияет на рождение живого ребенка.
Ключевые слова: Бластоциста; стадия спайности; перенос эмбрионов; исход беременности.
Проспективное рандомизированное контролируемое исследование
Turk J Obstet Gynecol. 2017 июн; 14 (2): 82–88.
Чафак Хатырназ
1 Частная трюмная больница, Клиника акушерства и гинекологии, Стамбул, Турция
Шахта Канат Пекташ
2 Университет Афьон Коджатепе, медицинский факультет, отделение акушерства и гинекологии, Афьон, Турция
1 Частная трюмная больница, Клиника акушерства и гинекологии, Стамбул, Турция
2 Университет Афьон Коджатепе, медицинский факультет, отделение акушерства и гинекологии, Афьон, Турция
* Адрес для корреспонденции: Частная трюмная больница, Клиника акушерства и гинекологии, Стамбул, Турция GSM: +90 212 444 95 75 Эл. Почта: moc.liamg @ zanritahkafas
Почта: moc.liamg @ zanritahkafasПоступила в редакцию 02.01.2017; Принято 16 марта 2017 г..
Copyright © Турецкий журнал акушерства и гинекологии, опубликовано издательством Galenos Publishing.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья цитируется в других статьях в PMC.Abstract
Цель:
Это исследование было направлено на то, чтобы показать, приводит ли перенос эмбрионов 5-го дня к более высоким показателям имплантации и наступления беременности, чем перенос эмбрионов 3-го дня у турецких женщин, перенесших цикл интрацитоплазматической инъекции сперматозоидов (ИКСИ).
Материалы и методы:
Всего 190 женщин, перенесших ИКСИ после извлечения более четырех ооцитов в день проверки оплодотворения, были случайным образом распределены для переноса эмбрионов на 3 или 5 день.
Результаты:
Переносы на 3-й и 5-й дни были статистически схожими в отношении возраста женщины (p = 0,107), продолжительности бесплодия (p = 0,528), причины бесплодия (p = 0,850), количества собранных ооцитов (p = 0,119), количество ооцитов в метафазе II (p = 0.178), количество оплодотворенных ооцитов (p = 0,092) и количество перенесенных эмбрионов (p = 0,556). Количество эмбрионов степени 1 было значительно выше при переносе на 5-й день, чем при переносе на 3-й день (p = 0,001). Перенос эмбрионов на 3-й и 5-й дни имел статистически схожие показатели имплантации, клинической беременности, двойни и живорождения (p = 0,779, p = 0,771, p = 0,183 и p = 0,649, соответственно). Показатели живорождений при одноплодной беременности, зачатой после переноса эмбрионов на 3 и 5 день, были статистически схожими (p = 0.594).
Заключение:
Перенос бластоцисты по эффективности не уступает переносу эмбриона на стадии дробления. Перенос бластоцисты может иметь преимущества, поскольку он связан с приемлемой частотой наступления беременности, а морфологическая оценка на 3-й день имеет ограниченную прогностическую ценность для последующего эмбрионального развития.
Ключевые слова: Бластоциста, перенос эмбриона, экстракорпоральное оплодотворение, интрацитоплазматическая инъекция сперматозоидов
PRECIS:
Перенос бластоцисты — эффективный метод переноса эмбриона, связанный с удовлетворительными исходами беременности, и выполнение переноса бластоцисты может иметь преимущества, поскольку морфологическая оценка в день 3 имеет ограниченную прогностическую ценность для последующего эмбрионального развития.
ВВЕДЕНИЕ
Интрацитоплазматическая инъекция сперматозоидов (ИКСИ) традиционно относится к процессу оплодотворения путем объединения яйцеклетки и спермы в лаборатории с последующим переносом полученных эмбрионов в матку. Перенос эмбрионов (ЭТ), выполняемый на второй или третий день оплодотворения, когда эмбрионы находятся на стадии 4-8 клеток, имеет частоту имплантации ниже 20% (1,2,3) .
В Турции ЭТ проводится в соответствии с предписаниями Министерства здравоохранения.Одиночная ЭТ (SET) рекомендуется женщинам в возрасте до 35 лет, у которых есть первая или вторая ЭТ, в то время как максимум два эмбриона могут быть перенесены женщинам старше 35 лет, у которых ранее было 2 неудачных переноса эмбрионов (4) .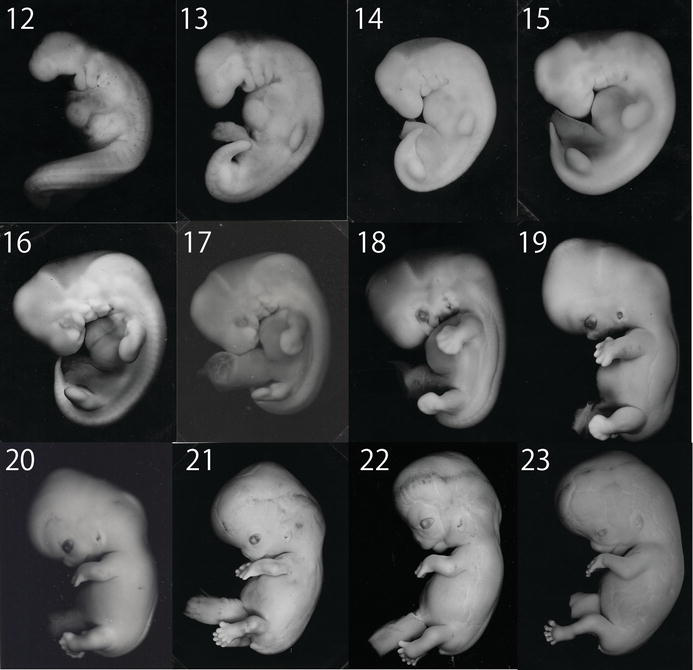 Это ограничение на ЭТ указывает на необходимость повышения эффективности циклов оплодотворения in vitro (ЭКО). Была выдвинута гипотеза, что стадия ЕТ бластоцисты позволит идентифицировать эмбрионы, которые могут поддерживать свой процесс развития, и, таким образом, позволить рекрутирование эмбрионов хорошего качества с повышенной способностью к развитию.Таким образом, было высказано предположение, что перенос бластоцисты на 5-й день обеспечит наибольшую частоту наступления беременности с наименьшим количеством эмбрионов (5,6,7) . Хорошо известно, что рост и бластоцисты на стадии 8 клеток нуждаются в более сложной среде, но недавний состав высокоспециализированной среды позволил сохранить бластоцисты in vitro (8,9,10) .
Это ограничение на ЭТ указывает на необходимость повышения эффективности циклов оплодотворения in vitro (ЭКО). Была выдвинута гипотеза, что стадия ЕТ бластоцисты позволит идентифицировать эмбрионы, которые могут поддерживать свой процесс развития, и, таким образом, позволить рекрутирование эмбрионов хорошего качества с повышенной способностью к развитию.Таким образом, было высказано предположение, что перенос бластоцисты на 5-й день обеспечит наибольшую частоту наступления беременности с наименьшим количеством эмбрионов (5,6,7) . Хорошо известно, что рост и бластоцисты на стадии 8 клеток нуждаются в более сложной среде, но недавний состав высокоспециализированной среды позволил сохранить бластоцисты in vitro (8,9,10) .
Настоящее исследование было организовано, чтобы определить, приведет ли перенос эмбрионов на стадии бластоцисты к более высоким показателям имплантации и наступления беременности, чем перенос эмбрионов на стадии дробления у турецких женщин, проходящих циклы ИКСИ, в контексте юридических ограничений на количество переносимых эмбрионов. Результаты этого исследования будут соответствовать необходимости данных, касающихся осуществления переноса бластоцисты при плановом SET или двойном ET.
Результаты этого исследования будут соответствовать необходимости данных, касающихся осуществления переноса бластоцисты при плановом SET или двойном ET.
МАТЕРИАЛЫ И МЕТОДЫ
Это проспективное рандомизированное исследование было проведено в соответствии с этическими принципами, изложенными в Хельсинкской декларации и одобренными местным комитетом по этике (номер одобрения: 149.01.2016).
Отбор и рандомизация пациентов
Подходили 218 пациентов, у которых на 1-й день оплодотворения (оценка пронуклеусов) во время цикла ИКСИ было извлечено не менее четырех оплодотворенных ооцитов.Получение по крайней мере четырех оплодотворенных ооцитов было установлено как критерий соответствия критериям, позволяющий свести к минимуму риск прекращения лечения и отмены цикла. Соответствующие критериям женщины были проинформированы об исследовании. После исключения 17 пациентов, которые отказались от участия в исследовании, оставшиеся 201 пациент дали письменное информированное согласие и были затем рандомизированы в группы переноса эмбриона на 3-й или 5-й день (n = 100, n = 101, соответственно) с использованием список случайных чисел, сгенерированный компьютером. После того, как пациентка была рандомизирована, она оставалась в одной группе на протяжении всего исследования. Из исследования были исключены семь пациентов, которые прекратили курс ИКСИ из-за остановки развития на стадии бластоцисты, и четыре пациента, которые считались пациентами с высоким риском синдрома гиперстимуляции яичников. Таким образом, в окончательный анализ были включены 95 пациентов из группы ЭТ 3-го дня и 95 пациентов из группы ЭТ 5-го дня ().
После того, как пациентка была рандомизирована, она оставалась в одной группе на протяжении всего исследования. Из исследования были исключены семь пациентов, которые прекратили курс ИКСИ из-за остановки развития на стадии бластоцисты, и четыре пациента, которые считались пациентами с высоким риском синдрома гиперстимуляции яичников. Таким образом, в окончательный анализ были включены 95 пациентов из группы ЭТ 3-го дня и 95 пациентов из группы ЭТ 5-го дня ().
Блок-схема CONSORT СГЯ: синдром гиперстимуляции яичников
Контролируемая гиперстимуляция яичников и извлечение ооцитов
Основным протоколом стимуляции был длинный протокол.Все пациенты получают ацетат лейпролида (Lucrin ® , Abbott Pharmaceuticals, IL, USA) на 21 день менструального цикла. Когда началось менструальное кровотечение, было проведено трансвагинальное ультразвуковое исследование и измерена концентрация эстрадиола в сыворотке крови. Как только обеспечивалось состояние покоя яичников при отсутствии кист яичников и уровни эстрадиола были ниже 50 пг / мл, начинали введение гонадотропинов с помощью рекомбинантного фолликулостимулирующего гормона в суточной дозе 150 МЕ (Gonal F ® , Serono Laboratories, Рэндольф, Массачусетс, США). Суточная доза подбиралась индивидуально. Когда по крайней мере три фолликула достигли среднего диаметра 17 мм, вводили хорионический гонадотропин человека [(ХГЧ), Ovitrelle ® , Merck-Serono, Aubonne, Switzerland]. Примерно через 35-36 часов ооциты извлекали с помощью двухпросветной аспирационной иглы (Swemed Laboratories, Billdal, Швеция) под контролем трансвагинального ультразвукового исследования.
Суточная доза подбиралась индивидуально. Когда по крайней мере три фолликула достигли среднего диаметра 17 мм, вводили хорионический гонадотропин человека [(ХГЧ), Ovitrelle ® , Merck-Serono, Aubonne, Switzerland]. Примерно через 35-36 часов ооциты извлекали с помощью двухпросветной аспирационной иглы (Swemed Laboratories, Billdal, Швеция) под контролем трансвагинального ультразвукового исследования.
Фолликулярный аспират разливали в чашки Falcon диаметром 60 мм (Beckton Dickinson Labware, Franklin Lakes, NJ, США) и комплексы кумулюс-ооцит переносили в другую чашку со стандартной средой для ЭКО (MediCult, Jillinge, Дания).После оценки морфологии клеток кумулюс-ооцит каждого комплекса кумулюс-ооцит, комплексы инкубировали в стандартных инкубаторах до момента удаления кумулюс-ооцитов и клеток короны радиата для ИКСИ.
Подготовка спермы
Все образцы спермы разжижаются в инкубаторе в течение 15–30 минут. Сперму получали с использованием градиента Перколла (95% 47,5%; Sigma, Сент-Луис, Миссури, США). От половины до 2 мл сырой спермы наслаивали на перколл, и препараты центрифугировали при 300 g в течение 20 минут.После центрифугирования осадки из каждой пробирки собирали в 5 мл культуральной среды и центрифугировали при 1800 g для ИКСИ в течение 10 минут. Оплодотворение было подтверждено наличием двух пронуклеусов и двух полярных телец на 1-й день.
От половины до 2 мл сырой спермы наслаивали на перколл, и препараты центрифугировали при 300 g в течение 20 минут.После центрифугирования осадки из каждой пробирки собирали в 5 мл культуральной среды и центрифугировали при 1800 g для ИКСИ в течение 10 минут. Оплодотворение было подтверждено наличием двух пронуклеусов и двух полярных телец на 1-й день.
Классификация эмбрионов
Эмбрионы для переноса 3-го дня культивировали в стандартной культуральной среде, тогда как бластоцисты для переноса 5-го дня были перемещены в G1.2 и G2. .2 средства массовой информации (Scandinavian IVF Sciences, Гетеборг, Скандинавия) в день 1 и день 3 соответственно.Стандартную культуральную среду сравнивали с последовательными средами, поскольку использование среды G1.2 не рекомендовалось для переноса на 3-й день. Количество бластомеров, степень фрагментации и равномерность размера бластомеров для каждого эмбриона регистрировали на 2 и 3 дни для переноса на 3 день и продолжали контролировать на 4 и 5 дни для переноса на 5 день.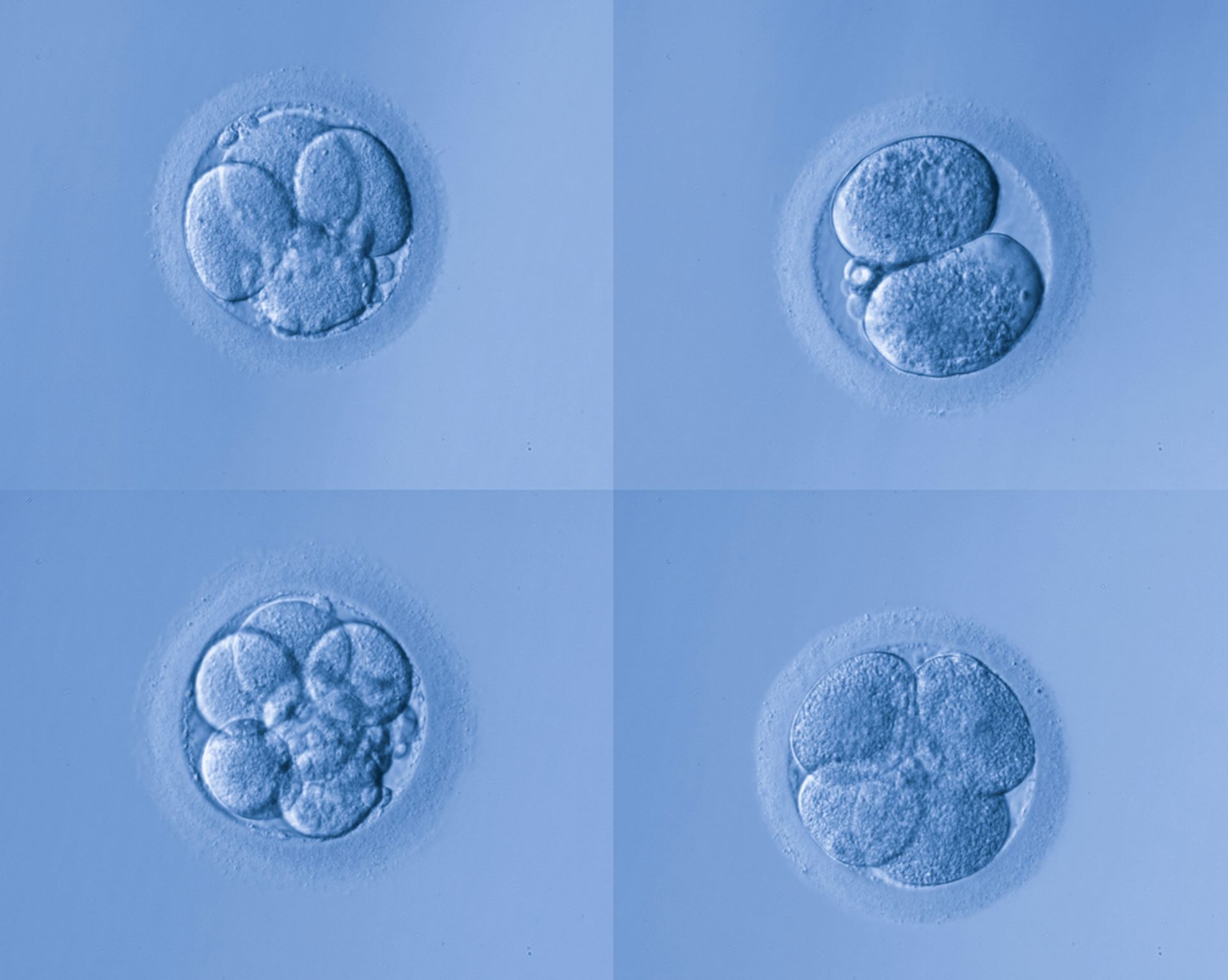 Система классификации, введенная Веком, использовалась для оценки эмбрионов на третий день культивирования. Эмбрионы были классифицированы как: степень 1 — эмбрионы с ровными бластомерами и без фрагментов цитоплазмы; степень 2 — эмбрионы с ровными бластомерами и небольшими фрагментами цитоплазмы или пузырьками; степень 3, эмбрионы с неровными бластомерами и отсутствием или небольшим количеством цитоплазматических фрагментов (11) .Бластоцисты классифицировали по размеру полости бластоцеле как ранние, полные или расширенные; внутренняя клеточная масса; и распределение слоя трофэктодермы.
Система классификации, введенная Веком, использовалась для оценки эмбрионов на третий день культивирования. Эмбрионы были классифицированы как: степень 1 — эмбрионы с ровными бластомерами и без фрагментов цитоплазмы; степень 2 — эмбрионы с ровными бластомерами и небольшими фрагментами цитоплазмы или пузырьками; степень 3, эмбрионы с неровными бластомерами и отсутствием или небольшим количеством цитоплазматических фрагментов (11) .Бластоцисты классифицировали по размеру полости бластоцеле как ранние, полные или расширенные; внутренняя клеточная масса; и распределение слоя трофэктодермы.
Перенос эмбрионов
Один или два эмбриона высшего сорта из обеих групп были перенесены в полость эндометрия на 3 и 5 день. В случае задержки развития на 5 день один или два наиболее продвинутых эмбриона были перенесены в матку. в день 5. Женщины в возрасте ≥35 лет и / или те, у кого было два предыдущих неудачных цикла, имели право на перенос двух эмбрионов.Лютеиновая фаза поддерживалась внутримышечным введением 50 мг прогестерона в масле один раз в день (Progestan ® , Koçak Farma, Стамбул, Турция) и эстрадиола, двух трансдермальных пластырей по 100 мкг (Estraderm TTS ® , Novartis Pharma AG, Базель, Швеция). с ежедневной заменой. Тест на беременность был проведен на 12 -й день после ET. Женщинам с положительным результатом на ХГЧ через 15 дней было проведено трансабдоминальное УЗИ. Клиническая беременность определялась как выявление внутриутробного эмбриона с сердечным сокращением.
с ежедневной заменой. Тест на беременность был проведен на 12 -й день после ET. Женщинам с положительным результатом на ХГЧ через 15 дней было проведено трансабдоминальное УЗИ. Клиническая беременность определялась как выявление внутриутробного эмбриона с сердечным сокращением.
Статистический анализ
Размер выборки был рассчитан в начале исследования с использованием онлайн-анализатора (http://clincalc.com/Stats/SampleSize.aspx). Для ожидаемой разницы в 15% между двумя группами (10% против 25%) с 5% уровнем значимости и мощностью 80% потребовалось всего 200 пациентов (100 пациентов в группе). Собранные данные анализировали с использованием статистического пакета для социальных наук версии 18.0 (SPSS IBM Software, Армонк, Нью-Йорк, США). Для статистического анализа использовались критерий Колмогорова-Смирнова, точный критерий Фишера и критерий хи-квадрат.Двусторонние значения p <0,05 считались статистически значимыми.
РЕЗУЛЬТАТЫ
Сорок девять женщин (25,8%) не имели предыдущих циклов ИКСИ, 67 женщин (35,3%) имели один предыдущий цикл ИКСИ, а 74 женщины (38,9%) имели как минимум два предыдущих цикла ИКСИ.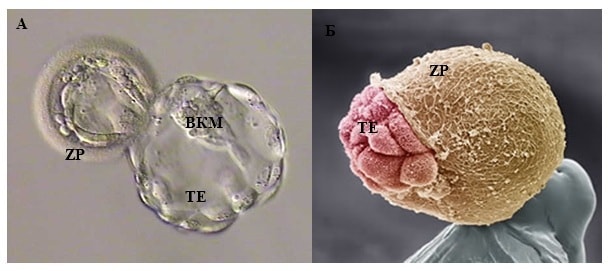
демонстрирует клинические характеристики ЭТ 3-го и 5-го дня. Переносы на 3 и 5 день были статистически схожими в отношении возраста женщин (p = 0,107), продолжительности бесплодия (p = 0,528), причины бесплодия (p = 0.850), количество собранных ооцитов (p = 0,119), количество ооцитов в метафазе II (p = 0,178), количество оплодотворенных ооцитов (p = 0,092) и количество перенесенных эмбрионов (p = 0,556). По сравнению с переносом на 3-й день количество эмбрионов 1 степени было значительно выше при переносе на 5-й день (p = 0,001).
Таблица 1
Клинические характеристики переноса эмбрионов
отображает исходы беременности на 3-й и 5-й дни ET. ЭТ на 3-й и 5-й день имели статистически схожие показатели имплантации, клинической беременности и живорождений (p = 0.779, p = 0,771 и p = 0,649 соответственно). Коэффициенты невынашивания беременности и перинатальной смертности также были статистически схожими на 3-й и 5-й день ЭП (p = 0,551 и p = 0,407, соответственно).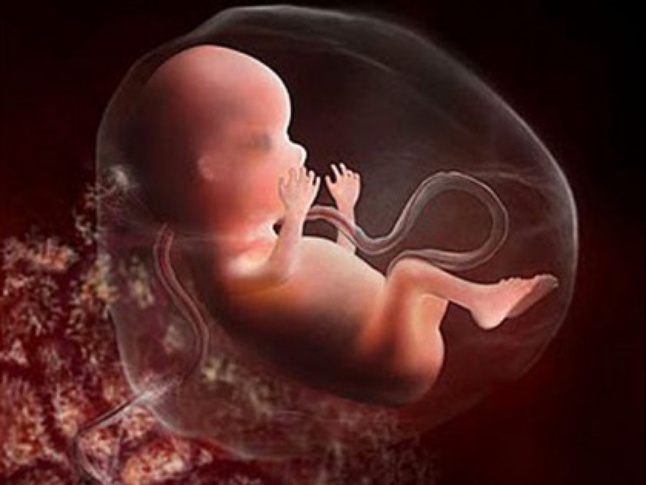 ET на 3-й и 5-й день привели к статистически сходным показателям двойникования (p = 0,183). Кроме того, частота выкидышей, перинатальной смертности и рождаемости при одноплодной беременности, зачатой после 3-го и 5-го дня, была статистически схожей (p = 0,276, p = 0,083 и p = 0,594, соответственно).
ET на 3-й и 5-й день привели к статистически сходным показателям двойникования (p = 0,183). Кроме того, частота выкидышей, перинатальной смертности и рождаемости при одноплодной беременности, зачатой после 3-го и 5-го дня, была статистически схожей (p = 0,276, p = 0,083 и p = 0,594, соответственно).
Таблица 2
Исходы беременности при переносе эмбрионов
SET и двойные ETs на 3-й день имели статистически схожую беременность (39.0% против 58,3%; χ 2 = 3,367; p = 0,067) и коэффициентов живорождения (32,2% против 44,4%; χ 2 = 1,440; p = 0,230). Переносы одинарных и двойных бластоцист на 5 день также имели статистически схожую беременность (43,6% против 45,0%; χ 2 = 0,017; p = 0,895) и коэффициент живорождений (36,4% против 32,5%; χ 2 = 0,152; p = 0,696). Наборы SET на 3-й и 5-й день показали статистически схожую беременность (39,0% против 43,6%; χ 2 = 0,254; p = 0,614) и коэффициент живорождений (32,2% против 36,4%; χ 2 = 0. 219; р = 0,640). Двойные ЭП на 3-й и 5-й день также привели к статистически схожей беременности (58,3% против 45,0%; χ 2 = 1,348; p = 0,246) и коэффициентам живорождений (44,4% против 32,5%; χ 2 ). = 1,146; p = 0,284).
219; р = 0,640). Двойные ЭП на 3-й и 5-й день также привели к статистически схожей беременности (58,3% против 45,0%; χ 2 = 1,348; p = 0,246) и коэффициентам живорождений (44,4% против 32,5%; χ 2 ). = 1,146; p = 0,284).
ОБСУЖДЕНИЕ
SET был установлен в качестве государственной политики во многих европейских странах, включая Турцию. Причина принятия такой политики — избежать многоплодной беременности. Таким образом, центры ЭКО, занимающиеся SET, сосредоточились на выявлении эмбрионов высшего качества и определении оптимального времени для их переноса.Другими словами, для достижения удовлетворительной частоты наступления беременности следует выбирать эмбрион с наибольшими шансами на имплантацию (1,2,3,4) .
Сообщалось, что морфологическая оценка и классификация эмбрионов на 2 или 3 день имеют ограниченную прогностическую ценность для дальнейшего эмбрионального развития (12,13,14) . Связанные исследования также показали, что набор на стадии бластоцисты дает лучшие результаты, чем отбор на 3-й день, который просто зависит от морфологической оценки эмбрионов.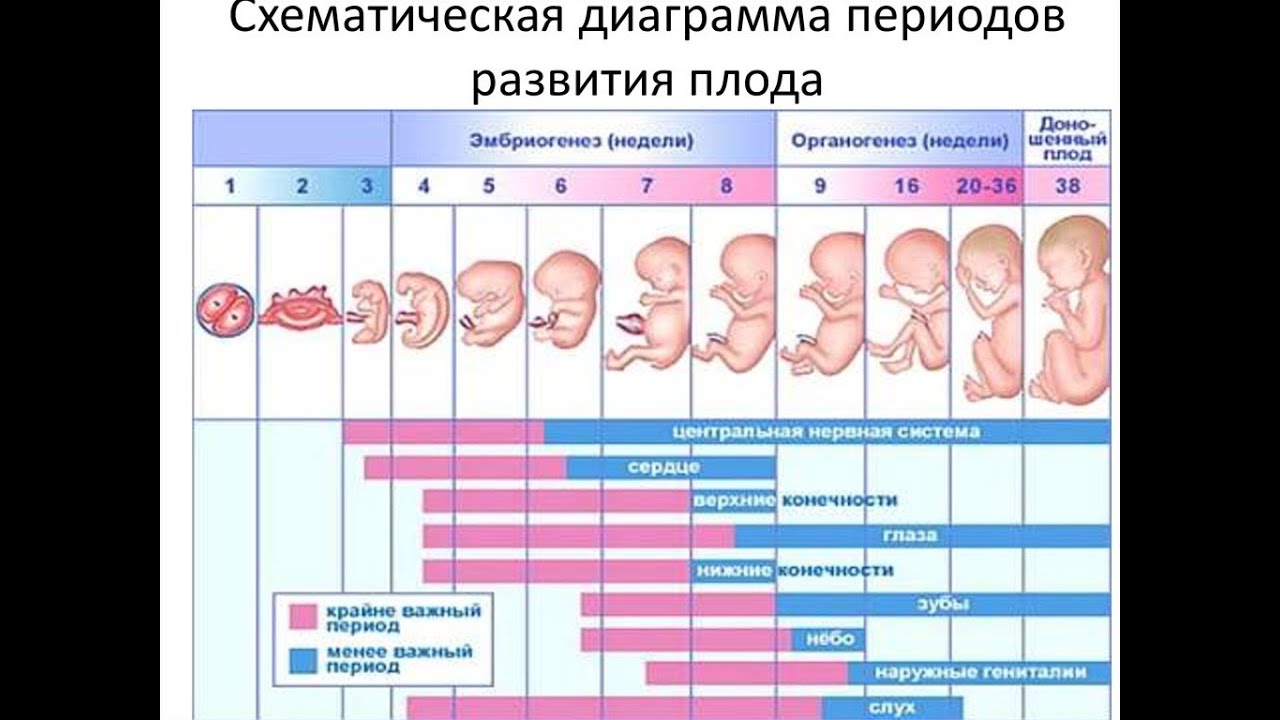 Эти исследования также утверждают, что частота наступления беременности до 50% может быть достигнута путем переноса бластоцист по сравнению с переносом эмбриона на стадии дробления (15,16,17,18,19,20,21) . Точно так же было показано, что риск анеуплоидии был значительно ниже у эмбрионов 5-го дня, чем у эмбрионов 3-го дня (22) . Однако окончательно не указано, что перенос бластоцисты дает лучшие перинатальные исходы, чем ЭТ на третий день (23) . Фактически, проспективное обсервационное исследование показало, что около 50% эмбрионов, зачатых в 224 циклах ЭКО / ИКСИ, подвергались задержке развития на стадии бластоцисты (24) .
Эти исследования также утверждают, что частота наступления беременности до 50% может быть достигнута путем переноса бластоцист по сравнению с переносом эмбриона на стадии дробления (15,16,17,18,19,20,21) . Точно так же было показано, что риск анеуплоидии был значительно ниже у эмбрионов 5-го дня, чем у эмбрионов 3-го дня (22) . Однако окончательно не указано, что перенос бластоцисты дает лучшие перинатальные исходы, чем ЭТ на третий день (23) . Фактически, проспективное обсервационное исследование показало, что около 50% эмбрионов, зачатых в 224 циклах ЭКО / ИКСИ, подвергались задержке развития на стадии бластоцисты (24) .
Обоснование переноса бластоцисты основано на увеличении вероятности получения продвинутых эмбрионов с наибольшим шансом на выживание, т. Е. Имплантации. Для продления культивирования эмбрионов до 5-го дня требуется относительно большое количество бластоцист высшего качества. Эмбрионы на стадии дробления хорошего качества увеличивают вероятность получения эмбрионов бластоцисты хорошего качества. Следовательно, было бы разумно ожидать никаких преимуществ, если в культуре (20,25,26) существует только несколько бластоцист хорошего качества.
Следовательно, было бы разумно ожидать никаких преимуществ, если в культуре (20,25,26) существует только несколько бластоцист хорошего качества.
Перенос двух бластоцист на 5-й день был более благоприятным, чем перенос двух эмбрионов на 3-й день в когорте из 164 бесплодных женщин в возрасте <37 лет в рандомизированном контролируемом исследовании. В этом исследовании перенос на стадии бластоцисты приводил к значительно более высоким показателям беременности (51,3% против 27,4%) и живорождений (47,5% против 27,4%), чем перенос на стадии расщепления. Тем не менее, частота двойникования была статистически схожей для переносов на 3 и 5 день (36,8% против 30,4%) (19) . В соответствии с этим результатом проспективное рандомизированное исследование показало, что перенос одиночных бластоцист имел значительно более высокую частоту наступления беременности (23.7% против 35,6%), чем SET в когорте из 227 бесплодных женщин в возрасте <36 лет, участвовавших в первом или втором испытаниях ЭКО (26) .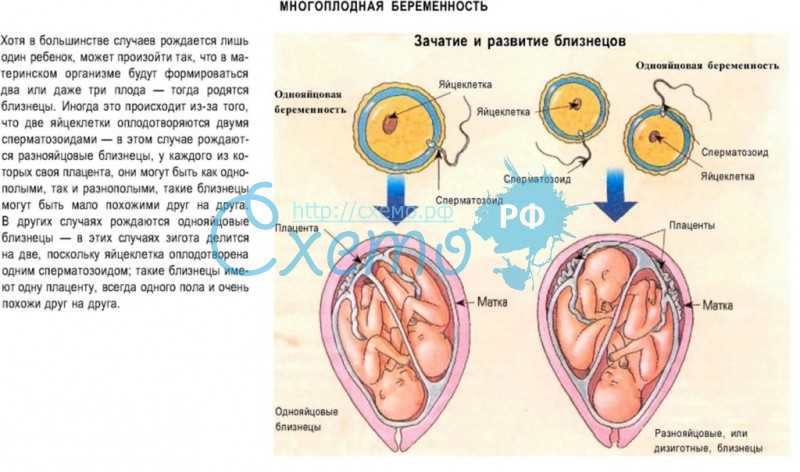
В отличие от вышеприведенного исследования, другое проспективное рандомизированное исследование показало, что перенос 3-го и 5-го дня давал статистически схожие общие результаты имплантации (21% против 23%), беременности (39% против 39%) и двойнивания (11,9% против 23%). 15%) в когорте из 201 бесплодной женщины (27) . Аналогичным образом, перенос 3-го и 5-го дня привел к статистически схожей имплантации (47.4% против 45,3%), клинической беременности (46,3% против 44,2%), живорождений (36,8% против 34,7%) и двойни (4,2% против 8,4%) в этом исследовании.
Обзор соответствующей литературы показал, что ЭТ 5-го дня с расширенными бластоцистами имела значительно более высокую скорость имплантации, чем нерасширяющиеся или некавитирующие эмбрионы, и, таким образом, перенос одиночной бластоцисты может быть более успешным, чем SET (26,27). . Например, около 60% женщин, перенесших одиночную бластоцисту, имели по крайней мере одну бластоцисту превосходного качества, а частота наступления беременности составила 40. 8% для этих пациентов в бельгийском исследовании (26) . Другое исследование, проведенное в Саудовской Аравии, продемонстрировало, что успешность переноса 5-го дня зависела от количества эмбрионов на стадии дробления хорошего качества и наличия по крайней мере одной бластоцисты для переноса (27) . Соответственно, перенос бластоцисты на 5-й день может закончиться более высокой частотой имплантации, чем ET на ранней стадии, если хотя бы одна бластоциста доступна для переноса 5-го дня.
8% для этих пациентов в бельгийском исследовании (26) . Другое исследование, проведенное в Саудовской Аравии, продемонстрировало, что успешность переноса 5-го дня зависела от количества эмбрионов на стадии дробления хорошего качества и наличия по крайней мере одной бластоцисты для переноса (27) . Соответственно, перенос бластоцисты на 5-й день может закончиться более высокой частотой имплантации, чем ET на ранней стадии, если хотя бы одна бластоциста доступна для переноса 5-го дня.
Настоящее исследование не смогло выявить статистически значимых различий в имплантации, клинической беременности и частоте живорождений на 3-й и 5-й день переносов.Эту неспособность можно объяснить относительно небольшим размером когорты и относительной неоднородностью исследуемой популяции. Различия в клинических характеристиках пациентов (например, возраст, причина бесплодия, продолжительность бесплодия) могли вызвать такое несоответствие.
Ограничения исследования
Относительно небольшой размер выборки для статистического анализа является ограничением исследования.
ЗАКЛЮЧЕНИЕ
В заключение можно сказать, что эффективность ЕТ стадии бластоцисты не уступает эффективности стадии расщепления ЕТ.Перенос бластоцисты может иметь преимущества, поскольку он связан с удовлетворительной частотой наступления беременности, а оценка морфологии эмбриона на 3-й день имеет ограниченную прогностическую ценность для последующего процесса развития. Поддержание культуры эмбрионов до 5-го дня может быть более разумным подходом для правильной идентификации эмбрионов лучшего качества с наибольшей вероятностью успеха имплантации.
Результаты настоящего исследования предполагают, что перенос бластоцисты на 5-й день может быть принят в качестве разумного подхода у турецких женщин, которым предстоит пройти плановую SET или двойную ET.Чтобы максимизировать вероятность зачатия беременности при плановом переносе бластоцисты, эту практику следует предлагать для циклов ИКСИ, в которых на 3-й день получают несколько эмбрионов хорошего качества. быть информированным, что существует больший риск отмены цикла, потому что культура эмбриона расширена до стадии бластоцисты. Необходимы дальнейшие исследования для определения эффективности переноса бластоцисты на 5-й день у турецких женщин, которым проводится плановая SET или двойная ET.
Необходимы дальнейшие исследования для определения эффективности переноса бластоцисты на 5-й день у турецких женщин, которым проводится плановая SET или двойная ET.
Сноски
Этика
Одобрение комитета по этике: Исследование было одобрено местным комитетом по этике Университета Афьон Коджатепе (номер одобрения: 149.01.2016).
Информированное согласие: Форма согласия заполнилась всеми участниками.
Экспертная проверка: Внешняя и внутренняя экспертная оценка.
ПредоставленоАвторские взносы
Хирургические и медицинские практики: Ş.H., Концепция: Ş.H., Дизайн: Ş.H., Сбор или обработка данных: Ş.H., M.K.P., Анализ или интерпретация: Ş.H., M.K.P., Литературный поиск: M.K.P., Написание: M.K.P.Конфликт интересов: Авторы не заявляли о конфликте интересов.
Раскрытие финансовой информации: Авторы заявили, что это исследование не получало финансовой поддержки.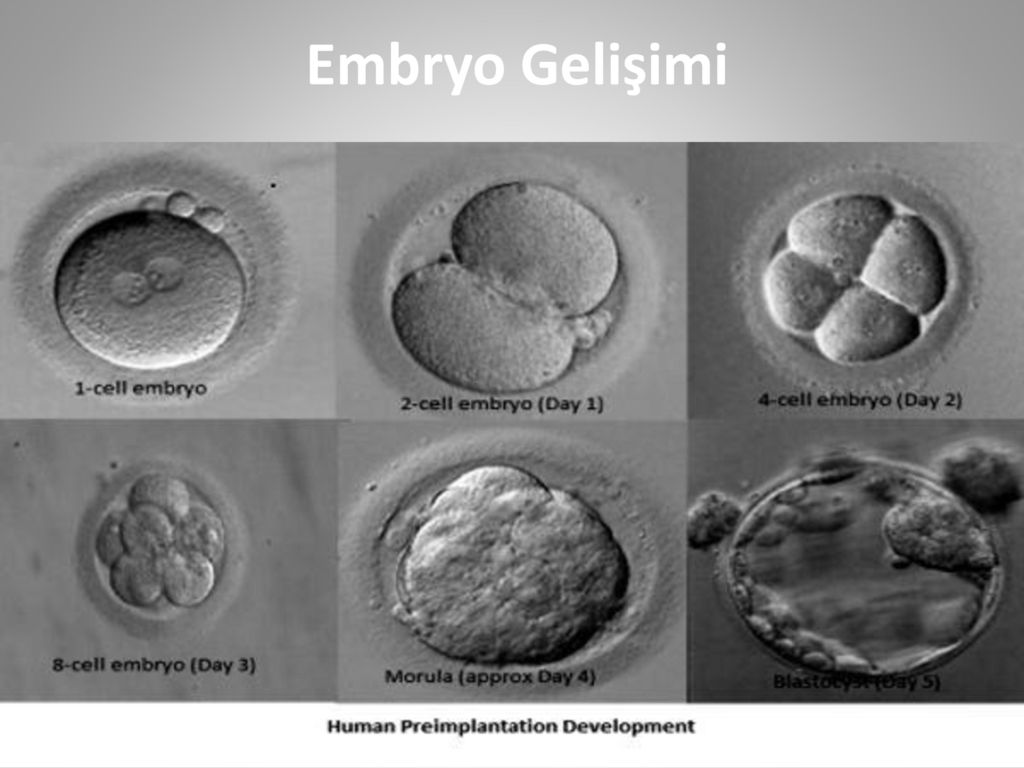
Ссылки
1. Махешвари А., МакЛернон Д., Бхаттачарья С. Совокупный коэффициент живорождения: время для консенсуса? Hum Reprod.2015; 30: 2703–7. [PubMed] [Google Scholar] 2. Мораджанни В.А., Пензиас А.С. Совокупный коэффициент живорождений после вспомогательных репродуктивных технологий. Curr Opin Obstet Gynecol. 2010; 22: 189–92. [PubMed] [Google Scholar] 3. Малиция Б.А., Хакер MR, Penzias AS. Кумулятивная рождаемость после экстракорпорального оплодотворения. N Engl J Med. 2009; 360: 236–43. [PubMed] [Google Scholar] 4. Гузоглу Н., Канмаз Х.Г., Дилли Д., Урас Н., Эрдеве О., Дилмен У. Влияние нового турецкого законодательства, предусматривающего перенос одного эмбриона после технологии вспомогательной репродукции, на использование отделения интенсивной терапии новорожденных: опыт единого центра.Hum Reprod. 2012; 27: 2384–8. [PubMed] [Google Scholar] 5. Сигалос Г., Триантафиллиду О, Влахос Н.Ф. Новые методы отбора эмбрионов для увеличения числа имплантаций эмбрионов при попытках ЭКО.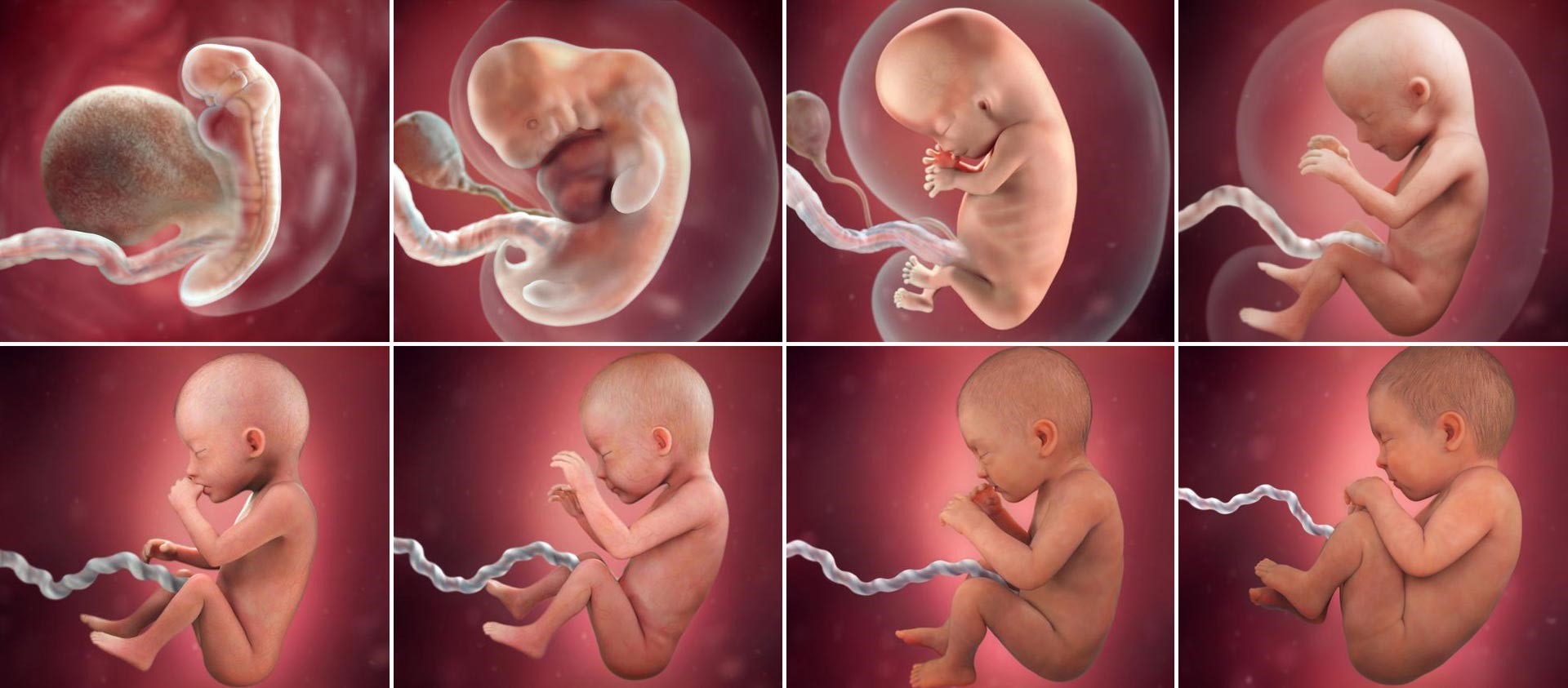 Arch Gynecol Obstet. 2016; 294: 1117–24. [PubMed] [Google Scholar] 6. Касер Д. Д., Раковски С. Клинические результаты после отбора человеческих преимплантационных эмбрионов с покадровым мониторингом: систематический обзор. Обновление Hum Reprod. 2014; 20: 617–31. [PubMed] [Google Scholar] 7. Тирас Б, Ченксой ПО. Практика переноса эмбрионов: рекомендации во время и после.Semin Reprod Med. 2014; 32: 291–6. [PubMed] [Google Scholar] 8. Глюевский Д., Фаркуар С. Стадия расщепления или перенос бластоцисты: в чем польза и вред? Fertil Steril. 2016; 106: 244–50. [PubMed] [Google Scholar] 9. Гарднер Д.К., Месегер М., Рубио С., Трефф Н.Р. Диагностика преимплантационной жизнеспособности эмбриона человека. Обновление Hum Reprod. 2015; 21: 727–47. [PubMed] [Google Scholar] 10. Mantikou E, Youssef MA, Wely M, van, Al-Inany HG, Repping S, Mastenbroek S. Среда для культивирования эмбрионов и показатели успешности ЭКО / ИКСИ: систематический обзор.Обновление Hum Reprod. 2013; 19: 210–20. [PubMed] [Google Scholar] 11.
Arch Gynecol Obstet. 2016; 294: 1117–24. [PubMed] [Google Scholar] 6. Касер Д. Д., Раковски С. Клинические результаты после отбора человеческих преимплантационных эмбрионов с покадровым мониторингом: систематический обзор. Обновление Hum Reprod. 2014; 20: 617–31. [PubMed] [Google Scholar] 7. Тирас Б, Ченксой ПО. Практика переноса эмбрионов: рекомендации во время и после.Semin Reprod Med. 2014; 32: 291–6. [PubMed] [Google Scholar] 8. Глюевский Д., Фаркуар С. Стадия расщепления или перенос бластоцисты: в чем польза и вред? Fertil Steril. 2016; 106: 244–50. [PubMed] [Google Scholar] 9. Гарднер Д.К., Месегер М., Рубио С., Трефф Н.Р. Диагностика преимплантационной жизнеспособности эмбриона человека. Обновление Hum Reprod. 2015; 21: 727–47. [PubMed] [Google Scholar] 10. Mantikou E, Youssef MA, Wely M, van, Al-Inany HG, Repping S, Mastenbroek S. Среда для культивирования эмбрионов и показатели успешности ЭКО / ИКСИ: систематический обзор.Обновление Hum Reprod. 2013; 19: 210–20. [PubMed] [Google Scholar] 11.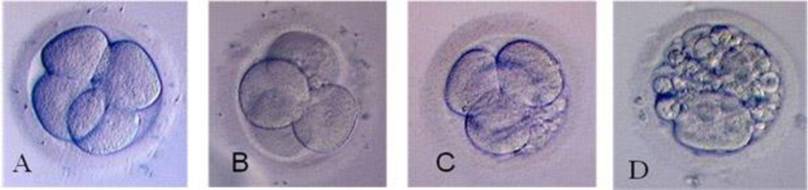 Hsu MI, Mayer J, Anonshon M, Lanzendorf S, Muasher S, Kolm P, Oehninger S. Имплантация эмбрионов при экстракорпоральном оплодотворении и интрацитоплазматической инъекции сперматозоидов: влияние статуса расщепления, степени морфологии и количества перенесенных эмбрионов. Fertil Steril. 1999; 72: 679–85. [PubMed] [Google Scholar] 12. Грэм Дж., Хан Т., Портер Р., Леви М., Стиллман Р., Такер М. Морфология 3-го дня — плохой предиктор качества бластоцисты в расширенной культуре. Fertil Steril.2000; 74: 495–7. [PubMed] [Google Scholar] 13. Милки А., Хинкли М., Гебхардт Дж., Дасиг Д., Вестфаль Л., Бер Б. Точность критериев 3-го дня для отбора лучших эмбрионов. Fertil Steril. 2002; 77: 1191–5. [PubMed] [Google Scholar] 14. Neuber E, Mahutte N, Arici A, Sakkas D. Последовательная оценка эмбрионов превосходит морфологическую оценку, проводимую исследователями, при выборе бластоцисты хорошего качества. Fertil Steril. 2006. 85: 794–6. [PubMed] [Google Scholar] 15. Гарднер Д., Суррей Э., Миньярес Д.
Hsu MI, Mayer J, Anonshon M, Lanzendorf S, Muasher S, Kolm P, Oehninger S. Имплантация эмбрионов при экстракорпоральном оплодотворении и интрацитоплазматической инъекции сперматозоидов: влияние статуса расщепления, степени морфологии и количества перенесенных эмбрионов. Fertil Steril. 1999; 72: 679–85. [PubMed] [Google Scholar] 12. Грэм Дж., Хан Т., Портер Р., Леви М., Стиллман Р., Такер М. Морфология 3-го дня — плохой предиктор качества бластоцисты в расширенной культуре. Fertil Steril.2000; 74: 495–7. [PubMed] [Google Scholar] 13. Милки А., Хинкли М., Гебхардт Дж., Дасиг Д., Вестфаль Л., Бер Б. Точность критериев 3-го дня для отбора лучших эмбрионов. Fertil Steril. 2002; 77: 1191–5. [PubMed] [Google Scholar] 14. Neuber E, Mahutte N, Arici A, Sakkas D. Последовательная оценка эмбрионов превосходит морфологическую оценку, проводимую исследователями, при выборе бластоцисты хорошего качества. Fertil Steril. 2006. 85: 794–6. [PubMed] [Google Scholar] 15. Гарднер Д., Суррей Э., Миньярес Д. , Лейтц А., Стивенс Дж., Скулкрафт Б.Перенос одиночной бластоцисты: проспективное рандомизированное исследование. Fertil Steril. 2004; 81: 551–5. [PubMed] [Google Scholar] 16. Траут С., Борер М., Зайфер Д. Перенос одной бластоцисты у женщин с риском синдрома гиперстимуляции яичников. Fertil Steril. 2001; 76: 1066–7. [PubMed] [Google Scholar] 17. Кингет К., Нийс М., Кокс А., Янссен М., Якобс П., Босманс Э., Омбелет В. Новый подход для пациентов с риском синдрома гиперстимуляции яичников: выборный перенос одной бластоцисты, свободной от свободной зоны, на 5-й день. Reprod Biomed Online.2002; 4: 51–5. [PubMed] [Google Scholar] 18. Милки А., Хинкли М., Вестфаль Л., Бер Б. Избирательный перенос одиночной бластоцисты. Fertil Steril. 2004. 81: 1697–8. [PubMed] [Google Scholar] 19. Папаниколау Э.Г., Камю М., Колибианакис Э.М., Ван Ландейт Л., Ван Штайртегем А., Девроей П. Оплодотворение in vitro с одной стадией бластоцисты по сравнению с эмбрионами на одной стадии дробления. N Engl J Med. 2006; 354: 1139–46.
, Лейтц А., Стивенс Дж., Скулкрафт Б.Перенос одиночной бластоцисты: проспективное рандомизированное исследование. Fertil Steril. 2004; 81: 551–5. [PubMed] [Google Scholar] 16. Траут С., Борер М., Зайфер Д. Перенос одной бластоцисты у женщин с риском синдрома гиперстимуляции яичников. Fertil Steril. 2001; 76: 1066–7. [PubMed] [Google Scholar] 17. Кингет К., Нийс М., Кокс А., Янссен М., Якобс П., Босманс Э., Омбелет В. Новый подход для пациентов с риском синдрома гиперстимуляции яичников: выборный перенос одной бластоцисты, свободной от свободной зоны, на 5-й день. Reprod Biomed Online.2002; 4: 51–5. [PubMed] [Google Scholar] 18. Милки А., Хинкли М., Вестфаль Л., Бер Б. Избирательный перенос одиночной бластоцисты. Fertil Steril. 2004. 81: 1697–8. [PubMed] [Google Scholar] 19. Папаниколау Э.Г., Камю М., Колибианакис Э.М., Ван Ландейт Л., Ван Штайртегем А., Девроей П. Оплодотворение in vitro с одной стадией бластоцисты по сравнению с эмбрионами на одной стадии дробления. N Engl J Med. 2006; 354: 1139–46. [PubMed] [Google Scholar] 20. Папаниколау Э., Д’Хазелер Э., Верхейен Дж., Камю М., Штайртегем А., ван и др. Уровень живорождения после переноса бластоцисты значительно выше, чем после переноса эмбрионов на стадии дробления, когда на 3-й день культивирования эмбрионов доступно не менее четырех эмбрионов.Рандомизированное проспективное исследование. Hum Reprod. 2005; 20: 3198–203. [PubMed] [Google Scholar] 21. Schwarzler P, Zech H, Auer M, Pfau K, Gobel G, Vanderzwalmen P, Zech N. Исход беременности после переноса бластоцисты по сравнению с переносом эмбриона на ранней стадии дробления. Hum Reprod. 2004; 19: 2097–102. [PubMed] [Google Scholar] 22. Staessen C, Platteau P, Assche E, van, Michiels A, Tournaye H, Camus M и др. Сравнение переноса бластоцисты с доимплантационной генетической диагностикой или без нее для скрининга анеуплоидии в парах пожилого возраста матери: проспективное рандомизированное контролируемое исследование.Hum Reprod. 2004. 19: 2849–58. [PubMed] [Google Scholar] 23.
[PubMed] [Google Scholar] 20. Папаниколау Э., Д’Хазелер Э., Верхейен Дж., Камю М., Штайртегем А., ван и др. Уровень живорождения после переноса бластоцисты значительно выше, чем после переноса эмбрионов на стадии дробления, когда на 3-й день культивирования эмбрионов доступно не менее четырех эмбрионов.Рандомизированное проспективное исследование. Hum Reprod. 2005; 20: 3198–203. [PubMed] [Google Scholar] 21. Schwarzler P, Zech H, Auer M, Pfau K, Gobel G, Vanderzwalmen P, Zech N. Исход беременности после переноса бластоцисты по сравнению с переносом эмбриона на ранней стадии дробления. Hum Reprod. 2004; 19: 2097–102. [PubMed] [Google Scholar] 22. Staessen C, Platteau P, Assche E, van, Michiels A, Tournaye H, Camus M и др. Сравнение переноса бластоцисты с доимплантационной генетической диагностикой или без нее для скрининга анеуплоидии в парах пожилого возраста матери: проспективное рандомизированное контролируемое исследование.Hum Reprod. 2004. 19: 2849–58. [PubMed] [Google Scholar] 23. Блейк Д.А., Проктор М., Джонсон Н.П. Преимущества бластоцист по сравнению с переносом эмбрионов на стадии дробления: Кокрановский обзор. Hum Reprod. 2004; 19: 795–807. [PubMed] [Google Scholar] 24. Zech NH, Lejeune B, Puissant F, Zech H, Vanderzwalmen S, Vanderzwalmen P. Перенос одного эмбриона: отбор на 3-й или 5-й день? Проспективное наблюдательное исследование. Fertil Steril. 2005; 84 (Приложение 1): S266. [Google Scholar] 25. Раковски С., Джексон К.В., Чекленяк Н.А., Фокс Дж. Х., Хорнштейн М. Д., Гинзбург Е. С..Количество восьмиклеточных эмбрионов является ключевым фактором при выборе переноса на 3 или 5 день. Fertil Steril. 2000. 73: 558–64. [PubMed] [Google Scholar] 26. Зех Н.Х., Лежен Б., Пюссан Ф., Вандерцвальмен С., Зех Х., Вандерцвальмен П. Предполагаемая оценка оптимального времени для выбора одного эмбриона для переноса: день 3 по сравнению с днем 5. Fertil Steril. 2007. 88: 244–6. [PubMed] [Google Scholar] 27. Coskun S, Hollanders J, Al-Hassan S, Al-Sufyan H, Al-Mayman H, Jaroudi K.
Блейк Д.А., Проктор М., Джонсон Н.П. Преимущества бластоцист по сравнению с переносом эмбрионов на стадии дробления: Кокрановский обзор. Hum Reprod. 2004; 19: 795–807. [PubMed] [Google Scholar] 24. Zech NH, Lejeune B, Puissant F, Zech H, Vanderzwalmen S, Vanderzwalmen P. Перенос одного эмбриона: отбор на 3-й или 5-й день? Проспективное наблюдательное исследование. Fertil Steril. 2005; 84 (Приложение 1): S266. [Google Scholar] 25. Раковски С., Джексон К.В., Чекленяк Н.А., Фокс Дж. Х., Хорнштейн М. Д., Гинзбург Е. С..Количество восьмиклеточных эмбрионов является ключевым фактором при выборе переноса на 3 или 5 день. Fertil Steril. 2000. 73: 558–64. [PubMed] [Google Scholar] 26. Зех Н.Х., Лежен Б., Пюссан Ф., Вандерцвальмен С., Зех Х., Вандерцвальмен П. Предполагаемая оценка оптимального времени для выбора одного эмбриона для переноса: день 3 по сравнению с днем 5. Fertil Steril. 2007. 88: 244–6. [PubMed] [Google Scholar] 27. Coskun S, Hollanders J, Al-Hassan S, Al-Sufyan H, Al-Mayman H, Jaroudi K.