Скорость трикуспидальной регургитации: Российские рекомендации по диагностике и лечению легочной гипертензии
Ультразвуковое исследование при диагностике легочной гипертензии и способ определения ее тяжести
Все заболевания, вызывающие перегрузку правого желудочка давлением, объемом или нарушающие систолическую и/или диастолическую его функцию, рано или поздно приводят к нарушению гемодинамики правых отделов сердца с развитием легочной гипертензии. Легочная гипертензия может быть первичной, развиваться медленно, например, при обструктивных заболеваниях легких, митральных пороках, дефекте межжелудочковой и межпредсердной перегородки, а также остро при массивной тромбэмболии легочной артерии (ЛА). Мелкие повторные тромбоэмболии постепенно, медленно способствуют повышению давления в ЛА. Ультразвуковое исследование сердца является эффективным методом диагностики причин легочной гипертензии.
Известно, что форма правого желудочка анатомически сложная, его оценку с помощью метода УЗИ следует производить в различных сечениях: из парастернального подхода c визуализацией пути притока и изгнания, по короткой оси сердца, а также в сечениях четырех камер из верхушечного и субкостального доступов.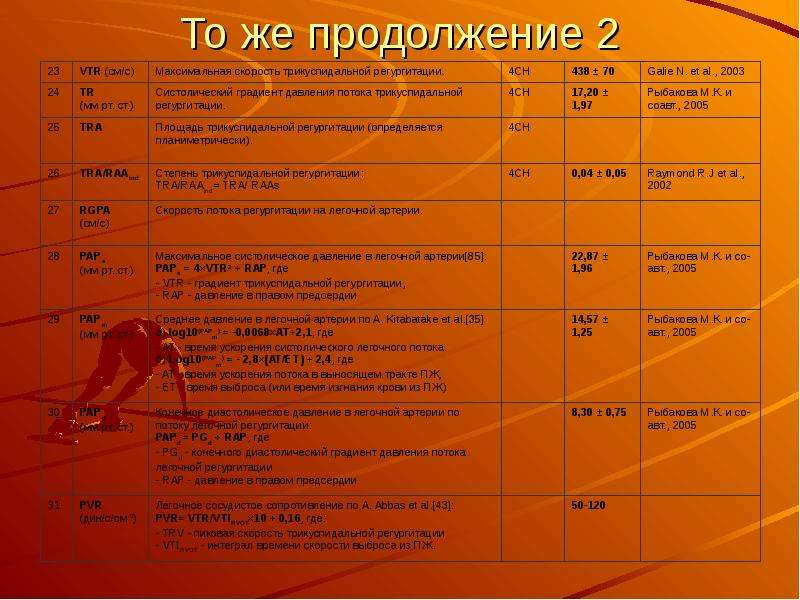
 1, 2).
1, 2).
При хроническом тромбозе и при легочной гипертензии иного происхождения (хроническое легочное сердце, пороки сердца) давление в малом круге кровообращения может достигать более высоких значений, поскольку правый желудочек постепенно адаптируется к перегрузке давлением. В случаях же небольшой острой тромбоэмболии ветвей ЛА давление в ней может не увеличиваться. При подострой массивной тромбоэмболии среднее давление в ЛА увеличивается до 40 мм рт.ст., а систолическое давление в ЛА возрастает до 70 мм рт.ст. и более.
Тромбоэмболия легочной артерии является одним из тяжелых осложнений острого трансмурального инфаркта и сопровождается умеренным повышением давления в легочной артерии. Когда развивается легочная гипертензия различной степени тяжести, ЭхоКГ-изменения включают в разном сочетании признаки увеличения размеров правого желудочка и его систолической дисфункции, усиление выраженности трикуспидальной и легочной клапанной недостаточности, дилатацию ЛА, другие признаки повышения давления в легочной артерии и сопутствующие изменения хода нормального контура и динамики сокращений межжелудочковой перегородки.
Следует иметь в виду, что при острой тромбоэмболии, если среднее давление в ЛА увеличивается до 30-40 мм рт.ст., то это соответствует тромбированию около 40% легочного сосудистого русла. Столь массивная тромбоэмболия всегда вызывает острую правожелудочковую недостаточность. Для эпизода острой массивной тромбоэмболии ЛА характерно быстрое развитие описанных выше ЭхоКГ-изменений на фоне появления внезапной одышки и выраженных системных гемодинамических нарушений. Иногда у таких больных в правых отделах сердца при ЭхоКГ-исследовании удается визуализировать проходящие тромбы. Основным источником тромбоэмболий в ЛА являются тромбы из глубоких вен нижних конечностей. У этих больных при наличии открытого овального окна в МПП создаются гемодинамические предпосылки для попадания тромбов из правого в левое предсердие и развития эпизодов пародоксальной системной эмболии. Незаращение овального окна в МПП может быть обнаружено с помощью цветного допплеровского и контрастного ЭхоКГ-исследований сердца.
При трансторакальном ЭхоКГ-исследовании ствол ЛА можно видеть из парастернального доступа по короткой оси сердца. При хорошем ультразвуковом окне ЛА удается визуализировать из этого доступа вплоть до ее бифуркации. Тромбы в просвете легочной артерии видны в продольном и поперечном сечении сосуда (рис. 3). Чувствительность метода ЧПЭхоКГ в диагностике тромбоэмболии ЛА достигает 88%. Специфичность метода ЧПЭхоКГ в диагностике легочной тромбоэмболии составляет 97%. Следует учитывать, что тромбы в стволе и в правой ветви ЛА выявляются на ЭхоКГ технически легче, чем тромбы в левой ее ветви. Проведение ЧПЭхоКГ-исследования показано всем больным, у которых по данным изотопного исследования вентиляции / перфузии (V/Q) имеются вероятность промежуточной тромбоэмболии ЛА и какие-либо признаки тромбоза глубоких вен бедра.
Следует учитывать, что тромбы в стволе и в правой ветви ЛА выявляются на ЭхоКГ технически легче, чем тромбы в левой ее ветви. Проведение ЧПЭхоКГ-исследования показано всем больным, у которых по данным изотопного исследования вентиляции / перфузии (V/Q) имеются вероятность промежуточной тромбоэмболии ЛА и какие-либо признаки тромбоза глубоких вен бедра.
Легочная гипертензия любого происхождения отражается на форме кривой ИВ допплеровского спектра кровотока через легочную артерию. Для регистрации легочного кровотока в ИВ-режиме опрашиваемый объем помещают сразу же над легочным клапаном в стволе ЛА. В норме допплерограмма легочного систолического потока имеет симметричную форму с примерно одинаковым наклоном обоих участков нарастания и замедления скорости. В норме время ускорения потока в ЛА составляет 134 ± 24 мс, а отношение времени ускорения ко времени изгнания крови из правого желудочка равно 0,45 ± 0,05 мс. При повышении давления в ЛА возрастает наклон восходящей части спектральной кривой скорости кровотока.
 Другой признак — сокращение времени ускорения до значений менее или равных 90 мс — имеет 89% чувствительности, уровень положительной предсказательной диагностической ценности при легочной гипертензии составляет 80%.
Другой признак — сокращение времени ускорения до значений менее или равных 90 мс — имеет 89% чувствительности, уровень положительной предсказательной диагностической ценности при легочной гипертензии составляет 80%.
Допплер ЭхоКГ-исследование, проведенное в ИВ допплеровском режиме, позволяет количественно определить уровень систолического давления в ЛА. Для этого измеряют значение максимальной скорости трикуспидального систолического потока регургитации и далее по уравнению Бернулли определяют систолический градиент давления между правым желудочком и правым предсердием (dP = 4V2). К полученным значениям желудочково-предсердного градиента давления нужно затем прибавить давление в правом предсердии (в норме равное 5 мм рт.ст.; но при дилатированной НПВ, которая коллабирует на вдохе менее 50%, оно равно 10 мм рт.ст.). Полученный результат будет отражать систолическое давление в ЛА. С методической точки зрения очень важно регистрировать на кривой непрерывноволнового (НВ) допплеровского потока максимальную скорость трикуспидальной недостаточности.
 ст. Рис. 4 демонстрирует расчет систолического давления в ЛА на допплеровском спектре трикуспидальной регургитации у больного с легочной гипертензией вследствие повторных тромбоэмболий в ЛА.
ст. Рис. 4 демонстрирует расчет систолического давления в ЛА на допплеровском спектре трикуспидальной регургитации у больного с легочной гипертензией вследствие повторных тромбоэмболий в ЛА.
У больных легочной гипертензией часто развивается недостаточность клапанов ЛА. Ее можно зарегистрировать в любом из допплеровских режимов исследования (ИВ, НВ и при цветном допплеровском сканировании). Скорость потока диастолической легочной регургитации зависит от диастолического градиента давления между ЛА и правым желудочком. Исследования показали, что максимальная скорость диастолической легочной регургитации хорошо отражает значения среднего давления в ЛА. Среднее давления в ЛА оценивается по формуле: PAEDP = 4 х PRpeak (V)2, где PAEDP — среднедиастолическое давление в легочной артерии; PRpeakV — максимальная скорость легочной регургитации. Например, если максимальная скорость легочной регургитации равна 2,5 м/с, то среднее давление в ЛА = 4 х 2,5 х 2,5 = 25 мм рт.ст.
Скорость конечно-диастолического потока легочной регургитации отражает конечно-диастолический градиент давления между ЛА и правым желудочком. Поскольку давление в правом желудочке в конце диастолы становится равным давлению в правом предсердии (RAP), то диастолическое давление в ЛА можно определить по формуле: PAEDP = 4 х ED Reg (V)2 + RAP, где PAEDP — конечно-диастолическое давление в легочной артерии; RAP — давление в правом предсердии.
Поскольку давление в правом желудочке в конце диастолы становится равным давлению в правом предсердии (RAP), то диастолическое давление в ЛА можно определить по формуле: PAEDP = 4 х ED Reg (V)2 + RAP, где PAEDP — конечно-диастолическое давление в легочной артерии; RAP — давление в правом предсердии.
Таким образом, ультразвуковое исследование сердца позволяет определить косвенные признаки легочной гипертензии, метод Допплер ЭхоКГ — вычислить значения максимального систолического, среднего и диастолического давления в ЛА.
Легочная гипертензия при саркоидозе органов дыхания
О.П. БАРАНОВА 1, к.м.н., В.Е. ПЕРЛЕЙ 2, д.м.н., профессор, В.П. ЗОЛОТНИЦКАЯ 2, к.м.н., А.А. СПЕРАНСКАЯ 3, М.М. ИЛЬКОВИЧ 1, д.м.н., профессор
1Кафедра пульмонологии ФПО, 2НИИ пульмонологии, 3кафедра рентгенологии и медицинской радиологии. Первый Санкт-Петербургский государственный медицинский университет имени академика И. П. Павлова Минздрава РФ
П. Павлова Минздрава РФ Понятие «легочная гипертензия» включает группу заболеваний, характеризующихся прогрессирующим повышением легочного сосудистого сопротивления, что приводит к развитию правожелудочковой недостаточности с последующим формированием «легочного сердца». Проблема легочной гипертензии (ЛГ) представляет особый интерес в связи с улучшением ее диагностики при различных заболеваниях.
Легочная гипертензия, ассоциированная с саркоидозом (ЛГАС), хорошо известное осложнение саркоидоза, которое обычно возникает при неблагоприятном прогрессирующем течении саркоидоза органов дыхания (СОД) [1-5]. Распространенность ЛГАС среди больных СОД, по мнению ряда исследователей, колеблется от 5 до 74% [15], что можно объяснить отсутствием однородной группы обследуемых и применением различных методов исследования. ЛГАС выявляется у 74% больных СОД, которым необходима трансплантация [5]. Пятилетняя выживаемость пациентов с ЛГАС составляет 59% [6], а смертность в 10 раз выше по сравнению с больными СОД без ЛГ [7]. ЛГ была выявлена у 47% больных СОД с одышкой и нарушениями вентиляционной способности легких [8]. Вместе с тем имеются публикации о выявлении ЛГ у больных СОД при отсутствии фиброза легких [9, 10]. Возможно, это объясняется особенностями патофизиологии ЛГАС. Кроме общих патогенетических механизмов (гипоксия, вазореактивность, ремоделирование сосудистого русла, миокардиальная дисфункция, портопульмональная гипертензия, легочная веноокклюзионная болезнь, сосудистая рестрикция), участвующих в формировании ЛГ при различных заболеваниях легких, выделяют специфические механизмы, которые имеют место только при СОД. К их числу относят внешнюю компрессию легочных сосудов увеличенными лимфатическими узлами средостения или фиброзными изменениями и сосудистую васкулопатию вследствие поражения стенок сосудов саркоидными гранулемами. Саркоидозные гранулемы выявляют в стенках сосудов у 69-100% больных с ЛГАС. В так называемый «васкулит» могут вовлекаться все слои сосудистой стенки, преимущественно поражаются лимфатические сосуды (рис.
ЛГ была выявлена у 47% больных СОД с одышкой и нарушениями вентиляционной способности легких [8]. Вместе с тем имеются публикации о выявлении ЛГ у больных СОД при отсутствии фиброза легких [9, 10]. Возможно, это объясняется особенностями патофизиологии ЛГАС. Кроме общих патогенетических механизмов (гипоксия, вазореактивность, ремоделирование сосудистого русла, миокардиальная дисфункция, портопульмональная гипертензия, легочная веноокклюзионная болезнь, сосудистая рестрикция), участвующих в формировании ЛГ при различных заболеваниях легких, выделяют специфические механизмы, которые имеют место только при СОД. К их числу относят внешнюю компрессию легочных сосудов увеличенными лимфатическими узлами средостения или фиброзными изменениями и сосудистую васкулопатию вследствие поражения стенок сосудов саркоидными гранулемами. Саркоидозные гранулемы выявляют в стенках сосудов у 69-100% больных с ЛГАС. В так называемый «васкулит» могут вовлекаться все слои сосудистой стенки, преимущественно поражаются лимфатические сосуды (рис. 1). Изолированная саркоидная васкулопатия может наблюдаться у пациентов с относительно небольшим вовлечением паренхимы легких. Падение коэффициента диффузии оксида углерода при сохраненных дыхательных объемах может быть первым признаком васкулопатии при прогрессирующей одышке. Поражение саркоидозом сердца или печени может усиливать развитие миокардиальной дисфункции или портопульмональной гипертензии. Возможно, клинические проявления ЛГАС зависят от преобладания того или иного патогенетического механизма. ЛГ в покое диагностируется при среднем давлении в легочной артерии (СрДЛА) свыше 25 мм рт. ст. и свыше 30 мм рт. ст. при физической нагрузке. Клинические проявления ЛГАС неспецифичны (одышка, кашель, снижение толерантности к физической нагрузке) и длительное время могут объясняться наличием саркоидоза. Физикальное обследование выявляет акцент второго тона над легочной артерией. Признаки правожелудочковой недостаточности встречаются у 21% пациентов с ЛГАС и выявляются поздно [11].
1). Изолированная саркоидная васкулопатия может наблюдаться у пациентов с относительно небольшим вовлечением паренхимы легких. Падение коэффициента диффузии оксида углерода при сохраненных дыхательных объемах может быть первым признаком васкулопатии при прогрессирующей одышке. Поражение саркоидозом сердца или печени может усиливать развитие миокардиальной дисфункции или портопульмональной гипертензии. Возможно, клинические проявления ЛГАС зависят от преобладания того или иного патогенетического механизма. ЛГ в покое диагностируется при среднем давлении в легочной артерии (СрДЛА) свыше 25 мм рт. ст. и свыше 30 мм рт. ст. при физической нагрузке. Клинические проявления ЛГАС неспецифичны (одышка, кашель, снижение толерантности к физической нагрузке) и длительное время могут объясняться наличием саркоидоза. Физикальное обследование выявляет акцент второго тона над легочной артерией. Признаки правожелудочковой недостаточности встречаются у 21% пациентов с ЛГАС и выявляются поздно [11].
Из лабораторных методов исследования выделяют определение уровня натрийдиуретического пептида (ВNP), концентрация которого повышается при ЛГ. Повышенный уровень BNP является маркером плохого прогноза [13]. Пациенты с ЛГАС имеют более низкие показатели диффузионной способности легких, а у больных с тяжелой ЛГАС выявляется обратная связь между ЖЕЛ и СрДЛА [14, 15]. Кардиопульмональные тесты и тесты с физической нагрузкой (6MWT, проба Вальсальвы) представляются полезными для выявления ранних нарушений гемодинамики и ЛГ.
Повышенный уровень BNP является маркером плохого прогноза [13]. Пациенты с ЛГАС имеют более низкие показатели диффузионной способности легких, а у больных с тяжелой ЛГАС выявляется обратная связь между ЖЕЛ и СрДЛА [14, 15]. Кардиопульмональные тесты и тесты с физической нагрузкой (6MWT, проба Вальсальвы) представляются полезными для выявления ранних нарушений гемодинамики и ЛГ.
Роль рентгенологических методов исследования в диагностике ЛГАС зачастую недооценивается. На рентгенограммах органов грудной клетки можно увидеть расширение тени легочной артерии и заподозрить ЛГ. Использование компьютерной томографии (КТ) позволяет измерить размер основных и проксимальных легочных артерий, а высокое разрешение (ВР) диагностировать вентиляционно-перфузионные нарушения на фоне хорошо изученной КТ-картины СОД. При тяжелой ЛГ выявляется больший калибр легочной артерии на уровне ее бифуркации по сравнению с восходящей аортой. КТ может дать дополнительную информацию о возможных патогенетических вариантах ЛГАС: наличии обструкции легочных сосудов лимфаденопатией средостения или зонами фиброза, или выявить признаки, указывающие на наличие легочно-окклюзионной болезни. Сдавление просвета легочных артерий у больных СОД наблюдается в 2% случаях [12]. Магнито-резонансная томография обеспечивает наиболее точные измерения правого желудочка и фракции выброса.
Сдавление просвета легочных артерий у больных СОД наблюдается в 2% случаях [12]. Магнито-резонансная томография обеспечивает наиболее точные измерения правого желудочка и фракции выброса.
Эталонным методом исследования легочной гемодинамики является катетеризация правых камер сердца и сосудов легких с прямым определением гемодинамических показателей. Однако этот способ является хирургической манипуляцией с присущими ей техническими трудностями и осложнениями и довольно редко используется в клинической практике, особенно, при обследовании больных терапевтичес¬кого профиля. Гораздо чаще применяются неинвазивные методы – эхокардиография (ЭхоКГ) и допплеркардиография (ДКГ), позволяющие с высокой точностью определить размеры полостей сердца, толщину и сократительную способность миокарда, характеристики внутрисердечного кровотока и своевременно диагностировать ЛГ.
В связи с недостаточно изученными механизмами патогенеза ЛГАС лечение этой группы больных затруднено. Большое внимание отводится лечению сопутствующей патологии (сердечной недостаточности, легочной эмболии, обструктивного апноэ сна) и проведению длительной кислородотерапии с использованием концентратора при наличии гипоксемии. Имеются противоречивые данные о применении кортикостероидов при ЛГАС [1621]. Возможно, оправдано назначение кортикостероидных препаратов у больных с прогрессирующим саркоидозом или в случае уменьшения просвета проксимальных легочных сосудов увеличенными лимфатическими узлами средостения. Некоторые авторы полагают, что при наличии саркоидной васкулопатии можно надеяться на положительный эффект кортикостероидной терапии. Рефрактерность к кортикостероидной терапии может быть обусловлена развитием ЛГ, требующей назначения специфической терапии [16].
Имеются противоречивые данные о применении кортикостероидов при ЛГАС [1621]. Возможно, оправдано назначение кортикостероидных препаратов у больных с прогрессирующим саркоидозом или в случае уменьшения просвета проксимальных легочных сосудов увеличенными лимфатическими узлами средостения. Некоторые авторы полагают, что при наличии саркоидной васкулопатии можно надеяться на положительный эффект кортикостероидной терапии. Рефрактерность к кортикостероидной терапии может быть обусловлена развитием ЛГ, требующей назначения специфической терапии [16].
Специфическая терапия, разработанная для лечения больных с ЛГ, включает простаноиды, антагонисты рецепторов эндотелина-1 (ЭТ-1) и ингибиторы фосфодиэстеразы-5 (ИФДЭ-5). Сегодня в России доступны три препарата для терапии ЛГ, каждый из которых действует на определенный механизм развития ЛГ, – силденафил цитрат, бозентан и иллопрост. О применении специфической терапии при ЛГАС имеются единичные зарубежные публикации. Шесть пациентов с ЛГАС на протяжении 29 мес получали внутривенно эпопростенол и ингаляции оксида азота [22]. У пяти пациентов было отмечено улучшение функционального класса, один пациент умер. В другом исследовании восемь пациентов в течение длительного времени получали ингаляции оксида азота, у пяти из них отмечался положительный нагрузочный тест (6МWT), у троих – улучшение функционального класса [23]. В последние годы появился ряд публикаций о случаях успешного применения антагонистов эндотелиновых рецепторов в лечении ЛГАС [24-26]. Через 4 мес лечения бозентаном у троих из пяти пациентов с исходным СрДЛА 50 мм рт. ст. выявили его снижение (до 35 мм рт. ст.) при повторной катетеризации правых отделов сердца [27].
У пяти пациентов было отмечено улучшение функционального класса, один пациент умер. В другом исследовании восемь пациентов в течение длительного времени получали ингаляции оксида азота, у пяти из них отмечался положительный нагрузочный тест (6МWT), у троих – улучшение функционального класса [23]. В последние годы появился ряд публикаций о случаях успешного применения антагонистов эндотелиновых рецепторов в лечении ЛГАС [24-26]. Через 4 мес лечения бозентаном у троих из пяти пациентов с исходным СрДЛА 50 мм рт. ст. выявили его снижение (до 35 мм рт. ст.) при повторной катетеризации правых отделов сердца [27].
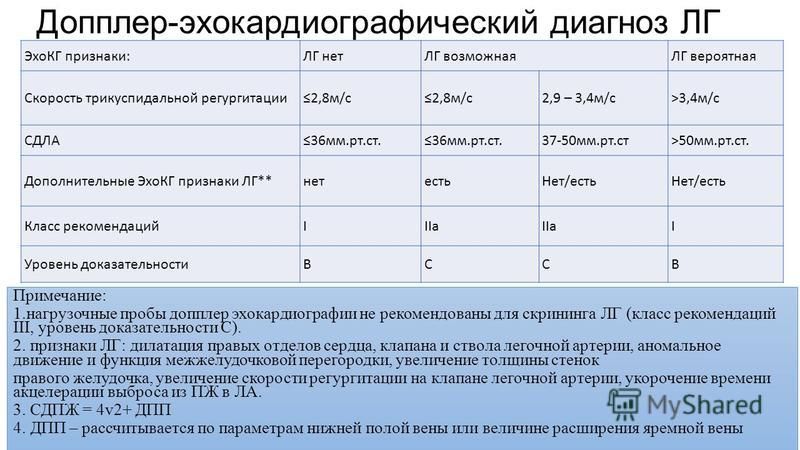
Высокая смертность больных с ЛГАС свидетельствует о необходимости разработки критериев ее ранней диагностики необходимой для своевременной корректировки терапии. В клинике пульмонологии ПСПбГМУ им. И.П. Павлова накоплен опыт по диагностике ЛГАС с помощью ЭхоКГ и ДКГ [28, 29]. Согласно рекомендациям по диагностике и лечению ЛГ ESC/ERS (2009), диагноз ЛГ считается возможным исходя из эхокардиографических данных, если максимальная скорость трикуспидальной регургитации меньше или равняется 2,8 м/с и СДЛА меньше или равняется 36 мм рт. ст. при наличии дополнительных ЭхоКГ признаков ЛГ: дилатация правых отделов и ствола ЛА, гипертрофия ПЖ, нарушение характера движения межжелудочковой перегородки. В том случае, если скорость трикуспидальной регургитации выше 2.9 м/с и систолическое давление в ЛА выше 37 мм рт. ст., диагноз ЛГ считается возможным и без наличия дополнительных ЭхоКГ признаков ЛГ [30].
ст. при наличии дополнительных ЭхоКГ признаков ЛГ: дилатация правых отделов и ствола ЛА, гипертрофия ПЖ, нарушение характера движения межжелудочковой перегородки. В том случае, если скорость трикуспидальной регургитации выше 2.9 м/с и систолическое давление в ЛА выше 37 мм рт. ст., диагноз ЛГ считается возможным и без наличия дополнительных ЭхоКГ признаков ЛГ [30].
Целью настоящей работы было выявить особенности нарушений легочно-сердечной гемодинамики в зависимости от стадии СОД, определить значимость неивазивных методов исследования для ранней диагностики ЛГАС.
Материалы и методы
Основу исследования составили 320 больных СОД, находившихся на обследовании и лечении в клинике пульмонологии ПСПбГМУ им. акад. И. П. Павлова с 2004 по 2013 год. У 229 пациентов (69 %) саркоидоз был подтвержден морфологически. Средний возраст больных составил 38,9 1,9 лет (соотношение женщин и мужчин – 191/129). Острое течение СОД наблюдалось у 48 пациентов (15 %) и хроническое – у 272 (85%). В соответствии с Консенсусом ATS, ERS и WASOG (1999) саркоидоз 1 стадии был диагностирован у 98 больных (30,6 %), 2-й – у 136 (42,5 %), 3-й – у 52 (16,3%) и 4-й стадии – у 34 (10,6%) пациентов. Все больные на момент обследования находились в фазе обострения. В динамике обследовано 32 % пациентов. Контрольную группу составили 37 практически здоровых лиц (средний возраст – 49,3 1,7 лет), которым проводилась эходопплеркардиография.
В соответствии с Консенсусом ATS, ERS и WASOG (1999) саркоидоз 1 стадии был диагностирован у 98 больных (30,6 %), 2-й – у 136 (42,5 %), 3-й – у 52 (16,3%) и 4-й стадии – у 34 (10,6%) пациентов. Все больные на момент обследования находились в фазе обострения. В динамике обследовано 32 % пациентов. Контрольную группу составили 37 практически здоровых лиц (средний возраст – 49,3 1,7 лет), которым проводилась эходопплеркардиография.
Помимо рутинного клинико-рентгенологического исследования, больным выполнялись мультиспиральная КТ (МСКТ) с высоким разрешением (ВР) и при подозрении на тромбоэмболию легочной артерии (ТЭЛА) – КТ-ангиография, перфузионная сцинтиграфии с Тс99m-микросферами (Макротех), КТ-ангиография и однофотонная эмиссионная КТ (ОФЭКТ) с Тс99m-микросферами с последующим совмещением КТ-ОФЭКТ изображения. Исследования проводились на мультиспиральном рентгеновском компьютерном томографе «Asteion» (Toshiba) и мультидетекторных гамма-камерах (Phillips Forte, «Phillips» и Е. саm, «Siemens»). Семи больным была проведена ОФЭКТ миокарда и позитивная томосцинтиграфия грудной клетки с использованием двухдетекторного однофотонного томографа с вариабельным положением детекторов E.cam (ФРГ). Шестнадцати больным была выполнена перфузионная сцинтиграфия миокарда на гамма-камере Sigma 410 S (ФРГ) с использованием Тс99m-технетрила. Радионуклидное исследование легких осуществлялось по специальным методикам, разработанным на кафедре рентгенологии и радиационной медицины ПСПбГМУ им. акад. И. П. Павлова. Всем больным выполнялась допплерэхокардиография (ДопплерЭхоКГ) с использованием эходопплеркардиографа VIVID-7 Dimension (GE, США) [31].
саm, «Siemens»). Семи больным была проведена ОФЭКТ миокарда и позитивная томосцинтиграфия грудной клетки с использованием двухдетекторного однофотонного томографа с вариабельным положением детекторов E.cam (ФРГ). Шестнадцати больным была выполнена перфузионная сцинтиграфия миокарда на гамма-камере Sigma 410 S (ФРГ) с использованием Тс99m-технетрила. Радионуклидное исследование легких осуществлялось по специальным методикам, разработанным на кафедре рентгенологии и радиационной медицины ПСПбГМУ им. акад. И. П. Павлова. Всем больным выполнялась допплерэхокардиография (ДопплерЭхоКГ) с использованием эходопплеркардиографа VIVID-7 Dimension (GE, США) [31].
Результаты и обсуждение
Повышение СДЛА было выявлено у 92 (28,7%) из 320 больных СОД. У больных с развитием ТЭЛА повышение СДЛА отмечалось от пограничных показателей до 75-100 мм рт. ст. Повышение СДЛА (максимально до 50 мм рт. ст.) отмечалось у больных СОД с сопутствующей патологией (пороки сердца – 3, склеродермия – 3, системная красная волчанка – 3, ревматоидный артрит – 2, постлучевой фиброз легких после мастэктомии – 2, токсикомания – 2, ХОБЛ – 2, ожирение – 7), на фоне которой также может возникать ЛГ. Для однородности исследуемой группы из нее были исключены пациенты с ИБС, ГБ, нарушениями липидного спектра, повышенным уровнем холестерина, заболеваниями эндокринной системы, имеющие профессиональную вредность. Это позволило выявить изменения, обусловленные СОД, а не сопутствующей патологией. Основу исследования составили 111 больных СОД. Анализ средних значений основных эхокардиографических параметров свидетельствует о том, что изменения гемодинамики МКК и нарушения функционального состояния миокарда встречались на всех стадиях СОД (табл. 1, 2).
Для однородности исследуемой группы из нее были исключены пациенты с ИБС, ГБ, нарушениями липидного спектра, повышенным уровнем холестерина, заболеваниями эндокринной системы, имеющие профессиональную вредность. Это позволило выявить изменения, обусловленные СОД, а не сопутствующей патологией. Основу исследования составили 111 больных СОД. Анализ средних значений основных эхокардиографических параметров свидетельствует о том, что изменения гемодинамики МКК и нарушения функционального состояния миокарда встречались на всех стадиях СОД (табл. 1, 2).
Корреляционный анализ выявил прямую связь между СДЛА и ТМ ПСПЖ: при 2 стадии r = 0,72 (p < 0,05), при 3-й – r = 0,57 (p<0,05) и 4-й – r=0,75 (p < 0,05). В связи с этим можно предположить, что одним из важных механизмов развития хронического легочного сердца у пациентов СОД является ЛГ. У больных с 4 стадией СОД определялись прямые корреляционные связи между выраженностью изменений в легких и показателями, характеризующими состояние гемодинамики: СДЛА (r = 0,60, p < 0,05), ТМ ПСПЖ (r = 0,98, p < 0,05), КДР ПЖ (r = 0,94, p < 0,05).
При 3 и 4 стадиях была также выявлена взаимосвязь уровня давления в МКК с напряжением О2 и СО2 в артериальной крови. У больных с 3 стадией определялась обратная зависимость между СДЛА и напряжением О2 (r = -0,97 p < 0,05). У больных с 4 стадией, кроме обратной линейной связи между этими показателями, была выявлена прямая линейная связь СДЛА с напряжением СО2 (r = 0,70, p<0,05). В связи с этим можно предположить, что развитию ЛГ у больных с 3 и 4 стадиями СОД способствует гипоксемия, а при 4 стадии и гиперкапния.
Для выявления скрытых нарушений легочно-сердечной гемодинамики у больных с 4 стадией СОД и нормальным СДЛА была выполнена нагрузочная проба Вальсальвы. После проведения пробы у четырех человек отмечалось умеренное, а у троих значительное повышение СДЛА, что позволило диагностировать наличие латентной ЛГ. Достоверное повышение СДЛА было отмечено и в контрольной группе, но оно не превышало нормальных значений (рис. 3). Также было отмечено достоверное снижение ФВ ЛЖ и УО ЛЖ, что свидетельствует о наличии у этих пациентов гипокинетического типа кровоснабжения. При этом среднее значение ФВ ЛЖ было ниже допустимой нормы (рис. 4).
При этом среднее значение ФВ ЛЖ было ниже допустимой нормы (рис. 4).
Поражение сердца саркоидозом было выявлено у 9 из 111 больных СОД, у 12 пациентов диагноз саркоидоза сердца обсуждался как вероятный. Пациенты с саркоидозом сердца были преимущественно молодого возраста с 1 и 2 стадиями, они не предъявляли жалоб со стороны сердечно-сосудистой системы. У всех пациентов, которым был установлен саркоидоз сердца, отмечалось значительное снижение ФВ левого желудочка. У части больных было отмечено нарушение как систолической, так диастолической функции ЛЖ. Диагноз саркоидоз сердца был установлен с учетом показателей эхокардиографии (снижение ФВЛЖ, гипертрофия ЗСЛЖ, сегментарный фиброз ЗСЛЖ, МЖП, папиллярных мышц), сцинтиграфии миокарда (умеренное и выраженное снижение перфузии мокарда, накопление галия в миокарде) и ЭКГ (атриовентрикулярная блокада 1 степени, изменения сегмента ST и зубца Т). Во всех случаях поражения сердца саркоидозом отмечалась ЛГ.
Заключение. Проведенное исследование показало, что генез легочной гипертензии, ассоциированной с саркоидозом, обусловлен многими патогенетическими факторами и не может быть объяснен только прогрессирующим фиброзом легких. Комплекс методов, включающий ЭКГ, ЭхоДКГ и современные лучевые методы исследования, позволяет своевременно выявить ранние признаки развития ЛГ при СОД, а также в случаях поражения саркоидозом сердца и развития ТЭЛА.
Комплекс методов, включающий ЭКГ, ЭхоДКГ и современные лучевые методы исследования, позволяет своевременно выявить ранние признаки развития ЛГ при СОД, а также в случаях поражения саркоидозом сердца и развития ТЭЛА.
Список литературы
1. Shigemitsu H, Nagai S, Sharma OP. Pulmonary hypertension and granulomatous vasculitis in sarcoidosis. Curr. Opin. Pulm. Med. 2007; 13: 434–8.
2. Battesti JP, Georges R, Basset F et al. Chronic cor pulmonale in pulmonary sarcoidosis. Thorax 1978; 33: 76–84.
3. Rizzato G, Pezzano A, Sala G et al. Right heart impairment in sarcoidosis: haemodynamic and echocardiographic study. Eur. J.Respir. Dis. 1983; 64: 121–8.
4. Mayock RL, Bertrand P,Morrison CE et al. Manifestations of sarcoidosis. Analysis of 145 patients with a review of nine seriesselected from the literature. Am. J. Med. 1963; 35: 67–89.
5. Shorr AF, Helman DL, Davies DB et al. Pulmonary hypertension in advanced sarcoidosis: epidemiology and clinical characteristics. Eur. Respir. J. 2005; 25: 783–788.
Eur. Respir. J. 2005; 25: 783–788.
6. Orens JB, Estenne M, Arcasoy S et al. International guidelines for the selection of lung transplant candidates: 2006 update a consensus report from the Pulmonary Scientific Council of the International Society for Heart and Lung Transplantation. J. Heart Lung Transplant. 2006; 25: 745–755.
7. Baughman RP, Engel PJ, Taylor L et al. Survival in sarcoidosis associated pulmonary hypertension: the importance of hemodynamic evaluation. Chest 2010. DOI: 10.1378/09-2002.
8. Baughman RP, Engel PJ, Meyer CA et al. Pulmonary hypertension in sarcoidosis. Sarcoidosis Vasc. Diffuse Lung Dis. 2006; 23:108–116.
9. Rosen Y, Moon S, Huang CT et al. Granulomatous pulmonary angiitis in sarcoidosis. Arch. Pathol. Lab. Med. 1977; 101: 170–174.
10. Takemura T, Matsui Y, Saiki S et al. Pulmonary vascular involvement in sarcoidosis: a report of 40 autopsy cases. Hum. Pathol.1992; 23: 1216–1223.
11. Sulica R, Teirstein AS, Kakarla S et al. Distinctive clinical, radiographic, and functional characteristics of patients with sarcoidosis-related pulmonary hypertension. Chest 2005; 128:1483–1489.
Sulica R, Teirstein AS, Kakarla S et al. Distinctive clinical, radiographic, and functional characteristics of patients with sarcoidosis-related pulmonary hypertension. Chest 2005; 128:1483–1489.
12. Сперанская А.А. Комплексное компьютерно-томографическое и радионуклидное исследование в дифференциальной диагностике интерстициальных заболеваний легких. Дисс. канд. наук, СПб., 2013.
13. Leuchte HH, Baumgartner RA, Nounou ME et al. Brain natriuretic peptide is a prognostic parameter in chronic lung disease. Am. J. Respir. Crit. Care Med. 2006; 173: 744–750.
14. Corte TJ, Wort SJ, Gatzoulis MA et al. Elevated Brain natriuretic peptide predicts mortality in interstitial lung disease. Eur. Respir.J. 2010; 36: 819–25. DOI: 10.1183/09031936.00173509.
15. Handa T, Nagai S, Shigematsu M et al. Patient characteristics and clinical features of Japanese sarcoidosis patients with low bronchoalveolar lavage CD4/CD8 ratios. Sarcoidosis Vasc. Diffuse Lung Dis.2008/71/2.jpg) 2005; 22: 154–160.
2005; 22: 154–160.
16. Baughman RP. Pulmonary hypertension associated with sarcoidosis. Arthritis Res. Ther. 2007; 9 (Suppl. 2): S8.
17. Rodman DM, Lindenfeld J. Successful treatment of sarcoidosis associated pulmonary hypertension with corticosteroids. Chest 1990; 97: 500–502.
18. Mangla A, Fisher J, Libby DM et al. Sarcoidosis, pulmonary hypertension, and acquired peripheral pulmonary artery stenosis. Cathet. Cardiovasc. Diagn. 1985; 11: 69–74.
19. Gluskowski J, Hawrylkiewicz I, Zych D et al. Effects of corticosteroid treatment on pulmonary haemodynamics in patients with sarcoidosis. Eur. Respir. J. 1990; 3: 403–407.
20. Damuth TE, Bower JS, Cho K et al. Major pulmonary artery stenosis causing pulmonary hypertension in sarcoidosis. Chest 1980; 78: 888–91.
21. Barst RJ, Ratner SJ. Sarcoidosis and reactive pulmonary hypertension. Arch. Intern. Med. 1985; 145: 2112–2114.
22. Fisher KA, Serlin DM, Wilson KC et al. Sarcoidosis-associated pulmonary hypertension: outcome with long-termepoprostenol treatment. Chest 2006; 130: 1481–1488.
Sarcoidosis-associated pulmonary hypertension: outcome with long-termepoprostenol treatment. Chest 2006; 130: 1481–1488.
23. Preston IR, Klinger JR, LandzbergMJ et al. Vasoresponsiveness of sarcoidosis-associated pulmonary hypertension. Chest 2001; 120: 866–72.
24. Foley RJ, Metersky ML. Successful treatment of sarcoidosis-associated
pulmonary hypertension with bosentan. Respiration 2008; 75: 211–14.
25. Sharma S, Kashour T, Philipp R. Secondary pulmonary arterial hypertension: treated with endothelin receptor blockade. Tex. Heart Inst. J. 2005; 32: 405–10.
26. Pitsiou GG, Spyratos D, Kioumis I et al. Sarcoidosis-associated pulmonary hypertension: a role for endothelin receptor antagonists? Ther. Adv. Respir. Dis. 2009; 3: 99–101.
27. Robert P. Baughman MD, Daniel A. et al. Concise Review of Pulmonary Sarcoidosis. 3AJRCCM Articles in Press. Published on October 29, 2010 as doi:10.1164/rccm.201006-0865CI
28. Лебедева Е.В. Функциональное состояние миокарда и особенности гемодинамики малого круга кровообращения у больных саркоидозом легких по данным ЭХОКГ. Дисс. канд. наук, СПб., 2004.
Лебедева Е.В. Функциональное состояние миокарда и особенности гемодинамики малого круга кровообращения у больных саркоидозом легких по данным ЭХОКГ. Дисс. канд. наук, СПб., 2004.
29. Перлей В.Е. Влияние повышенного внутригрудного давления на гемодинамику малого круга кровообращения. Дисс. канд. наук, Л., 1985.
30. Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur. Heart J. 2009; 30: 2493–2537.
31. Амосов В.И., Сперанская А.А., Лукина О.В., Бобров Е.И. Мультиспиральная компьютерная томография в клиниках медицинского унивеситета. – СПб.: ЭЛБИ-СПб., 2009. 234 c.
ЭхоКГ (эхокардиограмма) — Диагностика — Легочная гипертензия
Эхокардиография (ЭХОКГ) – относится к наиболее информативным методам диагностики легочной гипертензии, а также гипертрофии и дилатации правых отделов сердца, гемодинамических расстройств. Методом ЭхоКГ диагностируются клапанные пороки сердца, болезни миокарда, врожденные пороки, приводящие к развитию легочной гипертензии. По степени трикуспидальной регургитации рассчитывается среднее давление в легочной артерии (модифицированное уравнение Бернулли). Метод неинвазивной оценки давления в легочной артерии коррелирует с величиной давления, измеренной при катетеризации правых отделов сердца и легочной артерии. делают для осмотра сосудов и полостей сердца, определения скорости кровотока в системе легочной артерии. С помощью этого метода диагностики можно исключить поражения митрального, аортального клапанов, болезни миокарда, врожденные пороки с шунтированием крови слева направо, приводящие к развитию ЛГ.
По степени трикуспидальной регургитации рассчитывается среднее давление в легочной артерии (модифицированное уравнение Бернулли). Метод неинвазивной оценки давления в легочной артерии коррелирует с величиной давления, измеренной при катетеризации правых отделов сердца и легочной артерии. делают для осмотра сосудов и полостей сердца, определения скорости кровотока в системе легочной артерии. С помощью этого метода диагностики можно исключить поражения митрального, аортального клапанов, болезни миокарда, врожденные пороки с шунтированием крови слева направо, приводящие к развитию ЛГ.
Трикуспидальная регургитация определяется у большинства больных с ЛГ (74%) В исследованиях установлена корреляционная связь (0,57-0,93) между давлением, измеренным при ЭХОКГ и во время катетеризации правых отделов сердца и легочной артерии.
Систолическое давление в правом желудочке у здоровых людей в возрасте 1-89 лет составляет 28±5 мм.рт.ст. (15—57 мм.рт.ст.) и увеличивается с возрастом и увеличением индекса массы тела. Мягкая ЛГ может быть установлена при 36-50 мм.рт.ст. или скорости трикуспидальной регургитации 2,8-3,4 м/сек.
Мягкая ЛГ может быть установлена при 36-50 мм.рт.ст. или скорости трикуспидальной регургитации 2,8-3,4 м/сек.
У пациентов с ЛГ выявляется расширение полостей правого предсердия и правого желудочка (ПЖ), утолщение передней стенки ПЖ, изменяется характер движения межжелудочковой перегородки: в систолу она смещается “парадоксально” в сторону правого желудочка. Внутривенное введение физиологического раствора позволяет определить открытое овальное окно, ДМПП типа венозного синуса. Для подтверждения наличия открытого овального окна или небольшого ДМПП, оценки его точного размера требуется проведение чреспищеводной ЭХОКГ.
Легочная гипертензия | Руководство по кардиологии
(Ю.Н. Сиренко)
ОПРЕДЕЛЕНИЕ
Легочная (артериальная) гипертензия (ЛГ) — синдром, связанный с группой разных по своей природе заболеваний, при котором отмечают сложные нарушения функции эндотелия легочных сосудов, его пролиферацию и ремоделирование легочных сосудов. Течение заболевания характеризуется прогрессивным повышением легочного сосудистого сопротивления (ЛСС), приводящего к нарушению функции ПЖ, СН и преждевременной смерти.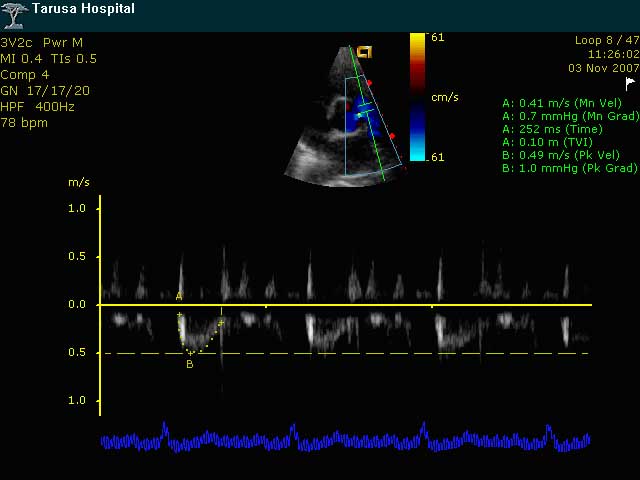 Основным клиническим признаком ЛГ является уровень среднего АД в ЛА выше 25 мм рт. ст. в покое и 30 во время нагрузки. ПЖ — насос системы низкого давления, который хорошо адаптируется к нагрузке объемом, но очень плохо — к нагрузке давлением, что приводит к его гипертрофии и дисфункции. Легочное сердце (cor pulmonale) определяют при развитии дисфункции ПЖ вследствие ЛГ, ассоциированной с хроническими заболеваниями паренхимы легких.
Основным клиническим признаком ЛГ является уровень среднего АД в ЛА выше 25 мм рт. ст. в покое и 30 во время нагрузки. ПЖ — насос системы низкого давления, который хорошо адаптируется к нагрузке объемом, но очень плохо — к нагрузке давлением, что приводит к его гипертрофии и дисфункции. Легочное сердце (cor pulmonale) определяют при развитии дисфункции ПЖ вследствие ЛГ, ассоциированной с хроническими заболеваниями паренхимы легких.
КЛАССИФИКАЦИЯ
ЛГ включает идиопатическую или первичную форму ЛГ, в том числе так называемую семейную форму, ЛГ при поражении сосудов при системных заболеваниях соединительной ткани, при врожденных пороках сердца вследствие шунтирования крови из большого круга кровообращения в малый, портальной гипертензии, ВИЧ-инфекции, хронической рецидивующей ТЭЛА, поражения левой половины сердца и заболеваний легких. Все эти болезни имеют общие патофизиологические механизмы, включающие прогрессивные изменения легочной микроциркуляции.
Современная клиническая классификация ЛГ (Venice expert meeting, 2003) представлена в табл. 1.1.
1.1.
Согласно МКБ-10 первичная ЛГ кодируется I27.0, другие уточненные формы ЛГ — I27.8, другие формы ЛГ неуточненные — I27.9, а ЛГ после ТЭЛА — I26.
Таблица 1.1
Клиническая классификация ЛГ
| 1. ЛГ
1.1. Идиопатическая ЛГ 1.2. Семейная ЛГ 1.3. ЛГ, ассоциированная с: — заболеваниями соединительной ткани; — врожденными пороками сердца с шунтированием крови слева направо; — портальной гипертензией; — ВИЧ-инфекцией; — лекарственными средствами или токсинами; — другими заболеваниями (болезни щитовидной железы, гликогенопатии, болезнь Гоше, врожденная геморрагическая телеангиэктазия, гемоглобинопатии, миелопролиферативные заболевания, спленэктомия) 1.4. ЛГ, ассоциированная с болезнями вен или капилляров: — легочная веноокклюзивная болезнь; — гемоангиоматоз легочных капилляров 1.5. Персистентная ЛГ новорожденных |
| 2. ЛГ при заболеваниях левой половины сердца
2. 2.2. ЛГ при клапанных пороках левой половины сердца |
| 3. ЛГ при заболеваниях легких и/или гипоксии
3.1. ЛГ при ХОБЛ 3.2. ЛГ при интерстициальных заболеваниях легких 3.3. ЛГ при нарушениях сна 3.4. ЛГ при гиповентиляционной патологии альвеол 3.5. ЛГ при хроническом пребывании на высокогорье 3.6. ЛГ при пороках развития легких |
| 4. ЛГ вследствие хронического тромбоза или эмболии
4.1. ЛГ вследствие тромбоэмболической обструкции проксимальных ветвей ЛА 4.2. ЛГ вследствие тромбоэмболической обструкции дистальных ветвей ЛА 4.3. ЛГ вследствие нетромботической эмболизации ЛА (опухоль, паразиты, инородные материалы) |
| 5. Редкие формы (саркоидоз, гистоцитоз Х, лимфоангиоматоз легочных сосудов, вследствие компрессии ЛА — аденопатия, опухоль, фиброзирующий медиастенит) |
ЭПИДЕМИОЛОГИЯ
Данные относительно распространенности ЛГ имеют разнородный характер из-за практического отсутствия четких регистров и значительного количества нозологических форм, отнесенных к этому синдрому. В Украине официальных статистических данных по распространенности ЛГ нет. По данным американских регистров, идиопатическую ЛГ выявляют в 1–4 случаях на 1 млн населения. В то же время эксперты отмечают, что указанная частота может быть большей при более агрессивном использовании диагностических инструментальных методик. Соотношение мужчины/женщины среди больных с ЛГ составляет 1:2. Средний возраст при установлении диагноза — 36 лет. Средняя продолжительность симптомов заболевания до установления диагноза составляет приблизительно 2 года, выживание в течение 1 года — 68%, на протяжении 3 лет — 48%, 5 лет — 34%. Средняя продолжительность жизни после установления диагноза составляет 2,8 года.
В Украине официальных статистических данных по распространенности ЛГ нет. По данным американских регистров, идиопатическую ЛГ выявляют в 1–4 случаях на 1 млн населения. В то же время эксперты отмечают, что указанная частота может быть большей при более агрессивном использовании диагностических инструментальных методик. Соотношение мужчины/женщины среди больных с ЛГ составляет 1:2. Средний возраст при установлении диагноза — 36 лет. Средняя продолжительность симптомов заболевания до установления диагноза составляет приблизительно 2 года, выживание в течение 1 года — 68%, на протяжении 3 лет — 48%, 5 лет — 34%. Средняя продолжительность жизни после установления диагноза составляет 2,8 года.
ЭТИОЛОГИЯ
Семейная форма ЛГ составляет 6–10% всех случаев этого заболевания. Развитие семейных форм ЛГ связывают с мутациями рецепторов семейства факторов роста TGF-β. Более 50% больных с семейной формой ЛГ и до 20% спорадичных случаев оказываются редкими мутациями рецепторов морфогенетического протеина костного мозга.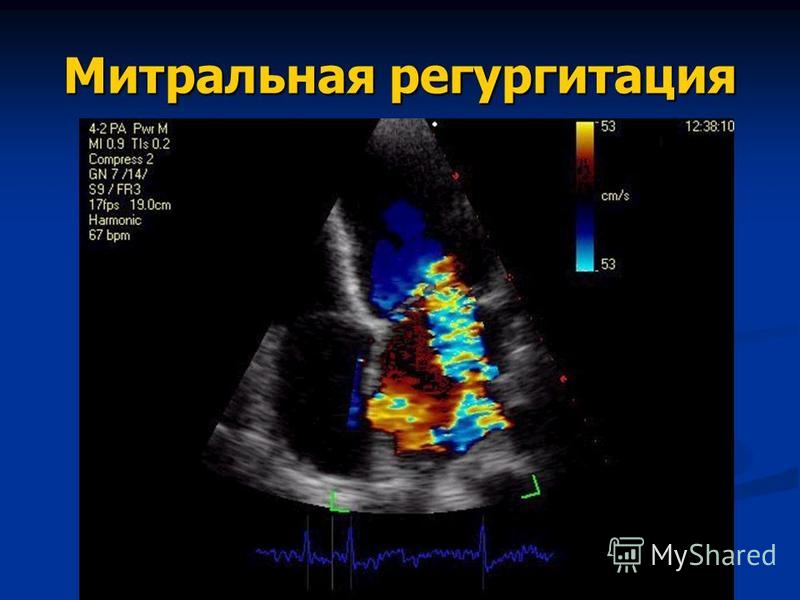 Этот цитокин является мощным регулятором и индуктором роста гладкомышечных клеток сосудистой стенки и апоптоза.
Этот цитокин является мощным регулятором и индуктором роста гладкомышечных клеток сосудистой стенки и апоптоза.
Более редким врожденным вариантом ЛГ является наследственная геморрагическая телеангиэктазия. Это заболевание обусловлено мутацией другого гена — ALK 1. Знания о генетических мутациях, ассоциированных с ЛГ, постоянно расширяются, возможно, будут выявлены и другие гены, играющие роль в развитии этого заболевания.
При системных заболеваниях соединительной ткани могут отмечать ЛГ как с поражением паренхимы легких, так и без него. По данным разных регистров только около 40% больных системными заболеваниями соединительной ткани не имеют поражения паренхимы или сосудов легких. Среди других 60% больных 19% имеют изолированную ЛГ, 22% — поражение паренхимы легких и 19% — сочетанную патологию. ЛГ выявляют у 37% пациентов с системной склеродермией, у 14% — системной красной волчанкой и у 5% — с ревматоидным артритом. По этим данным, еще около 13% пациентов с системными заболеваниями соединительной ткани имеют недиагностированную ЛГ.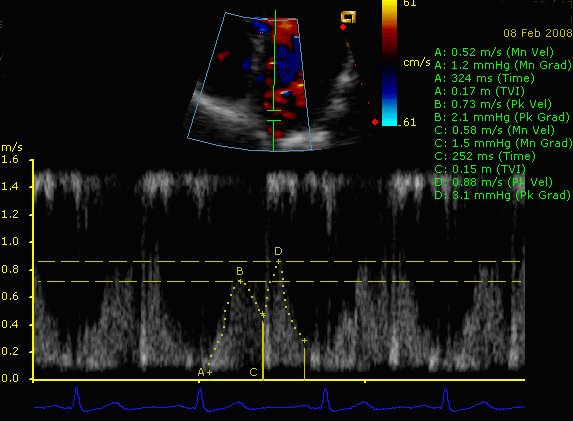
Распространенность ЛГ вследствие врожденных пороков сердца с шунтированием крови слева направо точно не установлена, но учитывая, что частота врожденных пороков сердца составляет около 0,8% всех живорожденных, в Украине это означает появление 5 тыс. случаев врожденных пороков сердца ежегодно. Количество таких больных продолжает увеличиваться, в том числе и вследствие улучшения оказания им помощи, усовершенствования хирургического лечения. Размер и локализация шунта, а также генетические факторы и реакция системы нейроэндокринной регуляции определяют скорость и степень развития ЛГ. По данным американских исследователей, выживание таких больных несколько лучше, чем пациентов с другими типами ЛГ; при условии хирургической коррекции 1-летнее выживание составляет 92%, 2-летнее — 89%, 3-летнее — 77%, и 5-летнее — 77%.
Легочно-печеночные сосудистые нарушения на поздних стадиях поражения печени включают гепатопульмональный синдром и портопульмональную АГ. Гепатопульмональный синдром, который отмечают у 20% пациентов с болезнями печени, характеризуется прогрессивной гипоксемией вследствие вазодилатации внутрилегочных сосудов. Это состояние не вызывает ЛГ и проходит после трансплантации печени. Портопульмональный тип ЛГ характеризуется повышением давления в ЛА без снижения оксигенации крови, его выявляют приблизительно у 20% больных на поздних стадиях поражения печени.
Это состояние не вызывает ЛГ и проходит после трансплантации печени. Портопульмональный тип ЛГ характеризуется повышением давления в ЛА без снижения оксигенации крови, его выявляют приблизительно у 20% больных на поздних стадиях поражения печени.
Выделяют три гемодинамических типа:
(а) гипердинамический тип, при котором отмечают умеренное повышение давления в ЛА (при этом значительно увеличивается сердечный выброс), нормальное легочное капиллярное давление (давление заклинивания) и сниженное ЛСС;
(б) гиперволемический тип, при котором увеличивается ОЦК, умеренно возрастает давление в ЛА, увеличивается сердечный выброс, повышается давление в легочных капиллярах при нормальном ЛСС;
(в) вазопролиферативный тип — наиболее редкий и связанный со значительным повышением давления в ЛА и ЛСС, умеренным снижением легочного капиллярного давления и умеренным увеличением, с дальнейшим уменьшением в динамике, сердечного выброса. Вообще после трансплантации печени ЛГ уменьшается или исчезает, но в ряде случаев проведение операции связано с высоким риском.
ЛГ, ассоциированная с ВИЧ-инфекцией, составляет 0,5% всех случаев. Некоторые эксперты усматривают ассоциацию ЛГ со смешанным инфицированием человека ВИЧ и вирусом герпеса 8-го типа, при котором развивается саркома Капоши. Выживание составляет 58% на 1-м году, 39% — за 2 года и 21% — в течение 3 лет.
Препараты и токсины, связанные с развитием ЛГ, включают анорексигенные препараты — аминорекс, амфетамины и кокаин. Использование этих лекарственных средств на протяжении более чем 3 мес повышает риск развития ЛГ в 30 раз по сравнению со здоровым населением. Считают, что развитие ЛГ может быть опосредовано нарушением функционирования транспортера серотонина, который локализуется в гладких мышцах сосудов легочного бассейна.
Установлено, что 20–40% пациентов с β-таласемией и серповидно-клеточной анемией склонны к развитию ЛГ. Развитие ЛГ ухудшает прогноз заболевания: смертность при серповидно-клеточной анемии с ЛГ значительно выше, чем при серповидно-клеточной анемии без ЛГ.
Развитие ЛГ часто отмечают у пациентов с тяжелыми заболеваниями бронхов и легких. Согласно современным представлениям, ХОБЛ — состояние, которое характеризуется прогрессирующей необратимой обструкцией дыхательных путей с патологическим воспалительным ответом и фиброзом легких вследствие воздействия вредных частичек и газов. Прогрессирование обструкции дыхательных путей наступает вследствие как воспаления бронхиол, так и снижения эластичности паренхимы легких из-за ее воспалительной деструкции, эластолизиса и потери соответствующих альвеол. Морфологически это проявляется хроническим бронхитом, бронхиолитом и эмфиземой. Воспаленные участки легочной и бронхиальной ткани выделяют реактивные продукты перекисного окисления, которые в свою очередь высвобождают провоспалительные цитокины. При ХОБЛ в легочной сосудистой сети также повышена экспрессия эндотелина-1, особенно в период обострения заболевания.
Поражение паренхимы легких может быть следствием системных заболеваний соединительной ткани, которые описаны выше, или вследствие идиопатического легочного фиброза (фиброзирующий альвеолит), и очень редко — саркоидоз легких.
В зависимости от этиологии, распространенность ЛГ при ХОБЛ может варьировать. Так, ЛГ выявляют у 31% больных с идиопатическим легочным фиброзом. Наличие ЛГ приводит к более значительному функциональному ограничению и сопровождается более высокой смертностью. Отмечают линейную обратную корреляцию между давлением в ЛА и клиническим прогнозом. Смертность при наличии симптомов ЛГ в 3 раза выше, чем без ЛГ.
Синдром ночного апноэ — наиболее опасная форма нарушения сна: его выявляют у 5–15% взрослого населения. Следствием синдрома ночного апноэ являются АГ, инсульт, аритмии и блокады сердца, а также ЛГ, особенно у больных с ХОБЛ. Точной патогенетической связи между синдромом ночного апноэ и ЛГ не выявлено. Возможно, что развитию ЛГ способствуют те же факторы, что и в отношении других упомянутых патологических состояний: гипоксемия, нарушение вегетативной регуляции, гиперсимпатикотония, дисфункция эндотелия, гиперагрегация тромбоцитов, активация провоспалительных и протромботических факторов и другие. По мнению большинства авторов, ведущим фактором для формирования ЛГ при синдроме ночного апноэ является нарушение функции эндотелия и гиперсекреция эндотелина-1. Обычно пациенты с синдромом ночного апноэ и ЛГ — это лица старшего возраста, имеющие сниженную функцию легких. При синдроме ночного апноэ ЛГ имеет умеренный характер и, как правило, отмечают положительный ответ на применение специфического лечения синдрома ночного апноэ — использование дыхания с положительным давлением в конце выдоха.
По мнению большинства авторов, ведущим фактором для формирования ЛГ при синдроме ночного апноэ является нарушение функции эндотелия и гиперсекреция эндотелина-1. Обычно пациенты с синдромом ночного апноэ и ЛГ — это лица старшего возраста, имеющие сниженную функцию легких. При синдроме ночного апноэ ЛГ имеет умеренный характер и, как правило, отмечают положительный ответ на применение специфического лечения синдрома ночного апноэ — использование дыхания с положительным давлением в конце выдоха.
ЛГ вследствие хронического тромбоза или эмболии развивается у 0,1–4% больных, перенесших острую легочную эмболию. Тем не менее, по мнению многих авторов, ее распространенность недооценена. Тромбоэмболические события отмечают в анамнезе у 60% больных с ЛГ, а нарушение коагуляции (наиболее часто положительный титр волчаночного антикоагулянта) — у 30% пациентов. Полиморфизм гена транспортера серотонина выявляют у 30% больных с хронической тромбоэмболической ЛГ. Наличие этого генетического полиморфизма, возможно, неблагоприятно модулирует клиническое течение болезни. Правильный диагноз этой формы ЛГ крайне важен, потому что некоторые пациенты могут быть излечены методом хирургической тромбэктомии.
Правильный диагноз этой формы ЛГ крайне важен, потому что некоторые пациенты могут быть излечены методом хирургической тромбэктомии.
Хроническая ЛГ может быть следствием поражения левой половины сердца — СН вследствие приобретенных пороков сердца и/или нарушения его сократительной способности (ИХС, ДКМП и миокардит) или наполнения (АГ, ГКМП и рестриктивная кардиомиопатии). Около 2/3 больных c левосторонней СН имеют нарушение систолической функции ЛЖ и 1/3 — диастолической функции. Хроническую СН с систолической дисфункцией ЛЖ отмечают приблизительно у 1% населения, которое в Украине составляет около 500 тыс. Количество таких больных увеличивается из года в год. Это связано как с естественным процессом старения населения, так и повышением эффективности лечения и выживания больных с хронической СН. Чаще при этих состояниях ЛГ имеет мягкий характер, но приблизительно у 1/3 больных она может быть тяжелой. Прогноз целиком зависит от прогноза основного заболевания. Соответственно следует проводить более тщательное обследование всех больных с хронической СН с целью выявления у них ЛГ.
Соответственно следует проводить более тщательное обследование всех больных с хронической СН с целью выявления у них ЛГ.
ПАТОГЕНЕЗ
Патогенез ЛГ до настоящего времени недостаточно исследован. Участие основных патогенетических механизмов в формировании ЛГ представлено на рис. 1.1. В процесс формирования ЛГ в различной степени на разных стадиях процесса вовлекаются системы регуляции кровообращения, вазоактивные субстанции, факторы роста, медиаторы воспаления, тромбоцитарные факторы, компоненты свертывающей системы крови.
Ключевым моментом патогенеза ЛГ является дисфункция эндотелия легочных сосудов. Она может возникнуть из-за наследственных механизмов и под влиянием факторов внешней среды, изменяющих естественный баланс метаболизма оксида азота, с одной стороны, и эндотелина и тромбоксана — с другой. Это приводит к нарушениям вазореактивности легочных сосудов и их вазоконстрикции. Вследствие такого дисбаланса активируются внутриклеточные механизмы, запускающие гиперплазию и гипертрофию гладкомышечных элементов, апоптоз, пролиферацию фибробластов, воспаление и ангиогенез.
Одним из ключевых моментов патогенеза АГ является активация рецепторов к эндотелину. Эта активация может иметь острые и хронические последствия. К острым относят вазоконстрикцию и воспаление, к хроническим — пролиферацию фибробластов, чрезмерный синтез компонентов экстрацеллюлярного матрикса, ремоделирование легочных сосудов, повышение секреции ренина и альдостерона, образование ангиотензина II, гипертрофию кардиомиоцитов. Причиной роста концентрации эндотелина может быть как увеличение его продукции, так и уменьшение его утилизации в легких. Значительное повышение содержания эндотелина отмечают при идиопатической форме ЛГ, врожденных пороках сердца, заболеваниях соединительной ткани. Эффекты эндо-телина реализуются посредством эндотелиновых рецепторов А- и В-типов. А-тип локализуется на клетках гладких мышц, а В-тип — на клетках эндотелия. Блокада эффектов эндотелина может включать как уменьшение его образования (ингибиция эндотелин-конвертирующего фермента), так и блокаду его рецепторов (селективную или неселективную).
Другим важным механизмом в патогенезе является нарушение синтеза и/или доступности NO. Проявлением нарушения функции эндотелия при ЛГ является снижение синтеза оксида азота. С одной стороны, это следствие снижения активности эндотелиальной NO-синтазы. С другой — отмечают снижение биодоступности оксида азота в связи с гипоксией, оксидантным стрессом и снижением содержания L-аргинина вследствие роста активности аргиназы в клетках эндотелия и эритроцитах. У больных с ЛГ ингаляции NO приводят к снижению давления в ЛА и клиническому улучшению. Вторым клинически значимым механизмом повышения концентрации оксида азота в легочных сосудах является снижение его распада под влиянием ФДЭ, особенно ее изоэнзима-5. В легочном сосудистом бассейне выявляют значительное количество этого типа ФДЭ и соответственно влияние на нее является важным терапевтическим механизмом.
Весомый элемент в патогенезе заболевания — нарушение или снижение нормальной функции вольтажзависимых калиевых каналов гладкомышечных клеток легочных сосудов. В результате таких нарушений дополнительно выводится калий и увеличивается внутриклеточное содержание кальция, что приводит к вазоконстрикции. Активация тромбоцитов сопровождается освобождением целого ряда биологически активных субстанций: тромбоцитарного фактора роста, серотонина, факторов свертываемости крови и проагрегации. Следствием этого является прокоагулянтное состояние в системе ЛА и возникновение тромботических осложнений. Указанные изменения приводят к тому, что дисфункция эндотелия легочных сосудов прогрессирует.
В результате таких нарушений дополнительно выводится калий и увеличивается внутриклеточное содержание кальция, что приводит к вазоконстрикции. Активация тромбоцитов сопровождается освобождением целого ряда биологически активных субстанций: тромбоцитарного фактора роста, серотонина, факторов свертываемости крови и проагрегации. Следствием этого является прокоагулянтное состояние в системе ЛА и возникновение тромботических осложнений. Указанные изменения приводят к тому, что дисфункция эндотелия легочных сосудов прогрессирует.
Еще один важный компонент в патогенезе ЛГ — снижение синтеза простациклина. При ЛГ отмечают снижение экспрессии простациклинсинтетазы в ЛА малого и среднего диаметра. Соответственно повышается концентрация антагониста простациклина — тромбоксана. Описанные нарушения чаще выявляют у больных с идиопатической ЛГ и c ЛГ при заболеваниях соединительной ткани.
Поражение миокарда ЛЖ и его структурно-функциональная перестройка (ремоделирование) являются основными компонентами развития СН.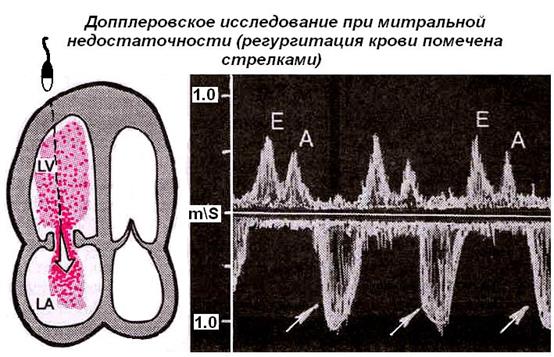 Ведущее участие в формировании СН принимают нейрогуморальные системы регуляции кровообращения: РААС, альдостерон, симпатоадреналовая система, эндотелиновая, кининовая, оксида азота, простагландиновая и прочие. Взаимодействие систем нейрогуморальной регуляции запускает определенные механизмы, которые приводят к дополнительному нарушению регуляции сосудистого тонуса в системе ЛА. Следствием этого каскада реакций является формирование стойкой ЛГ с ремоделированием легочных сосудов, гипертрофией и ремоделированием ПЖ: порочный круг замыкается. При врожденных пороках сердца ремоделирование легочных сосудов является следствием влияния сил стресса растяжения (shear-stress) под действием высокого давления в ЛА. На поздних стадиях процесса, по мере его хронизации, ЛГ идиопатического генеза патофизиологически не будет отличаться от ЛГ вследствие коллагеновых заболеваний, врожденных пороков или левожелудочковой СН.
Ведущее участие в формировании СН принимают нейрогуморальные системы регуляции кровообращения: РААС, альдостерон, симпатоадреналовая система, эндотелиновая, кининовая, оксида азота, простагландиновая и прочие. Взаимодействие систем нейрогуморальной регуляции запускает определенные механизмы, которые приводят к дополнительному нарушению регуляции сосудистого тонуса в системе ЛА. Следствием этого каскада реакций является формирование стойкой ЛГ с ремоделированием легочных сосудов, гипертрофией и ремоделированием ПЖ: порочный круг замыкается. При врожденных пороках сердца ремоделирование легочных сосудов является следствием влияния сил стресса растяжения (shear-stress) под действием высокого давления в ЛА. На поздних стадиях процесса, по мере его хронизации, ЛГ идиопатического генеза патофизиологически не будет отличаться от ЛГ вследствие коллагеновых заболеваний, врожденных пороков или левожелудочковой СН.
КЛИНИКА И ДИАГНОСТИКА
Без надлежащего лечения при ЛГ отмечают быстрое развитие и прогрессирование гипертрофии ПЖ, его дилатации и правожелудочковой СН. Это является основной причиной смерти. При проведении патогенетической терапии скорость прогрессирования заболевания значительно замедляется, развитие правожелудочковой СН замедляется и соответственно снижается смертность.
Это является основной причиной смерти. При проведении патогенетической терапии скорость прогрессирования заболевания значительно замедляется, развитие правожелудочковой СН замедляется и соответственно снижается смертность.
Диагностический подход при ЛГ требует проведения серии исследований с целью подтверждения ЛГ, определения функциональных изменений (клинический класс), выяснения причины возникновения ЛГ и оценки реакции на назначенное лечение. Этот последовательный подход используют, даже если некоторые исследования дают противоречивую информацию.
Для практических целей могут быть рекомендованы следующие 4 этапа установления диагноза ЛГ:
- подозрение на наличие заболевания;
- выявление;
- определение ФК;
- оценка гемодинамических изменений и реакции на назначенное лечение.
1. Подозрение на наличие ЛГ
Специфических симптомов для ЛГ нет. Начальные проявления ЛГ могут быть минимальными, что может привести к запаздыванию диагностики на ранней стадии заболевания. Чаще всего при подозрении на ЛГ используют скрининговый метод. Подозрение на ЛГ должно возникнуть при появлении таких общих симптомов, как одышка, усталость, слабость, боль в груди (по типу стенокардии), сердцебиение, синкопальное состояние, кашель (иногда кровохарканье), тяжесть в правом подреберье и увеличение объема живота. Симптомы в состоянии покоя отмечают, как правило, в острых или запущенных случаях, а также при очень быстром прогрессировании ЛГ. В других случаях симптомы смазаны и неспецифичны и часто приводят к неправильной диагностике других заболеваний сердца и легких.
Чаще всего при подозрении на ЛГ используют скрининговый метод. Подозрение на ЛГ должно возникнуть при появлении таких общих симптомов, как одышка, усталость, слабость, боль в груди (по типу стенокардии), сердцебиение, синкопальное состояние, кашель (иногда кровохарканье), тяжесть в правом подреберье и увеличение объема живота. Симптомы в состоянии покоя отмечают, как правило, в острых или запущенных случаях, а также при очень быстром прогрессировании ЛГ. В других случаях симптомы смазаны и неспецифичны и часто приводят к неправильной диагностике других заболеваний сердца и легких.
ЛГ может быть выявлена у пациентов без каких-либо симптомов при скрининговых исследованиях, особенно среди больных группы риска или с предрасположенностью к развитию ЛГ: системные заболевания соединительной ткани, портальная гипертензия, ВИЧ-инфекция, врожденные пороки сердца, ХОБЛ, левожелудочковая СН.
Иногда подозрение на наличие ЛГ возникает при случайном обследовании: рентгенографии, ЭКГ, эхоКГ.
2. Выявление ЛГ
Диагностика ЛГ требует проведения нескольких рутинных исследований, таких как общее клиническое обследование, ЭКГ, рентгенологическое исследование органов грудной клетки и трансторакальной эхоКГ с допплеровским датчиком.
При общем клиническом обследовании у больных с развитой ЛГ определяют расширение границ сердца вправо, прослушивают акцент II тона на ЛА, пансистолический шум регургитации на трикуспидальном клапане, диастолический шум недостаточности клапана ЛА, а также III тон. Выявляют расширение шейных вен, гепатомегалию, периферические отеки, асцит и похолодение конечностей. Указанные симптомы характерны для больного с уже развитыми симптомами правожелудочковой недостаточности. Часто это сопровождается центральным и периферическим цианозом. При перкуссии и аускультации легких все звуковые феномены обычно нормальные.
ЭКГ. Рутинное ЭКГ-исследование может указать на подозрение или дополнительно подтвердить диагноз ЛГ: виявляют гипертрофию ПЖ, признаки его растяжения или перенагрузки (чаще всего полная блокада правой ножки пучка Гиса). Подобные феномены могут быть выявлены и для правого предсердия. Тем не менее отсутствие изменений на обычной ЭКГ в покое не исключает наличие ЛГ.
Подобные феномены могут быть выявлены и для правого предсердия. Тем не менее отсутствие изменений на обычной ЭКГ в покое не исключает наличие ЛГ.
Рентгенологическое исследование органов грудной клетки позволяет выявить патологические изменения в 90% случаев. Среди наиболее частых симптомов: расширение корня ЛА, которое контрастирует с потерей рисунка периферических кровеносных сосудов в легких. Возможно выявление расширения теней, относящихся к правому предсердию и ПЖ. При рентгенографии четко определяют сопутствующие заболевания легких — ХОБЛ или застойные явления в легочных венах вследствие левожелудочковой недостаточности, соответствующие изменения тени сердца при наличии врожденных пороков и т.д.
Трансторакальная эхоКГ с допплеровским датчиком — наиболее информативное неинвазивное скрининговое исследование больных с подозрением на ЛГ. Метод разрешает исследовать скорость потока регургитации на трикуспидальном клапане и вычислить САД в ЛА и ПЖ. Согласно данным, у здоровых лиц мягкую ЛГ можно определить при САД в ЛА около 36–50 мм рт. ст. или скорости потока регургитации на трикуспидальном клапане 2,8–3,4 м/с (при предположении, что нормальное давление в правом предсердии составляет 5 мм рт. ст.). Несмотря на высокую информативность метода, следует отметить, что существуют категории больных с ложно-положительным диагнозом по данным эхоКГ: лица пожилого и преклонного возраста при наличии симптомной СН высокого ФК. В таких случаях рекомендуют проводить верификацию диагноза методом катетеризации правых отделов сердца и ЛА.
ст. или скорости потока регургитации на трикуспидальном клапане 2,8–3,4 м/с (при предположении, что нормальное давление в правом предсердии составляет 5 мм рт. ст.). Несмотря на высокую информативность метода, следует отметить, что существуют категории больных с ложно-положительным диагнозом по данным эхоКГ: лица пожилого и преклонного возраста при наличии симптомной СН высокого ФК. В таких случаях рекомендуют проводить верификацию диагноза методом катетеризации правых отделов сердца и ЛА.
Метод эхоКГ дает возможность оценить размеры полостей сердца и полой вены, функциональное состояние желудочков, наличие выпота в перикарде, наличие пороков сердца с шунтированием крови, степень дисфункции клапанов сердца. Для ЛГ характерно увеличение полости ПЖ, предсердия и полой вены, снижение функциональной способности ПЖ, уменьшение размера ЛЖ. Исследование может быть дополнено внутривенным введением контрастного для ультразвука вещества с целью лучшего выявления потоков крови при наличии порока сердца.
Обследование больных с подозрением на ЛГ должно включать проведение функциональных исследований легких: исследование функции внешнего дыхания и газового состава крови (в том числе для определения ХОБЛ). У больных с ЛГ обычно выявляют снижение легочной диффузии СО (на 40–80% должного уровня) и умеренное снижение дыхательного объема легких. Парциальное давление кислорода в артериальной крови (PaO2) при дыхании атмосферным воздухом, как правило, нормальное, парциальное давление углекислоты в артериальной крови (PaCO2) — нормальное или несколько снижено вследствие гипервентиляции.
Важным методом обследования для выявления больных с хронической ТЭЛА является вентиляционно-перфузионное сканирование легких. У больных с идиопатической ЛГ показатели вентиляционно-перфузионного сканирования, как правило, в норме. Могут отмечать небольшие периферические дефекты перфузии, которые анатомически не соответствуют легочным сегментам. При хронической ТЭЛА типичным является определение дефектов перфузии, которые соответствуют сегментарным или долевым участкам при нормальных показателях вентиляции. При ХОБЛ, наоборот, — типично выявление дефектов перфузии, сопровождающихся соответствующими дефектами вентиляции.
При ХОБЛ, наоборот, — типично выявление дефектов перфузии, сопровождающихся соответствующими дефектами вентиляции.
КТ легких может более точно выявить заболевание паренхимы легких, наличие утолщений плевры (особенно междолевой), локального выпота и патологии лимфоузлов. Также с помощью этого метода исследования можно лучше диагностировать тип поражения легких при наличии признаков усиления интерстициального рисунка на обычной рентгенограмме легких и отсутствии признаков левожелудочковой СН. Проведение КТ с контрастированием сосудов помогает диагностировать хроническую ТЭЛА. В таких случаях определяют окклюзии и стенозы, признаки реканализации тромба, дефекты перфузии. Окончательное показание для проведения эндартерэктомии определяют при прямой ангиографии ЛА.
Объективная оценка функционального состояния больных невозможна без проведения нагрузочных тестов. Наиболее простым для практического использования является тест с 6-минутной ходьбой. Для проведения теста необходимо провести оценку дистанции, которую больной сможет пройти на протяжении указанного промежутка времени. Более сложным является метод эргоспирометрии, при котором можно оценить не только способность больного к выполнению физической нагрузки, но и показатели газообмена и, главное, — потребление кислорода. Метод намного более сложный и его использование ограничено специализированными стационарами. Данные о соответствии результатов нагрузочных тестов функциональному состоянию приведены в следующем разделе в табл. 1.2.
Более сложным является метод эргоспирометрии, при котором можно оценить не только способность больного к выполнению физической нагрузки, но и показатели газообмена и, главное, — потребление кислорода. Метод намного более сложный и его использование ограничено специализированными стационарами. Данные о соответствии результатов нагрузочных тестов функциональному состоянию приведены в следующем разделе в табл. 1.2.
Таблица 1.2
Объективизация ФК по данным нагрузочных тестов
| ФК | Дистанция ходьбы, которую способен преодолеть больной за 6 мин, м | Максимальное потребление кислорода, мл/м2 за 1 мин |
| I | 426–550 | 18,1–22,0 |
| II | 300–425 | 14,1–18,1 |
| III | 150–300 | 10,1–14,0 |
| IV | <150 | <10 |
Золотым стандартом в установлении диагноза ЛГ является катетеризация правых отделов сердца и ЛА.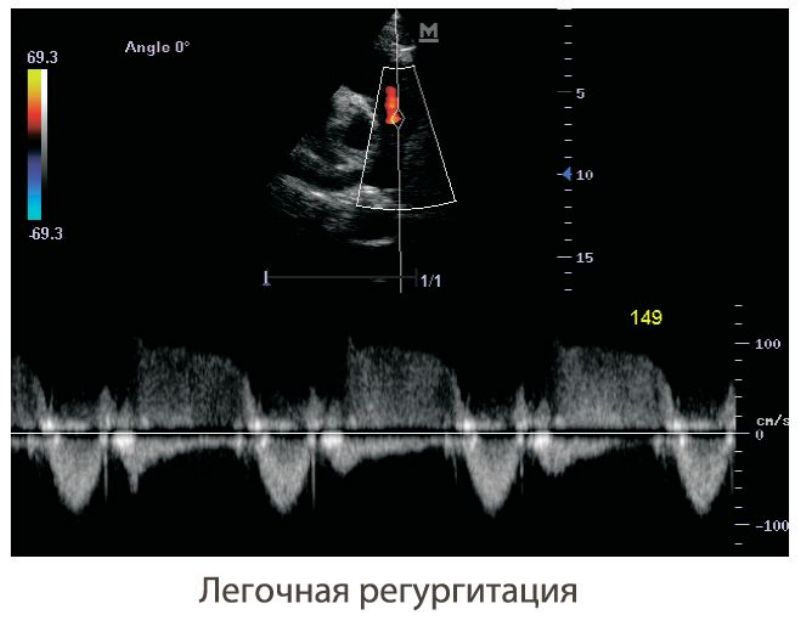 При этом подтверждается диагноз и непосредственно устанавливается степень ЛГ, а также появляется возможность определить вазореактивность легочных сосудов в ответ на применение лекарственных средств. При катетеризации определяют давление в ЛА, сердечный выброс, ЛСС, давление в правом предсердии, давление заклинивания в легочных капиллярах. ЛГ определяют при повышении АД в ЛА >25 мм рт. ст. в состоянии покоя или >30 мм рт. ст. при нагрузке, при уровне давления заклинивания в легочных капиллярах <15 мм рт. ст. и уровне ЛСС >3 мм рт. ст./л/мин. При катетеризации берут кровь из разных полостей сердца и ЛА для определения газового состава и насыщения крови кислородом. Это может помочь в определении локализации шунтов. Кроме того, показатели гемодинамики имеют прогностическое значение: низкая величина сердечного выброса, высокое давление в ЛА и правом предсердии, низкое насыщение центральной венозной крови кислородом ассоциируется с очень плохим прогнозом. В случае необходимости при катетеризации возможно проведение ангиопульмонографии.
При этом подтверждается диагноз и непосредственно устанавливается степень ЛГ, а также появляется возможность определить вазореактивность легочных сосудов в ответ на применение лекарственных средств. При катетеризации определяют давление в ЛА, сердечный выброс, ЛСС, давление в правом предсердии, давление заклинивания в легочных капиллярах. ЛГ определяют при повышении АД в ЛА >25 мм рт. ст. в состоянии покоя или >30 мм рт. ст. при нагрузке, при уровне давления заклинивания в легочных капиллярах <15 мм рт. ст. и уровне ЛСС >3 мм рт. ст./л/мин. При катетеризации берут кровь из разных полостей сердца и ЛА для определения газового состава и насыщения крови кислородом. Это может помочь в определении локализации шунтов. Кроме того, показатели гемодинамики имеют прогностическое значение: низкая величина сердечного выброса, высокое давление в ЛА и правом предсердии, низкое насыщение центральной венозной крови кислородом ассоциируется с очень плохим прогнозом. В случае необходимости при катетеризации возможно проведение ангиопульмонографии.
При катетеризации ЛА возможно проведение тестов с вазодилататорами. К сожалению, такое тестирование можно проводить только с препаратами короткого действия. Для этих целей используют внутривенное введение простациклина или аденозина фосфата и ингаляции оксида азота. Положительным считают ответ, когда отмечают снижение САД в ЛА на 10 мм рт. ст., достижение абсолютного значения давления меньше 40 мм рт. ст. при увеличении или неизменной величине сердечного выброса. Установлено, что у больных с положительным тестом есть стойкий продолжительный ответ при лечении вазодилататорами, в первую очередь — антагонистами кальция. Именно у таких больных продолжительная монотерапия антагонистами кальция сопровождается улучшением ФК и, возможно, повышением выживаемости. Обычно положительный ответ выявляют только у 10–15% больных с идиопатической ЛГ. Эмпирическое назначение антагонистов кальция в высоких дозах без определения вазореактивности часто сопровождается ухудшением состояния или тяжелыми побочными эффектами такой терапии.
В соответствии с рекомендациями Американской коллегии специалистов по торакальной медицине в согласованных Рекомендациях по АГ считается, что этот тест необходимо рутинно использовать у всех больных с ЛГ. В то же время его не следует применять у больных, которым не показана терапия антагонистами кальция, как правило, это больные IV ФК.
Последним шагом при диагностике ЛГ является определение ее типа и ассоциированных заболеваний или состояний. Как уже отмечалось, данные эхоКГ позволяют определить наличие врожденных пороков сердца с шунтированием крови, дисфункции ЛЖ, степень нарушения функции ПЖ. Биохимическое и иммунологическое исследование сыворотки крови позволяет выявить системные заболевания соединительной ткани и СПИД; рентгенологическое исследование (рутинное, а при необходимости — КТ) — подтвердить наличие ХОБЛ. Биохимическое исследование сыворотки крови в соединении с УЗИ органов брюшной полости позволяет выявить больных с поражением печени и портальной гипертензией. КТ с контрастированием, вентиляционно-перфузионное сканирование и ангиопульмонография дают возможность выявить больных с хронической ТЭ ЛА.
КТ с контрастированием, вентиляционно-перфузионное сканирование и ангиопульмонография дают возможность выявить больных с хронической ТЭ ЛА.
3. Определение ФК при ЛГ
По рекомендациям экспертов ВОЗ (1998), для больных с ЛГ была адаптирована функциональная классификация NYHA, которая изначально была предложена для больных с ХСН (табл. 1.3).
Таблица 1.3
Функциональная классификация ЛГ по ВОЗ (1998)
| ФК | Симптоматика |
| I | Больные с ЛГ без ограничения физической активности. Обычные физические нагрузки не приводят к появлению одышки, усталости, боли в груди и синкопальных состояний |
| II | Пациенты с ЛГ и незначительным ограничением в выполнении физической нагрузки. В состоянии покоя симптомы отсутствуют. Обычная физическая нагрузка вызывает одышку, усталость, боль в груди или синкопальные состояния |
| III | Больные с ЛГ и значительным ограничением физической активности. В состоянии покоя они ощущают себя комфортно. Физическая нагрузка меньше, чем обычная, вызывает у них значительную одышку или усталость, боль в груди или синкопальные состояния В состоянии покоя они ощущают себя комфортно. Физическая нагрузка меньше, чем обычная, вызывает у них значительную одышку или усталость, боль в груди или синкопальные состояния |
| IV | Больные с ЛГ, которые не могут выполнять никакую физическую нагрузку без возникновения симптомов. У больных имеются симптомы правосторонней СН. Одышку и слабость отмечают в состоянии покоя. Дискомфорт усиливается при любой физической активности |
Как правило, у больных с IV ФК отмечают симптомы развитой правосторонней СН. Вполне понятно, что прогрессирование ФК от I к IV отражает эволюцию/прогрессирование правожелудочковой СН.
4. Лечение ЛГ
Цель лечения ЛГ — уменьшение выраженности симптомов, замедление прогрессирования заболевания, улучшение качества жизни больных и увеличение ее продолжительности. Лечение необходимо начинать сразу после установления диагноза.
Больные с ЛГ должны избегать чрезмерных физических нагрузок, резких изменений позы тела (риск ортостатических реакций и синкопе), курения, чрезмерного потребления поваренной соли. Не следует использовать противозачаточные средства, содержащие эстрогены, а также необходимо предохраняться от беременности в связи с высоким риском материнской смертности (50%). Рекомендуется избегать приема препаратов (в том числе растительного происхождения), содержащих потенциальные вазоконстрикторные вещества. Желательно предотвращать простудные заболевания, проводить вакцинацию против гриппа. Больным с ЛГ следует исключить подъем в горы (более 1 тыс. м), а при перелетах в самолете быть готовыми к пользованию кислородными масками.
Не следует использовать противозачаточные средства, содержащие эстрогены, а также необходимо предохраняться от беременности в связи с высоким риском материнской смертности (50%). Рекомендуется избегать приема препаратов (в том числе растительного происхождения), содержащих потенциальные вазоконстрикторные вещества. Желательно предотвращать простудные заболевания, проводить вакцинацию против гриппа. Больным с ЛГ следует исключить подъем в горы (более 1 тыс. м), а при перелетах в самолете быть готовыми к пользованию кислородными масками.
При длительном путешествии рекомендуется делать короткие перерывы для непродолжительных прогулок каждые 2 ч. В самолетах рекомендуется вставать из кресла и ходить по салону.
При проведении хирургического лечения следует помнить, что общая анестезия и интубация трахеи связаны с очень высоким риском развития вагусных осложнений.
Основной алгоритм лечения был включен в заключительный документ Всемирного симпозиума по ЛГ (Венеция, 2003). В 2007 г. ведущие эксперты США его несколько дополнили в соответствии с новыми данными доказательной медицины (рис. 1.2).
В 2007 г. ведущие эксперты США его несколько дополнили в соответствии с новыми данными доказательной медицины (рис. 1.2).
Общая терапия больных с ЛГ включает прием антикоагулянтов, диуретиков и дигоксина, а также ингаляции кислорода. Результаты кратковременных исследований свидетельствуют об уменьшении выраженности симптомов и снижении содержания катехоламинов в крови при применении дигоксина в терапии ЛГ. Дигоксин также показан с целью улучшения контроля ЧСС при фибрилляции предсердий.
Диуретики рекомендованы как для лечения, так и профилактики застойных явлений. Ответ на прием диуретиков может значительно изменяться, поэтому дозы препаратов подбирают индивидуально. Следует тщательно мониторировать функцию почек и показатели электролитного обмена для предотвращения развития осложнений хронической диуретической терапии. Антагонисты альдостерона (спиронолактон) можно использовать при развитии хронической СН III–IV ФК.
Применение кислорода способствует улучшению оксигенации крови. Цель лечения — поддержка насыщения гемоглобина кислородом не менее 90%. В некоторых случаях длительное применение кислорода, особенно в высоких дозах, может вызвать легочную вазоконстрикцию и привести к ухудшению состояния больного. Использование кислорода особенно эффективно у больных c ХОБЛ, в то же время при врожденных пороках сердца его применение будет практически неэффективным.
Цель лечения — поддержка насыщения гемоглобина кислородом не менее 90%. В некоторых случаях длительное применение кислорода, особенно в высоких дозах, может вызвать легочную вазоконстрикцию и привести к ухудшению состояния больного. Использование кислорода особенно эффективно у больных c ХОБЛ, в то же время при врожденных пороках сердца его применение будет практически неэффективным.
Использование непрямых антикоагулянтов (варфарина) при ЛГ, по данным ретроспективных анализов, привело к улучшению результатов лечения больных с идиопатической ЛГ. Результатов проспективных исследований эффективности варфарина при этой патологии нет. Также есть определенные доказательства эффективности кумариновых производных у больных с ЛГ вследствие ТЭЛА. Рутинное применение варфарина при ЛГ, связанной с коллагенозами или врожденными пороками сердца, может значительно повышать риск желудочно-кишечных кровотечений и гемоптоза.
Целевым уровнем при назначении кумаринов является уровень МНО 1,5–2,5.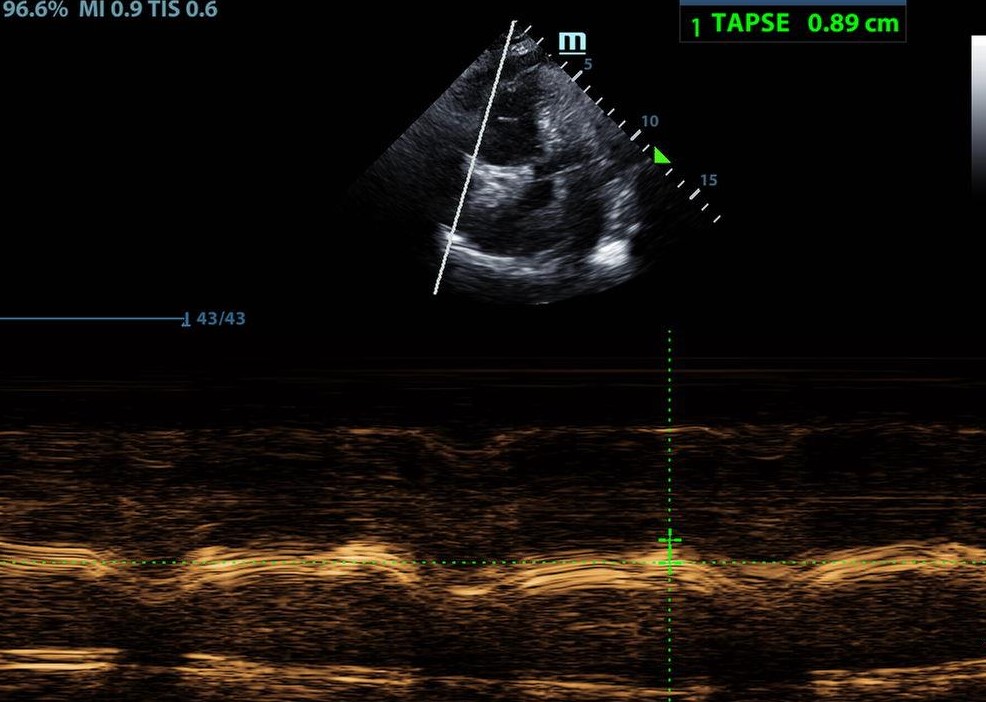
Обзор основных медикаментозных средств для терапии ЛГ и их эффективность по данным доказательной медицины приведены в табл. 1.4.
Таблица 1.4
Современные лекарственные средства для лечения ЛГ
| Средство лечения | Показание | Противопоказание | Комментарий |
| Антикоагулянты: варфарин (класс рекомендаций IIА) | Предупреждение тромбозов ЛА | Ограничение при системных заболеваниях соединительной ткани | Ассоциируется с удлинением жизни у больных с идиопатической и семейной ЛГ. Данных относительно эффективности варфарина при других формах ЛГ практически нет |
| Кислород (класс рекомендаций IIА) | Особенно при ЛГ у больных с ХОБЛ. Рекомендовано применять низкие концентрации О2 (2 л/мин) | Может вызвать вазоконстрикцию. Следует применять осторожно, проводя мониторинг | Является интегрированным компонентом лечения всех форм ЛГ |
| Поддерживаемая симптоматическая терапия: диуретики (класс рекомендаций I), дигоксин (класс рекомендаций IIВ) | Применяют при правожелудочковой СН. Дигоксин улучшает сердечный выброс у больных с сохраняющимися симптомами на фоне стандартного лечения Дигоксин улучшает сердечный выброс у больных с сохраняющимися симптомами на фоне стандартного лечения |
У больных пожилого возраста дигоксин применяют с осторожностью в связи с повышением риска токсичности | Дигоксин остается золотым стандартом лечения правосторонней СН с признаками перенагрузки жидкостью. При других формах СН более эффективны ингибиторы АПФ и блокаторы β-адренорецепторов |
| Антагонисты кальция: дилтиазем, нифедипин, амлодипин (класс рекомендаций I) | Снижают давление в ЛА. Снижают смертность у больных с положительной реакцией на лечение. Терапию следует начинать в стационаре, тщательно титровать дозу под контролем АД, оксигенации крови и толерантности к нагрузкам | Антагонисты кальция не назначают без теста на вазодилатацию. У больных с отрицательным ответом антагонисты кальция не имеют положительных эффектов и часто вызывают побочные. При низком давлении в ЛА (‘<10 мм рт. ст.) и низкой величине сердечного выброса (<2,1 л/мин/м2) антагонисты кальция противопоказаны | Часть больных со стойкой положительной реакцией на лечение антагонистами кальция составляет около 10% |
| Продолжительная терапия простагландинами: эпопростенол (класс рекомендаций I), илопрост (внутривенно или ингаляции) (класс рекомендаций IIА), трепростинил (класс рекомендаций IIА) | Ремоделирование сосудов в системе ЛА, уменьшение поражения клеток и гиперкоагуляции. Показана всем больным с ЛГ, у которых отсутствует ответ на обычное лечение. Терапия перед трансплантацией Показана всем больным с ЛГ, у которых отсутствует ответ на обычное лечение. Терапия перед трансплантацией |
Очень дорогостоящее. Обычное лечение необходимо продолжать. Антагонисты кальция следует отменить. Отмечают эффект рикошета при отмене (резкий рост давления в ЛА). Дозу простагландинов титруют до уменьшения выраженности симптомов | Терапия простагландинами была первым доказанным способом улучшения прогноза у больных с ЛГ. Следует проводить в специальных центрах, где есть опыт ее применения |
| Антагонисты эндотелиновых рецепторов: бозентан (класс рекомендаций I), ситаксентан (класс рекомендаций IIА), амбризентан (класс рекомендаций IIА) | Для лечения идиопатической ЛГ или ЛГ при системных заболеваниях соединительной ткани у больных III или IV ФК | Противопоказано при беременности, умеренной или тяжелой дисфункции печени, во время приема циклоспорина, глибенкламида и гиперчувствительности | Терапия вызвала уменьшение выраженности симптомов, повышение толерантности к нагрузке, улучшение показателей гемодинамики и структурных изменений в легочных сосудах. Отмечено замедление прогрессирования заболевания, повышение качества жизни и увеличение ее продолжительности Отмечено замедление прогрессирования заболевания, повышение качества жизни и увеличение ее продолжительности |
| Ингибиторы фосфодиэстеразы-5: сильденафил (класс рекомендаций I) | Для лечения идиопатической ЛГ у больных II–IV ФК (для других типов ЛГ — класс рекомендаций IIА) | Противопоказан больным, принимающим органические нитраты или донаторы оксида азота. При длительном приеме отмечают нарушение цветовосприятия | Доказаны уменьшение выраженности симптомов, снижение давления в ЛА, повышение толерантности к нагрузке, замедление прогрессирования заболевания |
Антагонисты кальция показали высокую эффективность относительно снижения давления в ЛА, улучшения симптомов и качества жизни, а также удлинения выживания у больных с идиопатической ЛГ. Этот эффект лечения проявляется только у больных с положительным ответом теста на вазодилатацию. Доля таких пациентов составляет около 10% всех больных с идиопатической ЛГ. У больных без положительного ответа при проведении функционального теста назначение антагонистов кальция может вызвать ухудшение, снижение оксигенации крови, тяжелую системную гипотензию. Считают, что достоверный результат теста возможно получить только при инвазивном исследовании, данные УЗИ в этом случае являются неинформативными. Антагонисты кальция нужно использовать в высоких дозах. Считают, что эффективность антагонистов кальция увеличивается при одновременном назначении с варфарином. У больных с СН преимущество следует отдать амлодипину. В то же время считается, что при IV ФК антагонисты кальция не показаны. Терапию нужно начинать в стационаре, тщательно титровать дозу под контролем АД, контролировать показатели оксигенации крови и толерантность к нагрузкам.
Считают, что достоверный результат теста возможно получить только при инвазивном исследовании, данные УЗИ в этом случае являются неинформативными. Антагонисты кальция нужно использовать в высоких дозах. Считают, что эффективность антагонистов кальция увеличивается при одновременном назначении с варфарином. У больных с СН преимущество следует отдать амлодипину. В то же время считается, что при IV ФК антагонисты кальция не показаны. Терапию нужно начинать в стационаре, тщательно титровать дозу под контролем АД, контролировать показатели оксигенации крови и толерантность к нагрузкам.
Антагонисты рецепторов эндотелина-1. Как было указано ранее, эндотелин-1 играет одну из ведущих ролей в формировании и прогрессировании ЛГ при ее идиопатической форме, при заболеваниях соединительной ткани и при врожденных пороках сердца. Это предопределяет важную роль блокаторов рецепторов эндотелина-1 в терапии ЛГ. Бозентан стал первым блокатором рецепторов эндотелина-1 А- и В-типов для перорального приема. В проспективных рандомизованных исследованиях установлена его способность снижать давление в ЛА, ЛСС и улучшать сердечный выброс у больных III–IV ФК. Это сопровождалось значительным улучшением ФК, уменьшением выраженности симптомов и ростом толерантности к нагрузке, повышением качества жизни. Также отмечали замедление прогрессирования заболевания, снижение степени ремоделирования ПЖ. Основным результатом терапии бозентаном стало повышение выживаемости на протяжении года (96%) и 2 лет (89%) по сравнению с контрольной группой (69 и 57% соответственно). Таким образом, бозентан показан для лечения ЛГ идиопатического генеза, при системных заболеваниях соединительной ткани, врожденных пороках сердца, действии токсичных веществ, а также при ВИЧ-инфекции. Доза бозентана в начале лечения составляет 62,5 мг 2 раза в сутки, через 4 нед терапии при хорошей переносимости дозу удваивают. При ухудшении состояния больных бозентан отменяют и назначают альтернативную терапию. Исследование эффективности бозентана при ЛГ II ФК к моменту написания руководства еще не закончено.
В проспективных рандомизованных исследованиях установлена его способность снижать давление в ЛА, ЛСС и улучшать сердечный выброс у больных III–IV ФК. Это сопровождалось значительным улучшением ФК, уменьшением выраженности симптомов и ростом толерантности к нагрузке, повышением качества жизни. Также отмечали замедление прогрессирования заболевания, снижение степени ремоделирования ПЖ. Основным результатом терапии бозентаном стало повышение выживаемости на протяжении года (96%) и 2 лет (89%) по сравнению с контрольной группой (69 и 57% соответственно). Таким образом, бозентан показан для лечения ЛГ идиопатического генеза, при системных заболеваниях соединительной ткани, врожденных пороках сердца, действии токсичных веществ, а также при ВИЧ-инфекции. Доза бозентана в начале лечения составляет 62,5 мг 2 раза в сутки, через 4 нед терапии при хорошей переносимости дозу удваивают. При ухудшении состояния больных бозентан отменяют и назначают альтернативную терапию. Исследование эффективности бозентана при ЛГ II ФК к моменту написания руководства еще не закончено.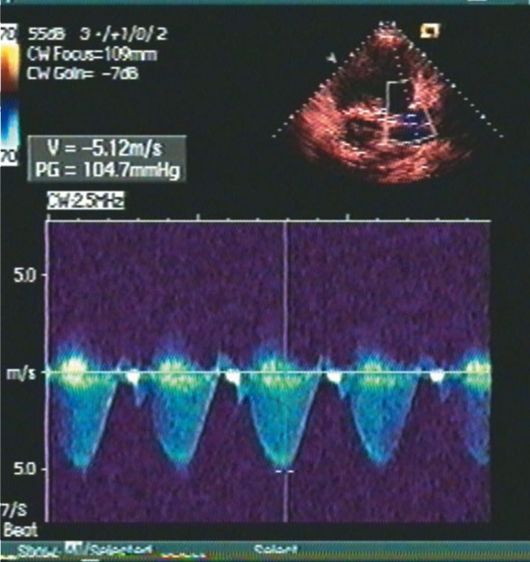 На протяжении последних лет получены положительные результаты клинических исследований относительно других блокаторов рецепторов эндотелина-1 — ситаксентана и амбризентана.
На протяжении последних лет получены положительные результаты клинических исследований относительно других блокаторов рецепторов эндотелина-1 — ситаксентана и амбризентана.
Простагландины (простаноиды). Как было отмечено выше, простаноиды принимают активное участие в регуляции функции эндотелия, адгезии и агрегации, воспалении и пролиферации клеток в легочных сосудах. Соответственно недостаточность простациклина (абсолютная или относительная) может играть значимую роль в патогенезе ЛГ. Следовательно, назначение экзогенного простациклина (парентерально или ингаляционно) при ЛГ является патогенетически обоснованным.
Наиболее исследованный препарат и соответственно имеющий наибольшую доказательную базу среди простаноидов — эпипростенол (синтетический аналог простациклина). Внутривенная терапия эпипростенолом в течение 12 нед улучшала гемодинамику, симптомы заболевания, качество жизни больного и расстояние 6-минутной ходьбы. Прогрессивное ремоделирование ПЖ уменьшалось, и этот положительный результат сохранялся в отдаленный период. В некоторых исследованиях было установлено повышение выживаемости больных, получающих данную терапию, по сравнению со стандартной терапией ЛГ. Внутривенная терапия эпипростенолом эффективна у больных с идиопатической ЛГ, при диффузных заболеваниях соединительной ткани, действии токсинов, врожденных пороках сердца с шунтированием крови справа налево III–IV ФК. Начальная доза составляет 2 нг/кг/мин с дальнейшим ее повышением при хорошей переносимости до 30 нг/кг/мин. Могут использоваться и более высокие дозы, но при этом увеличивается вероятность развития побочных эффектов. Побочные эффекты терапии эпипростенолом включают гиперемию с приливами, тошноту, рвоту, диарею, боль в области челюсти, скелетно-мышечную боль, кожные высыпания эритематозного характера, а также осложнения, связанные с длительным применением центрального катетера. Учитывая сложность проведения, данную терапию необходимо назначать только в центрах, имеющих соответствующий опыт.
В некоторых исследованиях было установлено повышение выживаемости больных, получающих данную терапию, по сравнению со стандартной терапией ЛГ. Внутривенная терапия эпипростенолом эффективна у больных с идиопатической ЛГ, при диффузных заболеваниях соединительной ткани, действии токсинов, врожденных пороках сердца с шунтированием крови справа налево III–IV ФК. Начальная доза составляет 2 нг/кг/мин с дальнейшим ее повышением при хорошей переносимости до 30 нг/кг/мин. Могут использоваться и более высокие дозы, но при этом увеличивается вероятность развития побочных эффектов. Побочные эффекты терапии эпипростенолом включают гиперемию с приливами, тошноту, рвоту, диарею, боль в области челюсти, скелетно-мышечную боль, кожные высыпания эритематозного характера, а также осложнения, связанные с длительным применением центрального катетера. Учитывая сложность проведения, данную терапию необходимо назначать только в центрах, имеющих соответствующий опыт.
Другой препарат простаноидов с доказанной эффективностью — илопрост, который можно использовать в ингаляционной форме.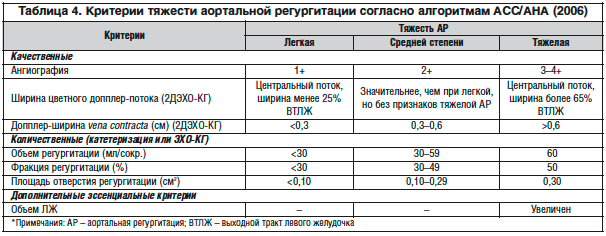 Ингаляционная терапия илопростом также улучшает гемодинамику, увеличивает дистанцию ходьбы в минутах, снижает ФК заболевания, симптомы и качество жизни после 12 нед ее применения. Побочные эффекты включают кашель, приливы с покраснением, головную боль, боль в челюсти, тошноту и гипотензию. Эта терапия эффективна у больных с идиопатической ЛГ, при диффузных заболеваниях соединительной ткани, действии токсинов, врожденных пороках сердца с шунтированием крови справа налево, тромбоэмболической болезни и III–IV ФК ЛГ. Рекомендованная доза — 6–9 ингаляций 2,5 мкг илопроста ежедневно с использованием портативного распылителя. Дозу можно повышать до 5 мкг при хорошей переносимости. Такой способ терапии простагландинами имеет определенные преимущества, но отдаленная эффективность (влияние на смертность) ее не доказана. Внутривенная терапия илопростом мало отличается от применения эпипротенола.
Ингаляционная терапия илопростом также улучшает гемодинамику, увеличивает дистанцию ходьбы в минутах, снижает ФК заболевания, симптомы и качество жизни после 12 нед ее применения. Побочные эффекты включают кашель, приливы с покраснением, головную боль, боль в челюсти, тошноту и гипотензию. Эта терапия эффективна у больных с идиопатической ЛГ, при диффузных заболеваниях соединительной ткани, действии токсинов, врожденных пороках сердца с шунтированием крови справа налево, тромбоэмболической болезни и III–IV ФК ЛГ. Рекомендованная доза — 6–9 ингаляций 2,5 мкг илопроста ежедневно с использованием портативного распылителя. Дозу можно повышать до 5 мкг при хорошей переносимости. Такой способ терапии простагландинами имеет определенные преимущества, но отдаленная эффективность (влияние на смертность) ее не доказана. Внутривенная терапия илопростом мало отличается от применения эпипротенола.
Еще один препарат простаноидов — трепростинил — бензидиновый аналог простациклина, который можно вводить внутривенно или подкожно. Неблагоприятный профиль эффектов внутривенной терапии трепростинилом подобен таковому эпипростенолу. Начальная доза составляет 5 нг/кг/мин с постепенным повышением до 60 нг/кг/мин. Непрерывное подкожное введение трепростинила на протяжении 12 нед вызывало клиническое улучшение с увеличением дистанции 6-минутной ходьбы. Это сопровождалось положительной динамикой симптомов, показателей гемодинамики и качества жизни. Подкожное введение трепростинила показано больным с идиопатической ЛГ, при заболеваниях соединительной ткани, врожденных пороках сердца при II–IV ФК. Побочные эффекты этой терапии включают боль в месте инъекции, диарею, боль в челюсти и отеки. Начальная доза составляет 1,25 нг/кг/мин с постепенным повышением до 22,5 нг/кг/мин. Технология введения включает использование специального инфузионного микронасоса, который создает дополнительное давление для постоянного введения. Это лекарственное средство нужно также применять только в центрах с достаточным опытом применения данной терапии.
Неблагоприятный профиль эффектов внутривенной терапии трепростинилом подобен таковому эпипростенолу. Начальная доза составляет 5 нг/кг/мин с постепенным повышением до 60 нг/кг/мин. Непрерывное подкожное введение трепростинила на протяжении 12 нед вызывало клиническое улучшение с увеличением дистанции 6-минутной ходьбы. Это сопровождалось положительной динамикой симптомов, показателей гемодинамики и качества жизни. Подкожное введение трепростинила показано больным с идиопатической ЛГ, при заболеваниях соединительной ткани, врожденных пороках сердца при II–IV ФК. Побочные эффекты этой терапии включают боль в месте инъекции, диарею, боль в челюсти и отеки. Начальная доза составляет 1,25 нг/кг/мин с постепенным повышением до 22,5 нг/кг/мин. Технология введения включает использование специального инфузионного микронасоса, который создает дополнительное давление для постоянного введения. Это лекарственное средство нужно также применять только в центрах с достаточным опытом применения данной терапии.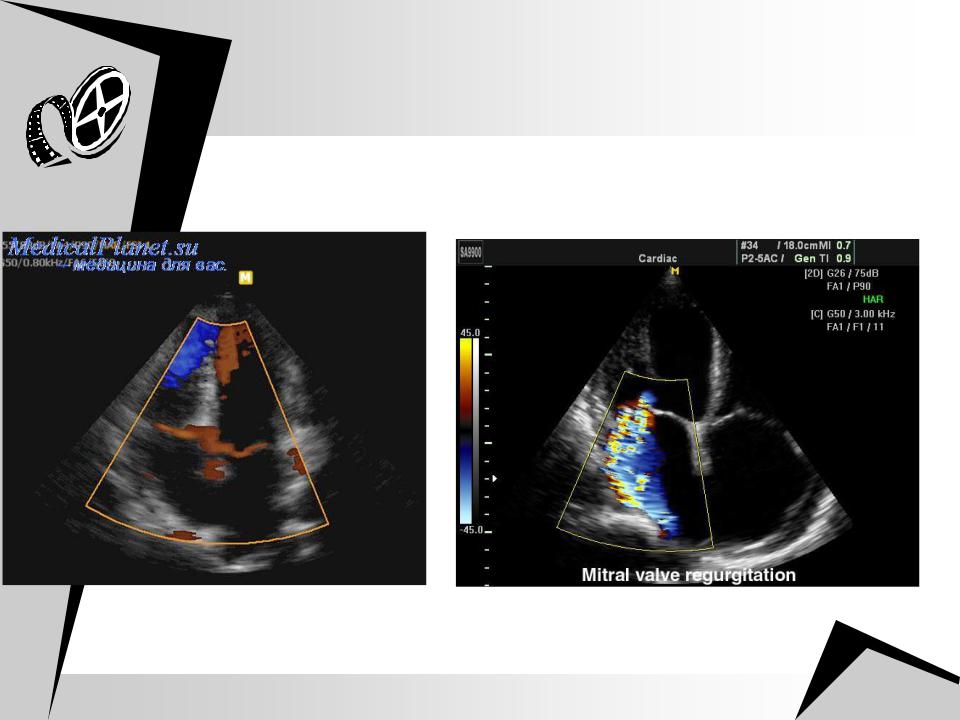
Ингибиторы фосфодиэстеразы-5 (ФДЭ-5). Учитывая важную роль дисфункции эндотелия в патогенезе ЛГ, применение препаратов, оказывающих непосредственное влияние на продукцию оксида азота, стало еще одним перспективным направлением в лечении этого заболевания. Первый из них — сильденафил — специфический ингибитор ФДЭ-5. Этот фермент отвечает за распад цГМФ, посредством которого реализуются эффекты оксида азота. Он широко представлен в легочном сосудистом русле. Основным показанием для назначения сильденафила до последнего времени была эректильная дисфункция. В то же время было установлено, что этот препарат после 12 нед приема способен снижать давление и сосудистое сопротивление в ЛА, увеличивать сердечный выброс у пациентов с ЛГ. В этот период отмечали уменьшение выраженности симптомов, увеличение дистанции 6-минутной ходьбы и снижение ФК, кроме этого отмечено увеличение периода клинического улучшения состояния больных. Эффект препарата не зависит от дозы. Он хорошо переносится, наиболее частые побочные явления — носовое кровотечение, головная боль и заложенность носа.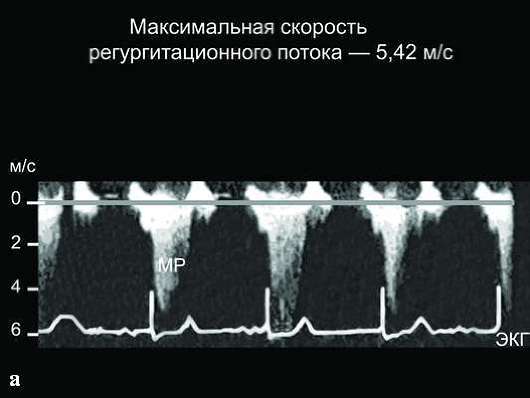 Эффективность сильденафила была доказана у пациентов II–IV ФК с идиопатической ЛГ, при диффузных заболеваниях соединительной ткани, врожденных пороках сердца с шунтированием крови справа налево. Предполагают, что препарат может быть эффективным у больных с ЛГ тромбоэмболического происхождения. Рекомендованная доза составляет 20 мг 3 раза в сутки. Препарат противопоказан больным, принимающим органические нитраты или донаторы оксида азота.
Эффективность сильденафила была доказана у пациентов II–IV ФК с идиопатической ЛГ, при диффузных заболеваниях соединительной ткани, врожденных пороках сердца с шунтированием крови справа налево. Предполагают, что препарат может быть эффективным у больных с ЛГ тромбоэмболического происхождения. Рекомендованная доза составляет 20 мг 3 раза в сутки. Препарат противопоказан больным, принимающим органические нитраты или донаторы оксида азота.
В прямых сравнительных исследованиях эффективности по суррогатным точкам с бозентаном (дистанция 6-минутной ходьбы, масса миокарда ПЖ) установлена практически одинаковая эффективность на протяжении 12-недельного курса лечения. Эффективность других блокаторов ФДЭ-5 (в том числе тадалафила) при ЛГ к моменту написания руководства находится на этапе исследования.
Комбинированная медикаментозная терапия. В клинической практике для достижения большего эффекта рационально использовать лекарственные средства с различными механизмами действия, которые могут влиять на разные звенья патогенеза и, таким образом, потенцировать эффекты друг друга. Однако в терапии ЛГ комбинация разных классов препаратов имеет более интуитивный характер, чем базируется на данных доказательной медицины.
Однако в терапии ЛГ комбинация разных классов препаратов имеет более интуитивный характер, чем базируется на данных доказательной медицины.
Существуют единичные пилотные исследования, в которых изучали эффективность и безопасность различных комбинаций: эпопростенола и бозентана, илопроста и бозентана. Несколько небольших исследований проведено для оценки эффективности и безопасности комбинированной терапии простаноидами и ингибиторами ФДЭ-5. Установлен более значительный гемодинамический эффект комбинации по сравнению с монотерапией. Но до настоящего времени отдаленные результаты такой терапии остаются неопределенными: есть сведения как о положительных, так и отрицательных последствиях. Не выявлено клинически значимых взаимодействий между перечисленными лекарственными средствами при их одновременном назначении.
Комбинированная терапия бозентаном и сильденафилом приводит к более значительному, чем монотерапия, увеличению дистанции 6-минутной ходьбы, этот эффект сохраняется на протяжении 6–12 мес. Это сопровождалось также положительной динамикой показателя максимального потребления кислорода. Проспективных исследований эффективности такой терапии к моменту написания руководства нет. В то же время известно, что бозентан значительно снижает концентрацию сильденафила в плазме крови, но клинические последствия такого взаимодействия остаются неизученными.
Это сопровождалось также положительной динамикой показателя максимального потребления кислорода. Проспективных исследований эффективности такой терапии к моменту написания руководства нет. В то же время известно, что бозентан значительно снижает концентрацию сильденафила в плазме крови, но клинические последствия такого взаимодействия остаются неизученными.
Возможно, в ближайшем будущем комбинированное лечение пероральными и ингаляционными препаратами сможет вытеснить необходимость применения продолжительной парентеральной терапии у больных с ЛГ. Для этого необходимо провести тщательно спланированные клинические испытания. Однако следует учитывать фармакоэкономические факторы. Все современные препараты для лечения ЛГ — дорогостоящие, и необходимо определить не просто эффективность, а реальное соотношение стоимость/эффективность с целью определения перспективных стратегий комбинированной терапии ЛГ.
Интервенционное и хирургическое лечение ЛГ. Существует несколько типов интервенционного и хирургического лечения ЛГ./58/58.jpg) Обзор основных типов вмешательств и их эффективность, по данным доказательной медицины, приведены в табл. 1.5.
Обзор основных типов вмешательств и их эффективность, по данным доказательной медицины, приведены в табл. 1.5.
Таблица 1.5
Хирургическое лечение ЛГ
| Способ лечения | Показание | Противопоказание | Комментарий |
| Предсердная септостомия: паллиативная процедура, создающая отверстие для сбрасывания крови, что приводит к снижению давления в правых отделах сердца, особенно у больных с тяжелыми формами ЛГ (класс рекомендаций IIА) | Тяжелая форма ЛГ, рефрактерная к терапии простагландинами, сопровождающаяся повторными синкопальными состояниями | Не показана больным в терминальной стадии правожелудочковой СН или у больных со значительной левожелудочковой СН | Вмешательство следует проводить в специализированных центрах и соответственно подготовленными специалистами |
| Тромбоэндартериэктомия: хирургическое удаление организованных тромботических материалов и внутренней оболочки артерии начиная со ствола к сегментарным ветвям ЛА (класс рекомендаций IIА) | Для больных с посттромбоэмболической формой ЛГ.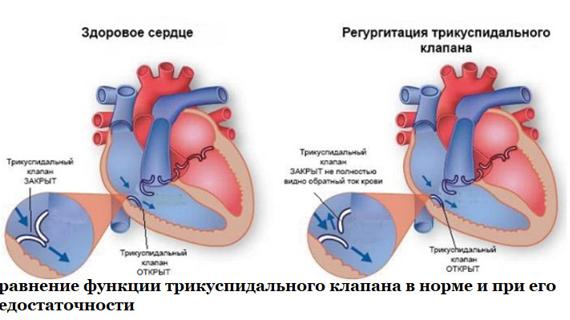 Рекомендована больным всех возрастных категорий Рекомендована больным всех возрастных категорий |
Противопоказана при тяжелых заболеваниях легких | Прогноз у больных с ЛГ вследствие хронической тромбоэмболии неблагоприятный: 5-летняя выживаемость составляет 10% |
| Трансплантация сердца и легких (класс рекомендаций I) | При прогрессирующей ЛГ, когда несмотря на адекватное медикаментозное лечение состояние пациента соответствует III–IV ФК | Кандидаты должны отвечать международным стандартам трансплантации сердца и легких | Трансплантация органов является лимитированной операцией и ее проведение возможно только в соответствующих центрах |
Предсердная септостомия (паллиативная процедура) — создание отверстия в межпредсердной перегородке для сброса крови, что приводит к снижению давления в правых отделах сердца, особенно у больных с тяжелыми формами ЛГ (IV ФК). У ряда пациентов наблюдается спонтанное открытие овального отверстия с соответствующим клиническим эффектом. Процедуру проводят с помощью специального баллонного катетера. Показана больным с рефрактерными формами ЛГ, когда продолжительная патогенетическая терапия (бозентан или простагландины) не приводит к улучшению их клинического состояния. Не показана больным с терминальными стадиями правожелудочковой СН или со значительной левожелудочковой СН. Риск смертности при проведении данной процедуры — 5–6%, выполнять ее следует только в соответствующих центрах. Отдаленные результаты баллонной предсердной септостомии неизвестны.
Процедуру проводят с помощью специального баллонного катетера. Показана больным с рефрактерными формами ЛГ, когда продолжительная патогенетическая терапия (бозентан или простагландины) не приводит к улучшению их клинического состояния. Не показана больным с терминальными стадиями правожелудочковой СН или со значительной левожелудочковой СН. Риск смертности при проведении данной процедуры — 5–6%, выполнять ее следует только в соответствующих центрах. Отдаленные результаты баллонной предсердной септостомии неизвестны.
Легочная тромбоэндартериэктомия — это эффективный метод лечения ЛГ вследствие хронического тромбоза и/или эмболии ЛА. Важным элементом успешного проведения оперативного вмешательства является отбор пациентов. Важно, чтобы именно тяжесть тромботической окклюзии определяла тяжесть ЛГ. При этом сама величина давления в ЛА не имеет значения для проведения оперативного вмешательства, поскольку у пациентов с наиболее высоким уровнем давления будет достигнут наибольший эффект от такого вмешательства. Для отбора больных следует использовать данные катетеризации правых отделов сердца и ангиопульмонографии. Операционная смертность в лучших медицинских центрах варьирует от 5 до 11%. Хотя сегодня не проведены контролируемые исследования эффективности такого оперативного лечения, пользу от него выявляют почти сразу: у большинства больных регрессируют симптомы, увеличивается переносимость нагрузки, повышаются гемодинамические показатели и качество жизни. По данным ретроспективного анализа, 5-летняя выживаемость после удачно проведенного оперативного лечения достигает 75%.
Для отбора больных следует использовать данные катетеризации правых отделов сердца и ангиопульмонографии. Операционная смертность в лучших медицинских центрах варьирует от 5 до 11%. Хотя сегодня не проведены контролируемые исследования эффективности такого оперативного лечения, пользу от него выявляют почти сразу: у большинства больных регрессируют симптомы, увеличивается переносимость нагрузки, повышаются гемодинамические показатели и качество жизни. По данным ретроспективного анализа, 5-летняя выживаемость после удачно проведенного оперативного лечения достигает 75%.
Пересадка легких или пересадка легких и сердца являются радикальным хирургическим методом лечения больных с ЛГ. Операция показана при прогрессирующей ЛГ, когда несмотря на адекватное медикаментозное лечение состояние пациента соответствует III–IV ФК. Все больные по результатам теста 6-минутной ходьбы <400 м могут рассматриваться в качестве кандидатов для проведения трансплантации. При пересадке только легких рекомендуют проводить пересадку обоих легких, а при наличии значительных структурно-функциональных изменений ПЖ — операцией выбора является трансплантация сердца и легких. Трансплантация органов — лимитированная операция, ее проведение возможно только в соответствующих центрах. Больные после операции должны получать иммуносупрессивную терапию. Выживаемость после пересадки сердца и легких у больных с идиопатической ЛГ в лучших центрах составляет: через 1 год — 64% (в последние годы до 74%), через 3 года — 54% и через 5 лет — 44%. У пациентов с врожденными пороками сердца результаты операции, как правило, хуже. Отбор кандидатов для пересадки сердца и легких значительно варьирует в различных центрах. В то же время желательно, чтобы больные были младше 50 лет, без наличия системных заболеваний, таких как неконтролируемый сахарный диабет с поражением органов, выраженный атеросклероз, злокачественные новообразования.
Лечение других форм ЛГ. В настоящее время с точки зрения доказательной медицины не определена приоритетная терапия лечения ЛГ у больных с ХОБЛ. Целью терапии таких пациентов является максимальное сохранение функции легких и предупреждение прогрессирования бронхообструкции. Стандартная терапия может включать производные эуфиллина, стимуляторы β-адренорецепторов, антигистаминные препараты и стероидные гормоны. Следует бороться с развитием фибрилляции предсердий. При ее развитии возможно назначение дигоксина для контроля ЧСС. Имеются сведения о положительном влиянии статинов, которые предупреждают деструкцию легочной ткани.
Больным с идиопатическим легочным фиброзом показана терапия иммунодепрессантами и цитостатиками согласно стандартам лечения этой болезни. Пациенты с левожелудочковой СН должны получать стандартную терапию диуретиками, ингибиторами АПФ и блокаторами β-адренорецепторов, антагонистами альдостерона и при необходимости дигоксином. Возможно, у таких больных будет положительный ответ на назначение антагонистов рецепторов эндотелина-1.
Наблюдение больных с ЛГ. После установки диагноза и назначения патогенетической терапии больным с ЛГ рекомендовано находиться на диспансерном учете по месту жительства. Терапию ЛГ назначают пожизненно. Целью наблюдения являются определение эффекта назначенного лечения и его своевременная коррекция, формулирование трудового и жизненного прогноза. Следует максимально использовать неинвазивные процедуры в динамике наблюдения: тест с 6-минутной ходьбой (1 раз в 3 мес) и эхоКГ (1 раз в 6 мес). Ухудшение состояния и отсутствие эффекта проводимой терапии является показанием для госпитализации и проведения катетеризации сердца с определением дальнейшей тактики лечения.
Прогноз. Прогноз при ЛГ значительно отличается в зависимости от ее этиологии. Прогноз идиопатической ЛГ неблагоприятный, в среднем продолжительность жизни больного составляет 2,8 года. Для ЛГ при системной склеродермии продолжительность жизни составляет только 1 год. Прогноз зависит от сроков присоединения СН. При ее наличии прогноз крайне неблагоприятный. Считается, что современное рациональное лечение способно продлить срок жизни таких пациентов; проводимая терапия в отдельных случаях дает время для подготовки для трансплантации сердца и легких. Это положение было отражено в заключительном документе Всемирного симпозиума по ЛГ (Venice expert meeting, 2003).
ЛИТЕРАТУРА
- Рекомендации Украинской ассоциации кардиологов по профилактике и лечению артериальной гипертензии (2004): 84 с.
- Abman S.H. (2007) Recent advances in the pathogenesis and treatment of persistent pulmonary hypertension of the newborn. Neonatology, 91: 283-290.
- Badesch D.B., Abman S.H., Simmoneau G. et al. (2007) Medical therapy for pulmonary arterial hypertension. Updated ACCP Evidence-based clinical practice guidelines. Chest, 131: 1917-1928.
- Barst R.J., McGoon M., Torbicki A. et al. (2004) Diagnosis and differential assessment of pulmonary arterial hypertension (World Symposium on Pulmonary Arterial Hypertension in Venice, 2003). J. Am. Coll. Cardiol., 43, Suppl. S.: 40S-47S.
- Badesch D.B., Abman S.H., Simmoneau G. et al. (2007). Medical therapy for pulmonary arterial hypertension. Updated ACCP Evidence-based clinical practice guidelines. Chest., 131.: 1917-1928.
- Benza R.L., Park M.H., Keogh A.et al. (2007) Management of pulmonary arterial hypertension with a focus on combination therapies. J. Heart Lung Transplant., 26: 437-446.
- Gaine S.P., Rubin L.J. (1998) Primary pulmonary hypertension. Lancet, 352: 719-725.
- Galie N., Torbicki A., Barst R. et al. (2004) Guidelines on diagnosis and treatment of pulmonary arterial hypertension. The Task Force on Diagnosis and Treatment of Pulmonary Arterial Hypertension of the European Society of Cardiology. Eur. Heart. J., 25: 2243-2278.
- Gaynor S.L., Maniar H.S., Bloch J.B. et al. (2005) Right atrial and ventricular adaptation to chronic right ventricular pressure overload. Circulation., 112: I-12-I218.
- Gibbs J.S.R., Higenbottam T.W. for British Cardiac Society Guidelines and Medical Practice Committee (2001) Recommendation on the management of pulmonary hypertension in clinical practice. Heart., 86, Suppl. 1: i1-i13.
- Ishida K., Masuda M. (2007) Thromboendarterectomy for severe chronic thromboembolic pulmonary hypertension. Asian Cardiovasc. Thorac. Ann., 3: 229-233.
- Keogh A.M., McNeil K.D., Williams T. et al. (2003) Pulmonary artery hypertension: a new era in management. M.J.A., 178: 564-567.
- Law M.A., Grifka R.G., Mullins C.E. et al. (2007) Atrial septostomy improves survival in select patients with pulmonary hypertension. Am. Heart J., 153: 779-784.
- Macchia A., Marchioli R., Marfisi R. et al. (2007) Meta-analysis of trials of pulmonary hypertension: a clinical condition looking for drugs and research methodology. Am. Heart J., 153: 1037-1047.
- McGoon M., Gutterman D., Steen V. et al. (2004) Screening, early detection, and diagnosis of pulmonary arterial hypertension. ACCP evidence-based clinical practice guidelines. Chest., 126: 14S-34S.
- McLaughlin V.V., Presberg K.W., Doyle R.L. et al. (2004) Prognosis of pulmonary arterial hypertension. ACCP evidence-based clinical practice guidelines. Chest, 126: 78S-92S.
- Rubin L.J. (2004) Diagnosis and management of pulmonary arterial hypertension: ACCP evidence-based clinical practice guidelines. Chest., 126: 7S-10S.
- Simonneau G., Galie N., Rubin L.J. et al. (2004) Clinical classification of pulmonary hypertension. J. Am. Coll. Cardiol., 43, Suppl S.: 5S-12S.
- Stewart S. (2005) Pulmonary arterial hypertension. London and New York: Taylor&Francis: 56.
- The American Society for Transplant Physicians/The American Thoracic Society/European respiratory Society/International Society for Heart Lung Transplantation (1997) International guidelines for the selection of lung transplantation. Am. J. Resp. Crit. Care. Med., 158: 335-339.
- World Health Organisation: Primary Pulmonary Hypertension — executive summary (ed. S. Rich) (1998).
- Guidelines for the management of arterial hypertension (2007) J. Hypertension, Vol. 25: 1105-1187.
Трикуспидальный клапан и клапан легочной артерии
ТЕМА: Ультразвуковая диагностика трикуспидального клапана и клапана легочной артерии.
(автор – доцент кафедры, к.м.н. Жерко О.М.)
Учебные вопросы:
1. Ультразвуковая диагностика недостаточности трикуспидального клапана.
2. Ультразвуковая диагностика стеноза трикуспидального клапана.
3. Ультразвуковая диагностика стеноза клапана легочной артерии.
4. Ультразвуковая диагностика недостаточности клапана легочной артерии.
1. Ультразвуковая диагностика недостаточности трикуспидального клапана.
Рекомендуемые файлы
Этиология недостаточности трикуспидального клапана.
· Врожденная трикуспидальная недостаточность, как правило, является следствием врожденной патологии со стороны створок клапана.
· Приобретенная недостаточность трикуспидального клапана.
· Ревматическое поражение створок клапана.
· Инфекционный эндокардит.
· Тромбоэмболия легочной артерии.
· Пролапс трикуспидального клапана.
· Карциноидный синдром.
· Травма сердца.
Признаки трикуспидальной регургитации.
Дилатация и гипертрофия правых камер сердца.
Изолированная дилатация правого предсердия.
Парадоксальное движение межжелудочковой перегородки.
Цветовое допплеровское картирование.
Оценка степени трикуспидальной регургитации по глубине проникновения трикуспидальной регургитации в полость правого предсердия.
Полуколичественная оценка по величине потока трикуспидальной регургитации.
Классификация по соотношению площади трикуспидальной регургитации и площади правого предсердия.
Классификация трикуспидальной регургитации:
остро возникшая трикуспидальная регургитация,
хроническая трикуспидальная регургитация.
Оценка степени значимости трикуспидальной регургитации по скорости нарастания давления в правом желудочке (dP / dt).
Постоянно-волновое допплеровское исследование. Определяется максимальная скорость трикуспидальной регургитации и максимальный транстрикуспидальный градиент давления.
2. Ультразвуковая диагностика стеноза трикуспидального клапана.
Этиология трикуспидального стеноза.
· Ревматизм.
· Инфекционный эндокардит.
· Обструкция правого фиброзного атриовентрикулярного кольца опухолью.
· Гемодинамика трикуспидального стеноза
Эхокардиографические критерии трикуспидального стеноза.
Изменение структуры створок трикуспидального клапана (утолщение, уплотнение).
Ограничение открытия створок трикуспидального клапана.
Однонаправленное движение передней и септальной створок трикуспидального клапана.
Высокая степень дилатации правого предсердия, нижней полой и печеночных вен.
Допплер-эхокардиография.
Оценка степени стеноза трикуспидального клапана по максимальному и среднему градиенту давления между правым предсердием и желудочком.
Оценка степени стеноза трикуспидального клапана по времени полуспада градиента давления (Т ½).
Оценка тяжести трикуспидального стеноза по средней скорости трикуспидального потока.
Оценка тяжести трикуспидального стеноза по площади трикуспидального отверстия.
3. Ультразвуковая диагностика стеноза клапана легочной артерии.
Этиология стеноза клапана легочной артерии.
· Врожденный стеноз клапана легочной артерии.
· Приобретенный стеноз клапана легочной артерии.
· Ревматическое поражение створок легочного клапана.
· Инфекционный эндокардит.
· Псевдостеноз клапана легочной артерии.
· Аневризма правого коронарного или левого коронарного синусов Вальсальвы.
· Гемодинамика легочного стеноза
Эхокардиографические признаки стеноза клапана легочной артерии.
Изменения со стороны створок клапана легочной артерии.
Гипертрофия стенки правого желудочка высокой степени.
Дилатация полости правого желудочка и правого предсердия.
Постстенотическая дилатация ствола легочной артерии.
Увеличение глубины волны А при анализе формы движения задней створки клапана легочной артерии в М-режиме.
Наличие ускоренного потока в систолу через клапан легочной артерии.
Оценка тяжести стеноза клапана легочной артерии по максимальной скорости потока через клапан легочной артерии.
Оценка тяжести стеноза клапана легочной артерии по максимальному градиенту давления.
4. Ультразвуковая диагностика недостаточности трикуспидального клапана.
Этиология патологической легочной регургитации.
· Врожденная патология клапана.
· Двухстворчатый клапан легочной артерии.
· Приобретенная легочная регургитация.
· Ревматическое поражение створок клапана легочной артерии.
· Инфекционный эндокардит.
Эхокардиографические критерии наличия легочной регургитации.
Дилатация ствола легочной артерии и полости правого желудочка.
Изменение движения створок клапана легочной артерии.
Легочная регургитация может быть остро возникшей и хронической.
Оценка степени регургитации на клапане легочной артерии в зависимости от глубины проникновения в полость правого предсердия.
Полуколичественная оценка регургитации на клапане легочной артерии.
Оценка тяжести недостаточности клапана легочной артерии по скорости регургитации.
СПИСОК ЛИТЕРАТУРЫ
1. Cardiac Ultrasound. Edited by P. Wilde. London, 1993.
2. Абдулаев Р.Я. с соавт. Атлас ультразвуковой диагностики. Харьков, Том 1,2, 1993.
3. Абдулаев Р.Я., Соболь Ю.С., Шиллер Н.Б., Фостер Э. Современная эхокардиография. Харьков, 1998.
4. Клиническое руководство по ультразвуковой диагностике. Под редакцией Митькова В.В., Садриковой В.А., М., Т.5.,1999.
Информация в лекции «21 — Промышленные типы месторождений» поможет Вам.
5. Фейгенбаум Х. Эхокардиография. М., 1999.
6. Белозеров Ю.М. Детская кардиология / Ю.М. Белозеров. — М. : МЕД-пресс-информ, 2004. — 600 с.
7. Белозеров Ю.М., Болбиков В.В. Ультразвуковая семиотика и диагностика в кардиологии детского возраста. — М.: МЕДпресс, 2001. — 176 с.
8. Дземешкевич С.Л. Болезни аортального клапана : Функция. Диагностика. Лечение / С.Л.Дземешкевич, Л.У.Стивенсон , В.В.Алекси-Месхишвили. — М. : ГЭОТАР-МЕД, 2004. — 328 с. — (Сер. «Высокие технологии в медицине»).
9. Инструментальные методы исследования в кардиологии : Руководство / Под ред. Г.И. Сидоренко. — Мн., 1994. — 270 с.
10. Маколкин В.И. Приобретенные пороки сердца /В.И.Маколкин. — 3-е изд., перераб. и доп. — М. : ГЭОТАР-МЕД, 2003. — 216 с.
Общество пульмональной гипертензииОбщество пульмональной гипертензии
Методы диагностики ПАГ/ПГ
- Электрокардиограмма
- Рентгенограмма легких
- Эхокардиография
Важнейшим исследованием или скрининг-исследованием в диагностике легочной гипертензии является эхокардиография. Данный метод позволяет косвенно судить об артериальном давлении в легочной артерии.
При оценке эхокардиографии следует тщательно проанализировать состояние правой части сердца, определить скорость струи трикуспидальной регургитации и систолическое давление правого желудочка, которое специалисты в области эхокардиографии часто обозначают буквами LKSS. В случае, если LKSS превышает 35 мм/Hg, следует выяснить причину повышения систолического давления правого желудочка, которое взаимосвязано с пульмональным артериальным давлением.
Если с помощью эхокардиографии констатирована пульмональная гипертензия, следует исключить наиболее частые тому причины – систолическую или диастолическую дисфункцию левой части сердца, проблемы клапана, легочные заболевания, тромбоэмболию. Если у пациента данных заболеваний нет или имеется какое-либо заболевание, которое вызывает пульмональную артериальную гипертензию, тогда можно определить диагноз первой группы или пульмональной артериальной гипертензии. В таких случаях необходимо провести зондирование сердца.
- Зондирование правой половины сердца или катетеризация
Во время зондирования кровяное давление в легочной артерии измеряют напрямую. После этого в случае необходимости пациенту назначается патогенетическая терапия болезни.
- Компьютерная томография
С помощью данных методов оценивается механическая функция легких. Можно определить статические показатели легких, к примеру, жизненный объем, а также динамические показатели – принудительный жизненный объем, принудительный объем выдоха за одну секунду.
- Определение уровня BNP в крови
- Тест 6-минутной ходьбы
Все исследования и всесторонний анализ их результатов можно провести в Латвийском кардиологическом центре Клинической университетской больницы им. Паула Страдыня.
Регургитация трехстворчатого клапана: симптомы и причины
Обзор
Что такое регургитация трехстворчатого клапана?
Регургитация трехстворчатого клапана происходит, когда трехстворчатый клапан в сердце не закрывается полностью. Это позволяет крови течь в обратном направлении, и чем больше обратный кровоток, тем он тяжелее. Со временем это может изменить структуру или форму вашего сердца и привести к необратимому повреждению сердца и множеству других проблем. Полное название часто сокращают до «трехстворчатой регургитации».”
Где находится трехстворчатый клапан?
Трехстворчатый клапан находится между правым предсердием (верхняя камера) и правым желудочком (нижняя камера) в сердце. Это первый клапан (из четырех), через который проходит кровь после циркуляции в вашем теле.
Насколько распространена регургитация трехстворчатого клапана?
Следы трикуспидальной регургитации обнаруживаются примерно у 50–60% молодых людей. Легкая трехстворчатая регургитация случается примерно у 15% взрослых. По крайней мере, 1.У 6 миллионов человек в США средние или тяжелые заболевания. По оценкам, во всем мире около 70 миллионов человек страдают трикуспидальной регургитацией.
Нормальна ли трехстворчатая регургитация?
Хотя трикуспидальная регургитация часто встречается у взрослых, это не считается нормальным явлением. Однако следовая регургитация не опасна.
Как регургитация трехстворчатого клапана влияет на мой организм?
На самом низком уровне трикуспидальная регургитация, похоже, не влияет на ваше тело.Однако по мере того, как состояние становится более серьезным, ухудшаются и последствия. Умеренная и тяжелая трикуспидальная регургитация может изменить форму вашего сердца. Это может вызвать необратимое повреждение сердца, что приведет к сердечной недостаточности и смерти (особенно у людей старше 70 лет).
Симптомы и причины
Каковы симптомы регургитации трикуспидального клапана?
Симптомы трикуспидальной регургитации могут не проявляться, когда реальной проблемой является другое состояние или заболевание. Также часто отсутствуют симптомы, сопровождающиеся незначительной или легкой трикуспидальной регургитацией.
Симптомы трикуспидальной регургитации включают:
- Одышка. Обычно это происходит, когда вы активны.
- Усталость или слабость. Это когда вы чувствуете себя истощенным в течение длительного периода (дней и более), а не просто чувствуете усталость.
- Отек живота, лодыжек или ступней. Такой отек возникает, когда сердце изо всех сил пытается выполнять свою работу, вызывая накопление слишком большого количества жидкости. Вздутие живота также может быть признаком того, что ваша печень получает слишком большой кровоток, что может привести к ее набуханию и неправильной работе.Это может вызвать желтуху (пожелтение кожи или белков глаз) и потерю веса.
- Шум в сердце. Медицинский работник со стетоскопом, прислушивающийся к звукам вашего сердца, обычно может услышать шум. Шепот — это необычный звук, который указывает на то, что часть вашего сердца не работает должным образом.
- Необычно сильный пульс. Ваш врач может почувствовать необычно сильный пульс на шее или около печени. Обычно это происходит в тяжелых и запущенных случаях трикуспидальной регургитации.
Что вызывает регургитацию трикуспидального клапана?
Каждый клапан внутри вашего сердца имеет створки (так называемые створки), через которые проходит кровь. Срыгивание происходит, когда створки не закрываются полностью, позволяя крови течь назад. Чем больше крови течет назад, тем хуже срыгивание.
Существует два типа трикуспидальной регургитации.
- Функциональные: Также называется вторичной трикуспидальной регургитацией. Этот тип трикуспидальной регургитации возникает из-за другого заболевания или состояния.Это наиболее распространенный тип, который часто встречается при диагностике других заболеваний.
- Органический: этот тип, также известный как первичная трехстворчатая регургитация, не вызван другим заболеванием или состоянием.
Трикуспидальная регургитация — это форма поражения трехстворчатого клапана. Другой формой этого заболевания является стеноз трехстворчатого клапана (сужение или закупорка клапана), и они могут иногда возникать одновременно.
Какие заболевания возникают или возникают вместе с трикуспидальной регургитацией?
Заболевания или состояния, которые могут вызывать трикуспидальную регургитацию, включают:
- Бактериальные инфекции. При отсутствии лечения бактериальные инфекции могут вызвать ревматизм, который повреждает створки клапанов сердца. Когда одновременно обнаруживаются регургитация и стеноз трехстворчатого клапана, это почти всегда происходит по этой причине.
- Аномалия Эбштейна . У людей, рожденных с этим редким дефектом, трикуспидальный клапан сформирован неправильно, а правое предсердие (верхняя камера) сердца слишком велико. Более легкие случаи могут оставаться незамеченными, пока человек не станет взрослым.
- Нарушения соединительной ткани .Генетические заболевания, такие как синдром Марфана и ревматоидный артрит, тесно связаны с трикуспидальной регургитацией.
- Карциноидные опухоли . Это необычный тип рака, который имеет тенденцию медленно расти и обычно начинается где-то в пищеварительной системе. Иногда это может вызвать образование тканей внутри вашего сердца, что мешает кровотоку.
- Эндокардит . Это воспаление внутри вашего сердца, вызванное инфекциями. Вы подвергаетесь более высокому риску, если вам нужен регулярный диализ или вам имплантирован постоянный порт для внутривенных (IV) лекарств.Это также более распространено, если вы в анамнезе принимали наркотики внутривенно.
- Миксоматозная дегенерация . Это происходит, когда створки клапана становятся слишком эластичными, что препятствует их уплотнению. Хотя это чаще встречается в митральном клапане, это также может случиться с трехстворчатым клапаном.
- Другие болезни или состояния сердечного клапана. Любое заболевание или состояние, которое влияет на кровоток через сердце, может привести к трикуспидальной регургитации. Это включает в себя сердечный приступ и проблемы с сердечным ритмом, особенно те, которые вызывают легочную гипертензию (высокое кровяное давление в легких).
Другие причины трикуспидальной регургитации включают:
- Травма . В редких случаях травма груди может повредить трикуспидальный клапан. Травма обычно серьезная, например, при падении с высоты или крупной автомобильной аварии.
- Имплантированные устройства. Кардиостимуляторы и аналогичные устройства могут вызывать трехстворчатую регургитацию. Обычно это происходит из-за смещенного провода, который оказывается не в том месте.
- Лучевая терапия .Лучевая терапия некоторых видов рака иногда может повредить трикуспидальный клапан.
- Лекарства. Некоторые лекарства могут повредить ваше сердце и вызвать трехстворчатую регургитацию.
Диагностика и тесты
Как диагностируется регургитация трехстворчатого клапана?
Несколько тестов могут помочь диагностировать трикуспидальную регургитацию самостоятельно или в связи с другим заболеванием или состоянием. Ваш основной лечащий врач или кардиолог может выполнить одно или несколько из следующих действий:
- Физический осмотр .Это будет включать прислушивание к своему сердцу и звукам дыхания. Шум в сердце — это легко обнаруживаемый признак во время медицинского осмотра. Они также могут чувствовать вашу шею и живот рядом с печенью. Ощущение сильного пульса в любом месте является признаком трикуспидальной регургитации.
- Электрокардиограмма (ЭКГ или ЭКГ). В этом тесте используются датчики, размещенные на коже груди, для измерения электрической активности сердца. Он может обнаружить незначительные изменения в ритме вашего сердца, а также другие проблемы с сердцем, которые могут вызвать трикуспидальную регургитацию.
- Рентген грудной клетки . Рентген часто может показать медицинскому работнику изменения в структуре вашего сердца, вызванные трикуспидальной регургитацией.
- Эхокардиограмма . Используя ультразвуковые волны, врач может увидеть ваше сердце, а также камеры и клапаны внутри него. Они также могут увидеть, как кровь течет в обратном направлении внутри вашего сердца, и измерить серьезность проблемы.
- Катетеризация сердца . Небольшое устройство вставляется в одну из артерий вашего тела, обычно в руке или около паха, а затем продвигается к сердцу.Это позволяет медицинским работникам видеть и диагностировать проблемы изнутри вашего сердца.
- Анализы крови. Трикуспидальная регургитация может оказать негативное влияние на вашу печень, что можно обнаружить с помощью определенных анализов крови.
Ведение и лечение
Есть ли лекарство от регургитации трикуспидального клапана?
Иногда можно вылечить трикуспидальную регургитацию, в зависимости от тяжести заболевания и его причины. Ремонт или замена клапана — наиболее распространенное решение.Когда причиной является другое заболевание (особенно сердечное), лечение основного заболевания может остановить срыгивание.
Если вы родились с трикуспидальной регургитацией, вылечить ее невозможно. Если это вызвано генетическим заболеванием, можно вылечить связанные симптомы, но болезнь, вызывающая срыгивание, неизлечима.
Более легкие случаи трехстворчатой регургитации могут не иметь никаких симптомов, и многие люди живут без симптомов годами. В тяжелых и запущенных случаях вылечить трехстворчатую регургитацию обычно невозможно, но обычно можно справиться с симптомами.
Как лечится регургитация трикуспидального клапана?
Лечение трикуспидальной регургитации может включать одно или несколько из следующих действий:
- Лекарства: лекарства могут контролировать многие симптомы трикуспидальной регургитации. Симптомы включают высокое кровяное давление, отек живота или конечностей, а также нарушения сердечного ритма (аритмии).
- Иногда с трикуспидальной регургитацией связана фибрилляция предсердий, аномальный ритм в одной или обеих верхних камерах сердца.Фибрилляция предсердий увеличивает риск образования тромба, который может вызвать инсульт или тромбоэмболию легочной артерии. Ваш лечащий врач может назначить разбавитель крови, чтобы предотвратить образование сгустков.
- Ремонт клапана. Этот вид восстановления выполняется одним из двух способов:
- Хирургическим путем: хирург сделает разрез в груди, получит прямой доступ к сердцу и восстановит трикуспидальный клапан. Это можно сделать через меньшие разрезы с использованием минимально инвазивных методов или роботизированной хирургии.В роботизированной хирургии хирург «управляет» роботом, что позволяет ему видеть и работать без необходимости делать большие разрезы. Меньшие разрезы меньше болят, и время восстановления меньше.
- Процедура на основе катетера: аналогично диагностическому подходу с катетеризацией сердца, упомянутому выше, интервенционный кардиолог может использовать аналогичный метод для восстановления клапана. Относительно новый способ сделать это включает тип зажима, который прикрепляется к створкам клапана, что помогает им правильно закрывать.Катетер вводится в ваше сердце через вену на верхней части бедра.
- Замена клапана. Замена трехстворчатого клапана также может быть выполнена одним из двух способов:
- Хирургическим путем: аналогично ремонту, упомянутому выше, разница в том, что хирург заменит клапан, а не отремонтирует его. Клапаны, используемые для его восстановления, могут быть биологическими (от людей, свиней или коров), механическими или их комбинацией.
- Процедура с использованием катетера: также аналогична процедурам с использованием катетера, упомянутым ранее, этот метод также обеспечивает доступ к вашему сердцу через вену в верхней части бедра.Оказавшись внутри, ставится новый клапан.
В целом, для большинства пациентов предпочтительным методом является восстановление клапана, так как он сопряжен с меньшими рисками, чем замена клапана. Ваш лечащий врач объяснит вам возможные варианты и поможет понять, какой из них с наибольшей вероятностью даст вам наилучший результат.
Сколько времени нужно для восстановления после ремонта или замены трикуспидального клапана?
Время восстановления после ремонта или замены клапана зависит от используемого метода.
- Хирургия: Ремонт или замена клапана хирургическим путем обычно требует пребывания в больнице на несколько дней.Общее время восстановления обычно составляет несколько недель.
- Катетерные процедуры: большинство людей, которым проводят катетерные процедуры, могут пойти домой в тот же или на следующий день. Большинство из них могут вернуться к своему обычному распорядку вскоре после этого.
Профилактика
Можно ли предотвратить регургитацию трехстворчатого клапана?
По большей части единственный способ предотвратить трикуспидальную регургитацию — это быстрое и эффективное лечение бактериальных инфекций. Ревматическую лихорадку и ее влияние на сердце почти всегда можно предотвратить с помощью лечения антибиотиками.
Перспективы / Прогноз
Чего мне ожидать, если у меня трикуспидальная регургитация?
Что следует ожидать от трикуспидальной регургитации, зависит от ее причины и тяжести вашего случая. В целом, чем хуже ваше дело, тем значительнее его влияние на вашу жизнь. Ваш лечащий врач может помочь вам лучше разобраться в вашем случае. Это включает в себя то, чего вы можете ожидать, какое лечение и последующее наблюдение необходимо.
Как я могу управлять симптомами регургитации трикуспидального клапана?
Как вы справляетесь с трикуспидальной регургитацией, будет зависеть от того, насколько она серьезна и что ее вызвало в первую очередь.
- Следите за срыгиванием: у вас, скорее всего, не будет никаких изменений в вашей жизни из-за такого уровня срыгивания.
- Легкая срыгивание: этот уровень срыгивания не должен иметь большого влияния на вашу жизнь. Ваш лечащий врач может посоветовать вам внести изменения в свой рацион.
- Умеренная или сильная срыгивание: Ваш лечащий врач может посоветовать вам изменить свой рацион. В тяжелых случаях, особенно при сердечной недостаточности, врач может порекомендовать вам ограничить физическую активность.Это необходимо для того, чтобы снизить нагрузку на сердце.
Когда мне следует позвонить своему врачу?
Вам следует позвонить своему врачу, если у вас есть какие-либо симптомы трехстворчатой регургитации, которые внезапно усиливаются или начинают мешать вашей жизни и нормальной деятельности.
Когда мне следует обратиться в пункт неотложной помощи?
Вы всегда должны обращаться в больницу при следующих симптомах:
Если вы принимаете новое лекарство от трикуспидальной регургитации, вам следует обратиться в отделение неотложной помощи в следующих ситуациях:
- Неожиданные побочные эффекты. Ваш лечащий врач может сказать вам, каких побочных эффектов следует ожидать и как они могут повлиять на вас. Ваш врач также может сказать вам, какие побочные эффекты требуют немедленной медицинской помощи.
- После падения. Если вы упали — особенно если ударились головой — во время приема антикоагулянтов. Разжижители крови значительно увеличивают риск внутреннего кровотечения после падения.
Если у вас была операция, восстановление или замена катетерного клапана, вам следует обратиться в больницу в следующих случаях:
- Если у вас есть признаки инфекции в месте разреза.К ним относятся отек, покраснение или ощущение горячего прикосновения к месту разреза.
- Если у вас есть признаки сердечного приступа или инсульта, особенно те, которые перечислены в начале этого раздела.
- Если вы принимаете антикоагулянты и упали или получили травму по причинам, указанным выше.
Справка из клиники Кливленда
Регургитация трехстворчатого клапана — это заболевание, которое может повлиять на вашу повседневную жизнь, в зависимости от степени тяжести.Благодаря достижениям в области технологий и пониманию современной медицины функции сердца можно вылечить или даже вылечить это состояние. Даже если болезнь неизлечима, ваш лечащий врач может помочь вам ее вылечить и контролировать, чтобы она не мешала вашей повседневной деятельности.
Влияние тяжелой трикуспидальной регургитации на долгосрочную выживаемость
Res Cardiovasc Med. 2013 Aug; 2 (3): 121–126.
Анита Садехпур
1 Исследовательский центр эхокардиографии, Медицинский и исследовательский центр сердечно-сосудистой системы Раджаи, Иранский университет медицинских наук, Тегеран, Иран Наук, Тегеран, Иран
Маджид Кьявар
2 Раджаи Кардиоваскулярный медицинский и исследовательский центр, Иранский университет медицинских наук, Тегеран, Иран
Хоман Бахшандех
2 Раджайский медицинский и исследовательский центр сердечно-сосудистой системы, Иран Министерства медицинских наук, Тегеран, Иран
Насим Надери
2 Раджаи Сердечно-сосудистый медицинский и исследовательский центр, Иранский университет медицинских наук, Тегеран, Иран
Бехшид Гадрдуст
2 Раджаи Медицинский исследовательский центр сердечно-сосудистой системы Иранский университет медицинских наук, Тегеран, IR Ir an
Arezou Haghighat Talab
2 Rajaie Сердечно-сосудистый медицинский и исследовательский центр, Иранский университет медицинских наук, Тегеран, Иран
1 Исследовательский центр эхокардиографии, Медицинский и исследовательский центр сердечно-сосудистой системы Rajaie, Иранский университет медицинских наук, Тегеран, Иран
2 Раджаи Кардиоваскулярный медицинский и исследовательский центр, Иранский университет медицинских наук, Тегеран, Иран
* Автор, ответственный за переписку: Мехри Хассанзаде, Раджаиский кардиологический медицинский и исследовательский центр, Иранский университет медицинских наук, Тегеран , IR Иран.Тел .: + 98-21230, Факс: + 98-2122663209, Электронная почта: moc.oohay@2102grablogПолучено 11 февраля 2013 г .; Пересмотрено 28 апреля 2013 г .; Принято 28 апреля 2013 г.
Авторские права © 2013 г., Центр исследований сердечно-сосудистой системы Раджаи, Иранский университет медицинских наук, Тегеран, Иран; Опубликовано Kowsar Corp.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья цитируется в других статьях в PMC.Abstract
Справочная информация:
Трикуспидальная регургитация (TR) — частая эхокардиографическая находка, которая часто сопровождает болезнь левого клапана. Данные о смертности и заболеваемости у пациентов с тяжелой ТР ограничены.
Цели:
Мы стремились оценить исход пациентов с тяжелой ТР с гипотезой о том, что значительная ТР отрицательно влияет на качество жизни и выживаемость, независимо от давления в легочной артерии (ДЛА) и фракции выброса левого желудочка (ФВЛЖ).
Материалы и методы:
В период с 2002 по 2012 год в исследование были включены 358 последовательных пациентов (средний возраст 54,67 ± 13,25 года, 75,5% женщин) с тяжелой ТР на основании анамнеза и трансторакальной эхокардиографии (ТТЭ). Были исключены пациенты с тяжелым пороком левого клапана сердца и врожденным пороком сердца. Оценивали распространенность симптомов сердечной недостаточности, повторную госпитализацию и продолжительность госпитализации. Выживаемость рассчитывалась согласно анализу кривой Каплана-Мейера.
Результаты:
Сердечная недостаточность (50%) была основной причиной смерти. Средняя продолжительность жизни с момента постановки диагноза тяжелой TR составила 4,35 ± 3,66 года, а средняя продолжительность жизни с момента появления симптома — 2,28 ± 1,40. Девяносто случаев (25,1%) были госпитализированы из-за сердечной недостаточности и в среднем через 1,9 ± 0,8 года наблюдения (6-32 месяца), 14% всех пациентов и 36,8% пациентов с правожелудочковой недостаточностью были повторно госпитализированы. Фибрилляция предсердий отмечена у 70,5% пациентов.
Выводы:
Наблюдается значительный рост смертности, продолжительной госпитализации и повторной госпитализации у симптомных пациентов с тяжелой ТР.Таким образом, мы рекомендуем более агрессивный подход к восстановлению или замене телевизора у этих пациентов независимо от ДЛА и систолической функции.
Ключевые слова: Трикуспидальная регургитация, желудочковая функция, правая, желудочковая функция, левая
1. Общие сведения
Трехстворчатая регургитация (TR), которая часто сопровождает левостороннее поражение клапана сердца, является частой эхокардиографической находкой, обнаруживаемой в 80% случаев. 90% нормальных людей (1). ТР в основном функциональная, а не органическая, и связана с легочной гипертензией или дилатацией правого желудочка.Субъективные симптомы часто неспецифичны, прогрессируют очень медленно и становятся очевидными только после возникновения необратимой дисфункции правого желудочка (ПЖ) (2). Поэтому определение оптимального времени для корректирующей операции остается сложной клинической проблемой у пациентов с тяжелой ТН (3). О значительном остаточном TR также сообщалось у 10–45% пациентов после восстановления ТВ с помощью различных методов (4). Несмотря на упомянутые факты, ТР долгое время игнорировали из-за того, что считали это редким и клинически незначимым заболеванием.Пациенты редко направляются на изолированное хирургическое лечение трикуспидального клапана, и большинство операций выполняется в контексте других плановых операций на сердце (4-7). Было проведено несколько исследований, посвященных этой важной проблеме, которые были ограничены из-за небольшого количества исследуемых пациентов или отсутствия эхокардиографического исследования правого желудочка (2).
2. Цели
Таким образом, целью данного исследования было оценить уровень смертности и заболеваемости, связанной с тяжелой TR у пациентов без манипуляций и у пациентов, подвергшихся безуспешным манипуляциям, чтобы исследовать гипотезу о том, что значительный TR может иметь неблагоприятное влияние на выживаемость пациентов. независимо от давления в легочной артерии и фракции выброса левого желудочка (ФВЛЖ).
3. Материалы и методы
В период с 2002 по 2012 год были обследованы все пациенты с пороком клапанов сердца, поступившие в Медицинский и исследовательский центр сердечно-сосудистой системы Rajaie. В исследование были включены пациенты со значительной TR, подвергшейся хирургическому вмешательству или без какого-либо вмешательства. Критериями исключения были степень TR от умеренной до тяжелой, тяжелый левосторонний клапанный порок сердца и значительный врожденный порок сердца.
Согласно этим критериям, 358 пациентов (средний возраст 54 года.67 ± 13,25 года, 14-81 год; Было обследовано 270 женщин и 88 мужчин). Трансторакальная эхокардиография (ТТЭ) выявила дополнительную аортальную регургитацию у 237 пациентов, митральную регургитацию у 292 пациентов, митральный стеноз в 187 случаях и стеноз аорты у 76 пациентов. Два случая имели стеноз легочной артерии (незначительный) и 275 пациентов имели легочную регургитацию. Другие поражения клапана были менее умеренными. Эхокардиографию выполняли с помощью имеющихся в продаже ультразвуковых систем. Всем пациентам проводилась ТТЭ, тяжелая ТР была определена с помощью эхокардиографии на основании одного из следующих критериев (8-10): 1.Расширение фиброзного кольца (4 см или более) или неадекватная коаптация створки, 2. Позднее изменение систолического кровотока в печеночной вене, 3. Объем регургитации 45 мл или более, 4. Эффективное отверстие для регургитации (ERO) 0,4 см 2 или больше, 5. Ширина вено-контракта 6,5 мм и более.
Пациенты прошли 6-месячное наблюдение 2 раза подряд с телефонным звонком или личным визитом. Клиническое течение пациентов также оценивалось документально. Для сбора данных был подготовлен соответствующий вопросник, и все необходимые данные, полученные с электрокардиограммы (ЭКГ), TTE или любой диагностической процедуры, которая выполнялась для пациентов во время наблюдения, также были собраны и проанализированы статистически.
3.1. Статистический анализ
Статистический анализ выполняли с помощью SPSS 15 для Windows (SPSS Inc., Чикаго, Иллинойс). Клинические данные были выражены как средние значения ± стандартное отклонение для интервала и количества (%) для категориальных переменных. Один образец критерия Колмогорова-Смирнова был применен для проверки равенства распределения интервальных переменных с распределением Гаусса. Сравнение подгрупп проводилось с использованием критерия t Стьюдента (или непараметрического эквивалента, U-критерия Манна-Уитни) для интервалов и критерия хи-квадрат Пирсона (или точного критерия Фишера) для категориальных переменных.Время до наступления событий исследовали методом анализа выживаемости Каплана-Мейера. Во всех статистических тестах значение P <0,05 считалось статистически значимым.
4. Результаты
В этом исследовании приняли участие 358 пациентов, 270 женщин (75,5%) и 88 мужчин (24,5%) с умеренной, тяжелой или тяжелой ТР и средним возрастом 54,67 ± 13,25 (14-81 год). Средний год наблюдения составил 1,9 года (6-32 месяца). Другими несущественными сопутствующими поражениями клапанов были следующие: митральный стеноз в 187 случаях (52.2%), митральная регургитация в 292 случаях (81,6%), стеноз аорты в 76 случаях (21,2%) и регургитация аорты в 237 случаях (66,2%). 275 случаев (76,8%) имели легочную регургитацию. В 81 случае (22,6%) была проведена хирургическая коррекция TR, а у 38,5% наблюдался значительный TR после операции, которые были включены в исследование. Общая летальность составила около 3,3% (12 случаев). Причиной смерти была правосторонняя сердечная недостаточность в 6 случаях (50%), другие причины смерти в остальных 5 случаях (41,7%) были следующими: 2 случая аритмии. , 2 случая кардиогенного шока и 1 случай отека легких.Один случай смерти произошел из-за сепсиса. Время и вероятность летального исхода продемонстрированы на основе метода Каплана-Мейера.
Уровень смертности во время наблюдения в исследовательской группе
Среднее время диагностики тяжелой TR составило 4,35 ± 3,66 года, без существенной разницы между мужчинами и женщинами (значение P = 0,46). Среднее время возникновения тяжелых симптомов TR составило 2,28 ± 1,40 года без существенной разницы между мужчинами и женщинами (p-значение = 0.39). По результатам ЭКГ в 101 случае (28,21%) имел место синусовый ритм, желудочковая аритмия — у 1 пациента (0,3%), аритмия предсердий — у 257 пациентов (71,8%), в том числе фибрилляция предсердий (ФП) — у 252. больных и ритм трепетания в 5 случаях. Тридцать два пациента (8,93%) имели блокаду правой ножки пучка Гиса (БПНПГ) и 7 случаев (1,95%) имели гипертрофию правого желудочка (ГПЖ). Распространенность дисфункции левого желудочка, дисфункции правого желудочка и легочной предсердной гипертензии показана в.
Таблица 1.
Распространенность дисфункции левого желудочка, дисфункции правого желудочка и легочной гипертензии у пациентов со значительным TR
| степени тяжести | LV a . Дисфункция | RV a . Дисфункция | PAH a |
|---|---|---|---|
| Нормальный | 140 (39,1%) | 14 (3.9%) | 26 (7,3%) |
| мягкий | 90 (25,1%) | 63 (17,5%) | 84 (23,4%) |
| Умеренная | 76 (21,2%) | 188 (52,5%) | 125 (34,9%) |
| Тяжелая | 52 (14,5%) | 93 (25,9%) | 123 (34,3%) |
| Всего | 358 | 358 | 358 |
Девяносто пациентов с тяжелой ТР были госпитализированы без существенной разницы между мужчинами (29.5%) и женщин (23,6%), (P = 0,26). Четырнадцать процентов всех пациентов и 36,8% пациентов с сердечной недостаточностью были госпитализированы. Семнадцать пациентов (4,7%) были госпитализированы впервые в течение среднего периода наблюдения 1,9 года (6-32 месяца). Средний интервал между первым поступлением и постановкой диагноза сердечной недостаточности составил 12,49 ± 1,06 года ().
Анализ выживаемости по Каплану Мейеру для диагностики сердечной недостаточности
Средний интервал времени между диагностикой сердечной недостаточности и повторной госпитализацией составил 8.45 ± 2,03 мес ().
Анализ выживаемости по Каплану Мейеру для повторной госпитализации
Включая частоту признаков и симптомов сердечной недостаточности; одышка при физической нагрузке (66,9%), утомляемость (30,1%), отек (26,7%), повышение давления в яремной вене (JVP) (19,5%), сердцебиение (19,2%), хрипы (15,4%), асцит (13,1%). %) и боль в груди (10,3%). В целом 246 пациентов получали лечение диуретиками. Однако частота ДЭ функциональных классов III (41,7%) и IV (5,4%) до лечения диуретиками снизилась до 26.5% и 0,7% соответственно после лечения диуретиками. Участники были разделены на основе давления в легочной артерии (ЛА); первичный TR: случаи с давлением в ЛА <55 и вторичный TR: случаи с PAP ≤ 55. Из общего числа 225 случаев (63%) включены в первичную группу TR и 133 случая (37%) во вторичную группу TR. Эти две группы случаев сравнивались по различным переменным, и результаты были продемонстрированы в.
Таблица 2.
Сравнение различных переменных между пациентами с первичным и вторичным TR
| Трикуспидальная регургитация | Значение P | ||
|---|---|---|---|
| первичное (n = | ) первичное (n = 226) | ||
| Признак сердечной недостаточности | |||
| сердцебиение | 44 (19.5%) | 25 (18,8%) | 0,876 |
| усталость | 68 (30,1%) | 40 (30,1%) | 0,998 |
| DOE a 902 %) | 99 (74,4%) | 0,019 | |
| Боль в груди | 19 (8,4%) | 18 (13,5%) | 0,126 |
| хрипов | 32 (14,3406%) (17,3%) | 0,447 | |
| отек | 59 (26.1%) | 37 (27,8%) | 0,723 |
| асцитов | 26 (11,5%) | 21 (15,8%) | 0,245 |
Elevated JVP | 19,0%) | 27 (20,3%) | 0,769 | |
| Аритмия | |||
| предсердный | 167 (73,9%) | 92 (69,2%) | 0,335 |
| желудочковый | 0 (0%) | 1 (0.8%) | 0,192 |
| ЭКГ a отклонение от нормы | |||
| RBBB a | 16 (7,1%) | 16 (12,0%) | 0,112 |
| RVH a | 3 (1,3% ) | 0,266 | |
| Смерть | 9 (4,0%) | 3 (2,3%) | 0,379 |
| Причина смерти | 0.091 | ||
| Несердечный | 1 (11,1%) | 0 (0%) | |
| сердечный (RHF a ) | 6 (66,7%) | ||
| сердечный (без RHF a ) | 2 (22,2%) | 3 (100%) | |
| Повторная госпитализация | |||
| Всего | 27 (12.3%) | 22 (16,8%) | 0,237 |
| HF | 19 (38,0%) | 13 (35,1%) | 0,784 |
| Средняя выживаемость с момента постановки диагноза (лет) | 4,48 ± 3,63 | 4,11 ± 3,71 | 0,128 |
| Средняя выживаемость с момента появления симптомов (лет) | 2,37 ± 1,48 | 2,16 ± 1,30 | 0,739 |
Различные степени дисфункции правого желудочка, дисфункции ЛЖ и степени тяжести гипертонии также сравнивались между первичной и вторичной ТН, и результаты были показаны в.
Таблица 3.
Сравнение различных степеней дисфункции правого желудочка, дисфункции ЛЖ и степени тяжести гипертонии у пациентов с первичным и вторичным TR
| Трикуспидальная регургитация | первичная регургитация = 226) | Среднее (n = 133) | ||||
|---|---|---|---|---|---|---|
| LV a дисфункция | 0.90 | |||||
| Нормальный | 89 (39,4%) | 51 (39,1%) | ||||
| Мягкий | 56 (24,8%) | 34 (25,6%) | 9038 51 (22,6%) | 25 (18,8%) | ||
| Тяжелая | 30 (13,3%) | 22 (16,6%) | ||||
| RV a дисфункция | <0.001 | |||||
| Нормальный | 13 (5,8%) | 2 (1,5%) | ||||
| Легкий | 47 (20,8%) | 16 (12,0%) | ||||
| 63 (48,1%) | ||||||
| Тяжелая | 42 (18,6%) | 51 (38,3%) | ||||
| PAH a | <0.001 | |||||
| Нормальный | 27 (11,9%) | 0 (0%) | ||||
| Легкий | 84 (37,2%) | 0 (0%) | ||||
| Средний 104 (46% 0) | 21 (15,8%) | |||||
| Тяжелая | 11 (4,8%) | 111 (84,2%) | ||||
Пациенты также были разделены на 2 группы по по их полу; 270 женщин и 88 мужчин.Различные переменные сравнивались между двумя группами, и результаты были продемонстрированы в.
Таблица 4.
Сравнение различных переменных между пациентами мужского и женского пола
| Пол | Значение P | ||||
|---|---|---|---|---|---|
| Мужчина (n = 88) | Женщина (n = | ) | |||
| Признак сердечной недостаточности | |||||
| сердцебиение | 17 (19.3%) | 52 (19,2%) | 0,979 | ||
| усталость | 30 (34,1%) | 78 (28,8%) | 0,345 | ||
| DOE a | 9040%183 (67,5%) | 0,633 | |||
| Боль в груди | 10 (11,4%) | 27 (10,0%) | 0,715 | ||
| хрипов | 14 (15,940%) 41409 %) | 0,880 | |||
| отек | 31 (35.2%) | 65 (24,0%) | 0,038 | ||
| асцит | 14 (15,9%) | 33 (12,2%) | 0,367 | ||
Повышенный JVP 9 | 19% ) | 51 (18,8%) | 0,569 | | ||
| Аритмия | |||||
| предсердный | 58 (65,9%) | 201 (74,2%) | 0,133 | ||
| желудочковый | 0 (0%) | 4%) | 0,568 | ||
| ЭКГ a отклонение от нормы | |||||
| RBBB a | 6 (6,8%) | 26 (9,6%) | 0,427 | ||
| RVH a | 1 (1,1%) | 1 (1,1%) | (2,2%) | ||
| Смерть | 4 (4,5%) | 8 (3,0%) | 0,470 | ||
| Причина смерти | |||||
| Несердечный | 1 (25%) | 0 (0%) | |||
| Сердечный (RHF) | 0 (0%) 6 (75406) | ||||
| Сердечный (без RHF a ) | 3 (75%) | 2 (25%) | 0.030 | ||
| Повторная госпитализация | |||||
| Всего | 14 (16,5%) | 35 (13,2%) | 0,443 | ||
| HF | 9 (31,0%) | 0,7 | |||
| Средняя выживаемость с момента постановки диагноза (лет) | 4,02 ± 3,450 | 4,45 ± 3,728 | 0,469 | ||
| Средняя выживаемость с момента появления симптомов (лет) | 2.02 ± 1,137 | 2,37 ± 1,489 | 0,392 | ||
| Прием диуретиков | 59 (67,8%) | 187 (69,0%) | 0,835 | ||
На основании результатов была выявлена значительная разница между мужчинами и женщинами в отношении тяжести TR после хирургического вмешательства (значение p: 0,021 ), кроме того, более тяжелая TR была значительно больше у мужчин, чем у женщин. Не было значительных различий между случаями сопутствующего поражения клапанов у мужчин и женщин.Однако между двумя группами наблюдалась значительная разница в отношении симптомов сердечной недостаточности; следовательно, частота отеков была значительно выше у мужчин, чем у женщин (значение p: 0,038). Различные степени дисфункции правого желудочка, дисфункции ЛЖ и тяжести гипертонии ЛА также сравнивались между двумя группами, и была выявлена значительная разница между двумя группами в основе дисфункции ЛЖ (значение p <0,001). Однако не было значительных различий между 2 группами в отношении дисфункции правого желудочка и тяжести гипертонии ПА (p-значение: 0.250 и p-значение: 0,514 соответственно) ().
Таблица 5.
Сравнение различных степеней дисфункции правого желудочка, дисфункции ЛЖ и тяжести гипертонии у пациентов мужского и женского пола
| Пол | Значение P | ||||||
|---|---|---|---|---|---|---|---|
| Мужской (n = ) | Женский (n = 271) | ||||||
| LV a Дисфункция | <0.001 | ||||||
| Нормальный | 17 (19,3%) | 123 (45,8%) | |||||
| Мягкий | 20 (22,7%) | 70 (25,8%) | 9040 24 (27,3%) | 52 (19,2%) | |||
| Тяжелая | 27 (30,7%) | 25 (9,2%) | |||||
| RV a Дисфункция | 0.250 | ||||||
| Нормальный | 7 (8,0%) | 8 (3,0%) | |||||
| Мягкий | 13 (14,8%) | 50 (18,5%) | |||||
| 149 (55,4%) | |||||||
| Тяжелая | 30 (34,1%) | 63 (23,3% 0) | |||||
| PAH a | 0,514 | ||||||
| Нормальный | 10 (11.4%) | 17 (6,3%) | |||||
| Легкий | 22 (25,0%) | 62 (22,9%) | |||||
| Средний | 26 (29,5%) 99 (36,5%) | %) | |||||
| Тяжелая | 30 (34,1%) | 92 (34,4%) | |||||
5. Обсуждение
Наше исследование показало, что значительный TR не следует рассматривать как доброкачественный. Тяжелая ТР связана с более высокими показателями смертности и госпитализаций, независимо от возраста, пола, систолической функции бивентрикулов и легочной гипертензии.Заболеваемость ревматической лихорадкой снизилась в промышленно развитых странах с 1950-х годов, но в развивающихся странах она остается эндемическим заболеванием (11). ТР долгое время игнорировали из-за того, что считали это редким и клинически незначимым заболеванием. Было проведено несколько исследований, посвященных этому важному вопросу. Таким образом, в этом исследовании мы подтвердили, что исход пациентов со значительным TR отрицательно влияет на выживаемость и качество жизни пациентов. Хирургическое лечение функциональной ТР может быть легко выполнено; однако частота послеоперационной заболеваемости и смертности высока.С другой стороны, восстановление трехстворчатого клапана у пациентов с ревматическим заболеванием клапана может быть выполнено с приемлемыми ранними результатами, но прогрессирование ревматической болезни связано с высокой частотой клапанной дисфункции и летальным исходом в долгосрочной перспективе (12).
Наше исследование показало, что наиболее сопутствующим пороком клапанов в нашей исследуемой группе был митральный ревматический порок без существенной разницы между мужчинами и женщинами, что было аналогично другим исследованиям. Тарамассо М., Ширан А. и др., также пришли к выводу в своем исследовании, что распространенность тяжелой TR у пациентов с заболеванием MV высока. Более 30% пациентов с дегенеративной митральной регургитацией имеют TR ≥ 2+ во время митральной операции, и до одной трети пациентов со значительным митральным стенозом имеют TR от умеренной до тяжелой (7, 13). Смертность в основном наступила из-за правосторонней сердечной недостаточности без существенной разницы между случаями у мужчин и женщин. У больных была чаще всего фибрилляция предсердий (70,5%). Аналогичные результаты были получены в исследовании Kim YJ et al., В котором 50 случаев из 61 пациента в их исследуемой группе (82%) имели фибрилляцию предсердий (2).В нашем исследовании распространенность аномалий ЭКГ существенно не различалась между мужчинами и женщинами.
Из общего числа у 141 случая была нормальная функция ЛЖ, и в большинстве случаев наблюдалась умеренная дисфункция ПЖ и тяжелая ЛАГ. В исследовании Nath J et al. О дисфункции правого желудочка сообщалось у 61% пациентов с тяжелой ТН (1). Основной причиной госпитализации в 90 случаях была сердечная недостаточность. Среди них 14% случаев, а среди пациентов с правосторонней сердечной недостаточностью 36,8% пациентов были госпитализированы повторно в течение 6 месяцев наблюдения.246 случаев (68,7%) наших пациентов получали диуретики со значительным улучшением симптомов сердечной недостаточности. Пациенты также были разделены на 2 группы; первичный TR и вторичный TR без существенной разницы между ними. Большинство пациентов как в первичной, так и в вторичной группах TR имели нормальную функцию ЛЖ и умеренную дисфункцию ПЖ. Легкая ЛАГ чаще всего выявлялась при первичной ТР; однако распространенность тяжелой ЛАГ была значительно выше в случаях со вторичной ТР. Пациенты с тяжелой ТР, перенесшие изолированную ТВ-операцию, обычно имеют плохой исход с высокой периоперационной летальностью, плохой поздней выживаемостью и отсутствием значительного улучшения функциональных возможностей у многих из них (14-17).Несмотря на рекомендации и недавние данные, которые поддерживают проактивный подход к хирургическому восстановлению TR во время операции на митральном клапане, восстановление трикуспидального клапана в настоящее время используется недостаточно (18). Очевидно, что пациентам с тяжелой TR во время операции на МК следует отремонтировать телевизор во время первоначальной операции на МК, и, учитывая плохой прогноз для нелеченых пациентов с тяжелой TR, мы рекомендуем ремонт или замену телевизора до того, как симптомы станут явными в этих случаях. пациенты.
Наблюдается значительный рост смертности, госпитализации и повторной госпитализации у симптомных пациентов с тяжелой ТР.Следовательно, более агрессивный подход к восстановлению или замене ТВ у этих пациентов, независимо от ДЛА и систолической функции, может привести к лучшим результатам. Однако рекомендации по ремонту или замене трехстворчатого клапана без учета функции правого желудочка и ПАП лучше отложить до того времени, когда в этой области будут выполнены подходящие интервенционные исследования. Это исследование можно использовать не только как документальный фильм, но и как основу для дальнейших исследований.
5.1. Ограничения исследования
Настоящие результаты следует интерпретировать с учетом некоторых ограничений исследования, таких как низкий уровень общей смертности. Наше исследование не проводилось в течение длительного периода наблюдения, так как средний год наблюдения составил 1,9 года (6-32 месяца). Необходимы дополнительные исследования с большей популяцией и более длительным периодом наблюдения.
Footnotes
Значение для политики / практики / исследований / медицинского образования в области здравоохранения: Для оценки результатов лечения пациентов с тяжелой TR с гипотезой о том, что значительный TR отрицательно влияет на качество жизни и выживаемость, независимо от давления в легочной артерии (PAP) и фракция выброса левого желудочка (ФВЛЖ).
Цитируйте этот документ как: Садехпур А., Хассанзаде М., Кьявар М., Бахшандех Н., Надери Н., Гадрдуст Б. и др. Влияние тяжелой трикуспидальной регургитации на долгосрочную выживаемость. Рес Cardiovasc Med.2013; 2 (3): 121-6. DOI: 10.5812 / cardiovascmed.10686
Вклад авторов: Все авторы внесли интеллектуальный вклад в подготовку рукописи, и рукопись была одобрена всеми авторами.
Раскрытие финансовой информации: Все авторы внесли свой интеллектуальный вклад в подготовку рукописи, и рукопись была одобрена всеми авторами.
Финансовая поддержка: Авторы заявляют, что финансовая информация не раскрывается.
Ссылки
1. Нат Дж., Фостер Э., Хайденрайх, Пенсильвания. Влияние трикуспидальной регургитации на долгосрочную выживаемость. J Am Coll Cardiol. 2004. 43 (3): 405–9. DOI: 10.1016 / j.jacc.2003.09.036. [PubMed] [CrossRef] [Google Scholar] 2. Ким Й.Дж., Квон Д.А., Ким Х.К., Пак Дж.С., Хан С., Ким К.Х. и др. Детерминанты хирургического результата у пациентов с изолированной трикуспидальной регургитацией. Тираж. 2009. 120 (17): 1672–8.DOI: 10.1161 / CIRCULATIONAHA.109.849448. [PubMed] [CrossRef] [Google Scholar] 3. Chang BC, Song SW, Lee S, Yoo KJ, Kang MS, Chung N. Восьмилетние результаты трикуспидальной аннулопластики с использованием аутологичной полоски перикарда для функциональной трикуспидальной регургитации. Ann Thorac Surg. 2008. 86 (5): 1485–92. DOI: 10.1016 / j.athoracsur.2008.07.007. [PubMed] [CrossRef] [Google Scholar] 4. Роджерс Дж. Х., Боллинг С. Ф. Трикуспидальный клапан: современные перспективы и новые методы лечения трикуспидальной регургитации. Тираж. 2009. 119 (20): 2718–25.DOI: 10.1161 / CIRCULATIONAHA.108.842773. [PubMed] [CrossRef] [Google Scholar] 5. Сингх С.К., Тан Г.Х., Маганти, доктор медицины, Армстронг С., Уильямс В.Г., Дэвид Т.Э. и др. Среднесрочные результаты восстановления трикуспидального клапана по сравнению с заменой при органической болезни трикуспидального клапана. Ann Thorac Surg. 2006. 82 (5): 1735–41. DOI: 10.1016 / j.athoracsur.2006.06.016. [PubMed] [CrossRef] [Google Scholar] 6. Берналь Дж. М., Моралес Д., Ревуэльта С., Льорка Дж., Гутьеррес-Морлоте Дж., Ревуэльта Дж. М.. Повторные операции после восстановления трикуспидального клапана. J Thorac Cardiovasc Surg.2005. 130 (2): 498–503. DOI: 10.1016 / j.jtcvs.2004.12.044. [PubMed] [CrossRef] [Google Scholar] 7. Taramasso M, Vanermen H, Maisano F, Guidotti A, La Canna G, Alfieri O. Растущее клиническое значение вторичной трикуспидальной регургитации. J Am Coll Cardiol. 2012. 59 (8): 703–10. DOI: 10.1016 / j.jacc.2011.09.069. [PubMed] [CrossRef] [Google Scholar] 8. Боноу Р.О., Манн Д.Л., Зипес Д.П., Болезнь сердца Либби П. Браунвальд: Учебник сердечно-сосудистой медицины, набор из 2-х томов. 2011. [Google Scholar] 9. Розенхек Р., Зильбершак Р., Шемпер М., Черни М., Мундиглер Г., Граф С. и др.Естественная история очень тяжелого стеноза аорты. Тираж. 2010. 121 (1): 151–6. DOI: 10.1161 / CIRCULATIONAHA.109.894170. [PubMed] [CrossRef] [Google Scholar] 10. Blase A, Carabello BA, Chatterjee K, de Leon AC, Jr, Faxon DP, Freed MD, et al. Рекомендации ACC / AHA 2006 по ведению пациентов с пороками клапанов сердца: отчет Целевой группы Американского колледжа кардиологов / Американской кардиологической ассоциации по практическим рекомендациям (написание Комитета по пересмотру рекомендаций 1998 года по ведению пациентов с пороками клапанов сердца) разработан в сотрудничестве с Обществом сердечно-сосудистых анестезиологов, одобрен Обществом сердечно-сосудистой ангиографии и вмешательств и Обществом торакальных хирургов.J Am Coll Cardiol. 2006; 48 (3): e1–148. DOI: 10.1016 / j.jacc.2006.05.021. [PubMed] [CrossRef] [Google Scholar] 11. Оливье С. Ревматическая лихорадка — это все еще проблема? J Antimicrob Chemother. 2000; 45 Suppl: 13–21. [PubMed] [Google Scholar] 12. Sarralde JA, Bernal JM, Llorca J, Ponton A, Diez-Solorzano L, Gimenez-Rico JR и др. Ремонт ревматической болезни трикуспидального клапана: предикторы очень долгосрочной смертности и повторной операции. Ann Thorac Surg. 2010. 90 (2): 503–8. DOI: 10.1016 / j.athoracsur.2010.03.105. [PubMed] [CrossRef] [Google Scholar] 13.Ширан А., Саги А. Трикуспидальная регургитация в заболеваемости митральным клапаном, прогностические последствия, механизм и лечение. J Am Coll Cardiol. 2009. 53 (5): 401–8. DOI: 10.1016 / j.jacc.2008.09.048. [PubMed] [CrossRef] [Google Scholar] 14. Mangoni AA, DiSalvo TG, Vlahakes GJ, Polanczyk CA, Fifer MA. Результат после изолированного протезирования трикуспидального клапана. Eur J Cardiothorac Surg. 2001. 19 (1): 68–73. [PubMed] [Google Scholar] 15. Санфелиппо ПМ, Джулиани Э.Р., Дэниэлсон Г.К., Уоллес Р.Б., Плут-младший, МакГун, округ Колумбия.Протезирование трехстворчатого клапана. Ранние и поздние результаты с протезом Старра-Эдвардса. J Thorac Cardiovasc Surg. 1976 г., 71 (3): 441–5. [PubMed] [Google Scholar] 16. King RM, Schaff HV, Danielson GK, Gersh BJ, Orszulak TA, Piehler JM и др. Операция по поводу трикуспидальной регургитации на поздних сроках после замены митрального клапана. Тираж. 1984; 70 (3 Pt 2): I193–7. [PubMed] [Google Scholar] 17. Квон Д.А., Пак Дж.С., Чанг Х.Дж., Ким Й.Дж., Сон Д.В., Ким К.Б. и др. Прогнозирование исхода у пациентов, перенесших операцию по поводу тяжелой трикуспидальной регургитации после операции на митральном клапане, и роль систолической скорости трикуспидального кольца.Am J Cardiol. 2006. 98 (5): 659–61. DOI: 10.1016 / j.amjcard.2006.03.047. [PubMed] [CrossRef] [Google Scholar] 18. Ваганян А., Баумгартнер Х., Бакс Дж., Бутчарт Э., Дион Р., Филиппатос Г. и др. Руководящие принципы ведения клапанной болезни сердца: Целевая группа по лечению клапанной болезни сердца Европейского общества кардиологов. Eur Heart J. 2007; 28 (2): 230–68. DOI: 10,1093 / eurheartj / ehl428. [PubMed] [CrossRef] [Google Scholar]эталонных диапазонов и детерминант скорости трикуспидальной регургитации у здоровых взрослых, оцененных с помощью двумерной допплер-эхокардиографии — FullText — Дыхание 2018, Vol.96, № 5
Аннотация
Справочная информация: Скорость трехстворчатой регургитации (TRV) является наиболее широко используемым параметром трансторакальной эхокардиографии (TTE) при оценке пациентов с подозрением на легочную гипертензию (PH). Цели: Изучить физиологический диапазон TRV у здоровых взрослых и изучить его клинические детерминанты. Методы: В первой части исследования участвовало 614 здоровых лиц (возраст 45.7 ± 14,7 лет, 60,26% женщин) были проспективно оценены с помощью TTE. Во второй части был проведен объединенный метаанализ 16 уже опубликованных исследований со значениями TRV у здоровых субъектов ( n = 981). Статистический анализ включал расчет 95% квантилей для определения референсных диапазонов. Результаты: В проспективно включенной когорте среднее значение TRV составило 2,01 ± 0,29 м / с (5–95% ДИ 1,987–2,033 м / с). Это было значимо, но слабо положительно коррелировало с возрастом, индексом массы тела, систолическим артериальным давлением, диастолическим артериальным давлением, объемом левого предсердия и отрицательным — с соотношением Е / А митрального притока.Существенных различий между самцами и самками не обнаружено. Проспективно зарегистрированные данные выявили значения, аналогичные значениям, полученным в наборах данных, основанных на литературе, что привело к среднему TRV 1,96 м / с (95% доверительный интервал 1,91–2,02 м / с) и 95% квантилю 2,55 м / с. Выводы: Насколько нам известно, это самый большой набор данных для описания референсных диапазонов TRV и их клинических детерминант в здоровых взрослых годах. Определенное пороговое значение 2,55 м / с этого исследования должно быть подтверждено для конкретных патологий, таких как пациенты с риском ЛГ.
© 2018 S. Karger AG, Базель
Введение
Легочная гипертензия (ЛГ) встречается при многих различных заболеваниях и определяется как повышение среднего легочного артериального давления (PAPm) на ≥25 мм рт.ст. по данным катетеризации правых отделов сердца (RHC) [1]. Последние данные показали, что нормальное ДПАД в покое составляет 14 + 3 мм рт. Ст. С верхним пределом нормы примерно 20 мм рт. Ст. [2]. В новых совместных рекомендациях европейских обществ респираторной медицины и кардиологии по диагностике и лечению ЛГ трансторакальная цветная допплерэхокардиография (ТТЭ) играет центральную роль в диагностике [1, 3, 4].Его следует использовать для визуализации воздействия ЛГ на сердце и оценки систолического давления в легочной артерии с помощью непрерывных измерений Доплера. Руководства Европейского общества кардиологов (ESC) / Европейского респираторного общества (ERS) рекомендуют классифицировать вероятность ЛГ на основе скорости трикуспидальной регургитации (TRV) в состоянии покоя как высокую (≥3,5 м / с), промежуточную (2,9–3,4 м / с). ) или низкий (≤2,8 м / с), а также наличие дополнительных эхокардиографических переменных, которые предполагают ЛГ [1]. На основании этих эхокардиографических параметров и дальнейших клинических данных необходимо принять решение о необходимости проведения РКЗ.
Эхокардиография всегда должна выполняться при подозрении на ЛГ или у пациентов с ЛГ при последующих оценках [1, 3, 5, 6]. В этом отношении TRV — это хорошо зарекомендовавший себя и наиболее широко используемый параметр TTE для неинвазивного определения легочного давления [7]. Однако пороговые значения, предложенные в текущих рекомендациях ESC / ERS для определения вероятности ЛГ, являются более или менее произвольными и еще не были научно оценены или подтверждены для ЛГ [3, 4, 8]. Ретроспективные данные большой когорты пациентов с высокой вероятностью до теста показывают, что в опытных руках определение систолического давления в легочной артерии с помощью TRV и расчетное давление в правом предсердии (RAP) хорошо коррелировали с инвазивно измеренными значениями ( r = 0.87) и, когда использовался предложенный предел (36 мм рт. Ст.), Он имел специфичность 79% и чувствительность 87% для определения ЛГ [9]. Однако в рутинной клинической практике в отдельных случаях могут встречаться большие отклонения, и только у 90% пациентов с ЛГ была трикуспидальная регургитация [10]. Более того, физиологический спектр TRV у здоровых людей остается неясным. Целью этого исследования было изучить полный диапазон TRV в большой когорте здоровых взрослых и выполнить метаанализ всех ранее сообщенных нормальных значений, чтобы определить пороговые значения TRV.Кроме того, мы хотим определить клинические детерминанты значений TRV.
Методы
В первой части этого исследования мы проспективно оценивали последовательных здоровых добровольцев или здоровых субъектов, направляемых для оценки трудоспособности путем клинического обследования, как описано ранее [11-13]. Действительно, больница «Кава-де-Тиррени и побережье Амальфи» отвечает за оценку пригодности для работы в этом районе. Обследования включали анкету по истории болезни, использованию лекарств, факторам риска сердечно-сосудистых заболеваний и привычкам образа жизни (потребление алкоголя, курение, физическая активность).Физические осмотры (рост, вес, частота сердечных сокращений [ЧСС] и артериальное давление [АД]) и клинические оценки проводились в соответствии со стандартными протоколами обученным и сертифицированным персоналом (F.F. и E.B.). Площадь поверхности тела (BSA) рассчитывали по формуле Дюбуа (BSA = 0,20247 × рост [м] 0,725 × вес [кг] 0,425 ). Критериями исключения были ишемическая болезнь сердца, системная артериальная гипертензия, сахарный диабет, значительные (как минимум умеренные) пороки клапанов сердца, врожденные пороки сердца, застойная сердечная недостаточность, кардиомиопатии, синусовая тахикардия, фибрилляция или трепетание предсердий, употребление запрещенных препаратов, элитные спортсмены и т. Д. неадекватное качество эхокардиографического изображения [14].Три измерения АД были получены сфигмоманометром на правой руке, и результаты были усреднены для определения систолического и диастолического АД. Пульсовое давление рассчитывалось как разность плечевого систолического и диастолического АД. Ни у одного из субъектов не было сердечно-сосудистых структурных или функциональных аномалий, и ни у одного из них не было лекарств.
Во второй части исследования был проведен систематический поиск литературы и объединенный метаанализ. Исследование было одобрено этическим советом учреждения, и участники получили информированное согласие.Работа выполнена в соответствии с этическим кодексом Всемирной медицинской ассоциации (Хельсинкская декларация).
TTE-обследования были выполнены с использованием имеющегося в продаже оборудования (Vivid 7 — GE Healthcare, Милуоки, Висконсин, США), как описано ранее [15]. Конкретные виды включали парастернальные виды по длинной и короткой оси, апикальные 4-, 2- и 3-камерные (CH) виды и подреберные виды, включая респираторный коллапс нижней полой вены. Импульсный и непрерывный допплеровский опрос проводился на всех 4 сердечных клапанах.Изображения были записаны в цифровом виде, а затем проанализированы двумя независимыми наблюдателями (F.F. и L.C.) с использованием автономного программного обеспечения (EchoPAC — Clinical Workstation Software — GE Healthcare, Милуоки, Висконсин, США). Все измерения были выполнены в соответствии с рекомендациями по эхокардиографической оценке левого и правого сердца Американского общества эхокардиографии / Европейской ассоциации сердечно-сосудистой визуализации, доступными в период регистрации (июнь 2007 г. — февраль 2014 г.), как сообщалось ранее [12, 14 , 16, 17].
Принимая во внимание, что измерения TRV зависят от угла, TRV оценивался из нескольких ракурсов в поисках наилучшего конверта и максимальной скорости. Пиковое значение TRV измерялось по спектральному профилю струи трикуспидальной регургитации в проекции притока правого желудочка (ПЖ) в парастернальной длинной оси, парастернальной короткой оси или апикальной 4-камерной проекции. Были приняты меры для обеспечения наилучшего согласования между потоком регургитации и скоростью доплеровского сигнала.Для расчета TRV использовалась самая высокая транс-клапанная скорость [14].
TRV представлено как среднее ± стандартное отклонение. Нормальное распределение непрерывных значений оценивали с помощью критерия Колмогорова-Смирнова. Переменные между мужчинами и женщинами сравнивались с помощью двустороннего непарного теста t . В качестве верхнего порогового значения для нормального TRV для женщин и мужчин мы использовали 95% квантиль. Частичная корреляция (Пирсон) использовалась для оценки одномерных отношений. Переменные были выбраны в соответствии с их клинической значимостью и потенциальным влиянием на TRV.TRV также анализировался в соответствии с возрастными классами (<30, 31-50, 51-70 и> 70 лет) и классами ИМТ (<18, 18-25, 25-30 и> 30 кг / м 2 ). с ANOVA. Графики Бланда-Альтмана использовались для построения разницы между двумя наблюдениями в сравнении со средним значением наблюдений для выявления общей систематической ошибки, а также систематической вариации с увеличением измерения TRV, как описано в другом месте [18]. Вариабельность между наблюдателями изучалась с использованием парных тестов t и коэффициентов внутриклассовой корреляции (ICC) в 100 случайно выбранных случаях.ICC> 0,8 указывает на хорошее согласие. Анализы проводил биометрический специалист (N.B.).
Это исследование было разработано в соответствии с Положением о предпочтительных элементах отчетности для систематических обзоров и метаанализов [19]. Систематический поиск литературы проводился с использованием Medline, Scopus, ISI Web of Sciences и Cochrane Database для исследований, опубликованных в период с января 1985 г. по апрель 2017 г., в которых сообщалось об эхокардиографических измерениях TRV у здоровых субъектов. В метаанализ были включены только записи на английском языке с абсолютными значениями TRV.Исследования с неясными эхокардиографическими методами или статусом субъектов были исключены. Исследования были обозначены следующими заголовками: «правое сердце», «правый желудочек», «скорость трикуспидальной регургитации», «систолическое давление в легочной артерии», «эхокардиография», «эхокардиограмма», «эхокардиограмма», «допплер», «ультразвук». в сочетании со словами «здоровые», «здоровые люди», «здоровые субъекты», «вменяемые», «контрольная группа», «контроль». Поскольку в литературе представлены только агрегированные данные, а именно средние значения, стандартное отклонение и размер выборки, для оценки 95% перцентилей и соответствующих 5–95% доверительных интервалов использовались объединенные средние TRV и объединенные SD.Среднее значение, 5–95% ДИ и 95% были взвешены в соответствии с размером выборки. Чтобы проанализировать влияние отдельных исследований на объединенную оценку, был проведен анализ чувствительности, исключая одно исследование за раз, вычисляя объединенные оценки с остальными исследованиями [13]. Все статистические анализы были выполнены с использованием SPSS, версия 21 (Чикаго, Иллинойс, США).
Результаты
Проспективное исследование
С июня 2007 г. по март 2017 г. выборка из 675 здоровых субъектов была проспективно и последовательно изучена TTE в отделении кардиологии «Кава-де-Тиррени-Амальфитанское побережье» кардиологического отделения университетской больницы Салерно, Италия.Среди них 61 субъект (9%) был исключен из-за TRV, который не подлежал оценке. В последнюю когорту исследования вошли 614 здоровых лиц (средний возраст 45,73 ± 14,67 лет, диапазон 18–88 лет; 370 [60,26%] женщин; таблица 1). По сравнению с мужчинами женщины были старше, имели меньшие размеры тела (ППТ и ИМТ), более низкое систолическое и диастолическое АД и более высокое ЧСС (Таблица 1).
Таблица 1.
Демографические характеристики исследуемой популяции
Мужчины имели более высокие размеры правого и левого желудочка (ЛЖ), о чем свидетельствуют более высокие значения конечно-диастолического и конечно-систолического объемов ЛЖ, массы ЛЖ и диаметров ПЖ.С другой стороны, не было зарегистрировано различий в фракции выброса ЛЖ, диастолической функции ЛЖ и систолической экскурсии плоскости трикуспидального кольца между мужчинами и женщинами (таблица 2).
Таблица 2.
Размер и функция левого и правого сердца
TRV показало нормальное распределение (2,00 ± 0,29 м / с, 5–95% ДИ 1,98–2,03 м / с, диапазон 1,10–2,85 м / с; Рис. . 1). Никаких различий ( p = 0,615) не было обнаружено между мужчинами (2,01 ± 0,31 м / с) и женщинами (2,00 ± 0,27 м / с). В однофакторном анализе TRV достоверно, но слабо положительно коррелировал с систолическим АД ( r = 0.151, p = 0,0001), диастолическое АД ( r = 0,095, p = 0,018) и объем ЛП ( r = 0,097, p = 0,02). TRV отрицательно и слабо коррелировал с соотношением E / A митрального притока ( r = –0,109, p = 0,007). TRV значительно варьировала в зависимости от возрастных классов ( p = 0,002; рис. 2) и ИМТ ( p = 0,001, данные не показаны). Анализ Бланда-Альтмана (рис. 3) дал среднюю разницу 0,0106 м / с (5–95% ДИ –0,14 до 0.16 м / с). Анализ вариабельности между наблюдателями выявил ICC 0,959 для одного показателя (5–95% ДИ 0,940–0,973) и 0,979 для среднего показателя (5–95% ДИ 0,969–0,989).
Рис. 1.
Распределение скорости трикуспидальной регургитации (TRV) в проспективно включенной когорте.
Рис. 2.
Скорость трикуспидальной регургитации (TRV) в зависимости от возрастных категорий.
Рис. 3.
График Блэнда Альтмана оценки скорости трикуспидальной регургитации (TRV) между двумя операторами.Красная толстая линия представляет собой среднюю разницу, а красные тонкие линии представляют 95% доверительного интервала. Синие тонкие линии представляют пределы согласия (5–95% ДИ).
Мета-анализ ранее опубликованных исследований, объединенный с проспективно собранными данными
В таблице 3 приводится описание 16 исследований, обнаруженных в медицинской литературе, в которых приводятся значения TRV у здоровых субъектов. Из 5 389 записей, обнаруженных при скрининге базы данных Medline и Cochrane на наличие TRV с использованием вышеупомянутых ключевых слов, было идентифицировано 90 полнотекстовых статей.Семьдесят четыре статьи были исключены по нескольким причинам (в основном потому, что значения TRV не были указаны). Всего было идентифицировано 16 статей, опубликованных в период с 1992 по 2016 гг. (Рис. 4) [10, 20-34]. Объединенный анализ ранее опубликованных исследований и текущей когорты включал в общей сложности 1595 субъектов. Корреляционный анализ возраста и BSA или анализ различий между полом и тренировочным статусом был невозможен, потому что были даны только средние значения TRV, а в литературе не сообщалось об анализе детерминант.Во всех исследованиях субъекты были классифицированы как здоровые и не страдающие сердечно-сосудистыми заболеваниями. В большинстве исследований выполнялись рентген грудной клетки, электрокардиограммы и физикальное обследование для исключения сердечно-сосудистых или респираторных заболеваний. В целом, испытуемым было от 18 до 80 лет. Размер выборки варьировался от 14 до 230 субъектов на одно исследование. Все исследования, кроме одного [21], включали пациентов обоих полов. На рисунке 5 показаны 95% квантили и доверительные интервалы TRV ранее опубликованных исследований и наших проспективных данных.Объединенные данные дали средневзвешенное значение TRV 1,96 м / с (95% доверительный интервал 1,90–2,01 м / с) и 95% квантиль 2,55 м / с (95% доверительный интервал 1,90–2,01 м / с).
Таблица 3.
Объединенные исследования, показывающие значения TRV у здоровых субъектов
Рис. 4. Блок-схема
PRISMA 2009. TRV, скорость трикуспидальной регургитации.
Рис. 5.
Лесной график объединенных данных относительно скорости трикуспидальной регургитации (TRV) у здоровых субъектов. Лесной график представляет 95% квантиль TRV и диапазон 95% доверительных интервалов наших проспективных данных и предыдущих публикаций, выбранных для объединенного анализа.Большее значение в нижней части графика показывает взвешенный объединенный доверительный интервал для 95% квантиля TRV (2,55 м / с).
Влияние каждого исследования анализировали, исключая одно исследование за раз. Если бы данные текущего исследования были исключены из объединенного анализа, пороговое значение было бы немного выше (95% квантиль: 2,59 м / с; 95% ДИ 1,86–2,02 м / с). Оценки без исключения для 95% квантилей варьировались от 2,53 до 2,68 м / с. У трех из 614 проспективно включенных субъектов показатель TRV был выше 2.8 м / с, что является пороговым значением, рекомендованным действующими руководящими указаниями. Аналогичные результаты были получены при исключении этих пациентов (данные не показаны).
Обсуждение
Насколько нам известно, текущий отчет представляет собой самый большой набор данных, касающихся TRV у здоровых людей. Главный вывод состоит в том, что 95% квантиль TRV в здоровой популяции соответствует 2,55 м / с, что ниже текущего порогового значения 2,8 м / с, предложенного руководящими принципами PH [1].
TRV широко используется в повседневной клинической практике, учитывая его линейную положительную корреляцию с sPAP при отсутствии обструкции выходного тракта правого желудочка и / или стеноза клапана легочной артерии, по формуле Бернулли (4 × [TRV] 2 + RAP) [ 3, 35, 36].Точность и прецизионность оценки легочного давления с помощью TTE в отношении измерений RCH были исследованы D’Alto et al. [7] из 161 пациента обратились в эхо-лабораторию с подозрением на ЛГ. По словам Д’Алто и его коллег, TTE позволяет точно измерить легочное давление (смещение и доверительные интервалы: ± 3 мм рт. Ст., ± 5 мм рт. предел + SD: +19 и –18 мм рт. ст. для mPAP соответственно и +8 и –12 мм рт. индивидуальная диагностика ЛГ [7].В свете всех этих аспектов текущие совместные рекомендации ESC / ERS по ЛГ [1], а также рекомендации Американского общества эхокардиографии по оценке правых полостей сердца [16], предлагают проводить TTE всякий раз, когда есть клиническое подозрение на ЛГ из-за крайняя важность ранней диагностики ЛГ, независимо от ее причины. Наряду с другими эхокардиографическими индексами и клиническими признаками в руководствах рекомендуется использовать абсолютное значение TRV, а не расчетное значение sPAP в качестве основного значения для определения эхокардиографической вероятности ЛГ [1].Действительно, они указывают на то, что диагноз ЛГ может быть исключен с высокой вероятностью для пациентов с TRV менее 2,8 м / с [1]. Ковач и др. [2] провели всесторонний систематический обзор 1187 человек из 47 исследований в 13 странах, чтобы определить нормальные значения легочного давления, оцененные RHC. В этом исследовании для sPAP был обнаружен верхний предел нормальности 29,6 мм рт. Согласно формуле Бернулли и допущению RAP, равному 5 мм рт. Ст., Верхний предел нормальности, предложенный в нашем текущем отчете (2.55 м / с) приведет к расчетному sPAP в 31,01 мм рт. Ст., Верхний предел очень близок к 29,6 мм рт. Ст., По данным Kovacs et al. [2]. Интересно, что наши результаты согласуются с результатами предыдущего проспективного исследования Grünig et al. [13], оценка 191 здорового человека из контрольной группы [22] и определение TRV в состоянии покоя 1,96 ± 0,25 м / с, что не коррелировало с полом [22]. McQuillan et al. [37] оценивали TRV ретроспективно на основе базы данных, явно не исключающей пациентов с ишемической болезнью сердца и / или легочными заболеваниями.В этом исследовании 95% верхний предел был эквивалентен TRV 2,61 м / с. Однако более высокие значения могут быть связаны с другой когортой, в которой оценивались госпитализированные пациенты.
В нашей проспективно включенной когорте TRV очень слабо положительно коррелировал с возрастом и ИМТ. Линейная связь между сердечным выбросом и ИМТ хорошо установлена, что позволяет предположить, что у субъектов с более высокой массой тела более высокий сердечный выброс и, следовательно, несколько более высокое давление в легких [38]. Однако наши данные и предыдущее проспективное исследование [22] не подтверждают это предположение, учитывая низкую корреляцию между BMI и TRV, которую мы обнаружили.Действительно, только 2,5% данных TRV можно объяснить возрастом.
Другими показателями, слабо коррелирующими с TRV, были артериальное АД, объем ЛП и диастолическая функция. Все эти параметры связаны с обратной передачей давления от левого желудочка в малый круг кровообращения [39]. Хотя размеры правых отделов сердца у здоровых взрослых людей различаются у мужчин и женщин [13, 15], у мужчин ПЖ [13] и РА [15] выше, чем у женщин, значения легочного давления одинаковы у мужчин и женщин в физиологических состояниях [2], хотя женщины более склонны к развитию ЛГ [40].Это может привести к предположению, что правые камеры сердца больше зависят от размера тела, чем TRV. Основываясь на всех этих выводах, можно предположить, что TRV является стабильным индексом, на который слабо влияют другие параметры и переменные. Это также верно с учетом зарегистрированной нами минимальной изменчивости внутри и между наблюдателями (рис. 3). Наше исследование имеет несколько ограничений.
Во-первых, корреляция между данными TTE и инвазивно оцененным легочным давлением не исследовалась.Однако было бы неэтично проводить такую инвазивную процедуру у здоровых людей без клинических показаний. Во-вторых, в нашу выборку не вошли люди с тяжелым ожирением: только 22 пациента из 614 (3,6%) умеренно страдали ожирением, с ИМТ> 30 кг / м 2 с самым высоким значением ИМТ 31,56 кг / м 2 . Однако аналогичные результаты были бы получены, если бы эти 22 субъекта с ИМТ выше 30 кг / м 2 были исключены из анализа (среднее TRV 1,95 м / с; 95% квантиль 2.57 м / с). Квантиль 95% использовался в качестве нормальных контрольных значений, поскольку самые большие 5% значений могут указывать на патологические процессы. Однако, если бы использовался процентиль 97,5%, контрольные значения изменились бы лишь незначительно (2,66 м / с).
В заключение, в текущем отчете представлены верхние физиологические пределы TRV в состоянии покоя и он может служить дополнительным пониманием неинвазивной оценки легочного давления в физиологических условиях. Значение порога 2,55 м / с для оценки риска ЛГ требует дальнейшего изучения, так как это может помочь выявить больше субъектов, которые склонны к развитию или уже имеют явную ЛГ.Более того, по нашим данным, TRV является надежным и стабильным индексом, без какого-либо клинического значимого влияния со стороны размера тела, возраста, пола и характеризуется высокой воспроизводимостью.
Заявление о раскрытии информации
Авторы заявляют, что у них нет конфликта интересов, о котором следует раскрывать.
Список литературы
- Galiè N, Humbert M, Vachiery JL, Gibbs S, Lang I., Torbicki A, et al: Руководство ESC / ERS 2015 по диагностике и лечению легочной гипертензии.Eur Heart J 2015; 46: ehv317.
- Ковач Г., Бергхольд А., Шейдл С., Ольшевски Х. Давление в легочной артерии во время отдыха и физических упражнений у здоровых субъектов: систематический обзор. Eur Respir J 2009; 34: 888–894.
- Bossone E, Dellegrottaglie S, Patel S, Grunig E, D’Andrea A, Ferrara F и др.: Мультимодальная визуализация при легочной гипертензии.Can J Cardiol 2015; 31: 440–459.
- Ковач Г., Думитреску Д., Барнер А., Грейнер С., Грюниг Е., Хагер А. и др.: Клиническая классификация легочной гипертонии и первоначальная диагностика: Empfehlungen der Kölner Konsensus Konferenz 2016. Dtsch Medizinische Wochenschrift 2016; 141: S10 – S18.
- Bossone E, D’Andrea A, D’Alto M, Citro R, Argiento P, Ferrara F и др.: Эхокардиография при легочной артериальной гипертензии: от диагноза к прогнозу. J Am Soc Echocardiogr 2013; 26: 1–14.
- Феррара Ф., Гаргани Л., Остенфельд Э., Д’Альто М., Каспрзак Дж., Вуальо Д. и др.: Визуализация правого отдела легочного кровообращения: выводы из передовых ультразвуковых методов.Эхокардиография 2017; 34: 1216–1231.
- Д’Альто М., Ромео Э., Ардженто П., Д’Андреа А., Вандерпул Р., Коррера А. и др.: Точность и точность эхокардиографии по сравнению с катетеризацией правых отделов сердца для оценки легочной гипертензии. Int J Cardiol 2013; 168: 4058–4062.
- Льюис Г.Д., Мерфи Р.М., Шах Р.В., Паппагианопулос П.П., Малхотра Р., Блох К.Д. и др.: Паттерны реакции легочных сосудов во время упражнений при систолической дисфункции левого желудочка позволяют прогнозировать способность к физической нагрузке и результаты. Circ Heart Fail 2011; 4: 276–285.
- Greiner S, Jud A, Aurich M, Hess A, Hilbel T, Hardt S, et al: Надежность неинвазивной оценки систолического давления в легочной артерии с помощью допплеровской эхокардиографии по сравнению с катетеризацией правых отделов сердца: анализ на большой популяции пациентов.J Am Heart Assoc 2014; 3: e001103 – e001103.
- Grünig E, Weissmann S, Ehlken N, Fijalkowska A, Fischer C, Fourme T. и др.: Стресс-допплеровская эхокардиография у родственников пациентов с идиопатической и семейной легочной артериальной гипертензией: результаты многоцентрового европейского анализа реакции давления в легочной артерии на упражнения и гипоксия.Тираж 2009 г .; 119: 1747–1757.
- Феррара Ф., Рудски Л.Г., Вриз О, Гаргани Л., Афилало Дж., Д’Андреа А. и др.: Физиологические корреляты систолической экскурсии плоскости трикуспидального кольца у 1168 здоровых субъектов. Int J Cardiol 2016; 223: 736–743.
- Марра А.М., Бенджамин Н., Феррара Ф., Вриз О, Д’Альто М., Д’Андреа А. и др.: Референсные диапазоны и детерминанты времени ускорения тракта оттока правого желудочка у здоровых взрослых с помощью двумерной эхокардиографии.Int J Cardiovasc Imaging 2017; 33: 219–226.
- Grünig E, Biskupek J, D’Andrea A, Ehlken N, Egenlauf B, Weidenhammer J, et al: Референсные диапазоны и детерминанты области правого желудочка у здоровых взрослых с помощью двумерной эхокардиографии. Дыхание 2015; 89: 284–293.
- Феррара Ф., Рудски Л.Г., Вриз О, Гаргани Л., Афилало Дж., Д’Андреа А. и др.: Физиологические корреляты систолической экскурсии плоскости трикуспидального кольца у 1168 здоровых субъектов. Int J Cardiol 2016; 223: 736–743.
- Груниг Э., Хенн П., Д’Андреа А., Клауссен М., Элкен Н., Майер Ф. и др.: Референсные значения и детерминанты области правого предсердия у здоровых взрослых с помощью двумерной эхокардиографии.Circ Cardiovasc Imaging 2013; 6: 117–124.
- Рудски Л.Г., Лай В.В., Афилало Дж., Хуа Л., Хандшумахер, доктор медицины, Чандрасекаран К. и др.: Рекомендации по эхокардиографической оценке правых отделов сердца у взрослых: отчет Американского общества эхокардиографии, одобренный Европейской ассоциацией эхокардиографии, a зарегистрированный филиал Европейского общества кардиологов и Канадского общества эхокардиографии.J Am Soc Echocardiogr 2010; 23: 685–713.
- Ланг Р.М., Бадано Л.П., Мор-Ави В., Афилало Дж., Армстронг А., Эрнанд Л. и др.: Рекомендации по количественной оценке камеры сердца с помощью эхокардиографии у взрослых: обновленные данные Американского общества эхокардиографии и Европейской ассоциации сердечно-сосудистой визуализации.J Am Soc Echocardiogr 2015; 28: 1–39.e14.
- Marra AM, Egenlauf B, Ehlken N, Fischer C, Eichstaedt C, Nagel C, Bossone E, Cittadini A, Halank M, Gall H, Olsson KM, Lange TJ и др .: Изменение размера и функции правого сердца в долгосрочной перспективе терапия риоцигуатом у пациентов с легочной артериальной гипертензией и хронической тромбоэмболической легочной гипертензией.Int J Cardiol 2015; 195: 19–26.
- Мохер Д., Либерати А., Тецлафф Дж., Альтман Д. Г.; PRISMA Group: Предпочтительные элементы отчетности для систематических обзоров и метаанализов: заявление PRISMA. PLoS Med 2009; 6: e1000097.
- Jobic Y, Slama M, Tribouilloy C, Lan Cheong Wah L, Choquet D, Boschat J и др.: Допплеровская эхокардиографическая оценка клапанной регургитации у здоровых добровольцев.Br Heart J 1993; 69: 109–113.
- Bossone E, Rubenfire M, Bach DS, Ricciardi M, Armstrong WF: Диапазон скорости трикуспидальной регургитации в покое и во время упражнений у нормальных взрослых мужчин: значение для диагностики легочной гипертензии. J Am Coll Cardiol 1999; 33: 1662–1666.
- Aessopos A, Farmakis D, Taktikou H, Loukopoulos D: Пиковый градиент систолического трикуспидального давления, определенный допплером, у людей с нормальной функцией легких и трикуспидальной регургитацией. J Am Soc Echocardiogr 2000; 13: 645–649.
- Bossone E, Avelar E, Bach DS, Gillespie B, Rubenfire M, Armstrong WF: Диагностическая ценность скорости трикуспидальной регургитации в состоянии покоя и параметров потока выброса правого желудочка для выявления легочной артериальной гипертензии, вызванной физической нагрузкой.Int J Card Imaging 2000; 16: 429–436.
- Алию З.Ы.Й. Гордюк В., Сачдев В., Бабадоко А., Мамман А.И., Акпанпе П. и др.: Распространенность и факторы риска систолической гипертензии легочной артерии среди пациентов с серповидно-клеточной анемией в Нигерии. Am J Hematol 2008; 83: 485–490.
- van Dijk J, Knaapen P, Bekkering I., Gotte MJ, Kamp O: Размеры и функция правого желудочка при изолированной блокаде левой ножки пучка Гиса: есть ли доказательства поражения бивентрикулов? Эхокардиография 2008; 25: 457–464.
- Махджуб Х., Леви Ф., Кассол М., Меймун П., Пельтье М., Русинару Д. и др.: Влияние возраста на систолическое давление в легочной артерии в состоянии покоя и во время физических упражнений у нормальных взрослых. Eur J Echocardiogr 2009; 10: 635–640.
- Sahin M, Sade LE, Tutuncu NB, Gursoy A, Kebapcilar L, Muderrisoglu H, et al: Систолическое давление в легочной артерии и эхокардиографические измерения у пациентов с эутиреоидным тиреоидитом Хашимото.J Endocrinol Invest 2009; 32: 530–532.
- Челик А, Коцигит I, Калапкорур Б, Коркмаз Х, Доганай Э, Эльчик Д. и др. Тенаскин-С может быть предиктором острой легочной тромбоэмболии. J Atheroscler Thromb 2011; 18: 487–893.
- Грапса Дж., Гиббс Дж. С., Кабрита И. З., Уотсон Г. Ф., Павлопулос Х, Доусон Д. и др.: Связь клинического исхода с ремоделированием правого предсердия и желудочка у пациентов с легочной артериальной гипертензией: исследование с трехмерной эхокардиографией в реальном времени.Eur Hear J Cardiovasc Imaging 2012; 13: 666–672.
- Д’Андреа А., Риглер Л., Голиа Э., Коккиа Р., Скарафил Р., Салерно Г. и др.: Диапазон измерений правых отделов сердца у спортсменов высокого уровня: влияние тренировки. Int J Cardiol 2013; 164: 48–57.
- Д’Андреа А., Риглер Л., Нунциата Л., Скарафил Р., Гравино Р., Салерно Г. и др.: Морфология и функция правого сердца у реципиентов трансплантации сердца.J Cardiovasc Med 2013; 14: 648–658.
- Зимбарра Кабрита I, Руисанчес С., Грапса Дж., Доусон Д., Норт Б., Пинто Ф. Дж. И др.: Проверка времени изоволюметрической релаксации для оценки систолического артериального давления в легочной артерии при хронической легочной гипертензии. Eur Heart J Cardiovasc Imaging 2013; 14: 51–55.
- Vasconcelos MC, Nunes MC, Barbosa MM, Fernandes BM, Passaglia LG, Silva CM, et al: Ремоделирование левого желудочка у пациентов с серповидно-клеточной анемией: факторы, определяющие факторы и влияние на исход. Ann Hematol 2015; 94: 1621–1629.
- Lin X, Xu RY, Liu JZ, Chen W, Chen LF, Yang PH и др.: Влияние систолической функции правых отделов сердца на исходы у пациентов с констриктивным перикардитом, перенесших перикардиэктомию.Chin Med J (англ.), 2016; 129: 154.
- Йок П.Г., Попп Р.Л .: Неинвазивная оценка систолического давления правого желудочка с помощью ультразвуковой допплерографии у пациентов с трикуспидальной регургитацией. Тираж 1984 г .; 70: 657–662.
- Bossone E, Ferrara F, Grünig E: Эхокардиография при легочной гипертензии.Curr Opin Cardiol 2015; 30: 574–586.
- McQuillan BM, Picard MH, Leavitt M, Weyman AE: Клинические корреляты и контрольные интервалы для систолического давления в легочной артерии среди эхокардиографически нормальных субъектов. Тираж 2001 г .; 104: 2797–2802.
- D’Andrea A, Naeije R, Grünig E, Caso P, D’Alto M, Di Palma E, et al: Эхокардиография легочного кровообращения и функции правого желудочка: изучение физиологического спектра у 1480 нормальных субъектов.Сундук 2014; 145: 1071–1078.
- Розенкранц С., Гиббс Дж. С., Вахтер Р., Де Марко Т., Вонк-Нордеграаф А., Вашери Дж. Л.: Левожелудочковая сердечная недостаточность и легочная гипертензия. Eur Heart J 2016; 37: 942–954.
- Marra AM, Benjamin N, Eichstaedt C, Salzano A, Arcopinto M, Gargani L, et al: Гендерные различия в назначении целевых препаратов для лечения легочной артериальной гипертензии.Pharmacol Res 2016; 114: 103–109.
Автор Контакты
Эдуардо Боссоне, MD, PhD
Директор кардиологического отделения больницы «Кава де Тиррени и побережье Амальфи»
Отделение сердца, Университет Салерно
Via Pr. Амедео, 36, IT – 83023 Лауро (Италия)
Электронная почта ebossone @ hotmail.com
Подробности статьи / публикации
Предварительный просмотр первой страницы
Поступила в редакцию: 5 февраля 2018 г.
Дата принятия: 16 мая 2018 г.
Опубликована онлайн: 18 июля 2018 г.
Дата выпуска: ноябрь 2018 г.
Количество страниц для печати: 9
Количество фигур: 5
Количество столов: 3
ISSN: 0025-7931 (печатный)
eISSN: 1423-0356 (онлайн)
Для дополнительной информации: https: // www.karger.com/RES
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме или любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование, или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарства: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарства, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным средством является новое и / или редко применяемое лекарство.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, нанесенный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Влияние трикуспидальной регургитации на долгосрочную выживаемость
https: // doi.org / 10.1016 / j.jacc.2003.09.036 Получить права и содержаниеРезюме
Цели
Целью этого исследования было изучить смертность, связанную с трикуспидальной регургитацией (TR), после контроля фракции выброса левого желудочка (LVEF), правого желудочка (ПЖ) дилатация и дисфункция, а также систолическое давление в легочной артерии (PASP).
Предпосылки
Трикуспидальная регургитация — частая эхокардиографическая находка; однако связь с прогнозом неясна.
Методы
Мы ретроспективно идентифицировали 5223 пациента (возраст 66,5 ± 12,8 лет; преимущественно мужчины), которым в течение четырех лет проводилась эхокардиография в одной из трех лабораторий Медицинского центра по делам ветеранов. Данные последующего наблюдения были доступны в течение четырех лет (в среднем 498 ± 402 дня). Для сравнения различий в выживаемости между классами TR использовались методы Каплана-Мейера и пропорциональные риски.
Результаты
Смертность возрастала с увеличением тяжести TR.Годовая выживаемость составила 91,7% при отсутствии TR, 90,3% при легкой TR, 78,9% при умеренной TR и 63,9% при тяжелой TR. Умеренный или более высокий TR был связан с повышенной смертностью независимо от PASP (отношение рисков [HR] 1,31, 95% доверительный интервал [CI] 1,16–1,49 для PASP> 40 мм рт. Ст.; HR 1,32, 95% ДИ от 1,05 до 1,62 для PASP ≤40 мм рт. ст.) и ФВЛЖ (ОР 1,49, 95% ДИ 1,34–1,66 для ФВ <50%; ОР 1,54, 95% ДИ 1,37–1,71 для ФВ ≥50%). С поправкой на возраст, ФВ ЛЖ, размер нижней полой вены, а также размер и функцию ПЖ, выживаемость была хуже для пациентов со средней степенью (HR 1.17, 95% ДИ от 0,96 до 1,42) и тяжелой TR (HR 1,31, 95% ДИ от 1,05 до 1,66), чем у пациентов без TR.
Выводы
Мы пришли к выводу, что увеличение тяжести ТР связано с худшей выживаемостью у мужчин независимо от ФВЛЖ или давления в легочной артерии. Тяжелая ТР связана с плохим прогнозом, независимо от возраста, систолической функции бивентрикула, размера ПЖ и дилатации нижней полой вены.
Сокращения
LVлевый желудочек / желудочек
LVEFфракция выброса левого желудочка
PASPсистолическое давление в легочной артерии
RVправый желудочек / желудочек
TRтрикуспидальная регургитация Фонд колледжа кардиологии.Опубликовано Elsevier Inc. Все права защищены.
Рекомендуемые статьи
Цитирующие статьи
Ретроспективное сравнение хирургического и консервативного лечения
Предпосылки . Неоперированная тяжелая трикуспидальная регургитация (TR) приводит к недостаточности правого желудочка (RV). Мы хотели определить, было ли в ближайшем будущем послеоперационное прогрессирование некорректированной функциональной TR от легкой до умеренной у пациентов, перенесших операцию на митральном клапане по поводу хронической значительной митральной регургитации (MR), и повлияло ли это на размер и функцию RV. Методы и результаты . Мы ретроспективно сравнили две группы пациентов. В первой группе (TVA +,) аннулопластика трикуспидального клапана (TVA) выполнялась в сочетании с заменой митрального клапана (MVR) или восстановлением митрального клапана (MVP). Вторая группа (TVA−,) прошла MVP или MVR без TVA. В группе TVA + выявлено достоверное уменьшение TR и диаметра правого желудочка. В группе TVA- у 7 пациентов (32%) наблюдалось значительное прогрессирование на одну или несколько степеней нескорректированной TR вместе с дилатацией и снижением фракции выброса правого желудочка. Выводы . Трехстворчатая аннулопластика, выполняемая одновременно с ПМК или ПМК, может предотвратить последующее прогрессирование трикуспидальной регургитации наряду с дилатацией правого желудочка и систолической дисфункцией в ближайшем послеоперационном периоде.
1. Введение
Существует два типа трикуспидальной регургитации. Первичная ТР, связанная с врожденными аномалиями или возникшая в результате бактериального эндокардита, встречается гораздо реже, чем вторичная (функциональная) ТР [1]. Вторичный TR объясняется дилатацией правого желудочка и трикуспидального кольца из-за перегрузки правого желудочка объемом или давлением.
Наиболее частыми причинами функциональной ТР являются [2–5] (1) заболевание левого сердца (значительное нарушение аортального или митрального клапана или дисфункция левого желудочка), (2) хроническое заболевание легких и (3) первичная легочная гипертензия.
Обратимая посткапиллярная или смешанная легочная гипертензия, позволяющая провести операцию на недостаточном трикуспидальном клапане, обычно сопровождает значительную хроническую митральную регургитацию [6].
Функциональный TR может уменьшиться или полностью исчезнуть после разрешения поражения левого сердца, ответственного за перегрузку правого желудочка.Однако прогрессирование TR происходит почти у половины пациентов [7, 8]. Этот нелеченый TR вместе с дилатацией трикуспидального кольца может привести к необратимой дисфункции и отказу правого желудочка [3].
Когда после операции на митральном клапане следует отдельная пластика трикуспидального клапана из-за значительной TR, смертность достигает 32%, а 5-летняя выживаемость составляет менее 50% [9, 10]. Причина — более плохое предоперационное состояние пациентов из-за пожилого возраста, осложнения, связанные с предыдущей операцией на митральном клапане, и возможность развития необратимой дисфункции правого желудочка к моменту второй операции.
Из-за высокой общей смертности после замены трикуспидального клапана [5], восстановление клапана предпочтительнее [11], а если показана замена трикуспидального клапана, биопротезный клапан предпочтительнее механического. Что касается методов, не требующих хирургического вмешательства (для вторичной дилатации фиброзного кольца трикуспидального клапана с последующей некоаптацией створок), для сужения фиброзного кольца первоначально использовалось наложение швов по окружности фиброзного кольца (чаще всего хирургическая техника по Де Веге). , но в настоящее время предпочтительным является не только сужение, но и ремоделирование трикуспидального кольца с использованием аннулопластического кольца (см. Рисунок 1).Преимущество этой процедуры — лучший отдаленный результат щадящей операции.
Легочная гипертензия, больший диаметр ПЖ с дилатацией кольца трикуспидального клапана и сниженная фракция выброса ПЖ считаются факторами риска ухудшения нелеченой регургитации трикуспидального клапана после операции на митральном клапане [7, 12]. Следовательно, восстановление трикуспидального клапана в сочетании с операцией на митральном клапане полезно при тяжелой TR и должно рассматриваться при менее тяжелой TR, когда имеется расширенное фиброзное кольцо (40 мм) или легочная гипертензия [7, 11, 13].
Целью данного ретроспективного анализа было сравнение развития нелеченой функциональной TR от легкой до умеренно значимой после операции по поводу хронической тяжелой митральной регургитации в ближайшем послеоперационном периоде между группой пациентов, у которых были только MVR или MVP, и группой пациентов, у которых одновременно были и (MVR или MVP), и TVA.
2. Пациенты и методы
Мы провели ретроспективный анализ 45 пациентов (группа TVA +), перенесших восстановление или замену митрального клапана из-за значительной хронической митральной регургитации ишемической или дегенеративной этиологии.Одновременно выполнялась аннулопластика трехстворчатого клапана с аннулопластическим кольцом, если у пациента была дилатация фиброзного кольца более 40 мм и при наличии хотя бы следов TR. Эту группу пациентов сравнивали с 22 пациентами (группа TVA-), которым выполнялась только операция или замена митрального клапана. Хотя у этих пациентов фиброзное кольцо также было расширено более чем на 40 мм и имелась по крайней мере следы TR, TVA не проводилась. Пациенты со структурным поражением трикуспидального клапана в исследование не включались.Не было значительных различий между двумя группами пациентов по возрасту, исходной фракции выброса левого и правого желудочков, исходной трикуспидальной и митральной регургитации и диаметру правого желудочка. Оценка функциональной стадии с использованием классификации NYHA (New York Heart Association) проводилась путем опроса пациентов. Пациенты в группе TVA + относились к значительно более высокому классу NYHA, чем пациенты в группе TVA- (Таблица 1).
| ||||||||||||||||||||||||||||||||||||||||||||||||
| TVA + аннулопластика трикуспидального клапана, TVA- без аннулопластики трехстворчатого клапана, NYHA: классификация New York Heart Association, ФВ ЛЖ: фракция выброса правого желудочка, фракция выброса правого желудочка , TR: трикуспидальная регургитация и MR: митральная регургитация | ||||||||||||||||||||||||||||||||||||||||||||||||
2.1. Эхокардиография
Трансторакальное эхокардиографическое исследование было выполнено обеим группам пациентов до операции и еще раз через 3 месяца после процедуры. Оценивали фракцию выброса обоих желудочков; диаметр правого желудочка в парастернальной проекции по длинной оси (PLAX) был измерен. Степень TR оценивалась полуколичественно в соответствии с цветовым допплеровским потоком (CFM) из апикальной четырехкамерной проекции (0,5 градуса: след, первая степень: до 1/3 правого предсердия (RA), вторая степень: 1 / 3– 1/2 прямого прямого восхождения, третья степень: 1 / 2–2 / 3 прямого восхождения, четвертая ступень: 2/3 — полная длина прямого восхождения).Митральную регургитацию также оценивали полуколичественно с помощью CFM из апикальной четырехкамерной проекции. Оценка систолического давления в легочной артерии, основанная на пиковом градиенте регургитации трехстворчатого клапана, не проводилась для всех пациентов. Следовательно, это значение не было включено в ретроспективный анализ.
2.2. Хирургическая техника
Все пациенты оперированы срединной стернотомией. В качестве защиты миокарда использовали кристаллоидную антеградную кардиоплегию.В группе TVA + восстановление митрального клапана было выполнено 35 пациентам (78%), а замена митрального клапана — 10 пациентам (22%), в то время как 22 пациентам (49%) также было выполнено аортокоронарное шунтирование (АКШ). Дополнительно 19 пациентов (42%) прошли процедуру лабиринта. В группе TVA- восстановление митрального клапана было выполнено 16 пациентам (73%), протезирование клапана — 6 пациентам (27%), а 15 пациентам (68%) была выполнена АКШ. Дополнительно 7 пациентов (32%) прошли процедуру лабиринта. В обеих группах АКШ была проведена либо как основное показание, либо как дополнительная операция.Обзор представлен в Таблице 2.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| TVA + трикуспидальная аннулопластика, TVA — без аннулопластики трехстворчатого клапана, АКШ: коронарный шунт, MVR: замена митрального клапана, и MVP: восстановление митрального клапана3. Статистические методы Для статистической оценки использовали критерий Стьюдента и U-критерий Манна-Уитни. 3. РезультатыНаблюдалась тенденция к более высокой одномесячной и трехмесячной смертности в группе TVA− (Рисунок 2). Класс NYHA улучшился для обеих групп. Группа TVA + показала статистически значимое уменьшение диаметра правого желудочка, но незначительное увеличение фракций выброса правого и левого желудочка. Снижение средней оценки TR было статистически значимым (таблица 3).Ни у одного из пациентов в группе TVA + не наблюдалось прогрессирования TR более чем на одну степень.
Как и группа TVA +, группа TVA- показала статистически значимое улучшение класса NYHA, а также снижение уровня TR и незначительное увеличение фракции выброса обоих желудочков.Однако группа TVA- показала статистически значимое расширение правого желудочка (таблица 4). У семи пациентов (32%) из группы TVA- наблюдалось послеоперационное прогрессирование TR более чем на одну степень с клинически значимой дилатацией правого желудочка и снижением фракции выброса (таблица 5). Не было различий в исходных характеристиках (возраст, класс NYHA, эхокардиографические параметры) между этими семью пациентами и остальной частью группы TVA.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 1. ЛГ при заболевании левого предсердия или ЛЖ
1. ЛГ при заболевании левого предсердия или ЛЖ