Стенд для пищевода: Стентирование пищевода в Москве, цены в АО «Медицина» (клиника академика Ройтберга)
Стентирование пищевода
Основным клиническим симптомом распространенного рака пищевода и кардиального отдела желудка является дисфагия (невозможность прохождения пищи и жидкости), которая возникает при сужении просвета пищевода на 50-75%.
Дисфагия крайне тяжело переносится пациентами, неотвратимо приводя к алиментарной дистрофии, кахексии (крайней степени истощения) и смерти.
Несмотря на современное развитие онкологии, у 60-70% пациентов с диагностированным раком пищевода и кардиального отдела желудка на момент выявления заболевания уже невозможно проведение радикального хирургического лечения, вследствие распространенности опухолевого процесса или наличия тяжелой сопутствующей патологии. Так же не исключается возможность возникновения рецидива опухоли после проведенного хирургического лечения.
В таких случаях, показано паллиативное лечение, направленное на уменьшение дисфагии (восстановление просвета пищевода) и повышение качества жизни пациента.
В настоящее время с развитием современного медицинского оборудования и инструментария разработана эффективная малоинвазивная методика восстановления просвета пищевода – стентирование пищевода.
Данная методика позволяет произвести реканализацию просвета пищевода и восстановить нормальный пассаж твердой пищи и жидкости по желудочно-кишечному тракту при помощи эндоскопического введения специального устройства — стента.
Стент по своей структуре представляет собой тонкий металлический (нитиноловый) каркас. Он доставляется в непроходимое место в системе доставки в сложенном виде, а затем расправляется принимая вид цилиндрической трубочки. В расправленном состоянии стент за счет большой радиальной жесткости выполняет каркасную функцию, тем самым восстанавливая просвет пищевода.
Стентирование пищевода является оптимальным способом восстановления просвета пищевода у пациентов, которым хирургическое лечение не показано в виду распространенности опухолевого процесса или при наличии противопоказаний к его проведению, а также, в некоторых случаях — как метод временной помощи перед предстоящим оперативным вмешательством.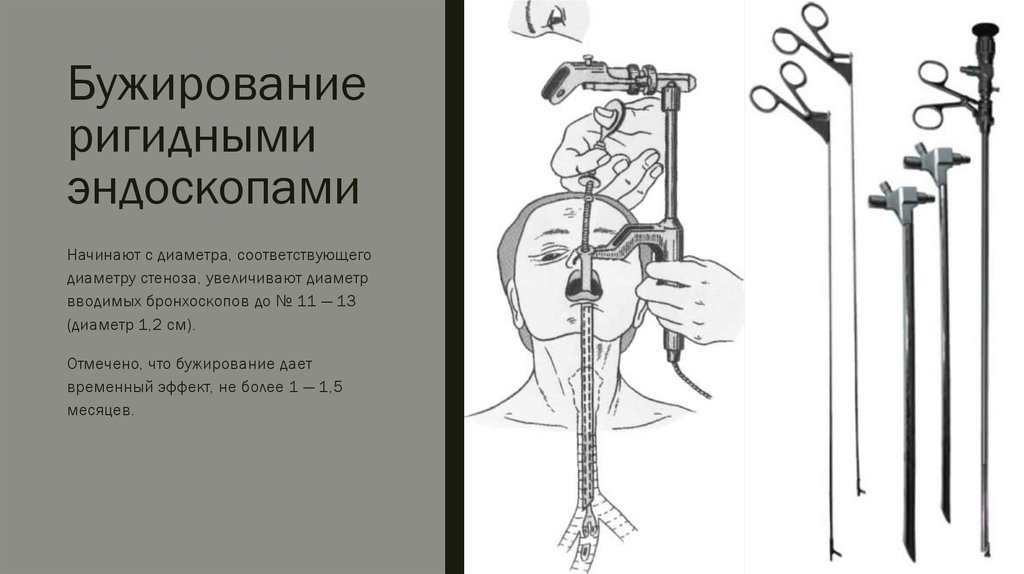
Стентирование пищевода позволяет значительно улучшить качество жизни пациента. После того как стент установлен в пищевод до 80-90% пациентов может вернуться к нормальному полноценному питанию и приему лекарств естественным способом.
Основными показаниями к стентированию пищевода являются:
• Опухолевое сужение просвета пищевода
• Послеоперационные рецидивы опухоли в зоне анастомоза
• Опухоли средостения, вызывающие сдавление пищевода
• Трахеоэзофагеальные свищи
• Перфорации пищевода
• Доброкачественные стриктуры пищевода.
В нашей клинике установка стента в пищевод проводится под двойным визуальным контролем: эндоскопическим и рентгенологическим. Это позволяет максимально точно позиционировать стент и полностью контролировать весь процесс его установки.
Эндоскопическое стентирование пищевода у пациентов со стриктурами различного генеза
Введение
На сегодняшний день стентирование пищевода является стандартным методом лечения и паллиативной помощи при доброкачественных и злокачественных стриктурах пищевода.
Вызванные различными причинами (табл. 1), Таблица 1. Этиологическая классификация стеноза пищевода (по Б. Блоку [1] с изменениями) стриктуры (стенозы) пищевода представляют собой состояния, которые значительно снижают качество жизни пациентов за счет проблематичности или невозможности энтерального питания и проявления дисфагии. Для разрешения дисфагии, а также с целью повышения качества и продолжительности жизни пациентов во многих случаях может быть применено эндоскопическое стентирование пищевода — имплантирование специализированных стентов.
Исторические аспекты вопросаСтент (англ.: stent) — это специальная конструкция, изготовленная в форме цилиндрического каркаса, которая устанавливается в просвет полых органов с целью расширения участка, суженного патологическим процессом, тем самым обеспечивая проходимость полого органа. Принято считать, что данная конструкция получила свое название от фамилии английского дантиста Чарльза Стента (Dr.
Началом истории эндопротезирования верхних отделов желудочно-кишечного тракта можно считать первую успешную установку пищеводного стента, о которой в 1885 г. сообщил Charles Symonds. Он установил оригинальный пероральный протез в пищевод, зафиксировав его шелковой нитью, проведенной через носовой ход к проксимальному концу стента и усам пациента, с целью предотвращения миграции стента [3].
Современная история стентирования пищевода началась в 1959 г., когда L. Celestin во время лапаротомии выполнил успешную установку пластикового стента пациенту со стенозирующим раком пищевода [4]. А уже в 1970-х годов. M. Atkinson внедрил в практику эндоскопическую установку пластиковых пищеводных стентов. Однако при установке таких стентов наблюдалась большая частота осложнений (до 36%) с летальностью от 2 до 16%.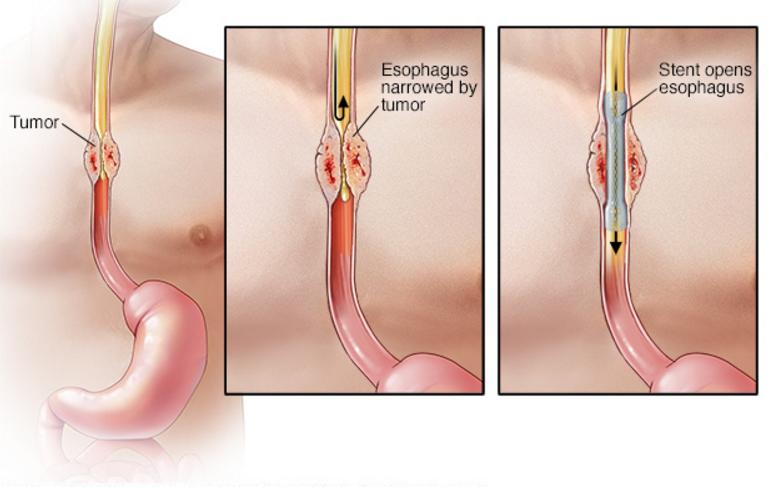 Частота перфораций пищевода при установке стентов достигала 6—8%, обтурации просвета — 5—10%. Развитие последней было связано в основном с небольшим диаметром использованных стентов (10—12 мм), что также ограничивало возможности возобновления полноценного энтерального питания у пациентов [5].
Частота перфораций пищевода при установке стентов достигала 6—8%, обтурации просвета — 5—10%. Развитие последней было связано в основном с небольшим диаметром использованных стентов (10—12 мм), что также ограничивало возможности возобновления полноценного энтерального питания у пациентов [5].
Со временем на смену ригидным пластиковым стентам пришли металлические саморасширяющиеся спиральные стенты, при установке которых значительно снизилось количество осложнений и повысилась эффективность операций. Впервые эндо-скопическую установку такого стента описал E. Frimberger в 1983 г. [6]. C этого момента начался процесс активной модернизации стентов, в том числе за счет применения новых конструкций и материалов.
Виды пищеводных стентов и техника стентирования пищеводаНа сегодняшний день разработано и предложено для клинического применения много различных видов пищеводных стентов, классификация которых представлена в табл. 2. Таблица 2. Классификация и основные разновидности пищеводных стентов
2. Таблица 2. Классификация и основные разновидности пищеводных стентов
Эндоскопическая установка стента может выполняться под прямым рентгеноскопическим контролем или без него. Использование прямого рентгеноскопического контроля при установке пищеводного стента является наиболее часто применяемой методикой и считается обязательным при извитом ходе стенозированного отдела пищевода. С другой стороны, некоторые исследователи указывают, что эндоскопическая установка пищеводного стента без прямого рентгеноскопического контроля может быть более перспективной методикой, к тому же она исключает лучевую нагрузку на медицинский персонал. Кроме того, во многих исследованиях приводятся данные о том, что обязательными условиями эндоскопического стентирования без прямого рентгеноскопического контроля являются предварительная реканализация, бужирование или баллонная дилатация до уровня дистальной границы стенозированного отдела пищевода.
Перед началом эндоскопического стентирования пищевода в обязательном порядке выполняется диагностическая эзофагогастродуоденоскопия, при которой определяется расстояние от резцов ротовой полости до верхней и нижней границ стриктуры (например, опухоли) для выбора размеров стента.
После выбора стента и наложения разметки выполняется непосредственно его установка. Под контролем гастроскопа вводится проводник-струна. После извлечения эндоскопа по струне проводится стент через зону сужения пищевода. Стент позиционируют в соответствии с разметкой, расстоянием от резцов ротовой полости, либо рентгенологически. Стент разворачивается под контролем гастроскопа и рентгеноскопии.
Несмотря на малоинвазивность рассматриваемой операции, использование в работе современных материалов и методик, необходимо помнить о возможности развития осложнений во время проведения данной процедуры и в послеоперационном периоде. Многие специалисты разделяют осложнения на ранние и отсроченные, хотя многие осложнения могут произойти в любое время, а некоторые из них могут потребовать проведения повторных хирургических вмешательств. Ниже рассмотрим различные виды возможных осложнений более подробно.
Боль. Умеренно выраженный болевой синдром в грудной клетке в раннем послеоперационном периоде после эндоскопического стентирования пищевода возникает почти у 100% пациентов. Сильная преходящая боль, по данным различных исследований, наблюдается в среднем у 8,7% пациентов (от 2 до 35%). Хронические боли сохраняются примерно у 15% больных [7—10]. Соблюдая определенные условия, можно сократить частоту развития хронического болевого синдрома: стент должен иметь соответствующие размеры, хорошую радиальную, но низкую осевую силу, что позволяет снизить избыточное давление и в итоге уменьшить уровень боли [11].
Сильная преходящая боль, по данным различных исследований, наблюдается в среднем у 8,7% пациентов (от 2 до 35%). Хронические боли сохраняются примерно у 15% больных [7—10]. Соблюдая определенные условия, можно сократить частоту развития хронического болевого синдрома: стент должен иметь соответствующие размеры, хорошую радиальную, но низкую осевую силу, что позволяет снизить избыточное давление и в итоге уменьшить уровень боли [11].
Кровотечение. Кровотечение в раннем послеоперационном периоде возникает в среднем в 7,6% случаев (от 2 до 26%). Оно может быть связано с прохождением эндоскопа или доставочного устройства стента по стриктуре и травмированием тканей. Чаще всего кровотечение необильное и разрешается самостоятельно. На долю отсроченного кровотечения, которое чаще оказывается фатальным, приходится в среднем 11,3% случаев (от 2 до 21%). В большинстве случаев кровотечение в отдаленном послеоперационном периоде возникает из-за прогрессирующего роста опухоли, некроза, вызванного давлением на уровне обоих концов стента, вследствие развития тяжелого эзофагита у пациентов с размещением стента в области гастроэзофагеального перехода. В качестве причины кровотечения описаны также случаи образования аортософизального свища у пациентов с вовлечением аортальной опухоли [7, 10, 12].
В качестве причины кровотечения описаны также случаи образования аортософизального свища у пациентов с вовлечением аортальной опухоли [7, 10, 12].
Перфорация. Ранняя перфорация пищевода возникает в среднем у 3,3% пациентов (от 0,9 до 6%). Чаще всего перфорация связана с избыточной дилатацией пищевода перед размещением стента. Перфорация также может быть ответом на чрезмерно активное манипулирование проводником во время операции и прохождение эндоскопом по всей протяженности стриктуры. Отсроченные перфорации чаще всего возникают вследствие некроза при сдавлении опухолью и травматизации стенки пищевода обоими краями стента. На долю отсроченных перфораций приходится около 4,5% случаев (от 3 до 9%) [10, 11, 13].
Миграция. Частота миграции пищеводных стентов в среднем достигает 6,6% (от 2 до 10%) в раннем и 11% (от 1 до 33%) в отдаленном послеоперационном периоде. Предрасполагающими факторами миграции стента являются небольшая протяженность стриктуры и наличие в ней изгибов, предшествующая лучевая или химиотерапия.
Обрастание и врастание опухоли в стент. Данное отдаленное осложнение, по сводным данным, возникает примерно у 14% пациентов (от 2,5 до 36%). Применение для стентирования FCSEMS или SEPS, стента с длиной больше, чем стриктура (не менее чем на 2 см), снижает риск врастания опухоли [15].
Образование грануляционной ткани. Это осложнение возникает в среднем у 10,0—13,4% пациентов после эндоскопического стентирования пищевода [16, 17]. Для предотвращения разрастания грануляций и гиперплазии тканей целесообразно использование стентов с мягкими концами. Однако считается, что грануляционный рост ткани, вызванный доброкачественной гиперплазией, может произойти при применении любого типа стента.
Обструкция. Обструкция стента пищей возникает примерно в 9% случаев (от 2 до 27%) у пациентов, не соблюдающих диетические рекомендации [16, 17].
Фистула. Данное осложнение возникает как отсроченное у 5% пациентов (от 2 до 8%). Основным фактором риска формирования эзофагореспираторной фистулы при стентировании пищевода является предшествующая лучевая терапия. Возникновение фистулы может быть связано с прогрессированием онкологического заболевания и эрозией на обоих краях стента. Снизить риск возникновения фистулы можно путем использования FCSEMS (актуально для злокачественных стриктур средней трети пищевода) [18—20].
Рефлюкс. По сводным данным, гастроэзофагеальный рефлюкс возникает у 9,3% пациентов (от 5 до 16%) в раннем и у 5% пациентов (от 2 до 96%) в позднем послеоперационном периоде. Для снижения риска развития рефлюкса у пациентов со стриктурой гастроэзофагеального перехода используют стент SEMS c антирефлюксным механизмом. Также таким пациентам после стентирования целесообразно проводить консервативную терапию при помощи ингибиторов протонной помпы.
Аспирация и аспирационная пневмония. Аспирация при установке стента возникает у 3,5% пациентов (от 2 до 5%). В дальнейшем аспирационная пневмония фиксируется в среднем у 10,3% пациентов (от 7 до 19%).
На долю других редких осложнений, таких как компрессия трахеи, формирование кармана между стентом и стенкой пищевода, неполное раскрытие, неправильное расположение, перелом, частичное разрушение конструкции стента, лихорадка, некроз от давления стента, приходится около 2,8% случаев (от 2 до 6%) в раннем послеоперационном периоде и 10% случаев (от 2 до 21%) в позднем послеоперационном периоде [11, 17, 21, 22].
Эндоскопическое стентирование при злокачественных поражениях пищеводаВо всем мире рак пищевода занимает 8-е место среди всех злокачественных новообразований [23]. В структуре смертности населения России за 2016 г. злокачественные новообразования занимали 2-е место (15,6%) после болезней системы кровообращения (47,8%). Заболеваемость раком пищевода при этом составила 2,3% мужского и 0,5% женского населения в общей структуре заболеваемости злокачественными новообразованиями среди всего населения Российской Федерации. Средний возраст мужчин и женщин, у которых впервые в жизни был установлен диагноз рака пищевода, составил 60 лет, однако заболеваемость в различных возрастно-половых группах населения резко возрастает после сорока лет. Самая большая смертность наблюдалась в возрасте от 55 до 65 лет (2,97—3,09%), а средний возраст умерших в 2016 г. составил 60 лет (табл. 3). Таблица 3. Статистические данные по злокачественным новообразованиям пищевода за 2016 г. [24] Динамика показателей заболеваемости населения России злокачественными новообразованиями пищевода в период 2006—2016 гг. показывает прирост заболеваемости на 9,25% (примерные показатели на 100 000 населения для обоих полов). Территориальным лидером по заболеваемости и смертности стали Москва и Московская область [24].
Заболеваемость раком пищевода при этом составила 2,3% мужского и 0,5% женского населения в общей структуре заболеваемости злокачественными новообразованиями среди всего населения Российской Федерации. Средний возраст мужчин и женщин, у которых впервые в жизни был установлен диагноз рака пищевода, составил 60 лет, однако заболеваемость в различных возрастно-половых группах населения резко возрастает после сорока лет. Самая большая смертность наблюдалась в возрасте от 55 до 65 лет (2,97—3,09%), а средний возраст умерших в 2016 г. составил 60 лет (табл. 3). Таблица 3. Статистические данные по злокачественным новообразованиям пищевода за 2016 г. [24] Динамика показателей заболеваемости населения России злокачественными новообразованиями пищевода в период 2006—2016 гг. показывает прирост заболеваемости на 9,25% (примерные показатели на 100 000 населения для обоих полов). Территориальным лидером по заболеваемости и смертности стали Москва и Московская область [24].
На сегодняшний день для лечения дисфагии, обусловленной злокачественными опухолями, оптимальным выбором считается установка пищеводных стентов типа SEMS. По рекомендации Европейского общества гастроинтестинальной эндоскопии (ESGE) для коррекции злокачественной дисфагии рекомендуется размещать частично или полностью покрытые SEMS, что является более эффективным по сравнению с лазерной терапией, фотодинамической терапией и наложением обходного анастомоза (уровень доказательности 1a, уровень рекомендации А). Также ESGE не рекомендует размещать нерасширяющиеся и саморасширяющиеся пластиковые стенты при дисфагии, вызванной злокачественными опухолями пищевода (уровень доказательности 1a, уровень рекомендации А) [11].
По рекомендации Европейского общества гастроинтестинальной эндоскопии (ESGE) для коррекции злокачественной дисфагии рекомендуется размещать частично или полностью покрытые SEMS, что является более эффективным по сравнению с лазерной терапией, фотодинамической терапией и наложением обходного анастомоза (уровень доказательности 1a, уровень рекомендации А). Также ESGE не рекомендует размещать нерасширяющиеся и саморасширяющиеся пластиковые стенты при дисфагии, вызванной злокачественными опухолями пищевода (уровень доказательности 1a, уровень рекомендации А) [11].
Ряд рандомизированных клинических исследований, сравнивающих эффективность SEMS и SEPS для лечения дисфагии, обусловленной злокачественными опухолями пищевода, показал превосходство SEMS. По данным этих исследований, металлические стенты проще в установке, дольше поддерживают проходимость пищевода и дают меньшее количество осложнений [25]. Также металлические стенты способствуют повышению уровня качества жизни и улучшают показатели выживаемости у пациентов с раком пищевода [26]. Например, систематический обзор литературы, проведенный в 2014 г. Y. Dai и соавт. [7], включил 7 РКИ, сравнивающих результаты применения стандартного пластикового стента и SEMS. В целом были проанализированы результаты лечения 433 пациентов, у которых было выполнено стентирование пищевода при злокачественных опухолях. 192 пациентам был установлен стандартный пластиковый стент, 241 пациенту были установлены SEMS. Во всех проанализированных исследованиях основным показателем результата считалось клиническое улучшение с точки зрения течения дисфагии. Также оценивались общая выживаемость, технический уровень выполнимости операции, частота осложнений и уровень качества жизни. По данным авторов, дисфагия сохранялась через 4 нед после стентирования у 49% пациентов при применении пластикового стента и у 29% больных при использовании SEMS, что было статистически значимо (средняя разница: –0,36; p=0,009) и свидетельствовало в пользу SEMS. Осложнения были значительно более частыми у пациентов, которым устанавливали пластиковые стенты.
Например, систематический обзор литературы, проведенный в 2014 г. Y. Dai и соавт. [7], включил 7 РКИ, сравнивающих результаты применения стандартного пластикового стента и SEMS. В целом были проанализированы результаты лечения 433 пациентов, у которых было выполнено стентирование пищевода при злокачественных опухолях. 192 пациентам был установлен стандартный пластиковый стент, 241 пациенту были установлены SEMS. Во всех проанализированных исследованиях основным показателем результата считалось клиническое улучшение с точки зрения течения дисфагии. Также оценивались общая выживаемость, технический уровень выполнимости операции, частота осложнений и уровень качества жизни. По данным авторов, дисфагия сохранялась через 4 нед после стентирования у 49% пациентов при применении пластикового стента и у 29% больных при использовании SEMS, что было статистически значимо (средняя разница: –0,36; p=0,009) и свидетельствовало в пользу SEMS. Осложнения были значительно более частыми у пациентов, которым устанавливали пластиковые стенты. С точки зрения всех других анализируемых аспектов статистически значимых различий не выявлено.
С точки зрения всех других анализируемых аспектов статистически значимых различий не выявлено.
Детальный разбор исследования M. Conio и соавт. [13], которые провели рандомизированное проспективное сравнение результатов установки саморасширяющихся пластиковых стентов и частично покрытых саморасширяющихся металлических стентов при паллиативной помощи пациентам с дисфагией на фоне злокачественных новообразований пищевода, также показывает превосходство SEMS с точки зрения безопасности применения. В данной работе 101 пациенту с нерезектабельной аденокарциномой пищевода были установлены саморасширяющиеся стенты из полиэфирной сетки (Polyflex, 47 случаев) или PCSEMS (Ultraflex, 54 случая). Многофакторный анализ показал, что частота осложнений была статистически значимо более высокой после установки стентов Polyflex, чем после установки стентов Ultraflex. Средняя продолжительность выживаемости пациентов составила 134 дня после установки стента Polyflex и 122 дня после установки стента Ultraflex. Основные итоги данного исследования представлены в табл. 4. Таблица 4. Основные результаты исследования различных стентов (M. Conio и соавт. [13])
Основные итоги данного исследования представлены в табл. 4. Таблица 4. Основные результаты исследования различных стентов (M. Conio и соавт. [13])
За последнее десятилетие частота использования саморасширяющихся стентов для лечения доброкачественных заболеваний пищевода значительно возросла. Известно, что при доброкачественных поражениях установка стента позволяет пищеводу реконструироваться вокруг него, тем самым предотвра-щает закрытие просвета пищевода после удаления стента. По мнению различных экспертов, установку стента в случаях доброкачественных стриктур пищевода следует производить, когда альтернативные методы лечения оказались безуспешны.
Для стентирования рефрактерных или рецидивирующих доброкачественных стриктур пищевода могут использоваться стенты SEMS, SEPS и BDS. В 2016 г. L. Fuccio и соавт. [27] осуществили крупнейший систематический обзор и метаанализ 18 исследований (10 проспективных и 8 ретроспективных исследований, всего 444 пациента), в котором оценили клинический результат размещения стента для рефрактерных доброкачественных стриктур пищевода (RBES). В 9 исследованиях использовались стенты FCSEMS (227 пациентов), в 8 исследованиях — стенты SEPS (140 пациентов), в 4 исследованиях — стенты BDS (77 пациентов). Общая частота клинического успеха составила 40,5% (95% ДИ: 31,5—49,5%). У пациентов, которым были установлены стенты SEPS и SEMS, не было выявлено статистически значимой разницы в показателе клинического успеха по сравнению с пациентами, которым устанавливались BDS (46,2, 40,1 и 32,9% соответственно). Средняя частота миграции стента составила 28,6% (95% ДИ: 21,9—37,1%): 33,3% — при установке SEPS; 31,5% — при установке SEMS и 15,3% — при установке BDS. Осложнения и другие неблагоприятные события зафиксированы у 20,6% пациентов (95% ДИ: 15,3—28,1%): у 19,4% — при установке SEPS; у 21,9% — при установке SEMS; у 21,9% — при установке BDS.
В 9 исследованиях использовались стенты FCSEMS (227 пациентов), в 8 исследованиях — стенты SEPS (140 пациентов), в 4 исследованиях — стенты BDS (77 пациентов). Общая частота клинического успеха составила 40,5% (95% ДИ: 31,5—49,5%). У пациентов, которым были установлены стенты SEPS и SEMS, не было выявлено статистически значимой разницы в показателе клинического успеха по сравнению с пациентами, которым устанавливались BDS (46,2, 40,1 и 32,9% соответственно). Средняя частота миграции стента составила 28,6% (95% ДИ: 21,9—37,1%): 33,3% — при установке SEPS; 31,5% — при установке SEMS и 15,3% — при установке BDS. Осложнения и другие неблагоприятные события зафиксированы у 20,6% пациентов (95% ДИ: 15,3—28,1%): у 19,4% — при установке SEPS; у 21,9% — при установке SEMS; у 21,9% — при установке BDS.
В клинической практике при лечении доброкачественных стриктур FCSEMS или SEPS принято оставлять в пищеводе на 6—8 нед, но не более чем на 12 нед. Данные сроки сводят к минимуму такие нежелательные явления, как гиперпластическая тканевая реакция и возможность врастания стента в стенку пищевода. Также использование FCSEMS вместо PCSEMS снижает частоту развития гиперпластической реакции слизистой оболочки и обеспечивает более легкое и безопасное удаление стента [28, 29]. Для удаления стентов PCSEMS, вросших в стенку пищевода, часто используют метод удаления «стент-в-стент» с полностью покрытым стентом.
Также использование FCSEMS вместо PCSEMS снижает частоту развития гиперпластической реакции слизистой оболочки и обеспечивает более легкое и безопасное удаление стента [28, 29]. Для удаления стентов PCSEMS, вросших в стенку пищевода, часто используют метод удаления «стент-в-стент» с полностью покрытым стентом.
Заключение
Эндоскопическое стентирование является одним из наиболее часто применяемых и эффективных методов паллиативной помощи пациентам с раком пищевода. Данный способ позволяет в большинстве случаев быстро устранить дисфагию и возобновить энтеральное питание у пациентов, что, безусловно, повышает их качество жизни. Данная процедура является малоинвазивной и сокращает время пребывания больных в стационаре. При хорошем материально-техническом оснащении, соответствующей квалификации врача-эндоскописта и учете всех осо-бенностей клинического диагноза возможно минимизировать риск развития осложнений.
Эндоскопическое стентирование пищевода не является терапией первой линии для лечения доброкачественных стриктур в связи с наличием альтернативных методов лечения, при которых риск неблагоприятных событий ниже и которые требуют меньших экономических затрат. Однако при рефрактерных и рецидивирующих доброкачественных стриктурах пищевода стентирование используется все чаще и может рассматриваться как метод лечения, обладающий необходимой эффективностью и безопасностью.
Однако при рефрактерных и рецидивирующих доброкачественных стриктурах пищевода стентирование используется все чаще и может рассматриваться как метод лечения, обладающий необходимой эффективностью и безопасностью.
Относительно новые типы стентов, такие как BDS и радиоактивные стенты, в будущем, возможно, найдут широкое применение в клинической практике и продемонстрируют улучшение результатов лечения дисфагии различной этиологии.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Фролова Е.В. — ординатор кафедры эндоскопической хирургии ФДПО ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава России; e-mail: [email protected]
Богданов Д.Ю. — д.м.н., профессор, профессор кафедры эндоскопической хирургии ФДПО ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава России; e-mail: [email protected]
Курганов И.А. — к.м.н., доцент кафедры эндоскопической хирургии ФДПО ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава России; e-mail: [email protected]; https://orcid.org/0000-0003-0968-3955
— к.м.н., доцент кафедры эндоскопической хирургии ФДПО ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава России; e-mail: [email protected]; https://orcid.org/0000-0003-0968-3955
Самсонян Э.Х. — ассистент кафедры эндоскопической хирургии ФДПО ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава России; e-mail: [email protected]; https://orcid.org/0000-0001-7984-6559
Емельянов С.И. — д.м.н., проф., заведующий кафедрой эндоскопической хирургии ФДПО ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава России; e-mail: [email protected]
Федоров А.В. — д.м.н., проф. кафедры эндоскопической хирургии ФДПО ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава России; e-mail: [email protected]
Урываев М.Ю. — соискатель кафедры эндоскопической хирургии ФДПО ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава России; e-mail: [email protected]
Секундова М.А. — заведующая отделением общей онкологии Больницы Центросоюза РФ; e-mail: masek84@mail. ru
ru
Автор, ответственный за переписку: Курганов Игорь Алексеевич — [email protected]; https://orcid.org/0000-0003-0968-3955
Стентирование пищевода | Johns Hopkins Medicine
Что такое стентирование пищевода?
При стентировании пищевода в пищевод (горло) вводится трубка, чтобы сохранить открытым закупоренный участок. Трубка помогает вам глотать твердые вещества и жидкости.
Пищевод — это мышечная трубка, соединяющая заднюю часть рта с желудком. Когда вы глотаете, мышцы пищевода сокращаются. Они продвигают пищу в ваш желудок.
Многие проблемы со здоровьем могут частично блокировать часть пищевода. Это может затруднить глотание. Медицинский термин для этого — дисфагия. У вас может быть боль при глотании или ощущение, что пища застревает в груди. Пища может вернуться обратно после того, как вы проглотите ее. Пищеводный стент может помочь открыть заблокированный пищевод и облегчить симптомы.
Процедура может проводиться под общей анестезией или седативными средствами в сознании. Если это происходит под общим наркозом, вы будете спать во время процедуры и не почувствуете боли. Если это происходит под сознательным седативным средством, вы получите лекарства, которые сделают вас расслабленным и сонным. Хирург может обезболить оперируемую область, чтобы вы не чувствовали сильной боли.
Если это происходит под общим наркозом, вы будете спать во время процедуры и не почувствуете боли. Если это происходит под сознательным седативным средством, вы получите лекарства, которые сделают вас расслабленным и сонным. Хирург может обезболить оперируемую область, чтобы вы не чувствовали сильной боли.
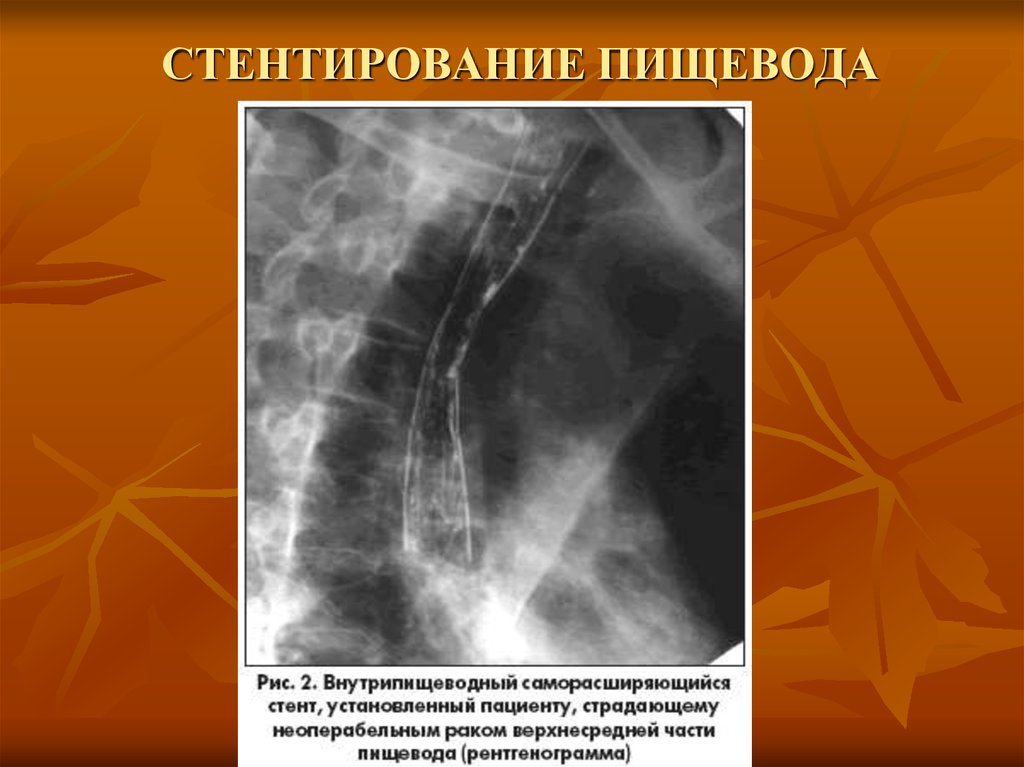
Во время процедуры хирург вводит длинную тонкую трубку (катетер) в заднюю часть рта и в пищевод. Затем хирург помещает свернутую полую трубку (стент) поверх катетера в правильном положении поперек закупорки. Стент расширяется относительно стенок пищевода, оказывая поддержку. Затем хирург удаляет катетер и оставляет стент на месте.
Зачем мне может понадобиться стентирование пищевода?
Вам может понадобиться пищеводный стент при ряде проблем со здоровьем. Традиционно поставщики медицинских услуг чаще всего использовали пищеводные стенты для лечения рака пищевода. Это по-прежнему самая распространенная причина. Но эти стенты также используются для лечения:
- Рак верхней части желудка
- Сужение пищевода, когда он выталкивается извне раком (например, раком легкого) или увеличением лимфатических узлов
- Сужение пищевода из-за язвы
- Сужение пищевода в результате лучевой терапии
- Аномальное отверстие между трахеей (трахеей) и пищеводом
- Отверстие в пищеводе
Любая из этих проблем со здоровьем может вызвать дисфагию. Дисфагия серьезна, поскольку может привести к аспирации. Во время аспирации вы вдыхаете пищу и содержимое желудка в легкие. Это может привести к таким осложнениям, как пневмония. Дисфагия также снижает качество жизни. Пищеводный стент может помочь облегчить эти проблемы.
Дисфагия серьезна, поскольку может привести к аспирации. Во время аспирации вы вдыхаете пищу и содержимое желудка в легкие. Это может привести к таким осложнениям, как пневмония. Дисфагия также снижает качество жизни. Пищеводный стент может помочь облегчить эти проблемы.
Даже если у вас рак пищевода, вам может не понадобиться пищеводный стент. В некоторых случаях ваш лечащий врач может вместо этого лечить рак хирургическим путем или химиотерапией. Если эти методы лечения не работают для вас, другим вариантом может быть пищеводный стент. В других случаях вам больше подойдет гастростомическая или еюностомическая трубка. Эти трубки идут прямо от внешней части живота к желудку или тонкой кишке. Поговорите со своим лечащим врачом обо всех возможных вариантах лечения.
Каковы риски процедуры стентирования пищевода?
Стентирование пищевода относительно безопасно. Но иногда они вызывают проблемы позже. К ним могут относиться:
- Боль в пищеводе
- Кровотечение (обычно легкое)
- Новое отверстие в пищеводе (редко)
- Перемещение стента
- Прорастание опухоли в стент
- Гастроэзофагеальный рефлюкс (ГЭРБ или изжога)
Существует также риск того, что вам потребуется повторная процедура из-за одного из этих осложнений. Ваши собственные риски могут варьироваться в зависимости от характера проблемы с пищеводом, других проблем со здоровьем и типа используемого стента. Поговорите со своим лечащим врачом обо всех своих проблемах.
Ваши собственные риски могут варьироваться в зависимости от характера проблемы с пищеводом, других проблем со здоровьем и типа используемого стента. Поговорите со своим лечащим врачом обо всех своих проблемах.
Как подготовиться к процедуре стентирования пищевода?
Поговорите со своим лечащим врачом о том, что вы должны сделать, чтобы подготовиться. Возможно, вам придется перестать есть и пить за ночь до процедуры. Следуйте инструкциям вашего поставщика медицинских услуг о том, какие лекарства принимать или не принимать заранее. Не прекращайте принимать лекарства, если он или она не скажет вам об этом. Запланируйте, чтобы кто-нибудь потом отвез вас домой.
Сообщите своему лечащему врачу следующее:
- Любая аллергия или проблемы с анестезией в прошлом
- Любые новые проблемы со здоровьем, такие как недавняя лихорадка
- Если вы беременны или можете быть беременны
- Все лекарства, которые вы принимаете, включая рецептурные и безрецептурные лекарства и добавки
Ваш лечащий врач может назначить некоторые анализы перед процедурой. Они могут включать тест на проглатывание бария. Это может дать больше информации об анатомии вашего пищевода. Непосредственно перед процедурой вы можете получить капельницу. Он может доставить вам лекарство во время процедуры.
Они могут включать тест на проглатывание бария. Это может дать больше информации об анатомии вашего пищевода. Непосредственно перед процедурой вы можете получить капельницу. Он может доставить вам лекарство во время процедуры.
Что происходит во время процедуры стентирования пищевода?
Ваш лечащий врач может сообщить вам, чего ожидать. Детали вашей процедуры могут несколько отличаться. Обычно это занимает около часа. В общем, вы можете ожидать следующее:
- Если вы испытываете седативное действие в сознании, лекарство будет введено через капельницу, чтобы вызвать у вас сонливость и расслабление во время процедуры. Вам также могут нанести обезболивающее лекарство на заднюю часть горла. После этого вы можете не вспомнить процедуру.
- Если вам делают общую анестезию, лекарство будет введено через капельницу, чтобы вы могли спать глубоко и безболезненно.
- Во время процедуры будут тщательно контролироваться частота сердечных сокращений, артериальное давление и другие жизненно важные показатели.
 При необходимости вы можете получить дополнительный кислород. Ваш поставщик медицинских услуг может использовать непрерывные рентгеновские изображения для наблюдения за процедурой. В других случаях он или она может использовать длинное тонкое устройство с небольшой камерой (эндоскоп).
При необходимости вы можете получить дополнительный кислород. Ваш поставщик медицинских услуг может использовать непрерывные рентгеновские изображения для наблюдения за процедурой. В других случаях он или она может использовать длинное тонкое устройство с небольшой камерой (эндоскоп). - Медицинский работник медленно введет катетер через рот в пищевод.
- Медицинский работник переместит свернутый пищеводный стент по катетеру к месту закупорки. Стент часто изготавливают из металла или пластика. Затем он откроется у стенки пищевода.
- После завершения процедуры врач удалит катетер из пищевода. Стент останется на месте.
Что происходит после процедуры стентирования пищевода?
Обычно стентирование пищевода проводится амбулаторно. После этого вы останетесь на несколько часов, пока будут наблюдать за вашими жизненными показателями. Убедитесь, что кто-то рядом, чтобы отвезти вас домой. Вам нужно будет расслабиться до конца дня. В других случаях вам может потребоваться остаться в больнице на ночь.
В других случаях вам может потребоваться остаться в больнице на ночь.
После процедуры у вас может быть некоторый дискомфорт. Но обычно это длится не более одного-двух дней. Вы можете приобрести безрецептурные обезболивающие, если они вам нужны.
Ваш лечащий врач даст вам конкретные инструкции о том, когда вы снова сможете есть и пить. Он или она может также дать вам другие конкретные инструкции по поводу вашего выздоровления. Продолжайте следить регулярно. Немедленно сообщите своему лечащему врачу о любых новых проблемах, таких как лихорадка или кислотный (гастроэзофагеальный) рефлюкс. Вам может потребоваться новая процедура из-за осложнения, такого как закупорка стента пищей или движение стента.
Следующие шаги
Прежде чем согласиться на тест или процедуру, убедитесь, что вы знаете:
- Название теста или процедуры
- Причина, по которой вы проходите тест или процедуру
- Каких результатов ожидать и что они означают
- Риски и преимущества теста или процедуры
- Возможные побочные эффекты или осложнения
- Когда и где вы должны пройти тест или процедуру
- Кто будет проводить тест или процедуру и какова квалификация этого человека
- Что произойдет, если вы не пройдете тест или процедуру
- Любые альтернативные тесты или процедуры, о которых стоит подумать
- Когда и как вы получите результаты
Кому звонить после теста или процедуры, если у вас есть вопросы или проблемы - Сколько вам придется заплатить за тест или процедуру
Пищевод Барретта: Медицинская энциклопедия MedlinePlus
URL этой страницы: //medlineplus.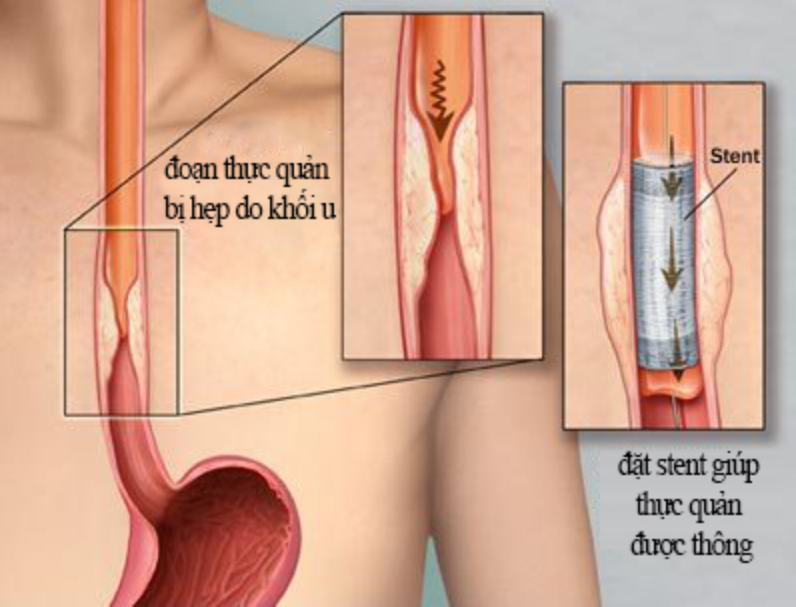 gov/ency/article/001143.htm
gov/ency/article/001143.htm
Чтобы использовать функции обмена на этой странице, включите JavaScript.
Пищевод Барретта (ПБ) — это заболевание, при котором слизистая оболочка пищевода повреждается желудочной кислотой. Пищевод также называют пищевой трубкой, и он соединяет ваше горло с желудком.
Люди с ПБ имеют повышенный риск развития рака пораженной области. Однако рак встречается нечасто.
Когда вы едите, пища попадает из горла в желудок через пищевод. Кольцо мышечных волокон в нижней части пищевода удерживает содержимое желудка от движения назад.
Если эти мышцы не смыкаются плотно, грубая желудочная кислота может попасть в пищевод. Это называется рефлюкс или гастроэзофагеальный рефлюкс (ГЭРБ). Это может привести к повреждению тканей с течением времени. Выстилка становится похожей на слизистую желудка.
ПБ чаще встречается у мужчин, чем у женщин. Люди, у которых была ГЭРБ в течение длительного времени, более склонны к этому заболеванию.
СЭ сам по себе не вызывает симптомов. Кислотный рефлюкс, вызывающий ПБ, часто приводит к симптомам изжоги. Многие люди с этим заболеванием не имеют никаких симптомов.
Вам может потребоваться эндоскопия, если симптомы ГЭРБ тяжелые или возвращаются после лечения.
Во время эндоскопии ваш эндоскопист может взять образцы тканей (биопсии) из разных частей пищевода. Эти образцы помогают определить состояние. Они также помогают искать изменения, которые могут привести к раку.
Ваш врач может порекомендовать повторную эндоскопию для выявления клеточных изменений, указывающих на рак, через регулярные промежутки времени.
ЛЕЧЕНИЕ ГЭРБ
Лечение должно облегчить симптомы кислотного рефлюкса и может предотвратить ухудшение ПБ. Лечение может включать изменение образа жизни и прием лекарств, таких как:
- Антациды после еды и перед сном
- Блокаторы гистаминовых h3-рецепторов
- Ингибиторы протонной помпы
- Отказ от табака, шоколада и кофеина
Изменение образа жизни, лекарства и антирефлюксная хирургия могут помочь при симптомах ГЭРБ. Однако эти шаги не заставят БЭ исчезнуть.
Однако эти шаги не заставят БЭ исчезнуть.
ЛЕЧЕНИЕ ПИЩЕДА БАРРЕТА
Эндоскопическая биопсия может показать изменения в клетке, которые могут быть раковыми. Ваш врач может посоветовать хирургическое вмешательство или другие процедуры для его лечения.
Некоторые из следующих процедур удаляют вредные ткани пищевода:
- Фотодинамическая терапия (ФДТ) использует специальное лазерное устройство, называемое пищеводным баллоном, вместе с лекарством Фотофрин.
- Другие процедуры используют различные типы высокой энергии для разрушения предраковых тканей.
- Операция по удалению аномальной подкладки.
Лечение должно облегчить симптомы кислотного рефлюкса и может предотвратить ухудшение ПБ. Ни одно из этих методов лечения не обратит вспять изменения, которые могут привести к раку.
Люди с хроническим ГЭРБ или эзофагитом Барретта обычно нуждаются в наблюдении за раком пищевода.
Свяжитесь со своим провайдером, если:
- Изжога длится дольше нескольких дней, или у вас есть боль или проблемы с глотанием.

- Вам поставили диагноз ПБ, и ваши симптомы ухудшаются.
- У вас появились новые симптомы (например, потеря веса, проблемы с глотанием).
Раннее выявление и лечение ГЭРБ может предотвратить ПБ.
Пищевод Барретта; ГЭРБ — Барретт; Рефлюкс — Барретт
- Пищеварительная система
- Анатомия пищевода и желудка
Фальк Г.В., Кацка Д.А. Заболевания пищевода. В: Goldman L, Schafer AI, ред. Медицина Гольдмана-Сесиля. 26-е изд. Филадельфия, Пенсильвания: Elsevier; 2020: глава 129.
Джексон А.С., Луи Б.Э. Лечение пищевода Барретта. В: Кэмерон А.М., Кэмерон Дж.Л., ред. Современная хирургическая терапия. 13-е изд. Филадельфия, Пенсильвания: Elsevier; 2020:19-25.
Ку Г.Я., Ильсон Д.Х. Рак пищевода. В: Нидерхубер Дж. Э., Армитаж Дж. О., Кастан М. Б., Дорошоу Дж. Х., Теппер Дж. Э., ред. Клиническая онкология Абелоффа. 6-е изд. Филадельфия, Пенсильвания: Elsevier; 2020: глава 71.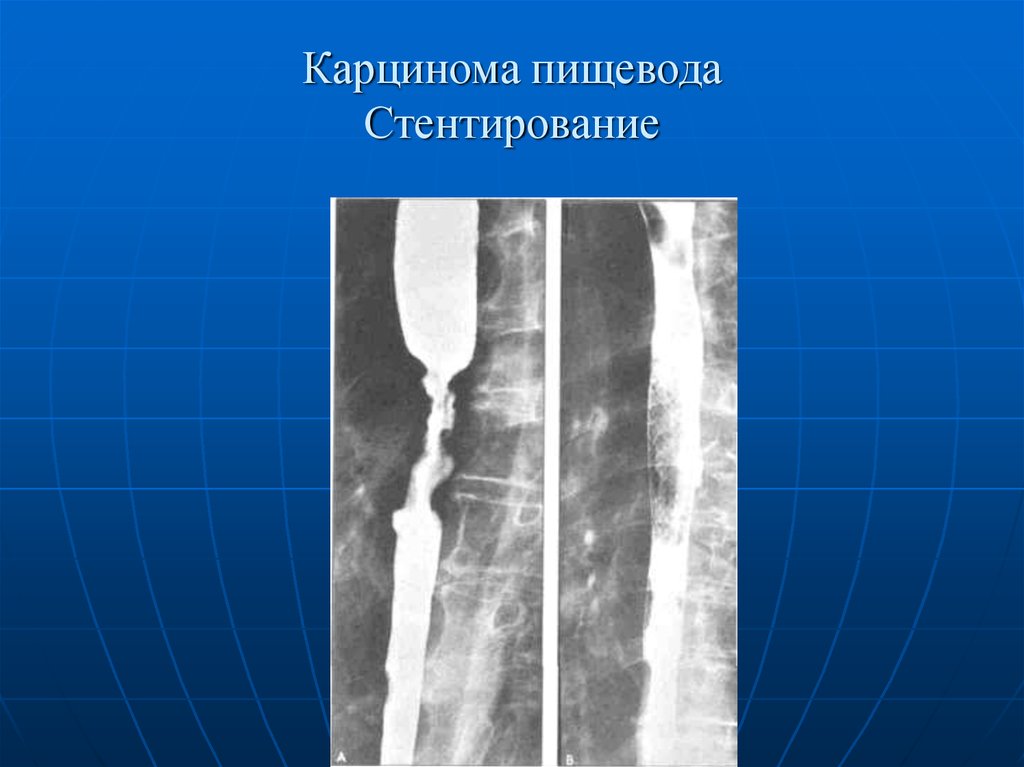

 При необходимости вы можете получить дополнительный кислород. Ваш поставщик медицинских услуг может использовать непрерывные рентгеновские изображения для наблюдения за процедурой. В других случаях он или она может использовать длинное тонкое устройство с небольшой камерой (эндоскоп).
При необходимости вы можете получить дополнительный кислород. Ваш поставщик медицинских услуг может использовать непрерывные рентгеновские изображения для наблюдения за процедурой. В других случаях он или она может использовать длинное тонкое устройство с небольшой камерой (эндоскоп).