Туберкулез антибиотики: Sivua ei löytynyt — venäjä
Туберкулёз
Исследование микобактерии туберкулёза не относится к приоритетным направлениям ГНЦ ВБ «Вектор», однако работы, начатые в 1999 году, продолжаются и приносят свои результаты.
Микобактерии туберкулёза были открыты более 100 лет назад, однако до сих пор эта болезнь остаётся одной из самой серьёзных социальных болезней. В отличие от многих других опасных инфекций, туберкулёз особенно опасен ещё и тем, что передаётся воздушно-капельным путём. Более того, на сегодняшний момент совершенно точно доказано, что для инфицирования микобактериями туберкулёза совсем не обязательно, чтобы имел место прямой контакт с больным человеком – инфицирование может произойти, если вы посещаете одни и те же места с больным туберкулезом – поликлиники, магазины, кинотеатры… Особенно «охотно» туберкулёз поражает людей с ослабленной иммунной системой.
В 90-е годы в ряде регионов мира, таких как Африка, территория бывшего
Советского Союза, начался стремительный рост числа заболеваний туберкулёзом, но
не просто туберкулёзом, а туберкулёзом с множественной лекарственной
устойчивостью.
 При
этом у ряда микобактерий туберкулёза возникает устойчивость не только к двум, а
к трём, четырём антибиотикам и эта проблема стала настолько острой, что в
октябре 2006 г., т.е. совсем недавно, ВОЗ ввела в обращение новый термин –
туберкулёз с широкой лекарственной устойчивостью. Такие формы туберкулеза
устойчивы не только к препаратам первой, но и второй линии, соответственно выбор
схем лечения туберкулеза с широкой лекарственной устойчивостью очень ограничен.
При
этом у ряда микобактерий туберкулёза возникает устойчивость не только к двум, а
к трём, четырём антибиотикам и эта проблема стала настолько острой, что в
октябре 2006 г., т.е. совсем недавно, ВОЗ ввела в обращение новый термин –
туберкулёз с широкой лекарственной устойчивостью. Такие формы туберкулеза
устойчивы не только к препаратам первой, но и второй линии, соответственно выбор
схем лечения туберкулеза с широкой лекарственной устойчивостью очень ограничен.Лекарственно устойчивые штаммы туберкулёза возникают естественным путём в
ходе спонтанного мутагенеза как ответная реакция на введение антибиотиков. Они,
как правило, обладают слабым фитнесом, т.е. они медленнее растут, слабее
размножаются, у них нет других преимуществ, за исключением устойчивости к
антибиотикам. И, соответственно, первоначальная стратегия при столкновении с
лекарственно устойчивыми штаммами заключалась в том, чтобы, во-первых,
антибиотики, направленные на лечение туберкулёза, были изъяты из широкой сети
обращения и использовались только в специализированных учреждениях и, во-вторых,
курс лечения проводился особым образом: сначала больного лечили антибиотиками,
потом делали перерыв, за это время оставшиеся лекарственно чувствительные штаммы
начинали доминировать, соответственно вытесняя лекарственно устойчивые варианты,
затем опять проводили химиотерапию, достигали хороших результатов, что снова
приводило к появлению лекарственно устойчивых штаммов, снова делали перерыв и
так до полного излечения.

И тогда первыми забеспокоились международные организации, потому что эпидемия любого заболевания, в том числе и туберкулёза, в одной стране, является проблемой многих. В данном случае это было связано и усугублялось миграцией, поскольку открылись все ворота, люди стали эмигрировать из бывшего Советского Союза, и в Западной Европе вдруг стали обнаруживать те генотипы туберкулёза, которые раньше там не регистрировались.
Ситуация ещё более осложнилась после того, как были обнаружены особые штаммы,
у которых очень специально устроен геном и которые мало того, что мутируют, как
и все микобактерии туберкулёза, но ещё и очень быстро адаптируются к новым
условиям. Эти штаммы получили название «пекинские», из-за того, что они впервые
были идентифицированы голландскими учёными в изолятах, полученных от больных в
Пекинском национальном институте здоровья. Потом оказалось, что ареал
распространения этих штаммов очень широк, это не только Китай, но и Монголия, а
также территория бывшего Советского Союза вплоть до Прибалтики, и другие страны
и регионы, вплоть до Америки. Отслеживая эти штаммы, удалось установить пути их
распространения. В частности, в Германии, где ситуация по туберкулёзу очень
благополучная, заболеваемость составляет всего 5 случаев на 100 000 населения, а
медицина нацелена на быстрое выявление, лечение и изучение этого заболевания, на
основании эпидемиологического расследования с использованием
молекулярно-генетических методов были установлены случаи заболевания, источником
которых оказались иммигранты из Казахстана. Таким образом, проблема лекарственно
устойчивого туберкулёза касается не только России, но является международной.
Эти штаммы получили название «пекинские», из-за того, что они впервые
были идентифицированы голландскими учёными в изолятах, полученных от больных в
Пекинском национальном институте здоровья. Потом оказалось, что ареал
распространения этих штаммов очень широк, это не только Китай, но и Монголия, а
также территория бывшего Советского Союза вплоть до Прибалтики, и другие страны
и регионы, вплоть до Америки. Отслеживая эти штаммы, удалось установить пути их
распространения. В частности, в Германии, где ситуация по туберкулёзу очень
благополучная, заболеваемость составляет всего 5 случаев на 100 000 населения, а
медицина нацелена на быстрое выявление, лечение и изучение этого заболевания, на
основании эпидемиологического расследования с использованием
молекулярно-генетических методов были установлены случаи заболевания, источником
которых оказались иммигранты из Казахстана. Таким образом, проблема лекарственно
устойчивого туберкулёза касается не только России, но является международной.
Несмотря на то, что со дня открытия туберкулёза прошло уже больше ста лет, микобактерия хорошо изучена, известен и расшифрован её геном, но, тем не менее, мы пока не имеем надёжных средств вакцинации от туберкулёза. Спектр имеющихся лекарственных препаратов из-за проблемы лекарственной устойчивости приходится постоянно расширять и модифицировать, и ещё одна большая проблема – это проблема ранней диагностики туберкулёза.
Кох, открыватель туберкулёза, получивший за это Нобелевскую премию, был
уверен, что можно быстро справиться с этой инфекцией. Но оказалось, что вакцина
Коха защиты не даёт. Тогда появилась другая вакцина, БЦЖ, но она защищает только
детей, а после 14 лет – что её вводи, что ни вводи – защиты нет. Кроме того,
эффективность использования этой вакцины значительно меняется в зависимости от
географического региона. В некоторых странах она обеспечивает высокую защиту
детей – до 80%, а в других – 0%.
 Возможно.
Этого никто не проверял. Мы готовы принять участие в таких исследованиях, и мы
могли бы найти те нуклеотидные замены, которые не должны присутствовать в
исходном штамме, и создать устройство, с помощью которого можно было бы
контролировать штаммы в ходе производства. Это позволяло бы проводить более
глубокий независимый внутренний производственный контроль. Это в любом случае
необходимо делать и, безусловно, это будет сделано, потому что любые живые
вакцины требуют такого контроля. Всё в этом мире меняется, хотим мы или нет, это
естественный, неизбежный процесс, возникают мутации, приобретаются какие-то
селективные преимущества, иногда эти селективные преимущества срабатывают в
организме, и это может привести к осложнениям. Такие работы – составление
генетических портретов вакцинных штаммов — необходимы для практического
здравоохранения и весьма интересны с научной точки зрения.
Возможно.
Этого никто не проверял. Мы готовы принять участие в таких исследованиях, и мы
могли бы найти те нуклеотидные замены, которые не должны присутствовать в
исходном штамме, и создать устройство, с помощью которого можно было бы
контролировать штаммы в ходе производства. Это позволяло бы проводить более
глубокий независимый внутренний производственный контроль. Это в любом случае
необходимо делать и, безусловно, это будет сделано, потому что любые живые
вакцины требуют такого контроля. Всё в этом мире меняется, хотим мы или нет, это
естественный, неизбежный процесс, возникают мутации, приобретаются какие-то
селективные преимущества, иногда эти селективные преимущества срабатывают в
организме, и это может привести к осложнениям. Такие работы – составление
генетических портретов вакцинных штаммов — необходимы для практического
здравоохранения и весьма интересны с научной точки зрения.Следующая проблема – диагностика. Для детей это – реакция Манту, для взрослых
– флюорография или томография. В ходе наших исследований и в ходе общения с
коллегами, мы поняли, что реакция Манту имеет весьма условное диагностическое
значение. Во-первых, реакция Манту не однозначна и существенно зависит от
иммунного статуса человека. Во-вторых, она не всегда обладает высокой
специфичностью и чувствительностью и не может отличить иммунитет, полученный при
вакцинации БЦЖ, от дикой бактерии. Ведь реакция Манту – это суммарные белки от
БЦЖ, и если вы вакцинированы БЦЖ, то они пересекаются с белками, полученными при
прививке, появляется папула, на основании чего возникает подозрение, и надо
проводить исследования дальше, тщательно проверять, что же происходит в
организме. Чувствительность реакции Манту очень высока, а специфичность очень
низкая, по оценкам некоторых специалистов она составляет всего 8-20%. Если же
ещё накладывается коассоциированная инфекция – ВИЧ, или гепатит, или
респираторные заболевания, то это вносит ещё большую путаницу.
Для детей это – реакция Манту, для взрослых
– флюорография или томография. В ходе наших исследований и в ходе общения с
коллегами, мы поняли, что реакция Манту имеет весьма условное диагностическое
значение. Во-первых, реакция Манту не однозначна и существенно зависит от
иммунного статуса человека. Во-вторых, она не всегда обладает высокой
специфичностью и чувствительностью и не может отличить иммунитет, полученный при
вакцинации БЦЖ, от дикой бактерии. Ведь реакция Манту – это суммарные белки от
БЦЖ, и если вы вакцинированы БЦЖ, то они пересекаются с белками, полученными при
прививке, появляется папула, на основании чего возникает подозрение, и надо
проводить исследования дальше, тщательно проверять, что же происходит в
организме. Чувствительность реакции Манту очень высока, а специфичность очень
низкая, по оценкам некоторых специалистов она составляет всего 8-20%. Если же
ещё накладывается коассоциированная инфекция – ВИЧ, или гепатит, или
респираторные заболевания, то это вносит ещё большую путаницу. Поэтому в случае
положительной реакции Манту необходимо провести подтверждающие диагностические
анализы с помощью более совершенных методов. Если же говорить о флюорографии или
результатах томографических исследований, то они выдают уже патологию. Т.е. это,
безусловно, очень нужная, но уже не ранняя диагностика.
Поэтому в случае
положительной реакции Манту необходимо провести подтверждающие диагностические
анализы с помощью более совершенных методов. Если же говорить о флюорографии или
результатах томографических исследований, то они выдают уже патологию. Т.е. это,
безусловно, очень нужная, но уже не ранняя диагностика.
«Вектор» никогда не был каким-то микробиологическим центром, и исследования
туберкулёза не были магистральным направлением наших исследований, но, тем не
менее, когда мы этой проблемой занялись, и нас поддержали из разных фондов, в
том числе международных, то нам удалось занять своё, вполне достойное место.
«Вектор» нашёл свою нишу в использовании молекулярно-эпидемиологических методов
для изучения проблемы туберкулёза. И здесь он оказался полезен, потому что на
«Векторе» существовали и существуют кадры, которые в состоянии освоить самые
сложные молекулярно-биологические методики, была внешняя поддержка, и мы
оказались весьма полезными для партнёров, потому что мы могли и умели делать то,
чего не могли сделать они сами. Система фтизиатрической службы подразумевает
наличие больниц, стационаров, которые работают по строго утверждённым методикам.
Головными кураторами фтизиатрической службы являются Центральный НИИ туберкулёза
и региональные НИИ туберкулёза, в частности, такой Институт есть и в
Новосибирске. Они обязаны курировать лечебные учреждения, следить за тем, как
они лечат, насколько адекватно утверждённым методикам. Сами они, конечно, тоже
разрабатывают новые схемы лечения. Основные задачи фтизиатрической службы – это
лечение и создание методов лечения, и кооперативное сотрудничество с любыми
учреждениями для изучения самого патогенеза этого заболевания. С молекулярными
биологами фтизиатрическая служба начала сотрудничать в 90-е годы и «Вектор»,
приступивший к этим работам в 1999 году, оказался на высоте.
Система фтизиатрической службы подразумевает
наличие больниц, стационаров, которые работают по строго утверждённым методикам.
Головными кураторами фтизиатрической службы являются Центральный НИИ туберкулёза
и региональные НИИ туберкулёза, в частности, такой Институт есть и в
Новосибирске. Они обязаны курировать лечебные учреждения, следить за тем, как
они лечат, насколько адекватно утверждённым методикам. Сами они, конечно, тоже
разрабатывают новые схемы лечения. Основные задачи фтизиатрической службы – это
лечение и создание методов лечения, и кооперативное сотрудничество с любыми
учреждениями для изучения самого патогенеза этого заболевания. С молекулярными
биологами фтизиатрическая служба начала сотрудничать в 90-е годы и «Вектор»,
приступивший к этим работам в 1999 году, оказался на высоте.
В то время руководство «Вектора» искало источники внешнего финансирования, а
одним из приоритетных направлений международных фондов, которые финансировали
научные работы в России, был туберкулёз. Начиналось же всё с одного
«провального» дела: необходимо было собрать коллекцию штаммов для того, чтобы на
этих штаммах проверить новые биочиповые технологии – работают они или не
работают, но за это не собирались платить деньги, только материалы – реактивы,
пипетки и т.д., и получилось так, что подвизались на это дело многие, а
исхитрились и выполнили эту работу только мы. Набрали несколько десятков штаммов
и как позже оказалось, это было как раз то, что нужно – ключевые штаммы. Дальше
начались совместные исследования с Институтом молекулярной биологии им.
В.А.Энгельгардта. И тогда возникла тема, которая была энергично поддержана –
использование биочиповой технологии при ранней диагностике лекарственно
устойчивого туберкулёза. Мы оказались в соисполнителях, нам были выделены
средства, благодаря которым лаборатория и пережила наиболее трудные годы. Здесь
нам удалось получить хорошие результаты: мы адаптировали новую биочиповую
технологию к массовому применению.
Начиналось же всё с одного
«провального» дела: необходимо было собрать коллекцию штаммов для того, чтобы на
этих штаммах проверить новые биочиповые технологии – работают они или не
работают, но за это не собирались платить деньги, только материалы – реактивы,
пипетки и т.д., и получилось так, что подвизались на это дело многие, а
исхитрились и выполнили эту работу только мы. Набрали несколько десятков штаммов
и как позже оказалось, это было как раз то, что нужно – ключевые штаммы. Дальше
начались совместные исследования с Институтом молекулярной биологии им.
В.А.Энгельгардта. И тогда возникла тема, которая была энергично поддержана –
использование биочиповой технологии при ранней диагностике лекарственно
устойчивого туберкулёза. Мы оказались в соисполнителях, нам были выделены
средства, благодаря которым лаборатория и пережила наиболее трудные годы. Здесь
нам удалось получить хорошие результаты: мы адаптировали новую биочиповую
технологию к массовому применению. Например, мы научились эти биочипы
регенирировать, т.е. использовать несколько (до 7 раз) раз без снижения качества
результата, что снижает стоимость такого чипа почти в 10 раз и делает анализ
доступным для большой сети учреждений.
Например, мы научились эти биочипы
регенирировать, т.е. использовать несколько (до 7 раз) раз без снижения качества
результата, что снижает стоимость такого чипа почти в 10 раз и делает анализ
доступным для большой сети учреждений.
Далее работы по ранней диагностике были продолжены. На тот момент мы исходили
из того, что любая диагностика должна быть доступна, в том числе и экономически,
быстра и достоверна. Если взять диагностические методы, которые уже были
разработаны – реакция Манту, иммуноферментный анализ (ИФА), ПЦР-анализ, то
однозначного результата они не давали, одни – из-за низкой чувствительности,
другие – из-за низкой специфичности. И мы, что называется, «начали с начала» —
детально проработали литературу, чтобы понять, а что вообще творится в этой
области. И выяснилось, что у микобактерии туберкулёза более 1500 белков, но из
них функционально значимых для практики около 200, а среди этих 200 есть два
белка, всего два(!), которые позволяют достичь и специфичности, и
чувствительности анализа на уровне 96-100%. Но не в традиционных на тот момент
технологиях, а в новых – Т-клеточных технологиях. Суть их в следующем: когда в
организм попадает какой-то возбудитель, на него реагируют, прежде всего, именно
Т-клетки иммунной системы, которые в результате сложного взаимодействия образуют
Т-клеточные комплексы. Эти комплексы отличаются от других и могут быть
определены высокоспецифичными методами. И оказалось, что в случае туберкулёза
Т-клеточный комплексы образуется именно с двумя видоспецифическими только для
микобактерий туберкулёза секреторным белками. При этом исключается образование
комплекса с белками каких-либо сопутствующих заболеваний, таких как гепатит или
ВИЧ. Это позволяет на очень ранних стадиях определить, инфицирован человек или
нет, потому что с помощью этого метода можно найти всего одну клетку макрофага,
инфицированную микобактерией туберкулеза, когда ещё цитология и флюорография
чистая, антител тоже нет, а человек уже является инфицированным.
Но не в традиционных на тот момент
технологиях, а в новых – Т-клеточных технологиях. Суть их в следующем: когда в
организм попадает какой-то возбудитель, на него реагируют, прежде всего, именно
Т-клетки иммунной системы, которые в результате сложного взаимодействия образуют
Т-клеточные комплексы. Эти комплексы отличаются от других и могут быть
определены высокоспецифичными методами. И оказалось, что в случае туберкулёза
Т-клеточный комплексы образуется именно с двумя видоспецифическими только для
микобактерий туберкулёза секреторным белками. При этом исключается образование
комплекса с белками каких-либо сопутствующих заболеваний, таких как гепатит или
ВИЧ. Это позволяет на очень ранних стадиях определить, инфицирован человек или
нет, потому что с помощью этого метода можно найти всего одну клетку макрофага,
инфицированную микобактерией туберкулеза, когда ещё цитология и флюорография
чистая, антител тоже нет, а человек уже является инфицированным. И если у вас
обнаруживается 1-5 таких клеток, вы уже должны встать на учёт. И что ещё очень
важно, Т-клеточные технологии различают иммунные ответы на белки, введённые при
вакцинации БЦЖ и белки «диких» штаммов.
И если у вас
обнаруживается 1-5 таких клеток, вы уже должны встать на учёт. И что ещё очень
важно, Т-клеточные технологии различают иммунные ответы на белки, введённые при
вакцинации БЦЖ и белки «диких» штаммов.
Т-клеточные технологии предоставляют практическим врачам и учёным огромные
возможности и могут использоваться для очень широкого применения. Доработка и
сертификация этой технологии потребует финансовой поддержки и времени – 3-4
года. Кроме того, для внедрения Т-клеточных технологий потребуется,
соответствующая приборная база, а эти приборы достаточно дороги (сейчас есть
несколько таких приборов в Москве, а у нас в Сибири один прибор в Институте
иммунологии в Новосибирске и у нас, на «Векторе», т.е. всего два прибора на всей
территории от Урала до Дальнего Востока). Ещё одна особенность Т-клеточных
технологий – для них необходимы живые клетки. Естественно, они требуют и особо
бережного отношения. Т.е. это — новый уровень развития диагностических
лабораторий. Однако общемировая тенденция заключается в том, что дорогостоящее
оборудование не может быть доступно каждой больнице. Им оснащаются какие-то
межрегиональные центры. И таким образом, возникает только организационный вопрос
– как быстро и каким образом доставлять образцы в эти центры. В Германии
пациенты, чтобы сдать аналогичный анализ, выезжают за 100-200 км, а это огромное
расстояние по масштабам Германии, либо образец передаётся в специализированный
диагностический центр, потому что далеко не любая клиника «потянет» такое
клиническое оборудование. Отсюда возникает система использования диагностических
методов: с начала используются самые простые и дешёвые методы, далее – более
сложные и дорогостоящие, и, наконец, дело может дойти и до очень специфических и
дорогих технологий, когда надо уже окончательно поставить диагноз или вести
мониторинг за конкретным больным.
это — новый уровень развития диагностических
лабораторий. Однако общемировая тенденция заключается в том, что дорогостоящее
оборудование не может быть доступно каждой больнице. Им оснащаются какие-то
межрегиональные центры. И таким образом, возникает только организационный вопрос
– как быстро и каким образом доставлять образцы в эти центры. В Германии
пациенты, чтобы сдать аналогичный анализ, выезжают за 100-200 км, а это огромное
расстояние по масштабам Германии, либо образец передаётся в специализированный
диагностический центр, потому что далеко не любая клиника «потянет» такое
клиническое оборудование. Отсюда возникает система использования диагностических
методов: с начала используются самые простые и дешёвые методы, далее – более
сложные и дорогостоящие, и, наконец, дело может дойти и до очень специфических и
дорогих технологий, когда надо уже окончательно поставить диагноз или вести
мониторинг за конкретным больным.
В России Т-клеточные технологии пока не внедрены. А в мире эти технологии уже внедрены в Германии и США, в специализированных крупных центрах, что надо делать и нам. Там не только есть центры, но действует система иммунологического мониторинга и система мониторинга генотипов микобактерии туберкулёза. Это позволяет реально оценивать эффективность всех противотуберкулёзных мероприятий, позволяет изучать процессы, которые реально происходят с микобактерией туберкулёза, вовремя выявлять эпидемические очаги, а не работать, как это делали раньше, по территориям в целом.
Работы по изучению туберкулёза всегда велись учёными «Вектора» в плотном
контакте с фтизиатрической службой. В частности, с Новосибирским НИИ
туберкулёза, зона ответственности которого простирается от Урала и до Дальнего
Востока. Возглавляет его профессор Краснов. У нас готовятся к выходу совместные
публикации, в которых мы оценили эпидемиологическую ситуацию в Новосибирской
области, оценили генетическое разнообразие штаммов микобактерий туберкулёза,
которые здесь циркулируют, попытались изучить взаимосвязи между клиническими
проявлениями и какими-то специальными генетическими структурами или генотипом,
чтобы дать какой-то инструмент для того, чтобы оценить процесс, который
происходит. Аналогичные творческие очень хорошие связи у нас с городским
противотуберкулёзным диспансером. Совместно мы тоже выполнили ряд совместных
исследований, часть из которых была опубликована. Цель работ – изучить
эффективность применения новых технологий для определения лекарственной
устойчивости микобактерий туберкулёза. Не менее интересные работы проводятся у
нас и с Сибирским государственным медицинским университетом.
Аналогичные творческие очень хорошие связи у нас с городским
противотуберкулёзным диспансером. Совместно мы тоже выполнили ряд совместных
исследований, часть из которых была опубликована. Цель работ – изучить
эффективность применения новых технологий для определения лекарственной
устойчивости микобактерий туберкулёза. Не менее интересные работы проводятся у
нас и с Сибирским государственным медицинским университетом.
Осенью 2007 года мы были приглашены для работы в Туберкулёзном кластере.
Туберкулёзный кластер – это российское добровольное сообщество учёных,
работающих над проблемой туберкулёза. Они устраивают меж собой взаимный обмен
информацией, координируют свои усилия и в том числе пытаются лоббировать в
хорошем смысле этого слова интересы своего научного сообщества в государственных
кругах. Пригласили нас, т.к. знали по работам и, кроме того, поступили
рекомендации из разных источников. В работе кластера принимали участие и ведущие
специалисты из Европы, и наиболее сильные группы, занимающиеся изучением
молекулярной эпидемиологии туберкулёза из Центрального НИИ туберкулёза, из
Санкт-Петербурга, Московского института им. Сеченова, СО РАМН. Прошло это в виде
двухдневной конференции, были представлены результаты по эпидемиологии и
молекулярной иммунологии туберкулёза в Европе по разным странам, по возможным
подходам к поиску вакцинных препаратов, прозвучали доклады москвичей,
санкт-петербуржцев, наш доклад, схлестнулись разные точки зрения по научным
концепциям. Наш доклад вызвал большой интерес и у представителей Европейского
бюро ВОЗ, которые принимали участие в работе кластера. Результатом работы
кластера явилось соглашение, в котором определилась цель его работы, определены
координаторы, в частности, по Новосибирску и Западной Сибири координатором
определён С.И.Татьков, что, несомненно, свидетельствует о высокой оценке работ,
проведённых учёными «Вектора». Ну, а каким будет продолжение работ и будет ли
оно вообще – покажет время.
Сеченова, СО РАМН. Прошло это в виде
двухдневной конференции, были представлены результаты по эпидемиологии и
молекулярной иммунологии туберкулёза в Европе по разным странам, по возможным
подходам к поиску вакцинных препаратов, прозвучали доклады москвичей,
санкт-петербуржцев, наш доклад, схлестнулись разные точки зрения по научным
концепциям. Наш доклад вызвал большой интерес и у представителей Европейского
бюро ВОЗ, которые принимали участие в работе кластера. Результатом работы
кластера явилось соглашение, в котором определилась цель его работы, определены
координаторы, в частности, по Новосибирску и Западной Сибири координатором
определён С.И.Татьков, что, несомненно, свидетельствует о высокой оценке работ,
проведённых учёными «Вектора». Ну, а каким будет продолжение работ и будет ли
оно вообще – покажет время.
Новые препараты не дали возбудителю туберкулеза избавиться от антибиотиков
16 февраля, 2022 13:36
Источник: Пресс-служба РНФ
Российские ученые совместно с коллегами из ЮАР предложили препараты, которые блокируют белки-насосы бактерий, способные буквально выбрасывать лекарство из клетки. Хотя сами эти вещества не являются антибиотиками, они помогут победить лекарственную устойчивость патогенных микроорганизмов. Новые исследования раскрывают механизмы развития резистентности бактерий к антибиотикам и вносят значительный вклад в создание препаратов против штаммов туберкулеза с лекарственной устойчивостью. Работы выполнены при финансовой поддержке Российского научного фонда (РНФ). Результаты опубликованы в журнале Biomedicines.
Хотя сами эти вещества не являются антибиотиками, они помогут победить лекарственную устойчивость патогенных микроорганизмов. Новые исследования раскрывают механизмы развития резистентности бактерий к антибиотикам и вносят значительный вклад в создание препаратов против штаммов туберкулеза с лекарственной устойчивостью. Работы выполнены при финансовой поддержке Российского научного фонда (РНФ). Результаты опубликованы в журнале Biomedicines.
Туберкулез стал настоящим бедствием ХХ столетия. Это инфекционное заболевание, возбудителем которого является палочка Коха, поражающая легкие человека. Успехи современной медицины позволяют выявлять и эффективно лечить туберкулез на ранних стадиях, тогда как раньше болезнь считалась непобедимой. Тем не менее, за период с 2015 по 2020 год число случаев смерти от туберкулеза во всем мире снизилось всего лишь на 9,2%. В результате пандемии COVID-19 показатели смертности также возросли, так как ухудшился доступ к лечению и профилактической терапии туберкулеза, особенно в период самоизоляции. Усугубляющим фактором стало и то, что бесконтрольный прием антибиотиков способствовал высокому уровню заболеваемости патогеном с множественной лекарственной устойчивостью.
В результате пандемии COVID-19 показатели смертности также возросли, так как ухудшился доступ к лечению и профилактической терапии туберкулеза, особенно в период самоизоляции. Усугубляющим фактором стало и то, что бесконтрольный прием антибиотиков способствовал высокому уровню заболеваемости патогеном с множественной лекарственной устойчивостью.
«Одним из биохимических механизмов, обеспечивающих развитие антибиотикорезистентности, является выведение лекарства из бактериальной клетки. Отвечают за это специфические мембранные белки-насосы или эффлюксные помпы, буквально выбрасывающие опасные для возбудителя болезни молекулы. Они могут стать мишенью для эффективной борьбы с лекарственной устойчивостью», — отмечает руководитель проекта по гранту РНФ Дмитрий Маслов, кандидат биологических наук, старший научный сотрудник лаборатории генетики микроорганизмов Института общей генетики имени Н. И. Вавилова РАН.
В своей новой работе ученые из ИОГен РАН (Москва), Университета Западной Капской провинции (Южная Африка), Российского университета дружбы народов (Москва) и Южно-уральского государственного университета (Челябинск) и исследовали белковые помпы непатогенной микобактерии Mycobacterium smegmatis — близкого родственника возбудителей туберкулеза.
Эксперимент с бактериальной культурой. Бумажные кружки пропитаны антибиотиком (3а) и ингибиторами эффлюксных помп; их поместили на среду с высеянными микроорганизмами. Выявленные препараты сами по себе не уничтожают микобактерий, но усиливают эффект антибиотика — это видно по светлому ареолу вокруг бумажного кружка. Источник: Дмитрий Маслов
Система эффлюкса MmpS5-MmpL5 этого микроорганизма способна откачивать основные противотуберкулезные препараты. Методами молекулярного моделирования ученые создали ее теоретическую модель и определили подходящие для ее блокирования препараты из базы антибактериальных соединений ASINEX в почти 6 000 молекул. Из 100 определенных ингибиторов были отобраны пять наилучших, которые потенциально могут хорошо выводиться из организма, а также безопасны для животных клеток. Серия экспериментов in vitro на микобактериях подтвердила эффективность двух соединений, предсказанную теоретической 3D-моделью и вычислительными расчетами.
«Мы рассчитываем, что на основе полученных результатов можно будет усовершенствовать созданную модель и отобрать больше таких молекул из баз данных Gold & Platinum ASINEX. В дальнейшем их предстоит проверить непосредственно на микобактериях туберкулеза. Результаты наших исследований найдут применение в разработке новых эффективных препаратов, способных помогать существующим противотуберкулезным лекарствам, например бедаквилину, преодолевать лекарственную устойчивость туберкулеза, обусловленную эффлюксом», — подводит итог Дмитрий Маслов.
Теги
Пресс-релизы
Лечение туберкулеза: антибиотики
Туберкулез (ТБ) поражал людей на протяжении тысячелетий — даже древние греки искали лекарство. Но эффективного лечения туберкулеза не существовало до середины 1800-х годов, когда впервые стали применяться санатории или лечение «на открытом воздухе». Это привело к созданию учреждений, предназначенных для размещения и ухода за больными туберкулезом. Санаторно-курортное лечение включало в себя отдых, свежий воздух и полноценное питание для укрепления естественной защиты организма от бактерий, вызывающих туберкулез. (1,2) Пребывание в санатории также включало изоляцию, чтобы другие не заразились.
Санаторно-курортное лечение включало в себя отдых, свежий воздух и полноценное питание для укрепления естественной защиты организма от бактерий, вызывающих туберкулез. (1,2) Пребывание в санатории также включало изоляцию, чтобы другие не заразились.
Первый антибиотик против туберкулеза, стрептомицин, был разработан в 1940-х годах. Вскоре после этого, в 1950-х годах, вместе с группой препаратов, называемых рифамицинами, был разработан препарат изониазид. Использование антибиотиков заменило потребность в санаториях, и число людей с этим заболеванием в США и других развитых странах начало резко снижаться. (1,2)
Число случаев заболевания в Соединенных Штатах снова начало расти в середине 1980-х годов, в основном из-за эпидемии ВИЧ и сокращения финансирования программ общественного здравоохранения в целом и противотуберкулезных клиник в частности. Теперь латентный ТБ (когда бактерии присутствуют, но дремлют в вашем организме и не делают вас больными или заразными) и активный ТБ можно эффективно лечить у людей с ВИЧ. (3)
(3)
Туберкулез по-прежнему распространен в некоторых странах, при этом самые высокие показатели новых случаев заболевания наблюдаются в Индии, Индонезии, Китае, Филиппинах, Пакистане, Бангладеш, Нигерии и Южной Африке. Всемирная организация здравоохранения (ВОЗ) считает туберкулез одной из главных причин смерти во всем мире. Во многом это связано с отсутствием ресурсов общественного здравоохранения и доступа к качественной медицинской помощи. (4)
Антибиотики, используемые для лечения туберкулеза
В настоящее время существует несколько препаратов, одобренных для использования против туберкулеза. Курс лечения зависит от того, есть ли у человека латентный или активный туберкулез. Людей с латентным туберкулезом обычно лечат профилактически, чтобы в будущем болезнь не активизировалась и не распространилась на других. Латентный ТБ можно лечить одним препаратом, а активный ТБ обычно требует комбинации четырех препаратов.
Лечение латентного ТБ может проходить под наблюдением вашего лечащего врача, в то время как люди с активным ТБ будут направлены для лечения к специалисту по инфекционным заболеваниям.
Ряд препаратов можно использовать для лечения туберкулеза, и их часто комбинируют для достижения лучших результатов: (5)
- изониазид
- рифампин (рифадин)
- пиразинамид
- этамбутол стандартный (миамбутол)
Поскольку очень многие штаммы туберкулеза выработали устойчивость к определенным антибиотикам, лечение активного туберкулеза включает введение нескольких различных антибиотиков, обладающих противотуберкулезной активностью. Лабораторные тесты, известные как тесты на лекарственную чувствительность, могут определить, какие антибиотики с большей вероятностью излечат конкретный случай туберкулеза. (4,5)
Лечение наркозависимости обычно длится не менее шести месяцев, а иногда и дольше. Слишком раннее прекращение лечения может привести к рецидиву инфекции и развитию лекарственно-устойчивого туберкулеза.
Используемые препараты и продолжительность лечения одинаковы как для взрослых, так и для детей, по словам Алексеи Гаффни-Адамс, доктора медицинских наук, терапевта и педиатра со специализацией в области инфекционных заболеваний в Stony Brook Medicine в Смиттауне, Нью-Йорк. Она отмечает, что дозировка зависит от веса человека.
Она отмечает, что дозировка зависит от веса человека.
У людей с туберкулезом, принимающих лекарства, обычно не бывает рецидивов, говорит Ли Райхман, доктор медицины, магистр здравоохранения, пульмонолог из Ньюарка, штат Нью-Джерси.
Изоляция для людей с активным туберкулезом легких
Туберкулез считается проблемой общественного здравоохранения. По этой причине изоляция все еще является частью современного лечения туберкулеза. Человек с активным туберкулезом легких (в отличие от латентного туберкулеза) должен быть изолирован до тех пор, пока он не ответит на лечение. Активное заболевание все еще может распространяться на других, пока человек не примет несколько доз лекарства.
Это может означать, что вы остаетесь дома или находитесь на карантине в медицинском учреждении. Обычно требуется не более двух недель, чтобы лекарства предотвратили заражение человека. Но для людей с лекарственно-устойчивым туберкулезом рекомендации по изоляции остаются неясными. (6)
Появление лекарственно-устойчивых туберкулезных супербактерий
Лечение туберкулеза и борьба с распространением болезни осложнились во всем мире появлением туберкулеза с множественной лекарственной устойчивостью (МЛУ-ТБ), который определяется как штаммы туберкулеза, которые не реагируют на изониазид и рифампин, два препарата, которые являются краеугольным камнем лечения туберкулеза.
ВОЗ считает МЛУ-ТБ глобальной кризисной ситуацией в области общественного здравоохранения. В 2021 г. во всем мире было зарегистрировано около 450 000 новых случаев МДБ/РУ-ТБ (термин, который также включает случаи устойчивости только к рифампицину), причем почти половина из них приходится на Африку и Юго-Восточную Азию.
У некоторых людей развивается еще более сильная, более серьезная форма МЛУ-ТБ, известная как туберкулез с широкой лекарственной устойчивостью (ШЛУ-ТБ). Люди с ШЛУ-ТБ могут остаться без вариантов лечения, если бактерии станут устойчивыми к наиболее эффективным препаратам второго ряда. (4)
Подробнее о лекарственной устойчивости
Антибиотики часто назначают людям без инфекций, как показывает исследование
Лекарственно-устойчивый ТБ гораздо реже встречается в Соединенных Штатах. Центры по контролю и профилактике заболеваний (CDC) сообщили о 77 случаях МЛУ-ТБ в 2021 г. (7)
Бактерии, вызывающие инфекцию, естественным образом адаптируются, чтобы стать устойчивыми к определенным антибиотикам, превращаясь в супербактерии , на которые не действует большинство антибиотиков.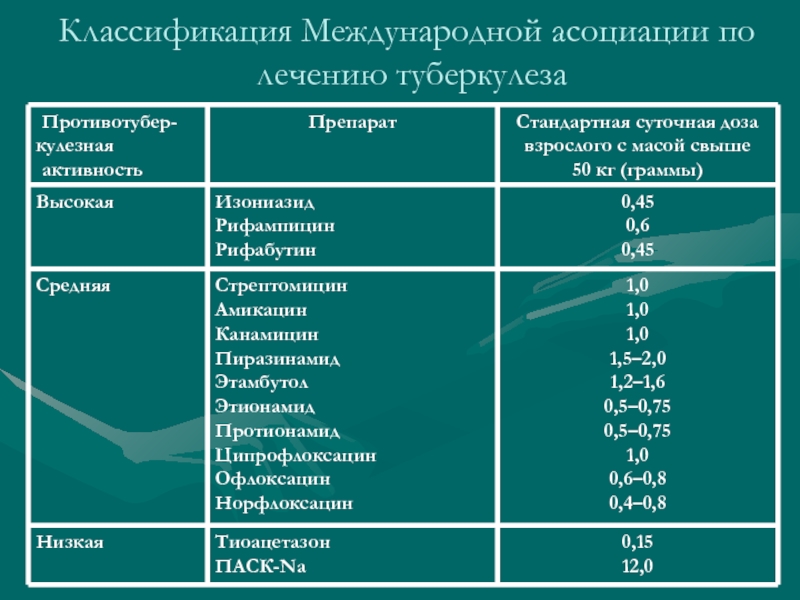 Но то, как люди использовали антибиотики на протяжении многих лет, ускорило этот процесс.
Но то, как люди использовали антибиотики на протяжении многих лет, ускорило этот процесс.
Некоторые причины лекарственно-устойчивого ТБ включают следующие тактики:
- Чрезмерное использование антибиотиков, например, их прием для лечения вирусных инфекций, при которых они неэффективны, является одной из причин того, что некоторые бактерии стали устойчивыми к обычным антибиотикам.
- Когда поставщик медицинских услуг прописывает неправильный препарат или дозу, бактерии могут стать устойчивыми.
- В некоторых регионах мира нет доступа к надлежащим лекарствам, необходимым для лечения больных туберкулезом.
Другая серьезная проблема возникает, когда люди не проходят полный курс антибиотиков при наличии бактериальной инфекции. При раннем прекращении приема антибиотиков бактерии, которые еще не были убиты, часто вырабатывают устойчивость к лекарству, используемому для лечения. Это обычная проблема при лечении туберкулеза, при котором антибиотики необходимо принимать ежедневно в течение нескольких месяцев. (8)
(8)
Лечение лекарственно-устойчивого ТБ может длиться от 20 до 30 месяцев и включать комбинацию антибиотиков, как инъекционных, так и пероральных. (9)
К широко используемым инъекционным препаратам относятся следующие:
- амикацин (амикин)
- капреомицин
- стрептомицин
Бедаквилин (Сиртуро) – это новый антибиотик, который можно добавлять к существующей комбинации.
Терапия под непосредственным наблюдением для помощи в лечении туберкулеза
Одним из подходов, которые должностные лица общественного здравоохранения применяют для борьбы с туберкулезом с множественной лекарственной устойчивостью, является терапия под непосредственным наблюдением (DOT). В DOT обученный медицинский работник выдает каждую дозу лекарства, наблюдает за тем, как человек ее проглатывает, и документирует, что лекарство было принято. Специалист может встретиться с человеком дома или в противотуберкулезном диспансере. (10)
«Вы перестаете быть заразными в течение недели или двух после приема лекарства, — говорит доктор Райхман. Когда люди больше не чувствуют себя больными, может возникнуть соблазн прекратить прием лекарств до того, как они закончат работу по уничтожению всех бактерий туберкулеза. «Симптомы проходят очень быстро, поэтому люди думают, что им не нужно принимать оставшуюся часть лекарства», — говорит он.
Когда люди больше не чувствуют себя больными, может возникнуть соблазн прекратить прием лекарств до того, как они закончат работу по уничтожению всех бактерий туберкулеза. «Симптомы проходят очень быстро, поэтому люди думают, что им не нужно принимать оставшуюся часть лекарства», — говорит он.
Исследования показывают более высокий уровень излечения среди людей, получающих ДОТ, чем среди тех, кто самостоятельно принимает противотуберкулезные препараты. В США с 19С 93 по 2013 г. у людей с МЛУ-ТБ, получавших лечение по схеме DOT, уровень смертности был на 77 % ниже, чем у людей, ответственных за прием собственных лекарств. Этот показатель успеха также может быть связан с тем, что люди получают доступ к другим ресурсам, находясь под наблюдением. (11)
Хотя любой больной туберкулезом является кандидатом на DOT, CDC особо рекомендует, чтобы его получали люди из следующих групп:
- Люди с лекарственно-устойчивым ТБ
- Люди, получающие прерывистую терапию
- Бездомные или люди с нестабильным жильем
- Люди, злоупотребляющие алкоголем или запрещенными наркотиками
- Люди, которые не могут самостоятельно принимать таблетки из-за умственной, эмоциональной или физической неполноценности
- Дети и подростки следуя предписанному режиму приема лекарств
Райхман отмечает, что технологии позволяют проводить DOT с помощью видео, что теперь доступно для некоторых людей.
Возможные побочные эффекты противотуберкулезных препаратов
Лекарства для лечения туберкулеза могут быть токсичными для печени. Даже людям, которые не находятся под DOT, необходимо будет регулярно посещать своего врача во время лечения, чтобы контролировать, насколько хорошо их организм переносит лекарства. (12)
Побочные эффекты встречаются нечасто, но могут быть опасны, если они случаются. (9,12)
Немедленно обратитесь к врачу, если вы испытываете что-либо из следующего:
- Пожелтение кожи или глаз
- Тошнота или рвота
- Потеря аппетита
- Необъяснимая лихорадка, которая не проходит
- Темная моча
Лучший антибиотик для лечения туберкулеза | Новости
Харим Вон 12 мая 2022 г. — В течение последних нескольких лет своего докторского исследования Харим Вон закладывал основу для разработки нового типа антибиотика для лечения туберкулеза (ТБ), решая давние проблемы длительного лечения. и устойчивость к антибиотикам. Вон использует новый подход, чтобы настроить нормальную белковую систему в бактериальной клетке против самой себя.
Вон использует новый подход, чтобы настроить нормальную белковую систему в бактериальной клетке против самой себя.
Вон, который работает в лаборатории Эрика Рубина, адъюнкт-профессора иммунологии и инфекционных заболеваний Гарвардского университета Т.Х. Школа общественного здравоохранения Чана получает степень в области биологических наук в области общественного здравоохранения.
В январе Высшая школа искусств и наук назвала Вона стипендиатом Harvard Horizons 2022 года. Отобранный за свои многообещающие исследования, он вместе с семью другими учеными Horizons получил возможность поделиться своей работой на публичном симпозиуме в середине апреля.
Поскольку лечение туберкулеза длится от шести месяцев для типичных случаев до двух лет для случаев с множественной лекарственной устойчивостью, медицинские работники каждый день посещают пациентов на дому, чтобы обеспечить постоянный прием антибиотиков. Пандемия COVID-19 нарушила этот процесс, особенно в странах с низким и средним уровнем доходов и ограниченными ресурсами. В результате после многих лет неуклонного снижения смертности от туберкулеза тенденция изменилась.
В результате после многих лет неуклонного снижения смертности от туберкулеза тенденция изменилась.
Традиционная стратегия поиска более эффективных антибиотиков за последние несколько десятилетий показала ограниченный успех. «Если вы думаете о бактериальной клетке как об электрической точилке для карандашей, один из бактериальных белков можно сравнить с лезвиями точилки», — объяснил Вон. «Если вы возьмете Silly Putty и воткнете его прямо в лезвия, это перестанет работать этот компонент, и точилка не сработает, подобно тому, как бактериальная клетка погибнет, если молекула антибиотика застрянет в белке. Вместо этого, что, если бы мы могли каким-то образом заставить точилку пережевать собственную проводку?»
Поскольку традиционная молекула антибиотика помещается в один конкретный участок белка, единственная мутация в нем может предотвратить связывание и привести к лекарственной устойчивости.
Вон обратился за вдохновением к другим областям, приняв подход, называемый направленной деградацией белка, который использовался для создания лекарств от рака. Адаптируя стратегию для бактерий, вместо одной молекулы антибиотика, прилипающей к одному бактериальному белку, метод использует двуглавую молекулу, которая связывается как с целевым белком, так и с белковой системой, называемой протеазой. «Мы можем думать о протеазе как о мусоропроводе в клетке. Его работа включает в себя пережевывание старых белков или тех, которые испорчены по той или иной причине. При целенаправленной деградации белка вы берете нормальную систему клеток и перенаправляете ее на уничтожение белков, вызывающих заболевание», — сказал он.
Адаптируя стратегию для бактерий, вместо одной молекулы антибиотика, прилипающей к одному бактериальному белку, метод использует двуглавую молекулу, которая связывается как с целевым белком, так и с белковой системой, называемой протеазой. «Мы можем думать о протеазе как о мусоропроводе в клетке. Его работа включает в себя пережевывание старых белков или тех, которые испорчены по той или иной причине. При целенаправленной деградации белка вы берете нормальную систему клеток и перенаправляете ее на уничтожение белков, вызывающих заболевание», — сказал он.
По сравнению с традиционным антибиотиком, двухголовая молекула теоретически может прикрепляться к целевому белку и протеазе в любом месте, а не только в одном месте, что дает исследователям больше возможностей для разработки лекарств и борьбы с устойчивостью к антибиотикам.
В экспериментах по проверке концепции Вон использовал методы генной инженерии для модификации потенциальных белков-мишеней и протеазы. Он добавил метки, которые сближали две части внутри клетки, имитируя роль двуглавой молекулы. Он обнаружил, что протеаза действительно может расщеплять целевые белки и воздействовать на бактерии, либо уменьшая рост бактерий, либо делая бактерии более чувствительными к существующему антибиотику.
Он обнаружил, что протеаза действительно может расщеплять целевые белки и воздействовать на бактерии, либо уменьшая рост бактерий, либо делая бактерии более чувствительными к существующему антибиотику.
Вон провел эксперименты в чашке Петри с использованием бактериального штамма, который моделирует туберкулез, поэтому следующие шаги включают тестирование с использованием бактерий туберкулеза и моделей заболевания на животных. Как только эксперименты определят лучшие целевые белки, лаборатория будет сотрудничать с химиками, чтобы найти молекулу, которая связывается с белками и протеазой.
«Наш подход к разработке новых антибиотиков в значительной степени заключается в том, чтобы попытаться выяснить, как заглушить работу организма, вызывающую инфекцию», — сказал Рубин. «Гарри идет совсем другим путем, настраивая основную бактериальную систему против самой себя. Это открывает совершенно новый путь к разработке противоинфекционных препаратов».
В целом, Вон рассматривает разработку антибиотиков как вопрос справедливости.
