Увеличение полого органа в толщину: Увеличение. утолщение полового члена в Новосибирске
Утолщение полового члена / Изменение размеров полового члена / Андрология и генитальная хирургия, врач уролог, андролог Барнаул
Утолщение полового члена – это хирургические методики увеличения диаметра пениса. Для качественной половой жизни толщина полового члена имеет большее значение.
В настоящее время отмечается устойчивый рост интереса к операциям, позволяющим увеличить размеры полового члена. Как правило, по вопросу увеличения гениталий обращаются мужчины с нормальными размерами полового члена, но неудовлетворенные качеством сексуальной жизни. Избавиться от комплекса такие мужчины могут, только сделав микрохирургическое утолщение полового члена. Таким образом, становится понятно, что основным мотивом пациентов для увеличения размеров полового члена является желание соответствовать символу мужественности и сексуальности. Этот символ сложился исторически и в последнее время культивируется средствами массовой информации.
На основании вышесказанного становится понятно, что четкие медицинские показания для проведения операций по увеличению размеров полового члена не определены. Единственным основанием у людей без психических нарушений является их устойчивое желание изменить размеры гениталий.
В настоящее время для утолщения полового члена применяются несколько методов – трансплантация под кожу пениса свободного жира, полосок кожи или мышцы передней брюшной стенки, хирургическая пересадка части мышцы.
Все эти методы, направленные на утолщение полового члена, имеют недостатки: непрогнозируемый результат, отсутствие эффекта за счет рассасывания введенного трансплантата, значительная травматичность, после операции остаются дефекты кожи (рубцы) в местах выделения утолщающих тканей, высокий риск развития осложнений, длительный период нахождения в стационаре.
С 2006 года мы применяем для утолщения полового члена совершенно новую и перспективную методику, основанную на выращивании собственных тканей пациента в требуемом участке тела.
Принцип операции заключается во вживлении под кожу пениса специально подготовленной утолщающей матрицы на основе биологического материала коллагена, совместно с выделенной из крови пациента культурой ростковых клеток (фибробластов), которые в процессе рассасывания матрицы полностью замещают ее собственной тканью пациента.
Данный способ утолщения полового члена был разработан и апробирован в г. Сеуле (Корея) проф. Kim Jin-Hong а также в г. Белграде (Сербия) ведущим генитальным хирургом мира проф. Perovic Sava. Поэтому данная методика применяется лишь в нескольких клиниках – в Корее, Сербии и в Москве, а теперь и в Барнауле.
Методика утолщения полового члена
В день операции у пациента берут 50 мл крови из вены для последующей лабораторной инкубации с целью выделения клеточной культуры. Полученную культуру наносят на матрицу необходимого размера.
Полученную культуру наносят на матрицу необходимого размера.
В процессе несложного хирургического вмешательства через циркулярный разрез кожи по краю головки члена, матрицу фиксируют под кожу полового члена вдоль всей его длины. Для лучшего эстетического эффекта, при желании пациента, выполняют обрезание крайней плоти (схема операции).
Результат
Размещенная на матрице культура тканей постепенно прорастает сквозь нее и через 3-6 месяцев вся матрица полностью растворяется, а вместо нее под кожей пениса вырастает его собственная соединительная ткань. При этом потеря первоначально достигнутого увеличения объема происходит не более чем на 15-20%, а кожа пениса остается полностью чувствительной и подвижной (фотографии до и после операции)
Преимущества метода:
Малая травматичность операции
Отличный косметический и эстетический результат
Долговременное сохранение достигнутого результата
Отсутствие грубых послеоперационных рубцов на других участках тела
Для увеличения объема используются собственные ткани пациента
Пребывание в стационаре не более 2 дней
Минимальный риск развития осложнений
На прием может прийти любой пациент. Прописка и регистрация значения не имеют.
Прописка и регистрация значения не имеют.
Анонимность и конфиденциальность гарантируются.
Записаться на консультацию к урологу-андрологу Вы можете в Андрологическом центре «Мужская консультация №1»
по телефону 8 (3852) 40-28-68
Увеличение полового члена в Оренбурге
Хирургическое увеличение длины и толщины полового члена — это самый радикальный способ, но именно он дает видимый результат и избавляет от комплекса обладания маленьким пенисом.
В Медгард-Оренбург проводятся операции по увеличению мужского достоинства двумя способами.
Удлинение (Лигаментотомия) полового члена
Это хирургическое вмешательство, которое направлено на устранение, иссечение связки пениса. Эта связка фиксирует внутреннюю часть ствола и служит поддержкой полового члена. Благодаря иссечению фаллос выдвигается и тем самым становится гораздо длиннее. Операция проходит под местной анестезией и длится около часа. На следующий день, после осмотра оперирующим врачом урологом, пациента выписывают из стационара. Для закрепления результата операции рекомендуется носить экстендер в течении года, по 2-3 часа в день. Он поможет вытянуть не только внешнюю сторону члена, но и внутреннюю.
Лигаментотомия это малоинвазивная операция, но она требует особенного мастерства и опыта. Доверяя столь деликатную проблему врачу урологу-андрологу клиники Медгард-Оренбург, вы можете быть уверены в своей безопасности и в полноценной эрекции на долгие годы.
Увеличение полового члена полимолочной кислотой (PowerFill)
Это один из самых малотравматичных и безопасных способов увеличения толщины полового члена, который основан на подкожном введении синтетического импланта в половой член. Препарат под названием PowerFill гипоаллергенен, абсолютно безопасен и разрешен к применению на территории Российской Федерации. После введения под кожу и постепенно рассасываясь, данный препарат запускает рост соединительной ткани, образуя плотную коллагеновую оболочку. Благодаря этому процессу и увеличивается объем полового члена по всем зонам введения. Эффект сохраняется на протяжении 2-3 лет. По желанию пациента возможно дополнительное введение препарата.
Данная операция проводится в стерильных условиях операционной, под местной анестезией. Госпитализация пациента не требуется. Половая жизнь может возобновляться через 3 недели.
Как увеличить член — Лайфхакер
Как узнать, что надо увеличить член
Если вам кажется, что орган маленький, — вероятнее всего, вам просто кажется. Большинство мужчин склонны думать , что «нормальный пенис» — это нечто большое, и недооценивать собственный.
Большинство мужчин склонны думать , что «нормальный пенис» — это нечто большое, и недооценивать собственный.
Проверить это легко. Возьмите рулетку и измерьте длину пениса в спокойном и в эрегированном состоянии. А теперь сравните результаты с нормой :
- Средняя длина неэрегированного члена — около 9 см. Сантиметр‑два в обе стороны не являются отклонением. Также учитывайте, что в некоторых случаях, например если вы замёрзли или купаетесь в прохладной воде, половой орган может временно чуть уменьшиться в размерах.
- Средняя длина пениса при эрекции — 13–18 см. С той же погрешностью в сантиметр‑два в обе стороны.
В целом медики считают , что задумываться об увеличении члена стоит лишь тем, у кого длина органа в неэрегированном состоянии составляет менее 4 см, а в эрегированном — менее 7,5 см.
Мужчины с действительно маленькими пенисами и правда существуют. Но их значительно меньше, чем может показаться. И почти наверняка лично вы не относитесь к их числу.
И почти наверняка лично вы не относитесь к их числу.
Как увеличить член с помощью операции
С медицинской точки зрения подобные операции оправданны в единственном случае: если пенис не функционирует нормально из‑за врождённых дефектов или травм.
Однако тем, кто хочет увеличить орган ради красоты или повышения самооценки, некоторые клиники всё же предлагают удлиняющую фаллопластику . Это общий термин для хирургических процедур, направленных на увеличение размера члена, в основном в неэрегированном состоянии.
К сожалению, все эти операции на сегодня считаются экспериментальными, а их эффект недостаточно исследован. В некоторых случаях они действительно помогают увеличить член. Но чаще всего незначительно — буквально на 1–2 см. При этом у удлиняющей фаллопластики высокий риск осложнений, из‑за которых результаты операции могут вас, мягко скажем, не порадовать.
Вот наиболее популярные методы хирургического увеличения члена и их возможные последствия:
- Лигаментотомия.
 Во время этой процедуры перерезают связку, которая крепит половой член к лобковой кости. Из‑за этого пенис в неэрегированном состоянии обвисает и кажется чуть длиннее, чем был. Возможное осложнение лигаментотомии — нестабильность полового члена во время эрекции. Он слишком легко качается из стороны в сторону, что может доставлять серьёзные неудобства.
Во время этой процедуры перерезают связку, которая крепит половой член к лобковой кости. Из‑за этого пенис в неэрегированном состоянии обвисает и кажется чуть длиннее, чем был. Возможное осложнение лигаментотомии — нестабильность полового члена во время эрекции. Он слишком легко качается из стороны в сторону, что может доставлять серьёзные неудобства. - Операции по утолщению члена. Во время этих процедур под кожу пениса вводят силиконовые имплантаты или собственную жировую ткань пациента. Из‑за этого обхват члена увеличивается. Но есть проблема: жировая ткань склонна неравномерно рассасываться, а силикон может смещаться. Всё это в конечном итоге приводит к появлению под кожей пениса комков. А сам половой орган начинает выглядеть асимметрично или серьёзно искривляется. Вернуть ему нормальную форму можно лишь с помощью очередного хирургического вмешательства.
Как увеличить член без операции
Сразу скажем, что общепринятая медицинская точка зрения однозначна .
Невозможно увеличить или уменьшить член с помощью каких‑либо упражнений или лекарств.
Любые «домашние» методы, обещающие сделать ваш пенис толще или длиннее, — это маркетинговые уловки или даже откровенный обман. Вот некоторые популярные продукты и методы (спойлер: ни об одном из них наука не может сказать ничего хорошего):
- Таблетки. Это пищевые добавки, в состав которых чаще всего входят витамины, вытяжки из трав, иногда гормоны, а также экстракты всяких экзотических ингредиентов типа медвежьей желчи. По данным американской медицинской организации Mayo Clinic, ни один из подобных продуктов не работает. Кроме того, поскольку эти средства не зарегистрированы в качестве лекарственных препаратов, их состав не слишком‑то контролируется (если вообще контролируется). А значит, совершенно не ясно, что у таблетки внутри. Хорошо, если ничего опасного.
- Кремы и лосьоны. Та же ситуация, что и с таблетками.
 Иногда в состав таких средств включают раздражающие вещества, из‑за которых пенис слегка отекает. Но этот эффект, во‑первых, временный, а во‑вторых, небезопасный: непонятно, как на такое раздражение отреагирует орган. Возможно всё, вплоть до тяжёлых аллергических реакций.
Иногда в состав таких средств включают раздражающие вещества, из‑за которых пенис слегка отекает. Но этот эффект, во‑первых, временный, а во‑вторых, небезопасный: непонятно, как на такое раздражение отреагирует орган. Возможно всё, вплоть до тяжёлых аллергических реакций. - Вакуумные насосы. Механическое воздействие на пенис вызывает прилив крови и небольшой отёк, поэтому какое‑то время член действительно может выглядеть чуть увеличенным. Но это быстро проходит. А если использовать насосы часто, можно повредить ткани пениса, так что он деформируется или начнутся проблемы с эрекцией.
- Упражнения. Самое популярное из них — джелкинг («доение»). Лайфхакер подробно писал об этой процедуре. Она не работает.
- Растяжка. Заключается в том, что к члену прикрепляют грузы или приспособления под названием «экстендеры» («растяжители»). Несколько небольших исследований показали, что некоторым мужчинам удалось таким образом удлинить пенис на 1–3 см.
 Однако медики относятся к таким процедурам скептически и настаивают, что вопрос требует дополнительного изучения. Лишь это поможет оценить эффективность и, что более важно, безопасность растяжек.
Однако медики относятся к таким процедурам скептически и настаивают, что вопрос требует дополнительного изучения. Лишь это поможет оценить эффективность и, что более важно, безопасность растяжек.
Что делать, если член кажется маленьким
Сколько ни повторяют, что размер — не главное, мужчины продолжают волноваться. Если переживания настолько велики, что подрывают вашу самооценку и вообще портят жизнь, попробуйте сделать следующее:
- Посмотрите на себя со стороны. В буквальном смысле: разденьтесь догола и встаньте перед зеркалом. А затем представьте, что перед вами посторонний мужчина. Как вам? По‑прежнему ли пенис кажется слишком маленьким? Фокус в том, что зеркало позволяет увидеть член так, как его видят окружающие люди, например любимая женщина или коллега в душевой спортклуба. А при взгляде со стороны мужское достоинство кажется очевидно большим, чем если смотреть на него сверху вниз.
- Поговорите с психотерапевтом.
 Специалист не увеличит ваш член. Но поможет разобраться, почему нормальные размеры полового органа всё равно заставляют вас нервничать. Возможно, ваша сниженная самооценка на самом деле связана отнюдь не с физическими размерами некоторых частей тела. И психотерапевт подскажет, как это исправить.
Специалист не увеличит ваш член. Но поможет разобраться, почему нормальные размеры полового органа всё равно заставляют вас нервничать. Возможно, ваша сниженная самооценка на самом деле связана отнюдь не с физическими размерами некоторых частей тела. И психотерапевт подскажет, как это исправить. - Попробуйте принимать таблетки. Но не те, о которых вы подумали. Если ваши переживания по поводу размеров члена зашкаливают, психотерапевт может прописать антидепрессанты, которые помогут справиться с неврозом.
- Восстановите нормальную физическую форму. Проще говоря — похудейте. Реальная возможность увеличить пенис — уменьшить то, что вокруг него.
- Удалите слишком буйную растительность. В не в меру густых волосах может потеряться даже приличных размеров член. Учитывайте это и время от времени проводите процедуру депиляции, например триммером или с помощью специальных кремов.
Этот материал впервые был опубликован в ноябре 2017 года. В апреле 2021‑го мы обновили текст.
В апреле 2021‑го мы обновили текст.
Читайте также 🔥❤️💋
Почему филлеры для пениса становятся все более популярными?
- Рик Келси
- ВВС, программа Виктории Дарбишир
Автор фото, Getty
Несмотря на предостережения о возможных осложнениях, процедура увеличения пениса с помощью филлеров приобретает все большую популярность. Двое мужчин рассказали BBC, почему решились на это и совершенно не считают зазорным.
27-летний Абдул Хасан не впервые увеличивает половой член. На сей раз это должно стать сюрпризом для его девушки.
Они вместе уже восемь лет, но, по его словам, он до сих пор волнуется, удовлетворена ли она их интимной жизнью.
В прошлый раз ему удалось «удивить ее на все сто», говорит он. «Я подумал: можно и повторить. Почему-то это делает меня счастливым», — добавляет мужчина.
«Я подумал: можно и повторить. Почему-то это делает меня счастливым», — добавляет мужчина.
Эффект от инъекции филлеров сохраняется примерно полтора года
Филлер для пениса — это жидкость (обычно гиалуроновая кислота), которая вводится подкожно в мягкие ткани полового органа.
Это нехирургическая процедура, выполняемая в специализированной клинике, и длится всего пару часов. Стоимость одной процедуры в Великобритании — около 3 тысяч фунтов стерлингов.
Инъекция увеличивает объем органа в неэрегированном состоянии — обычно на 1-2 см в окружности в зависимости от количества введенного филлера. Эффект держится примерно полтора года.
Впрочем, подобные инъекции практически не регулируются официальной медициной.
Представитель Британской ассоциации хирургов-урологов Азиф Мунир говорит, что не рекомендует прибегать к таким методам: «Эти процедуры увеличивают только объем неэрегированного пениса и не влияют на его длину в состоянии эрекции — значит, функционально это не отразится на половой жизни».
«Не исключено, что позже это негативно скажется на сексуальной функции», — добавляет медик.
По мнению Мунира, многие выбирают эту процедуру из-за проблем с восприятием своего тела, услышав рекламу из уст звезд или лидеров общественного мнения.
«Нечего скрывать»
Абдул, который работает водителем службы доставки, не отрицает, что подверг себя этой процедуре из-за низкой самооценки.
Длина и объем его полового члена — в пределах норм Национальной службы здравоохранения Великобритании. Однако он чувствует себя неуверенно рядом с другими обнаженными мужчинами в раздевалке местного спортклуба.
После первой процедуры ему стало гораздо комфортнее — хоть он и признает, что боялся возможных осложнений.
«Но я это сделал, и моя уверенность в себе возросла. Я знал, что мне больше нечего скрывать», — говорит он.
По его словам, через несколько дней после процедуры он почувствовал себя лучше и в обычных социальных ситуациях.
«Я будто переродился. Теперь мне проще подойти к человеку и завязать разговор», — говорит мужчина.
Підпис до фото,Врачам приходится исправлять последствия использования филлеров в домашних условиях, говорит Азиф Мунир
В последнее время запросов на увеличение пениса стало значительно больше, сообщают представители компаний Moorgate Aesthetics и Androfill — двух крупнейших британских косметологических клиник, специализирующихся на мужском интимном здоровье.
Сейчас эти компании суммарно получают около 700 таких запросов ежемесячно, тогда как три года назад их было менее десяти.
Что касается количества выполненных процедур, то за то же время оно возросло в 20 раз и составляет более 130 в месяц.
Абдул заказал инъекцию в клинике, следовательно, это сертифицированное вещество, которое вводят квалифицированные врачи.
В то же время эксперты обеспокоены распространением препаратов так называемого «домашнего использования».
Мужчины сами вводят себе филлеры — например, вазелин, различные масла или силикон, не имея представления о потенциальных осложнения, говорит Мунир.
Многие из них через несколько дней обращаются к врачу за помощью для лечении занесенной инфекции.
«В таком случае нужна операция по удалению либо мертвых тканей, либо вещества-филлера», — объясняет Мунир.
«Нередко приходится удалять всю кожу с пениса, пересаживая кожу с других органов», — говорит он.
Підпис до фото,Стюарт Прайс говорит, что увеличение пениса поможет ему лучше чувствовать себя в окружающем его мире
Стюарт Прайс из города Карфилли проходит процедуру увеличения полового члена впервые.
Этот 36-летний мужчина убежден: никто бы не отказался увеличить пенис, если бы имел такую возможность.
Стюарт недавно похудел на 50 кг и рассказывает, что это привело к определенным изменениям в его теле, в частности, к образованию складок.
«Не думаю, что я так уж нуждаюсь в увеличении пениса. Впрочем, это придаст мне уверенности в себе», — говорит он.
«Я буду чувствовать себя немного лучше, если он будет немного больше», — объясняет мужчина.
Стюарт увидел рекламу филлеров для пениса случайно, когда изучал возможность трансплантации волос. Ему понравилось, что это не требует хирургического вмешательства.
Миф о большом пенисе
Во время совместного исследования Королевского колледжа Лондона и Национальной службы здравоохранения, проведенного в 2015 году, ученые измерили длину и ширину членов более 15 тысяч мужчин из разных стран мира.
Исследование показало, что средняя длина эрегированного пениса составляет 13 см.
Лишь у 5% мужчин его длина превышала 16 см, и только у 0,14% встречается так называемый «микропенис» — менее трех дюймов (7,62 см) в длину в эрегированном состоянии.
В окружности средний охват члена в состоянии покоя — 9 см, а окружность среднего эрегированного — 11,7 см.
Стюарт хочет, чтобы ему ввели предельно допустимое количество гиалуроновой кислоты — 15 мл. Этим веществом часто заполняют морщины на лице.
Подруга Стюарта Кэрис не скрывает тревоги: «А вдруг он окажется слишком большим?»
Підпис до фото,Кэрис не присутствовала во время проведения процедуры
Впрочем, в крайнем случае филеры можно удалить (за средства пациента).
Несмотря на сомнения женщины, процедура уже началась и не может быть отменена; примерно через час будут видны результаты.
Окружность пениса Стюарта в неэрегированном состоянии увеличилась с 12,5 до 15 см.
«Я чувствую, что он стал больше, — говорит он. — Я счастлив!»
Пенис Абдула увеличился с 10 до 11,5 см.
Врачи советуют мужчинам воздерживаться от половых контактов первые четыре недели после процедуры, на что Абдул с радостью соглашается.
«Кому хочется осложнений в этой сфере? — рассуждает он. — Интимные органы надо беречь!»
— Интимные органы надо беречь!»
Увеличение полового члена в Москве — лучшие клиники и медцентры: отзывы, врачи, цены
Увеличение полового члена достигается проведением реконструктивно-пластических операций с целью добиться увеличения его длины или толщины.
Как правило, такие хирургические вмешательства проводятся по личной инициативе мужчины, который стремится соответствовать стандарту мужественности и сексуальности.
В то же время отдельным категориям лиц такие операции назначаются по медицинским показаниям, когда нужно восстановить нормальную функциональность органа, повысить качество жизни больного.
Объем хирургического вмешательства для каждого пациента устанавливается врачом-хирургом в индивидуальном порядке. Так, например, манипуляции по увеличению размеров органа могут сочетаться с устранением эректильной деформации (искривления полового члена) врожденного и приобретенного характера.
Участвовать в подобных операциях могут лица, у которых не обнаружено противопоказаний в ходе дооперационного комплексного обследования.
Основные показания
Чаще всего утолщение или удлинение полового члена выполняется при:
- врожденном недоразвитии органа при нормальной его анатомической конфигурации;
- желании мужчины таким способом превысить стандарты мужественности и сексуальности;
- неудовлетворенности мужчины величиной, формой и функциональными возможностями пениса;
- травматических повреждениях или ожоговых деформациях гениталий;
- малой длине пениса (не более 8-10 см в состоянии эрекции).
Как подготовиться к процедуре
Операция выполняется после комплексного обследования пациента. Начинается оно с изучения его жалоб, сбора анамнестических сведений и физикального осмотра с оценкой функционального и анатомического состояния гениталий.
Пациенту понадобится пройти лабораторные и инструментальные исследования, которые используются в общехирургической практике в программе предоперационной подготовки и для выбора техники хирургического вмешательства. Обычно это:
Обычно это:
- общий анализ крови и мочи;
- биохимические исследования крови;
- коагулография;
- анализ крови на ВИЧ, сифилис, гепатит;
- электрокардиография;
- компьютерная или магнитно-резонансная томография;
- УЗИ сосудов;
- урофлоуметрия;
- уретрография и др.
На этом этапе врачом-хирургом изучаются ожидания пациента от предстоящей операции. С ним детально обговариваются все нюансы лечебно-реабилитационной программы и наличие рисков.
Особенности процедуры
Утолщение полового члена осуществляется следующими методами:
- обертывание органа кожно-жировыми аутотрансплантатами, отобранными из области ягодиц;
- инъекция под кожу пениса собственной жировой ткани пациента;
- наложение лоскутов из прямой мышцы живота, передней брюшной стенки;
- пересадка свободных лоскутов из передней зубчатой или широчайшей мышцы спины.

Техника удлинение пениса предполагает выполнение следующих мероприятий.
Проведение вмешательства методом иссечения поддерживающей связки члена и наполнение образовавшейся в области лобка полости собственной жировой или синтетической тканью. Либо боковой обход кавернозного тела и выделение поддерживающей связки (пеноскротальный доступ) в зоне лобкового симфиза с последующим ее дренированием.
Постоперационное ношение вытягивающих конструкций типа Extender.
Местная обработка тестостероносодержащими мазями и кремами, по усмотрению врача может применяться медикаментозная коррекция андрогенодефицитных нарушений гормональными препаратами.
В послеоперационном периоде отек держится около 14 дней. Возобновление половых отношений возможно не ранее чем через 2 месяца.
цены на услугу в клинике АО Медицина
Размеры полового члена зависят от наследственных факторов и особенностей анатомического строения мужчины. Нередко генетические нарушения или врожденные заболевания приводят к уменьшению размеров органа, что становится источником психологических проблем и нарушений в работе выделительной системы. Решение готова предложить фаллопластика – процедура увеличения полового члена, которая проводится по согласованию с врачом и назначается при наличии серьезных показаний. Результаты оперативного вмешательства позволяют исправить дефект и вернуть пациенту способность к половой жизни и уверенность в себе.
Решение готова предложить фаллопластика – процедура увеличения полового члена, которая проводится по согласованию с врачом и назначается при наличии серьезных показаний. Результаты оперативного вмешательства позволяют исправить дефект и вернуть пациенту способность к половой жизни и уверенность в себе.
Показания к проведению фаллопластики
В большинстве случаев операция назначается с целью:
- устранения аномалий развития или последствий травмирования;
- возвращения эстетической формы полового члена;
- восстановления способности к половой жизни.
В отдельную категорию выделяют случаи проведения операции по «образованию» полового члена из кожной ткани. Такая фаллопластика проводится у женщин — трансгендеров, сделавших операцию по смене пола, а также у лиц, которым была проведена вынужденная ампутация органа вследствие травмирования, воспалительного или иного заболевания.
Если врожденный или приобретенный дефект заключается лишь в небольшой внешней патологии, прямых показаний к фаллопластике нет. Решение о проведении процедуры принимает лечащий врач по согласованию с пациентом на основании пожеланий последнего.
Решение о проведении процедуры принимает лечащий врач по согласованию с пациентом на основании пожеланий последнего.
Противопоказания для проведения фаллопластики
Проведение операции по корректировке формы и размеров полового члена исключено:
- при нарушении свертываемости крови;
- при наличии серьезных патологий внутренних органов;
- при сахарном диабете;
- в случае наличия у пациента онкологического заболевания;
- в период восстановления после тяжелых травм, оперативного вмешательства или продолжительных болезней.
Подготовка к проведению операции
С целью уточнения состояния здоровья пациента и его готовности к операции назначаются:
- общий анализ крови и мочи;
- рентгенография;
- ЭКГ;
- обследование у уролога со сдачей необходимых дополнительных анализов с целью изучения состояния мочеполовой системы.

Типы и особенности проведения фаллопластики
Современные методики проведения фаллопластики позволяют увеличить половой член в длину и толщину, устраняя косметический дефект и врожденные аномалии развития. В зависимости от назначения процедуры и состояния органа специалисты могут выбрать:
- лигаментотомию – увеличение длины полового члена, которое достигается за счет разрезания подвешивающей связки и последующего ношения экспандера. Результат фаллопластики в данном случае – увеличение длины органа на 4-6 см. Процедура признана современной и максимально безопасной для пациента. Единственное противопоказание – нарушение эрекции, которое может принять необратимый характер после оперативного вмешательства;
- липофилинг – процедура для увеличения толщины полового члена, которая подразумевает введение под кожу жировой ткани. Современные методики проведения позволяют увеличить диаметр органа на 1 см, но эффект от такой процедуры наблюдается в течение ограниченного промежутка времени;
- трансплантацию мышечной ткани – еще один способ увеличения диаметра полового члена.
 Подразумевает подшивание к органу лоскута подходящей формы с брюшной стенки с соединением кровеносных сосудов. В результате можно достичь увеличения размеров на 3-4 см;
Подразумевает подшивание к органу лоскута подходящей формы с брюшной стенки с соединением кровеносных сосудов. В результате можно достичь увеличения размеров на 3-4 см; - фаллопротезирование – процедура, проводимая только с учетом строгих показаний из-за повышенной сложности. Подразумевает использование хрящевой ткани пациента или искусственных эластичных материалов для восстановления функции полового члена и увеличения его размеров.
Длительность хирургического вмешательства
Операция проводится под общим наркозом, а ее продолжительность зависит от выбранной методики. Липофилинг, протезирование и лигаментотомия длятся 1 час, трансплантация – около 3 часов, что связано с необходимостью аккуратного соединения тканей и кровеносных сосудов.
Особенности восстановительного периода
После проведения фаллопластики пациент может находиться в стационаре около 2 дней, а после выписки ему рекомендуется регулярно посещать врача для осмотра и перевязки. Заживление шва происходит за 2-3 недели. Ношение экспандера для увеличения длины полового члена рекомендуется в течение полугода. Сложнее происходит восстановление после фаллопротезирования. Его ход и длительность зависят от общего состояния здоровья пациента и качества медицинского наблюдения.
Заживление шва происходит за 2-3 недели. Ношение экспандера для увеличения длины полового члена рекомендуется в течение полугода. Сложнее происходит восстановление после фаллопротезирования. Его ход и длительность зависят от общего состояния здоровья пациента и качества медицинского наблюдения.
Наши врачи
Преимущества проведения фаллопластики в клинике АО «Медицина» (клиника академика Ройтберга) в Москве
Внешний дефект или дисфункция полового члена – повод обратиться к специалистам. После всесторонних обследований врач совместно с пациентом примут решение о проведении операции оптимальным методом, гарантирующим исправление имеющегося недостатка. Каждому посетителю клиники гарантированы тактичное и внимательное отношение, конфиденциальность обращения к врачу, квалифицированный подход и безопасность при проведении диагностических и лечебных манипуляций.
Как узнать цену фаллопластики
Стоимость фаллопластики формируется в индивидуальном порядке с учетом сложности дефекта, состояния пациента, выбранного метода оперативного вмешательства. Для получения любой интересующей информации звоните в клинику по указанным телефонам.
Для получения любой интересующей информации звоните в клинику по указанным телефонам.
Как делается надрез при лигаментотомии?
Для удобства доступа к зоне проведения операции надрез делается в области лобка или по центру мошонки. Преимущества последнего способа – в минимальной травматичности и незаметности рубцов. Метод разреза в лобковой области показан при необходимости обеспечить доступ к скрытой части полового члена в полости таза.
Обязательно ли ношение экспандера после операции?
Этот вопрос решается с лечащим врачом индивидуально. Обязательных показаний к ношению экспандера нет, но его использование позволяет улучшить и закрепить полученные результаты. Тем более что для пациента здесь нет выраженного дискомфорта, и приспособление незаметно под одеждой.
Как часто следует посещать врача для перевязки?
Первая перевязка осуществляется на следующий день после операции для проверки качества заживления тканей. График остальных процедур назначается хирургом в зависимости от сложности операции и количества наложенных швов.
График остальных процедур назначается хирургом в зависимости от сложности операции и количества наложенных швов.
Есть ли вред от ношения экспандера?
Чтобы исключить побочные эффекты и дискомфорт, важно соблюдать следующие правила: использовать экспандер не более трех часов в сутки и носить его так, чтобы ткани не сдавливались от нагрузки, и кровообращение не нарушалось. О нюансах применения экспандера расскажет лечащий врач.
Как без скальпеля увеличить размер пениса
Медицинская статистика гласит, что некоторые нехирургические способы по увеличению длины мужского пениса оказываются более эффективными, чем хирургические, способные вызвать лишь гнев и разочарование пациента.
Согласно результатам специально проведенного исследования, опубликованным на этой неделе в Journal of the British Association of Urological Surgeons, хирургические методы увеличения мужского полового органа весьма небезопасны и чреваты «недопустимо высокой вероятностью различных осложнений». При этом число мужчин, обращающихся к урологам с жалобами на «короткий пенис» постоянно увеличивается, констатируют авторы статьи, однако в большинстве подобных случаев длина их пенисов с точки зрения физиологии абсолютно нормальна. У мужчин, как утверждают медики, сложилось явно преувеличенное представление о том, какой должна быть длина их пениса.
При этом число мужчин, обращающихся к урологам с жалобами на «короткий пенис» постоянно увеличивается, констатируют авторы статьи, однако в большинстве подобных случаев длина их пенисов с точки зрения физиологии абсолютно нормальна. У мужчин, как утверждают медики, сложилось явно преувеличенное представление о том, какой должна быть длина их пениса.
С научной точки зрения длина пениса считается нормальной, если она составляет по меньшей мере 4 см в спокойном состоянии этого органа и не менее 7,5 см в напряженном. Некоторые поправки в эту норму может внести рост мужчины и индекс массы тела, который может указывать на отклонения между весом человека и его сложением.
Но, как показывают очереди в урологические кабинеты, не все с такой точкой зрения согласны. Мужчине с маленьким членом, которого уролог отказался направлять к хирургу, остается уповать лишь на нехирургические методы удлинения члена, которые, если вы заглянете в свой почтовый ящик, предназначенный для спама, весьма активно рекламируются в интернете.
Чтобы выяснить, насколько эффективны и безопасны различные методики по увеличению размера пениса, сотрудники Университета Турина Марко Ордера и Паоло Гонтера проанализировали данные из научной медицинской периодики. Всего они обнаружили десять исследований, посвященных таким специфическим методикам. Выяснилось, что самым эффективным неинвазивным способом, увеличивающим мужской половой член, является метод вытягивания. Так, в одном случае удалось достичь устойчивого удлинения пениса на 1,8 см, в другом — на 2,3 см в спокойном и на 1,7 в эрегированном состоянии.
Однако усилия, затраченные на достижение этих результатов, оказались просто титаническими. В первом случае пациенту приходилось носить специальный растягиватель по 6 часов в день на протяжении четырех месяцев, во втором по четыре часа, но на протяжении уже полугода.
Еще одно устройство для увеличения члена — вакуумная помпа, создающая вокруг члена зону пониженного давления. В принципе это то же самое, что и вытягивание, только не чисто механическое, а вакуумное.
Шестимесячное применение помпы не дало заметных приращений в размерах мужских членов, зато некоторые пациенты, прошедшие этот курс, демонстрировали «нечто вроде психологического удовлетворения», отмечает медики.
В двух случая было исследовано воздействие так называемых «мошоночных колец» — колец из твердого или гибкого материала, охватывающих область основания члена и мошонки. Такие кольца «могут увеличить длину эрегированного члена и поддерживать эрекцию, в случае если мужчина находится в состоянии стресса», резюмируют ученые.
Подтвержденных данных об эффективности широко рекламируемых «упражнений по увеличению члена» нет, сообщают Ордера и Гонтера. К тому же существующие техники, позволяющие увеличить длину члена, совсем не увеличивают его толщину.
Характеристики каркаса для функциональной регенерации полых органов
Материалы (Базель). 2010 январь; 3(1): 241–263.
Rita Gobet
3 Отделение детской урологии, отделение детской хирургии, Университетская детская больница, Цюрих, Швейцария; Электронная почта: hc. [email protected] (R.G.)
[email protected] (R.G.)
Heike Hall
2 Клетки и биоматериалы, Департамент материалов, ETH Zurich, Швейцария; Электронная почта: [email protected] (H.H.)
2 Клетки и биоматериалы, Департамент материалов, ETH Zurich, Швейцария; Электронная почта: [email protected] (H.H.) 3 Отделение детской урологии, отделение детской хирургии, Университетская детская больница, Цюрих, Швейцария; E-Mail: [email protected] (R.G.) * Автор, которому следует направлять корреспонденцию; Электронная почта: [email protected]; Тел.: + 41 44 255 96 30; Факс: + 41 44 255 96 20.Поступила в редакцию 10 декабря 2009 г.; Пересмотрено 5 января 2010 г.; Принято 7 января 2010 г.
лицензиат Molecular Diversity Preservation International, Базель, Швейцария. Эта статья находится в открытом доступе и распространяется на условиях лицензии Creative Commons Attribution (http://creativecommons.org/licenses/by/3.0/).Abstract
Многие заболевания требуют хирургической реконструкции полых органов. Тканевая инженерия органов и тканей является многообещающей новой техникой без болезненности места забора. Идеальный биоматериал должен быть биосовместимым, поддерживать формирование тканей и обеспечивать адекватную структурную поддержку.Он должен постепенно разрушаться и обеспечивать среду, обеспечивающую межклеточное взаимодействие, адгезию, пролиферацию, миграцию и дифференцировку. Хотя формирование ткани возможно, функциональность никогда не демонстрировалась. В основном отсутствие надлежащей иннервации и васкуляризации препятствуют сократительной способности и нормальной функции. В этой главе мы критически рассматриваем современное состояние инженерии полых органов, уделяя особое внимание иннервации и васкуляризации.
Тканевая инженерия органов и тканей является многообещающей новой техникой без болезненности места забора. Идеальный биоматериал должен быть биосовместимым, поддерживать формирование тканей и обеспечивать адекватную структурную поддержку.Он должен постепенно разрушаться и обеспечивать среду, обеспечивающую межклеточное взаимодействие, адгезию, пролиферацию, миграцию и дифференцировку. Хотя формирование ткани возможно, функциональность никогда не демонстрировалась. В основном отсутствие надлежащей иннервации и васкуляризации препятствуют сократительной способности и нормальной функции. В этой главе мы критически рассматриваем современное состояние инженерии полых органов, уделяя особое внимание иннервации и васкуляризации.
Ключевые слова: скаффолд, регенерация, тканевая инженерия, биоматериалы, полые органы, регенеративная медицина
1.Введение
Замена тонкой кишки и мочевого пузыря функциональными конструкциями тканевой инженерии представляет собой значительный прогресс в хирургическом лечении. В тонкой кишке потеря более двух третей тонкой кишки вызывает синдром короткой кишки (СКК), приводящий к опасной для жизни мальабсорбции питательных веществ. Наиболее частой причиной СКК является обширная хирургическая резекция тонкой кишки вследствие некротизирующего энтероколита у новорожденных и болезни Коэна у взрослых.Терапевтические возможности, доступные для пациентов с СБС, направлены на обеспечение адекватного снабжения питательными веществами, водой, электролитами, микроэлементами и витаминами. В настоящее время терапия включает парентеральное питание, хирургические процедуры удлинения кишечника или трансплантацию тонкой кишки, но все эти подходы имеют ограничения.
В тонкой кишке потеря более двух третей тонкой кишки вызывает синдром короткой кишки (СКК), приводящий к опасной для жизни мальабсорбции питательных веществ. Наиболее частой причиной СКК является обширная хирургическая резекция тонкой кишки вследствие некротизирующего энтероколита у новорожденных и болезни Коэна у взрослых.Терапевтические возможности, доступные для пациентов с СБС, направлены на обеспечение адекватного снабжения питательными веществами, водой, электролитами, микроэлементами и витаминами. В настоящее время терапия включает парентеральное питание, хирургические процедуры удлинения кишечника или трансплантацию тонкой кишки, но все эти подходы имеют ограничения.
Конструкции для замены мочевого пузыря необходимы при многих заболеваниях, включая тяжелую дисфункцию мочевого пузыря, травму и рак. Дисфункция мочевого пузыря может быть вызвана заболеванием или хирургическим вмешательством, нарушающим нормальную картину накопления и мочеиспускания.Это может привести к хроническому недержанию мочи и повышению давления в верхних мочевых путях, что приводит к необратимому повреждению почек. В случае неэффективности консервативного лечения у этих пациентов методом выбора является хирургическое увеличение мочевого пузыря с использованием ткани кишечника с целью увеличения емкости мочевого пузыря и снижения накопительного давления. К сожалению, эта процедура не восстанавливает функцию опорожнения и связана с многочисленными осложнениями, такими как нарушение обмена веществ, повышенное выделение слизи, мочекаменная болезнь, инфекции и даже злокачественные заболевания.Как при СКК, так и при недостаточности мочевого пузыря современные методы лечения сопровождаются тяжелой заболеваемостью и смертностью.
В случае неэффективности консервативного лечения у этих пациентов методом выбора является хирургическое увеличение мочевого пузыря с использованием ткани кишечника с целью увеличения емкости мочевого пузыря и снижения накопительного давления. К сожалению, эта процедура не восстанавливает функцию опорожнения и связана с многочисленными осложнениями, такими как нарушение обмена веществ, повышенное выделение слизи, мочекаменная болезнь, инфекции и даже злокачественные заболевания.Как при СКК, так и при недостаточности мочевого пузыря современные методы лечения сопровождаются тяжелой заболеваемостью и смертностью.
Тканевая инженерия (ТЭ), один из основных подходов регенеративной медицины, является быстро развивающейся и интересной областью исследований. В сочетании с лучшим пониманием структуры, биологии и физиологии методы культивирования клеток или ТЭ могут предложить новые варианты лечения пациентов, нуждающихся в замене или восстановлении органа. Принцип заключается в отделении клеток от биопсии ткани, размножении этих клеток в культуре и высеве их на каркасный материал in vitro для формирования живой тканевой конструкции перед реимплантацией в организм реципиента. В соответствующей биохимической и биомеханической среде эти ткани полностью реализуют свой функциональный потенциал и служат эквивалентами нативных тканей. Подход ТЭ имеет большие преимущества перед традиционной трансплантацией органов. Ткани, которые точно соответствуют потребностям пациента, могут быть реконструированы из легко доступной биопсии. Более того, новая реконструкция может быть трансплантирована в организм пациента без болезненности донорского участка и с минимальной или нулевой иммуногенностью. Это в конечном итоге преодолевает несколько ограничений, встречающихся в подходах к трансплантации тканей.
В соответствующей биохимической и биомеханической среде эти ткани полностью реализуют свой функциональный потенциал и служат эквивалентами нативных тканей. Подход ТЭ имеет большие преимущества перед традиционной трансплантацией органов. Ткани, которые точно соответствуют потребностям пациента, могут быть реконструированы из легко доступной биопсии. Более того, новая реконструкция может быть трансплантирована в организм пациента без болезненности донорского участка и с минимальной или нулевой иммуногенностью. Это в конечном итоге преодолевает несколько ограничений, встречающихся в подходах к трансплантации тканей.
Концепция тканевой инженерии применялась в клинической практике при различных заболеваниях, например, искусственная кожа для пациентов с ожогами [1], тканевая инженерия трахеи [2], хрящ для процедур по замене коленного сустава [3], инъекционные хондроциты для лечения пузырно-мочеточникового рефлюкса [4] и недержания мочи [5,6].
Для полых органов, таких как мочевой пузырь, кишечник, а также уретра, пищевод, влагалище или кровеносные сосуды, стратегии обычно включают имплантацию либо биоматериала, который впоследствии интегрируется в организм хозяина путем иммиграции клеток из окружающих тканей, либо , с техническими достижениями в TE предпочтительно in vitro предварительно комбинированная конструкция материалов и клеток. Основными требованиями для получения функциональной ткани являются соответствующие клетки , подходящая среда и надлежащие каркасы .
Основными требованиями для получения функциональной ткани являются соответствующие клетки , подходящая среда и надлежащие каркасы .
Недавно в нескольких исследованиях сообщалось об использовании тканеинженерной тонкой кишки на моделях мелких животных с использованием каркасов из природных или синтетических полимеров, засеянных аутологичными клетками [7,8]. Отчеты о моделях крупных животных (собаки и свиньи) смогли продемонстрировать возможность успешного создания искусственного кишечника с правильной архитектурой, включая черты интактной ниши стволовых клеток [9,10].Даже если гистология сконструированных кишечных сегментов показывает нормальные структуры, включая присутствие нейронных элементов, и, по-видимому, функциональна, подвижность в этих сегментах еще не продемонстрирована.
Для ТЭ мочевого пузыря несколько исследований подтвердили возможность реконструкции мочевого пузыря с использованием инженерных сегментов, которые были сформированы с использованием биоматериалов, засеянных аутологичными клетками in vitro [11,12]. Этот базовый подход был впервые исследован на модели субтотальной цистэктомии у собак, где были успешно имплантированы конструкции мочевого пузыря, сконфигурированные из натуральных или синтетических каркасов и засеянные расширенными аутологичными клетками, полученными из мочевого пузыря [11].Этот подход позволил улучшить результаты по сравнению с более ранними попытками. Вдохновленный многообещающими результатами нескольких исследований на животных, аналогичный подход был недавно применен Atala et al к небольшой группе пациентов с тяжелой нейропатической дисфункцией мочевого пузыря. в 2006 г. [13]. Они сообщили о результатах семи пациентов в возрасте от 4 до 19 лет со средним периодом наблюдения четыре года. Все три пациента со сконструированными тканями, изготовленными из композитных каркасов (коллаген-PGA), показали значительное увеличение емкости мочевого пузыря и эластичности мочевого пузыря.Было описано, что биопсии тканей сконструированных сегментов мочевого пузыря демонстрируют адекватную структурную архитектуру и фенотип различных клеток.
Этот базовый подход был впервые исследован на модели субтотальной цистэктомии у собак, где были успешно имплантированы конструкции мочевого пузыря, сконфигурированные из натуральных или синтетических каркасов и засеянные расширенными аутологичными клетками, полученными из мочевого пузыря [11].Этот подход позволил улучшить результаты по сравнению с более ранними попытками. Вдохновленный многообещающими результатами нескольких исследований на животных, аналогичный подход был недавно применен Atala et al к небольшой группе пациентов с тяжелой нейропатической дисфункцией мочевого пузыря. в 2006 г. [13]. Они сообщили о результатах семи пациентов в возрасте от 4 до 19 лет со средним периодом наблюдения четыре года. Все три пациента со сконструированными тканями, изготовленными из композитных каркасов (коллаген-PGA), показали значительное увеличение емкости мочевого пузыря и эластичности мочевого пузыря.Было описано, что биопсии тканей сконструированных сегментов мочевого пузыря демонстрируют адекватную структурную архитектуру и фенотип различных клеток. Хотя у некоторых пациентов сообщалось о пользе, клиническое улучшение было минимальным. До сих пор эффективность этого нового подхода не сравнима с эффективностью традиционных методов реконструкции с использованием сегментов кишечника в качестве источника материала. На сегодняшний день клиническому применению искусственных тканей препятствуют медленная васкуляризация, плохое питание, приводящее к гибели клеток и последующему фиброзу тканей [12,14].Для успешной реконструкции мочевого пузыря реваскуляризация конструкции необходима для поддержания краткосрочной и долгосрочной выживаемости. Кроме того, для восстановления физиологической функции мочевого пузыря необходима реиннервация.
Хотя у некоторых пациентов сообщалось о пользе, клиническое улучшение было минимальным. До сих пор эффективность этого нового подхода не сравнима с эффективностью традиционных методов реконструкции с использованием сегментов кишечника в качестве источника материала. На сегодняшний день клиническому применению искусственных тканей препятствуют медленная васкуляризация, плохое питание, приводящее к гибели клеток и последующему фиброзу тканей [12,14].Для успешной реконструкции мочевого пузыря реваскуляризация конструкции необходима для поддержания краткосрочной и долгосрочной выживаемости. Кроме того, для восстановления физиологической функции мочевого пузыря необходима реиннервация.
Амбициозная цель реконструкции функционального сократительного мочевого пузыря, реагирующего на произвольный контроль, является постоянной задачей на будущее. Наша способность эффективно использовать донорскую ткань, обеспечивать оптимальные условия для культивирования, долгосрочного выживания, дифференцировки и роста заложит основу для успеха.
2. Клетки
Основные кирпичики живых организмов, клетки, являются преобладающим фактором успешного ТУ. Для обновления ткани требуется достаточное количество способных к регенерации клеток, которые не вызывают иммунного ответа. Поэтому аутологичные клетки являются идеальным выбором, поскольку их использование позволяет избежать многих проблем воспаления и отторжения, связанных с подходом несамодонорства [28]. За последнее десятилетие были достигнуты значительные успехи в расширении множества первичных клеток человека.Различные типы клеток, обычно используемые для применения ТЭ, можно разделить на дифференцированные нестволовые или взрослые клетки и недифференцированные стволовые клетки. Каждый из этих типов клеток имеет свои преимущества и недостатки.
Эпителий кишечника представляет собой сливающийся клеточный слой, состоящий из ряда подтипов клеток, таких как энтероциты, бокаловидные клетки, энтероэндокринные клетки, а также кишечные стволовые клетки [29]. На кишечных органоидах (многоклеточных единицах, происходящих из кишечника) было показано, что дезагрегированная кишечная ткань, содержащая все различные типы клеток и мезенхимальную строму, способствует образованию неокишечной ткани [30,31]. Кроме того, было показано, что кишечные органоиды превосходят изолированные кишечные клетки для посева биоматериала [29].
Кроме того, было показано, что кишечные органоиды превосходят изолированные кишечные клетки для посева биоматериала [29].
В области реконструкции мочевого пузыря взрослые уротелиальные и гладкомышечные клетки могут быть эффективно собраны из биопсийного материала, экстенсивно размножены в культуре и реимплантированы тому же хозяину [12,32,33]. Их характеристики дифференцировки, требования к росту и другие биологические свойства широко изучены [34,35,36]. Однако у пожилых пациентов или пациентов с обширной терминальной стадией органной недостаточности биопсия ткани может не дать достаточного количества нормальных клеток для размножения и трансплантации.Следовательно, взрослых клеток-предшественников может быть недостаточно или они не подходят для тканевой инженерии и трансплантации во всех случаях [37].
Хотя взрослые предшественники остаются важными для ТЭ, использование плюрипотентных стволовых клеток недавно было признано многообещающим альтернативным источником клеток, из которых можно получить желаемую ткань.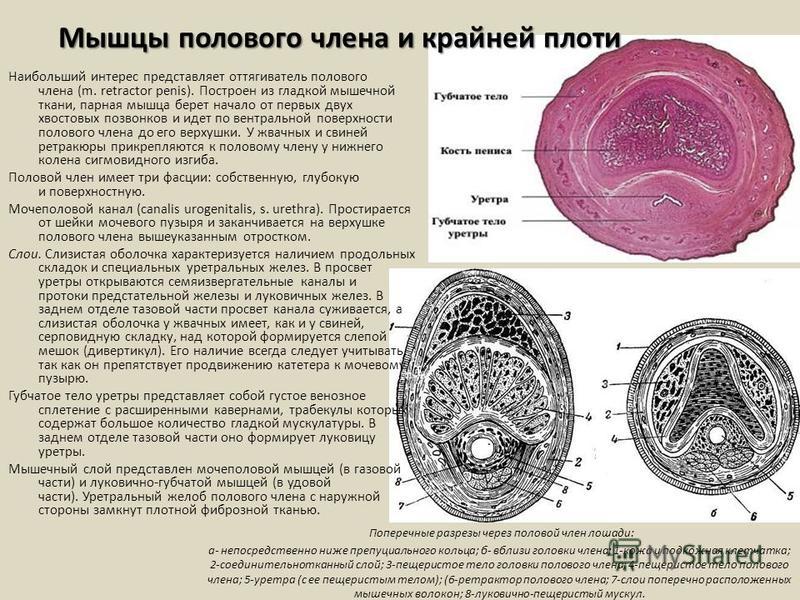 Стволовые клетки, по определению, являются незрелыми или недифференцированными клетками, способными проходить многочисленные циклы самообновления, таким образом пополняя пул стволовых клеток, а также дифференцироваться в более специализированные, ткане/органоспецифические клетки.Стволовые клетки можно разделить на эмбриональные, фетальные или взрослые клетки в зависимости от источника их происхождения (NIH).
Стволовые клетки, по определению, являются незрелыми или недифференцированными клетками, способными проходить многочисленные циклы самообновления, таким образом пополняя пул стволовых клеток, а также дифференцироваться в более специализированные, ткане/органоспецифические клетки.Стволовые клетки можно разделить на эмбриональные, фетальные или взрослые клетки в зависимости от источника их происхождения (NIH).
Эмбриональные стволовые клетки обладают двумя замечательными свойствами: способностью пролиферировать в недифференцированном, но все же плюрипотентном состоянии (самовосстановление) и способностью дифференцироваться в большое количество специфических клеток [38]. Как следует из их названия, эмбриональные стволовые клетки получают из эмбриона на ранней стадии. Хотя считается, что исследования эмбриональных стволовых клеток имеют гораздо больший потенциал, чем взрослые стволовые клетки, все еще существует несколько этических и юридических споров относительно их использования у людей. Кроме того, было показано, что эмбриональные стволовые клетки трансдифференцируются в злокачественный фенотип, образуя тератомы [39,40].
Кроме того, было показано, что эмбриональные стволовые клетки трансдифференцируются в злокачественный фенотип, образуя тератомы [39,40].
Фетальные стволовые клетки , полученные из амниотической жидкости и плаценты, были недавно описаны и представляют собой новый источник стволовых клеток [41]. Основным типом стволовых клеток, выделенных из амниотической жидкости и плаценты, является мезенхимальный, но они обладают потенциалом экспансии, превосходящим таковой у взрослых стволовых клеток. Они менее иммуногенны, так как не экспрессируют человеческий лейкоцитарный антиген (HLA) и не образуют тератомы in vivo .Фетальные стволовые клетки мультипотентны, и было показано, что они действительно дифференцируются в миогенные, адипогенные, остеогенные, нефрогенные, нервные и эндотелиальные клетки. Кроме того, клетки обладают высоким репликативным потенциалом и могут храниться для будущего использования без риска отторжения и без этических соображений [42].
Взрослые стволовые клетки в основном представляют собой недифференцированные клетки, встречающиеся среди дифференцированных клеток в тканях или органах. Они присутствуют во всех тканях взрослого человека и имеют решающее значение для здоровья тканей, их поддержания и реакции на травмы или заболевания на протяжении всей жизни.По сравнению с эмбриональными стволовыми клетками взрослые стволовые клетки более коммитированы, но все же обладают пластичностью для дифференцировки во все три зародышевых листка [43]. Однако они демонстрируют значительные преимущества, в том числе; стабильная дифференцировка в определенные клеточные линии, отсутствие трансдифференцировки в злокачественный фенотип (тератомы), отсутствие необходимости умерщвления человеческих эмбрионов для их изоляции и отсутствие или незначительное иммунное отторжение. Кроме того, некоторые этические и юридические проблемы также могут быть преодолены.
Они присутствуют во всех тканях взрослого человека и имеют решающее значение для здоровья тканей, их поддержания и реакции на травмы или заболевания на протяжении всей жизни.По сравнению с эмбриональными стволовыми клетками взрослые стволовые клетки более коммитированы, но все же обладают пластичностью для дифференцировки во все три зародышевых листка [43]. Однако они демонстрируют значительные преимущества, в том числе; стабильная дифференцировка в определенные клеточные линии, отсутствие трансдифференцировки в злокачественный фенотип (тератомы), отсутствие необходимости умерщвления человеческих эмбрионов для их изоляции и отсутствие или незначительное иммунное отторжение. Кроме того, некоторые этические и юридические проблемы также могут быть преодолены.
В настоящее время плюрипотентные стволовые клетки или дифференцируемые взрослые стволовые клетки могут быть получены из многих различных тканей, включая костный мозг [44,45], поперечнополосатые мышцы [46], жир [47], кожу [48], синовиальную оболочку [49] , а в последнее время и яички [50,51]. Эти клетки могут дифференцироваться в коммитированные клетки других тканей, что определяется как пластичность. Это позволит создавать композитные ткани, состоящие из нескольких типов клеток, с использованием одного единственного источника взрослых стволовых клеток. Таким образом, взрослые стволовые клетки особенно подходят для клеточной терапии и инженерии тканей и органов.
Эти клетки могут дифференцироваться в коммитированные клетки других тканей, что определяется как пластичность. Это позволит создавать композитные ткани, состоящие из нескольких типов клеток, с использованием одного единственного источника взрослых стволовых клеток. Таким образом, взрослые стволовые клетки особенно подходят для клеточной терапии и инженерии тканей и органов.
Недавно было показано, что реконструкция мочевого пузыря с использованием стволовых клеток, посеянных на каркасе, является многообещающей альтернативой для инженерии мочевого пузыря [41, 52, 53, 54, 55]. Недавний прогресс свидетельствует о том, что искусственные ткани и клеточная терапия с использованием взрослых стволовых клеток могут иметь расширенную клиническую применимость в будущем и могут представлять собой жизнеспособный терапевтический вариант для тех, кому требуется замена или восстановление тканей.
Наиболее активно изучаемые взрослые стволовые клетки — это мезенхимальные стволовые клетки (МСК). Этот тип клеток имеет значительные перспективы для инженерии скелетно-мышечных структур. Костный мозг представляет собой основной источник МСК. Чанг и др. . провели исследования на крысиной модели, в которых изучалась способность МСК помогать в регенерации ткани мочевого пузыря на каркасе бесклеточного матрикса [52]. Клетки высевали на бесклеточный матрикс (подслизистая оболочка тонкой кишки) и использовали в исследованиях увеличения мочевого пузыря. Количество гладких мышц, содержащих пучки, было резко увеличено в засеянных трансплантатах по сравнению с незасеянными контрольными, что позволяет предположить, что мезенхимальные стволовые клетки (МСК) дифференцировались в гладкомышечные клетки (ГМК) и способствовали регенерации трансплантата.В аналогичном исследовании Zhang и др. . описали выделение и размножение МСК костного мозга собак для использования в качестве альтернативного клеточного источника для аутологичных трансплантатов мочевого пузыря с использованием подслизистой оболочки тонкой кишки (SIS) [53].
Этот тип клеток имеет значительные перспективы для инженерии скелетно-мышечных структур. Костный мозг представляет собой основной источник МСК. Чанг и др. . провели исследования на крысиной модели, в которых изучалась способность МСК помогать в регенерации ткани мочевого пузыря на каркасе бесклеточного матрикса [52]. Клетки высевали на бесклеточный матрикс (подслизистая оболочка тонкой кишки) и использовали в исследованиях увеличения мочевого пузыря. Количество гладких мышц, содержащих пучки, было резко увеличено в засеянных трансплантатах по сравнению с незасеянными контрольными, что позволяет предположить, что мезенхимальные стволовые клетки (МСК) дифференцировались в гладкомышечные клетки (ГМК) и способствовали регенерации трансплантата.В аналогичном исследовании Zhang и др. . описали выделение и размножение МСК костного мозга собак для использования в качестве альтернативного клеточного источника для аутологичных трансплантатов мочевого пузыря с использованием подслизистой оболочки тонкой кишки (SIS) [53]. Эти авторы продемонстрировали способность MSCs дифференцироваться в SMCs и обеспечивать сократительную силу на коллагеновых матрицах in vitro . МСК также усиливали регенеративный процесс при посеве на СИС для аугментационной цистопластики за счет усиления образования пучков гладких мышц [53].Однако в обоих исследованиях клетки не были помечены и, следовательно, были неотличимы от клеток, которые могли мигрировать из окружающих нормальных тканей.
Эти авторы продемонстрировали способность MSCs дифференцироваться в SMCs и обеспечивать сократительную силу на коллагеновых матрицах in vitro . МСК также усиливали регенеративный процесс при посеве на СИС для аугментационной цистопластики за счет усиления образования пучков гладких мышц [53].Однако в обоих исследованиях клетки не были помечены и, следовательно, были неотличимы от клеток, которые могли мигрировать из окружающих нормальных тканей.
Другим источником взрослых стволовых клеток является жировая ткань. В отличие от стволовых клеток костного мозга, которые трудно изолировать и которые относительно редки, жировые стволовые клетки (ASC) чрезвычайно многочисленны и легко доступны [56]. Джек и др. . продемонстрировали возможность создания ткани мочевого пузыря из жировых стволовых клеток. Они показали, что ASCs дифференцируются в гладкомышечные клетки мочевого пузыря и проявляют сократительную функцию in vivo .Широкая доступность ASC в сочетании с простотой их получения и способностью дифференцироваться в сократительные гладкие мышцы делают их конкурентоспособной неэмбриональной альтернативой для регенерации мочевого пузыря и других гладкомышечных тканей [56].
Хотя считается, что стволовые клетки являются ключевым фактором для будущего ТЭ, одна из основных проблем, связанных с использованием этих клеток, заключается в обеспечении соответствующих сигналов клеточной среды, которые регулируют рост клеток и последующее образование тканей контролируемым и эффективным образом. образом [27].Более глубокое понимание сложного взаимодействия стволовых клеток и окружающей среды может позволить разработать новые стратегии, в которых стволовые клетки активно участвуют в формировании функциональных тканей и органов. Стволовые клетки будут дифференцироваться в различные типы клеток in situ в зависимости от требований регенерирующей ткани, или они останутся стволовыми клетками, дающими потомство для поддержания ткани. Кроме того, стволовые клетки можно использовать для секреции факторов, усиливающих врастание клеток, неоваскуляризацию и реиннервацию.Кишечные органоиды, которые росли на каркасах, не только заселяли кишечник, но также приводили к сосудистой и лимфатической пролиферации, преимущественно за счет продукции фактора роста эндотелия сосудов (VEGF) [57].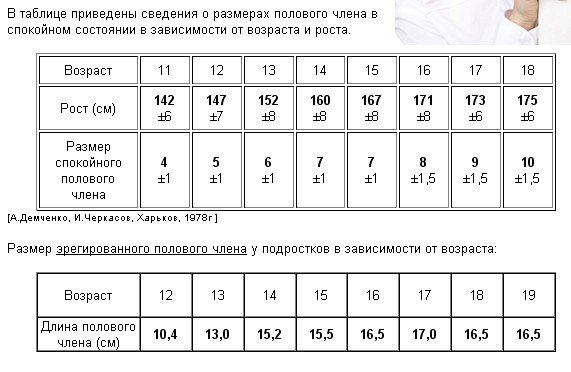
3. Окружающая среда
Успешные подходы к ТЭ зависят от соблюдения множества критических экспериментальных условий. Один из них заключается в создании среды, способствующей росту, дифференцировке клеток и, в конечном итоге, обеспечивающей интеграцию имплантированной ТЭ-конструкции с окружающей тканью хозяина.Для этого ТЕ-конструкции не должны вызывать иммунный ответ, т. е. , клетки-хозяева не распознают его как инородное тело. Кроме того, TE-конструкции стремятся имитировать механические и биохимические свойства нативного внеклеточного матрикса (ECM). ВКМ представляет собой оптимизированную естественную среду, которая направляет развитие тканей и поддерживает их гомеостаз. ECM относится к сложной сети молекул, которые обеспечивают 2D- или 3D-механическую поддержку клеток, служат барьером между различными компартментами или типами клеток и обеспечивают ориентиры во время развития, восстановления тканей или заживления ран.На индивидуальной клеточной основе ECM индуцирует клеточную полярность, позволяет или ингибирует клеточную адгезию, способствует или замедляет миграцию и индуцирует дифференцировку клеток и тканей. Он также может вызывать запрограммированную гибель клеток [18]. ECM состоит из химически очень разных макромолекул, которые собраны в организованные структуры, остающиеся в тесной связи с поверхностью секретирующих их клеток. Основными компонентами являются заполняющие пространство протеогликаны, содержащие коллагеновые волокна и неколлагеновые гликопротеины, такие как эластин.В эту гидрогелеподобную матрицу интегрированы сигнальные молекулы, такие как факторы роста, цитокины и гормоны [19,20]. ECM встречается во многих различных формах в зависимости от требований окружающих тканей. Во многих случаях это 3D-структура окружающих клеток ВКМ, которая поддерживает тканеспецифическую 3D-архитектуру. В других случаях внеклеточный матрикс образует гибкие пластинчатые структуры толщиной от 40 до 120 нм, которые служат твердыми опорными слоями, состоящими из сети, образующей ламинин-энтактиновые комплексы, коллагена IV типа и геарансульфатных протеогликанов.Этот листообразный внеклеточный матрикс, называемый базальной пластинкой, часто встречается в полых органах, таких как кровеносные сосуды или ткань мочевого пузыря.
Он также может вызывать запрограммированную гибель клеток [18]. ECM состоит из химически очень разных макромолекул, которые собраны в организованные структуры, остающиеся в тесной связи с поверхностью секретирующих их клеток. Основными компонентами являются заполняющие пространство протеогликаны, содержащие коллагеновые волокна и неколлагеновые гликопротеины, такие как эластин.В эту гидрогелеподобную матрицу интегрированы сигнальные молекулы, такие как факторы роста, цитокины и гормоны [19,20]. ECM встречается во многих различных формах в зависимости от требований окружающих тканей. Во многих случаях это 3D-структура окружающих клеток ВКМ, которая поддерживает тканеспецифическую 3D-архитектуру. В других случаях внеклеточный матрикс образует гибкие пластинчатые структуры толщиной от 40 до 120 нм, которые служат твердыми опорными слоями, состоящими из сети, образующей ламинин-энтактиновые комплексы, коллагена IV типа и геарансульфатных протеогликанов.Этот листообразный внеклеточный матрикс, называемый базальной пластинкой, часто встречается в полых органах, таких как кровеносные сосуды или ткань мочевого пузыря.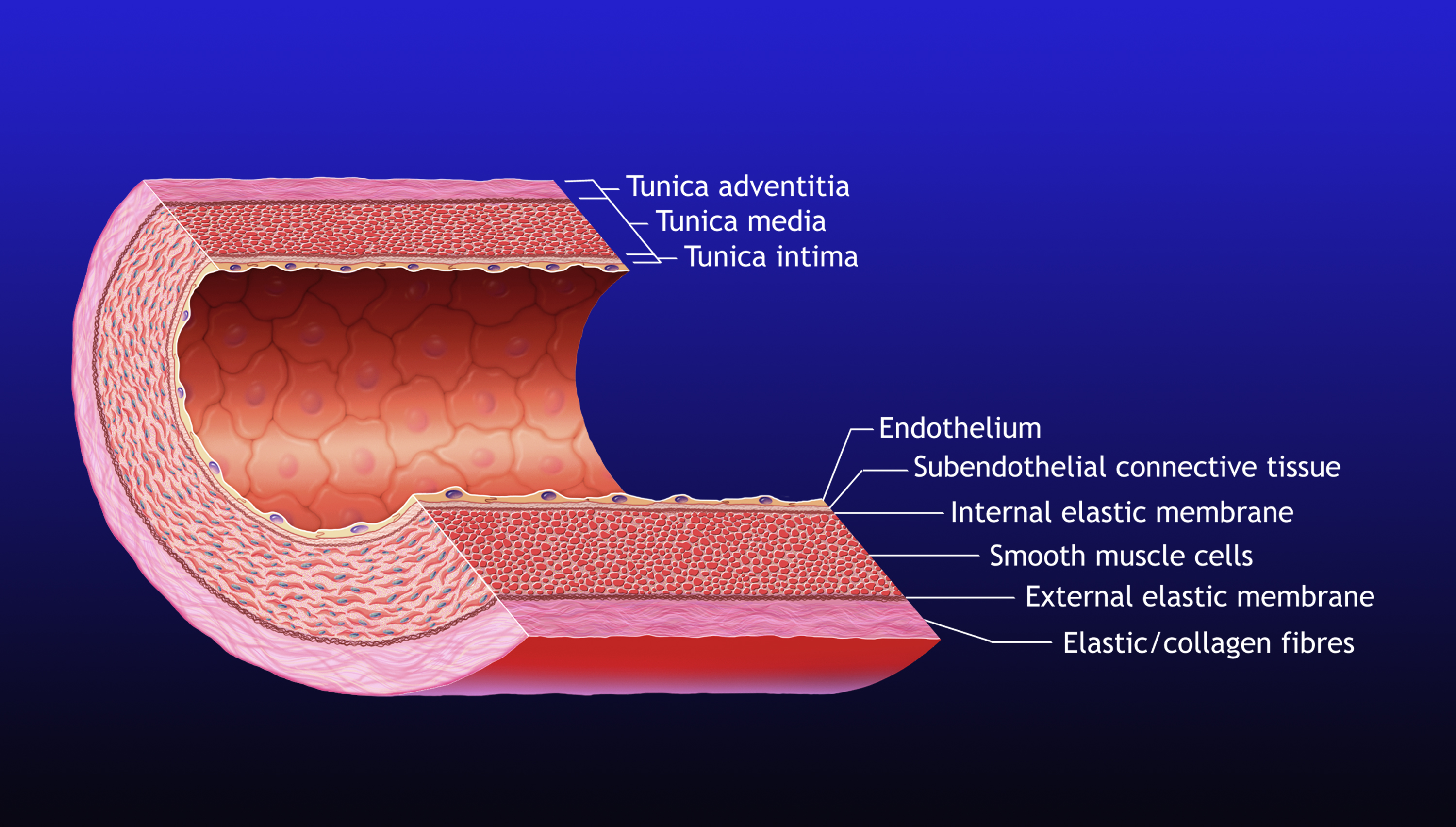 ECM является тканеспецифичным, и его компоненты самособираются, образуя спонтанные 2D- или 3D-структуры в физиологических условиях. Поэтому были предприняты большие усилия, чтобы понять соответствующие биологические, физические и химические сигналы с целью имитации ВКМ для управления морфогенезом при восстановлении тканей [21].
ECM является тканеспецифичным, и его компоненты самособираются, образуя спонтанные 2D- или 3D-структуры в физиологических условиях. Поэтому были предприняты большие усилия, чтобы понять соответствующие биологические, физические и химические сигналы с целью имитации ВКМ для управления морфогенезом при восстановлении тканей [21].
Более того, состав и структура ВКМ постоянно меняется по мере развития, ремоделирования, восстановления и старения тканей [22].Все клетки тела, за исключением клеток крови, взаимодействуют непосредственно и весьма специфическим образом с окружающим их ВКМ. Устанавливаются специфические контакты рецептор-лиганд, которые обеспечивают взаимную связь между ECM и внутренней частью клетки, таким образом регулируя сборку матрикса, специфическое ремоделирование и локальное удаление или разборку матрикса [21]. Клеточно-матриксные контакты в основном формируются между различными интегринами, собранными в гигантские трансмембранные белковые комплексы, которые регулируют и специфицируют их аффинность связывания с лигандом, а также сборку матрикса. Интегрины представляют собой трансмембранные гетеродимерные гликопротеины, состоящие из одной α- и одной β-субъединицы, образующие не менее 24 интегрин-гетеродимеров, известных у человека. Многим интегринам требуются двухвалентные катионы (Ca 2+ , Mg 2+ или Mn 2+ ) для структурной целостности и связывания лиганда, а также для активации посредством образования кластеров, чтобы быть полностью функциональными [23,24,25, 26]. Хотя формируется множество контактов клетка-матрикс, которые позволяют клетке реагировать на свое непосредственное 2D- или 3D-окружение, эти контакты преходящи и строго регулируются.После имплантации ТЕ-конструкции взаимодействие клеток с матрицей определяется поверхностными свойствами материала каркаса, и было обнаружено, что происходят их императивные взаимодействия. В дополнение к этим взаимодействиям между клетками и матриксом несколько факторов роста и биологических молекул также участвуют в клеточной адгезии, коммуникации между клетками и взаимодействии между клетками и матриксом.
Интегрины представляют собой трансмембранные гетеродимерные гликопротеины, состоящие из одной α- и одной β-субъединицы, образующие не менее 24 интегрин-гетеродимеров, известных у человека. Многим интегринам требуются двухвалентные катионы (Ca 2+ , Mg 2+ или Mn 2+ ) для структурной целостности и связывания лиганда, а также для активации посредством образования кластеров, чтобы быть полностью функциональными [23,24,25, 26]. Хотя формируется множество контактов клетка-матрикс, которые позволяют клетке реагировать на свое непосредственное 2D- или 3D-окружение, эти контакты преходящи и строго регулируются.После имплантации ТЕ-конструкции взаимодействие клеток с матрицей определяется поверхностными свойствами материала каркаса, и было обнаружено, что происходят их императивные взаимодействия. В дополнение к этим взаимодействиям между клетками и матриксом несколько факторов роста и биологических молекул также участвуют в клеточной адгезии, коммуникации между клетками и взаимодействии между клетками и матриксом. Эта очень сложная область была освещена в недавних обзорах ([27]) и поэтому не будет далее обсуждаться в этой главе.
Эта очень сложная область была освещена в недавних обзорах ([27]) и поэтому не будет далее обсуждаться в этой главе.
4. Биоматериалы
Каркас служит временной опорной конструкцией, позволяющей не только трехмерно поддерживать рост и формирование тканей, но и обеспечивать биологическую среду, необходимую для клеточного роста, дифференцировки и образования тканей.Материалы для строительных лесов могут быть природного или синтетического происхождения. Основополагающий принцип конструирования каркасов для ТЭ одинаков для разных типов тканей. Каркас предпочтительно имитирует структуру и биологические функции нативного ECM как с точки зрения химического состава, так и физических свойств. Нативный ВКМ представляет собой сложную и динамичную среду, наполненную наноэлементами, такими как волокна, демонстрирующие определенный размер пор и взаимосвязь, которые в идеале должны обладать тканеспецифичными структурами и свойствами.Когда используются каркасы природного происхождения, они обеспечивают специфические лиганды для клеточной адгезии и миграции, а также различные факторы роста, индуцирующие специфическую пролиферацию и функции клеток.
В первые дни были исследованы жесткие или неуступчивые материалы для их использования в тканевой инженерии. Эти материалы не подходили для поддержки формирования здоровой ткани из-за биомеханических нарушений и биологической несовместимости [15,16,17].
В настоящее время для изготовления каркасов для ТЭ доступны различные материалы, в том числе природные и синтетические полимеры и их композиты.Выбор материала зависит от типа реконструируемой ткани. Большинство полых органов организовано сходным образом и состоит из эпителия, окруженного соединительной тканью, богатой коллагеном I типа, и гладкомышечным слоем. Эпителиальный или эндотелиальный слой служит барьером, препятствующим проникновению содержимого просвета в организм. Слой, богатый коллагеном I типа, и мышечный слой поддерживают структурную и функциональную целостность органа. Клетки внутри этих слоев взаимодействуют друг с другом и со структурными белками, чтобы регулировать клеточную дифференцировку и функцию [58].
Следующие характеристики желательны для лесов, используемых для ТЭ в целом. Каркас должен:
быть биосовместимым, то есть не вызывать отторжения, воспаления, иммунного ответа или реакции на инородное тело.
обеспечивают трехмерный шаблон для прикрепления клеток и управления их ростом.
имеют пористую структуру с большой площадью поверхности для максимальной загрузки клеток, взаимодействия клеток с поверхностью, прорастания тканей и транспортировки питательных веществ и кислорода.
быть разлагаемым в физиологических условиях, а скорость разложения должна соответствовать скорости регенерации ткани для поддержания ее функциональности.
быть механически прочным, чтобы выдерживать in vivo биологические нагрузки.
поддерживают клетки в синтезе тканеспецифических компонентов внеклеточного матрикса и факторов роста, необходимых для роста здоровых тканей.
поддаваться стерилизации во избежание токсического загрязнения без ухудшения каких-либо структурных и механических свойств.

Наконец, процесс производства лесов со всеми перечисленными выше уникальными характеристиками должен быть воспроизводимым, экономичным и масштабируемым [27].
В отношении полых органов идеальный материал каркаса должен
обеспечивают структурную поддержку отдельных слоев клеток, включая достаточную поверхность для стабильного прикрепления уротелиальных клеток.
обеспечивают достаточную биомеханическую поддержку для обеспечения высокой плотности гладкомышечных клеток на внешней поверхности, не вызывая преждевременного коллапса полого органа.
служат барьером между содержимым просвета и полостью тела.
поддерживают формирование однонаправленной мышечной ткани в определенных слоях и обеспечивают быструю иннервацию и васкуляризацию.
Поскольку каждый из различных типов клеток благоприятствует различным условиям для оптимального роста и дифференцировки, тканевая инженерия с использованием нескольких типов клеток должна учитывать эти факторы.
Два основных класса биоматериалов использовались для создания полых органов; бесклеточные матрицы, полученные из донорских тканей (например,g., подслизистая оболочка мочевого пузыря и подслизистая оболочка тонкой кишки) и синтетические полимеры, такие как полигликолевая кислота (PGA), полимолочная кислота (PLA) и поли(молочная-со-гликолевая кислота) (PLGA) (см. ). Эти материалы были протестированы на предмет их биосовместимости в тканях хозяина [59,60]. Было показано, что оба типа материала способны поддерживать формирование урогенитальной и желудочно-кишечной ткани. Матрицы бесклеточной ткани экстрагируются из нативной ткани и, следовательно, содержат факторы роста, гормоны и другие сигнальные факторы [61,62], которые способствуют развитию ткани и имеют последовательности доменов адгезии (например,g., RGD), которые могут поддерживать фенотип и активность многих типов клеток [63]. Известно, что эти матрицы медленно деградируют при имплантации и обычно замещаются и ремоделируются белками ЕСМ, синтезируемыми и секретируемыми трансплантированными или врастающими клетками [64,65,66,67]. Напротив, синтетические полимеры можно воспроизводимо производить в больших масштабах с контролируемыми свойствами их прочности, скорости разложения и ультраструктуры [68,69]. Оба класса биоматериалов использовались с клетками или без них для тканевой инженерии полых органов, включая мочевой пузырь [11,12,70], уретру [71,72], пищевод [73], кишечник [8], влагалище [74]. ] или кровеносных сосудов [75,76].
Напротив, синтетические полимеры можно воспроизводимо производить в больших масштабах с контролируемыми свойствами их прочности, скорости разложения и ультраструктуры [68,69]. Оба класса биоматериалов использовались с клетками или без них для тканевой инженерии полых органов, включая мочевой пузырь [11,12,70], уретру [71,72], пищевод [73], кишечник [8], влагалище [74]. ] или кровеносных сосудов [75,76].
Таблица 1
Сравнение двух основных классов биоматериалов, используемых для ТЭ полых органов.
| Каркасы природного происхождения | Каркасы синтетические |
| напр. Подслизистая оболочка мочевого пузыря | например. PGA |
| + в основном коллаген, натурально полученный | + поглощаемый |
| + высокая пористость (до 95%) | |
| + сайты распознавания ячейки | + низкая вариантность |
| + Факторы роста | — Синтетические, сайты не распознаются |
| — Низкая эластичность | |
| — Высокая изменчивость |
4.
 1. Нативные бесклеточные матрицы
1. Нативные бесклеточные матрицы Нативные бесклеточные матрицы являются новаторскими материалами и обладают многими потенциальными преимуществами по сравнению с синтетическими каркасными материалами [77]. Эти богатые коллагеном матрицы извлекаются из нативной ткани путем механической или химической децеллюляризации [78,79]. Они происходят либо из мочевого пузыря [бесклеточный матрикс мочевого пузыря (BAM)] [80], либо из тонкой кишки (SIS) [72]. Растяжимая основа каркаса состоит из фибриллярного коллагена типа I и базальной мембраны, служащей в качестве цито- и тканесовместимого полимерного каркаса для рецеллюляризации.Важным преимуществом перед синтетическими материалами является состав бесклеточного матрикса, включающий структурные и функциональные белки, присутствующие в нативном внеклеточном матриксе. Следовательно, бесклеточный матрикс может сохранять свою биологическую активность. Они обеспечивают специфические сайты связывания интегрина и содержат эндогенные факторы роста, способствующие врастанию ткани [81]. Кроме того, учитывая, что состав и структура ECM уникальны для отдельных тканей, могут быть преимущества в ортотопических матрицах: можно ожидать, что BAM будет содержать более подходящие факторы роста для TE мочевого пузыря, чем SIS [82].После имплантации в организм они медленно деградируют, поддерживая врастание клеток-хозяев, которые затем начинают производить новые белки ECM.
Кроме того, учитывая, что состав и структура ECM уникальны для отдельных тканей, могут быть преимущества в ортотопических матрицах: можно ожидать, что BAM будет содержать более подходящие факторы роста для TE мочевого пузыря, чем SIS [82].После имплантации в организм они медленно деградируют, поддерживая врастание клеток-хозяев, которые затем начинают производить новые белки ECM.
Для реконструкции тонкой кишки использовали SIS без посева и с посевом кишечных органоидов [31], мезенхимальных стволовых клеток [83] и гладкомышечных клеток [9]. При использовании незасеянных графтов СИС наблюдалась значительная контракция имплантата (20–40%) [8,84]. Ансалони и др. показали регенерацию эпителия слизистой оболочки, организованные гладкомышечные волокна в 2 слоя, неоваскуляризацию и реиннервацию регенерированного кишечника [8].Исследования с использованием SIS и клеток показывают, что использование соответствующих клеток-предшественников имеет большое преимущество для инициации регенерации тканей кишечника и уменьшения усадки тканей [9,31,83].
При реконструкции мочевого пузыря бесклеточные матриксы использовались либо в виде одного трансплантата, либо с засеянными уротелиальными и гладкомышечными клетками [11,12,85,86,87]. Анализ незасеянных пластырей SIS после имплантации собакам показал замещение нормальной тканью мочевого пузыря, васкуляризацию и реиннервацию [70].Однако успешная регенерация мочевого пузыря с помощью СИС, по-видимому, зависит от скорости реваскуляризации трансплантата и степени первоначального повреждения мочевого пузыря. SIS не поддерживал функциональную регенерацию тканей при использовании у животных с воспаленными и сморщенными остатками мочевого пузыря [87].
Имплантация БАМ в мочевой пузырь крыс, кроликов, собак и свиней приводила к регенерации уротелиального и мышечного слоев с иннервацией и васкуляризацией трансплантата [85,86]. Кроме того, было показано, что BAM высвобождает экзогенный основной фактор роста фибробластов (bFGF) в крысиной модели увеличения мочевого пузыря.bFGF является важным фактором роста, поддерживающим формирование ткани и уменьшающим усадку трансплантата [88].
Однако проблемы с плохой васкуляризацией, усадкой трансплантата и неполным или дезорганизованным развитием гладкой мускулатуры были связаны с использованием децеллюляризированных матриксов в различных тканях [87,89,90]. Усадка трансплантата происходит из-за быстрого врастания фибробластов [89]. Кажется, это частая находка каркаса при использовании в качестве трансплантата для полых структур. Исследователи сходятся во мнении, что чем больше трансплантат, тем более выражена усадка из-за активности актин-позитивных фибробластов гладкой мускулатуры [89,90].Сообщалось, что покрытие сальника, посев эндотелиальных клеток или применение экзогенных ангиогенных факторов роста позволяют врастать капиллярам в трансплантат [88,91]. Тем не менее, создание и поддержание постоянного и достаточно надежного кровоснабжения для поддержания большого трансплантата мочевого пузыря человека еще предстоит продемонстрировать.
Вышеупомянутые проблемы привели к концепции посева ex vivo аутологичных клеток на различные каркасные материалы с целью улучшения интеграции тканей после имплантации. Это сведет к минимуму воспалительную реакцию на матрицу, что позволит избежать контрактуры и усадки трансплантата. Ю и др. . показали, что существует большая разница между BAM, используемой с аутологичными клетками, и матрицами, используемыми без клеток [11].
Это сведет к минимуму воспалительную реакцию на матрицу, что позволит избежать контрактуры и усадки трансплантата. Ю и др. . показали, что существует большая разница между BAM, используемой с аутологичными клетками, и матрицами, используемыми без клеток [11].
Основным недостатком этих систем является рутинная изменчивость белкового состава между партиями. Также могут возникнуть этические проблемы, связанные с их доступностью, хотя большинство естественных каркасов представляют собой свиные ксенотрансплантаты.
4.2. Синтетические полимеры
Исторически сложилось так, что попытки включения одних только синтетических материалов в полые органы в основном терпели неудачу, главным образом в результате биологической и механической несовместимости. Первоначальные сообщения об использовании протезных материалов, таких как дакрон [92] или политетрафторэтилен (ПТФЭ) [93], для восстановления дефектов кишечника не увенчались успехом. Эти материалы не могли в достаточной степени поддерживать формирование новой ткани. Использование рассасывающихся биоматериалов, таких как полигликолевая кислота PGA и PLA, засеянных кишечными органоидами, показало способность выращивать неоинтестин, который имеет гистологический вид тонкой кишки и анастомозирует с нативной кишкой, не вызывая проблем [94].
Использование рассасывающихся биоматериалов, таких как полигликолевая кислота PGA и PLA, засеянных кишечными органоидами, показало способность выращивать неоинтестин, который имеет гистологический вид тонкой кишки и анастомозирует с нативной кишкой, не вызывая проблем [94].
Среди прочего поливиниловые губки, силикон, политетрафторэтилен (тефлон) и бумага с напылением смолы использовались для реконструкции мочевого пузыря с переменными результатами, но ни один из методов не применялся до настоящего времени [15,16,17]. Современные синтетические полимеры, такие как PGA, PLA и PLGA, широко используются в тканевой инженерии и применяются при реконструкции мочевого пузыря. Эти полимеры получили одобрение FDA для различных применений у людей, включая шовный материал. Эфирные связи в этих полимерах гидролитически лабильны, что позволяет разлагать их неферментативным гидролизом.
Разложение PGA, PLA и PLGA сопровождается выделением кислых побочных продуктов, которые снижают местный pH и вызывают легкую реакцию на инородное тело. Эти естественные метаболиты со временем выводятся из организма в виде углекислого газа и воды [95]. Скорость деградации этих полимеров можно регулировать от нескольких недель до нескольких лет путем изменения кристалличности, начальной молекулярной массы и соотношения молочной и гликолевой кислот в сополимере. Поскольку эти полимеры являются термопластами, их можно легко превратить в трехмерный каркас с желаемой микроструктурой, грубой формой и размерами с помощью различных методов, включая формование, экструзию [96], литье из растворителя [97], методы разделения фаз, методы вспенивания газа. [98] и электроспиннинг [99,100].Многие приложения в тканевой инженерии требуют каркаса с высокой пористостью и высоким отношением площади поверхности к объему. Другие биоразлагаемые синтетические полимеры, в том числе поли(ангидриды) и поли(ортоэфиры), также могут быть использованы для изготовления каркасов для тканевой инженерии с контролируемыми свойствами [101].
Эти естественные метаболиты со временем выводятся из организма в виде углекислого газа и воды [95]. Скорость деградации этих полимеров можно регулировать от нескольких недель до нескольких лет путем изменения кристалличности, начальной молекулярной массы и соотношения молочной и гликолевой кислот в сополимере. Поскольку эти полимеры являются термопластами, их можно легко превратить в трехмерный каркас с желаемой микроструктурой, грубой формой и размерами с помощью различных методов, включая формование, экструзию [96], литье из растворителя [97], методы разделения фаз, методы вспенивания газа. [98] и электроспиннинг [99,100].Многие приложения в тканевой инженерии требуют каркаса с высокой пористостью и высоким отношением площади поверхности к объему. Другие биоразлагаемые синтетические полимеры, в том числе поли(ангидриды) и поли(ортоэфиры), также могут быть использованы для изготовления каркасов для тканевой инженерии с контролируемыми свойствами [101].
По сравнению с природными материалами преимущество производства синтетического каркасного материала заключается в полном контроле технологических свойств, таких как прочность, биоразлагаемость, микроструктура и проницаемость, однако фундаментальной особенностью этих материалов является отсутствие естественных сигналов, регулирующих клетки.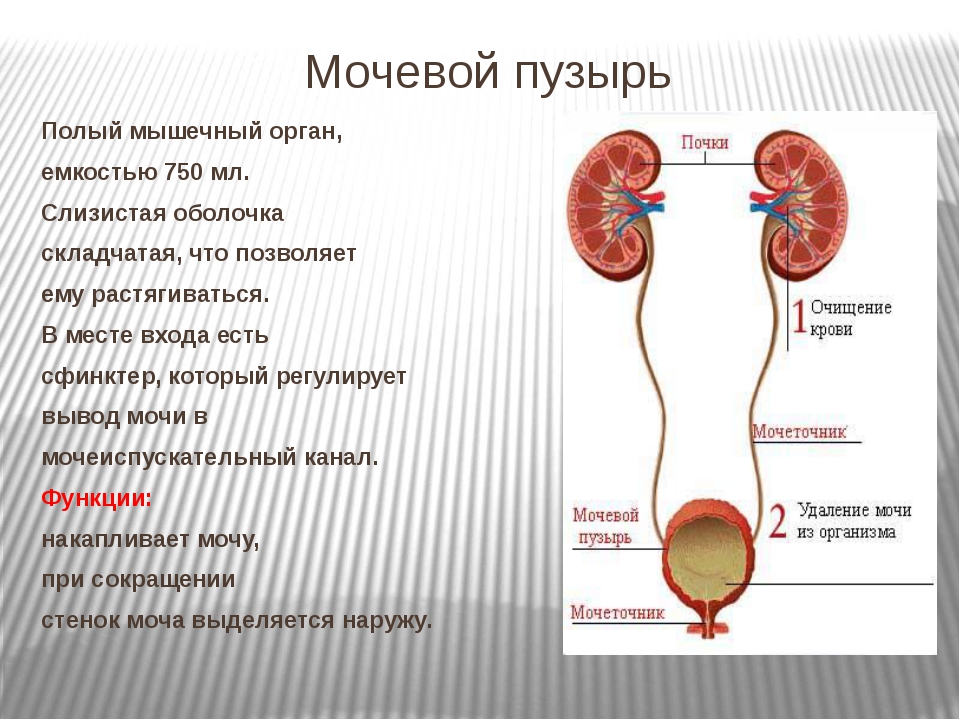 прикрепление, рост и дифференцировка [102,103].
прикрепление, рост и дифференцировка [102,103].
Atala и коллеги впервые продемонстрировали возможность посева клеток на чисто синтетическую матрицу для имплантации in vivo [12]. PLGA — хорошо охарактеризованный биоматериал с предсказуемыми свойствами деградации, который широко используется в качестве шовного материала и сеток Vicryl®. Он нетоксичен и биосовместим как с уротелиальными клетками, так и с клетками гладкой мускулатуры мочевого пузыря [59,60]. Эти качества делают PLGA привлекательным кандидатом для комбинирования с природными материалами для формирования имплантируемых конструкций для реконструкции мочевого пузыря.Оберпеннинг и др. В модели также использовались сетки PGA, отлитые в форме баллона и покрытые PLGA. Конструкции засевали аутологичными гладкомышечными клетками на внешней и уротелиальными клетками на внутренней поверхности каркасного материала [12]. После субтотальной цистэктомии у собак конструкции мочевого пузыря затем имплантировали в основание мочевого пузыря (треугольник), после чего новый мочевой пузырь покрывали фибриновым клеем и окружали сальником.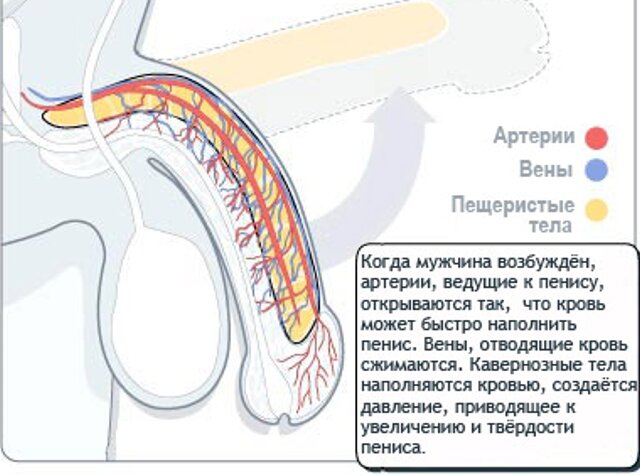 За животными наблюдали до 11 месяцев.Осложнений не было, и через три месяца полимер разложился. Функционально реконструированные мочевые пузыри обеспечивали достаточную емкость с хорошей податливостью. Гистологически и иммуноцитохимически мочевой пузырь показал адекватную структурную архитектуру, а фенотипически уротелий и мышцы сохранили свою программу нормальной дифференцировки.
За животными наблюдали до 11 месяцев.Осложнений не было, и через три месяца полимер разложился. Функционально реконструированные мочевые пузыри обеспечивали достаточную емкость с хорошей податливостью. Гистологически и иммуноцитохимически мочевой пузырь показал адекватную структурную архитектуру, а фенотипически уротелий и мышцы сохранили свою программу нормальной дифференцировки.
Как упоминалось ранее, синтетические биоразлагаемые полимеры не содержат компонентов внеклеточного матрикса и, следовательно, последовательностей клеточной адгезии и сигнальных молекул.Тем не менее, модификация химического состава полимерных каркасов и метода производства позволяет улучшить потенциал адгезии клеток, скорость роста и регулирование фенотипа [104,105]. Важно, чтобы структурные особенности изготовленных матриксов напоминали природный ВКМ, чтобы обеспечить формирование ткани и способствовать быстрой клинической трансформации. В последнее время многочисленные исследования изучали возможность создания каркасов, подобных природному ECM [106,107]. Эти каркасы обладают большой площадью поверхности, высокой пористостью, малым размером пор и низкой плотностью — все эти свойства необходимы для улучшения клеточной адгезии, необходимой для миграции, пролиферации и дифференцировки клеток.Матрицы из полимерных нановолокон являются одними из наиболее перспективных биоматериалов, имитирующих ВКМ, поскольку их физическая структура аналогична структуре волокнистых белков в нативном ВКМ. Они все чаще используются в ТЭ и имеют преимущества перед традиционными каркасами из-за увеличенного отношения поверхности к объему, что, как предполагается, выгодно для взаимодействия клетки с каркасом, способствуя клеточной адгезии, пролиферации, миграции и функционированию.
Эти каркасы обладают большой площадью поверхности, высокой пористостью, малым размером пор и низкой плотностью — все эти свойства необходимы для улучшения клеточной адгезии, необходимой для миграции, пролиферации и дифференцировки клеток.Матрицы из полимерных нановолокон являются одними из наиболее перспективных биоматериалов, имитирующих ВКМ, поскольку их физическая структура аналогична структуре волокнистых белков в нативном ВКМ. Они все чаще используются в ТЭ и имеют преимущества перед традиционными каркасами из-за увеличенного отношения поверхности к объему, что, как предполагается, выгодно для взаимодействия клетки с каркасом, способствуя клеточной адгезии, пролиферации, миграции и функционированию.
Кроме того, создание каркаса из нановолокон может направлять рост мышечных клеток в трех измерениях.Положение и ориентация этих волокон считаются одной из важных особенностей функционального тканевого каркаса, содержащего мышечные клетки. Это приводит к концепции нановолокнистых каркасов для применения в тканевой инженерии. Кроме того, ориентация волокон каркасов сильно влияет на ориентацию клеток и фенотипическую экспрессию [108,109,110]. Например, Сюй и др. . [107] оценили электропрядение синтетических биоматериалов [поли(L-лактид-ко-ε-капролактон), P(LLA-CL)] с использованием гладкомышечных клеток.Диаметр сгенерированных волокон составлял около 500 нм с выровненной топографией, имитирующей циркулярную ориентацию клеток и фибрилл, обнаруженных в медиальном слое нативной артерии. Результаты показывают, что клетки прикреплялись и мигрировали вдоль оси выровненных каркасов, проявляя при этом веретенообразный фенотип. Организация цитоскелета внутри этих клеток также была параллельна ориентации сборки волокон. Исследование Бейкера и др. . показали, что гладкомышечные клетки адаптировались к более естественной организации при выращивании на электроформованных полистироловых каркасах по сравнению с коллагеновыми волокнами in vivo [110].Следовательно, инженерные каркасы при контроле ориентации волокон необходимы для имитации структурных и функциональных аспектов нативного ECM, контроля ориентации клеток и роста тканей.
Кроме того, ориентация волокон каркасов сильно влияет на ориентацию клеток и фенотипическую экспрессию [108,109,110]. Например, Сюй и др. . [107] оценили электропрядение синтетических биоматериалов [поли(L-лактид-ко-ε-капролактон), P(LLA-CL)] с использованием гладкомышечных клеток.Диаметр сгенерированных волокон составлял около 500 нм с выровненной топографией, имитирующей циркулярную ориентацию клеток и фибрилл, обнаруженных в медиальном слое нативной артерии. Результаты показывают, что клетки прикреплялись и мигрировали вдоль оси выровненных каркасов, проявляя при этом веретенообразный фенотип. Организация цитоскелета внутри этих клеток также была параллельна ориентации сборки волокон. Исследование Бейкера и др. . показали, что гладкомышечные клетки адаптировались к более естественной организации при выращивании на электроформованных полистироловых каркасах по сравнению с коллагеновыми волокнами in vivo [110].Следовательно, инженерные каркасы при контроле ориентации волокон необходимы для имитации структурных и функциональных аспектов нативного ECM, контроля ориентации клеток и роста тканей. В настоящее время существует ряд методов изготовления тканевых каркасов, в том числе электроформование, самосборка, разделение фаз, литье из растворителя и выщелачивание частиц, сушка вымораживанием, формование из расплава, темплатный синтез, вытяжка, вспенивание газом и твердофазное вспенивание. свободное формирование [27]. Среди них только электроформование дает возможность создавать нановолоконные каркасы в виде нетканых структур, которые могут удовлетворить требования тканевой инженерии на основе каркасов.
В настоящее время существует ряд методов изготовления тканевых каркасов, в том числе электроформование, самосборка, разделение фаз, литье из растворителя и выщелачивание частиц, сушка вымораживанием, формование из расплава, темплатный синтез, вытяжка, вспенивание газом и твердофазное вспенивание. свободное формирование [27]. Среди них только электроформование дает возможность создавать нановолоконные каркасы в виде нетканых структур, которые могут удовлетворить требования тканевой инженерии на основе каркасов.
4.3. Композитный каркас
Методы улучшения прикрепления и пролиферации клеток на синтетических материалах уже изучены. Один из подходов состоит в том, чтобы покрыть синтетический материал биологическими веществами, такими как коллаген, сыворотка, или использовать процедуры модификации поверхности перед посевом клеток, чтобы стимулировать прикрепление. Культивированные ГМК In vitro , например, прикрепляются и широко размножаются на биоразлагаемом полиэфируретановом пеноматериале, предварительно обработанном эмбриональной бычьей сывороткой [102], а также на полистироле, покрытом плазмой, полученном методом электропрядения [110].
Альтернативный подход заключается в комбинировании различных материалов лесов с различными свойствами. Так называемые композитные каркасы могут быть изготовлены из двух или более совершенно разных полимерных систем для проектирования полых органов. Каркасы, разработанные для полых органов, требуют особого внимания к их барьерной функции между полостью и окружающими тканями, в то же время вмещая достаточное количество клеток, которые способствуют развитию тканей. При реконструкции тканей желудочно-кишечного тракта пока нет сообщений об использовании композитных каркасов.Недавние сообщения о реконструкции мочевого пузыря с использованием композитного каркаса, состоящего из синтетического PGA и нативного бесклеточного матрикса (коллагена), оказались оптимальными для инженерии ткани мочевого пузыря, сочетающей в себе преимущества различных материалов [111].
Коллагеновые гибридные матрицы были использованы со смешанными результатами in vitro . В одном исследовании сетка PLGA была объединена с коллагеном и превращена в губку или гель [112].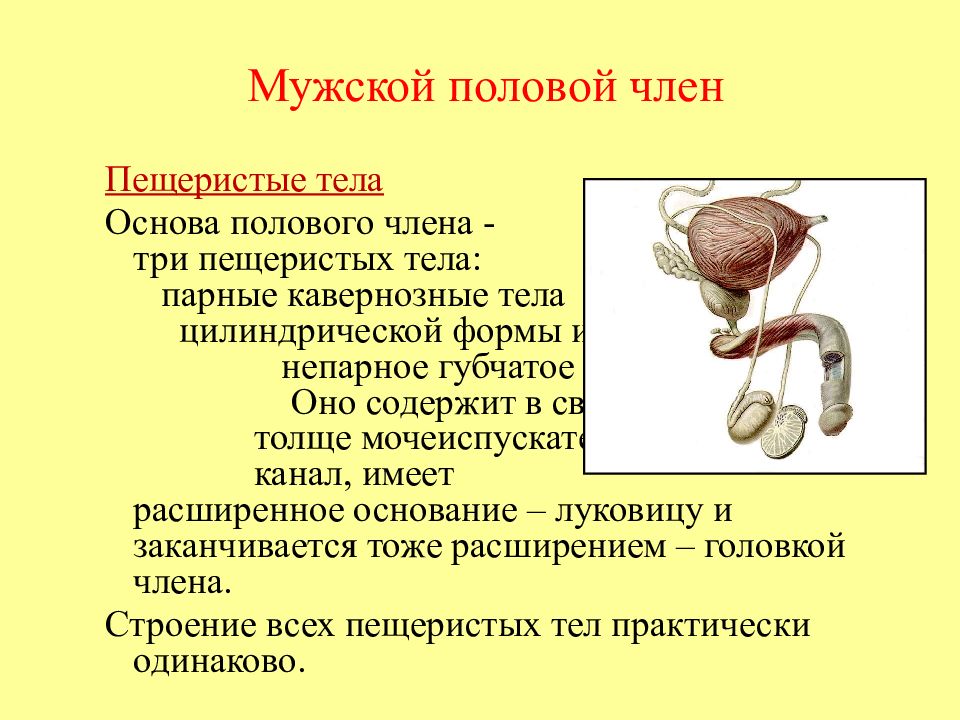 Культивированные свиные уротелиальные клетки и гладкомышечные клетки мочевого пузыря высевали на каждую из конструкций.Гладкомышечные клетки были способны пролиферировать и сохранять экспрессию маркеров дифференцировки при культивировании на конструкции на основе геля, но не на губке. Противоположная ситуация была в случае с уротелиальными клетками, которые расслаивались на губке, а не на геле, хотя однозначные иммуногистохимические маркеры дифференцировки на уротелии не тестировались [112]. Более многообещающими были результаты Эберли и коллег [111], которые использовали композитную каркасную систему из нативного бесклеточного коллагенового матрикса, связанного с полимерными сетками PGA.Бесклеточный матрикс служил барьером, препятствующим проникновению содержимого просвета в полость тела, обеспечивая при этом оптимальную поверхность для прикрепления и роста эпителиальных клеток. Синтетический полимерный слой с большими порами был разработан для размещения достаточного количества мышечных клеток и в то же время поддерживал структурную целостность каркаса.
Культивированные свиные уротелиальные клетки и гладкомышечные клетки мочевого пузыря высевали на каждую из конструкций.Гладкомышечные клетки были способны пролиферировать и сохранять экспрессию маркеров дифференцировки при культивировании на конструкции на основе геля, но не на губке. Противоположная ситуация была в случае с уротелиальными клетками, которые расслаивались на губке, а не на геле, хотя однозначные иммуногистохимические маркеры дифференцировки на уротелии не тестировались [112]. Более многообещающими были результаты Эберли и коллег [111], которые использовали композитную каркасную систему из нативного бесклеточного коллагенового матрикса, связанного с полимерными сетками PGA.Бесклеточный матрикс служил барьером, препятствующим проникновению содержимого просвета в полость тела, обеспечивая при этом оптимальную поверхность для прикрепления и роста эпителиальных клеток. Синтетический полимерный слой с большими порами был разработан для размещения достаточного количества мышечных клеток и в то же время поддерживал структурную целостность каркаса. Исследование показало, что этот композитный каркас оставался биосовместимым, обладал идеальными физическими и структурными характеристиками для применения в полых органах и формировал ткань мочевого пузыря in vivo [111].Композитные каркасы кажутся идеальным подходом для ТЭ полых органов, отвечающим требованиям биоматериала, отвечающего уникальным потребностям различных используемых клеток.
Исследование показало, что этот композитный каркас оставался биосовместимым, обладал идеальными физическими и структурными характеристиками для применения в полых органах и формировал ткань мочевого пузыря in vivo [111].Композитные каркасы кажутся идеальным подходом для ТЭ полых органов, отвечающим требованиям биоматериала, отвечающего уникальным потребностям различных используемых клеток.
5. Васкуляризация и иннервация
Несмотря на то, что во многих исследованиях было продемонстрировано образование ткани, аналогичной нативному мочевому пузырю, функциональность этих конструкций никогда не демонстрировалась. Двумя основными проблемами, ограничивающими сократительную способность конструкций и их способность выполнять физиологические функции, являются правильная иннервация и васкуляризация конструкции, созданной с помощью тканевой инженерии.
Быстрая неоваскуляризация необходима для выживания трансплантата и полного восстановления структуры и функциональности органа.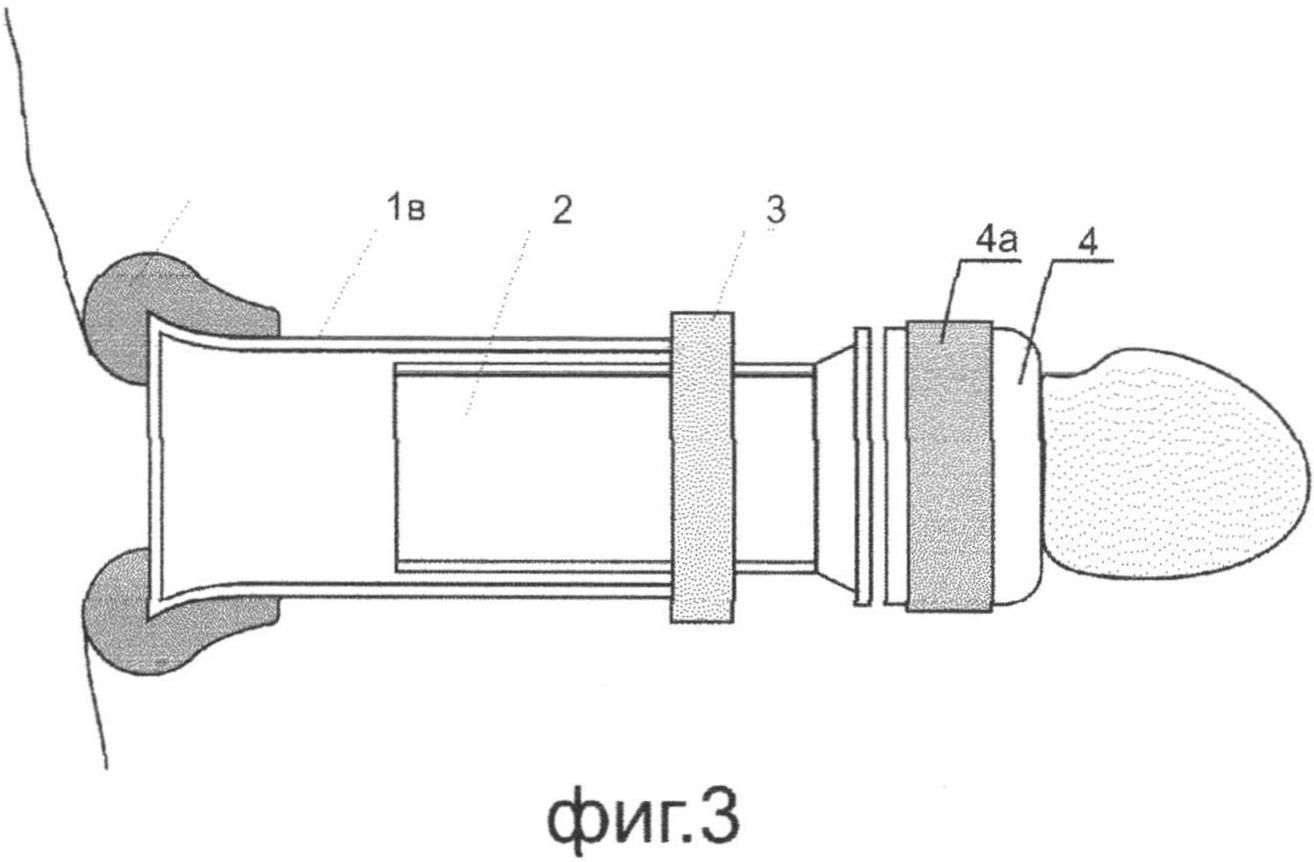 Двумя основными механизмами формирования новых кровеносных сосудов являются ангиогенез (пролиферация и миграция эндотелиальных клеток из уже существующей сосудистой сети) и васкулогенез (образование новых сосудов путем включения in situ, дифференцировки, миграции и/или пролиферации эндотелиальных клеток-предшественников, рекрутированных из периферической крови). ). Трансплантированные матриксы зависят от прорастания сосудов из окружающей ткани, чтобы поддерживать ранее засеянные клетки и способствовать миграции нативных клеток в пересаженную область [14, 113].
Двумя основными механизмами формирования новых кровеносных сосудов являются ангиогенез (пролиферация и миграция эндотелиальных клеток из уже существующей сосудистой сети) и васкулогенез (образование новых сосудов путем включения in situ, дифференцировки, миграции и/или пролиферации эндотелиальных клеток-предшественников, рекрутированных из периферической крови). ). Трансплантированные матриксы зависят от прорастания сосудов из окружающей ткани, чтобы поддерживать ранее засеянные клетки и способствовать миграции нативных клеток в пересаженную область [14, 113].
Одним из ключевых факторов инженерии крупных органов является сосудистая сеть артерий, вен и капилляров, обеспечивающая доставку достаточного количества питательных веществ и кислорода к каждой клетке. Одним из возможных методов искусственной реваскуляризации искусственных тканей может быть применение ангиогенных агентов, таких как фактор роста эндотелия сосудов (VEGF), или имплантация клеток эндотелия сосудов. VEGF является многофункциональным фактором роста с митогенными эффектами, включая миграцию и пролиферацию эндотелиальных клеток, стабилизацию новых сосудов и ремоделирование тканей [114]. В дополнение к своей ангиогенной функции VEGF также действует как антиапоптотический фактор для гладких мышц [115] и эндотелиальных клеток [116].
В дополнение к своей ангиогенной функции VEGF также действует как антиапоптотический фактор для гладких мышц [115] и эндотелиальных клеток [116].
О положительном влиянии VEGF на тканеинженерный кишечник сообщалось Rocha et al . [57]. Сконструированную ткань получали путем посева единиц кишечных органоидов донорских новорожденных крыс на каркасы PGA вместе с микросферами, содержащими VEGF. Через четыре недели in vivo ткань анализировали, показывая, что устойчивая доставка VEGF приводила к усилению микроциркуляторного русла и пролиферации эпителия.Кишечные конструкции с микросферами VEGF были значительно крупнее, а пролиферация эпителиальных клеток и плотность капилляров значительно увеличивались по сравнению с контрольной тканью.
Поскольку усадка трансплантата является естественным процессом каркасного материала для полого органа, улучшение кровоснабжения трансплантата было задумано как мера поддержания жизнеспособности регенерированной ткани. Сообщалось, что при аугментации мочевого пузыря покрытие сальником [12], применение экзогенных ангиогенных факторов роста [88, 117, 118] и засев эндотелиальных клеток [119] позволяют врастать капиллярам в трансплантат, но все же может отсутствовать способность обеспечить постоянное и достаточное прилегание. надежное кровоснабжение для поддержания большого трансплантата мочевого пузыря человека.
надежное кровоснабжение для поддержания большого трансплантата мочевого пузыря человека.
Иннервация регенерированного полого органа необходима для долгосрочной функциональной приживаемости трансплантата и во избежание вторичной дегенерации органоспецифических клеток. Особенно при реконструкции мочевого пузыря одним из основных препятствий для клинического использования является отсутствие функциональной иннервации.
Накасе и др. смогли вызвать реиннервацию тонкой кишки с тканевой инженерией. Нервные волокна, отходящие от тела нерва в нормальных тканях к центру области трансплантата, наблюдались в регенерированных гладкомышечных слоях, ворсинках и подслизистой оболочке, но конституции мышечно-кишечного сплетения Ауэрбаха или подслизистого сплетения Майсснера не наблюдалось.
Влияние различных нейротрофических факторов на развитие, выживание, рост и разветвление нервной системы изучалось различными исследовательскими группами [120,121,122]. Мицуи и др. . трансплантировали иммортализованные нейральные стволовые клетки, нейрональные и глиальные ограниченные предшественники или фибробласты, экспрессирующие нейротрофические факторы, в ушибленный спинной мозг и сообщили об улучшении функции мочевого пузыря [123]. NGF является первым и лучше всего охарактеризованным членом семейства нейротрофинов. NGF поддерживает выживание, рост и разветвление сенсорных и вегетативных нейронов, но не способствует регенерации моторных нейронов [124].Генная терапия для регенерации периферических нервов использовалась Sasaki et al . Они вводили фактор роста нервов (NGF) в стенку мочевого пузыря вместе с дефектным по репликации аденовирусом для лечения диабетической цистопатии у взрослых и сообщили о заметном улучшении функции мочевого пузыря [125]. Было показано, что эта вирусная векторная система восстанавливает сниженную экспрессию NGF в мочевом пузыре. Однако повышенные уровни NGF в афферентных нейронах мочевого пузыря приводят к гиперрефлексии, которая значительно снижается, когда уровни NGF нейтрализуются антителами против NGF [126].
. трансплантировали иммортализованные нейральные стволовые клетки, нейрональные и глиальные ограниченные предшественники или фибробласты, экспрессирующие нейротрофические факторы, в ушибленный спинной мозг и сообщили об улучшении функции мочевого пузыря [123]. NGF является первым и лучше всего охарактеризованным членом семейства нейротрофинов. NGF поддерживает выживание, рост и разветвление сенсорных и вегетативных нейронов, но не способствует регенерации моторных нейронов [124].Генная терапия для регенерации периферических нервов использовалась Sasaki et al . Они вводили фактор роста нервов (NGF) в стенку мочевого пузыря вместе с дефектным по репликации аденовирусом для лечения диабетической цистопатии у взрослых и сообщили о заметном улучшении функции мочевого пузыря [125]. Было показано, что эта вирусная векторная система восстанавливает сниженную экспрессию NGF в мочевом пузыре. Однако повышенные уровни NGF в афферентных нейронах мочевого пузыря приводят к гиперрефлексии, которая значительно снижается, когда уровни NGF нейтрализуются антителами против NGF [126]. Более того, высокие дозы NGF задерживают регенерацию нервов, замедляя GAP 43 [127]. Следовательно, не менее важно учитывать оптимальную дозу и кинетику высвобождения для применения таких терапевтических факторов роста. Нейротрофический фактор глиальной клеточной линии (GDNF) является мощным фактором выживания двигательных нейронов [128]. Изменения высвобождения GDNF влияли на скорость функционального восстановления двигательного нерва при первичной репарации периферических нервов у крыс [129]. VEGF, мощный ангиогенетический фактор, также служит нейротрофическим фактором для регенерации нервов [122].
Более того, высокие дозы NGF задерживают регенерацию нервов, замедляя GAP 43 [127]. Следовательно, не менее важно учитывать оптимальную дозу и кинетику высвобождения для применения таких терапевтических факторов роста. Нейротрофический фактор глиальной клеточной линии (GDNF) является мощным фактором выживания двигательных нейронов [128]. Изменения высвобождения GDNF влияли на скорость функционального восстановления двигательного нерва при первичной репарации периферических нервов у крыс [129]. VEGF, мощный ангиогенетический фактор, также служит нейротрофическим фактором для регенерации нервов [122].
Применение нескольких факторов роста, а не одного, может иметь большие перспективы для поддержки иннервации органов-мишеней. Сложный нервный механизм, регулирующий функцию мочевого пузыря, включает различные нейронные субпопуляции, которые реагируют на различные нейротрофические факторы. Например, было обнаружено, что нейроны поясничного ганглия задних корешков (DRG) экспрессируют 65% рецепторов Ret и 35% TrkA для GDNF и NGF соответственно и 9% рецепторов, положительных как для GDNF, так и для NGF [130]. Маддури и др. .продемонстрировали синергетический эффект GNDF и NGF на удлинение аксонов и ветвление форм нейронов DRG [131].
Маддури и др. .продемонстрировали синергетический эффект GNDF и NGF на удлинение аксонов и ветвление форм нейронов DRG [131].
NGF в сочетании с VEGF усиливал регенерацию трансплантатов ацеллюлярного матрикса мочевого пузыря в нейрогенных мочевых пузырях крыс, индуцированных повреждением спинного мозга, и положительных по продукту гена белка 9,5 (PGP) нервных волокнах наблюдалось наиболее часто в группах, получавших комбинированные факторы, а не в группах, получавших один фактор 132]. Однако оптимальное сочетание нейротрофических факторов, поддерживающих регенерацию мочевого пузыря, остается неясным.
Направление роста аксонов хорошо регулируется топографическими особенностями. Продольно выровненные нановолокна направляли аксоны в одном направлении по сравнению со случайными волокнами, которые демонстрировали рост аксонов во всех направлениях [133].
6. Выводы
Идеальный биоматериал для инженерии функциональной ткани для реконструкции полых органов должен быть биосовместимым и поддерживать формирование ткани, а также обеспечивать адекватную структурную поддержку неооргана во время развития ткани.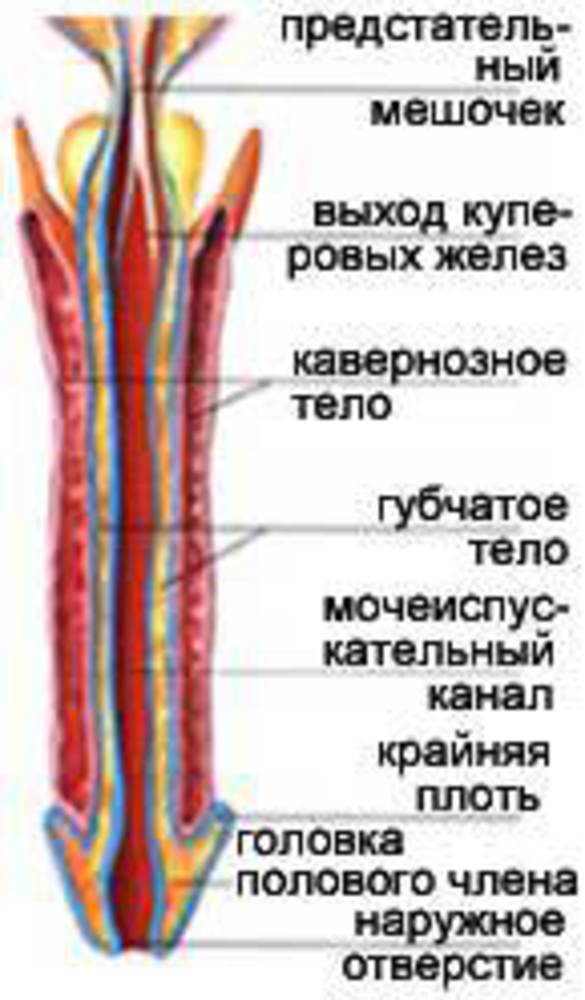 Многие исследовательские группы смогли показать инженерные конструкции, структурно похожие на нативную ткань. Однако функциональность этих конструкций никогда не демонстрировалась. Двумя основными проблемами, препятствующими сократимости тканевых инженерных конструкций и обеспечению нормальной функции органов, являются правильная иннервация и васкуляризация.
Многие исследовательские группы смогли показать инженерные конструкции, структурно похожие на нативную ткань. Однако функциональность этих конструкций никогда не демонстрировалась. Двумя основными проблемами, препятствующими сократимости тканевых инженерных конструкций и обеспечению нормальной функции органов, являются правильная иннервация и васкуляризация.
В ближайшем будущем каркасы тканевой инженерии с контролируемой топографией и множественными нервными и ангиогенетическими факторами обеспечат потенциальную возможность придания надлежащей биологической функции искусственной ткани.
Благодарности
Авторы хотели бы поблагодарить Damina Balmer Dipl.rer.nat за ее поддержку и помощь в подготовке рукописи.
Ссылки
1. Меткалф А.Д., Фергюсон М.В. Биоинженерия кожи с использованием механизмов регенерации и восстановления. Биоматериалы. 2007; 28:5100–5113. doi: 10.1016/j.biomaterials.2007.07.031. [PubMed] [CrossRef] [Google Scholar]2. Маккиарини П., Юнгеблут П. , Го Т., Аснаги М.А., Рис Л.Е., Коган Т.А., Додсон А., Марторелл Дж., Беллини С., Парниготто П.П., Дикинсон С.К., Холландер А.П., Мантеро С., Конкони М.Т., Бирчалл М.А. Клиническая трансплантация тканеинженерных дыхательных путей. Ланцет. 2008;372:2023–2030. doi: 10.1016/S0140-6736(08)61598-6. [PubMed] [CrossRef] [Google Scholar]3. Бриттберг М., Линдал А., Нильссон А., Олссон С., Исакссон О., Петерсон Л. Лечение глубоких дефектов хряща в коленном суставе с трансплантацией аутологичных хондроцитов. Н. англ. Дж. Мед. 1994; 331: 889–895. doi: 10.1056/NEJM199410063311401. [PubMed] [CrossRef] [Google Scholar]4.Калдамоне А.А., Даймонд Д.А. Отдаленные результаты эндоскопической коррекции пузырно-мочеточникового рефлюкса у детей с использованием аутологичных хондроцитов. Дж. Урол. 2001; 165: 2224–2227. doi: 10.1016/S0022-5347(05)66170-8. [PubMed] [CrossRef] [Google Scholar]5. Бент А.Э., Тутрон Р.Т., МакЛеннан М.Т., Ллойд Л.К., Кеннелли М.Дж., Бадлани Г. Лечение дефицита внутреннего сфинктера с использованием аутологичных ушных хондроцитов в качестве наполнителя.
, Го Т., Аснаги М.А., Рис Л.Е., Коган Т.А., Додсон А., Марторелл Дж., Беллини С., Парниготто П.П., Дикинсон С.К., Холландер А.П., Мантеро С., Конкони М.Т., Бирчалл М.А. Клиническая трансплантация тканеинженерных дыхательных путей. Ланцет. 2008;372:2023–2030. doi: 10.1016/S0140-6736(08)61598-6. [PubMed] [CrossRef] [Google Scholar]3. Бриттберг М., Линдал А., Нильссон А., Олссон С., Исакссон О., Петерсон Л. Лечение глубоких дефектов хряща в коленном суставе с трансплантацией аутологичных хондроцитов. Н. англ. Дж. Мед. 1994; 331: 889–895. doi: 10.1056/NEJM199410063311401. [PubMed] [CrossRef] [Google Scholar]4.Калдамоне А.А., Даймонд Д.А. Отдаленные результаты эндоскопической коррекции пузырно-мочеточникового рефлюкса у детей с использованием аутологичных хондроцитов. Дж. Урол. 2001; 165: 2224–2227. doi: 10.1016/S0022-5347(05)66170-8. [PubMed] [CrossRef] [Google Scholar]5. Бент А.Э., Тутрон Р.Т., МакЛеннан М.Т., Ллойд Л.К., Кеннелли М.Дж., Бадлани Г. Лечение дефицита внутреннего сфинктера с использованием аутологичных ушных хондроцитов в качестве наполнителя. Нейророл. Уродын. 2001; 20: 157–165. doi: 10.1002/1520-6777(2001)20:2<157::AID-NAU18>3.0.СО;2-А. [PubMed] [CrossRef] [Google Scholar]6. Канцлер М.Б., Йокояма Т., Тирни С., Маттес К.Е., Озава Х., Йошимура Н., де Гроат В.К., Хуард Дж. Предварительные результаты инъекции миобластов в уретру и стенку мочевого пузыря: возможный метод лечения стрессового мочеиспускания недержание мочи и нарушение сократительной способности детрузора. Нейророл. Уродын. 2000; 19: 279–287. doi: 10.1002/(SICI)1520-6777(2000)19:3<279::AID-NAU9>3.0.CO;2-M. [PubMed] [CrossRef] [Google Scholar]7. Чой Р.С., Ваканти Дж.П.Предварительные исследования тканеинженерного кишечника с использованием изолированных эпителиальных органоидных единиц на трубчатых синтетических биоразлагаемых каркасах. Пересадка. проц. 1997; 29: 848–851. doi: 10.1016/S0041-1345(96)00164-9. [PubMed] [CrossRef] [Google Scholar]8. Ансалони Л., Бонасони П., Камбрини П., Катена Ф., Де Каталдис А., Гальярди С., Газзотти Ф., Перуцци С., Сантини Д., Таффурелли М.
Нейророл. Уродын. 2001; 20: 157–165. doi: 10.1002/1520-6777(2001)20:2<157::AID-NAU18>3.0.СО;2-А. [PubMed] [CrossRef] [Google Scholar]6. Канцлер М.Б., Йокояма Т., Тирни С., Маттес К.Е., Озава Х., Йошимура Н., де Гроат В.К., Хуард Дж. Предварительные результаты инъекции миобластов в уретру и стенку мочевого пузыря: возможный метод лечения стрессового мочеиспускания недержание мочи и нарушение сократительной способности детрузора. Нейророл. Уродын. 2000; 19: 279–287. doi: 10.1002/(SICI)1520-6777(2000)19:3<279::AID-NAU9>3.0.CO;2-M. [PubMed] [CrossRef] [Google Scholar]7. Чой Р.С., Ваканти Дж.П.Предварительные исследования тканеинженерного кишечника с использованием изолированных эпителиальных органоидных единиц на трубчатых синтетических биоразлагаемых каркасах. Пересадка. проц. 1997; 29: 848–851. doi: 10.1016/S0041-1345(96)00164-9. [PubMed] [CrossRef] [Google Scholar]8. Ансалони Л., Бонасони П., Камбрини П., Катена Ф., Де Каталдис А., Гальярди С., Газзотти Ф., Перуцци С., Сантини Д., Таффурелли М. Экспериментальная оценка Surgisis как каркаса для регенерации неоинтестина в модель крысы. Пересадка. проц. 2006; 38: 1844–1848.doi: 10.1016/j.transproceed.2006.05.004. [PubMed] [CrossRef] [Google Scholar]9. Накасе Ю., Накамура Т., Кин С., Накашима С., Йошикава Т., Куриу Ю., Миягава К., Сакакура С., Оцудзи Э., Икада Ю., Ямагиши Х., Хагивара А. Эндокринные клетки и регенерация нервов в аутологичной тонкой кишке, сконструированной in situ. Дж. Сур. Рез. 2007; 137:61–68. doi: 10.1016/j.jss.2006.06.019. [PubMed] [CrossRef] [Google Scholar] 10. Судан Д. Достижения в нетрансплантационном медицинском и хирургическом лечении кишечной недостаточности.Курс. мнение Трансплантация органа. 2009; 14: 274–279. doi: 10.1097/MOT.0b013e32832b1033. [PubMed] [CrossRef] [Google Scholar] 11. Yoo JJ, Meng J., Oberpenning F., Atala A. Увеличение мочевого пузыря с использованием аллогенной подслизистой оболочки мочевого пузыря, засеянной клетками. Урология. 1998; 51: 221–225. doi: 10.1016/S0090-4295(97)00644-4.
Экспериментальная оценка Surgisis как каркаса для регенерации неоинтестина в модель крысы. Пересадка. проц. 2006; 38: 1844–1848.doi: 10.1016/j.transproceed.2006.05.004. [PubMed] [CrossRef] [Google Scholar]9. Накасе Ю., Накамура Т., Кин С., Накашима С., Йошикава Т., Куриу Ю., Миягава К., Сакакура С., Оцудзи Э., Икада Ю., Ямагиши Х., Хагивара А. Эндокринные клетки и регенерация нервов в аутологичной тонкой кишке, сконструированной in situ. Дж. Сур. Рез. 2007; 137:61–68. doi: 10.1016/j.jss.2006.06.019. [PubMed] [CrossRef] [Google Scholar] 10. Судан Д. Достижения в нетрансплантационном медицинском и хирургическом лечении кишечной недостаточности.Курс. мнение Трансплантация органа. 2009; 14: 274–279. doi: 10.1097/MOT.0b013e32832b1033. [PubMed] [CrossRef] [Google Scholar] 11. Yoo JJ, Meng J., Oberpenning F., Atala A. Увеличение мочевого пузыря с использованием аллогенной подслизистой оболочки мочевого пузыря, засеянной клетками. Урология. 1998; 51: 221–225. doi: 10.1016/S0090-4295(97)00644-4. [PubMed] [CrossRef] [Google Scholar] 12. Оберпеннинг Ф., Мэн Дж., Ю Дж.Дж., Атала А. Реконструкция de novo функционального мочевого пузыря млекопитающих с помощью тканевой инженерии. Нац. Биотехнолог. 1999; 17: 149–155.дои: 10.1038/6146. [PubMed] [CrossRef] [Google Scholar] 13. Атала А., Бауэр С.Б., Сокер С., Ю Дж.Дж., Ретик А.Б. Тканеинженерные аутологичные мочевые пузыри для пациентов, нуждающихся в цистопластике. Ланцет. 2006; 367:1241–1246. doi: 10.1016/S0140-6736(06)68438-9. [PubMed] [CrossRef] [Google Scholar] 14. Ко Х.К., Милторп Б.К., МакФарланд К.Д. Инженерия толстых тканей — проблема васкуляризации. Евро. Сотовый Матер. 2007; 14:1–18, обсуждение 18–19. [PubMed] [Google Scholar] 15. Кудиш Х. Г. Применение поливиниловой губки для экспериментальной цистопластики.Дж. Урол. 1957; 78: 232–235. [PubMed] [Google Scholar] 16. Боно А.В., Де Грести А. Частичное замещение стенки мочевого пузыря тефлоновой тканью. (Предварительное и экспериментальное замечание о непроницаемости и переносимости протеза) Minerva Urol.
[PubMed] [CrossRef] [Google Scholar] 12. Оберпеннинг Ф., Мэн Дж., Ю Дж.Дж., Атала А. Реконструкция de novo функционального мочевого пузыря млекопитающих с помощью тканевой инженерии. Нац. Биотехнолог. 1999; 17: 149–155.дои: 10.1038/6146. [PubMed] [CrossRef] [Google Scholar] 13. Атала А., Бауэр С.Б., Сокер С., Ю Дж.Дж., Ретик А.Б. Тканеинженерные аутологичные мочевые пузыри для пациентов, нуждающихся в цистопластике. Ланцет. 2006; 367:1241–1246. doi: 10.1016/S0140-6736(06)68438-9. [PubMed] [CrossRef] [Google Scholar] 14. Ко Х.К., Милторп Б.К., МакФарланд К.Д. Инженерия толстых тканей — проблема васкуляризации. Евро. Сотовый Матер. 2007; 14:1–18, обсуждение 18–19. [PubMed] [Google Scholar] 15. Кудиш Х. Г. Применение поливиниловой губки для экспериментальной цистопластики.Дж. Урол. 1957; 78: 232–235. [PubMed] [Google Scholar] 16. Боно А.В., Де Грести А. Частичное замещение стенки мочевого пузыря тефлоновой тканью. (Предварительное и экспериментальное замечание о непроницаемости и переносимости протеза) Minerva Urol. 1966; 18: 43–47. [PubMed] [Google Scholar] 17. Fujita K. Использование тонкой бумаги с напылением смолы для регенерации мочевого пузыря. Вкладывать деньги. Урол. 1978; 15: 355–357. [PubMed] [Google Scholar] 18. Череш Д.А., Ступак Д.Г. Регуляция ангиогенеза: сигналы апоптоза от ECM.Онкоген. 2008; 27: 6285–6298. doi: 10.1038/onc.2008.304. [PubMed] [CrossRef] [Google Scholar] 20. Уберсакс Л., Меркл Х.П., Мейнел Л. Доставка фактора роста на основе биополимеров для восстановления тканей: от естественных концепций до инженерных систем. Тисс. англ. Часть B Ред. 2009; 15: 263–289. doi: 10.1089/ten.teb.2008.0668. [PubMed] [CrossRef] [Google Scholar] 21. Гош К., Ингбер Д.Э. Микромеханический контроль развития клеток и тканей: значение для тканевой инженерии. Доп. Наркотик Делив. 2007; 59: 1306–1318.doi: 10.1016/j.addr.2007.08.014. [PubMed] [CrossRef] [Google Scholar] 22. Furth M.E., Atala A., Van Dyke M.E. Умный дизайн биоматериалов для тканевой инженерии и регенеративной медицины. Биоматериалы.
1966; 18: 43–47. [PubMed] [Google Scholar] 17. Fujita K. Использование тонкой бумаги с напылением смолы для регенерации мочевого пузыря. Вкладывать деньги. Урол. 1978; 15: 355–357. [PubMed] [Google Scholar] 18. Череш Д.А., Ступак Д.Г. Регуляция ангиогенеза: сигналы апоптоза от ECM.Онкоген. 2008; 27: 6285–6298. doi: 10.1038/onc.2008.304. [PubMed] [CrossRef] [Google Scholar] 20. Уберсакс Л., Меркл Х.П., Мейнел Л. Доставка фактора роста на основе биополимеров для восстановления тканей: от естественных концепций до инженерных систем. Тисс. англ. Часть B Ред. 2009; 15: 263–289. doi: 10.1089/ten.teb.2008.0668. [PubMed] [CrossRef] [Google Scholar] 21. Гош К., Ингбер Д.Э. Микромеханический контроль развития клеток и тканей: значение для тканевой инженерии. Доп. Наркотик Делив. 2007; 59: 1306–1318.doi: 10.1016/j.addr.2007.08.014. [PubMed] [CrossRef] [Google Scholar] 22. Furth M.E., Atala A., Van Dyke M.E. Умный дизайн биоматериалов для тканевой инженерии и регенеративной медицины. Биоматериалы. 2007; 28: 5068–5073. doi: 10.1016/j.biomaterials.2007.07.042. [PubMed] [CrossRef] [Google Scholar] 26. Мозер М., Легат К.Р., Зент Р., Фасслер Р. Хвост интегринов, талинов и киндлинов. Наука. 2009; 324: 895–899. doi: 10.1126/science.1163865. [PubMed] [CrossRef] [Google Scholar] 27. Муруган Р., Рамакришна С.Стратегии проектирования каркасов тканевой инженерии с контролируемой ориентацией волокон. Тисс. англ. 2007; 13: 1845–1866. doi: 10.1089/10.2006.0078. [PubMed] [CrossRef] [Google Scholar] 28. Атала А. Биоинженерные ткани для восстановления мочеполовой системы у детей. Педиатр Рез. 2008; 63: 569–575. doi: 10.1203/PDR.0b013e3181660639. [PubMed] [CrossRef] [Google Scholar] 29. Чен М.К., Бейерле Э.А. Животные модели для инженерии тканей кишечника. Биоматериалы. 2004; 25:1675–1681. doi: 10.1016/S0142-9612(03)00517-9. [PubMed] [CrossRef] [Google Scholar] 30.Эванс Г.С., Флинт Н., Сомерс А.С., Эйден Б., Поттен К.С. Разработка метода приготовления первичных культур эпителиальных клеток кишечника крыс.
2007; 28: 5068–5073. doi: 10.1016/j.biomaterials.2007.07.042. [PubMed] [CrossRef] [Google Scholar] 26. Мозер М., Легат К.Р., Зент Р., Фасслер Р. Хвост интегринов, талинов и киндлинов. Наука. 2009; 324: 895–899. doi: 10.1126/science.1163865. [PubMed] [CrossRef] [Google Scholar] 27. Муруган Р., Рамакришна С.Стратегии проектирования каркасов тканевой инженерии с контролируемой ориентацией волокон. Тисс. англ. 2007; 13: 1845–1866. doi: 10.1089/10.2006.0078. [PubMed] [CrossRef] [Google Scholar] 28. Атала А. Биоинженерные ткани для восстановления мочеполовой системы у детей. Педиатр Рез. 2008; 63: 569–575. doi: 10.1203/PDR.0b013e3181660639. [PubMed] [CrossRef] [Google Scholar] 29. Чен М.К., Бейерле Э.А. Животные модели для инженерии тканей кишечника. Биоматериалы. 2004; 25:1675–1681. doi: 10.1016/S0142-9612(03)00517-9. [PubMed] [CrossRef] [Google Scholar] 30.Эванс Г.С., Флинт Н., Сомерс А.С., Эйден Б., Поттен К.С. Разработка метода приготовления первичных культур эпителиальных клеток кишечника крыс. Дж. Клеточные науки. 1992; 101 (часть 1): 219–231. [PubMed] [Google Scholar] 31. Чой Р.С., Риглер М., Потулакис С., Ким Б.С., Муни Д., Ваканти М., Ваканти Дж.П. Исследования ферментов щеточной каемки, компонентов базальной мембраны и электрофизиологии тканеинженерного неокишечника. Дж. Педиатр. Surg. 1998; 33: 991–996, обсуждение 996–997. doi: 10.1016/S0022-3468(98)
Дж. Клеточные науки. 1992; 101 (часть 1): 219–231. [PubMed] [Google Scholar] 31. Чой Р.С., Риглер М., Потулакис С., Ким Б.С., Муни Д., Ваканти М., Ваканти Дж.П. Исследования ферментов щеточной каемки, компонентов базальной мембраны и электрофизиологии тканеинженерного неокишечника. Дж. Педиатр. Surg. 1998; 33: 991–996, обсуждение 996–997. doi: 10.1016/S0022-3468(98)-6.обсуждение 996–997. [PubMed] [CrossRef] [Google Scholar] 32. Чжан Ю.Ю., Людвиковски Б., Херст Р., Фрей П. Экспансия и долгосрочное культивирование дифференцированных нормальных уротелиальных клеток крысы in vitro . In Vitro Cell Dev. биол. Аним. 2001; 37: 419–429. doi: 10.1290/1071-2690(2001)037<0419:EALTCO>2.0.CO;2. [PubMed] [CrossRef] [Google Scholar] 33. Атала А. Регенерация мочевого пузыря с помощью тканевой инженерии. БЖУ Интерн. 2001; 88: 765–770. doi: 10.1046/j.1464-4096.2001.atala.2467.x. [PubMed] [CrossRef] [Google Scholar] 34.Ludwikowski B., Zhang Y.Y., Frey P. Длительное культивирование свиных уротелиальных клеток и индукция уротелиальной стратификации.
 БЖУ Интерн. 1999; 84: 507–514. doi: 10.1046/j.1464-410x.1999.00221.x. [PubMed] [CrossRef] [Google Scholar] 35. Саутгейт Дж., Хаттон К.А., Томас Д.Ф., Трейдосевич Л.К. Нормальные уротелиальные клетки человека in vitro : пролиферация и индукция стратификации. лаборатория Вкладывать деньги. 1994; 71: 583–594. [PubMed] [Google Scholar] 36. Тернер А.М., Субраманиам Р., Томас Д.Ф., Саутгейт Дж.Создание функциональной дифференцированной свиной уротелиальной ткани in vitro . Евро. Урол. 2008;54:1423–1432. doi: 10.1016/j.eururo.2008.03.068. [PubMed] [CrossRef] [Google Scholar] 37. Хит К.А. Клетки для тканевой инженерии. Тенденции биотехнологии. 2000; 18:17–19. doi: 10.1016/S0167-7799(99)01396-7. [PubMed] [CrossRef] [Google Scholar] 38. Бриванлоу А.Х., Гейдж Ф.Х., Йениш Р., Джесселл Т., Мелтон Д., Россант Дж. Стволовые клетки. Установление стандартов для эмбриональных стволовых клеток человека. Наука. 2003; 300:913–916.doi: 10.1126/science.1082940. [PubMed] [CrossRef] [Google Scholar] 39.
БЖУ Интерн. 1999; 84: 507–514. doi: 10.1046/j.1464-410x.1999.00221.x. [PubMed] [CrossRef] [Google Scholar] 35. Саутгейт Дж., Хаттон К.А., Томас Д.Ф., Трейдосевич Л.К. Нормальные уротелиальные клетки человека in vitro : пролиферация и индукция стратификации. лаборатория Вкладывать деньги. 1994; 71: 583–594. [PubMed] [Google Scholar] 36. Тернер А.М., Субраманиам Р., Томас Д.Ф., Саутгейт Дж.Создание функциональной дифференцированной свиной уротелиальной ткани in vitro . Евро. Урол. 2008;54:1423–1432. doi: 10.1016/j.eururo.2008.03.068. [PubMed] [CrossRef] [Google Scholar] 37. Хит К.А. Клетки для тканевой инженерии. Тенденции биотехнологии. 2000; 18:17–19. doi: 10.1016/S0167-7799(99)01396-7. [PubMed] [CrossRef] [Google Scholar] 38. Бриванлоу А.Х., Гейдж Ф.Х., Йениш Р., Джесселл Т., Мелтон Д., Россант Дж. Стволовые клетки. Установление стандартов для эмбриональных стволовых клеток человека. Наука. 2003; 300:913–916.doi: 10.1126/science.1082940. [PubMed] [CrossRef] [Google Scholar] 39. Пшиборски С.А. Дифференцировка эмбриональных стволовых клеток человека после трансплантации иммунодефицитным мышам. Стволовые клетки. 2005; 23:1242–1250. doi: 10.1634/стволовые клетки.2005-0014. [PubMed] [CrossRef] [Google Scholar]40. Ян С., Линь Г., Тан Ю.К., Чжоу Д., Дэн Л.Ю., Ченг Д.Х., Луо С.В., Лю Т.С., Чжоу С.Ю., Сунь З., Сян Ю., Чен Т.Дж., Вен Дж.Ф., Лу Г.Х. Опухолевая прогрессия адаптированных к культуре эмбриональных стволовых клеток человека при длительном культивировании.Ген. Хромосомный рак. 2008; 47: 665–679. doi: 10.1002/gcc.20574. [PubMed] [CrossRef] [Google Scholar]41. Де Коппи П., Каллегари А., Кьявегато А., Гаспаротто Л., Пикколи М., Тайани Дж., Поццобон М., Болдрин Л., Окабе М., Коцци Э., Атала А., Гамба П., Сарторе S. Мезенхимальные стволовые клетки, полученные из амниотической жидкости и костного мозга, могут быть преобразованы в гладкомышечные клетки в криоповрежденном мочевом пузыре крысы и предотвращают компенсаторную гипертрофию выживших гладкомышечных клеток. Дж.
Пшиборски С.А. Дифференцировка эмбриональных стволовых клеток человека после трансплантации иммунодефицитным мышам. Стволовые клетки. 2005; 23:1242–1250. doi: 10.1634/стволовые клетки.2005-0014. [PubMed] [CrossRef] [Google Scholar]40. Ян С., Линь Г., Тан Ю.К., Чжоу Д., Дэн Л.Ю., Ченг Д.Х., Луо С.В., Лю Т.С., Чжоу С.Ю., Сунь З., Сян Ю., Чен Т.Дж., Вен Дж.Ф., Лу Г.Х. Опухолевая прогрессия адаптированных к культуре эмбриональных стволовых клеток человека при длительном культивировании.Ген. Хромосомный рак. 2008; 47: 665–679. doi: 10.1002/gcc.20574. [PubMed] [CrossRef] [Google Scholar]41. Де Коппи П., Каллегари А., Кьявегато А., Гаспаротто Л., Пикколи М., Тайани Дж., Поццобон М., Болдрин Л., Окабе М., Коцци Э., Атала А., Гамба П., Сарторе S. Мезенхимальные стволовые клетки, полученные из амниотической жидкости и костного мозга, могут быть преобразованы в гладкомышечные клетки в криоповрежденном мочевом пузыре крысы и предотвращают компенсаторную гипертрофию выживших гладкомышечных клеток. Дж. Урол. 2007; 177: 369–376. дои: 10.1016/j.juro.2006.09.103. [PubMed] [CrossRef] [Google Scholar]42. Фауза Д. Амниотическая жидкость и плацентарные стволовые клетки. Лучшая практика. Рез. клин. Обст. Гы. 2004; 18: 877–891. doi: 10.1016/j.bpobgyn.2004.07.001. [PubMed] [CrossRef] [Google Scholar]43. Эберли Д., Атала А. Тканевая инженерия с использованием взрослых стволовых клеток. Мет. Энзимология. 2006; 420: 287–302. [PubMed] [Google Scholar]44. Ангеле П., Куят Р., Нерлих М., Ю Дж., Голдберг В., Джонстон Б. Инженерия костно-хрящевой ткани с мезенхимальными клетками-предшественниками костного мозга в дериватизированной гиалуронан-желатиновой композитной губке.Тисс. англ. 1999; 5: 545–554. doi: 10.1089/ten.1999.5.545. [PubMed] [CrossRef] [Google Scholar]45. Питтенгер М.Ф., Маккей А.М., Бек С.К., Джайсвал Р.К., Дуглас Р., Моска Дж.Д., Мурман М.А., Симонетти Д.В., Крейг С., Маршак Д.Р. Многолинейный потенциал мезенхимальных стволовых клеток взрослого человека. Наука. 1999; 284:143–147. doi: 10.
Урол. 2007; 177: 369–376. дои: 10.1016/j.juro.2006.09.103. [PubMed] [CrossRef] [Google Scholar]42. Фауза Д. Амниотическая жидкость и плацентарные стволовые клетки. Лучшая практика. Рез. клин. Обст. Гы. 2004; 18: 877–891. doi: 10.1016/j.bpobgyn.2004.07.001. [PubMed] [CrossRef] [Google Scholar]43. Эберли Д., Атала А. Тканевая инженерия с использованием взрослых стволовых клеток. Мет. Энзимология. 2006; 420: 287–302. [PubMed] [Google Scholar]44. Ангеле П., Куят Р., Нерлих М., Ю Дж., Голдберг В., Джонстон Б. Инженерия костно-хрящевой ткани с мезенхимальными клетками-предшественниками костного мозга в дериватизированной гиалуронан-желатиновой композитной губке.Тисс. англ. 1999; 5: 545–554. doi: 10.1089/ten.1999.5.545. [PubMed] [CrossRef] [Google Scholar]45. Питтенгер М.Ф., Маккей А.М., Бек С.К., Джайсвал Р.К., Дуглас Р., Моска Дж.Д., Мурман М.А., Симонетти Д.В., Крейг С., Маршак Д.Р. Многолинейный потенциал мезенхимальных стволовых клеток взрослого человека. Наука. 1999; 284:143–147. doi: 10. 1126/science.284.5411.143. [PubMed] [CrossRef] [Google Scholar]46. Ли Дж.Ю., Ку-Петерсен З., Цао Б., Кимура С., Янковски Р., Камминс Дж., Усас А., Гейтс С., Роббинс П., Верниг А., Huard J. Клональное выделение клеток мышечного происхождения, способных усиливать регенерацию мышц и заживление костей. Дж. Клеточная биология. 2000;150:1085–1100. doi: 10.1083/jcb.150.5.1085. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]47. Зук П.А., Чжу М., Мизуно Х., Хуанг Дж., Футрелл Дж.В., Кац А.Дж., Бенхайм П., Лоренц Х.П., Хедрик М.Х. Многолинейные клетки из жировой ткани человека: значение для клеточной терапии. Тисс. англ. 2001; 7: 211–228. doi: 10.1089/107632701300062859. [PubMed] [CrossRef] [Google Scholar]48.Тома Дж.Г., Ахаван М., Фернандес К.Дж., Барнабе-Хейдер Ф., Садикот А., Каплан Д.Р., Миллер Ф.Д. Выделение мультипотентных взрослых стволовых клеток из дермы кожи млекопитающих. Нац. Клеточная биол. 2001; 3: 778–784. doi: 10.1038/ncb0901-778. [PubMed] [CrossRef] [Google Scholar]49.
1126/science.284.5411.143. [PubMed] [CrossRef] [Google Scholar]46. Ли Дж.Ю., Ку-Петерсен З., Цао Б., Кимура С., Янковски Р., Камминс Дж., Усас А., Гейтс С., Роббинс П., Верниг А., Huard J. Клональное выделение клеток мышечного происхождения, способных усиливать регенерацию мышц и заживление костей. Дж. Клеточная биология. 2000;150:1085–1100. doi: 10.1083/jcb.150.5.1085. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]47. Зук П.А., Чжу М., Мизуно Х., Хуанг Дж., Футрелл Дж.В., Кац А.Дж., Бенхайм П., Лоренц Х.П., Хедрик М.Х. Многолинейные клетки из жировой ткани человека: значение для клеточной терапии. Тисс. англ. 2001; 7: 211–228. doi: 10.1089/107632701300062859. [PubMed] [CrossRef] [Google Scholar]48.Тома Дж.Г., Ахаван М., Фернандес К.Дж., Барнабе-Хейдер Ф., Садикот А., Каплан Д.Р., Миллер Ф.Д. Выделение мультипотентных взрослых стволовых клеток из дермы кожи млекопитающих. Нац. Клеточная биол. 2001; 3: 778–784. doi: 10.1038/ncb0901-778. [PubMed] [CrossRef] [Google Scholar]49. Де Бари К., Делл’Аччио Ф., Тылзановски П., Луйтен Ф.П. Мультипотентные мезенхимальные стволовые клетки из синовиальной оболочки взрослого человека. Ревмирующий артрит. 2001; 44:1928–1942. doi: 10.1002/1529-0131(200108)44:8<1928::AID-ART331>3.0.CO;2-P.[PubMed] [CrossRef] [Google Scholar]50. Гуан К., Наерниа К., Майер Л.С., Вагнер С., Дрессель Р., Ли Дж. Х., Нолте Дж., Вольф Ф., Ли М., Энгель В., Хазенфусс Г. Плюрипотентность сперматогониальных стволовых клеток семенников взрослых мышей . Природа. 2006; 440:1199–1203. doi: 10.1038/nature04697. [PubMed] [CrossRef] [Google Scholar]51. Коссак Н., Менесес Дж., Шефи С., Нгуен Х.Н., Чавес С., Николас С., Громолл Дж., Турек П.Дж., Рейхо-Пера Р.А. Выделение и характеристика плюрипотентных клеток, полученных из сперматогониальных стволовых клеток человека.Стволовые клетки. 2009; 27: 138–149. doi: 10.1634/стволовые клетки.2008-0439. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]52. Чанг С.Ю., Криворов Н.П., Раусей В., Томас Л., Францен М.
Де Бари К., Делл’Аччио Ф., Тылзановски П., Луйтен Ф.П. Мультипотентные мезенхимальные стволовые клетки из синовиальной оболочки взрослого человека. Ревмирующий артрит. 2001; 44:1928–1942. doi: 10.1002/1529-0131(200108)44:8<1928::AID-ART331>3.0.CO;2-P.[PubMed] [CrossRef] [Google Scholar]50. Гуан К., Наерниа К., Майер Л.С., Вагнер С., Дрессель Р., Ли Дж. Х., Нолте Дж., Вольф Ф., Ли М., Энгель В., Хазенфусс Г. Плюрипотентность сперматогониальных стволовых клеток семенников взрослых мышей . Природа. 2006; 440:1199–1203. doi: 10.1038/nature04697. [PubMed] [CrossRef] [Google Scholar]51. Коссак Н., Менесес Дж., Шефи С., Нгуен Х.Н., Чавес С., Николас С., Громолл Дж., Турек П.Дж., Рейхо-Пера Р.А. Выделение и характеристика плюрипотентных клеток, полученных из сперматогониальных стволовых клеток человека.Стволовые клетки. 2009; 27: 138–149. doi: 10.1634/стволовые клетки.2008-0439. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]52. Чанг С.Ю., Криворов Н.П., Раусей В., Томас Л., Францен М. , Ландситтель Д., Канг Ю.М., Чон Ч.Х., Нг К.С., Фукс Г.Дж. Реконструкция мочевого пузыря стволовыми клетками, полученными из костного мозга, высеянными на подслизистую оболочку тонкой кишки, улучшает морфологический и молекулярный состав. Дж. Урол. 2005; 174: 353–359. doi: 10.1097/01.ju.0000161592.00434.c1. [PubMed] [CrossRef] [Google Scholar]53. Чжан Ю., Лин Х.К., Фримбергер Д., Эпштейн Р.Б., Кропп Б.П. Рост стромальных клеток костного мозга на подслизистой оболочке тонкой кишки: альтернативный источник клеток для тканевой инженерии мочевого пузыря. БЖУ Интерн. 2005;96:1120–1125. doi: 10.1111/j.1464-410X.2005.05741.x. [PubMed] [CrossRef] [Google Scholar]54. Фримбергер Д., Моралес Н., Гирхарт Дж. Д., Гирхарт Дж. П., Лакшманан Ю. Эмбриональные стволовые клетки человека в улучшенной тканевой инженерией миграции в совместной культуре с гладкими мышцами мочевого пузыря и уротелием. Урология. 2006; 67: 1298–1303.doi: 10.1016/юрология.2005.12.005. [PubMed] [CrossRef] [Google Scholar]55. Оттамасатиен С.
, Ландситтель Д., Канг Ю.М., Чон Ч.Х., Нг К.С., Фукс Г.Дж. Реконструкция мочевого пузыря стволовыми клетками, полученными из костного мозга, высеянными на подслизистую оболочку тонкой кишки, улучшает морфологический и молекулярный состав. Дж. Урол. 2005; 174: 353–359. doi: 10.1097/01.ju.0000161592.00434.c1. [PubMed] [CrossRef] [Google Scholar]53. Чжан Ю., Лин Х.К., Фримбергер Д., Эпштейн Р.Б., Кропп Б.П. Рост стромальных клеток костного мозга на подслизистой оболочке тонкой кишки: альтернативный источник клеток для тканевой инженерии мочевого пузыря. БЖУ Интерн. 2005;96:1120–1125. doi: 10.1111/j.1464-410X.2005.05741.x. [PubMed] [CrossRef] [Google Scholar]54. Фримбергер Д., Моралес Н., Гирхарт Дж. Д., Гирхарт Дж. П., Лакшманан Ю. Эмбриональные стволовые клетки человека в улучшенной тканевой инженерией миграции в совместной культуре с гладкими мышцами мочевого пузыря и уротелием. Урология. 2006; 67: 1298–1303.doi: 10.1016/юрология.2005.12.005. [PubMed] [CrossRef] [Google Scholar]55. Оттамасатиен С. , Ван Ю., Уильямс К., Франко О.Э., Уиллс М.Л., Томас Дж.С., Саба К., Шариф-Афшар А.Р., Макари Дж.Х., Бхоумик Н.А., ДеМарко Р.Т., Хипкенс С., Магнусон М., Брок Дж.В., 3-й, Хейворд С.В., Папа JCT, Матусик Р.Дж. Направленная дифференцировка эмбриональных стволовых клеток в ткань мочевого пузыря. Дев. биол. 2007; 304: 556–566. doi: 10.1016/j.ydbio.2007.01.010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]56. Джек Г.С., Чжан Р., Ли М., Сюй Ю., Ву Б.М., Родригес Л.В. Гладкая мускулатура мочевого пузыря, созданная из жировых стволовых клеток и трехмерного синтетического композита. Биоматериалы. 2009;30:3259–3270. doi: 10.1016/j.biomaterials.2009.02.035. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]57. Роча Ф.Г., Сандбак К.А., Кребс Н.Дж., Лич Дж.К., Муни Д.Дж., Эшли С.В., Ваканти Дж.П., Ванг Э.Э. Влияние устойчивой доставки фактора роста эндотелия сосудов на ангиогенез в тканевой инженерии кишечника.Биоматериалы. 2008; 29: 2884–2890. doi: 10.1016/j.biomaterials.2008.
, Ван Ю., Уильямс К., Франко О.Э., Уиллс М.Л., Томас Дж.С., Саба К., Шариф-Афшар А.Р., Макари Дж.Х., Бхоумик Н.А., ДеМарко Р.Т., Хипкенс С., Магнусон М., Брок Дж.В., 3-й, Хейворд С.В., Папа JCT, Матусик Р.Дж. Направленная дифференцировка эмбриональных стволовых клеток в ткань мочевого пузыря. Дев. биол. 2007; 304: 556–566. doi: 10.1016/j.ydbio.2007.01.010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]56. Джек Г.С., Чжан Р., Ли М., Сюй Ю., Ву Б.М., Родригес Л.В. Гладкая мускулатура мочевого пузыря, созданная из жировых стволовых клеток и трехмерного синтетического композита. Биоматериалы. 2009;30:3259–3270. doi: 10.1016/j.biomaterials.2009.02.035. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]57. Роча Ф.Г., Сандбак К.А., Кребс Н.Дж., Лич Дж.К., Муни Д.Дж., Эшли С.В., Ваканти Дж.П., Ванг Э.Э. Влияние устойчивой доставки фактора роста эндотелия сосудов на ангиогенез в тканевой инженерии кишечника.Биоматериалы. 2008; 29: 2884–2890. doi: 10.1016/j.biomaterials.2008. 03.026. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]58. Бацакова Л., Филова Е., Рыпачек Ф., Сворчик В., Старый В. Клеточная адгезия на искусственных материалах для тканевой инженерии. Физиол. Рез. 2004; 53 (Приложение 1): S35–S45. [PubMed] [Google Scholar]59. Париенте Дж.Л., Ким Б.С., Атала А. Оценка биосовместимости in vitro природных и синтетических биоматериалов с использованием нормальных гладкомышечных клеток мочевого пузыря человека.Дж. Урол. 2002; 167: 1867–1871. doi: 10.1016/S0022-5347(05)65251-2. [PubMed] [CrossRef] [Google Scholar] 60. Скривен С.Д., Трейдосевич Л.К., Томас Д.Ф., Саутгейт Дж. Трансплантация уротелиальных клеток с использованием биоразлагаемых синтетических каркасов. Дж. Матер. науч. Матер. Мед. 2001; 12: 991–996. doi: 10.1023/A:1012869318205. [PubMed] [CrossRef] [Google Scholar] 61. Браун А.Л., Брук-Оллред Т.Т., Уодделл Дж.Э., Уайт Дж., Веркмайстер Дж.А., Рэмшоу Дж.А., Багли Д.Дж., Вудхаус К.А. Бесклеточный матрикс мочевого пузыря как субстрат для изучения in vitro взаимодействий гладкой мускулатуры мочевого пузыря и уротелиальных клеток.
03.026. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]58. Бацакова Л., Филова Е., Рыпачек Ф., Сворчик В., Старый В. Клеточная адгезия на искусственных материалах для тканевой инженерии. Физиол. Рез. 2004; 53 (Приложение 1): S35–S45. [PubMed] [Google Scholar]59. Париенте Дж.Л., Ким Б.С., Атала А. Оценка биосовместимости in vitro природных и синтетических биоматериалов с использованием нормальных гладкомышечных клеток мочевого пузыря человека.Дж. Урол. 2002; 167: 1867–1871. doi: 10.1016/S0022-5347(05)65251-2. [PubMed] [CrossRef] [Google Scholar] 60. Скривен С.Д., Трейдосевич Л.К., Томас Д.Ф., Саутгейт Дж. Трансплантация уротелиальных клеток с использованием биоразлагаемых синтетических каркасов. Дж. Матер. науч. Матер. Мед. 2001; 12: 991–996. doi: 10.1023/A:1012869318205. [PubMed] [CrossRef] [Google Scholar] 61. Браун А.Л., Брук-Оллред Т.Т., Уодделл Дж.Э., Уайт Дж., Веркмайстер Дж.А., Рэмшоу Дж.А., Багли Д.Дж., Вудхаус К.А. Бесклеточный матрикс мочевого пузыря как субстрат для изучения in vitro взаимодействий гладкой мускулатуры мочевого пузыря и уротелиальных клеток. Биоматериалы. 2005; 26: 529–543. doi: 10.1016/j.biomaterials.2004.02.055. [PubMed] [CrossRef] [Google Scholar]62. Чун С.Ю., Лим Г.Дж., Квон Т.Г., Квак Э.К., Ким Б.В., Атала А., Ю Дж.Дж. Идентификация и характеристика биоактивных факторов в матриксе подслизистой оболочки мочевого пузыря. Биоматериалы. 2007; 28:4251–4256. doi: 10.1016/j.biomaterials.2007.05.020. [PubMed] [CrossRef] [Google Scholar]63. Доусон Р.А., Гобердхан Н.Дж., Фридлендер Э., Макнейл С. Влияние белков внеклеточного матрикса на прикрепление, пролиферацию и перенос кератиноцитов человека на модель кожной раны.Бернс. 1996; 22: 93–100. doi: 10.1016/0305-4179(95)00092-5. [PubMed] [CrossRef] [Google Scholar]64. Ашаммахи Н., Рокканен П. Рассасывающиеся полигликолидные устройства в травматологической и костной хирургии. Биоматериалы. 1997; 18:3–9. doi: 10.1016/S0142-9612(96)00107-X. [PubMed] [CrossRef] [Google Scholar] 65. Hodde J. Природные каркасы для восстановления и регенерации мягких тканей. Тисс. англ. 2002; 8: 295–308. doi: 10.
Биоматериалы. 2005; 26: 529–543. doi: 10.1016/j.biomaterials.2004.02.055. [PubMed] [CrossRef] [Google Scholar]62. Чун С.Ю., Лим Г.Дж., Квон Т.Г., Квак Э.К., Ким Б.В., Атала А., Ю Дж.Дж. Идентификация и характеристика биоактивных факторов в матриксе подслизистой оболочки мочевого пузыря. Биоматериалы. 2007; 28:4251–4256. doi: 10.1016/j.biomaterials.2007.05.020. [PubMed] [CrossRef] [Google Scholar]63. Доусон Р.А., Гобердхан Н.Дж., Фридлендер Э., Макнейл С. Влияние белков внеклеточного матрикса на прикрепление, пролиферацию и перенос кератиноцитов человека на модель кожной раны.Бернс. 1996; 22: 93–100. doi: 10.1016/0305-4179(95)00092-5. [PubMed] [CrossRef] [Google Scholar]64. Ашаммахи Н., Рокканен П. Рассасывающиеся полигликолидные устройства в травматологической и костной хирургии. Биоматериалы. 1997; 18:3–9. doi: 10.1016/S0142-9612(96)00107-X. [PubMed] [CrossRef] [Google Scholar] 65. Hodde J. Природные каркасы для восстановления и регенерации мягких тканей. Тисс. англ. 2002; 8: 295–308. doi: 10. 1089/107632702753725058. [PubMed] [CrossRef] [Google Scholar]66. Дейли В.П., Питерс С.Б., Ларсен М.Динамика внеклеточного матрикса в развитии и регенеративной медицине. Дж. Клеточные науки. 2008; 121: 255–264. doi: 10.1242/jcs.006064. [PubMed] [CrossRef] [Google Scholar]67. Мохамед Ф., ван дер Валле К.Ф. Разработка биоразлагаемых полиэфирных частиц со специфическими свойствами нацеливания и высвобождения лекарств. Дж. Фарм. науч. 2008; 97: 71–87. doi: 10.1002/jps.21082. [PubMed] [CrossRef] [Google Scholar]68. Hutmacher D.W., Schantz J.T., Lam C.X., Tan K.C., Lim T.C. Современное состояние и будущие направления костной инженерии на основе каркасов с точки зрения биоматериалов.Дж. Тисс. англ. Реген. Мед. 2007; 1: 245–260. doi: 10.1002/term.24. [PubMed] [CrossRef] [Google Scholar]69. Ма З., Мао З., Гао С. Модификация поверхности и анализ свойств биомедицинских полимеров, используемых для тканевой инженерии. Коллоид. Серф. Б. 2007; 60: 137–157. doi: 10.1016/j.colsurfb.2007.06.019. [PubMed] [CrossRef] [Google Scholar]70.
1089/107632702753725058. [PubMed] [CrossRef] [Google Scholar]66. Дейли В.П., Питерс С.Б., Ларсен М.Динамика внеклеточного матрикса в развитии и регенеративной медицине. Дж. Клеточные науки. 2008; 121: 255–264. doi: 10.1242/jcs.006064. [PubMed] [CrossRef] [Google Scholar]67. Мохамед Ф., ван дер Валле К.Ф. Разработка биоразлагаемых полиэфирных частиц со специфическими свойствами нацеливания и высвобождения лекарств. Дж. Фарм. науч. 2008; 97: 71–87. doi: 10.1002/jps.21082. [PubMed] [CrossRef] [Google Scholar]68. Hutmacher D.W., Schantz J.T., Lam C.X., Tan K.C., Lim T.C. Современное состояние и будущие направления костной инженерии на основе каркасов с точки зрения биоматериалов.Дж. Тисс. англ. Реген. Мед. 2007; 1: 245–260. doi: 10.1002/term.24. [PubMed] [CrossRef] [Google Scholar]69. Ма З., Мао З., Гао С. Модификация поверхности и анализ свойств биомедицинских полимеров, используемых для тканевой инженерии. Коллоид. Серф. Б. 2007; 60: 137–157. doi: 10.1016/j.colsurfb.2007.06.019. [PubMed] [CrossRef] [Google Scholar]70. Кропп Б.П., Риппи М.К., Бадылак С.Ф., Адамс М.К., Китинг М.А., Ринк Р.К., Тор К.Б. Регенеративное увеличение мочевого пузыря с использованием подслизистой оболочки тонкой кишки: уродинамическая и гистопатологическая оценка при длительном увеличении мочевого пузыря у собак.Дж. Урол. 1996;155:2098–2104. doi: 10.1016/S0022-5347(01)66117-2. [PubMed] [CrossRef] [Google Scholar]71. Olsen L.B.S., Busch C., Carlsten J., Eriksson I. Реконструкция уретры новым синтетическим рассасывающимся устройством. Экспериментальное исследование. Сканд Дж. Урол. Нефрол. 1992; 26: 323–326. doi: 10.3109/003655992020. [PubMed] [CrossRef] [Google Scholar]72. Кропп Б.П., Ладлоу Дж.К., Спайсер Д., Риппи М.К., Бадылак С.Ф., Адамс М.К., Китинг М.А., Ринк Р.К., Бирле Р., Тор К.Б. Регенерация уретры кролика с использованием подслизистых трансплантатов тонкой кишки.Урология. 1998; 52: 138–142. doi: 10.1016/S0090-4295(98)00114-9. [PubMed] [CrossRef] [Google Scholar]73. Урита Ю., Комуро Х., Чен Г., Шинья М., Канеко С.
Кропп Б.П., Риппи М.К., Бадылак С.Ф., Адамс М.К., Китинг М.А., Ринк Р.К., Тор К.Б. Регенеративное увеличение мочевого пузыря с использованием подслизистой оболочки тонкой кишки: уродинамическая и гистопатологическая оценка при длительном увеличении мочевого пузыря у собак.Дж. Урол. 1996;155:2098–2104. doi: 10.1016/S0022-5347(01)66117-2. [PubMed] [CrossRef] [Google Scholar]71. Olsen L.B.S., Busch C., Carlsten J., Eriksson I. Реконструкция уретры новым синтетическим рассасывающимся устройством. Экспериментальное исследование. Сканд Дж. Урол. Нефрол. 1992; 26: 323–326. doi: 10.3109/003655992020. [PubMed] [CrossRef] [Google Scholar]72. Кропп Б.П., Ладлоу Дж.К., Спайсер Д., Риппи М.К., Бадылак С.Ф., Адамс М.К., Китинг М.А., Ринк Р.К., Бирле Р., Тор К.Б. Регенерация уретры кролика с использованием подслизистых трансплантатов тонкой кишки.Урология. 1998; 52: 138–142. doi: 10.1016/S0090-4295(98)00114-9. [PubMed] [CrossRef] [Google Scholar]73. Урита Ю., Комуро Х., Чен Г., Шинья М., Канеко С. , Канеко М., Ушида Т. Регенерация пищевода с использованием желудочного бесклеточного матрикса: экспериментальное исследование на крысиной модели. Педиатр. Surg. Междунар. 2007; 23:21–26. doi: 10.1007/s00383-006-1799-0. [PubMed] [CrossRef] [Google Scholar]74. Де Филиппо Р.Э., Ю Дж.Дж., Атала А. Инженерия вагинальной ткани in vivo . Тисс. англ. 2003; 9: 301–306. дои: 10.1089/107632703764664765. [PubMed] [CrossRef] [Google Scholar]75. Амиэль Г.Э., Комура М., Шапира О., Ю Дж.Дж., Яздани С., Берри Дж., Каушал С., Бишофф Дж., Атала А., Сокер С. Инженерия кровеносных сосудов из бесклеточных коллагеновых матриц, покрытых эндотелиальными клетками человека . Тисс. англ. 2006; 12: 2355–2365. doi: 10.1089/10.2006.12.2355. [PubMed] [CrossRef] [Google Scholar]76. Lee JY, Choo JE, Choi YS, Lee KY, Min DS, Pi SH, Seol YJ, Lee SJ, Jo IH, Chung CP, Park YJ Характеристика иммобилизованного на поверхности синтетического гепарин-связывающего домена, полученного из фактора роста фибробластов человека-2 и Его влияние на дифференцировку остеобластов.
, Канеко М., Ушида Т. Регенерация пищевода с использованием желудочного бесклеточного матрикса: экспериментальное исследование на крысиной модели. Педиатр. Surg. Междунар. 2007; 23:21–26. doi: 10.1007/s00383-006-1799-0. [PubMed] [CrossRef] [Google Scholar]74. Де Филиппо Р.Э., Ю Дж.Дж., Атала А. Инженерия вагинальной ткани in vivo . Тисс. англ. 2003; 9: 301–306. дои: 10.1089/107632703764664765. [PubMed] [CrossRef] [Google Scholar]75. Амиэль Г.Э., Комура М., Шапира О., Ю Дж.Дж., Яздани С., Берри Дж., Каушал С., Бишофф Дж., Атала А., Сокер С. Инженерия кровеносных сосудов из бесклеточных коллагеновых матриц, покрытых эндотелиальными клетками человека . Тисс. англ. 2006; 12: 2355–2365. doi: 10.1089/10.2006.12.2355. [PubMed] [CrossRef] [Google Scholar]76. Lee JY, Choo JE, Choi YS, Lee KY, Min DS, Pi SH, Seol YJ, Lee SJ, Jo IH, Chung CP, Park YJ Характеристика иммобилизованного на поверхности синтетического гепарин-связывающего домена, полученного из фактора роста фибробластов человека-2 и Его влияние на дифференцировку остеобластов. Дж. Биомед. Матер. Рез. А. 2007; 83: 970–979. doi: 10.1002/jbm.a.31351. [PubMed] [CrossRef] [Google Scholar]77. Саутгейт Дж., Кросс В., Эрдли И., Томас Д.Ф., Трейдосевич Л.К. Реконструкция мочевого пузыря — от клеток к материалам. проц. Инст. мех. англ. Х. 2003; 217: 311–316. doi: 10.1243/095441103322060776. [PubMed] [CrossRef] [Google Scholar]78. Чен Ф., Ю Дж. Дж., Атала А. Бесклеточный коллагеновый матрикс как возможный готовый биоматериал для восстановления уретры. Урология. 1999; 54: 407–410. doi: 10.1016/S0090-4295(99)00179-X.[PubMed] [CrossRef] [Google Scholar]79. Дамс С.Э., Пьехота Х.Дж., Дахия Р., Луэ Т.Ф., Танаго Э.А. Состав и биомеханические свойства трансплантата бесклеточного матрикса мочевого пузыря: сравнительный анализ у крыс, свиней и человека. бр. Дж. Урол. 1998; 82: 411–419. doi: 10.1046/j.1464-410X.1998.00748.x. [PubMed] [CrossRef] [Google Scholar]80. Сазерленд Р.С., Баскин Л.С., Хейворд С.В., Кунья Г.Р. Регенерация уротелия мочевого пузыря, гладкой мускулатуры, кровеносных сосудов и нервов в матрикс бесклеточной ткани.
Дж. Биомед. Матер. Рез. А. 2007; 83: 970–979. doi: 10.1002/jbm.a.31351. [PubMed] [CrossRef] [Google Scholar]77. Саутгейт Дж., Кросс В., Эрдли И., Томас Д.Ф., Трейдосевич Л.К. Реконструкция мочевого пузыря — от клеток к материалам. проц. Инст. мех. англ. Х. 2003; 217: 311–316. doi: 10.1243/095441103322060776. [PubMed] [CrossRef] [Google Scholar]78. Чен Ф., Ю Дж. Дж., Атала А. Бесклеточный коллагеновый матрикс как возможный готовый биоматериал для восстановления уретры. Урология. 1999; 54: 407–410. doi: 10.1016/S0090-4295(99)00179-X.[PubMed] [CrossRef] [Google Scholar]79. Дамс С.Э., Пьехота Х.Дж., Дахия Р., Луэ Т.Ф., Танаго Э.А. Состав и биомеханические свойства трансплантата бесклеточного матрикса мочевого пузыря: сравнительный анализ у крыс, свиней и человека. бр. Дж. Урол. 1998; 82: 411–419. doi: 10.1046/j.1464-410X.1998.00748.x. [PubMed] [CrossRef] [Google Scholar]80. Сазерленд Р.С., Баскин Л.С., Хейворд С.В., Кунья Г.Р. Регенерация уротелия мочевого пузыря, гладкой мускулатуры, кровеносных сосудов и нервов в матрикс бесклеточной ткани. Дж.Урол. 1996; 156: 571–577. doi: 10.1016/S0022-5347(01)65755-0. [PubMed] [CrossRef] [Google Scholar]81. Бадылак С.Ф. Ксеногенный внеклеточный матрикс как каркас для реконструкции тканей. Транспл. Иммунол. 2004; 12: 367–377. doi: 10.1016/j.trim.2003.12.016. [PubMed] [CrossRef] [Google Scholar]82. Болланд Ф., Коросис С., Уилшоу С.П., Ингам Э., Фишер Дж., Кирни Дж.Н., Саутгейт Дж. Разработка и характеристика полнослойного бесклеточного матрикса свиного мочевого пузыря для тканевой инженерии. Биоматериалы.2007; 28:1061–1070. doi: 10.1016/j.biomaterials.2006.10.005. [PubMed] [CrossRef] [Google Scholar]83. Хори Ю., Накамура Т., Кимура Д., Кайно К., Курокава Ю., Сатоми С., Симидзу Ю. Экспериментальное исследование тканевой инженерии тонкой кишки путем посева мезенхимальных стволовых клеток. Дж. Сур. Рез. 2002; 102: 156–160. doi: 10.1006/jsre.2001.6294. [PubMed] [CrossRef] [Google Scholar]84. Ли М., Чанг П. К., Данн Дж. К. Оценка подслизистой оболочки тонкой кишки в качестве каркаса для инженерии тканей кишечника.
Дж.Урол. 1996; 156: 571–577. doi: 10.1016/S0022-5347(01)65755-0. [PubMed] [CrossRef] [Google Scholar]81. Бадылак С.Ф. Ксеногенный внеклеточный матрикс как каркас для реконструкции тканей. Транспл. Иммунол. 2004; 12: 367–377. doi: 10.1016/j.trim.2003.12.016. [PubMed] [CrossRef] [Google Scholar]82. Болланд Ф., Коросис С., Уилшоу С.П., Ингам Э., Фишер Дж., Кирни Дж.Н., Саутгейт Дж. Разработка и характеристика полнослойного бесклеточного матрикса свиного мочевого пузыря для тканевой инженерии. Биоматериалы.2007; 28:1061–1070. doi: 10.1016/j.biomaterials.2006.10.005. [PubMed] [CrossRef] [Google Scholar]83. Хори Ю., Накамура Т., Кимура Д., Кайно К., Курокава Ю., Сатоми С., Симидзу Ю. Экспериментальное исследование тканевой инженерии тонкой кишки путем посева мезенхимальных стволовых клеток. Дж. Сур. Рез. 2002; 102: 156–160. doi: 10.1006/jsre.2001.6294. [PubMed] [CrossRef] [Google Scholar]84. Ли М., Чанг П. К., Данн Дж. К. Оценка подслизистой оболочки тонкой кишки в качестве каркаса для инженерии тканей кишечника. Дж. Сур.Рез. 2008; 147: 168–171. doi: 10.1016/j.jss.2008.03.012. [PubMed] [CrossRef] [Google Scholar]85. Пробст М., Пьехота Х.Дж., Дахия Р., Танаго Э.А. Гомологичное увеличение мочевого пузыря у собак с трансплантатом бесклеточного матрикса мочевого пузыря. БЖУ Интерн. 2000; 85: 362–371. doi: 10.1046/j.1464-410x.2000.00442.x. [PubMed] [CrossRef] [Google Scholar]86. Редди П.П., Баррьерас Д.Дж., Уилсон Г., Багли Д.Дж., МакЛори Г.А., Хури А.Е., Мергерян П.А. Регенерация функциональных заменителей мочевого пузыря с использованием аллотрансплантатов бесклеточного матрикса большого сегмента на модели свиньи.Дж. Урол. 2000; 164:936–941. doi: 10.1016/S0022-5347(05)67221-7. [PubMed] [CrossRef] [Google Scholar]87. Чжан Ю., Фримбергер Д., Ченг Э.Ю., Лин Х.К., Кропп Б.П. Проблемы при замене мочевого пузыря большего размера трансплантатами подслизистой оболочки тонкой кишки с засеянными и незасеянными клетками в модели субтотальной цистэктомии. БЖУ Интерн. 2006;98:1100–1105. doi: 10.1111/j.1464-410X.
Дж. Сур.Рез. 2008; 147: 168–171. doi: 10.1016/j.jss.2008.03.012. [PubMed] [CrossRef] [Google Scholar]85. Пробст М., Пьехота Х.Дж., Дахия Р., Танаго Э.А. Гомологичное увеличение мочевого пузыря у собак с трансплантатом бесклеточного матрикса мочевого пузыря. БЖУ Интерн. 2000; 85: 362–371. doi: 10.1046/j.1464-410x.2000.00442.x. [PubMed] [CrossRef] [Google Scholar]86. Редди П.П., Баррьерас Д.Дж., Уилсон Г., Багли Д.Дж., МакЛори Г.А., Хури А.Е., Мергерян П.А. Регенерация функциональных заменителей мочевого пузыря с использованием аллотрансплантатов бесклеточного матрикса большого сегмента на модели свиньи.Дж. Урол. 2000; 164:936–941. doi: 10.1016/S0022-5347(05)67221-7. [PubMed] [CrossRef] [Google Scholar]87. Чжан Ю., Фримбергер Д., Ченг Э.Ю., Лин Х.К., Кропп Б.П. Проблемы при замене мочевого пузыря большего размера трансплантатами подслизистой оболочки тонкой кишки с засеянными и незасеянными клетками в модели субтотальной цистэктомии. БЖУ Интерн. 2006;98:1100–1105. doi: 10.1111/j.1464-410X. 2006.06447.x. [PubMed] [CrossRef] [Google Scholar]88. Канемацу А., Ямамото С., Ногучи Т., Озеки М., Табата Ю., Огава О. Регенерация мочевого пузыря бесклеточным матриксом мочевого пузыря в сочетании с устойчивым высвобождением экзогенного фактора роста.Дж. Урол. 2003; 170:1633–1638. doi: 10.1097/01.ju.0000084021.51099.8a. [PubMed] [CrossRef] [Google Scholar]89. Браун А.Л., Фархат В., Мергуриан П.А., Уилсон Г.Дж., Хури А.Е., Вудхаус К.А. 22-недельная оценка бесклеточного матрикса мочевого пузыря в качестве материала для увеличения мочевого пузыря на модели свиньи. Биоматериалы. 2002; 23: 2179–2190. doi: 10.1016/S0142-9612(01)00350-7. [PubMed] [CrossRef] [Google Scholar]90. Кропп Б.П., Ченг Э.Ю., Лин Х.К., Чжан Ю. Надежная и воспроизводимая регенерация мочевого пузыря с использованием необработанной подслизистой оболочки дистального отдела тонкой кишки.Дж. Урол. 2004; 172:1710–1713. doi: 10.1097/01.ju.0000139952.64753.27. [PubMed] [CrossRef] [Google Scholar]91. Baumert H., Simon P., Hekmati M.
2006.06447.x. [PubMed] [CrossRef] [Google Scholar]88. Канемацу А., Ямамото С., Ногучи Т., Озеки М., Табата Ю., Огава О. Регенерация мочевого пузыря бесклеточным матриксом мочевого пузыря в сочетании с устойчивым высвобождением экзогенного фактора роста.Дж. Урол. 2003; 170:1633–1638. doi: 10.1097/01.ju.0000084021.51099.8a. [PubMed] [CrossRef] [Google Scholar]89. Браун А.Л., Фархат В., Мергуриан П.А., Уилсон Г.Дж., Хури А.Е., Вудхаус К.А. 22-недельная оценка бесклеточного матрикса мочевого пузыря в качестве материала для увеличения мочевого пузыря на модели свиньи. Биоматериалы. 2002; 23: 2179–2190. doi: 10.1016/S0142-9612(01)00350-7. [PubMed] [CrossRef] [Google Scholar]90. Кропп Б.П., Ченг Э.Ю., Лин Х.К., Чжан Ю. Надежная и воспроизводимая регенерация мочевого пузыря с использованием необработанной подслизистой оболочки дистального отдела тонкой кишки.Дж. Урол. 2004; 172:1710–1713. doi: 10.1097/01.ju.0000139952.64753.27. [PubMed] [CrossRef] [Google Scholar]91. Baumert H., Simon P., Hekmati M. , Fromont G., Levy M., Balaton A., Molinie V., Malavaud B. Разработка засеянного каркаса в большом сальнике: осуществимость биореактора in vivo для тканевая инженерия мочевого пузыря. Евро. Урол. 2007; 52: 884–890. doi: 10.1016/j.eururo.2006.11.044. [PubMed] [CrossRef] [Google Scholar]92. Хармон Дж. В., Райт Дж. А., Ноэль Дж., Коган М. Судьба протезов дакрона в тонкой кишке кроликов.Surg. Форум. 1979; 30: 365–366. [PubMed] [Google Scholar]93. Уотсон Л.К., Фридман Х.И., Гриффин Д.Г., Нортон Л.В., Меллик П.В. Неослизистая оболочка тонкой кишки. Дж. Сур. Рез. 1980; 28: 280–291. doi: 10.1016/0022-4804(80)-4. [PubMed] [CrossRef] [Google Scholar]94. Кайхара С., Ким С.С., Ким Б.С., Муни Д., Танака К., Ваканти Дж.П. Долгосрочное наблюдение за тканевой инженерией кишечника после анастомоза с нативной тонкой кишкой. Трансплантация. 2000;69:1927–1932. doi: 10.1097/00007890-200005150-00031. [PubMed] [CrossRef] [Google Scholar]95.Хатмахер Д.В. Каркасы в тканевой инженерии костей и хрящей.
, Fromont G., Levy M., Balaton A., Molinie V., Malavaud B. Разработка засеянного каркаса в большом сальнике: осуществимость биореактора in vivo для тканевая инженерия мочевого пузыря. Евро. Урол. 2007; 52: 884–890. doi: 10.1016/j.eururo.2006.11.044. [PubMed] [CrossRef] [Google Scholar]92. Хармон Дж. В., Райт Дж. А., Ноэль Дж., Коган М. Судьба протезов дакрона в тонкой кишке кроликов.Surg. Форум. 1979; 30: 365–366. [PubMed] [Google Scholar]93. Уотсон Л.К., Фридман Х.И., Гриффин Д.Г., Нортон Л.В., Меллик П.В. Неослизистая оболочка тонкой кишки. Дж. Сур. Рез. 1980; 28: 280–291. doi: 10.1016/0022-4804(80)-4. [PubMed] [CrossRef] [Google Scholar]94. Кайхара С., Ким С.С., Ким Б.С., Муни Д., Танака К., Ваканти Дж.П. Долгосрочное наблюдение за тканевой инженерией кишечника после анастомоза с нативной тонкой кишкой. Трансплантация. 2000;69:1927–1932. doi: 10.1097/00007890-200005150-00031. [PubMed] [CrossRef] [Google Scholar]95.Хатмахер Д.В. Каркасы в тканевой инженерии костей и хрящей. Биоматериалы. 2000;21:2529–2543. doi: 10.1016/S0142-9612(00)00121-6. [PubMed] [CrossRef] [Google Scholar]96. Фрид Л.Э., Вуньяк-Новакович Г., Бирон Р.Дж., Иглз Д.Б., Лесной Д.К., Барлоу С.К., Лангер Р. Биоразлагаемые полимерные каркасы для тканевой инженерии. Биотехнология. 1994; 12: 689–693. doi: 10.1038/nbt0794-689. [PubMed] [CrossRef] [Google Scholar]97. Микос А.Г., Лайман М.Д., Фрид Л.Е., Лангер Р. Смачивание пен поли(L-молочная кислота) и поли(DL-молочная-со-гликолевая кислота) для культуры тканей.Биоматериалы. 1994; 15:55–58. doi: 10.1016/0142-9612(94)-X. [PubMed] [CrossRef] [Google Scholar]98. Харрис Л.Д., Ким Б.С., Муни Д.Дж. Биоразлагаемые матрицы с открытыми порами, сформированные газовым вспениванием. Дж. Биомед. Матер. Рез. 1998; 42: 396–402. doi: 10.1002/(SICI)1097-4636(19981205)42:3<396::AID-JBM7>3.0.CO;2-E. [PubMed] [CrossRef] [Google Scholar]99. Бини Т.Б., Гао С., Сюй С., Ван С., Рамакришна С., Леонг К.В. Регенерация периферических нервов микроплетением поли(L-лактид-со-гликолид) биоразлагаемых полимерных волокон.
Биоматериалы. 2000;21:2529–2543. doi: 10.1016/S0142-9612(00)00121-6. [PubMed] [CrossRef] [Google Scholar]96. Фрид Л.Э., Вуньяк-Новакович Г., Бирон Р.Дж., Иглз Д.Б., Лесной Д.К., Барлоу С.К., Лангер Р. Биоразлагаемые полимерные каркасы для тканевой инженерии. Биотехнология. 1994; 12: 689–693. doi: 10.1038/nbt0794-689. [PubMed] [CrossRef] [Google Scholar]97. Микос А.Г., Лайман М.Д., Фрид Л.Е., Лангер Р. Смачивание пен поли(L-молочная кислота) и поли(DL-молочная-со-гликолевая кислота) для культуры тканей.Биоматериалы. 1994; 15:55–58. doi: 10.1016/0142-9612(94)-X. [PubMed] [CrossRef] [Google Scholar]98. Харрис Л.Д., Ким Б.С., Муни Д.Дж. Биоразлагаемые матрицы с открытыми порами, сформированные газовым вспениванием. Дж. Биомед. Матер. Рез. 1998; 42: 396–402. doi: 10.1002/(SICI)1097-4636(19981205)42:3<396::AID-JBM7>3.0.CO;2-E. [PubMed] [CrossRef] [Google Scholar]99. Бини Т.Б., Гао С., Сюй С., Ван С., Рамакришна С., Леонг К.В. Регенерация периферических нервов микроплетением поли(L-лактид-со-гликолид) биоразлагаемых полимерных волокон.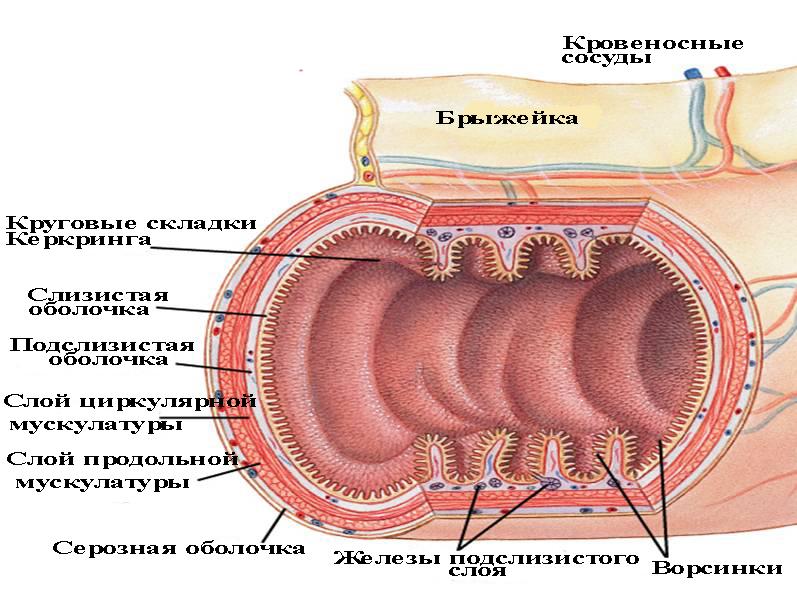 Дж. Биомед. Матер. Рез. А. 2004; 68: 286–295. doi: 10.1002/jbm.a.20050. [PubMed] [CrossRef] [Google Scholar] 100. Zong X., Bien H., Chung C.Y., Yin L., Fang D., Hsiao B.S., Chu B., Entcheva E. Тонкотекстурированные электропряденые каркасы для конструкций из ткани сердца. Биоматериалы. 2005; 26: 5330–5338. doi: 10.1016/j.biomaterials.2005.01.052. [PubMed] [CrossRef] [Google Scholar] 101. Пеппас Н.А., Лангер Р. Новые вызовы в области биоматериалов. Наука. 1994; 263:1715–1720. doi: 10.1126/science.8134835. [PubMed] [CrossRef] [Google Scholar] 102.Danielsson C., Ruault S., Simonet M., Neuenschwander P., Frey P. Каркас из полиэфируретановой пены для инженерии гладкомышечных клеток. Биоматериалы. 2006; 27:1410–1415. doi: 10.1016/j.biomaterials.2005.08.026. [PubMed] [CrossRef] [Google Scholar] 103. Ваканти Дж. П., Лангер Р. Тканевая инженерия: проектирование и изготовление живых замещающих устройств для хирургической реконструкции и трансплантации. Ланцет. 1999; 354 (Прил. 1):SI32–SI34. doi: 10.
Дж. Биомед. Матер. Рез. А. 2004; 68: 286–295. doi: 10.1002/jbm.a.20050. [PubMed] [CrossRef] [Google Scholar] 100. Zong X., Bien H., Chung C.Y., Yin L., Fang D., Hsiao B.S., Chu B., Entcheva E. Тонкотекстурированные электропряденые каркасы для конструкций из ткани сердца. Биоматериалы. 2005; 26: 5330–5338. doi: 10.1016/j.biomaterials.2005.01.052. [PubMed] [CrossRef] [Google Scholar] 101. Пеппас Н.А., Лангер Р. Новые вызовы в области биоматериалов. Наука. 1994; 263:1715–1720. doi: 10.1126/science.8134835. [PubMed] [CrossRef] [Google Scholar] 102.Danielsson C., Ruault S., Simonet M., Neuenschwander P., Frey P. Каркас из полиэфируретановой пены для инженерии гладкомышечных клеток. Биоматериалы. 2006; 27:1410–1415. doi: 10.1016/j.biomaterials.2005.08.026. [PubMed] [CrossRef] [Google Scholar] 103. Ваканти Дж. П., Лангер Р. Тканевая инженерия: проектирование и изготовление живых замещающих устройств для хирургической реконструкции и трансплантации. Ланцет. 1999; 354 (Прил. 1):SI32–SI34. doi: 10. 1016/S0140-6736(99)-7. [PubMed] [CrossRef] [Google Scholar] 104.Биссон И., Хилборн Дж., Вурм Ф., Мейрат Б., Фрей П. Уротелиальные клетки человека, выращенные на коллагене, адсорбированном на поверхностно-модифицированных полимерах. Урология. 2002; 60: 176–180. doi: 10.1016/S0090-4295(02)01642-4. [PubMed] [CrossRef] [Google Scholar] 105. Ким Б.С., Николовски Дж., Бонадио Дж., Смайли Э., Муни Д.Дж. Сконструированные гладкомышечные ткани: регулирование клеточного фенотипа с помощью каркаса. Эксп. Клетка. Рез. 1999; 251:318–328. doi: 10.1006/excr.1999.4595. [PubMed] [CrossRef] [Google Scholar] 106. Муруган Р., Рамакришна С.Каркасы с наноэлементами для тканевой инженерии: обзор методологий прядения. Тисс. англ. 2006; 12: 435–447. doi: 10.1089/ten.2006.12.435. [PubMed] [CrossRef] [Google Scholar] 107. Xu C.Y., Inai R., Kotaki M., Ramakrishna S. Выровненная биоразлагаемая нановолокнистая структура: потенциальный каркас для инженерии кровеносных сосудов. Биоматериалы. 2004; 25: 877–886. doi: 10.
1016/S0140-6736(99)-7. [PubMed] [CrossRef] [Google Scholar] 104.Биссон И., Хилборн Дж., Вурм Ф., Мейрат Б., Фрей П. Уротелиальные клетки человека, выращенные на коллагене, адсорбированном на поверхностно-модифицированных полимерах. Урология. 2002; 60: 176–180. doi: 10.1016/S0090-4295(02)01642-4. [PubMed] [CrossRef] [Google Scholar] 105. Ким Б.С., Николовски Дж., Бонадио Дж., Смайли Э., Муни Д.Дж. Сконструированные гладкомышечные ткани: регулирование клеточного фенотипа с помощью каркаса. Эксп. Клетка. Рез. 1999; 251:318–328. doi: 10.1006/excr.1999.4595. [PubMed] [CrossRef] [Google Scholar] 106. Муруган Р., Рамакришна С.Каркасы с наноэлементами для тканевой инженерии: обзор методологий прядения. Тисс. англ. 2006; 12: 435–447. doi: 10.1089/ten.2006.12.435. [PubMed] [CrossRef] [Google Scholar] 107. Xu C.Y., Inai R., Kotaki M., Ramakrishna S. Выровненная биоразлагаемая нановолокнистая структура: потенциальный каркас для инженерии кровеносных сосудов. Биоматериалы. 2004; 25: 877–886. doi: 10. 1016/S0142-9612(03)00593-3. [PubMed] [CrossRef] [Google Scholar] 108. Ма З., Котаки М., Инаи Р., Рамакришна С. Потенциал матрикса нановолокна в качестве основы для тканеинженерии.Тисс. англ. 2005; 11: 101–109. doi: 10.1089/10.2005.11.101. [PubMed] [CrossRef] [Google Scholar] 109. Ян Ф., Муруган Р., Ван С., Рамакришна С. Электропрядение нано/микроразмерных поли(L-молочной кислоты) волокон и их потенциал в инженерии нервной ткани. Биоматериалы. 2005; 26: 2603–2610. doi: 10.1016/j.biomaterials.2004.06.051. [PubMed] [CrossRef] [Google Scholar] 110. Бейкер С.С., Аткин Н., Ганнинг П.А., Гранвиль Н., Уилсон К., Уилсон Д., Саутгейт Дж. Характеристика электроформованных полистироловых каркасов для трехмерных биологических исследований in vitro .Биоматериалы. 2006; 27:3136–3146. doi: 10.1016/j.biomaterials.2006.01.026. [PubMed] [CrossRef] [Google Scholar] 111. Эберли Д., Фрейтас Филью Л., Атала А., Ю Дж.Дж. Композитные каркасы для инженерии полых органов и тканей. Методы. 2009; 47: 109–115. doi: 10.
1016/S0142-9612(03)00593-3. [PubMed] [CrossRef] [Google Scholar] 108. Ма З., Котаки М., Инаи Р., Рамакришна С. Потенциал матрикса нановолокна в качестве основы для тканеинженерии.Тисс. англ. 2005; 11: 101–109. doi: 10.1089/10.2005.11.101. [PubMed] [CrossRef] [Google Scholar] 109. Ян Ф., Муруган Р., Ван С., Рамакришна С. Электропрядение нано/микроразмерных поли(L-молочной кислоты) волокон и их потенциал в инженерии нервной ткани. Биоматериалы. 2005; 26: 2603–2610. doi: 10.1016/j.biomaterials.2004.06.051. [PubMed] [CrossRef] [Google Scholar] 110. Бейкер С.С., Аткин Н., Ганнинг П.А., Гранвиль Н., Уилсон К., Уилсон Д., Саутгейт Дж. Характеристика электроформованных полистироловых каркасов для трехмерных биологических исследований in vitro .Биоматериалы. 2006; 27:3136–3146. doi: 10.1016/j.biomaterials.2006.01.026. [PubMed] [CrossRef] [Google Scholar] 111. Эберли Д., Фрейтас Филью Л., Атала А., Ю Дж.Дж. Композитные каркасы для инженерии полых органов и тканей. Методы. 2009; 47: 109–115. doi: 10. 1016/j.ymeth.2008.10.014. [PubMed] [CrossRef] [Google Scholar] 112. Наканиши Ю., Чен Г., Комуро Х., Ушида Т., Канеко С., Татеиши Т., Канеко М. Тканеинженерная стенка мочевого пузыря с использованием сетчато-коллагеновых гибридных каркасов PLGA: сравнительное исследование коллагеновой губки и геля в качестве эшафот.Дж. Педиатр. Surg. 2003; 38: 1781–1784. doi: 10.1016/j.jpedsurg.2003.08.034. [PubMed] [CrossRef] [Google Scholar] 113. Поуп Дж. К. Т., Дэвис М. М., Смит Э. Р. мл., Уолш М. Дж., Эллисон П. К., Ринк Р. К., Кропп Б. П. Онтогенез регенерированного подслизистого мочевого пузыря тонкой кишки собак. Дж. Урол. 1997; 158:1105–1110. doi: 10.1016/S0022-5347(01)64398-2. [PubMed] [CrossRef] [Google Scholar] 114. Феррара Н., Дэвис-Смит Т. Биология фактора роста эндотелия сосудов. Эндокр. 1997; 18:4–25. doi: 10.1210/edrv.18.1.0287. [PubMed] [CrossRef] [Google Scholar] 115. Яманака М., Шираи М., Шиина Х., Шираи М., Танака Ю., Фудзиме М., Окуяма А., Дахия Р. Потеря антиапоптотических генов у стареющих крысиных ножек.
1016/j.ymeth.2008.10.014. [PubMed] [CrossRef] [Google Scholar] 112. Наканиши Ю., Чен Г., Комуро Х., Ушида Т., Канеко С., Татеиши Т., Канеко М. Тканеинженерная стенка мочевого пузыря с использованием сетчато-коллагеновых гибридных каркасов PLGA: сравнительное исследование коллагеновой губки и геля в качестве эшафот.Дж. Педиатр. Surg. 2003; 38: 1781–1784. doi: 10.1016/j.jpedsurg.2003.08.034. [PubMed] [CrossRef] [Google Scholar] 113. Поуп Дж. К. Т., Дэвис М. М., Смит Э. Р. мл., Уолш М. Дж., Эллисон П. К., Ринк Р. К., Кропп Б. П. Онтогенез регенерированного подслизистого мочевого пузыря тонкой кишки собак. Дж. Урол. 1997; 158:1105–1110. doi: 10.1016/S0022-5347(01)64398-2. [PubMed] [CrossRef] [Google Scholar] 114. Феррара Н., Дэвис-Смит Т. Биология фактора роста эндотелия сосудов. Эндокр. 1997; 18:4–25. doi: 10.1210/edrv.18.1.0287. [PubMed] [CrossRef] [Google Scholar] 115. Яманака М., Шираи М., Шиина Х., Шираи М., Танака Ю., Фудзиме М., Окуяма А., Дахия Р. Потеря антиапоптотических генов у стареющих крысиных ножек. Дж. Урол. 2002;168:2296–2300. doi: 10.1016/S0022-5347(05)64374-1. [PubMed] [CrossRef] [Google Scholar] 116. Гербер Х.П., Диксит В., Феррара Н. Фактор роста эндотелия сосудов индуцирует экспрессию антиапоптотических белков Bcl-2 и A1 в эндотелиальных клетках сосудов. Дж. Биол. хим. 1998; 273:13313–13316. дои: 10.1074/jbc.273.21.13313. [PubMed] [CrossRef] [Google Scholar] 117. Канемацу А., Ямамото С., Озеки М., Ногучи Т., Канатани И., Огава О., Табата Ю. Коллагеновые матрицы как высвобождающие носители экзогенных факторов роста. Биоматериалы. 2004; 25:4513–4520. doi: 10.1016/j.biomaterials.2003.11.035. [PubMed] [CrossRef] [Google Scholar] 118. Номи М., Атала А., Коппи П.Д., Сокер С. Принципы неоваскуляризации для тканевой инженерии. Мол. Аспекты Мед. 2002; 23: 463–483. doi: 10.1016/S0098-2997(02)00008-0. [PubMed] [CrossRef] [Google Scholar] 119.Шультейсс Д., Габуев А.И., Чеботари С., Тудораче И., Уоллес Т., Шлоте Н., Вефер Дж., Кауфманн П.М., Хаверих А., Йонас У., Штиф К.Г., Мертшинг Х. Биологический васкуляризированный матрикс для ткани мочевого пузыря инженерия: подготовка матрицы, техника повторного посева и краткосрочная имплантация в модель свиньи.
Дж. Урол. 2002;168:2296–2300. doi: 10.1016/S0022-5347(05)64374-1. [PubMed] [CrossRef] [Google Scholar] 116. Гербер Х.П., Диксит В., Феррара Н. Фактор роста эндотелия сосудов индуцирует экспрессию антиапоптотических белков Bcl-2 и A1 в эндотелиальных клетках сосудов. Дж. Биол. хим. 1998; 273:13313–13316. дои: 10.1074/jbc.273.21.13313. [PubMed] [CrossRef] [Google Scholar] 117. Канемацу А., Ямамото С., Озеки М., Ногучи Т., Канатани И., Огава О., Табата Ю. Коллагеновые матрицы как высвобождающие носители экзогенных факторов роста. Биоматериалы. 2004; 25:4513–4520. doi: 10.1016/j.biomaterials.2003.11.035. [PubMed] [CrossRef] [Google Scholar] 118. Номи М., Атала А., Коппи П.Д., Сокер С. Принципы неоваскуляризации для тканевой инженерии. Мол. Аспекты Мед. 2002; 23: 463–483. doi: 10.1016/S0098-2997(02)00008-0. [PubMed] [CrossRef] [Google Scholar] 119.Шультейсс Д., Габуев А.И., Чеботари С., Тудораче И., Уоллес Т., Шлоте Н., Вефер Дж., Кауфманн П.М., Хаверих А., Йонас У., Штиф К.Г., Мертшинг Х. Биологический васкуляризированный матрикс для ткани мочевого пузыря инженерия: подготовка матрицы, техника повторного посева и краткосрочная имплантация в модель свиньи. Дж. Урол. 2005; 173: 276–280. doi: 10.1097/01.ju.0000145882.80339.18. [PubMed] [CrossRef] [Google Scholar] 120. МакКоннелл М.П., Дхар С., Наран С., Нгуен Т., Брэдшоу Р.А., Эванс Г.Р. In vivo индукция и доставка фактора роста нервов с использованием клеток HEK-293.Тисс. англ. 2004; 10:1492–1501. doi: 10.1089/10.2004.10.1492. [PubMed] [CrossRef] [Google Scholar] 121. Левенберг С., Бердик Дж. А., Краэнбюль Т., Лангер Р. Нейротрофин-индуцированная дифференцировка эмбриональных стволовых клеток человека на трехмерных полимерных каркасах. Тисс. англ. 2005; 11: 506–512. doi: 10.1089/10.2005.11.506. [PubMed] [CrossRef] [Google Scholar] 122. Sondell M., Sundler F., Kanje M. Сосудистый эндотелиальный фактор роста является нейротрофическим фактором, который стимулирует рост аксонов через рецептор flk-1.Евро. Дж. Нейроски. 2000; 12:4243–4254. doi: 10.1046/j.0953-816X.2000.01326.x. [PubMed] [CrossRef] [Google Scholar] 123. Мицуи Т., Шумский Дж.С., Лепор А.С., Мюррей М., Фишер И. Трансплантация нейрональных и глиальных ограниченных предшественников в ушибленный спинной мозг улучшает мочевой пузырь и моторные функции, снижает термическую гиперчувствительность и модифицирует интраспинальную схему.
Дж. Урол. 2005; 173: 276–280. doi: 10.1097/01.ju.0000145882.80339.18. [PubMed] [CrossRef] [Google Scholar] 120. МакКоннелл М.П., Дхар С., Наран С., Нгуен Т., Брэдшоу Р.А., Эванс Г.Р. In vivo индукция и доставка фактора роста нервов с использованием клеток HEK-293.Тисс. англ. 2004; 10:1492–1501. doi: 10.1089/10.2004.10.1492. [PubMed] [CrossRef] [Google Scholar] 121. Левенберг С., Бердик Дж. А., Краэнбюль Т., Лангер Р. Нейротрофин-индуцированная дифференцировка эмбриональных стволовых клеток человека на трехмерных полимерных каркасах. Тисс. англ. 2005; 11: 506–512. doi: 10.1089/10.2005.11.506. [PubMed] [CrossRef] [Google Scholar] 122. Sondell M., Sundler F., Kanje M. Сосудистый эндотелиальный фактор роста является нейротрофическим фактором, который стимулирует рост аксонов через рецептор flk-1.Евро. Дж. Нейроски. 2000; 12:4243–4254. doi: 10.1046/j.0953-816X.2000.01326.x. [PubMed] [CrossRef] [Google Scholar] 123. Мицуи Т., Шумский Дж.С., Лепор А.С., Мюррей М., Фишер И. Трансплантация нейрональных и глиальных ограниченных предшественников в ушибленный спинной мозг улучшает мочевой пузырь и моторные функции, снижает термическую гиперчувствительность и модифицирует интраспинальную схему.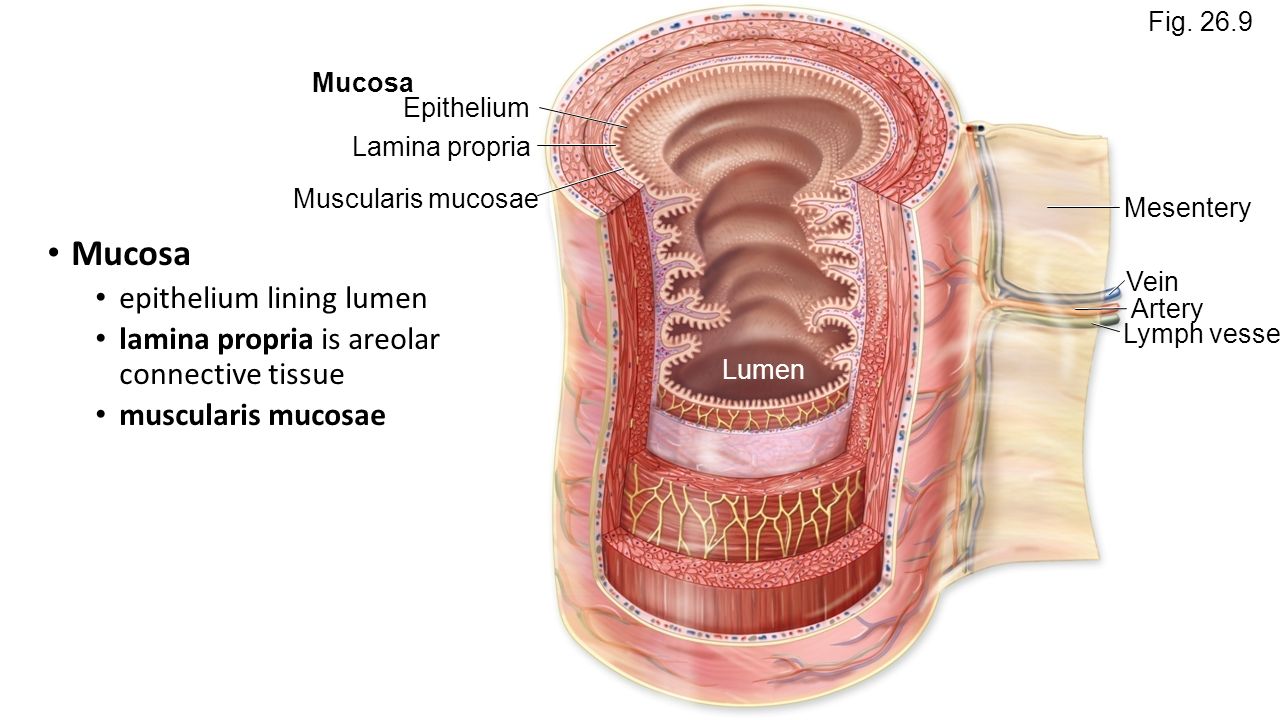 Дж. Нейроски. 2005; 25:9624–9636. doi: 10.1523/JNEUROSCI.2175-05.2005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]125.Сасаки К., Канцлер М.Б., Гоинс В.Ф., Фелан М.В., Глориозо Дж.К., де Гроат В.К., Йошимура Н. Генная терапия с использованием векторов вируса простого герпеса с дефектом репликации, экспрессирующих фактор роста нервов в крысиной модели диабетической цистопатии. Сахарный диабет. 2004; 53: 2723–2730. doi: 10.2337/диабет.53.10.2723. [PubMed] [CrossRef] [Google Scholar] 126. Секи С., Сасаки К., Фрейзер М.О., Игава Ю., Нисидзава О., Канцлер М.Б., де Гроат В.К., Йошимура Н. Иммунонейтрализация фактора роста нервов в пояснично-крестцовом отделе спинного мозга снижает гиперрефлексию мочевого пузыря у крыс с травмой спинного мозга.Дж. Урол. 2002; 168: 2269–2274. doi: 10.1016/S0022-5347(05)64369-8. [PubMed] [CrossRef] [Google Scholar] 127. Хирата А., Масаки Т., Мотоёси К., Камакура К. Интратекальное введение фактора роста нервов задерживает экспрессию GAP 43 и раннюю фазу регенерации периферического нерва взрослой крысы.
Дж. Нейроски. 2005; 25:9624–9636. doi: 10.1523/JNEUROSCI.2175-05.2005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]125.Сасаки К., Канцлер М.Б., Гоинс В.Ф., Фелан М.В., Глориозо Дж.К., де Гроат В.К., Йошимура Н. Генная терапия с использованием векторов вируса простого герпеса с дефектом репликации, экспрессирующих фактор роста нервов в крысиной модели диабетической цистопатии. Сахарный диабет. 2004; 53: 2723–2730. doi: 10.2337/диабет.53.10.2723. [PubMed] [CrossRef] [Google Scholar] 126. Секи С., Сасаки К., Фрейзер М.О., Игава Ю., Нисидзава О., Канцлер М.Б., де Гроат В.К., Йошимура Н. Иммунонейтрализация фактора роста нервов в пояснично-крестцовом отделе спинного мозга снижает гиперрефлексию мочевого пузыря у крыс с травмой спинного мозга.Дж. Урол. 2002; 168: 2269–2274. doi: 10.1016/S0022-5347(05)64369-8. [PubMed] [CrossRef] [Google Scholar] 127. Хирата А., Масаки Т., Мотоёси К., Камакура К. Интратекальное введение фактора роста нервов задерживает экспрессию GAP 43 и раннюю фазу регенерации периферического нерва взрослой крысы. Мозг Res. 2002; 944: 146–156. doi: 10.1016/S0006-8993(02)02739-7. [PubMed] [CrossRef] [Google Scholar] 128. Хендерсон К.Э., Филлипс Х.С., Поллок Р.А., Дэвис А.М., Лемель С., Арманини М., Симмонс Л., Моффет Б., Vandlen R.A., Simpson L.C., et al. GDNF: мощный фактор выживания для мотонейронов, присутствующих в периферических нервах и мышцах. Наука. 1994; 266:1062–1064. doi: 10.1126/science.7973664. [PubMed] [CrossRef] [Google Scholar] 129. Пиквиллоуд Г., Кристен Т., Пфистер Л.А., Гандер Б., Папалоизос М.Ю. Изменения в высвобождении нейротрофического фактора, происходящего из линии глиальных клеток, из биоразлагаемых нервных проводников изменяют скорость функционального восстановления моторики после восстановления первичного нерва у крыс. Евро. Дж. Нейроски. 2007; 26:1109–1117.doi: 10.1111/j.1460-9568.2007.05748.x. [PubMed] [CrossRef] [Google Scholar] 130. Kashiba H., Hyon B., Senba E. мРНК нейротрофического фактора, полученного из глиальной клеточной линии, и рецептора фактора роста нервов экспрессируются в отдельных подгруппах нейронов ганглиев дорсальных корешков и по-разному регулируются периферической аксотомией у крыс.
Мозг Res. 2002; 944: 146–156. doi: 10.1016/S0006-8993(02)02739-7. [PubMed] [CrossRef] [Google Scholar] 128. Хендерсон К.Э., Филлипс Х.С., Поллок Р.А., Дэвис А.М., Лемель С., Арманини М., Симмонс Л., Моффет Б., Vandlen R.A., Simpson L.C., et al. GDNF: мощный фактор выживания для мотонейронов, присутствующих в периферических нервах и мышцах. Наука. 1994; 266:1062–1064. doi: 10.1126/science.7973664. [PubMed] [CrossRef] [Google Scholar] 129. Пиквиллоуд Г., Кристен Т., Пфистер Л.А., Гандер Б., Папалоизос М.Ю. Изменения в высвобождении нейротрофического фактора, происходящего из линии глиальных клеток, из биоразлагаемых нервных проводников изменяют скорость функционального восстановления моторики после восстановления первичного нерва у крыс. Евро. Дж. Нейроски. 2007; 26:1109–1117.doi: 10.1111/j.1460-9568.2007.05748.x. [PubMed] [CrossRef] [Google Scholar] 130. Kashiba H., Hyon B., Senba E. мРНК нейротрофического фактора, полученного из глиальной клеточной линии, и рецептора фактора роста нервов экспрессируются в отдельных подгруппах нейронов ганглиев дорсальных корешков и по-разному регулируются периферической аксотомией у крыс. Неврологи. лат. 1998; 252:107–110. doi: 10.1016/S0304-3940(98)00558-8. [PubMed] [CrossRef] [Google Scholar] 131. Madduri S., Papaloizos M., Gander B. Синергетический эффект GDNF и NGF на ветвление и удлинение аксонов in vitro .Неврологи. Рез. 2009; 65: 88–97. doi: 10.1016/j.neures.2009.06.003. [PubMed] [CrossRef] [Google Scholar] 132. Кикуно Н., Кавамото К., Хирата Х., Вейдани К., Каваками К., Фандель Т., Нунес Л., Ураками С., Сиина Х., Игава М., Танаго Э., Дахия Р. Фактор роста нервов в сочетании с фактором роста эндотелия сосудов усиливает регенерацию трансплантата бесклеточного матрикса мочевого пузыря в нейрогенном мочевом пузыре крыс, вызванном повреждением спинного мозга. БЖУ Интерн. 2009; 103:1424–1428. doi: 10.1111/j.1464-410X.2008.08129.x. [PubMed] [CrossRef] [Google Scholar] 133.Corey J.M., Lin D.Y., Mycek KB, Chen Q., Samuel S., Feldman EL, Martin D.C. Выровненные электропряденые нановолокна определяют направление роста нейритов ганглиев дорсальных корешков. Дж. Биомед.
Неврологи. лат. 1998; 252:107–110. doi: 10.1016/S0304-3940(98)00558-8. [PubMed] [CrossRef] [Google Scholar] 131. Madduri S., Papaloizos M., Gander B. Синергетический эффект GDNF и NGF на ветвление и удлинение аксонов in vitro .Неврологи. Рез. 2009; 65: 88–97. doi: 10.1016/j.neures.2009.06.003. [PubMed] [CrossRef] [Google Scholar] 132. Кикуно Н., Кавамото К., Хирата Х., Вейдани К., Каваками К., Фандель Т., Нунес Л., Ураками С., Сиина Х., Игава М., Танаго Э., Дахия Р. Фактор роста нервов в сочетании с фактором роста эндотелия сосудов усиливает регенерацию трансплантата бесклеточного матрикса мочевого пузыря в нейрогенном мочевом пузыре крыс, вызванном повреждением спинного мозга. БЖУ Интерн. 2009; 103:1424–1428. doi: 10.1111/j.1464-410X.2008.08129.x. [PubMed] [CrossRef] [Google Scholar] 133.Corey J.M., Lin D.Y., Mycek KB, Chen Q., Samuel S., Feldman EL, Martin D.C. Выровненные электропряденые нановолокна определяют направление роста нейритов ганглиев дорсальных корешков. Дж. Биомед. Матер. Рез. А. 2007; 83А: 636–645. doi: 10.1002/jbm.a.31285. [PubMed] [CrossRef] [Google Scholar]
Матер. Рез. А. 2007; 83А: 636–645. doi: 10.1002/jbm.a.31285. [PubMed] [CrossRef] [Google Scholar]полых органов
СодержаниеВведение
Полые органы составляют половину дихотомии, которую дополняют солидные органы. Проще говоря, первые представляют собой трубы, а вторые — кубы.Неудивительно, что трубка является чрезмерным упрощением, и разговорное описание лучше предлагать как трубки и пакеты. Общим для всех полых органов является анатомическое строение, состоящее из просвета и окружающей его стенки. Просвет может быть либо открытым с обоих концов образца (пробирка), либо закрытым с одного конца (мешок). Трубчатые полые органы тела охватывают желудочно-кишечный тракт и, следовательно, пищевод, желудок, тонкую кишку и толстую кишку. К этому списку можно добавить и гортань. Резекция любого из этих органов даст трубку.К полым органам сумки относятся мочевой пузырь, матка и желчный пузырь. Каждый из них закрыт с одного конца (мочеточники в случае мочевого пузыря и фаллопиевы трубы для мочеточника исключены).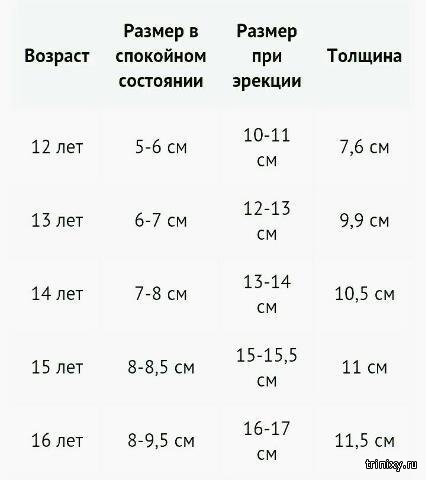 Полые органы тела обычно имеют четыре слоя (изнутри наружу):
Полые органы тела обычно имеют четыре слоя (изнутри наружу):- Слизистая оболочка
- Подслизистая оболочка
- Собственная мускулатура
- Сероза
Поля
Каждый открытый конец полого органа обычно является краем, где хирург должен был сделать надрез, чтобы отделить образец от органов, которые неразрывно связаны с образцом.Таким образом, сегмент тонкой кишки будет иметь два обрезанных конца (аналогично вырезанию отрезка шланга из катушки целиком). В трубчатых органах, таких как тонкая кишка, они известны как продольные края . Напротив, полые органы сумки более сложны. Желчный пузырь имеет только один продольный край — пузырный проток. Другие, такие как матка и мочевой пузырь, имеют только один основной продольный край (соответственно место соединения с влагалищем и уретрой), но также имеют две входные трубы узкого калибра (фаллопиевы трубы и мочеточники).Такие органы, как мочевой пузырь и матка, можно представить как букву Y в отношении их продольных краев. После продольных краев следует более сложное понятие окружного или радиального края и его отличия от поверхности. Полые органы не просто свисают со своих продольных краев внутри полости тела. Вместо этого они имеют некоторое прикрепление либо к соседним органам, либо к стенке полости. Чтобы удалить орган, хирург должен разрезать эти прикрепления.В частности, в случае прикрепления к стенке полости тела термин ножка может использоваться для обозначения этого прикрепления. Кровеносные, лимфатические и нервные сосуды обычно получают доступ к органу через ножку, и, таким образом, ножка обеспечивает не только поддержку, удерживающую орган на месте, но также является каналом для сосудисто-нервного снабжения органа. Эти прикрепления составляют радиальный или окружной край. В случае тонкой кишки этот край образован вершиной брыжейки.Он занимает лишь небольшую часть периметра образца и поэтому может называться радиальным. В отличие от этого, прямая кишка полностью покрыта мезоректальным жиром, и хирург должен сделать надрез по всей окружности этого жира, чтобы удалить прямую кишку.
После продольных краев следует более сложное понятие окружного или радиального края и его отличия от поверхности. Полые органы не просто свисают со своих продольных краев внутри полости тела. Вместо этого они имеют некоторое прикрепление либо к соседним органам, либо к стенке полости. Чтобы удалить орган, хирург должен разрезать эти прикрепления.В частности, в случае прикрепления к стенке полости тела термин ножка может использоваться для обозначения этого прикрепления. Кровеносные, лимфатические и нервные сосуды обычно получают доступ к органу через ножку, и, таким образом, ножка обеспечивает не только поддержку, удерживающую орган на месте, но также является каналом для сосудисто-нервного снабжения органа. Эти прикрепления составляют радиальный или окружной край. В случае тонкой кишки этот край образован вершиной брыжейки.Он занимает лишь небольшую часть периметра образца и поэтому может называться радиальным. В отличие от этого, прямая кишка полностью покрыта мезоректальным жиром, и хирург должен сделать надрез по всей окружности этого жира, чтобы удалить прямую кишку. Таким образом, используется термин окружной край.
Таким образом, используется термин окружной край.| Упрощенный трубчатый полый орган. Ножка показана оранжевым цветом. | Упрощенный мешок для полых органов.Основной продольный край показан зеленым цветом. Входные трубки желтые. |
| Полый орган, окруженный периферическим краем (оранжевый). Ножка выходит на плато по мере приближения к брюшной стенке. Заманчива аналогия с пращой. | Полый орган с радиальным краем. Ножка показана оранжевым цветом. Часть стенки органа, показанная синим цветом, является поверхностью.То, что в зеленом цвете, покрыто ножкой. |
Постановка
Стадирование первичной опухоли по системе TNM в полых органах обычно определяется тем, насколько глубоко через слои стенки органа прорастает опухоль, прорывает ли она поверхность и прорастает ли она в соседние органы. В разных органах могут быть вариации на эту тему, но общий принцип сохраняется. Из этой предпосылки возникает необходимость взять блоки опухоли, которые могут показать эту глубину инвазии.Лимфатические узлы полых органов, как правило, предстают прикрепленными к органу и определяют N-стадию системы TNM. Дополнительные лимфатические узлы также могут быть отправлены в отдельные горшки. Прикрепленные лимфатические узлы обычно содержат объем фиброзно-жировой ткани, и ее необходимо рассечь, чтобы найти лимфатические узлы.
В разных органах могут быть вариации на эту тему, но общий принцип сохраняется. Из этой предпосылки возникает необходимость взять блоки опухоли, которые могут показать эту глубину инвазии.Лимфатические узлы полых органов, как правило, предстают прикрепленными к органу и определяют N-стадию системы TNM. Дополнительные лимфатические узлы также могут быть отправлены в отдельные горшки. Прикрепленные лимфатические узлы обычно содержат объем фиброзно-жировой ткани, и ее необходимо рассечь, чтобы найти лимфатические узлы.| Короткий сегмент толстой кишки был вскрыт в продольном направлении, чтобы обнаружить относительно плоскую опухоль неправильной формы с изъязвлением в середине образца. | То же двоеточие с указанными блоками и полями Синий: опухоль Темно-зеленый: продольные поля Светло-зеленый: расстояние до продольных полей Оранжевый: радиальный (ножковый) край Оранжево-желтый: расстояние до радиального края |
Описание
При описании полого органа можно использовать базовый шаблон. Разные органы будут иметь разные нюансы, но общие принципы останутся.
Разные органы будут иметь разные нюансы, но общие принципы останутся.Трубчатый полый орган
- Длина
- Диаметр или длина окружности (если они несимметричны, укажите два перпендикулярных диаметра)
- Толщина стенки
- Расстояние от верхушки ножки до стенки органа
- Описание фоновой слизистой оболочки и серозной поверхности
- Длина, ширина и толщина опухоли
- Глубина инвазии опухоли через слои стенки
- Расстояние опухоли от продольных краев
- Расстояние от опухоли до радиального/периферического края
Образец представляет собой сегмент пищевода длиной 150 мм и окружностью 25 мм. Толщина стенки 10 мм. Отсутствуют ориентирующие маркеры, позволяющие различать проксимальный и дистальный концы.
Адвентициальная поверхность ничем не примечательна.
На расстоянии 60 мм от одного края и 70 мм от противоположного продольного края расположена изъязвленная опухоль, занимающая примерно половину окружности. Опухоль имеет размеры 20 мм в длину и 15 см в ширину и прорастает на глубину 10 мм.Опухоль, по-видимому, прорастает через собственную мускулатуру в адвентицию и упирается в образец по окружности.
Опухоль имеет размеры 20 мм в длину и 15 см в ширину и прорастает на глубину 10 мм.Опухоль, по-видимому, прорастает через собственную мускулатуру в адвентицию и упирается в образец по окружности.
Пищевод вдали от опухоли без особенностей.
Сумка для полых органов
- Три перпендикулярных диаметра (иногда могут обозначаться как высота, ширина и глубина или другие анатомические обозначения)
- Толщина стенки
- Длина и диаметр входных трубок
- Толщина любой окружающей мягкой ткани
- Описание фоновой слизистой оболочки и серозной поверхности
- Длина, ширина и толщина опухоли
- Глубина инвазии опухоли через слои стенки
- Расстояние опухоли от продольных краев
- Расстояние от опухоли до радиального/периферического края
Образец включает цистэктомию размером 40 мм в высоту, 30 мм в поперечном измерении и 30 мм в переднезаднем измерении. Толщина стенки 5 мм.
Толщина стенки 5 мм.
Прикрепленный правый мочеточник имеет длину 15 мм и диаметр 3 мм. Прикрепленный левый мочеточник имеет длину 20 мм и диаметр 3 мм.
Внешний вид образца ничем не примечателен.
На задней стенке мочевого пузыря внутри треугольника расположена изъязвленная экзофитная опухоль размером 22 мм на 14 мм и толщиной 8 мм.Опухоль ограничена стенкой мочевого пузыря.
Опухоль расположена на расстоянии 11 мм от края уретры, 27 мм от правого края мочеточника, 29 мм от левого края мочеточника и 12 мм от окружного края.
Слизистая оболочка вдали от опухоли без особенностей.
Блокировка
Существуют основные принципы отбора образцов полых органов, которые учитывают большинство блоков, взятых из большинства полых органов. Все продольные поля должны быть отобраны.Обычно это будет блок с лицевой стороны всего поля, но иногда потребуются крестообразные блоки. Блоки опухоли должны позволять определить тип опухоли, глубину ее инвазии через плоскости органа и ее отношение как к периферической анатомической поверхности, так и к периферическому краю (если он имеется). Блоков, которые выполняются для этого, обычно достаточно для оценки других важных параметров, таких как лимфатическая инвазия, сосудистая инвазия, периневральная инвазия и иммуногистохимические свойства.Блок фоновой нормальной ткани полезен для определения наличия какого-либо основного заболевания, предрасполагающего к развитию опухоли.
Блоков, которые выполняются для этого, обычно достаточно для оценки других важных параметров, таких как лимфатическая инвазия, сосудистая инвазия, периневральная инвазия и иммуногистохимические свойства.Блок фоновой нормальной ткани полезен для определения наличия какого-либо основного заболевания, предрасполагающего к развитию опухоли. Биоматериалы для инженерии тканей полых органов | Фиброгенез и восстановление тканей
Cooper DKC. Краткая история межвидовой трансплантации органов. Proc (Бейл Юнив Мед Цент). 2012;25(1):49–57.
Google Scholar
Батлер Дж. Р., Ладовски Дж. М., Мартенс Г. Р., Тектор М., Тектор А. Дж.Специальный выпуск: ксенотрансплантация, последние достижения в области редактирования генома и создания генетически модифицированных свиней. Int J Surg. 2015;23:217–22.
Артикул пабмед Google Scholar

Рирдон С. Новая жизнь трансплантации свиней человеку. 2015 [12.09.15]; Доступно по адресу: http://www.nature.com/news/new-life-for-pig-to-human-transplants-1.18768.
Zhu N, Chen X. Биопроизводство тканевых каркасов. Достижения в области биоматериаловедения и биомедицинских приложений.2013.
Чан Б.П., Леонг К.В. Леса в тканевой инженерии: общие подходы и тканеспецифические соображения. Eur Spine J. 2008;4(4):467–79.
Артикул Google Scholar
Хаббелл Дж.А. Биоматериалы в тканевой инженерии. Природа. 1995;13(6):565–76.
КАС Google Scholar
Атала А., Бауэр С.Б., Сокер С., Ю Дж.Дж., Ретик А.Б.Тканеинженерные аутологичные мочевые пузыри для пациентов, нуждающихся в цистопластике. Ланцет. 2006;367(9518):1241–6.
Артикул пабмед Google Scholar
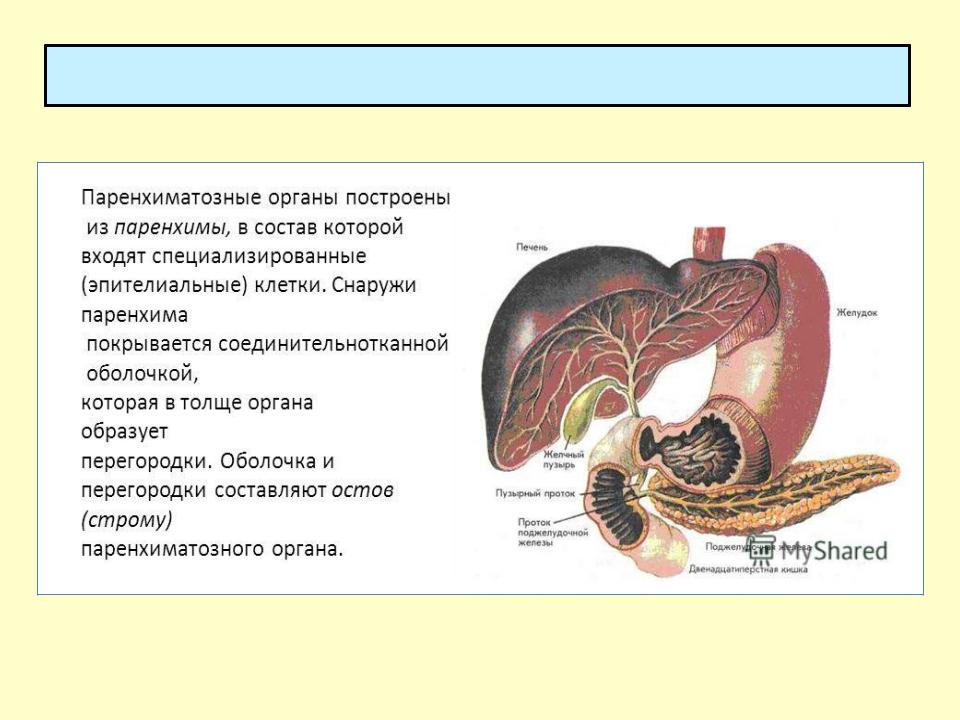
Hamilton NJ, Kanani M, Roebuck DJ, Hewitt RJ, Cetto R, Culme-Seymour EJ, Toll E, Bates AJ, Comerford AP, McLaren CA, Butler CR, Crowley C, McIntyre D, Sebire NJ, Джейнс С.М., О’Каллаган С., Мейсон С., Де Коппи П., Лоуделл М.В., Эллиотт М.Дж., Берчалл М.А. Тканеинженерная замена трахеи у ребенка: последующее 4-летнее исследование.Ам Джей Трансплант. 2015;15(10):2750–7.
КАС Статья пабмед ПабМед Центральный Google Scholar
Macchiarini P, Jungebluth P, Go T, Asnaghi MA, Rees LE, Cogan TA, Dodson A, Martorell J, Bellini S, Parnigotto PP, Dickinson SC, Hollander AP, Mantero S, Conconi MT, Bichall MA . Клиническая трансплантация тканеинженерного воздуховода. Ланцет. 2008;372(9655):2023–30.
Артикул пабмед Google Scholar
Дхандаютхапани Б., Ёсида Ю., Маекава Т., Кумар Д.С. Полимерные каркасы в тканевой инженерии: обзор. Int J Polym Sci. 2011;1-19.
2011;1-19.
Нам Ю.С., Парк Т.Г. Биоразлагаемые полимерные микроячеистые пены модифицированным методом термоиндуцированного фазового разделения. Биоматериалы. 1999; 20 (19) 1783–90.
КАС Статья пабмед Google Scholar
Kaji H. Методы биопроизводства для биологически значимых моделей тканей и устройств доставки лекарств, Micro-NanoMechatronics and Human Science (MHS), 2012 Международный симпозиум.2012.
Google Scholar
Sofokleous P, Stride E, Bonfield W, Edirisinghe M. Дизайн, конструкция и характеристики портативного электрогидродинамического многоигольного распылителя для биомедицинских применений. Mater Sci Eng C. 2013; 33 (1): 213–23.
КАС Статья Google Scholar
Hoch E, Tovar GE, Borchers K. Биопечать искусственных кровеносных сосудов: современные подходы к сложной цели. Eur J Кардио-Торак. 2014;45(5):767–78.
Eur J Кардио-Торак. 2014;45(5):767–78.
Артикул Google Scholar
Ахмед Э.М. Гидрогель: приготовление, характеристика и применение: обзор. J Adv Res. 2015;6(2):105–21.
КАС Статья пабмед ПабМед Центральный Google Scholar
Ulery BD, Nair LS, Laurencin CT. Биомедицинские применения биоразлагаемых полимеров. J Polym Sci B Polym Phys.2011;49(12):823–64.
Артикул Google Scholar
Мартинес-Перес CA, Оливас-Армендарис I, Кармона C, Гарсия-Касильяс PE. Каркасы для тканевой инженерии с помощью термически индуцированного фазового разделения, достижения в области регенеративной медицины. 2011 Доступно по адресу: http://www.intechopen.com/books/advances-in-regenerative-medicine/scaffolds-for-tissue-engineering-via-thermally-induced-phase-separation.
Makadia HK, Siegel SJ. Полимолочно-гликолевая кислота (PLGA) в качестве биоразлагаемого носителя для контролируемой доставки лекарств. Полимеры (Базель). 2011;3(3):1377–97.
Полимолочно-гликолевая кислота (PLGA) в качестве биоразлагаемого носителя для контролируемой доставки лекарств. Полимеры (Базель). 2011;3(3):1377–97.
КАС Статья Google Scholar
You Y, Lee SW, Youk JH, Min BM, Lee SJ, Park WH. Разложение in vitro непористых сверхтонких волокон из поли(гликолевой кислоты)/поли(1-молочной кислоты) и пористых сверхтонких волокон из поли(гликолевой кислоты). Полим Деград Стаб. 2005;90(3):441–8.
КАС Статья Google Scholar
Лам К.Х., Ньювенхейс П., Моленаар И., Эссельбрюгге Х., Фейен Дж., Дейкстра П.Дж., Шакенрад Дж.М. Биодеградация пористых пленок из поли(L-молочной кислоты) по сравнению с непористыми. J Mater Sci Mater Med. 1994;5(4):181–9.
КАС Статья Google Scholar
Nemeno-Guanzon JG, Lee S, Berg JR, Jo YH, Yeo JE, Nam BO, Koh YG, Lee JI.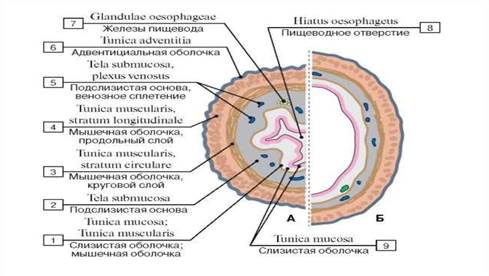 Тенденции тканевой инженерии сосудов. Дж. Биомед Биотехнолог. 2012;2012:956345.
Тенденции тканевой инженерии сосудов. Дж. Биомед Биотехнолог. 2012;2012:956345.
Артикул пабмед ПабМед Центральный Google Scholar
БХФ. Лекарства для вашего сердца. 2015 [12.09.15]; Доступно по адресу: https://www.bhf.org.uk/heart-health/treatments/medication.
Hong KU, Li QH, Guo Y, Patton NS, Moktar A, Bhatnagar A, Bolli R. Высокочувствительный и точный метод количественного определения абсолютного количества c-kit+ сердечных стволовых клеток после трансплантации мышам. Базовый Рез Кардиол. 2013;108:346.
Артикул пабмед ПабМед Центральный Google Scholar
Альбертс Б., Джонсон А., Льюис Дж. и др. Кровеносные сосуды и эндотелиальные клетки, Молекулярная биология клетки, том. 4. Нью-Йорк: Наука о гирляндах; 2002.
Google Scholar
Мелони А.Э. , Спенсер М., Риу Х.Л., Катаре Ф., Мангиаларди Р., Ойкава Г., Родригес-Арабаолаза А., Данг И., Митчелл З., Рени К., Альвино С., Роулинсон В.В., Ливи Дж., Сесселли У., Анджелини Д., Эмануэли Г., Бельтрами С., Мадедду П. Комбинированная интрамиокардиальная доставка перицитов человека и сердечных стволовых клеток дополнительно улучшает заживление инфарктных сердец мышей за счет стимуляции восстановления сосудов и мышц.Цирк Рез. 2015; 116:81–91.
, Спенсер М., Риу Х.Л., Катаре Ф., Мангиаларди Р., Ойкава Г., Родригес-Арабаолаза А., Данг И., Митчелл З., Рени К., Альвино С., Роулинсон В.В., Ливи Дж., Сесселли У., Анджелини Д., Эмануэли Г., Бельтрами С., Мадедду П. Комбинированная интрамиокардиальная доставка перицитов человека и сердечных стволовых клеток дополнительно улучшает заживление инфарктных сердец мышей за счет стимуляции восстановления сосудов и мышц.Цирк Рез. 2015; 116:81–91.
Артикул Google Scholar
Buijtenhuijs P, Buttafoco L, Poot AA, Daamen WF, van Kuppevelt TH, Dijkstra PJ, de Vos RA, Sterk LM, Geelkerken BR, Feijen J, Vermes I. Тканевая инженерия кровеносных сосудов: характеристика гладких -мышечные клетки для культивирования на каркасах на основе коллагена и эластина. Биотехнология Appl Biochem. 2004;39(2):141–9.
КАС Статья пабмед Google Scholar
Скардал А., Чжан Дж. , Прествич Г.Д. Биопечать сосудоподобных конструкций с использованием гиалуроновых гидрогелей, сшитых тетраэдрическими тетракрилатами полиэтиленгликоля. Биоматериалы. 2010;31(24):6373–3681.
, Прествич Г.Д. Биопечать сосудоподобных конструкций с использованием гиалуроновых гидрогелей, сшитых тетраэдрическими тетракрилатами полиэтиленгликоля. Биоматериалы. 2010;31(24):6373–3681.
Артикул Google Scholar
Чжао X, Ирвин С.А., Агравал А., Цао И., Лим П.К., Тан С.Ю., Венкатраман С.С. Субстраты с трехмерным рисунком для биоискусственных кровеносных сосудов — влияние гидрогелей на выровненные клетки на поверхности биоматериала.Акта Биоматер. 2015;26:159–68.
КАС Статья пабмед Google Scholar
Яо Л., Лю Дж., Андреадис СТ. Композитные фибриновые каркасы повышают механическую прочность и сохраняют сократительную способность тканевых кровеносных сосудов. Фарм Рез-Дордр. 2008;25(5):1212–21.
КАС Статья Google Scholar
Сингх Р.К., Селиктар Д., Патнэм А.Дж. Капиллярный морфогенез в гидрогелях ПЭГ-коллаген. Биоматериалы. 2013;34(37):9331–40.
Биоматериалы. 2013;34(37):9331–40.
КАС Статья пабмед ПабМед Центральный Google Scholar
Мун Дж.Дж., Сайк Дж.Е., Поче Р.А. Биомиметические гидрогели с проангиогенными свойствами. Биоматериалы. 2010;31(14):3840–7.
КАС Статья пабмед ПабМед Центральный Google Scholar
Щербины И.М., Якуб М.Х. Гидрогелевые каркасы для тканевой инженерии: прогресс и проблемы.Glob Cardiol Sci Pract. 2013;38:316–42.
Google Scholar
Adair TH, Montani JP. Ангиогенез. Сан-Рафаэль (Калифорния): Morgan & Claypool Publishers; 2010. Доступно по адресу: http://www.ncbi.nlm.nih.gov/books/NBK53242/.
Баутерс С., Асахара Т., Чжэн Л.П., Такешита С., Бантинг С., Феррара Н., Саймс Дж.Ф., Иснер Дж.М. Сайт-специфический терапевтический ангиогенез после системного введения фактора роста эндотелия сосудов.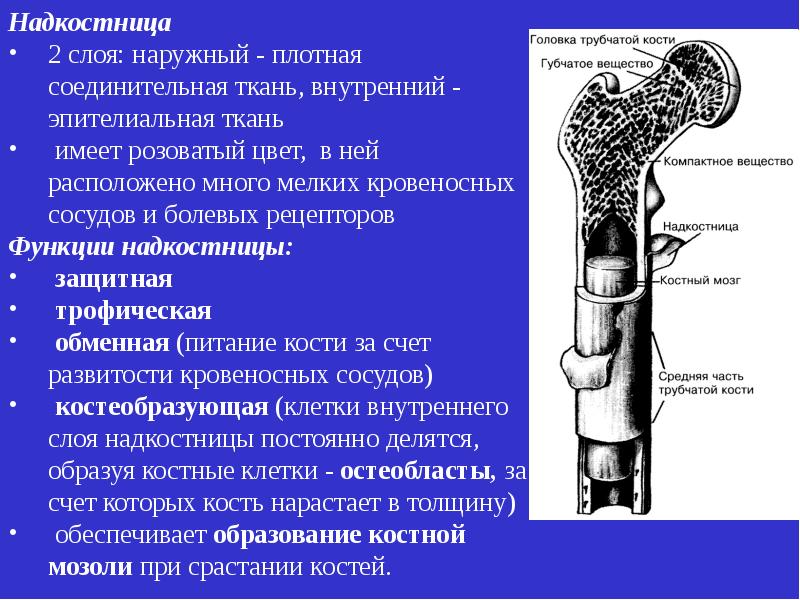 J Vasc Surg. 1995;21(2):314–25.
J Vasc Surg. 1995;21(2):314–25.
КАС Статья пабмед Google Scholar
Бронзино Д.Д., Петерсон Д.Р. Тканевая инженерия и искусственный орган, т. 1, с. 4. Broken Sound Parkway (северо-запад): Тейлор и Фрэнсис; 2006 г. Доступно по адресу: https://www.crcpress.com/Tissue-Engineering-and-Artificial-Organs/Bronzino-Peterson-Bronzino/9780849321238#googlePreviewContainer.
Койке Н., Фукумура Д., Гралла О., Ау П., Шехнер Дж.С., Джейн Р.К.Создание долгоживущих кровеносных сосудов. Природа. 2004; 428 (6979): 138–9.
КАС Статья пабмед Google Scholar
Rocha FG, Sundback CA, Krebs NJ, Leach JK, Mooney DJ, Ashley SW, Vacanti JP, Whang EE. Влияние устойчивой доставки фактора роста эндотелия сосудов на ангиогенез в тканевой инженерии кишечника. Биоматериалы. 2008;29(19):2884–90.
КАС Статья пабмед ПабМед Центральный Google Scholar
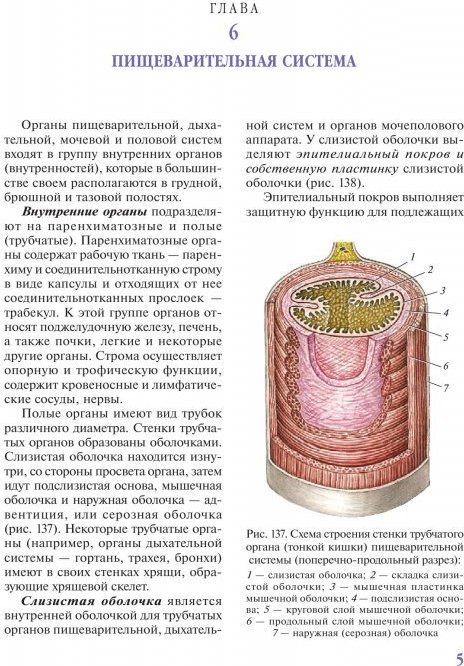
Chen J, Zhang ZG, Li Y, Wang L, Xian Xu Y, Gautam SC, Lu M, Zhu Z, Chopp M. Внутривенное введение стромальных клеток костного мозга человека вызывает ангиогенез в пограничной зоне ишемии после инсульта у крыс. Цирк Рез. 2003; 92: 692–9.
КАС Статья пабмед Google Scholar
UK, CR Статистика смертности от рака желудка. Статистика рака 2014 [12.09.15]; Доступно по адресу: http://www.cancerresearchuk.org/health-professional/cancer-statistics/statistics-by-cancer-type/stomach-cancer/mortality#heading-Zero.
Society, A.C. Выбор лечения в зависимости от типа и стадии рака желудка. 2015 [12.10.15]; Доступно по адресу: http://www.cancer.org/cancer/stomachcancer/detailedguide/stomach-cancer-treating-by-stage.
Отман Р., Моррис Г.Э., Шах Д.А., Холл С., Холл Г., Уэллс К., Шакешев К.М., Диксон Д.Э. Стратегия автоматизированного производства для создания узорчатых трубчатых архитектур на уровне клеток и тканей.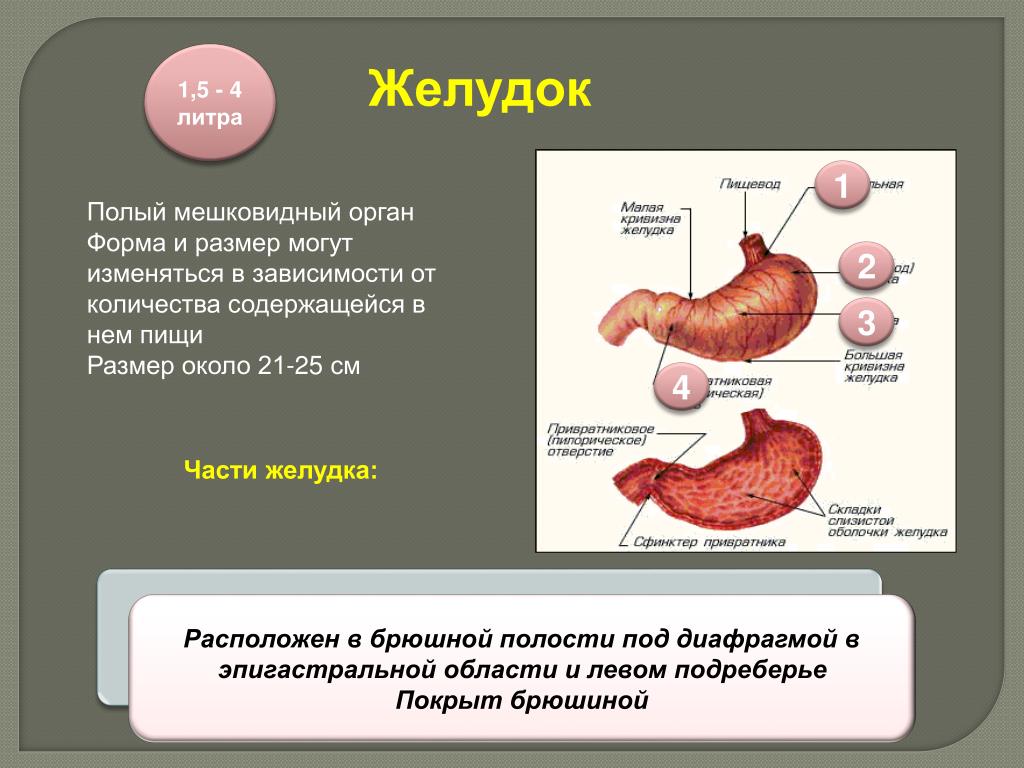 Биофабрикация. 2015;7(2):025003.
Биофабрикация. 2015;7(2):025003.
Артикул пабмед Google Scholar
Маэмура Т., Шин М., Киношита М. и др. Тканеинженерный желудок демонстрирует наличие протонного насоса и G-клеток на модели крысы, что приводит к уменьшению анемии после тотальной гастрэктомии. Артиф Органы. 2008;32(3):234–9.
Артикул пабмед Google Scholar
Маэмура Т., Киношита М., Шин М. и др. Оценка тканеинженерной заплаты на стенке желудка на крысиной модели. Артиф Органы. 2012;36(4):409–17.
КАС Статья пабмед Google Scholar
Сала Ф.Г., Кунисаки С.М., Очоа Э.Р. и др. Тонкая кишка и желудок с тканевой инженерией формируются из аутологичной ткани на доклинической модели крупного животного. J Surg Res. 2009;156(2):205–12.
Артикул пабмед Google Scholar
Гастроэнтерология, B.S.o. Неотложная помощь — воспалительное заболевание кишечника. 2009 [15.01.16]; Доступно по адресу: http://www.bsg.org.uk/clinical/commissioning-report/acute-воспалительный-кишечник-disease.html.
NHS. Inflammatory bowel disease 2015 [15/01/16]; Available at: http://www.nhs.uk/conditions/Inflammatory-bowel-disease/Pages/Introduction.aspx.
NHS. Ulcerative colitis—treatment 2014 [15/01/16]; Available at: http://www.nhs.uk/Conditions/Ulcerative-colitis/Pages/Treatment.aspx.
Nakase Y, Hagiwara A, Nakamura T, Kin S, Nakashima S, Yoshikawa T, Fukuda K, Kuriu Y, Miyagawa K, Sakakura C, Otsuji E, Shimizu Y, Ikada Y, Yamagishi H.Тканевая инженерия ткани тонкой кишки с использованием коллагеновых губчатых каркасов, засеянных гладкомышечными клетками. Ткань англ. 2006;12(2):403–12.
КАС Статья пабмед Google Scholar
Lee M, Wu BM, Stelzner M, Reichardt HM, Dunn JC. Поддержание гладкомышечных клеток кишечника основным фактором роста фибробластов. Tissue Eng, часть A. 2008; 14 (8): 1395–402.
КАС Статья пабмед Google Scholar
Битар К.Н., Рагхаван С. Инженерия тканей кишечника: современные концепции и будущее видение регенеративной медицины в кишечнике. Нейрогастроэнтерол Мотил. 2012;24(1):7–9.
КАС Статья пабмед ПабМед Центральный Google Scholar
Grikscheit TC, Siddique A, Ochoa ER, et al. Тканеинженерная тонкая кишка улучшает восстановление после массивной резекции тонкой кишки. Энн Сург. 2004; 240(5):748–54.
Артикул пабмед ПабМед Центральный Google Scholar
Чен М.К., Бадылак С.Ф. Тканевая инженерия тонкой кишки с использованием подслизистой оболочки тонкой кишки в качестве каркаса. J Surg Res. 2001;99(2):352–8.
КАС Статья пабмед Google Scholar
Битар К.Н., Захем Э. Тканевая инженерия и регенеративная медицина применительно к желудочно-кишечному тракту. Курр Опин Биотехнолог. 2013;24(5):909–15.
КАС Статья пабмед ПабМед Центральный Google Scholar
Захем Э., Рагхаван С., Гилмонт Р.Р., Битар К.Н. Каркасы на основе хитозана для поддержки конструкций гладких мышц в тканевой инженерии кишечника. Биоматериалы. 2012;33:4810–7.
КАС Статья пабмед ПабМед Центральный Google Scholar
Росси К.А., Поззобон М., Де Коппи П. Достижения в инженерии костно-мышечной ткани: переход к терапии. Органогенез. 2010;6(6):167–72.
Артикул пабмед ПабМед Центральный Google Scholar
Нарушения, I.F.f.F.G. Распространенность недержания кишечника. 2014 [12.09.15]; Доступно по адресу: http://www.aboutincontinence.org/site/what-is-incontinence/prevalence/.
Hunskaar, S., Lose, et al. Распространенность стрессового недержания мочи у женщин в четырех европейских странах. 2003 [12.09.15]; Доступно по адресу: http://www.icsoffice.org/publications/2002/pdf/257.pdf.
Герхард В.А. Типы эндокринных клеток желудочно-кишечного тракта и поджелудочной железы рептилии (Bitis arietans): иммуноцитохимическое исследование.1986: Университет Витватерсранда, 1986. Машинопись (фотокопия).
Thakar R, Sultan AH. Лечение акушерских травм анального сфинктера. Акушер-гинеколог. 2003;5(2):72–8.
Артикул Google Scholar
Пармар Н., Кумар Л., Эммануэль А., Дэй РМ. Перспективные регенеративные методы лечения недержания кала, вызванного акушерской травмой. Реген Мед. 2014;9(6):831–40.
КАС Статья пабмед Google Scholar
Knight T, Basu J, Rivera EA, Spencer T, Jain D, Payne R. Изготовление многослойного трехмерного каркаса с контролируемой пористой микроархитектурой для применения в тканевой инженерии тонкой кишки. Сотовый АдхМигр. 2013;3:267.
Google Scholar
Килиан К.А., Бугария Б., Лан Б.Т., Мрксич М. Геометрические сигналы для управления дифференцировкой мезенхимальных стволовых клеток. Proc Natl Acad Sci U S A. 2010;107(11):4872–7.
КАС Статья пабмед ПабМед Центральный Google Scholar
Ши Л.Б., Цай Х.С., Чен Л.К., Ву И., Чжу С.А., Гонг С.Н., Ся Ю.С., Оуян Х.В., Цзоу Х.Х. Тканеинженерный наполнитель со стволовыми клетками жировой ткани и микросферами фиброина шелка для лечения дефицита внутреннего уретрального сфинктера. Биоматериалы. 2014;35(5):1519–30.
КАС Статья пабмед Google Scholar
Клаузер А., Фраушер Ф., Штрассер Х., Хельвег Г., Колле Д., Штромейер Д. Возрастная функция рабдосфинктера при стрессовом недержании мочи у женщин: оценка интрауретральной сонографии. J УЗИ Мед. 2004;23(5):631–637.
ПабМед Google Scholar
Welkoborsky HJ, Hinni ML, Moebius H, Bauer L, Ostertag H. Микроскопическое исследование ятрогенного подсвязочного стеноза трахеи: наблюдения, которые могут пролить свет на его гистопатологическое происхождение.Энн Отол Ринол Ларингол. 2014;123(1):25–31.
Артикул пабмед Google Scholar
Хайкал С., Сална М., Уодделл Т.К., Хофер С.О. Успехи в реконструкции трахеи. Plast Reconstr Surg Glob Open. 2014;2(7):e178.
Артикул пабмед ПабМед Центральный Google Scholar
Номото Ю., Сузуки Т., Тада Ю., Кобаяши К., Мияке М., Хазама А., Вада И., Канемару С., Накамура Т., Омори К.Тканевая инженерия для регенерации эпителия трахеи. Энн Отол Ринол Ларингол. 2006;115(7):501–6.
Артикул пабмед Google Scholar
Hong HJ, Lee JS, Choi JW, Min BH, Lee HB, Kim CH. Трансплантация аутологичных хондроцитов, высеянных на композитный гель фибрин/гиалуронан, в дефекты хряща трахеи у кроликов: предварительные результаты. Артиф Органы. 2012;36(11):998–1006.
КАС Статья пабмед Google Scholar
Sutherland RS, Baskin LS, Hayward SW, Cunha GR. Регенерация уротелия мочевого пузыря, гладкой мускулатуры, кровеносных сосудов и нервов в матрикс бесклеточной ткани. Дж Урол. 1996;156(2):571–7.
КАС Статья пабмед Google Scholar
Walles T. Биоискусственные трансплантаты трахеи: сможет ли тканевая инженерия сдержать свое обещание? Эксперт Rev Med Devices. 2004;1(2):241–50.
Артикул пабмед Google Scholar
Shi H, Xu Z, Qin X, Zhao X, Lu D. Экспериментальное исследование замещения периферических дефектов трахеи новым протезом. Энн Торак Серг. 2005;79(2):672–6.
Артикул пабмед Google Scholar
Линь Ч., Хсу С.Х., Су Дж.М. Модификация поверхности пористых каркасов из поли(эпсилон-капролактона) с использованием желатинового гидрогеля в качестве замены трахеи. J Tissue Eng Regen M. 2011; 5 (2): 156–62.
КАС Статья Google Scholar
Tatekawa Y, Kawazoe N, Chen GP, Shirasaki Y, Komuro H, Kaneki M. Восстановление дефекта трахеи с использованием гибридного каркаса PLGA-коллагена, армированного сополимерным стентом с желатиновым гидрогелем, пропитанным bFGF. Pediatr Surg Int. 2010;26(6):575–80.
Артикул пабмед Google Scholar
Zang M, Zhang Q, Chang EI, Mathur AB, Yu P. Децеллюляризованный матрикс трахеи для тканевой инженерии. Plast Reconstr Surg. 2012;130(3):532–40.
КАС Статья пабмед Google Scholar
Гонсалес-Молина Дж., Риглер Дж., Саутерн П., Ортега Д., Франгос К.С., Ангелопулос И., Хусейн С., Литгоу М.Ф., Панкхерст К.А., Дэй Р.М. Быстрая доставка магнитных клеток для больших трубчатых биоинженерных конструкций. Интерфейс JR Soc. 2012;9(76):3008–16.
КАС Статья пабмед ПабМед Центральный Google Scholar
Park JH, Hong JM, Ju YM, Jung JW, Kang HW, Lee SJ, Yoo JJ, Kim SW, Kim SH, Cho DW. Новая тканевая инженерия трахеи с механическим поведением, сходным с нативной трахеей. Биоматериалы. 2015;62:106–15.
КАС Статья пабмед Google Scholar
Гольдштейн Т.А., Смит Б.Д., Зельцман Д., Гранде Д., Смит Л.П. Представляем тканеинженерный трансплантат с трехмерной печатью для реконструкции дыхательных путей: пилотное исследование. Отоларингол Head Neck Surg.2015;153(6):1001–6.
Артикул пабмед Google Scholar
Zhao DE, Li RB, Liu WY, et al. Тканеинженерный сердечный клапан на каркасе бесклеточного аортального клапана: исследование in vivo. Кардиоваскулярная грудная клетка Энн. 2003;11(2):153–156.
Артикул Google Scholar
Пархизкар М и др. Новое приготовление каркасов с контролируемой пористостью, загруженных частицами/волокнами, с использованием гибридной микрожидкостной и электрогидродинамической техники.Биофабрикация. 2014;6(14):045010.
Артикул пабмед Google Scholar
Блейкер Дж.Дж., Ноулз Дж.К., Дэй Р.М. Новые методы изготовления микросфер путем термически индуцированного фазового разделения для тканевой инженерии и доставки лекарств. Акта Биоматериалы. 2008;4(2):264–72.
КАС Статья Google Scholar
Park JH, Hong JM, Ju YM, Jung JW, Kang HW, Lee SJ, Yoo JJ, Kim SW, Kim SH, Cho DW, Новая тканеинженерная трахея с механическим поведением, аналогичным естественной трахее .Биоматериалы. 2015;62:106–15.
КАС Статья пабмед Google Scholar
Доши Дж., Ренекер Д.Х. Процесс электропрядения и применение электропряденых волокон. Дж Электрон. 1995;35(2):1698–1703.
Google Scholar
Желудок
Нажмите, чтобы просмотреть большое изображение
Продолжение сверху…Анатомия желудка
Общая анатомия
Желудок представляет собой округлый полый орган, расположенный чуть ниже диафрагмы в левой части брюшной полости. Расположенный между пищеводом и двенадцатиперстной кишкой, желудок представляет собой примерно серповидное расширение желудочно-кишечного тракта. Внутренний слой желудка полон складок, известных как морщины (или желудочные складки). Руги позволяют желудку растягиваться, чтобы вместить большие порции, и помогают захватывать и перемещать пищу во время пищеварения.
В зависимости от формы и функции желудок можно разделить на четыре области:
- Пищевод соединяется с желудком в небольшой области, называемой кардией . Кардия представляет собой узкую трубчатую область, которая открывается в более широкие области желудка. Внутри кардии находится нижний пищеводный сфинктер, полоса мышечной ткани, которая сокращается, чтобы удерживать пищу и кислоту внутри желудка.
- Кардия впадает в тело желудка, которое образует центральную и самую большую область желудка.
- Над телом находится куполообразная область, известная как глазное дно .
- Ниже тела находится воронкообразная область, известная как привратник . Привратник соединяет желудок с двенадцатиперстной кишкой и содержит сфинктер привратника. Пилорический сфинктер контролирует поток частично переваренной пищи (известной как химус ) из желудка в двенадцатиперстную кишку.
Микроскопическая анатомия
Микроскопический анализ структуры желудка показывает, что он состоит из нескольких отдельных слоев ткани: слизистой, подслизистой, мышечной и серозной.
Слизистая оболочка
Самый внутренний слой желудка известен как слизистая оболочка и состоит из слизистой оболочки. Слизистая оболочка желудка содержит ткань простого цилиндрического эпителия с множеством экзокринных клеток. Небольшие поры, называемые желудочными ямками, содержат множество экзокринных клеток, которые выделяют пищеварительные ферменты и соляную кислоту в просвет или полую область желудка. Слизистые клетки, обнаруженные в слизистой оболочке желудка и желудочных ямках, выделяют слизь для защиты желудка от собственных пищеварительных выделений.Слизистая оболочка желудка значительно толще слизистой оболочки других органов желудочно-кишечного тракта за счет глубины желудочных ямок.
Глубоко внутри слизистой оболочки находится тонкий слой гладких мышц, известный как мышечная слизистая оболочка. Мышечный слой слизистой оболочки позволяет слизистой образовывать складки и увеличивать ее контакт с содержимым желудка.
Подслизистая основа
Слизистая оболочка окружена подслизистой оболочкой слоя желудка. Подслизистая оболочка состоит из различных соединительных тканей, кровеносных сосудов и нервов.Соединительные ткани поддерживают ткани слизистой оболочки и соединяют ее с мышечным слоем. Кровоснабжение подслизистой оболочки обеспечивает питание стенок желудка. Нервная ткань в подслизистой основе следит за содержимым желудка и контролирует сокращение гладких мышц и секрецию пищеварительных веществ.
Мышечный
Мышечный слой желудка окружает подслизистую оболочку и составляет большую часть массы желудка. Мышечная оболочка состоит из трех слоев гладкой мышечной ткани, волокна которой расположены в трех разных направлениях.Эти слои гладкой мускулатуры позволяют желудку сокращаться, перемешивая и продвигая пищу по пищеварительному тракту.
Сероза
Самый наружный слой желудка, окружающий мышечный слой, представляет собой серозную оболочку — тонкую серозную оболочку, состоящую из простого плоского эпителия и ареолярной соединительной ткани. Серозная оболочка имеет гладкую скользкую поверхность и выделяет жидкий водянистый секрет, известный как серозная жидкость. Гладкая, влажная поверхность серозной оболочки помогает защитить желудок от трения, когда он расширяется вместе с пищей и движется, перемешивая и продвигая пищу.
Физиология желудка
Хранение
Во рту мы пережевываем и смачиваем твердую пищу до тех пор, пока она не превратится в небольшую массу, известную как болюс . Когда мы проглатываем каждый болюс, он затем проходит через пищевод в желудок, где хранится вместе с другими болюсами и жидкостями из той же еды.
Размер желудка варьируется от человека к человеку, но в среднем он может комфортно вместить 1-2 литра пищи и жидкости во время еды. При максимальном растяжении из-за обильной еды или переедания желудок может вмещать до 3-4 литров.Вздутие желудка до максимального размера затрудняет пищеварение, так как желудок не может легко сокращаться для правильного перемешивания пищи и приводит к ощущению дискомфорта.
После того, как желудок был заполнен пищей из еды, он сохраняет пищу в течение примерно 1-2 часов. В это время желудок продолжает процесс пищеварения, который начался во рту, и позволяет кишечнику, поджелудочной железе, желчному пузырю и печени подготовиться к завершению процесса пищеварения.
Пилорический сфинктер, расположенный в нижнем отделе желудка, контролирует продвижение пищи в кишечник.Пилорический сфинктер обычно закрыт, чтобы удерживать пищу и желудочные выделения в желудке. Когда химус готов покинуть желудок, сфинктер привратника открывается, позволяя небольшому количеству химуса пройти в двенадцатиперстную кишку. Этот процесс, известный как опорожнение желудка , медленно повторяется в течение 1-2 часов, пока пища хранится в желудке. Медленная скорость опорожнения желудка помогает распределить объем химуса, высвобождаемого из желудка, и максимизирует переваривание и всасывание питательных веществ в кишечнике.
Секрет
Желудок производит и выделяет несколько важных веществ для контроля переваривания пищи. Каждое из этих веществ вырабатывается экзокринными или эндокринными клетками слизистой оболочки.
- Основным экзокринным продуктом желудка является желудочный сок — смесь слизи, соляной кислоты и пищеварительных ферментов. Желудочный сок смешивается с пищей в желудке, чтобы способствовать пищеварению.
- Специализированные экзокринные клетки слизистой оболочки, известные как слизистые клетки, секретируют слизь в просвет желудка и в желудочные ямки.Эта слизь распространяется по поверхности слизистой оболочки, покрывая слизистую оболочку желудка толстым, кислото- и ферментоустойчивым барьером. Слизь желудка также богата ионами бикарбоната, которые нейтрализуют кислотность желудочного сока.
- Париетальные клетки, обнаруженные в желудочных ямках желудка, производят 2 важных секрета: внутренний фактор и соляную кислоту. Внутренний фактор представляет собой гликопротеин, который связывается с витамином B 12 в желудке и позволяет витамину всасываться в тонком кишечнике.Витамин B 12 является важным питательным веществом для образования эритроцитов. Соляная кислота защищает организм, уничтожая болезнетворные бактерии, естественным образом содержащиеся в пищевых продуктах. Соляная кислота также помогает переваривать белки, денатурируя их в развернутую форму, которую легче переваривать ферментам. Фермент пепсин, расщепляющий белки, активируется под воздействием соляной кислоты внутри желудка. Клетки
- Chief, также обнаруженные в желудочных ямках, вырабатывают два пищеварительных фермента: пепсиноген и желудочную липазу. Пепсиноген является молекулой-предшественником очень мощного фермента пепсина, расщепляющего белки. Поскольку пепсин разрушил бы главные клетки, которые его производят, он секретируется в неактивной форме пепсиногена. Когда пепсиноген достигает кислого pH, характерного для желудка, благодаря соляной кислоте, он меняет форму и становится активным ферментом пепсином. Затем пепсин расщепляет пищевые белки на строительные блоки аминокислот. Желудочная липаза представляет собой фермент, расщепляющий жиры путем удаления жирной кислоты из молекулы триглицеридов. Клетки
- G представляют собой эндокринные клетки, находящиеся на дне желудочных ямок. G-клетки выделяют гормон гастрин в кровоток в ответ на многие раздражители, такие как сигналы от блуждающего нерва; наличие в желудке аминокислот из переваренных белков; растяжение стенки желудка во время еды. Гастрин проходит через кровь к различным рецепторным клеткам по всему желудку, где он стимулирует железы и мышцы желудка. Стимуляция желез гастрином приводит к увеличению секреции желудочного сока для улучшения пищеварения.Стимуляция гладких мышц гастрином приводит к более сильным сокращениям желудка и открытию пилорического сфинктера для продвижения пищи в двенадцатиперстную кишку. Гастрин также связывается с рецепторными клетками поджелудочной железы и желчного пузыря, где он увеличивает секрецию панкреатического сока и желчи.
Переваривание
Пищеварение в желудке можно разделить на 2 класса: механическое пищеварение и химическое пищеварение. Механическое пищеварение — это физическое разделение массы пищи на более мелкие массы, тогда как химическое пищеварение — это химическое превращение более крупных молекул в более мелкие.
- Перемешивание стенок желудка позволяет механическому пищеварению происходить в желудке. Гладкие мышцы желудка производят сокращения, известные как волны смешивания, которые смешивают комки пищи с желудочным соком. Это смешивание приводит к образованию густой жидкости, известной как химус.
- В то время как пища физически смешивается с желудочным соком для образования химуса, ферменты, присутствующие в желудочном соке, химически расщепляют большие молекулы на их более мелкие субъединицы.Желудочная липаза расщепляет триглицеридные жиры на жирные кислоты и диглицериды. Пепсин расщепляет белки на более мелкие аминокислоты. Химическое переваривание, начатое в желудке, не завершится, пока химус не достигнет кишечника, но желудок готовит трудноперевариваемые белки и жиры для дальнейшего переваривания.
Гормональный контроль
Деятельность желудка находится под контролем нескольких гормонов, которые регулируют выработку желудочной кислоты и выделение пищи в двенадцатиперстную кишку.
- Гастрин , вырабатываемый G-клетками самого желудка, увеличивает активность желудка, стимулируя повышенную выработку желудочного сока, сокращение мышц и опорожнение желудка через сфинктер привратника.
- Холецистокинин (ХЦК) , вырабатываемый слизистой оболочкой двенадцатиперстной кишки, представляет собой гормон, замедляющий опорожнение желудка за счет сокращения пилорического сфинктера. CCK высвобождается в ответ на пищу, богатую белками и жирами, которые организму трудно переваривать.Ингибируя опорожнение желудка, CCK позволяет пище дольше храниться в желудке, что способствует улучшению пищеварения в желудке и дает время поджелудочной железе и желчному пузырю высвобождать ферменты и желчь для улучшения пищеварения в двенадцатиперстной кишке.
- Секретин , другой гормон, вырабатываемый слизистой оболочкой двенадцатиперстной кишки, реагирует на кислотность химуса, поступающего в двенадцатиперстную кишку из желудка. Секретин проходит через кровоток в желудок, где замедляет выработку желудочного сока экзокринными железами слизистой оболочки.Секретин также способствует выработке панкреатического сока и желчи, содержащих нейтрализующие кислоту ионы бикарбоната. Чистый эффект секретина заключается в защите кишечника от повреждающего действия кислого химуса.
Гистология в SIU, желудочно-кишечный тракт
Гистология в SIU, желудочно-кишечный трактИсследование Руководство
Гистология
Желудочно-кишечная системаSAQ — Вопросы и слайды доступны для самооценка (и углубленное обучение).
Слои тканей желудочно-кишечного тракта
Желудочно-кишечный тракт представляет собой трубку, идущую от полости рта к анус. Эта трубка состоит из четырех отдельных слоев, достаточно постоянны на всем протяжении. (Нажмите на ссылку для подробнее или прокрутите вниз.)
Предупреждение: Условия такие как внутри и снаружи могут сбивать с толку, когда используется для описания трубчатых органов.Контекст имеет решающее значение. Чаще всего, внутри относится к просвету органа, а снаружи относится к части, наиболее удаленной от просвета (т. е. наиболее глубоко внутри тело). Однако это использование часто переворачивается, когда речь идет о эпителий слизистой оболочки, так что снаружи относится к апикальной поверхности эпителия, в то время как внутри относится к базальной соединительной ткани боковая сторона.
Менее двусмысленны «правильные» термины адлюминал ( в сторону просвет) и аблюминальный ( в сторону от просвет). К сожалению, эти собственные термины так похожи на один другой как в написании, так и в произношении, что их тоже легко спутать (и поэтому используется редко).
Исходя изнутри (т.е. ab люминально из просвета):
- Слизистая оболочка — самая внутренняя слой (ближайший к просвету), мягкая, рыхлая выстилка тракта, состоящая эпителия, собственной пластинки, и мышечной оболочки слизистых оболочек.
- Подслизистая оболочка — соединительная ткань, поддерживающая (снаружи, вглубь) слизистую оболочку.
- Наружная мускулатура — мышечная стенка тракта, окружающая (снаружи, вглубь) подслизистую оболочку.
- Адвентиция / серозная оболочка — самый наружный слой (самый глубокий, самый дальний от просвета) называется либо адвентицией (в областях, где трубка проходит через стенку тела) или серозная оболочка (в местах прохождения трубки через полости тела).
Примеры:
слизистая оболочка — внутренний слой любого полого органа, выстланного эпителием. (например, рот, кишечник, матка, трахея, мочевой пузырь и т. д.). Слизистая оболочка состоит самого эпителия, а также поддерживающей рыхлой соединительная ткань, называемая собственной пластинкой, сразу под эпителием. Более глубокая соединительная ткань, поддерживающая слизистую оболочку. называется подслизистой оболочкой.В ЖКТ (но не в других трубчатых органах), имеется тонкий слой гладкой мускулатуры, musculis mucosae, на границе слизистой оболочки и подслизистой оболочки.
Слизистая оболочка является наиболее высокодифференцированной слой ЖКТ. Специализация тканей и форма поверхности коррелируют с функциональной дифференциацией по ходу тракта.
Оральный полость — Эпителий защитный (многослойный чешуйчатый, частично ороговевший на деснах и твердом небе и на нитевидных сосочках языка неороговевающие в другом месте).Lamina propria неспециализирована. Мышечная оболочка слизистой отсутствует.
Пищевод — Эпителий защитный (многослойный плоский, неороговевающий). Lamina propria неспециализирована. мускулистый слизистая оболочка состоит из рассеянных пучков продольных мышц волокна.
Желудок — Слизистая оболочка желудка специализируется на выработке пищеварительной кислоты и ферменты. Поверхность слизистой из одностолбчатого эпителия состоит из клеток, секретирующих слизь, для защиты от самопереваривание.Основную часть этой толстой слизистой оболочки занимают секретирующие кислоту клетки и клетки, секретирующие ферменты, представляют собой плотно упакованные железы в слизистой оболочке желудка. Ламина propria незаметна, заполняя промежутки между трубчатыми желудочные железы. Muscularis mucosae тонкая.
Маленький кишечник — Слизистая оболочка кишечника специализируется на всасывании питательных веществ и поэтому является нежным и уязвимым.Простой столбец эпителий состоит из абсорбирующих клетки (энтероциты) с рассеянными бокаловидными клетки (которые выделяют слизь для смазки). Площадь поверхности значительно увеличивается за счет выпячивания ворсинок. Инвагинирующие склепы содержат стволовые клетки для постоянного пополнения эпителия. Ламина propria занимает сердцевину ворсинок, покрывает крипты и включает многочисленные иммунные клетки. Гладкие мышечные волокна могут переходить в ворсинки.Muscularis mucosae тонкая.
Приложение — Слизистая похожа на слизистую толстой кишки, но с большей лимфоидная ткань. Поглощающий и секреторный эпителий (простая столбчатая) имеет форму крипт (без ворсинок). Lamina propria окружает склепы и содержит множество лимфатических узлов. мускулистый слизистая тонкая.
Двоеточие (и прямая кишка) — Всасывающие и секреторные эпителий (простой столбчатый) имеет форму крипт (без ворсинок).Собственная пластинка окружает крипты (т. е. заполняет промежутки между ними). мускулистый слизистая тонкая.
Анальный канал — Эпителий защитный (неороговевающий ороговевающий плоскоклеточный) с переходом на эпидермис (кератинизированный). Lamina propria неспециализирована. с переходом в дерму. Muscularis mucosae заканчивается на ректо-анальном переходе.
Гистология всего желудочно-кишечного тракта в основном представляет собой гистологию из эпителиальных тканей .
Щелкните здесь, чтобы ознакомиться с основными введения в эпителиальную ткань.
Эпителий слизистой оболочки выстилает всю длину желудочно-кишечного тракта. То Эпителий слизистой оболочки высоко дифференцирован по нескольким участкам. желудочно-кишечного тракта. На верхнем и нижнем концах тракта эпителий защитный, многослойный чешуйчатый .
Этот защитный эпителий частично ороговевает на на твердом небе и деснах и на кончиках нитевидных сосочков языка.В других местах ротовой полости, пищевода, и анального канала эпителий неороговевает.
Вдоль слизистой оболочки желудка, мелкие кишка и толстая кишка, эпителий простой столбчатый .
Каждый регион содержит определенные специализированные типы клеток, которые адаптированы для выполнения характерных для региона функции секреции и всасывания.
Нажмите здесь для ознакомления обзор эпителиальной ткани.
Lamina propria – рыхлая соединительная ткань слизистой оболочки. Собственная пластинка пластинки поддерживает нежный эпителий слизистой оболочки, позволяет эпителию свободно перемещаться по отношению к более глубоким структурам, и обеспечивает иммунную защиту. По сравнению с другими рыхлыми соединительная ткань, lamina propria относительно клеточная. Это получил название «соединительная ткань с лимфатическими тенденции».(Примеры собственной пластинки)
Поскольку эпителий слизистой оболочки относительно нежный и уязвимый (т. легко разрушается потенциальными вторгающимися микроорганизмами по сравнению с эпидермисом), lamina propria содержит многочисленные клетки с иммунными функцию обеспечения эффективной вторичной линии обороны.
В рассеянные участки вдоль тракта, lamina propria могут быть сильно инфильтрированы с лимфоцитами и могут включать лимфатические узлы (я.д., зародышевые центры, где пролиферируют лимфоциты). Такие сайты особенно характерны для миндалин, Пейеровы бляшки (в подвздошной кишке) и аппендикс, но может возникнуть где угодно.
Скопления лимфоидной ткани могут напоминать воспаление (например, слизистая оболочка хронически воспаленная толстая кишка может напоминать нормальный аппендикс).
Lamina propria содержит большинство элементов обычной соединительной ткани.
- Собственная пластинка пластинки обычно не такая волокнистая, как более глубокая соединительная ткань подслизистой основы.
- Lamina propria имеет относительно высокую долю лимфоцитов. и другие иммунные клетки.
- Lamina propria практически не имеет жировых клеток.
- Lamina propria включает богатое русло капилляров.
(Капилляры обычно незаметны в стандартных гистологических препаратах, но хорошо отображаются на изображении (миниатюра справа) сосудистого препарата слизистой оболочки желудка.)- В тонкой кишке собственная пластинка ворсинок включает млечные (лимфатические капилляры).
- Собственная пластинка кишечных ворсинок может включать гладкие мышечные волокна.
В устной форме полости и пищевода, собственная пластинка располагается непосредственно под многослойным плоским эпителием. Собственная пластинка под таким защитным эпителием обычно меньше клеток (меньше лимфоцитов) чем в другом месте.
Где эпителий слизистой оболочки сильно выбухает (например, кишечные ворсинки) или инвагинированные (кишечные крипты), расположение собственной пластинки «под» количеством эпителия к заполнению между близлежащими эпителиальными поверхностями (т. е. окружающими каждую крипту, внутри каждой ворсинки).
Где эпителиальные инвагинации плотно упакованы (например, желудочные железы желудка), lamina propria может быть относительно незаметной.
muscosae mucosae представляет собой тонкий слой гладких мышц на границе между слизистой оболочкой и подслизистой оболочкой. Это происходит по всему желудочно-кишечному тракту от пищевода в прямую кишку. Наиболее толстый в пищеводе, где он состоит из относительно заметных пучков продольных мышечных волокон. Слизистая оболочка muscosae тоньше в остальной части тракта (желудок, тонкая кишка, толстая кишка), хотя он содержит как кольцевые, так и продольные волокна.
Поскольку гладкие мышцы и коллаген имеют несколько сходный внешний вид (эозинофильные волокна с рассеянными удлиненными ядрами), может потребоваться особое внимание, чтобы заметить слизистую мускулатуры.
Функционально мышечная оболочка слизистых оболочек недостаточно изучена. предположительно его функция заключается в стимулировании местного перемешивания на поверхности слизистой оболочки, чтобы улучшить секрецию и усвоение питательных веществ.
Подслизистая оболочка представляет собой слой соединительной ткани, глубокий и поддерживающий слизистая оболочка.
Примеры:
вещество подслизистой основы – обыкновенная рыхлая соединительная ткань. ткань. Это позволяет слизистой оболочке гибко двигаться во время перистальтики.
T попробуйте этот , чтобы изучить механические качество подслизистой оболочки: удерживайте внутреннюю оболочку (слизистую оболочку) одной щеки между зубами, и зажмите кожу этой щеки пальцами.Теперь почувствуйте, как эти два слоя свободно перемещаются друг относительно друга (до точка), даже если они связаны между собой рыхлой соединительной тканью.
Подвижность может быть снижена из-за избытка фиброзной ткани в подслизистая оболочка, такая как склеродермия . (За больше, перейдите в WebPath или см. Патологическая основа болезни Роббинса .)
Подслизистая оболочка содержит сосудистое сплетение, относительно крупные вены и артерии, дающие начало капиллярному руслу слизистая оболочка.
подслизистая оболочка также включает тонкую нервную сеть, называемую мейснеровской сплетение (или подслизистое сплетение).
Подслизистые железы встречаются в двух областях тракта:
В остальном подслизистая оболочка имеет сходные характеристики на всем протяжении тракта.
muscularis externa («muscularis» для краткости) — мышечная стенка желудочно-кишечного тракта, глубоко (окружающая) подслизистую оболочку.
язык и мышечная оболочка верхних отделов пищевода состоит из поперечнополосатых мышц.
Вдоль остальная часть тракта musculis состоит из двух отдельных слоев гладкой мускулатуры.
Внутренний круговой слой состоит из гладкой мышечные волокна, обернутые вокруг длинной оси тракта.
Наружный продольный слой состоит из гладкомышечные волокна, идущие вдоль длинной оси тракта.
Точнее, мышечные волокна в обоих слоях закручиваются вокруг тракта либо под очень небольшим углом (круговые волокна), либо под большим более крутой угол (продольные волокна).
Мышечная оболочка желудка толще, чем где-либо еще, с мышечными волокнами, расположенными в большем количестве ориентаций (часто описывается как предполагающий наличие трех слоев, которые трудно различить в рутинных разделах).
В толстой кишке продольная мышца собрана в три продольных тяжа, taenia coli .
Между два мышечных слоя залегают парасимпатическое сплетение Ауэрбаха нервная ткань. Координированное сокращение этих слоев ответственно за для ритмичной перистальтики.
адвентиция или серозная оболочка является самой наружной (т.д., самый дальний из просвета) слоя ЖКТ.
Когда внешний слой прикреплен к окружающей ткани, это называется адвентиция .
- Адвентиция представляет собой обычную волокнистую соединительную ткань расположены вокруг органа, который он поддерживает.
Когда самый наружный слой прилегает к брюшной полости, он называется серозной оболочкой .
- серозная оболочка состоит из обычной соединительной ткани с поверхностью мезотелия .
- Серозная оболочка имеет тот же состав, что и брыжейка .
- Серозная оболочка включает висцеральную брюшину . Она продолжается над брюшной стенкой в виде париетальной брюшины .
Мезотелий представляет собой простую плоскоклеточную эпителиальную ткань, формирующую поверхность серозной оболочки в основных полостях тела (брюшинной, плевральный и перикардиальный).
Брыжейка представляет собой соединительную ткань, соединяющую петли желудочно-кишечного тракта. Брыжейки имеют тот же состав, что и серозная оболочка, и, как и серозная оболочка, и покрыты на открытых лицах мезотелием .
Области желудочно-кишечного тракта
Каждая область желудочно-кишечного тракта структурно и функционально дифференцирована, с особенностями клеточной специализации и строения тканей (особенно эпителиальные ткани), которые выполняют местную функцию.
верхних отделов мочевыводящих путей предназначен для сенсорных дискриминация (вкус), механическая обработка (жевание), начальная смазывание и ферментативное пищеварение (слюнная секреция) и иммунное наблюдения (миндалины), с защитным многослойным плоским эпителием на протяжении.
Специализированные подразделения включают язык, зубы (нет ссылки, оставляем зубы стоматологам), твердое и мягкое небо, слюнные железы, миндалины.
пищевод обеспечивает проход между ротовой полость к желудку. По сравнению с другими отделами желудочно-кишечного тракта пищевод представляет собой довольно простую трубку, выстланную многослойным плоским эпителием. Соответственно, функциональных специализаций немного.
желудок специализируется на секреции пищеварительных ферментов и кислоты, для механического перемешивания и для защиты от самопереваривание.
тонкая кишка специализируется на всасывании питательных веществ.
Подразделы тонкой кишки включают двенадцатиперстную кишку (с железами Бруннера, специализированными для нейтрализация желудочной кислоты), тощая кишка, и подвздошная кишка.
поджелудочная железа это железа, специализирующаяся на относительно массивной секреции пищеварительных ферментов в тонкую кишку на границе между двенадцатиперстная кишка и тощая кишка.
Печень имеет уникальный рисунок организации эпителиальных клеток, специализированных ОБЕ для фильтрации крови (вся кровь из кишечник и селезенка проходят через печень, прежде чем вернуться в общее кровообращение) И для секреции желчи.
нижний тракт предназначен для длительного всасывания питательных веществ и для концентрации непереваренного материала путем реабсорбции воды.
Подразделы нижних отделов включают червеобразный отросток, толстая кишка, прямая кишка и заднепроходной канал.
Ссылка на специализированных типов ячеек
Особенности гистологической организации
Особенности формы поверхности
Вилли представляют собой очень мелкие, обычно плотно упакованные, выпячивания слизистой оболочки.(Слово villus имеет тот же корень, что и бархат .) В тонкая кишка, ворсинки вносят вклад на порядок увеличение площади поверхности слизистой оболочки, доступной для всасывания.
Ворсинки характеризуют слизистую оболочку тонкой кишки на всем ее протяжении.
различные формы ворсинок, которые могут быть пальцеобразными, уплощенными или гребневидными. — лучше всего определяются в тангенциальных отделах кишечника слизистая оболочка.
Каждый кишечная ворсинка имеет поверхность простой столбчатой формы. эпителий (поглотительные клетки и бокаловидные клетки) и ядро собственной пластинки. В в дополнение к рыхлой клеточной соединительной ткани, типичной для пластинки propria по всей кишке, ворсинки также содержат капилляры, млечные и гладкомышечных волокон.
Внешний вид ворсинок и крипт.
На разрезе ворсинка очерчена кольцом эпителия, окружающим ядро собственной пластинки. Пустой пространство окружает каждую ворсинку.
Склепы, напротив, окружены пластиной собственная Эпителий окружает центральный просвет.
Изображение © Голубая гистология
Крипты – короткие инвагинации слизистой оболочки эпителий.Склепы предоставляют защищенные карманы для специальных сотовых функций.
Крипты миндалин возникают на небе, в глотке и спинка языка.
- Крипты миндалин обеспечивают места, где иммунный наблюдательные клетки (лимфоциты) могут столкнуться с чужеродными антигенами, которые попадают в организм через рот полость.
- Крипты миндалин окружены лимфоидной ткань с хорошо развитыми зародышевыми центрами.Вся структура (крипта, эпителий и лимфатические узлы) называется миндалина .
Кишечные крипты характерны как для тонкой кишки (где они встречаются между ворсинками) и аппендикса, толстой и прямой кишки (где крипты не связаны с ворсинками).
- Кишечные крипты иногда называют «кишечными криптами». железы» (имеют форму коротких, прямых, простых трубчатые железы).
- Их также обычно называют склепы Либеркюна .
Историческая справка : Склепы Либеркюна названы в честь Теодор Либеркюн (р. 1711).
Кишечные крипты содержат секреторные клетки Панета, (назван в честь Джозефа Панета, 1857 г.р.). на глубоком конце. Эти клетки секретируют лизосомальные ферменты, которые способствуют для защиты стволовых клеток в слизистой оболочке крипты.
Недифференцированный стволовые клетки, расположенные по всей длине кишечника крипты дают начало новым поглотительным клеткам и бокаловидные клетки. Вся поверхность эпителий кишечника заменяется каждые несколько дней новыми клетками, возникающими из крипт.
Внешний вид ворсинок и крипт.
На разрезе ворсинка очерчена кольцом эпителия, окружающим ядро собственной пластинки.Пустой пространство окружает каждую ворсинку.
Склепы, напротив, окружены пластиной собственная Эпителий окружает центральный просвет.
Изображение © Голубая гистология
А plica — это складка (тот же корень, что и «складка»). складки тонкой кишки представляют собой постоянные складки в слизистая оболочка поддерживается ядром подслизистой основы.Складки увеличивают всасывающую поверхность слизистой оболочки, а также вынуждая кишечное содержимое следовать более извилистым путем вниз по кишечнику просвет.
Историческая справка: Кишечные складки также называют клапанами. Керкринга , названного в честь Теодора Керкринга, б. 1638.А сосочек представляет собой небольшой выступ. В системе GI это слово используется для описания различных небольших выступов на поверхности языка.
A желудочная ямка представляет собой неглубокую выемку в поверхностном эпителии слизистая желудка. Эти ямы, которые выложены защитным эпителием поверхностных слизистых клетки, придают характерную текстуру всей поверхности желудка. Желудочные железы открываются в днище ям.
Лимфатические функции
Для получения дополнительной информации об иммунной системе, включая внешних ссылок , см. CRR Лимфатическая система.
Лимфоидная ткань встречается в собственной пластинке на всем протяжении желудочно-кишечного тракта, где его иногда называют GALT для связанного с кишечником лимфоидного Ткань или MALT для лимфоидных тканей, связанных со слизистой оболочкой.
Наиболее характерным признаком кишечно-ассоциированной лимфоидной ткани является наличие скоплений лимфатических узелков (также называемых лимфоидными фолликулами ), которые являются местами, где лимфоциты собираться.В центре каждого лимфатического узла находится «зародышевый центр». где размножаются лимфоциты.
Соединительная ткань вокруг лимфатического узла обычно сильно инфильтрированы лимфоцитами мигрируют в зародышевый центр и из него.
Лимфа узелки могут возникать в собственной пластинке в любом месте по ходу ЖКТ. Тысячи отдельных лимфоидных узелков может возникать по ходу тонкой и толстой кишки.Массы лимфоидного ткань может выходить за пределы собственной пластинки и проникать в подслизистую оболочку. Близлежащая эпителиальная ткань также может быть инфильтрирована лимфоцитами.
Агрегации лимфатические узлы характерны для миндалин, болезни Пейера участки подвздошной кишки и аппендикса.
Для получения дополнительной информации о лимфоидных тканях, связанных с кишечником, проконсультируйтесь с вашим текст гистологии.
Последние результаты исследований см. в разделе «Иммунитет, Воспаление и аллергия в кишечнике», Science 307:1920 (2005).
Миндалины представляют собой лимфоидные образования, расположенные в слизистой оболочке языка, неба и глотки. Каждая миндалина состоит из эпителиальной крипты. (инвагинированный карман), окруженный плотными скоплениями лимфы узелки. Миндалины обеспечивают места, где иммунные наблюдательные клетки (лимфоциты) могут столкнуться с чужеродными антигенами, которые попадают в организм через рот полость.
Подробнее о «Лимфоидных тканях, связанных с кишечником» (GALT или MALT для лимфоидных тканей, связанных со слизистой оболочкой), проконсультируйтесь со своим гистологом текст.
Пейера бляшки представляют собой лимфоидные структуры, расположенные в слизистой оболочке подвздошной кишки.
Историческая справка : Пейеровы бляшки названы в честь Иоганна Конрада. Пейер, швейцарский анатом XVII века, впервые описавший эти структуры в 1677 году.
Каждое пятно состоит из скопления лимфатических узлов. которые выпячиваются вверх к просвету. Поверхностный эпителий Пейера бляшки образованы невысокими кубовидными М-клетками , специализированными энтероцитами которые облегчают взаимодействие между антигеном и лимфоцитами. (За несколько устаревший обзор биологии М-клеток, см. Gut (2000) 47:735)
Подробнее о «Лимфоидных тканях, связанных с кишечником» (GALT или MALT для лимфоидных тканей, связанных со слизистой оболочкой), проконсультируйтесь со своим гистологом текст.О перспективах недавних исследований см. «Иммунитет, Воспаление и аллергия в кишечнике», Science 307:1920 (2005).
Млечные являются лимфатическими каналами в каждой из ворсинок малого кишечник. Млечные железы обеспечивают проход для абсорбированного жира (хиломикронов). в лимфатический дренаж кишечника.
Для получения дополнительной информации об иммунной системе, включая внешних ссылок , см. CRR Лимфатическая система.
Ссылка на Сальники
Основные ткани
Гистология желудочно-кишечного тракта в значительной степени совпадает с гистологией эпителиальных ткани . Убедитесь, что вы знакомы с основными свойства эпителиальной ткани.
Эпителий слизистой оболочки желудочно-кишечного тракта разнообразно дифференцирован и специализированные для функций пищеварительной секреции и всасывания.Несколько железы предлагают дополнительную специализацию эпителиальных структура и функция.
Соединительные ткани , связанные с кишечником, довольно неспециализированы, за исключением лимфоидных тканей, специализированных для иммунной функции. Тем не менее, обычная рыхлая соединительная ткань собственной пластинки, подслизистая и серозная оболочки выполняют жизнедеятельности транспорта и механического обеспечения (а также задействование при воспалении).Убедитесь, что вы знакомы с основными Компоненты и функции соединительной ткани.
В солидных органах, таких как железы, соединительная ткань вместе со связанными кровеносными сосудами и протоками часто называют стромой.
При исследовании препарата любого органа обращайте внимание на соединительную ткань. Признаки воспаления появляются в соединительной ткани. Для обнаружения таких признаков необходимо сначала знаком с нормальным (т.э., неинтересный) внешний вид.
Нервная ткань
Желудочно-кишечный тракт хорошо снабжен как сенсорными, так и моторными органами. иннервация. По ходу тракта эта нервная ткань концентрируется в Ауэрбаха и Мейснера. сплетение. Каждое сплетение состоит из сети немиелинизированных нервных волокон. (обычно незаметные) и связанные с ними ганглии.
тела нервных клеток, которые объединяются в парасимпатические ганглии Ауэрбаха и Мейснера сплетения легко просматриваются микроскопически.
Каждый тело нервной клетки может быть довольно большим (до ~ 50 мкм), с относительно базофильная цитоплазма и большое округлое эухроматиновое ядро с одиночное заметное ядрышко.
С периферическими ганглиями связаны многочисленные мелкие сателлитные клетки и шванновские клетки, а также фибробласты окружающей соединительной ткань.
Ауэрбаха сплетение расположено между круговым и продольным гладким мышечные слои наружной мускулатуры.Скоординированный сокращение этих слоев отвечает за ритмичную перистальтику.
сплетение Ауэрбаха также называют миэнтеральным сплетением (из мио — мышца, и энтерон кишка)
Сплетение Мейснера расположено в подслизистой оболочке. Нейроны этого сплетения влияют на гладкую мускулатуру. мышечной оболочки слизистых оболочек, включая гладкую мускулатуру волокна, переходящие в кишечные ворсинки.
Сплетение Мейснера также называют подслизистым сплетение.
парасимпатические ганглии мейснеровского сплетения встречаются реже и имеют меньшие размеры (меньше тел нервных клеток), чем у Ауэрбаха. сплетение. Если вы случайно заметите крупную клетку с базофильной цитоплазмой, округлое эухроматическое ядро и заметное ядрышко, расположенное в подслизистой оболочке, тогда вы видели нейрон мейсснеровского сплетения.
Для получения дополнительной информации о нервных клетках в целом см. Нейрон или «Нервные клетки ‘R’ Us».
Мышечная ткань
полосатый мышца составляет основную часть языка, а также мышечная оболочка верхнего отдела пищевода.
На протяжении остальная часть ЖКТ, гладкомышечные формы прочная двухслойная мышечная оболочка.
Гладкая мускулатура также образует тонкую мышечную оболочку. mucosae на глубокой границе слизистой оболочки (т.е. между собственной пластинкой и подслизистой оболочкой).
В отличие от поперечнополосатых мышц, гладкие мышца состоит из отдельных клеток, каждая клетка со своим ядром. То функция гладкой мускулатуры также существенно различается от поперечнополосатых мышц. (Подробнее.)
Каждый гладкомышечная клетка (или «мышечное волокно») очень длинный и узкий, до нескольких сотен микрометров в длину, но всего несколько микрометров в диаметре.Ядро также удлиненное. (Подробнее.)
Комментарии и вопросы: [email protected]
SIUC / Школа медицины / анатомии / Давид King
https://histology.siu.edu/erg/giguide.htm
Последнее обновление: 30 декабря 2021 г. / dgk
Стадии, симптомы, лечение и тесты
Обзор
Технология синего света в терапии рака мочевого пузыряЧто такое рак мочевого пузыря?
Мочевой пузырь, полый орган в нижней части живота, служит резервуаром для мочи до тех пор, пока она не выйдет из организма через мочеиспускательный канал.
Существуют различные типы рака мочевого пузыря. Тип раковых клеток может быть переходно-клеточной карциномой, плоскоклеточной карциномой или аденокарциномой, каждая из которых названа в честь типа клеток, которые выстилают стенку мочевого пузыря, где возникает рак.
- Большинство случаев рака мочевого пузыря (более 90 процентов) начинается с переходных клеток, которые занимают внутреннюю оболочку стенки мочевого пузыря. Рак, возникающий в этих клетках, выстилающих мочевой пузырь, может в некоторых случаях проникать в более глубокие слои мочевого пузыря (называемые собственной пластинкой мочевого пузыря), в толстый мышечный слой мочевого пузыря или через стенку мочевого пузыря в жировые ткани, которые окружают мочевой пузырь.
- Плоскоклеточные клетки представляют собой тонкие плоские клетки, которые выстилают уретру и могут образовываться в мочевом пузыре после длительных приступов воспаления или раздражения мочевого пузыря. Плоскоклеточная карцинома составляет около 5 процентов случаев рака мочевого пузыря.
- Аденокарцинома — это очень редкий тип рака мочевого пузыря, который начинается в железистых (секреторных) клетках слизистой оболочки мочевого пузыря. Только от 1 до 2 процентов случаев рака мочевого пузыря составляют аденокарциномы.
Каковы стадии рака мочевого пузыря?
Рак мочевого пузыря может быть ранней стадии (ограничен слизистой оболочкой мочевого пузыря) или инвазивным (проникающим в стенку мочевого пузыря и, возможно, распространяющимся на близлежащие органы или лимфатические узлы).
Стадии варьируются от TA (ограничена внутренней оболочкой мочевого пузыря) до IV (наиболее инвазивная). На самых ранних стадиях (TA, T1 или CIS) рак ограничен слизистой оболочкой мочевого пузыря или соединительной тканью непосредственно под слизистой оболочкой, но не прорастает в основную мышечную стенку мочевого пузыря.
Стадии II-IV обозначают инвазивный рак:
- На стадии II рак распространился на мышечную стенку мочевого пузыря.
- На стадии III рак распространился на жировую ткань за пределами мышцы мочевого пузыря.
- На стадии IV рак метастазирует из мочевого пузыря в лимфатические узлы или другие органы или кости.
Более сложная и предпочтительная система стадирования известна как TNM, что означает опухоль, поражение лимфатических узлов и метастазы. В этой системе:
- Инвазивные опухоли мочевого пузыря могут варьироваться от T2 (распространение на основную мышечную стенку ниже слизистой оболочки) до T4 (опухоль распространяется за пределы мочевого пузыря на близлежащие органы или боковую стенку таза).
- Поражение лимфатических узлов варьируется от N0 (отсутствие рака в лимфатических узлах) до N3 (рак во многих лимфатических узлах или в одном или нескольких крупных лимфатических узлах размером более 5 см).
- М0 означает отсутствие метастазов вне таза. M1 означает, что опухоль метастазировала за пределы таза.
Симптомы и причины
Каковы предупреждающие признаки рака мочевого пузыря?
Некоторые симптомы рака мочевого пузыря также являются симптомами других состояний и требуют обращения к врачу. Кровь в моче является наиболее важным предупредительным признаком. Другими симптомами являются боль во время мочеиспускания, частое мочеиспускание или затрудненное мочеиспускание.
Диагностика и тесты
Какие анализы мне нужно будет пройти, если мой врач заподозрит рак мочевого пузыря или другую проблему с мочеиспусканием?
Ваш врач захочет проанализировать вашу мочу (анализ мочи), чтобы определить, не может ли инфекция быть причиной ваших симптомов. Микроскопическое исследование мочи, называемое цитологией, поможет найти раковые клетки.
Цистоскопия является основным методом выявления и диагностики рака мочевого пузыря. В ходе этой процедуры в мочевой пузырь из уретры вводится телескоп с подсветкой (цистоскоп), чтобы осмотреть внутреннюю часть мочевого пузыря и, если это делается под анестезией, взять образцы тканей (биопсию), которые затем исследуются под микроскопом на наличие признаков рака. .Когда эта процедура проводится в кабинете врача, гель для местной анестезии помещается в уретру перед процедурой, чтобы свести к минимуму дискомфорт.
Если поставлен диагноз рака мочевого пузыря, то следующим шагом будет удаление опухоли для детальной постановки диагноза.
Трансуретральная резекция (ТУР) — это процедура, проводимая под общей или спинальной анестезией в операционной. В мочевой пузырь вводят телескоп и удаляют опухоль, соскабливая ее со стенки мочевого пузыря (с ним удаляется часть стенки мочевого пузыря) с помощью специального цистоскопа (называемого резектоскопом).Эта процедура является не только лечебной, но и диагностической.
Часто это можно сделать амбулаторно, при этом пациентов выписывают из больницы в тот же день. После удаления опухоль анализируется патологоанатомом, который определяет тип опухоли, степень опухоли (агрессивность) и глубину инвазии. Целью процедуры является удаление опухоли и получение важной информации о стадии (такой как степень опухоли и глубина инвазии).
Для некоторых пациентов с инвазивным раком компьютерная томография брюшной полости и таза может быть следующим шагом для определения распространения болезни за пределы мочевого пузыря.
Магнитно-резонансная томография, при которой используются магнит, радиоволны и компьютер для получения подробных изображений, также может быть выполнена и полезна при планировании дополнительного лечения.
Также может быть выполнено рентгенологическое исследование органов грудной клетки, чтобы определить, распространился ли какой-либо рак на легкие. Иногда может быть выполнено сканирование костей для поиска метастазов (распространения) рака в кости. Большинство этих тестов используются выборочно, то есть только у определенных пациентов с родственными симптомами.
После того, как рак мочевого пузыря диагностирован, определяют стадию заболевания с помощью тестов, описанных выше.Стадия заболевания будет определять курс лечения.
Управление и лечение
Какие существуют варианты лечения рака мочевого пузыря?
Существует четыре вида лечения больных раком мочевого пузыря. К ним относятся:
Иногда используются комбинации этих методов лечения.
Хирургические опции
Хирургия является распространенным методом лечения рака мочевого пузыря. Тип выбранной операции будет зависеть от стадии рака.
- Трансуретральная резекция мочевого пузыря чаще всего используется на ранних стадиях заболевания (TA, T1 или CIS) . Проводится под общей или спинальной анестезией. При этой процедуре специальный телескоп, называемый резектоскопом, вводится через уретру в мочевой пузырь. Затем опухоль обрезают резектоскопом, используя проволочную петлю, а необработанную поверхность мочевого пузыря затем фульгурируют (разрушают электрическим током).
- Частичная цистэктомия — удаление части мочевого пузыря .Иногда он используется для одиночной опухоли, которая прорастает стенку мочевого пузыря только в одной области мочевого пузыря. Этот тип операции сохраняет большую часть мочевого пузыря. Химиотерапия или лучевая терапия часто используются в комбинации. Лишь немногие пациенты подходят для этой операции по сохранению мочевого пузыря.
- Радикальная цистэктомия – полное удаление мочевого пузыря . Он используется для более обширных видов рака и тех, которые распространились за пределы мочевого пузыря (или нескольких ранних опухолей на большую часть мочевого пузыря).
Эта операция часто выполняется с помощью робота, который удаляет мочевой пузырь и другие окружающие органы. У мужчин это предстательная железа и семенные пузырьки. У женщин яичники, матка и часть влагалища могут быть удалены вместе с мочевым пузырем.
Поскольку мочевой пузырь удален, необходимо выполнить процедуру, называемую отведением мочи, чтобы моча могла выйти из организма. Внутри тела можно сделать мешок, состоящий из кишечника, или для сбора мочи можно использовать герметичный мешок, который носят вне тела.Процедура обычно требует пребывания в больнице от пяти до шести дней, плюс-минус несколько дней в любом случае.
ХимиотерапияХимиотерапия относится к использованию любого из группы препаратов, основное действие которых заключается либо в уничтожении, либо в замедлении размножения быстро размножающихся клеток. Раковые клетки поглощают химиотерапевтические препараты быстрее, чем нормальные клетки (но все клетки подвергаются воздействию химиотерапевтических препаратов). Химиотерапевтические препараты вводятся внутривенно (через вену) или могут вводиться внутрипузырно (непосредственно в мочевой пузырь через катетер, продетый через мочеточник), в зависимости от стадии рака.
Некоторые распространенные химиотерапевтические препараты, используемые для лечения рака мочевого пузыря, включают:
- Метотрексат
- Винбластин
- Доксорубицин
- Циклофосфамид
- Паклитаксел
- Карбоплатин
- Цисплатин
- Ифосфамид
- Гемцитабин
Многие из этих препаратов используются в комбинациях.
Побочные эффекты могут возникать при химиотерапии, и их тяжесть зависит от конкретного используемого препарата и способности пациента переносить препараты.Общие побочные эффекты химиотерапии включают:
Химиотерапия может использоваться отдельно, но часто применяется в сочетании с хирургическим вмешательством или лучевой терапией.
Внутрипузырная терапияРак мочевого пузыря можно лечить с помощью внутрипузырной (в мочевой пузырь через трубку, вставленную в уретру) иммунотерапии или химиотерапии.
Иммунотерапия относится к использованию собственной иммунной системы организма для атаки на раковые клетки. Вакцина под названием Bacillus Calmette-Guérin (BCG) обычно используется для этой цели при внутрипузырном лечении рака мочевого пузыря на стадиях Ta, T1 или карциномы in situ (ограниченной самой внутренней оболочкой).При этой процедуре раствор, содержащий БЦЖ, остается в мочевом пузыре в течение нескольких часов, после чего его дренируют.
Внутрипузырная БЦЖ обычно вводится один раз в неделю в течение шести недель, но иногда требуется длительная поддерживающая терапия. Возможными побочными эффектами внутрипузырного введения БЦЖ являются раздражение мочевого пузыря, боль или жжение во время мочеиспускания, субфебрильная температура и озноб.
Внутрипузырная химиотерапия митомицином С является еще одним вариантом лечения. Поскольку химиотерапия вводится непосредственно в мочевой пузырь, другие клетки организма не подвергаются химиотерапии, что снижает вероятность побочных эффектов химиотерапии.Его также часто назначают в виде разовой дозы после удаления опухоли с помощью цистоскопии.
Лучевая терапияЛучевая терапия повреждает ДНК раковых клеток путем бомбардировки их высокоэнергетическим рентгеновским излучением или другими видами излучения. Это может быть альтернативой хирургическому вмешательству или использоваться в сочетании с хирургическим вмешательством или химиотерапией. Лучевая терапия может проводиться снаружи или внутри.
При внешней лучевой терапии источником излучения является устройство, находящееся вне тела, которое направляет сфокусированный пучок излучения на опухоль.Благодаря более совершенным технологиям визуализации, используемым сегодня, компьютерное излучение, подаваемое под несколькими углами, сводит к минимуму радиационное воздействие на окружающие ткани и органы, ограничивая повреждение этих тканей. Усталость, отек мягких тканей и раздражение кожи являются частыми побочными эффектами внешнего облучения.
Внутренняя лучевая терапия не часто используется при раке мочевого пузыря. При этом виде лечения радиоактивный шарик вводится в мочевой пузырь через мочеиспускательный канал или разрез в нижней части живота.Внутреннее облучение требует пребывания в больнице в течение курса лечения, которое может длиться несколько дней, после чего гранулу удаляют.
Профилактика
Каковы факторы риска рака мочевого пузыря?
Некоторые факторы повышают риск рака мочевого пузыря:
- Курение сигарет является самым большим фактором риска; это более чем удваивает риск. Курение трубки и сигар и пассивное курение также могут увеличить риск.
- Предыдущее радиационное облучение является следующим наиболее распространенным фактором риска (т.г., для лечения рака шейки матки, рака предстательной железы или рака прямой кишки).
- Некоторые химиотерапевтические препараты (например, циклофосфамид) также повышают риск развития рака мочевого пузыря.
- Воздействие окружающей среды увеличивает риск рака мочевого пузыря. Риску подвержены люди, работающие с химическими веществами, такими как ароматические амины (химические вещества, используемые в красителях). Обширное воздействие резины, кожи, некоторых тканей, красок и парикмахерских принадлежностей, обычно связанное с профессиональным воздействием, также, по-видимому, увеличивает риск.
- Заражение паразитом, известным как Schistosoma haematobium , который чаще встречается в развивающихся странах и на Ближнем Востоке. (Этот организм не встречается в США.)
- Люди с частыми инфекциями мочевого пузыря, камнями в мочевом пузыре или другими заболеваниями мочевыводящих путей или с хронической потребностью в катетере в мочевом пузыре могут подвергаться более высокому риску развития плоскоклеточного рака.
- Пациенты с раком мочевого пузыря в анамнезе подвержены повышенному риску образования новых или рецидивирующих опухолей мочевого пузыря.
Другие факторы риска включают рацион с высоким содержанием жареного мяса и животных жиров, а также пожилой возраст. Кроме того, у мужчин риск в три раза выше, чем у женщин.
Ресурсы
Загрузите наше бесплатное руководство по лечению
Патент США на метод иссечения тканей Патент (Патент № 9,028,510, выдан 12 мая 2015 г.)
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ1. Область изобретения
Настоящее изобретение относится к методу иссечения ткани, в частности, к так называемому методу иссечения по всей толщине, при котором часть полого органа иссекается по всей толщине направление.
2. Описание предшествующего уровня техники
В предшествующем уровне техники при лечении рака желудка и т.п. выполняют иссечение опухоли и окружающей ее ткани по всей толщине стенки желудка. Такое иссечение на всю толщину часто выполняется путем лапаротомии или лапароскопической хирургии.
Кроме того, в опубликованном японском переводе № 2010-522035 Международной публикации РСТ описан операционный степлер, оснащенный парой браншей.
Одна из пар браншей снабжена магазином скоб, загруженным скобами, а к другой бранше прикреплен упор с множеством гнезд для скоб. Когда бранши закрыты тканью, расположенной между парой браншей, часть ткани может быть разрезана по всей толщине при сшивании ткани скобкой.
СУЩНОСТЬ ИЗОБРЕТЕНИЯСпособ иссечения ткани согласно изобретению представляет собой способ иссечения ткани, при котором часть ткани иссекается в области иссечения, установленной в полом органе, по всей толщине.Способ иссечения ткани включает первый процесс захвата одной точки периферического краевого участка области иссечения изнутри полого органа; второй процесс перемещения части захваченного полого органа, складывания части полого органа так, чтобы внешние поверхности полого органа соприкасались друг с другом, и втягивания сложенного полого органа в прорезь заданной ширины; третий процесс сшивания части, расположенной вне области иссечения, с части вытянутого полого органа таким образом, чтобы он был цельным в направлении толщины; и четвертый процесс разрезания части вытянутого полого органа вдоль периферического края области иссечения.Во втором процессе часть жидкости внутри полого органа перемещается из полого органа, чтобы удерживать внутреннее давление полого органа в фиксированном диапазоне при втягивании части полого органа в щель.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙРИС. 1 представляет собой вид, показывающий пример медицинского устройства, предпочтительно используемого для метода иссечения ткани согласно варианту осуществления изобретения.
РИС. 2 представляет собой вид, показывающий операцию при использовании медицинского устройства.
РИС. 3 представляет собой вид, показывающий область иссечения и точку захвата.
РИС. 4 и 5 представляют собой виды, показывающие процесс этого метода иссечения ткани.
РИС. 6 представляет собой вид, показывающий усилие вытягивания и фактор, влияющий на усилие вытягивания.
РИС. 7А представляет собой схематический вид желудка в разрезе.
РИС. 7В представляет собой схематический вид в разрезе, когда нарисована часть желудка.
РИС. 8-11 представляют собой изображения, показывающие процесс этого метода иссечения ткани.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯДалее будет описан вариант осуществления изобретения со ссылкой на фиг. с 1 по 11.
В качестве примера медицинского устройства, предпочтительно используемого для метода иссечения ткани по изобретению, медицинское устройство 1 , оснащенное сшивающим аппаратом, показано на ФИГ. 1. Медицинское устройство 1 оснащено обрабатывающей частью 10 , расположенной на наконечнике для проведения лечения на целевой ткани, первой рабочей частью 30 для управления обрабатывающей частью 10 , вводной частью . 40 между лечебной частью 10 и первой рабочей частью 30 , смотровой частью 50 , вставленной через вставную часть 40 , и второй рабочей частью 60 для управления смотровой частью 30 .Деталь для обработки 10 имеет первую браншу (первый захватный элемент) 11 и вторую браншу (второй захватный элемент) 12 в виде пары открывающихся и закрывающихся губок и накладывает швы и отрезает ткань с помощью картриджа . 13 , загруженный скобами 13 A, и его базовая структура хорошо известна, например, как описано в вышеописанном опубликованном японском переводе № 2010-522035 Международной публикации РСТ.
Первая рабочая часть 30 имеет известную конфигурацию и имеет две круглые ручки 31 и 32 и рычаг 33 .Ручка циферблата 31 соединена с обрабатывающей частью 10 с помощью элемента управления (не показан), такого как проволока, а открывание и закрывание пары браншей 11 и 12 может осуществляться с помощью вращая ручку набора 31 .
Вставная часть 40 имеет трубчатую форму, обладающую гибкостью, и имеет лечебную часть 10 , прикрепленную к ее кончику, и первую рабочую часть 30 , прикрепленную к ее основанию, соответственно.Вставная часть 40 имеет изгибающуюся часть 41 хорошо известной конструкции, имеющую множество соединительных колец, гибких рамок и т.п. на ее концевой стороне, и может изгибаться с помощью ручки циферблата 32 . первой рабочей части 30 . Рабочий элемент вставляется через внутреннюю полость вставной части 40 , чтобы иметь возможность выдвигаться и втягиваться в осевом направлении. Кроме того, порт для пинцета 42 предусмотрен на стороне основания вставной части 40 , а инструмент для общей обработки 100 или аналогичный для эндоскопа, снабженного пинцетной частью 101 , может быть вставлен в отверстие для щипцов 42 и может выступать из основания конца первой бранши 11 .
Наблюдательная часть 50 вставляется через вставную часть 40 , чтобы иметь возможность выдвигаться и втягиваться, и оснащена осветительной частью 51 , включающей светодиод и т.п., или частью формирования изображения 52 , такие как ПЗС, в его концевой части. Кроме того, смотровая часть 50 имеет сгибаемую часть 53 , имеющую ту же конструкцию, что и сгибаемая часть 41 , на ее концевой стороне.Поскольку кончик части наблюдательной части 50 может выдвигаться и втягиваться из отверстия 42 , расположенного на стороне кончика вставной части 40 , ткань, удерживаемая в обрабатывающей части 10 , хорошо видна благодаря выступанию. часть наконечника смотровой части 50 и изогнуть изогнутую часть 53 соответствующим образом, как показано на ФИГ. 2, например.
Вторая рабочая часть 60 соединяется с базовым концом смотровой части 50 , которая выходит наружу со стороны базового конца вставной части 40 .Вторая рабочая часть 60 снабжена ручкой 61 , кнопкой 62 и т.п., такой же, как и первая рабочая часть 30 , и операция сгибания сгибаемой части 53 , операция часть 51 освещения, часть 52 формирования изображения и т.п. Видеосигнал, полученный блоком 52 формирования изображения, отправляется в блок обработки изображений (не показан) через универсальный кабель 63 и отображается на дисплее (не показан) или т.п.В качестве смотровой части 50 и второй рабочей части 60 можно использовать хорошо известное эндоскопическое устройство и т.п., установив соответствующие размеры и т.п.
Далее будет описан способ иссечения ткани согласно настоящему варианту осуществления, в котором вся толщина злокачественной опухоли (далее именуемой просто «опухоль») желудка (полого органа) иссекается с использованием медицинского устройства. 1 , например.
Сначала оператор вводит медицинское устройство 1 в желудок изо рта пациента или т.п. и наблюдает за опухолью с помощью смотровой части 50 .Затем, как показано на фиг. 3 установлена грубая область вырезания R, окружающая опухоль Tm. Предпочтительно, чтобы область иссечения R была установлена таким образом, чтобы кратчайшее расстояние от опухоли Tm становилось равным или более 5 мм, чтобы не повредить опухоль Tm во время иссечения ткани.
Затем оператор выдвигает обрабатывающий инструмент 100 из первой челюсти 11 и, как показано на ФИГ. 4, захватывает одну точку стенки желудка вдали от опухоли Tm с помощью части пинцета 101 изнутри желудка Sm (первый процесс).Поскольку эта единственная точка становится частью периферического края области, подлежащей фактическому иссечению, предпочтительно, чтобы эта точка была установлена в положение, эквивалентное участку периферического края заданной области иссечения R, например, в части, удаленной от можно выделить центр опухоли Tm примерно на 30 мм. В дальнейшем эта единственная точка захвата упоминается как первая точка захвата P 1 .
Затем оператор отводит инструмент 100 для обработки, который захватил первую точку захвата P 1 , и, как показано на ФИГ.5, втягивает часть ткани стенки желудка ST в щелевидный зазор, образованный между первой браншей 11 и второй браншей 12 в закрытом состоянии (второй процесс). Пара губок обрабатывающей части 10 может быть закрыта заранее перед захватом первой точки захвата P 1 . Кроме того, во время рисования опухоль Tm наблюдают с помощью наблюдательного элемента 50 и обращают внимание на то, чтобы пара челюстей не касалась опухоли Tm.
Ткань стенки желудка ST вытягивается между первой браншей 11 и второй браншей 12 вдоль двух первых линий чертежа L 1 , которые проходят от первой точки захвата P 1 . То есть нарисованную ткань стенки желудка ST складывают наружной поверхностью желудка, обращенной внутрь так, чтобы наружные поверхности желудка соприкасались друг с другом, а одна линия рисования первых линий рисования L 1 обращена первая челюсть 11 и другая линия чертежа L 1 обращены ко второй челюсти 12 .Поскольку щель между парой челюстей узкая и щелевидная, ткани других внутренних органов, прилегающих к желудку, не втягиваются между парой челюстей вместе с тканью стенки желудка.
РИС. 6 представляет собой вид, показывающий усилие вытягивания, необходимое для вытягивания ткани ST стенки желудка, и фактор, влияющий на усилие вытягивания. Что касается сопротивления при вытягивании ткани стенки желудка, натяжение T ткани стенки желудка ST, сопротивление между захватными поверхностями 11 a и 12 a пары челюстей 11 и 12 и стенки желудка, а также сопротивление, возникающее между кончиками пар челюстей и тканью стенки желудка ST.Таким образом, если коэффициенты трения на поверхностях захватов равны μ г , нормальные силы на поверхностях захватов равны N г , коэффициенты трения в концевых частях равны μd, а нормальные силы в концевых частях равны N d , ткань стенки желудка ST может быть втянута в щель между парой зажимов 11 и 12 , если установлена следующая формула относительно силы вытягивания F.
F≥2(T+μ g N g +μdN d )
Здесь, начиная с поверхности стенки желудка ST, которая соприкасается с захватными поверхностями 11 a и 12
2 из-за слизи и т.п. значения мкг и мкд не такие большие.Соответственно, можно сказать, что натяжение Т ткани стенки желудка ST является доминирующим среди факторов, определяющих требуемую силу вытягивания F. К факторам, определяющим натяжение Т, относятся эластичность ткани стенки желудка и внутреннее давление желудка.РИС. 7А представляет собой схематический вид в разрезе, показывающий нормальное состояние желудка Sm, а на ФИГ. 7B представляет собой схематический вид в поперечном сечении, показывающий состояние желудка Sm, где нарисован участок ткани стенки желудка ST.Как показано на фиг. 7 B, поскольку ткань стенки желудка ST складывается при вытягивании, объем желудка Sm уменьшается за счет втягивания части ткани стенки желудка ST во втором процессе. Соответственно, поскольку внутреннее давление желудка Sm повышается за счет втягивания ткани стенки желудка, а напряжение T возрастает, если общее количество жидкостей, таких как воздух или углекислый газ, внутри желудка не изменяется, большая сила втягивания F требуется для дальнейшего рисования ткани стенки желудка.
Таким образом, в способе иссечения ткани согласно изобретению жидкость в желудке удаляется из желудка параллельно с извлечением ткани во втором процессе. Это подавляет рост напряжения Т, возникающий в результате повышения внутреннего давления, и предотвращает чрезмерное увеличение требуемой силы вытягивания.
Средства для перемещения жидкости в желудке из желудка конкретно не ограничены, и можно соответствующим образом использовать хорошо известную конфигурацию.Например, смотровая часть 50 может быть снабжена аспирационным каналом, жидкость в желудке может быть отсосана из аспирационного канала и может быть перемещена из желудка, или в желудок может быть отдельно введена аспирационная трубка для всасывание жидкости в желудке.
Количество жидкости, выводимой из желудка, устанавливается соответствующим образом с учетом внутреннего давления в желудке. В настоящем варианте осуществления внутреннее давление Sm в желудке отслеживается с использованием хорошо известного датчика давления или подобного устройства, и жидкость в желудке отсасывается и выпускается из желудка, так что значение внутреннего давления поддерживается примерно на равно тому, что было до рисования ткани стенки желудка (приблизительно в диапазоне от ± 1 до 6 мм ртутного столба (мм рт. ст.)).Это подавляет повышение внутреннего давления, сохраняя поле зрения смотровой части 50 чистым во время манипуляции.
Кроме того, вместо вышеизложенного, степень уменьшения объема желудка в результате втягивания может быть рассчитана или оценена заранее, а движение жидкости может быть задано таким образом, чтобы стать равным или превышать величину уменьшения .
Если ткань стенки желудка ST достаточно протянута между парой захватов 11 и 12 , оператор воздействует на рычаг 33 .Затем клин (не показан) сгибает скобы 13 A внутри картриджа 13 , толкая скобы к опорному элементу (не показан), предусмотренному во второй губке 12 , с использованием хорошо известного механизма. В результате сложенную ткань стенки желудка ST сшивают таким образом, чтобы она стала единой по направлению толщины с обеих сторон первых линий чертежа L 1 (третий процесс). Далее резак (не показан) разрезает ткань стенки желудка, расположенную между рядами скоб 13 А, сшивающих ткань стенки желудка ST, приблизительно по первым линиям чертежа L 1 и, как показано на фиг.8 участок стенки желудка рассечен на всю толщину (четвертый отросток). Однако, поскольку ткань стенки желудка ST сшита скобами 13 А по обе стороны от линии разреза, определяющей область иссечения, отверстия, открывающегося в желудок, не остается.
После завершения разрезания по первым линиям чертежа L 1 оператор извлекает медицинское изделие 1 , заменяет картридж 13 и снова вводит медицинское изделие 1 в желудок.Затем, как показано на фиг. 9, щипцовая часть 101 лечебного инструмента 100 захватывает вторую точку захвата P 2 . Вторая точка захвата P 2 расположена в конце линии разреза вдоль первых линий чертежа L 1 и напротив первой точки захвата P 1 .
Затем оператор отводит обрабатывающий инструмент 100 и, как показано на ФИГ. 10, втягивает ткань ST стенки желудка, захваченную пинцетом 101 , в пару браншей 11 и 12 вдоль второй линии чертежа L 2 .В это время ткань стенки желудка ST нарисована так, что линия гребня rg ткани стенки желудка ST, которая сложена так, что внешние поверхности желудка соприкасаются друг с другом, проходит через внутреннюю часть пары захватов 11 и 12 .
После этого, если наложение швов и рассечение выполняются той же операцией, что и описанная выше, ткань стенки желудка ST разрезают по вторым линиям чертежа L 2 . Кроме того, поскольку первые линии L 1 чертежа и вторые линии L 2 чертежа образуют замкнутый четырехугольник, как показано на фиг.2, ткань ST стенки желудка в области вырезания R, включая опухоль Tm, разрезается и отделяется от желудка Sm, как показано на фиг. 11, линией разреза, образованной вдоль первых линий чертежа L 1 и вторых линий чертежа L 2 . Таким образом, часть ткани стенки желудка ST иссекают на всю толщину, не формируя отверстие, позволяющее желудку Sm сообщаться с брюшной полостью.
После окончания иссечения оператор извлекает медицинское устройство 1 , собирает иссеченную ткань стенки желудка ST (иссеченный кусок) и завершает процедуру.В это время иссеченный фрагмент захватывается щипцовой частью 101 , и можно одновременно выполнять извлечение медицинского устройства 1 и сбор иссеченного фрагмента.
Как описано в начале, иссечение по всей толщине в предшествующем уровне техники выполнялось посредством лапаротомии и лапароскопической хирургии. Однако было изучено, что это иссечение выполняется через естественное отверстие, такое как рот, с точки зрения уменьшения инвазивности для пациента или снижения риска рецидива при иссечении опухоли.
Обычно в случае осмотра желудка с помощью эндоскопа и т.п. для получения хорошего поля зрения в желудок подается воздух и желудок надувается. Даже в том случае, когда выполняется иссечение на всю толщину, необходимо проводить процедуру с достаточным наблюдением, чтобы опухоль не была разрезана. Следовательно, в желудке необходимо достаточное количество газа (жидкости).
Однако, как показано на ФИГ. 7А и 7В, если вытянуть часть ткани стенки желудка для выполнения иссечения по всей толщине, объем желудка уменьшится.Следовательно, если количество жидкости в желудке постоянно, внутреннее давление повышается. В результате увеличивается напряжение желудка Т и требуется большее усилие натяжения. Несмотря на то, что сила захвата или сила натяжения терапевтического инструмента, который захватывает ткань стенки желудка, может быть до некоторой степени улучшена за счет усовершенствования терапевтического инструмента, существует предел толерантности ткани, поскольку толщина и т.п. ткани обычно ограничены. к фиксированному диапазону, даже если учитываются индивидуальные различия.В результате, если требуемое усилие протягивания становится слишком большим, ткань не может противостоять усилию протягивания, и, следовательно, может возникнуть проблема, заключающаяся в том, что отрывается только часть, захваченная инструментом для обработки.
В методе иссечения ткани в соответствии с настоящим вариантом осуществления часть жидкости в желудке удаляется из желудка во время второго процесса, при этом внутреннее давление не повышается и поддерживается на фиксированном уровне, даже если объем живот уменьшается за счет прорисовки тканей.Соответственно, требуемое усилие вытягивания не увеличивается чрезмерно, и ткань может быть выгодно вытянута для выполнения иссечения по всей толщине.
Кроме того, поскольку третий процесс и четвертый процесс выполняются после втягивания ткани в сравнительно узкий щелевидный зазор между парой сомкнутых браншей 11 и 12 , даже если другие внутренние органы, ткани или подобные, примыкающие к желудку, могут сблизиться, этому препятствует входное отверстие щели.Соответственно, даже при доступе через естественное отверстие, при котором внешняя часть желудка не может быть распознана визуально, можно предотвратить возникновение ситуации, в которой эти внутренние органы, ткани и т.п. случайно сшиваются или разрезаются вместе с желудком.
Хотя предпочтительные варианты осуществления изобретения были описаны и проиллюстрированы выше, следует понимать, что они являются примерами изобретения и не должны рассматриваться как ограничивающие. Дополнения, пропуски, замены и другие модификации могут быть сделаны без отклонения от сущности или объема настоящего изобретения.
Во-первых, медицинское устройство, используемое для метода иссечения ткани по изобретению, не ограничивается устройством, имеющим описанную выше функцию степлера. Например, для наложения швов может использоваться обычная изогнутая игла или шовный блок, в котором анкер (анкеры) прикреплен/прикреплены к одному или обоим концам шовной нити, или так называемые холодные резаки, такие как скальпель, или электрические инструменты для иссечения, такие как электрический скальпель или высокочастотный нож, могут использоваться для разрезания.
Кроме того, щелевидная щель, в которую втягивается ткань стенки желудка, также не ограничивается щелью между сомкнутыми челюстями.Например, в пластинчатом элементе, имеющем фиксированную жесткость, может быть сформирована прорезь, и ткань может быть захвачена зажимными щипцами или подобными средствами для втягивания ткани в прорезь.
Как описано выше, способ иссечения ткани по изобретению может быть осуществлен, если разрез сохраняет фиксированную форму, даже если ткань втянута, средства для сшивания ткани и средства для разрезания ткани гарантированы. Если ширина щели установлена в диапазоне, который равен или меньше двойной толщины ткани полого органа, это является предпочтительным, поскольку можно успешно выполнить как вытягивание ткани, так и исключение соседних тканей.
Кроме того, в приведенном выше варианте осуществления описан пример, в котором пара зажимов открывается и закрывается посредством операции. Вместо этого к паре зажимов может быть прикреплен упругий элемент, такой как пружина, и пара зажимов может всегда смещаться в направлении, в котором зажимы смыкаются под действием восстанавливающей силы упругого элемента. Кроме того, в состоянии, когда пара зажимов закрыта восстанавливающей силой упругого элемента, можно заранее выполнить настройку, чтобы между парой зажимов можно было образовать щель меньше заданной толщины, или можно настроить так, чтобы поверхности захвата пары губок соприкасались друг с другом.
При такой конфигурации, если между парой браншей предполагается втягивание ткани, пара браншей открывается против смещающей силы (восстанавливающей силы) в направлении, в котором бранши закрываются упругим элементом, и ткань втягивается между парой челюстей. При этом в щель с заданной шириной, равной толщине ткани, между парой челюстей помещается сложенная полая ткань. В результате, аналогично вышеупомянутому варианту осуществления, имеется преимущество, состоящее в том, что можно одновременно выполнять как вытягивание полой ткани, так и исключение тканей, прилегающих к ткани просвета.
Кроме того, хотя в приведенном выше варианте осуществления описан пример, в котором сшивание и разрезание выполняются дважды, а ткань иссекается, количество сшиваний и разрезов не ограничивается двумя раза. Например, в случае, когда из-за большой опухоли и т.п. устанавливается большая область иссечения, разрез может не производиться дважды в зависимости от размера челюстей. В таком случае, если второе наложение швов и разрезание выполняются в случае, когда часть полого органа оттянута так, что линия хребта сложенного полого органа не проходит через внутреннюю часть разреза, ткань, подлежащая иссечению, удаляется. не рассечены и отделены после повторного сшивания и рассечения.После этого вся толщина области произвольного размера может быть иссечена путем повторения того же самого сшивания и разрезания по мере необходимости и, наконец, выполнения сшивания и разрезания таким образом, чтобы линия хребта полого органа проходила через внутреннюю часть разреза.
Кроме того, в способе иссечения ткани по изобретению способ перемещения жидкости может быть задан по-разному. Например, в дополнение к перемещению жидкости параллельно с вытягиванием ткани заранее заданное количество жидкости может быть перемещено перед вытягиванием ткани.Однако, если жидкость чрезмерно перемещается перед забором ткани, возникает случай, когда желудок чрезмерно сжимается, и наблюдение за опухолью и т.п. не может быть выполнено с пользой. Следовательно, предпочтительно, чтобы объем, подлежащий перемещению перед извлечением ткани, был установлен на заданное значение или меньше, и чтобы желудок не сжимался.
Более того, хотя в приведенном выше варианте осуществления был описан пример, в котором сшивание выполняется с обеих сторон линии разреза, вместо этого сшивание может быть выполнено только с одной стороны линии разреза, которая становится внешней стороной иссечения область.Это связано с тем, что иссеченный участок не обязательно зашивают. Однако в этом случае, поскольку во время процедуры возникает состояние, при котором отверстие временно открывается в полом органе, в случае, когда отверстие предназначено для того, чтобы не открываться даже во время манипуляции, предпочтительно выполнять ушивание на с обеих сторон от линии разреза.
- Гастроэнтеролог купчино: 20 гастроэнтерологов в Купчино СПб, 141 отзыв
- Переизбыток йода в организме последствия: Избыток йода — признаки, причины, симптомы, лечение и профилактика

 Во время этой процедуры перерезают связку, которая крепит половой член к лобковой кости. Из‑за этого пенис в неэрегированном состоянии обвисает и кажется чуть длиннее, чем был. Возможное осложнение лигаментотомии — нестабильность полового члена во время эрекции. Он слишком легко качается из стороны в сторону, что может доставлять серьёзные неудобства.
Во время этой процедуры перерезают связку, которая крепит половой член к лобковой кости. Из‑за этого пенис в неэрегированном состоянии обвисает и кажется чуть длиннее, чем был. Возможное осложнение лигаментотомии — нестабильность полового члена во время эрекции. Он слишком легко качается из стороны в сторону, что может доставлять серьёзные неудобства. Иногда в состав таких средств включают раздражающие вещества, из‑за которых пенис слегка отекает. Но этот эффект, во‑первых, временный, а во‑вторых, небезопасный: непонятно, как на такое раздражение отреагирует орган. Возможно всё, вплоть до тяжёлых аллергических реакций.
Иногда в состав таких средств включают раздражающие вещества, из‑за которых пенис слегка отекает. Но этот эффект, во‑первых, временный, а во‑вторых, небезопасный: непонятно, как на такое раздражение отреагирует орган. Возможно всё, вплоть до тяжёлых аллергических реакций. Однако медики относятся к таким процедурам скептически и настаивают, что вопрос требует дополнительного изучения. Лишь это поможет оценить эффективность и, что более важно, безопасность растяжек.
Однако медики относятся к таким процедурам скептически и настаивают, что вопрос требует дополнительного изучения. Лишь это поможет оценить эффективность и, что более важно, безопасность растяжек. Специалист не увеличит ваш член. Но поможет разобраться, почему нормальные размеры полового органа всё равно заставляют вас нервничать. Возможно, ваша сниженная самооценка на самом деле связана отнюдь не с физическими размерами некоторых частей тела. И психотерапевт подскажет, как это исправить.
Специалист не увеличит ваш член. Но поможет разобраться, почему нормальные размеры полового органа всё равно заставляют вас нервничать. Возможно, ваша сниженная самооценка на самом деле связана отнюдь не с физическими размерами некоторых частей тела. И психотерапевт подскажет, как это исправить.

 Подразумевает подшивание к органу лоскута подходящей формы с брюшной стенки с соединением кровеносных сосудов. В результате можно достичь увеличения размеров на 3-4 см;
Подразумевает подшивание к органу лоскута подходящей формы с брюшной стенки с соединением кровеносных сосудов. В результате можно достичь увеличения размеров на 3-4 см;