Бессимптомная гиперурикемия – Бессимптомная гиперурикемия » CardioПланета — профессиональная информация о заболеваниях сердца и сосудов
Бессимптомная гиперурикемия » CardioПланета — профессиональная информация о заболеваниях сердца и сосудов
— является независимым и модифицируемым фактором риска сердечно-сосудистой заболеваемости и смертности.

Роль мочевой кислоты как предиктора сердечно-сосудистой заболеваемости и смертности изучалась практически во всех крупных популяционных исследованиях.
Сопоставление двух наиболее крупных исследований — NHANES и Framingham Heart Study — показало, что в целом в популяциях с более высоким кардиоваскулярным риском возрастает роль мочевой кислоты как независимого фактора риска сердечно-сосудистой заболеваемости и смертности (кардиоваскулярная смертность была почти в 2 раза выше у лиц, включенных в исследование NHANES, в сравнении с Framingham Heart Study).
В настоящее время доказана роль гиперурикемии как независимого предиктора кардиоваскулярной заболеваемости и смертности у больных ишемической болезнью сердца, хронической и острой сердечной недостаточностью, артериальной гипертензией и предгипертензией и метаболическим синдромом.
Гиперурикемия и ИБС
 Данные исследования MONICA/KORA Cohort Study
показали, что у больных с документированной ИБС повышение уровня мочевой
кислоты, независимо от других известных факторов риска, ассоциировалось с
достоверным и значительным увеличением как сердечно-сосудистой, так и общей
смертности. У больных инфарктом миокарда с элевацией
сегмента ST повышение уровня мочевой кислоты — также независимый предиктор
неблагоприятных исходов.
Данные исследования MONICA/KORA Cohort Study
показали, что у больных с документированной ИБС повышение уровня мочевой
кислоты, независимо от других известных факторов риска, ассоциировалось с
достоверным и значительным увеличением как сердечно-сосудистой, так и общей
смертности. У больных инфарктом миокарда с элевацией
сегмента ST повышение уровня мочевой кислоты — также независимый предиктор
неблагоприятных исходов.Крупное исследование влияния различных факторов на выраженность атеросклеротического поражения коронарных артерий по данным коронарографии показало, что уровень мочевой кислоты является более значимым фактором, определяющим степень поражения коронарных артерий, чем снижение уровня ЛПВП, повышение АД и возраст больных [ Hu W. et al., 2009].
Гиперурикемия и хроническая сердечная недостаточность
Несколько исследований показали, что бессимптомная гиперурикемия является независимым предиктором смертности и потребности в трансплантации сердца у больных с ХСН.
При повышении уровня мочевой кислоты более 520 мкмоль/л риск смерти в течение года у больных с ХСН возрастал в 7 раз, а при повышении более 800 мкмоль/л — в 18,6 раза.
Гиперурикемия не только предиктор неблагоприятных исходов у больных с ХСН, но и независимый фактор риска развития сердечной недостаточности у лиц старше 60 лет.
Повышение уровня мочевой кислоты увеличивает риск смерти и у больных с острой сердечной недостаточностью.
По данным Alimonda A.L.(2009) при уровне мочевой кислоты менее 425 мкмоль/л смертность от всех причин была 21,6%, а при уровне более 425 мкмоль/л смертность была почти в 2 раза выше и составила 39,7%.
Патогенез бессимптомной гиперурикемии
Повышенное потребление с пищей пуринов и/или белков, высокие дозы алкоголя или нарушения в системе ферментов, метаболизирующих ксантины, снижение скорости клубочковой фильтрации, прием тиазидных или тиазидоподобных диуретиков приводит к увеличению уровня мочевой кислоты в плазме.В свою очередь, при постоянной гиперурикемии развитие артериальной гипертензии связано с развитием прегломерулярной артериопатии и тубулоинтерстициальным поражением.
Повышение уровня мочевой кислоты стимулирует активацию ренин-ангиотензиновой системы и усугубляет дисфункцию эндотелия.
Кроме того, в условиях ишемии происходит превращение фермента ксантиноксиредуктазы в ксантиноксидазу, что приводит к изменению метаболизма ксантинов, превращению мочевой кислоты из антиоксиданта в прооксидант и стимулированию оксидативного стресса.
Гиперурикемия приводит к эндотелиальной дисфункции за счет угнетения синтеза NO. Этот эффект мочевой кислоты обусловлен ее прооксидантными свойствами в условиях измененного метаболизма.
Мочевая кислота также стимулирует пролиферацию гладкомышечных клеток сосудов путем активации ростовых факторов, вазоконстрикторных и провоспалительных молекул.

Таким образом, мочевая кислота является не только маркером, но и активным компонентом развития артериальной гипертензии.
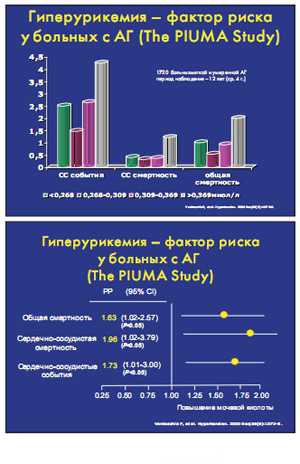 Краеугольным камнем в понимании роли мочевой
кислоты как независимого предиктора кардиоваскулярной заболеваемости и
смертности у больных артериальной гипертензией стало исследование PIUMA Study,
включавшее 1720 больных АГ, наблюдавшихся в течение 12 лет.
Краеугольным камнем в понимании роли мочевой
кислоты как независимого предиктора кардиоваскулярной заболеваемости и
смертности у больных артериальной гипертензией стало исследование PIUMA Study,
включавшее 1720 больных АГ, наблюдавшихся в течение 12 лет.С другой стороны, у больных АГ с низким исходным уровнем мочевой кислоты (менее 268 мкмоль/л) также было достоверно больше количество сердечно-сосудистых событий и выше общая смертность.
В исследовании SHEP подтвердилась линейная зависимость у больных с АГ количества кардиоваскулярных событий, за исключением инсультов, от исходного уровня мочевой кислоты.
Терапия тиазидным диуретиком в обычных терапевтических дозах (25 мг хлорталидона) у половины больных в течение года привела к повышению уровня мочевой кислоты.
Однако наиболее важно то, что в группе больных, у которых применение тиазидного диуретика привело к повышению уровня МК, количество сердечно-сосудистых событий было на 42 % выше, чем в группе больных, у которых не было отмечено повышение мочевой кислоты.
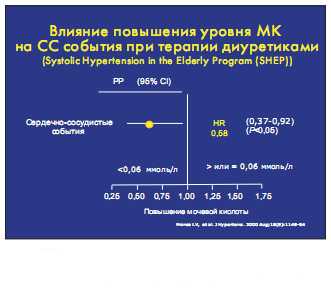
Исследование SHEP дало два важных вывода для клинической практики.
Применение тиазидных диуретиков в обычных терапевтических дозах приводит у половины больных в течение года к бессимптомному повышению уровня мочевой кислоты, с которым ассоциируется значительное увеличение количества кардиоваскулярных событий.
Следовательно, у таких больных необходимо мониторирование уровня мочевой кислоты и его снижение.
Доказана роль мочевой кислоты и в развитии гипертрофии миокарда левого желудочка у больных артериальной гипертензией.
Полагают, что мочевая кислота обладает способностью стимулировать рост кардиомиоцитов.
Повышение уровня мочевой кислоты в пределах 390–650 ммоль/л значительно и достоверно увеличивало количество больных с гипертрофией ЛЖ независимо от индекса массы тела, уровня креатинина, наличия диабета и дислипидемии. Аналогичные результаты были получены у лиц с нормальным артериальным давлением (Mitsuhashi H., 2009).
Гиперурикемия также рассматривается как важный компонент метаболического синдрома. Более того, первые определения метаболического синдрома включали гиперурикемию как основной компонент наряду с гипертензией и гипергликемией. Многочисленные исследования позволили четко определить роль мочевой кислоты в патогенезе метаболического синдрома.
Таким образом, гиперурикемия — сильный, независимый и, главное, модифицируемый предиктор сердечно-сосудистой и общей смертности у больных с высоким и очень высоким сердечно-сосудистым риском (АГ, ИБС, цереброваскулярные заболевания, ХСН, метаболический синдром/сахарный диабет).
Соответственно, необходима разработка методов коррекции бессимптомной гиперурикемии и доказательство их эффективности в рандомизированных проспективных исследованиях.
Лечение бессимптомной гиперурикемии.
Диета: Уменьшить до минимума употребление пищи, при расщеплении которой образуется значительное количество мочевой кислоты — это мясные супы и отвары, жирное, жареное и копченое мясо, паштеты, сало, печень, почки, мозги, наваристые бульоны, говяжий язык, грибы, сардины, шпроты, селедку, рыбная икра, рыбная уха, жареную рыба, кильки, фасоль, горох, пиво, помидоры, шпинат, цветная капуста, кофе, какао, шоколад.Бедны пуринами молоко и молочные продукты, яйца, картофель, большинство овощей, хлеб, крупы, фрукты и ягоды.
Из минеральных вод лучше выбирать щелочные минеральные воды.
Медикаментозное лечение гиперурикемии
Целесообразность использования специфической антиурикемической терапии у больных кардиоваскулярными заболеваниями с бессимптомной гиперурикемией требует доказательства в рандомизированных исследованиях (2012 Update on Diagnosis and Management of Gout).
Аналогично профилактика мочекаменной болезни не оправдана у большинства лиц с бессимптомной гиперурикемией, но терапия должна быть начата после обнаружения камней.
Однако коррекцию необходимо начать с подщелачивания, используя цитрат калия или бикарбонат калия, витамин С, но не с аллопуринола.
Критерии для назначения антиурикемической терапии у пациентов:
1) с круглосуточной гиперурикемией и с устойчивой концентрацией мочевой кислоты в сыворотке крови более 773 мкмоль/л у мужчин и 595 мкмоль/л у женщин.
Однако, эта рекомендация не относится к пациентам с сердечной недостаточностью, у которых гиперурикемия возникает вследствие почечной гипоперфузии и снижения экскреции уратов.
Такие пациенты обычно имеют прогрессирующую сердечную недостаточность с ограниченной продолжительности жизни (если только они не подвергаются трансплантации) и низкий уровень риска возникновения хронической уратной нефропатии;
2) следует рассмотреть назначение аллопуринола если на фоне диетического ограничения пуринов не уменьшается выведение мочевой кислоты менее чем 1000 мг/сут (5,9 ммоль/сут). При этом, доза аллопуринола должна быть скорректирована, чтобы уменьшить выведение мочевой кислоты ниже 800 мг/сут (4,8 ммоль/сут).
Так как, при экскреции мочевой кислоты более 1100 мг/сут (6,5 ммоль/сут) на 50% увеличивается риск возникновения уратных камней.
3) У больных, получающих лучевую терапии или химиотерапию для предотвращения острой уратной нефропатии и других проявлений синдрома лизиса опухоли.
У пациентов с высоким риском профилактическое лечение включает внутривенную гидратацию и аллопуринол или расбуриказа (рекомбинантная уратоксидаза).
Препараты с дополнительным урикозурическим эффектом, которые используются при лечении больных с сердечно-сосудистыми заболеваниями:
— лосартан;
— аторвастатин;
— фенофибрат.
Наиболее хорошо изучено влияние на гиперурикемию лосартана в большом количестве рандомизированных и нерандомизированных исследований. Наиболее крупное исследование — J-HEALTH, проведенное в Японии.
В ходе терапии лосартаном 88% больных достигли целевого уровня АД, при этом 3,6% больных имели побочные эффекты, что сопоставимо с плацебо.
Влияние лосартана на уровень мочевой кислоты зависело от исходного уровня и не коррелировало с изменениями АД и гемодинамики, показателями липидного обмена и вариабельностью сердечного ритма.
Лосартан также обладает способностью устранять гиперурикемию, связанную с применением тиазидных и тиазидоподобных диуретиков.
Проведенные многочисленные исследования с различными комбинациями сартанов и тиазидных диуретиков продемонстрировали уникальность данного свойства молекулы лосартана.
 Ни один из сартанов, кроме
лосартана, не обладал способностью снижать уровень мочевой кислоты при
комбинации с тиазидными и тиазидоподобными диуретиками.
Ни один из сартанов, кроме
лосартана, не обладал способностью снижать уровень мочевой кислоты при
комбинации с тиазидными и тиазидоподобными диуретиками. 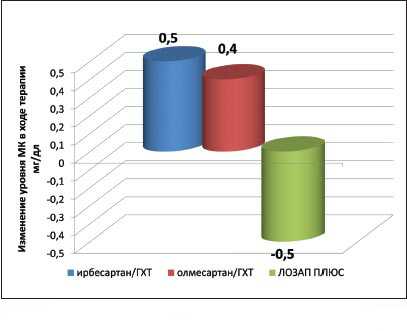
- У больных АГ повышение уровня мочевой кислоты повышает фатальных сердечно-сосудистых событий и общей смертности.
- Повышение уровня мочевой кислоты у больных абдоминальным ожирением — независимый предиктор кардиоваскулярной смертности, развития сахарного диабета, артериальной гипертензии и нефролитиаза.
- При лечении больных АГ тиазидными и тиазидоподобными диуретиками повышение уровня мочевой кислоты — независимый предиктор увеличения сердечно-сосудистой смертности.
- При гиперурикемии у больных с АГ лосартан снижает уровень мочевой кислоты за счет урикозурического эффекта.
- У больных с АГ и гиперурикемией вследствие применения тиазидных или тиазидоподобных диуретиков необходимо комбинировать их с лосартаном.
Бильченко
А.В. «Коррекция гиперурикемии как фактора риска сердечно-сосудистой
заболеваемости и смертности»
Uptodate.com
www.cardioplaneta.ru
Бессимптомная гиперурикемия – польза или вред? | Ильина А.Е., Барскова В.Г., Насонов Е.Л.
Согласно рекомендациям EULAR (Европейской антиревматической лиги) гиперурикемией (ГУ) считается повышение мочевой кислоты (МК) сыворотки крови выше 360 мкмоль/л [1,2]. Бессимптомное увеличение уровня МК имеют 5–8% популяции, из них только у 5–20% развивается подагра – системное заболевание, при котором в различных тканях откладываются кристаллы моноурата натрия и у лиц с ГУ развивается воспаление, обусловленное внешнесредовыми и/или генетическими факторами [1,3]. Наиболее распространенными причинами, влияющими на уровень МК, являются ожирение, инсулинорезистентность, метаболический синдром [4–7], артериальная гипертензия [8–14], применение диуретиков и низких доз ацетилсалициловой кислоты [15–21], избыточное употребление алкоголя [22,23], пожилой возраст [24–27], почечная недостаточность [28,29]. Среди них лидирует метаболический синдром и его компоненты. Распространение метаболического синдрома возрастает с каждым годом, что отчасти объясняет увеличение частоты встречаемости ГУ и подагры [30]. Так, за период с 1950 по 1980 г. в популяции средний уровень МК в сыворотке крови повысился с 5 до 6 мг/дл [31].
В настоящее время все более актуальным становится вопрос: насколько «безвредна» бессимптомная ГУ [32]? По мнению некоторых исследователей, повышение МК может благоприятно влиять на организм. Например, Orowan E. утверждает, что по своей химической структуре МК сходна с триметилированным ксантин кофеином и поэтому способна повышать умственную и физическую работоспособность [33]. Многочисленные исследования в 1960–70–х годах подтверждали, что люди с ГУ отличаются более высоким интеллектом и быстротой реакции [34–36]. Однако в большинстве работ показан сравнительно небольшой биологический эффект, к тому же возможное влияние оказал социо–экономический статус участников. Тем не менее эти исследования являются некоторым подтверждением умеренного нейростимулирующего действия МК.Другим полезным свойством МК считается ее способность действовать в качестве антиоксиданта, блокирующего супероксид, пероксинитрит и катализируемые железом окислительные реакции [37]. Ряд авторов свидетельствуют, что повышенная МК может быть одним из ключевых антиоксидантов плазмы и предотвращать связанный со старением окислительный стресс, тем самым способствуя продлению жизни [37]. Как показали исследования, инфузия МК людям повышает антиоксидантную активность сыворотки и улучшает функцию эндотелия [38]. Способность ГУ уменьшать пероксинитрит–опосредованное образование нитротирозина свидетельствует о нейропротекторных свойствах МК, что особенно важно при рассеянном склерозе, болезни Паркинсона, инсульте и других неврологических заболеваниях. По данным эпидемиологических исследований, лица с ГУ значительно реже страдают рассеянным склерозом, болезнью Паркинсона и Альцгеймера, а инфузия МК может уменьшать неврологические проявления, полученные экспериментальным путем (например, при экспериментальном аллергическом энцефаломиелите) [39]. Недавние исследования показали, что благоприятный эффект МК при этих состояниях связан, скорее, не с ее нитротирозин–подавляющим антиоксидантным действием, а со способностью блокировать гемато–энцефалический барьер или с воздействием на астроглиальные клетки [40,41].
Наряду с данными о некотором положительном влиянии МК, большинство работ связывают ГУ с развитием кардиоваскулярных заболеваний (КВЗ) и поражением почек [42]. Так, повышение МК ассоциировано с артериальной гипертензией, повышенной реабсорбцией натрия в проксимальных почечных канальцах, микроальбуминурией, протеинурией, поражением почек, ожирением, гипертриглицеридемией, низким содержанием холестерина липопротеидов высокой плотности, гиперинсулинемией, гиперлептинемией, гипоадипонектинемией, поражением периферических, сонных и коронарных артерий, эндотелиальной дисфункцией, окислительным стрессом, увеличением концентрации ренина, эндотелина и С–реактивного белка. Уровень МК выше у постменопаузальных женщин по сравнению с женщинами в пременопаузе и у городских жителей по сравнению с сельскими [31,43,44].
Связь между ГУ и риском развития КВЗ установлена в ходе крупных эпидемиологических исследований [45–48]. Доказана взаимосвязь ГУ с артериальной гипертензией, сахарным диабетом, инсулинорезистентностью, ожирением и обусловленными атеросклерозом сердечно–сосудистыми заболеваниями [45–49]. Однако остается неясным, является ли ГУ причиной или следствием кардиоваскулярной патологии, отражая наличие других факторов риска, таких как артериальная гипертензия, дислипидемия и диабет [50]. В исследовании NHANES I (the National Health and Nutrition Examination Survey) выявлена независимая связь между ГУ и ростом сердечно–сосудистой летальности. С повышением уровня МК риск смерти от ИБС возрастал на 77% у мужчин и на 300% у женщин. Увеличение концентрации МК на 1 мг/дл (59,5 мкмоль/л) ассоциировалось со значительным увеличением летальности от КВЗ как среди мужчин, так и среди женщин [10]. 12–летнее исследование (PIUMA), в котором участвовало более 1500 ранее не леченных пациентов с АГ, также продемонстрировало, что уровень МК сыворотки – сильный предиктор кардиоваскулярной заболеваемости и смертности [51]. У пациентов с сердечной недостаточностью повышение уровня МК рассматривается как показатель плохого прогноза и свидетельствует о необходимости трансплантации сердца [52]. Изучение больных сахарным диабетом 2 типа показало значительное повышение частоты инсульта при росте уровня МК. При этом связь оставалась значимой даже после исключения других кардиоваскулярных факторов риска [53]. Между тем результаты Фрамингемского исследования не выявили значительной связи между уровнем МК и кардиоваскулярной заболеваемостью [50]. Изучалась ассоциация уровня МК с поражением органов–мишеней у пациентов с АГ. Полученные результаты также неоднозначны. В ряде исследований получена взаимосвязь ГУ с массой миокарда левого желудочка и другими маркерами органного поражения [54–57]. Другие авторы не выявили значимой ассоциации МК с массой ЛЖ, поражением сонных артерий или микроальбуминурией [58]. В отличие от популяционных данных, результаты которых в отношении независимого значения МК, как фактора риска, противоречивы; в группах больных, собранных по нозологическому принципу, установленa значимость ГУ в качестве фактора риска развития КВЗ и связанных с ними осложнений. Это касается больных подагрой, а также пациентов с ревматоидным артритом [59] и системной склеродермией [60]. При этом показано, что не только кристаллы моноурата натрия, но и растворимая мочевая кислота при бессимптомной ГУ может приводить к увеличению уровня воспалительных медиаторов и индуцировать пролиферацию сосудистых гладкомышечных клеток in vitro [43,61–65]. Многие из этих «провоспалительных» медиаторов имеют фундаментальное значение в патогенезе атеросклеротического поражения сосудов и его осложнений [64,65].
В настоящее время предложено несколько механизмов, с помощью которых МК может участвовать в развитии КВЗ. Так, Johnson R.J. и соавт. в серии экспериментов на животных показали, что умеренное повышение МК может вызывать едва заметные гломерулотубулярные повреждения, способствующие активации ренин–ангиотензиновой системы (РАС) и повышению АД, при этом все изменения претерпевали обратное развитие после устранения ГУ [43, 66]. Sanchez–Lozada L.G. и соавт., изучая афферентные артериолы на крысиных моделях подагры, нашли, что высокие цифры МК могут индуцировать сосудистое повреждение, прекращавшееся при использовании аллопуринола [67]. Также показано, что ГУ вызывает констрикцию почечных сосудов, коррелирует с активностью РАС [67–69], участвует в развитии дисфункции эндотелия [70]. Имеются данные о том, что МК индуцирует пролиферацию сосудистых гладкомышечных клеток in vitro [62], активируя факторы транскрипции и сигнальные молекулы, вызывая гиперэкспрессию циклооксигеназы, тромбоцитарного фактора роста и моноцитарного хемоаттрактантного белка. МК и фермент ксантиноксидаза часто выявляются в атеросклеротических бляшках [71,72]. Свободные радикалы, встречающиеся при ГУ, стимулируют перекисное окисление липидов, ответственное за утолщение комплекса интима–медиа сонных артерий [62,68]. Другие потенциальные механизмы, с помощью которых ГУ и/или повышенная активность ксантиноксидазы могут способствовать сосудистому повреждению, включают адгезию тромбоцитов, пролиферацию гладкомышечных клеток сосудов и стимуляцию воспалительного ответа. Таким образом, ГУ может реализовывать свое патологическое влияние на сосуды различными путями [42].
У крыс не развивается ГУ за счет наличия у них фермента уриказы, превращающего МК в аллантоин. Интересно, что подавление уриказы у крыс приводит к возникновению гипертензии, опосредованной эндотелиальной дисфункцией и активацией ренин–ангиотензиновой системы, со временем переходящей в нефрогенную в связи с развитием у них артериолосклеротического повреждения сосудов [73,74]. С этим согласуются данные других исследований, в которых ГУ предшествовала возникновению АГ [75,76]. ГУ была обнаружена у почти 90% подростков с впервые диагностированной АГ [77]. В пилотных исследованиях уменьшению уровня МК аллопуринолом сопутствовало снижение АД [78].
Результаты исследований свидетельствуют, что коррекция ГУ может предотвращать развитие сердечно–сосудистых катастроф. Исследование LIFE впервые показало, что у больных с АГ и гипертрофией левого желудочка медикаментозное снижение МК может уменьшать кардиоваскулярный риск [79,80].
Таким образом, значение ГУ в развитии КВЗ вызывает много вопросов. Так, если острое повышение МК оказывает антиоксидантное действие и благоприятно влияет на функцию эндотелия, то хроническая ГУ, напротив, способствует развитию окислительного стресса и эндотелиальной дисфункции. Возможно, это связано с различными внутриклеточным и внутрисосудистым влияниями острой и хронической ГУ [81, 82].
Клинические исследования показали, что блокатор ксантиноксидазы аллопуринол может улучшать функцию эндотелия, снижать кардиоваскулярные осложнения у пациентов, перенесших аорто–коронарное шунтирование, и улучшать кардиальную функцию у пациентов с дилатационной кардиомиопатией и застойной сердечной недостаточностью [83–86]. Однако другие уратснижающие агенты не продемонстрировали подобных результатов [87,88]. Нельзя исключить, что эти эффекты обусловлены ингибированием ксантиноксидазы и не связаны со снижением МК или ингибиторы ксантиноксидазы преимущественно влияют на внутриклеточную МК, с которой связывают большинство кардиоренальных эффектов [89]. Если ГУ действительно влияет на клинические исходы, то диетарные и фармакологические вмешательства, направленные на снижение МК, могут стать новым методом профилактики сердечно–сосудистых заболеваний. Будем надеяться, что дальнейшие исследования в скором времени подскажут ответы на эти вопросы.
Литература
1. Ревматология: национальное руководство, 2008.
2. W Zhang, M Doherty, E Pascual, T Bardin, V Barskova, P Conaghan, J Gerster, J Jacobs, B Leeb, F Liote?, G McCarthy, P Netter, G Nuki, F Perez–Ruiz, A Pignone, J Pimenta?o, L Punzi, E Roddy, T Uhlig, I Zimmermann–Go`rska. EULAR evidence based recommendations for gout. Part I: Diagnosis. Report of a task force of the standing committee for international clinical studies including therapeutics (ESCISIT). Ann Rheum Dis 2006; 65:1301–1311.
3. Campion E.W.; Glynn R.J.; DeLabry L.O. Asymptomatic hyperuricemia. Risks and consequences in the Normative Aging Study. Am J Med. 1987; 82(3):421–6.
4. Choi H.K., Atkinson K., Karlson E.W., Curhan G. Obesity, weight change, hypertension, diuretic use, and risk of gout in men: the Health Professionals Follow–up Study // Arch Intern Med.– 2005.– № 165.– р. 742–748.
5. Dessein P.H., Shipton E.A., Stanwix A.E., Joffe B.I., Ramokgadi J. Beneficial effects of weight loss associated with moderate calorie/carbohydrate restriction, and increased proportional intake of protein and unsaturated fat on serum urate and lipoprotein levels in gout: a pilot study // Ann Rheum Dis.– 2000.– № 59.– р. 539–543.
6. Fam A.G. Gout, diet, and the insulin resistance syndrome // J Rheumatol.– 2002.– № 29.– р. 1350–5.
7. Lin K.C., Lin H.Y., Chou P. Community based epidemiological study on hyperuricemia and gout in Kin–Hu, Kinmen // J Rheum.– 2000.– № 27.– р. 1045–50.
8. Alper A.B. Jr, Chen W., Yau L., Srinivasan S.R., Berenson G.S., Hamm L.L. Childhood uric acid predicts adult blood pressure: the Bogalusa Heart Study // Hypertension. – 2005.– №45.– р. 34–38.
9. Grodzicki T., Palmer A., Bulpitt C.J., Incidence of diabetes and gout in hypertensive patients during 8 year of follow–up // J Hum Hypertens.– 1997.– № 11.– р. 583–585.
10. Fang J., Alderman M. Serum uric acid and cardiovascular mortality: The NHANES I epidemiologic follow–up study, 1971–1992. National Health and Nutrition Examination Survey // JAMA.– 2000.– № 238.– р. 2404–10.
11. Johnson R.J., Kang D.H., Feig D., et al. Is there a pathogenetic role for uric acid in hypertension and cardiovascular and renal disease? // Hypertension.– 2003.– № 41.– р. 1183–90.
12. Mazzali M., Hughes J., Kim Y.G., et al. Elevated uric acid increases blood pressure in the rat by a novel crystal–independent mechanism // Hypertension.– 2001.– № 38.– р. 1101–6.
13. Tykarski A. Evaluation of renal handling of uric acid in essential hypertension: hyperuricemia related to decreased urate secretion // Nephron.– 1991.– № 59.– р. 364–368.
14. Breckenridge A. Hypertension and hyperuricaemia // Lancet.– 1966.–№ 1. р. 15–18.
15. Aronoff A. Acute gouty arthritis precipitated by chlorotiazide // N Engl J Med.– 1960.– № 262.– р. 767–769.
16. Campion E.W., Glynn RJ, DeLabry LO. Asymptomatic hyperuricemia. Risks and consequences in the Normative Aging Study // Am J Med.– 1987.–№ 82.– р. 421–426.
17. Grodzicki T., Palmer A., Bulpitt C.J., Incidence of diabetes and gout in hypertensive patients during 8 year of follow–up // J Hum Hypertens.– 1997.– № 11.– р. 583–585.
18. Lane P. Drug–induced gout // Br. Med J.– 1960.– № 2.– р. 1383–4.
19. Laragh J.H., Heinemann H.O. Demartini F.F. Effect of chlorothiazide on electrolyte transport in man; its use in the treatment of edema of congestive heart failure, nephrosis, and cirrhosis // JAMA.– 1958.– № 166.– р. 145–152.
20. Lin K.C., Lin H.Y., Chou P. Community based epidemiological study on hyperuricemia and gout in Kin–Hu, Kinmen // J Rheum.– 2000.– № 27.– р. 1045–50.
21. Oren B.G., Rich M., Belle M.S. Chlorothiazide (Diuril) as a hyperuricacidemic agent // JAMA.– 1958.– № 168.– р. 2128–9.
22. Drum D.E., Goldman P.A., Jankowski C.B. Elevation of serum uric acid as a clue to alcohol abuse // Arch Intern Med.– 1981.– № 141.– р. 477–479.
23. Sharpe C.R. A case–control study of alcohol consumption and drinking behavior on patients with acute gout // Can Med Assoc J.– 1984.– № 131.– р. 563–567.
24. Arromdee E., Michet C.J., Crowson C.S. et al. Epidemiology of Gout: Is the Incidence Rising? //J Rheumatol.– 2002.– № 29.– р. 2403–6.
25. Adams P.F., Hendershot G.E., Marano M.A. Current estimates from the National Health Interview Survey, 1996.– Vital Health Stat 10.– 1999.– 200р.
26. Fam A.G. Gout in the elderly: clinical presentation and treatment // Drug Aging.– 1998.– № 13.– р. 229–243.
27. Troen B.R. The biology of aging // Mt Sinai J Med.– 2003.– № 70.– р. 3–22.
28. US Renal Data System. USRDS 1999 annual data report. Bethesda (MD): National Institute of Health (US), National Institute of diabetes and Digestive and Kidney Diseases.– 1999.
29. Ahn K.J., Kim Y.S., Lee H.C., Park K., Huh K.B. Cyclosporine–induced hyperuricemia after renal transplant: clinical characteristics and mechanisms // Transplant Proc.– 1992.– № 24.– р. 1391–2.
30. Saag K.G., Choi H. Epidemiology, risk factors, and lifestyle modifications for gout. Arthritis Res Ther. 2006; 8 (suppl 1): S2.
31. Johnson RJ, Titte S, Cade JR, Rideout BA, Oliver WJ. Uric acid, evolution and primitive cultures. Semin Nephrol 2005;25:3–8.
32. Neogi T. Asymptomatic Hyperuricemia: Perhaps Not So Benign? The J of Rheumatol. 2008, 5, 734–737.
33. Orowan E. The origin of man. Nature 1955;175:683–4.
34. Bloch S, Brackenridge CJ. Psychological, performance and biochemical factors in medical students under examination stress. J Psychosom Res 1972;16:25–33.
35. Brooks GW, Mueller E. Serum urate concentrations among university professors; relation to drive, achievement, and leadership. JAMA 1966;195:415–8.
36. Stetten D Jr, Hearon JZ. Intellectual level measured by army classification battery and serum uric acid concentration. Science 1959;129:1737.
37. Ames BN, Cathcart R, Schwiers E, Hochstein P. Uric acid provides an antioxidant defense in humans against oxidant– and radical–caused aging and cancer: a hypothesis. Proc Natl Acad Sci USA 1981;78:6858–62.
38. Waring WS, McKnight JA, Webb DJ, Maxwell SR. Uric acid restores endothelial function in patients with type 1 diabetes and regular smokers. Diabetes 2006;55:3127–32.
39. Kutzing MK, Firestein BL. Altered uric acid levels and disease states. J Pharmacol Exp Ther 2008;324:1–7.
40. Du Y, Chen CP, Tseng CY, Eisenberg Y, Firestein BL. Astroglia–mediated effects of uric acid to protect spinal cord neurons from glutamate toxicity. Glia 2007;55:463–72.
41. Spitsin SV, Scott GS, Mikheeva T, et al. Comparison of uric acid and ascorbic acid in protection against EAE. Free Radic Biol Med 2002;33:1363–71.
42. Baker JF, Krishnan E, Chen L, Schumacher HR. Serum uric acid and cardiovascular disease: recent developments, and where do they leave us? Am J Med 2005;118:816–26.
43. Johnson RJ, Kang DH, Feig D, et al. Is there a pathogenetic role for uric acid in hypertension and cardiovascular and renal disease? Hypertension 2003;41:1183–90.
44. Nakanishi N, Okamoto M, Yoshida H, Matsuo Y, Suzuki K, Tatara K. Serum uric acid and risk for development of hypertension and impaired fasting glucose or Type II diabetes in Japanese male office workers. Eur J Epidemiol 2003;18:523–30.
45. Fang J., Alderman M. Serum uric acid and cardiovascular mortality: The NHANES I epidemiologic follow–up study, 1971–1992. National Health and Nutrition Examination Survey // JAMA.– 2000.– № 238.– р. 2404–10.
46. Freedman D.S, Willamson D.F., Gunter E.W., Byers T. Relation of serum uric acid to mortality and ishemic heart disease. The NHANES 1 Epidemiologic Follow–up Study // Am. J. Epidemiol.– 1995.– № 141(7).–р. 637–644.
47. Brand F.N., McGee D.L., Kannel W.B. et al. Hyperuricemia as a risk factor of coronary heart disease: The Framingham Study // Am. J. Epidemiol.– 1985. Vol. 121. P.11.
48. Niskanen L.K., Laaksonen D.E., Nyyssonen K. et al. Uric acid level as a risk factor for cardiovascular and all–cause mortality in middle–aged men: a prospective cohort study // Arch. Intern. Med.–2004.–Vol.164, p. 1546.
49. Барскова В.Г., Ильиных Е.В., Елисеев М.С., Зилов А.В., Насонов Е.Л. Кардиоваскулярный риск у больных подагрой. Ожирение и метаболизм. 2006, 3(8), 40–44.
50. Culleton B.F., Larson M. G., Kannel W.B., D. Levy. Serum Uric Acid and Risk for Cardiovascular Disease and Death: The Framingham Heart Study // Ann. Intern. Med.– 1999.– № 131.– р. 7–13.
51. Verdecchia P., Schillaci G., Reboldi G. et al. Relation between serum uric acid and risk of cardiovascular disease in essential hypertension. The PUIMA study. Hypertension 2000; 36: 1072–8.
52. Anker S.D., Doehner W., Rauchhaus M. et al. Uric acid and survival in chronic heart failure: validation and application in metabolic, functional, and hemodynamic staging. Circulation 2003; 107: 1991–7.
53. Lehto S., Niskanen L., Ronnemaa T. et al. Serum uric acid is a strong predictor of stroke in patients with non–insulin–independent diabetes mellitus. Stroke 1998; 29: 635–9.
54. Alderman M.N., Cohen H., Madhvan S. et al. Serum uric acid and cardiovascular events in successfully treated hypertensive patients. Hypertension. 1999; 34: 144–150.
55. Campo C., Ruilope L.M., Segura J. Et al. Hyperuricemia, low urine urate excretion and target organ damage in arterial hypertension. Blood press. 2003; 12: 277–283.
56. Viazzi F., Parodi D., Leoncini G. Et al. Serum uric acid and target organ damage in primary hypertension. Hypertension. 2005; 45: 991–996.
57. Iribarren C., Folsom A.R., Eckfeldt J.H. et al. Correlates of uric acid and its association with asymptomatic carotid atherosclerosis: the ARIC study. Ann Epidemiol. 1996; 6: 331–340.
58. Cuspidi C., Valerio C., Sala C. Et al. Lack of association between serum uric acid and organ damage in a never–treated essential hypertensive population at low prevalence of hyperuricemia. Am J Hypertens. 2007; 20: 678–685.
59. Panoulas V.F., Milionis H.J., Douglas K.M. et al. Association of serum uric acid with cardiovascular disease in rheumatoid arthritis. Rheumatology (Oxford). – 2007; 46 (9): 1466–1470.
60. Chen C.H., Chen H.A., Wang H.P. et al. Pulmonary arterial hypertension in autoimmune diseases: an analysis of 19 cases from a medical center in northern Taiwan. J Micribiol Immunol Infect.–2006; 39 (2): p. 162–168.
61. Leyva F., Anker S., Godsland I.F. et al. Uric acid in chronic heart failure: a marker of chronic inflammation // Eur. Heart. J. – 1998. Vol.19.– P.1814 –1822.
62. Rao G.N., Corson M.A., Berk B.C. Uric acid stimulates vascular smooth muscle cell proliferation by increasing platelet–derived growth factor A–chain expression // J.Biol.Chem.–1991.–Vol. 266.–P.8604–8608.
63. Schumacher H.R. Jr. Crystal–induced arthritis: an overview // Am J Med.– 1996.– № 100.– р. 46S–52S.
64. Насонов Е.Л. Проблема атеротромбоза в ревматологии. Вестник РАМН, 2003; 7: 6–10.
65. Насонов Е.Л., Насонова В.А., Барскова В.Г. Механизмы развития подагрического воспаления. Тер арх. 2006, 6 (78), 77–84.
66. Johnson R.J., Rodriguez–Iturbe B., Kang D.H. et al. A unifying pathway for essential hypertension. Am J Hypertens. 2005; 18: 431–440.
67. Sanchez–Lozada L.G., Tapia E., Avila–Casado C. Et al. Mild hyperuricemia induces glomerular hypertension in normal rats. Am J Physiol. 2002; 283:F1105–F1110.
68. Mazzali M., Kanellis J., Han L. Et al. Hyperuricemia induces a primary arteriolopathy in rats by a blood pressure–independent mechanism. Am J Physiol. 2002; 282:F 991–F997.
69. Saito I., Saruta T., Kondon K. Et al. Serum uric acid and the renin–angiotensin system in hypertension. J Am Geriatr Soc. 1978; 26: 241–247.
70. Waring W.S., Webb D.J., Maxwell S.R.J. et al. Effect of local hyperucemia on endothelial function in the human forearm vascular bed. Br J Clin Pharmacol. 2000; 49:511.
71. Suarna C., Dean R.T., May J. et al. Human atherosclerotic plaque contains both oxidized lipids and relatively large amounts of alpha–tocopherol and ascorbate. Artherioscler Thromb Vasc Biol. 1995; 15: 1616–1624.
72. Iribarren C., Folsom A.R., Eckfeldt J.H. et al. Correlates of uric acid and its association with asymptomatic carotid atherosclerosis: the ARIC Study: Atherosclerosis Risk in Communities. Stroke. 1999; 29:635–639.
73. Mazzali M, Hughes J, Kim YG, et al. Elevated uric acid increases blood pressure in the rat by a novel crystal–independent mechanism. Hypertension 2001;38:1101–6.
74. Watanabe S, Kang DH, Feng L, et al. Uric acid, hominoid evolution, and the pathogenesis of salt–sensitivity. Hypertension 2002;40:355–60.
75. Masuo K, Kawaguchi H, Mikami H, Ogihara T, Tuck ML. Serum uric acid and plasma norepinephrine concentrations predict subsequent weight gain and blood pressure elevation. Hypertension 2003;42:474–80.
76. Sundstrom J, Sullivan L, D’Agostino RB, Levy D, Kannel WB, Vasan RS. Relations of serum uric acid to longitudinal blood pressure tracking and hypertension incidence. Hypertension 2005;45:28–33.
77. Feig DI, Johnson RJ. Hyperuricemia in childhood primary hypertension. Hypertension 2003;42:247–52.
78. Feig DI, Nakagawa T, Karumanchi SA, et al. Hypothesis: Uric acid, nephron number, and the pathogenesis of essential hypertension. Kidney Int 2004;66:281–7.
79. Dahlof B., Devereux R.B., Kjeldsen S.E. et al. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol. Lancet 2002; 359: 995–1003.
80. Hoieggen A., Alderman M.H., Kjeldsen S.E. et al. The impact of serum uric acid on cardiovascular outcomes in the LIFE study. Kidney Int. 2004; 65: 1041–1049.
81. Santos CX, Anjos EI, Augusto O. Uric acid oxidation by peroxynitrite: multiple reactions, free radical formation, and amplification of lipid oxidation. Arch Biochem Biophys 1999;372:285–94.
82. Sautin YY, Nakagawa T, Zharikov S, Johnson RJ. Adverse effects of the classical antioxidant uric acid in adipocytes: NADPH oxidase–mediated oxidative/nitrosative stress. Am J Physiol Cell Physiol 2007;293:C584–96.
83. Doehner V., Schoene N., Rauchhaus M. Et al. Effects of xantine oxidase inhibition with allopurinol on endothelial function and peripheral blood flow in hyperuricemic patients with chronic heart failure: results from 2 placebo–controlled studies. Circulation 2002; 105: 2619–2624.
84. Coghlan J.G., Flitter W.D., Clutton S.M. et al. Allopurinol pretreatment improves postoperative recovery and reduces lipid peroxidation in patients undergoing coronary artery bypass grafting. J Thorac Cardiovasc Surg. 1994; 107: 248–256.
85. Weimert N.A., Tanke W.F., Sims JJ. Allopurinol as a cardioprotective during coronary artery bypass graft surgery. Ann Pharmacother 2003; 37: 1708–1711.
86. Cappola T.P., Kass D.A., Nelson G.S. et al. Allopurinol improves myocardial effeciency in patients with idiopathic dilated cardiomyopathy. Circulation 2001; 104: 2407–2411.
87. George J, Carr E, Davies J, Belch JJ, Struthers A. High–dose allopurinol improves endothelial function by profoundly reducing vascular oxidative stress and not by lowering uric acid. Circulation 2006;114:2508–16.
88. Waring WS, McKnight JA, Webb DJ, Maxwell SR. Lowering serum urate does not improve endothelial function in patients with type 2 diabetes. Diabetologia 2007;50:2572–9.
89. Kang DH, Park SK, Lee IK, Johnson RJ. Uric acid–induced C–reactive protein expression: implication on cell proliferation and nitric oxide production of human vascular cells. J Am Soc Nephrol 2005;16:3553–62.
www.rmj.ru
причины, признаки, симптомы и лечение
Гиперурикемия – патологическое состоянием, для которого характерно высокое содержание мочевой кислоты в организме. Эта болезнь является одной из причин, повышающей риск возникновения у человека подагры (разновидность артрита, при которой поражаются почки и суставы). Такое состояние обусловлено нарушением пуринового обмена и диагностируется практически у каждого пятого взрослого человека из всего населения земного шара. У детей такое расстройство встречается крайне редко. В международной классификации заболеваний (МКБ-10) гиперурикемия имеет собственное значение – Е79.0.
Онлайн консультация по заболеванию «Гиперурикемия».
Задайте бесплатно вопрос специалистам: Эндокринолог.Возрастание частоты проявления недуга обуславливается неблагоприятными условиями проживания, загрязнённой окружающей средой. Одним из главных симптомов такого заболевания является повышение концентрации мочевой кислоты в крови. У взрослых людей зачастую протекает бессимптомно, а у детей выражается запорами, значительным возрастанием показателей массы тела и повышенным потоотделением. Диагностика болезни состоит из лабораторных исследований анализов крови. Лечение заключается в приёме лекарственных препаратов и соблюдении специальной диеты.
Этиология
Гиперурикемия прогрессирует вследствие быстрого образования в теле индивида мочевой кислоты. Это нередко обусловлено следующими причинами:
- участием пурина в метаболизме;
- нарушением функционирования почек;
- высоким содержанием фруктозы в рационе.
Основными факторами возникновения такого расстройства являются:
- злоупотребление продуктами, которые содержат в себе высокий процент пурина;
- приём большого количества жареных и жирных блюд, а также высококалорийного фаст-фуда;
- продолжительный отказ от еды или соблюдение строгих диет. Голодание приводит к тому, что организму не хватает питательных веществ, и он начинает использовать собственную мышечную массу. По этой причине пурин попадает в кровь, что выявляется по высоким его показателям при биохимическом обследовании крови;
- онкологические опухоли;
- широкий спектр заболеваний, которые негативно влияют на функционирование почек;
- чрезмерный приём алкоголя и некоторых лекарственных препаратов без назначения врача;
- сахарный диабет;
- атеросклероз у пожилых людей;
- гипертония;
- широкий спектр заболеваний крови, для которых характерен распад нуклеотидов.
Кроме этого, гиперурикемия сопровождает множество заболеваний, среди которых:
- недостаток железа в организме;
- токсикоз при тяжёлом протекании беременности;
- интоксикация организма спиртными напитками;
- хроническая экзема;
- злокачественные опухоли, поражающие костный мозг при лейкозе;
- псориаз или чешуйчатый лишай;
- нарушение кислотно-щелочного баланса;
- крапивница;
- острое протекание различных инфекционных заболеваний.
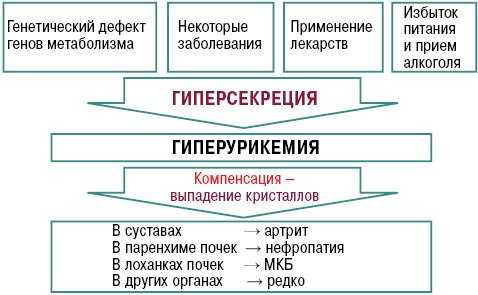
Механизм развития гиперурикемии
Разновидности
Для диагностики и установления правильной тактики лечения необходимо правильно определить вид гиперурикемии, которая может быть:
- метаболической – характеризуется высоким содержанием мочевой кислоты не только в крови, но и в урине;
- почечной – определяется нарушением выделения мочевой кислоты;
- смешанной – выражается в сочетании двух вышеуказанных типов недуга и диагностируется на фоне уратурии.
По этиологическому фактору это заболевание делится на:
- врождённую форму – встречается крайне редко;
- вторичную или приобретённую – составляет практически все случаи гиперурикемии.
Симптомы
Зачастую встречается бессимптомная гиперурикемия. Именно из-за этого чаще удаётся диагностировать болезнь на стадиях её трансформации в пиелонефрит или в мочекаменную болезнь. Считается, что мочевая кислота может привести к снижению иммунитета. У взрослых патология сопровождается болевым синдромом или протекает вовсе без выражения каких-либо признаков. Для детей характерными симптомами гиперурикемии являются:
- боли в суставах и мышцах;
- тики, т. е. непроизвольные подёргивания мышц лица или конечностей;
- частые позывы к мочеиспусканию в ночное время;
- интоксикация;
- нарушение моторики желчевыводящих путей;
- непереносимость яркого света, резких запахов и громких звуков.
Диагностика
Основа диагностических мероприятий — биохимический анализ крови. Помимо этого, в план диагностики включают:
- анализ мочи;
- обнаружение мочевой кислоты в сыворотке крови;
- рентгенографию почек и поражённых суставов, но только в случаях подозрения лечащего врача на подагру;
- УЗИ этого органа и мочеточников.
Перед тем как сдавать анализы крови и урины, пациенту необходимо придерживаться нескольких правил – за четыре дня до сдачи жидкостей необходимо ограничить употребление в пищу белков и полностью отказаться от спиртных напитков. За восемь часов до анализов запрещается принимать пищу.
Анализы будут готовы через несколько суток, после чего специалист назначает индивидуальную тактику лечения и применение медикаментов (что зависит от причин возникновения недуга и степени проявления симптомов).
Лечение
Основу лечения гиперурикемии составляют приём медикаментов и назначение специальной диеты. Первый способ предусматривает приём пациентом лекарственных препаратов, направленных на снижение концентрации мочевой кислоты.
Диета при гиперурикемии предусматривает отказ от таких продуктов, как:
- алкоголь. Допустим лишь приём небольшого количества сухого вина;
- рыба и мясо любых сортов, в частности, жаренные или запечённые;
- жирные бульоны и супы, приготовленные из них;
- копчёности;
- колбасы;
- консервы;
- бобовые культуры;
- твёрдый сыр и грибы;
- шоколад и какао;
- редис, щавель и шпинат;
- цветная капуста.
Строгое питание не ограничивает употребление:
- диетических сортов мяса, таких как курица, индейка или кролик;
- кисломолочных и молочных продуктов;
- овощных супов;
- яиц, но только в отварном виде;
- ягод, зелени, фруктов и овощей, кроме запрещённых. Приветствуются тыква и дыня, яблоки и груши, виноград и горошек, абрикосы и морковь, черешня и вишня, баклажаны и огурцы, морковь и перец, калина и белокочанная капуста;
- морсов, фрешей и компотов. Необходимо употреблять более двух литров жидкости в день.
Во время лечения можно принимать щелочную минеральную воду, но не более двухнедельного срока. Также благоприятным воздействием обладают разгрузочные дни, которые необходимо устраивать один раз в неделю.
simptomer.ru
Гиперурикемия
Повышение уровня мочевой кислоты в крови, в результате нарушения пуринового обмена. Максимальный уровень мочевой кислоты у женщин 360 мкм/л, у мужчин — 400 мкм/л. Превышение данных показателей требует выяснения причинных факторов.
Причины возникновения. Гиперурикемия развивается под воздействием как внешних факторов (окружающая среда, питание), так и наследственных. Она также считается ведущим биохимическим признаком подагры.
Может быть свидетельством таких патологических состояний, как лимфома, лейкоз, анемия, обусловленная недостатком витамина В12, заболевания желчевыводящих путей, печени, почек, псориаз, пневмония, гестоз, туберкулез, сахарный диабет, хроническая экзема.
Факторы риска.
-
Злоупотребление пищевыми продуктами, насыщенными пуринами, жирная пища;
-
Голодание,
-
Разрушение тканей,
-
Новообразования злокачественной природы,
-
Заболевания лимфатической системы, крови,
-
Анемия,
-
Хроническая экзема,
-
Ацидоз,
-
Псориаз,
-
Токсикоз при беременности.
Симптомы. Единственный симптом – превышение нормы содержания мочевой кислоты в крови.
Бессимптомная гиперурикемия (на начальной стадии) выявляется случайно, при диагностике других заболеваний. Вторая стадия сопровождается патологическими изменениями в органах.
В детском возрасте гиперурикемия может проявляться запорами, дефектами речи, нервным тиком, сильной потливостью, ночным энурезом, болями в суставах и мышцах. Могут возникать даже состояния интоксикации.
У подростков присоединяются другие проявления: зуд в уретре, боль в пояснице, дискинезия желчевыводящих путей, накопление избыточного веса.
У взрослых – развиваются патологии пищеварительного тракта.
Диагностика. Определяется с помощью лабораторных анализов: клинического анализа крови и мочи.
Лечение. Назначается на основе полученных данных лабораторных исследований и других видов дополнительного обследования. Его основой является диетотерапия. Из рациона питания пациента исключаются продукты, содержащие значительное количество производных пурина, или же существенно уменьшается их употребление. Медикаментозный курс включает урикозодепрессорные препараты, препараты, обладающие урикозурическим действием. Важным аспектом лечения считается достижение щелочной реакции мочи.
Профилактика. Заключается в регулярном посещении врача, сдаче анализов, соблюдении элементарных правил здорового питания.
navigator.mosgorzdrav.ru
симптомы, лечение, диета и причины возникновения заболевания

В каждой клетке тела человека и межклеточном пространстве в норме сохраняется постоянство внутренней среды. Все вещества – органические и неорганические – должны оставаться в строго определенной концентрации.
При нарушении такого баланса развиваются опасные болезни и патологические состояния, которые затрагивают все органы и системы.
Небольшие сдвиги в концентрации биохимических соединений организм может корректировать самостоятельно, посредством нервной или гуморальной саморегуояции, и тогда человек не ощущает дискомфорта. Если система регуляции не срабатывает, отклонения от нормы начинают проявляться заметными симптомами. Гиперурикемия и гиперурикурия – это одно из таких нарушений обмена веществ.
Что это такое?
 Гиперурикемия, она же гиперурикозурия – это превышение концентрации мочевой кислоты в крови более, чем 360 мкМ/л у женщин или более, чем 420 мк М/л у мужчин.
Гиперурикемия, она же гиперурикозурия – это превышение концентрации мочевой кислоты в крови более, чем 360 мкМ/л у женщин или более, чем 420 мк М/л у мужчин.
Эта кислота в организме появляется вследствие обмена пуриновых соединений.
Такое заболевание встречается весьма часто – им страдают около пятой части взрослого населения и примерно 3% детей, но как правило, больные редко знают об этом.
Большинству людей, которые не сталкивались в жизни с данным диагнозом, неизвестно, что такое гиперурикозурия и гиперурикемия, и чем они отличаются. Гиперурикозурией называется состояние, при котором повышается содержание мочевой кислоты в урине.
Если доктор поставил диагноз «гиперурикемия», следует подробно расспросить его об этом заболевании, уточнить все непонятные нюансы, чтобы избежать ошибок при лечении.Виды
В зависимости от первопричин повышения мочевой кислоты, различают три разновидности гиперурикемии:
- метаболическая – развивается при нарушении обмена веществ;
- почечная – развивается при склерозировании почечных сосудов из-за атеросклеорза, гипертонии, диабета или как врожденное заболевание;
- смешанная – обусловлена одновременным воздействием двух предыдущих провоцирующих факторов.
Определить вид и причину гиперурикемии можно только после комплексной диагностики и консультации специалистов.
Причины
Гиперурикемия причины возникновения имеет следующие:

- употребление большого количества пищи, богатой пуриновыми соединениями (особенно аденином) или фруктозой;
- частое употребление жирных блюд и алкоголя;
- голодание;
- заболевания крови, сопровождающиеся разрушением клеток, их ядер и нуклеотидов наследственного вещества;
- недостаточное функционирование почек;
- влияние негативных факторов окружающей среды на обменные процессы в организме.
Симптомы
 Гиперурикозурия и гиперурикемия симптомы имеют немногочисленные.
Гиперурикозурия и гиперурикемия симптомы имеют немногочисленные.
Превышение нормы содержания мочевой кислоты в крови – это единственный симптом.
Показатель можно определить с помощью лабораторных анализов. В остальном же нарушение проявляется, когда на его фоне развивается подагра, нефролитиаз или другие болезни.
Поэтому в большинстве случаев бессимптомная гиперурикемия выявляется случайно, при диагностике других заболеваний. Это состояние врачи характеризуют, как первую стадию развития гиперурикемии. Она может длиться несколько десятков лет.
Вторая стадия сопровождается патологическими изменениями в органах. В детском возрасте гиперурикемия может проявляться нарушением работы систем пищеварения, мочевыделения, нервной системы, функционирования кожи. При этом развиваются запоры, дефекты речи, нервный тик, сильная потливость, ночной энурез, боли в суставах и мышцах.
 Могут возникать даже состояния интоксикации.
Могут возникать даже состояния интоксикации.
У подростков присоединяются другие проявления – зуд в уретре, боль в пояснице, дискинезия желчевыводящих путей, накопление избыточного веса.
У взрослых повышение содержания мочевой кислоты нередко провоцируют патологии пищеварительного тракта. Пациенты с гиперурикемией чаще сталкиваются с нарушениями метаболизма в миокарде.
Если такое явление протекает в организме беременной женщины, повышается вероятность появления множественных патологий развития у плода, так как соли мочевой кислоты оказывают на ткани сильное токсическое влияние.
Существует и понятие межкритичной гиперурикемии. Этим термином доктора пользуются для обозначения признаков состояния между обострениями. Ремиссия при этом заболевании может длиться до двух лет.
Симптомы гиперурикемии неспецифичны, то есть характерны для многих других болезней, поэтому самостоятельно по внешним проявлениям выявить патологию невозможно.Факторы риска
Риск заболеваемости гиперурикемией повышается, если на организм человека воздействуют факторы риска. К ним относятся:

- злоупотребление алкоголем;
- неправильное питание;
- физические факторы, вызывающие разрушение клеток;
- соблюдение неправильно разработанных диет;
- мужской пол;
- период перед менопаузой у женщин;
- преклонный возраст;
- наличие в организме болезней внутренних органов;
- применение некоторых лекарств (тиазидных диуретиков).
Чтобы не допустить развития гиперурикемии, нужно стараться избегать действия указанных факторов. Это действительно опасное состояние, которое может спровоцировать развитие тяжелых неизлечимых недугов или болезней, которые переходят в хроническую форму.
Вследствие накопления мочевой кислоты развиваются тубулоинтерстициальный нефрит, почечнокаменная болезнь, подагрический артрит и прочие патологии. Крайне негативно воздействует такая патология на развивающийся плод.
Повышение мочевой кислоты очень зависит от питания, поэтому необходимо разумно составлять свой рацион.Гиперурикемия: диета и лечение
Основные способы устранения гиперурикемии – диета и лечение медикаментами. Только комплексный подход способен оказать лечебное воздействие и предотвратить развитие опасных болезней на фоне нарушенного обмена веществ.
Диета при гиперурикемии должна быть разработана таким образом, чтобы в рационе больного было как можно меньше пуриновых соединений и веществ, участвующих в накоплении мочевой кислоты.
 В питании пациента не должно быть таких продуктов:
В питании пациента не должно быть таких продуктов:
- колбасы и копченые блюда;
- жирные рыбные и мясные блюда;
- внутренности животных;
- консервы;
- супы;
- бобовые культуры.
Следует ограничить употребление зелени и некоторых овощей (шпината, капусты цветной, щавеля, редиса), шоколада, сыра.
Для улучшения состояния организма и предотвращения накопления мочевой кислоты вводят в рацион следующие продукты:
- куриное и кроличье мясо;
- продукты из свежего и кислого молока;
- овощи, фрукты;
- супы вегетарианского типа.
Очень полезны при этом заболевании калийсодержащие растительные продукты – капуста белокочанная, персики, кабачки, дыни, бананы, морковь, лимон, груши, огурцы, зеленый горошек, тыква, баклажаны.
Ягоды лучше выбирать те, которые имеют темный цвет (синие, красные) – вишню, клюкву, голубику, бруснику, черешню. Следует пить много жидкости (не менее 2,5 литров), но при появлении отечности лучше посоветоваться с врачом о суточной норме.
В воду можно добавлять сок ягод, это способствует выведению мочевой кислоты из тканей. Один день в неделю должен быть разгрузочным, чтобы организм мог очиститься от вредных метаболитов, способствующих развитию гиперурикемии.

Таблетки Аллопуринол Сандоз
Гиперурикемия лечение подразумевает и медикаментозное. Показан прием препаратов, ускоряющих выведение мочевой кислоты и препятствующих ее образованию в организме из пуриновых соединений. В качестве лекарств используются Аллопуринол, Пробенецид.
Если развиваются какие-либо симптомы сопутствующих недугов или осложнения, нужно их устранять с помощью специальной терапии. Необходим постоянный мониторинг за состоянием пациента, для чего он проходит обследования внутренних органов, анализы крови, лабораторные исследования мочи.
Поэтому полноценное и единственно правильное лечение может назначать только врач, самолечение может привести к усугублению состояния, появлению других болезней, переходу их в хроническую форму.
Халатное отношение к медикаментозному лечению и несоблюдение диеты может привести к ухудшению состояния пациента, запущенное заболевание лечить гораздо сложнее и дороже.Видео по теме
О связи ожирения и гиперурикемии:
Если появились симптомы гиперурикемии, либо факт повышения мочевой кислоты зафиксирован случайно при обследовании, нельзя оставлять это без внимания. Назначенную врачом диету и медикаментозную терапию следует соблюдать тщательно. При своевременном лечении снижается риск патологического изменения жизненно важных органов. Если к гиперурикемии присоединяется подагра или болезни почек, организм требует еще большего внимания.
mkb.guru
Гиперурикемия (повышение содержания мочевой кислоты в крови): причины, симптомы, поражение суставов (подагра) при гиперурикемии
Одна из наиболее распространенных обменных патологий, представляющая собой увеличение в крови содержания мочевой кислоты, носит название гиперурикемии. Увеличение концентрации мочевой кислоты в крови (гиперурикемия), в зависимости от степени ее повышения, может протекать латентно и выявляться случайно при исследовании биохимического состава крови.
В других случаях гиперурикемия выявляется при появлении жалоб со стороны почек, суставов и других органов. Гиперурикемия влечёт за собой целый ряд процессов, запускающих каскад биохимических, а затем патофизиологических изменений, итогом которых является появление болезней, таких как подагра, уролитиаз (образование мочевых уратных камней в почках), нефропатия и другие состояния.
Мочевая кислота — вещество, появляющееся на заключительном, конечном этапе нормальных метаболических процессов, в которых принимают участие пурины, из которых она образуется. Путь выведения пуринов из организма — превращение их метаболитов в мочевую кислоту в паренхиме печени. Мочевая кислота фильтруется через почки, превращается в ураты (соли мочевой кислоты), которые затем вместе с мочой выводятся из организма.
Ураты — химические соединения, относящиеся к солям, предшественником которых является мочевая кислота. Ураты обладают способностью, при нормальной их концентрации, находиться в растворе, при этом их растворимость в моче может характеризоваться как средняя. При превышении концентрации солей мочевой кислоты особенность метаболизма уратов определяет возможность их выпадения в осадок из раствора (образование уратных микро- и макролитов).

Содержание мочевой кислоты у человека (в норме) ограничено значениями, не превышающими 0,42 ммоль/л у мужской половины населения, у женщин нормальное содержание мочевой кислоты меньше, порядка 0,36 ммоль/л. Ее концентрация в моче строго регламентирована, при превышении нормальных значений ураты могут инициировать патологический процесс преципитации и образования сначала микро- (песок), а затем и макролитов (камней) в почках.
Гиперурикемия в любых её проявлениях (как минимальном, так и при значительном её повышении) ведёт к патологии: откладываясь в тканях и органах, мочевая кислота приводит в последующем к появлению типичных симптомов.
Для понимания системности процессов, происходящих при гиперурикемии, рассмотрим наиболее частые причины, приводящие к избыточному содержанию в плазме крови мочевой кислоты.
Причины гиперурикемии (повышения содержания мочевой кислоты в крови):
- Одной из главных причин гиперурикемии считают индивидуальную особенность метаболизма пуринов данного индивидуума (обмена, выведения, синтеза мочевой кислоты и её солей), обусловленных генетическими особенностями организма.
У некоторых людей при прочих равных условиях и отсутствии избытка поступления пуринов с пищей может выявляться гиперурикемия. Причина этого явления кроется в особенностях метаболизма уратов у конкретного больного. Часто нарушение пуринового обмена обусловлено генной мутацией фермента, ответственного за выведение или дальнейшее превращение пуринов, либо нарушением механизма выведения солей уратов.
- Значительную роль в формировании гиперурикемии играет неправильное, избыточное питание, в котором превалируют белковые продукты, содержащие много пуринов, пища, богатая предельными тугоплавкими жирными кислотами (животный жир, субпродукты, желток).
Усиливается пагубное влияние избыточного потребления пуринов одновременным приёмом алкоголя. При этом риск гиперурикемии увеличивается, особенно если алиментарные погрешности сочетаются с наследственной предрасположенностью.
- Некоторые лекарственные средства, применяемые для лечения различных заболеваний сердца, повышенного давления, эндокринных патологий, могут давать побочный эффект в виде гиперурикемии. Например, хорошо известно гиперурикемическое действие тиазидных диуретиков, б-блокаторов.
И наоборот, существуют препараты, значимо снижающие повышенный уровень уратов (мочевой кислоты). К ним относятся урикозурические средства (выводящие мочевую кислоту) и препараты, уменьшающие её образование.
- Наконец, некоторые заболевания и патологические процессы могут вызвать гиперурикемию.
Важным является не только клинически значимая гиперурикемия, которая проявляется подагрой, нефроуролитиазом или уратной нефропатией, но и бессимптомная гиперурикемия.
Гиперурикемия входит в состав так называемого метаболического синдрома, включающего в себя повышение давления, ту или иную степень ожирения, повышение в крови атерогенных липопротеидов, появление гликемии (у одного человека может присутствовать несколько перечисленных факторов одновременно). Метаболический синдром — комплекс состояний, увеличивающих риск фатальных событий (смерти) в несколько раз. В последние годы частота выявления метаболического синдрома неуклонно растёт, гиперурикиемия при этом вносит значительный вклад в риски при метаболическом синдроме.
В среднем гиперурикемия может быть выявлена более чем у 6 % населения, но клинически значимые состояния и заболевания при документально повышенном уровне мочевой кислоты развиваются не во всех случаях.
Возникновение гиперурикемии может быть связано как с повышенным синтезом продуктов метаболизма пуринового обмена, так и с пониженной фильтрацией и экскрецией мочевой кислоты через нефроны почки. Увеличивается содержание пуринов при ряде онкологических заболеваний, псориазе, использовании цитостатических препаратов.
Симптомы гиперурикемии
Гиперурикемия чаще всего проявляется поражением суставов, что носит название «подагра», и нарушением функции почек (нефропатия, образование почечных камней).
Почечные проявления гиперурикемии
Повышенное выделение уратов с мочой оказывает повреждающее действие как на почечную интерстициальную ткань (уратная нефропатия), так и на чашечно-лоханочную систему мочевыводящей системы. Уратная нефропатия захватывает функциональную ткань — почечные нефроны (клубочки) и интерстиций, в результате чего выделительная и другие функции почек прогрессивно снижаются, появляются признаки и симптомы почечной недостаточности (чаще в виде хронической формы).
При сочетании уратной нефропатии и гиперурикемии с другими обменными патологиями — сахарным диабетом, атеросклерозом, патологиями почек — почечная недостаточность приобретает более злокачественное течение.
Нефроуролитиаз — самое частое проявление гиперурикемии. Чаще при образовании камней в почках гиперурикемия достигает значительной степени выраженности. Нефролитиаз — одно из частых заболеваний, вызванных наследственными дефектами метаболизма уратов в сочетании с диетическими погрешностями, использованием жёсткой питьевой и минеральной воды в течение длительного времени.
Почечные конкременты (камни) могут иметь разный состав. При гиперурикемии конкременты носят характер уратных образований. Начало формирования камней бессимптомное, ничем себя не проявляет. Образование микролитов, так называемого «песка», может инициироваться воспалением в чашках и лоханках, что имеет место при остром (чаще хроническом) пиелонефрите.
Уратные камни в почечных лоханках могут быть единичными и множественными, с одно- и двусторонней локализацией. Иногда уратный камень занимает всю полость лоханки. В таком случае конкремент носит название коралловидного.
Поражение почек при уратном нефролитиазе может усугубляться возможностью поддержания в почках хронического воспалительного процесса вследствие длительного нарушения оттока и стаза мочи, характеризующегося периодами ухудшения состояния (обострение) и ремиссий.
Острое затруднение оттока мочи из почки может возникнуть при миграции (движении) подвижных, мелких камней в мочеточник. Это состояние носит название «почечная колика», при которой больному требуется неотложная медицинская помощь. Нередко уратный нефролитиаз вследствие гиперурикемии впервые проявляется именно почечной коликой, так как до этого даже относительно крупные камни могут долго не давать о себе знать.
Почечная колика может быть спровоцирована такими факторами, как сотрясение тела (длительная тряская езда), прыжки, обильный приём жидкости, алкоголя, подъём тяжестей. У больного при почечной колике любого генеза, в том числе при камнях вследствие гиперурекимии, возникают острые, выраженные, нестерпимые боли в поясничной области. Часто при колике интенсивные боли отдают в пах, сопровождаются частым мочеиспусканием.
На высоте боли у больного с коликой возникает тошнота, часто рвота, повышается системное АД (давление). Цвет мочи может меняться, появляются примеси крови (необязательный симптом). Интенсивность болей в пояснице при колике такова, что больной мечется от боли, ищет помощи, не может найти положение, которое бы облегчило его страдания. При полной закупорке мочеточника конкрементом может возникнуть острое осложнение — гидронефроз.
Гиперурикемия и поражение суставов (подагра)
Поражение суставов при гиперурикемии носит название «подагра». Типичным именно для подагры является поражение в начале заболевания первого пальца стопы (плюснефалангового суставного сочленения). Подагрический артрит начинается остро, без предвестников, часто в ночное время с острой боли в указанном суставе. При этом сустав при подагре быстро краснеет, отекает, больной жалуется на распирающие, «стреляющие» боли, невозможность наступать на поражённую конечность, нарушается сон, трудоспособность невозможна.
После стихания островоспалительных явлений первой атаки (в результате лечения и снижения степени гиперурикемии) у больного наступает улучшение. Но в последующем при нарушении диеты (белковая, жирная пища, алкоголь) может наступить обострение суставного синдрома при подагре. Со временем, если гиперурикемия не компенсирована или прогрессирует, в процесс вовлекаются другие крупные суставы (коленные, голеностопы, локтевые). В них наблюдаются подобные воспалительные изменения вследствие хронической гиперурикемии и отложения в тканях суставов мочевой кислоты.
Также типичным для подагры считается формирование отложений в тканях уратов — появление так называемых тофусов. Тофусы при гиперурикемии могут образовываться в любом месте, часто вблизи суставов, на ушных раковинах. Чрезмерная гиперурикемия может приводить к тому, что тофусы самопроизвольно вскрываются с выделением масс, состоящих из кристаллов уратов.
Хроническая гиперурикемия также может способствовать отложению уратов в других органах и тканях, коже.
Таким образом, гиперурикемия — серьёзное состояние, требующее грамотного подхода, обязательной диагностики, коррекции и лечения. Гиперурикемия всегда приводит к поражению тканей и формированию хронических метаболических расстройств — подагры, нефроуролитиаза, уратной нефропатии — и к поражению суставных тканей. Важным является то, что гиперурикемия даже на доклиническом этапе оказывает неблагоприятное воздействие на организм.
При подозрении на гиперурикемию, при наличии метаболического синдрома и других состояниях, при которых нарушается обмен пуринов, обязательно исследование плазмы крови на содержание мочевой кислоты, проведение других функциональных тестов.
www.mosmedic.com
Гиперурикемия – причины, симптомы, диета, лечение
С каждым годом все более возрастает количество случаев проявления у детей и взрослых такой патологии, как гиперурикемия. Как утверждают данные скриннинговых исследований, данное патологическое состояние, связанное с нарушениями пуринового обмена, наблюдается практически у 20% взрослого и 3% детского населения земного шара. Возрастание нарушений метаболизма пуриновых снований ученые связывают с неблагоприятной экологической обстановкой в мире, в частности с увеличением токсических выбросов продуктов сгорания бензиновых моторов, которые крайне негативно влияют на пуриновый обмен.
Что же представляет собой данное заболевание, каковы симптомы гиперурикемии и причины возникновения? Так исторически сложилось, что данная патология больше известна своими клиническими проявлениями, то есть нефролитиазом и подагрой. Собственно говоря, гиперурикемия – это повышенное содержание в крови человека мочевой кислоты. До недавнего времени это заболевание не привлекало к себе большого внимания, поскольку обладало небольшой распространенностью в популяции, но последние исследования в области влияния данной патологии на течение сердечнососудистых заболеваний, заставили специалистов посмотреть на заболевание другими глазами. Основные симптомы гиперурикемии – это повышение уровня мочевой кислоты в биохимическом анализе крови. Если болезнь прогрессирует, к данным симптомам гиперурикемии присоединяются клинические проявления подагры.
Также необходимо отметить, что гиперурикемия у беременной женщины крайне опасна для плода, поскольку способствует формированию врожденной гистологической или анатомической нефропатии. Сегодня выделяют три патогенетических вида гиперурикемии:
- почечную;
- метаболическую;
- смешанную.
Нормальная концентрация мочевой кислоты в крови колеблется в диапазоне 240-400 мкм/л. Некоторые специалисты довольно критически относятся к верхнему порогу и считают пограничным уровнем содержание мочевой кислоты в количестве 354 мкм/л.
У современного человека, употребляющего с пищей в избыточном количестве натрий хлорид, гиперурикемия может привести к развитию артериальной гипертензии, и способна значительно повысить риск осложнений различных сердечнососудистых заболеваний. Существует медикаментозное и нефармокологическое лечение гиперурикемии, которое заключается в соблюдении определенной диеты, направленной на снижение уровня мочевой кислоты.
Причины гиперурикемии
Причинами гиперурикемии почечного типа являются три основных фактора:
- участие пурина в обмене веществ;
- избыточное образование мочевой кислоты из-за высокого содержания в пище фруктозы;
- нарушение выведения мочевой кислоты из-за ослабленной работы почек.
Почечная гиперурикемия может носить как наследственный, так и приобретенный характер. Пусковым механизмом, независимо от причины гиперурикемии, является нарушение фильтрационно-канальцевых функций почек. Почечная гиперурикемия, которая носит приобретенный характер, чаще всего возникает в пожилом возрасте на фоне склерозирования почечных сосудов из-за атеросклероза, сахарного диабета, гипертонии или в результате необоснованного длительного приема некоторых лекарственных препаратов, например, диуретиков или аспирина.
Причины гиперурикемии могут заключаться в заболеваниях крови, которые сопровождаются массивным распадом нуклеотидов в клеточных ядрах – это различные заболевания лимфатической системы, болезни крови, саркоидоз, псориаз и другие патологии, которые способны нарушить почечную экскрецию.
Основные причины гиперурикемии приобретенного характера кроются в постоянном употреблении богатой пурином, или высококалорийной, жирной пищи. Также крайне негативное влияние на метаболические процессы оказывает алкоголь. Такие продукты вызывают в организме избыток субстрата синтезирующего мочевую кислоту. Кроме того, жирная пища серьезно влияет на экскрецию уратов почками. Поэтому в лечении патологии особое значение имеет диета при гиперурикемии.
Диагностика и клинические проявления
Чаще всего, гиперурикемия не вызывает со стороны человека никаких жалоб и проходит практически бессимптомно, а выявление обмена веществ, как правило, происходит в случае какого-либо медицинского обследования. Симптомы гиперурикемии в основном неспецифичны. У детей данная патология может проявляться запорами, ночным энурезом, болями в животе, повышенной потливостью, тиками и логоневрозом. У подростков встречаются такие симптомы гиперурикемии, как зуд в мочеиспускательном канале, боль в пояснице, избыточная масса тела, дискинезия желчевыводящих путей. Также к симптоматике могут присоединиться признаки интоксикации и астенизации. У пациентов с гиперурикемией часто диагностируют различные патологии пищеварительного тракта и признаки нарушений метаболических процессов в миокарде.
Лечение гиперурикемии
Одним из терапевтических направлений в лечении гиперурикемии является диетотерапия, которая предусматривает снижение употребления тех продуктов питания, которые содержат пуриновые основания. Значительно ограничивается прием крепкого чая и кофе, жирных сортов рыбы, блюд, содержащих в составе желатин. Из рациона следует исключить крепкий алкоголь и пиво, наваристые рыбные и мясные супы, запеченные, жареные, тушеные мясо и рыбу, копчености, консервы, колбасные изделии. Диета при гиперурикемии подразумевает ограничение потребления шоколада, какао, шпината, щавеля, цветной капусты.
Правильная диета при гиперурикемии играет первостепенное значение. В рацион необходимо включить те фрукты и овощи, которые содержат много калия – баклажаны, тыква, белокочанная капуста, зеленый горошек, кабачки, абрикосы, персики, бананы, дыни, груши, виноград, огурцы, морковь и др.
Из ягод более всего полезны ярко-красные, синие и темные плоды – черешня, вишня, голубика, клюква, ежевика, брусника и т.д. Содержащиеся в них вещества способствуют снижению мочевой кислоты в крови. Также диета при гиперурикемии включает в себя обильное питье. В день необходимо выпивать не менее 2,5 л жидкости, которая обладает способностью разбавлять мочу, предупреждая образование камней в почках.
Очень полезно добавлять в питьевую воду небольшое количество сока клюквы, брусники или лимона. Кроме того, необходимо проводить раз в неделю разгрузочные дни. Следование этим несложным рекомендациям поможет избежать дальнейшего развития заболеваний, связанных с высоким уровнем мочевой кислоты в крови. Такое лечение гиперурикемии вполне посильно для человека.
Медикаментозное лечение гиперурикемии предполагает прием лекарственных препаратов, которые повышают почечный клиренс мочевой кислоты. Очень эффективным препаратом в данной области является Пробенецид. Также широко применяется ингибитор ксантинокидазы – Аллопуринол, который способствует снижению продукции пуринов и повышению экскреции оксипуринов. Медикаментозное лечение гиперурикемии и разработку индивидуального плана питания у лиц с данным заболеванием должен осуществлять только специалист, поскольку самолечение приведет к тяжелому осложнению патологии – развитию подагры.
dolgojit.net
