Пцр 12 какие инфекции: Анализы на ПЦР-12, цены в лаборатории KDL
Анализы на ПЦР-12, цены в лаборатории KDL
Выберите требуемый вид биоматериала
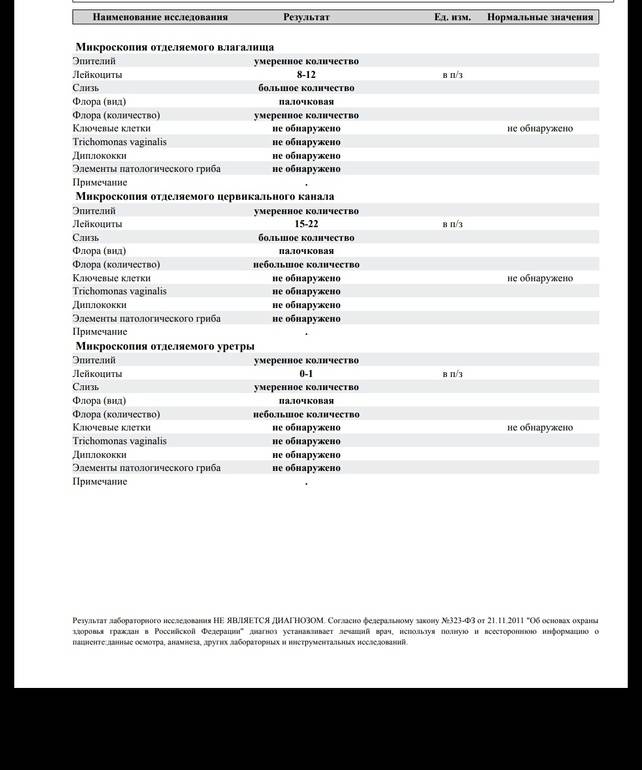
Соскобы из урогенитального тракта не берутся в течение суток после местной терапии (свечи, мази, спринцевания), после полового контакта и во время менструации у женщин. После кольпоскопии, интравагинального УЗИ должно пройти 48 часов. В случае наличия признаков острого воспаления необходимость взятия мазка определяется лечащим врачом. Если необходимо получить соскоб из уретры, то перед взятием материала нужно не мочиться 1,5 — 2 часа. Если исследование назначается для контроля излеченности, то взятие материала на исследование методом ПЦР возможно не ранее, чем через 28 дней после окончания приема антибиотиков, на микробиологические исследования не ранее,чем через 14 дней.
Накануне исследования не применять местные лекарственные препараты и процедуры, исключить половой акт. При взятии соскоба из уретры не мочиться в течение 1,5-2 часов до процедуры.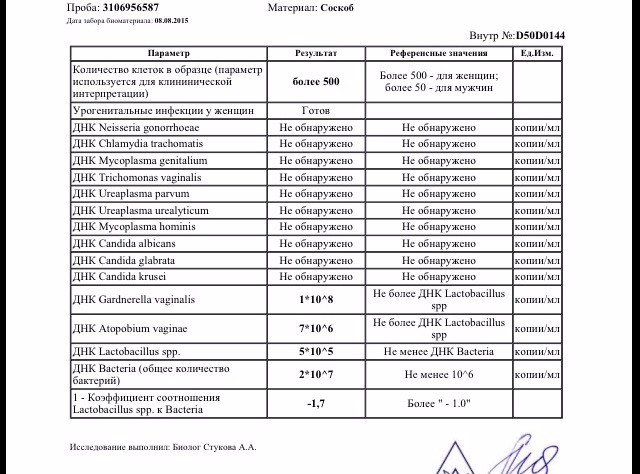
Смешанный соскоб урогенитального тракта не берется на фоне местной терапии (свечи, мази, спринцевания) и во время менструации у женщин. После кольпоскопии, интравагинального УЗИ или полового контакта должно пройти 48 часов. Если есть необходимость взятия материала из уретры, то перед взятием материала нужно не мочиться 1,5 — 2 часа. Если исследование назначается для контроля излеченности, то взятие материала на исследование возможно через 14-21 день после окончания приема антибиотиков.
Соскобы из урогенитального тракта не берутся в течение суток после местной терапии (свечи, мази, спринцевания), после полового контакта и во время менструации у женщин. После кольпоскопии, интравагинального УЗИ должно пройти 48 часов.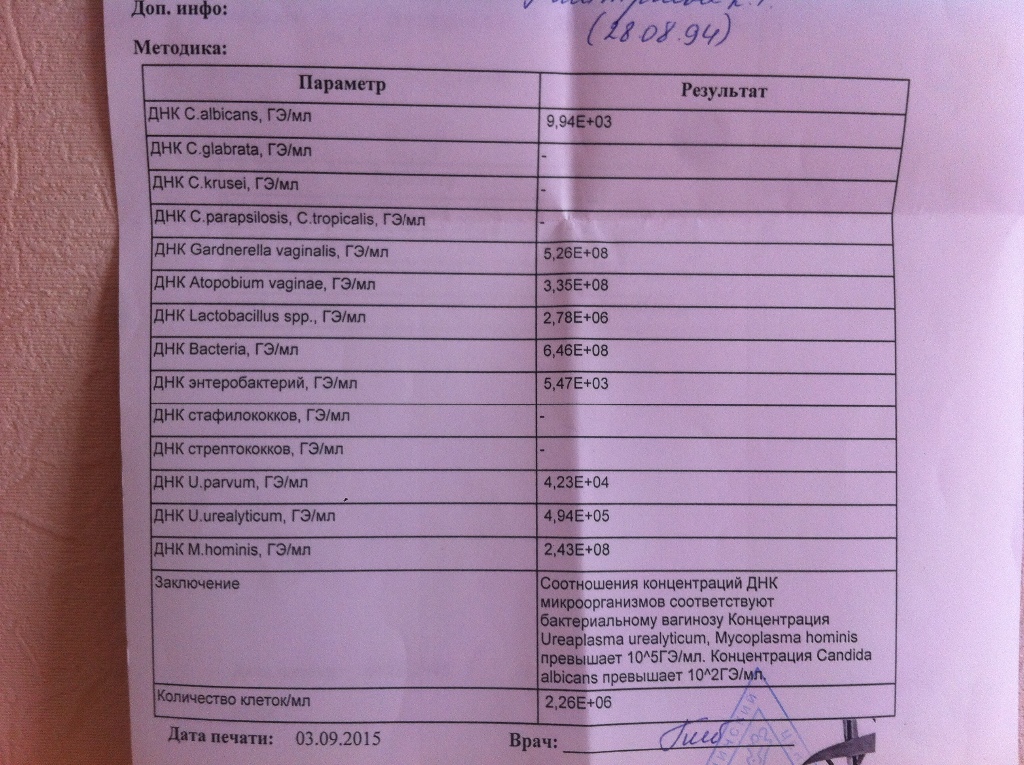
Анализы на половые инфекции ИППП-12 со скидкой до 50%
Информация об анализе
Инфекции, передаваемых половым путем, могут протекать с яркими жалобами, а могут быть незаметны, приводя к осложнениям и представляя угрозу для полового партнера, а у беременной женщины для ребенка.
Сдавать комплекс желательно перед началом новых половых отношений, через 2 недели после незащищенного или случайного полового контакта, особенно если не была проведена профилактическая антибактериальная терапия.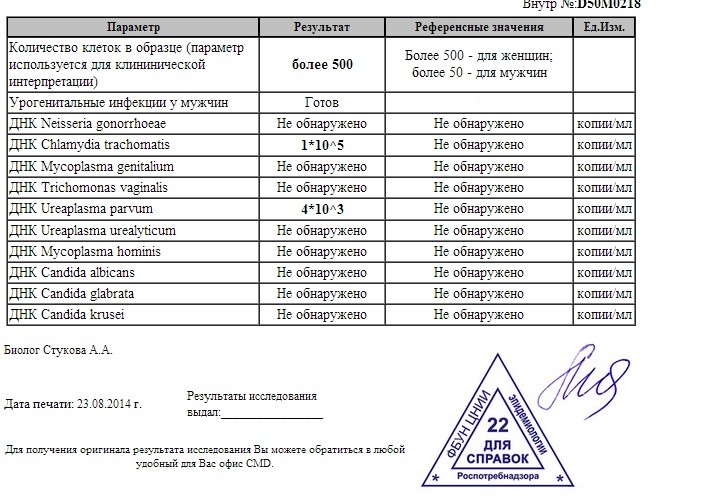
В случае наличия жалоб (выделения из влагалища, болезненность при половом акте и мочеиспускании) результаты анализов помогут выявить основных возбудителей инфекции.
Ваш партнер может сдать комплекс анализов ИППП-12 для мужчин.
В этот комплекс не входят анализы на ВИЧ, сифилис и гепатиты, т.к. они выполняются по крови. Их можно сдать в комплексе Группа риска.
Также комплекс ИППП для женщин не включает высокоонкогенные типы вируса папилломы человека, которые можно выявить в анализе Вирусы папилломы человека типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, типирование ДНК.
Метод исследования — ПЦР Real Time
Материал для исследования — Урогенитальный соскоб
Состав и результаты
Срок исполнения
Анализ будет готов в
течение 3 дней, исключая день забора. Срок может быть увеличен на 1 день в случае необходимости.
Вы получите результаты на эл. почту сразу по готовности.
Срок может быть увеличен на 1 день в случае необходимости.
Вы получите результаты на эл. почту сразу по готовности.
Расшифровку мы направим на эл.почту в течение 1 дня, исключая субботу и воскресенье.
Срок исполнения: 2 дня, исключая субботу и воскресенье (кроме дня взятия биоматериала)Подготовка к анализу
ЗаранееЕсли вы беременны, перед сдачей мазков обязательно предупредите медицинский центр по телефону заранее.
Забор мазков на исследование осуществляется в кабинете гинеколога у женщин и уролога или венеролога у мужчин.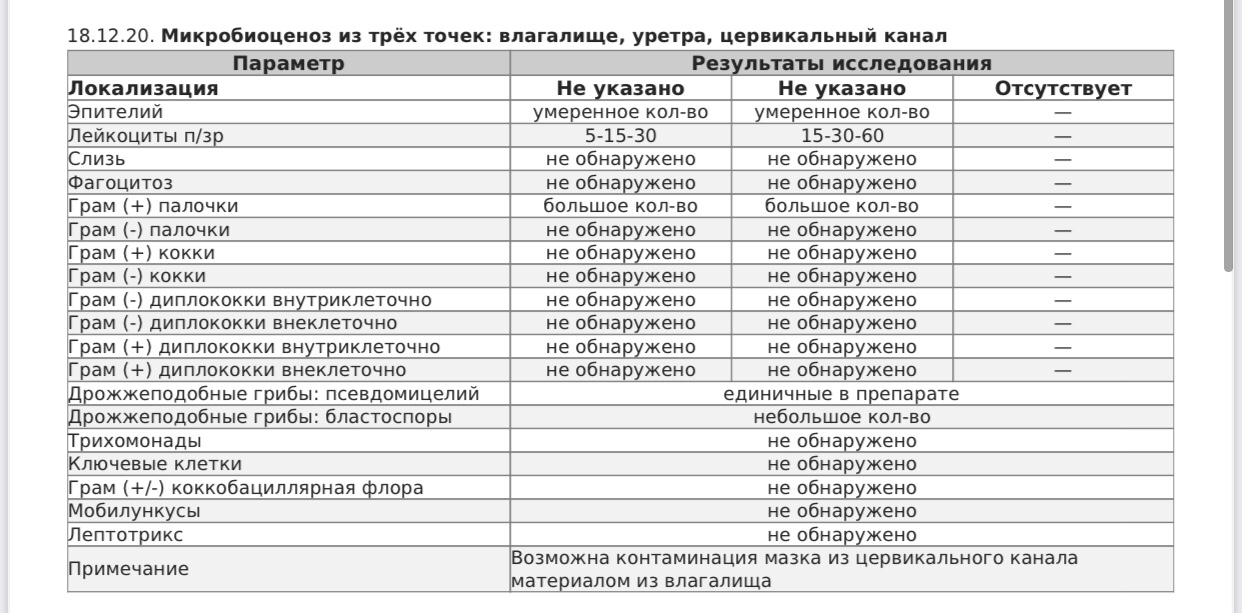
Забор у женщин не проводится во время менструации (на фоне кровянистых выделений) и не рекомендуется за 5 дней до начала предполагаемой менструации.
Общие правила подготовки:
- обсудите с врачом прием антибактериальных препаратов и препаратов, содержащих микроорганизмы, т.к. это может приводить к ложноотрицательным и ложноположительным результатам,
- рекомендуется проводить забор мазков не ранее, чем через 2 недели после законченного курса лечения,
- 72 часа не вступайте в половой контакт,
- для женщин 48 часов не проводите кольпоскопию и трансвагинальное УЗИ, не используйте местные хлорсодержащие и антибактериальные препараты.
- В день сдачи мазка не проводите гигиенические процедуры половых органов (для женщин также спринцевание влагалища, не используйте тампоны и влажные салфетки).
- В течение 2-х часов до анализа воздержитесь от посещения туалета (при заборе мазка из уретры).

Процедура у мужчин
Для взятия мазка мужчина стоит, медработник убирает слизь и вводит в уретру одноразовый зонд на глубину до 3-4 см, осторожно двигая инструмент, извлекает его из уретры.
Процедура у женщин
Для взятия мазка женщина садится в гинекологическое кресло, медработник осматривает половые пути, вводит во влагалище зеркало — стерильный инструмент, убирает слизь.
Далее зондом берёт материал из наиболее поражённой области. Это может быть: задний свод влагалища, шейка матки, уретра.
Расшифровка результатов
Расшифровка представляет расширенный результат комплекса лабораторных исследований и выполняется для женщин старше 18 лет только при возможности проанализировать результаты комплекса анализов и не выполняется при выполнении части анализов. Мы можем отказать в выполнении Расшифровки по своему усмотрению с возвратом оплаты.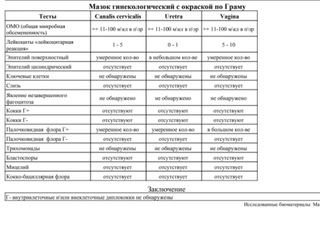
Она позволяет оценить значение выявленных возбудителей инфекций.
Расшифровка направляется на эл. почту в течение 1 дня после выполнения анализов, исключая субботу и воскресенье.
Расшифровка носит информационный и рекомендательный характер, не заменяет полноценный прием и консультацию врача. В основу данной расшифровки заложено условие – строгое соблюдение правил подготовки к сдаче анализов.
ИППП-12 для женщин
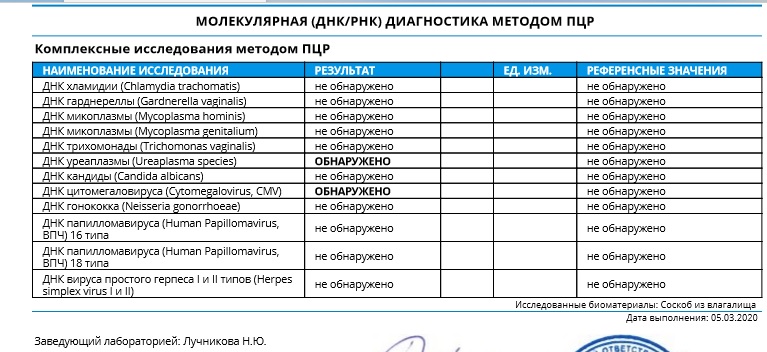 Инфекция может также передаваться от инфицированной матери плоду и новорожденному. Инфицирование бытовым путем через полотенца, туалетные принадлежности, и т.п. крайне редко возможно для некоторых заболеваний.
Инфекция может также передаваться от инфицированной матери плоду и новорожденному. Инфицирование бытовым путем через полотенца, туалетные принадлежности, и т.п. крайне редко возможно для некоторых заболеваний.
Каждый год во всем мире, по оценкам разных авторов, заражается ИППП около 330 миллионов человек. Самыми распространенными заболеваниями определены трихомониаз (около 120 млн.), хламидиоз (около 50 млн.) и гонорея (около 25 млн.). В России также наблюдается постоянный рост заболеваний передающихся половым путем.
Продолжительность периода с момента заражения до появления симптомов может варьировать от 2-3 дней до нескольких недель в зависимости от инфекции. Об инфицировании можно судить по следующим симптомам:
- выделения из влагалища;
- боль при мочеиспускании и во время полового акта;
- появление сыпи, язвочек в области гениталий.
Но при этом, необходимо учитывать, что заболевание может протекать и бессимптомно.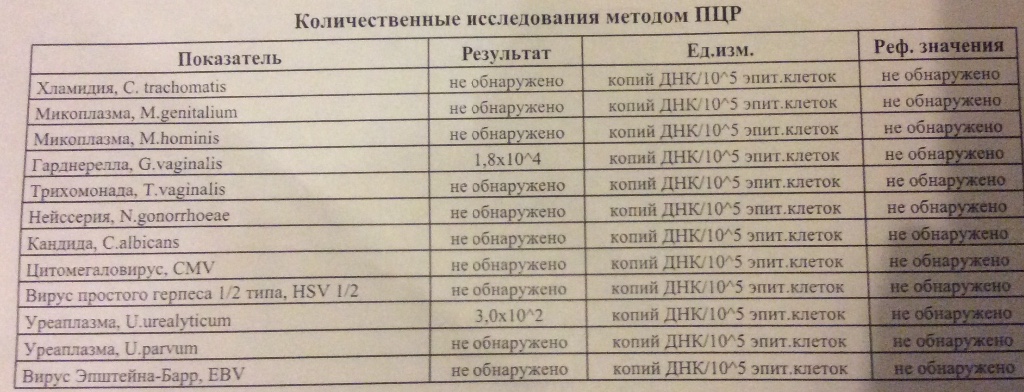 Инфекция, которую вовремя не диагностировали и не пролечили ведет к развитию серьёзных осложнений в виде воспалительных заболеваний органов малого таза и в итоге к бесплодию.
Инфекция, которую вовремя не диагностировали и не пролечили ведет к развитию серьёзных осложнений в виде воспалительных заболеваний органов малого таза и в итоге к бесплодию.
Многие возбудители широко распространены и могут сохраняться в организме длительное время, проявляя себя в периоды стресса, снижения иммунитета, представляя угрозу для плода во время беременности, т.к. способны передаваться от матери к плоду через плаценту или в родах.
Вирусы папилломы человека высокого онкогенного риска связаны с дисплазией и раком шейки матки, поэтому важно проверяться на эти вирусы регулярно.
Помните, что выявление некоторых возбудителей требует от вас решительных действий, информирование полового партнера с целью обследования и лечения.
| ПЦР-ДИАГНОСТИКА (мазок, соскоб из урогенитального тракта) | |||
Бактериальный вагиноз (Gardnerella vaginalis/ Lactobacillus sp/ Atopobium vaginae/ количество клеток), определение ДНК, кол.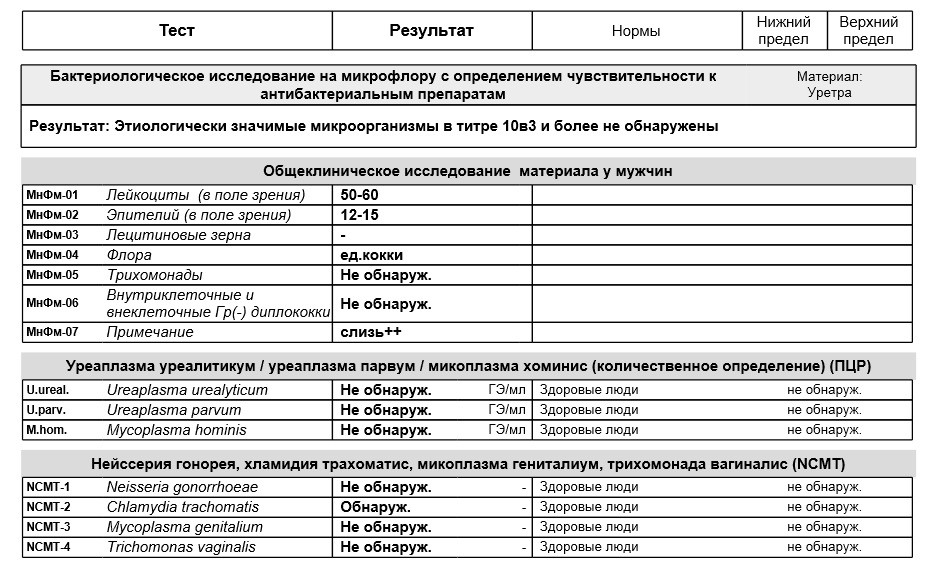 ан. ан. |
до 5 д. | 1090 р. | |
| Вирус папилломы человека высокого канцерогенного риска (HPV 16, 18, 31, 33, 35, 39, 45, 51, 52,56, 58, 59), качественное определение ДНК с указанием типа вируса (генотипирование) | до 9 д. | 820 р. | |
| Вирус папилломы человека высокого канцерогенного риска, без определения типа (HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68), определение ДНК, кач.ан. | до 5 д. | 540 р. | |
| Вирус папилломы человека высокого канцерогенного риска, без определения типа (у женщин) (HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68), определение ДНК, кол.ан. | до 7 д. | 1210 р. | |
Вирус папилломы человека, типы 16,18 (HPV 16,18), определение ДНК, кач. ан. ан. |
до 5 д. | 330 р. | |
| Вирус папилломы человека, типы 16,18 (HPV 16,18), определение ДНК, кол.ан. | до 7 д. | 610 р. | |
| Вирус папилломы человека, типы 6,11 (HPV 6,11), определение ДНК, кач.ан. | до 5 д. | 330 р. | |
| Вирус простого герпеса 1 и 2 типа (HSV 1,2), определение ДНК, кач.ан. | до 4 д. | 330 р. | |
| Возбудители кандидоза (Candida albicans/Candida glabrata/Candida krusei/Candida parapsilosis /Candida tropicalis), определение ДНК, кол.ан. | до 5 д. | 600 р. | |
Гарднерелла вагиналис (Gardnerella vaginalis), определение ДНК, кач. ан. ан. |
до 4 д. | 330 р. | |
| Кандида Альбиканс (Candida albicans), определение ДНК, кач.ан. | до 4 д. | 330 р. | |
| Микоплазма гениталиум (Mycoplasma genitalium), определение ДНК, кач.ан. | до 4 д. | 330 р. | |
| Микоплазма гениталиум (Mycoplasma genitalium), определение ДНК, кол.ан. | до 5 д. | 720 р. | |
| Микоплазма хоминис (Mycoplasma hominis), определение ДНК, кач.ан. | до 4 д. | 330 р. | |
Микоплазма хоминис (Mycoplasma hominis), определение ДНК, кол. ан. ан. |
до 5 д. | 680 р. | |
| Нейссерия гонореи (Neisseria gonorrhoeae), определение ДНК, кач.ан. | до 4 д. | 330 р. | |
| Нейссерия гонореи (Neisseria gonorrhoeae), определение ДНК, кол.ан. | до 5 д. | 720 р. | |
| Типирование уреаплазмы (U.urealyticum / U. parvum), определение ДНК, кач.ан. | до 4 д. | 330 р. | |
| Типирование уреаплазмы (U.urealyticum / U. parvum), определение ДНК, кол.ан. | до 5 д. | 550 р. | |
Трепонема паллидум (Treponema pallidum)(Сифилис), определение ДНК, кач. ан. ан. |
до 4 д. | 330 р. | |
| Трихомонас вагиналис (Trichomonas vaginalis), определение ДНК, кач.ан. | до 4 д. | 330 р. | |
| Трихомонас вагиналис (Trichomonas vaginalis), определение ДНК, кол.ан. | до 5 д. | 720 р. | |
| Урогенитальные инфекции (ПЦР 12 соскоб) (Хламидия трахоматис, Микоплазма гениталиум, Трихомонас вагиналис, Нейссерия гонорея, Микоплазма хоминис, Уреаплазма уреалитикум, Уреаплазма парвум, Гарднерелла вагиналис, Кандида альбиканс, Цитомегаловирус, Вирус простого герпеса 1 и 2), кач.ан. | до 4 д. | 2360 р. | |
Урогенитальные инфекции (ПЦР 15 соскоб) (Хламидия трахоматис, Микоплазма гениталиум, Трихомонас вагиналис, Нейссерия гонорея, Микоплазма хоминис, Уреаплазма уреалитикум, Уреаплазма парвум, Гарднерелла вагиналис, Кандида альбиканс, Цитомегаловирус, Вирус простого герпеса 1 и 2, Трепонема паллидум, Вирус папилломы человека 6/11), кач. ан. ан. |
до 4 д. | 2860 р. | |
| Урогенитальные инфекции (ПЦР 7 соскоб) (Хламидия трахоматис, Микоплазма гениталиум, Трихомонас вагиналис, Нейссерия гонорея, Микоплазма хоминис, Уреаплазма уреалитикум, Уреаплазма парвум), кач.ан. | до 4 д. | 1450 р. | |
| Урогенитальные инфекции (ПЦР 9 соскоб) (Хламидия трахоматис, Микоплазма гениталиум, Трихомонас вагиналис, Нейссерия гонорея, Микоплазма хоминис, уреаплазма уреалитикум, Уреаплазма парвум, Гарднерелла вагиналис, Кандида альбиканс), кач.ан. | до 4 д. | 1920 р. | |
Урогенитальные инфекции у женщин (Нейссерия гонорея, Хламидия трахоматис, Микоплазма гениталиум, Трихомонас вагиналис, Уреаплазма уреалитикум, Уреаплазма парвум, Микоплазма хоминис, Кандида альбиканс/глабрата/крузей/парапсилозис и тропикалис, Бактериальный вагиноз) определение ДНК, кол.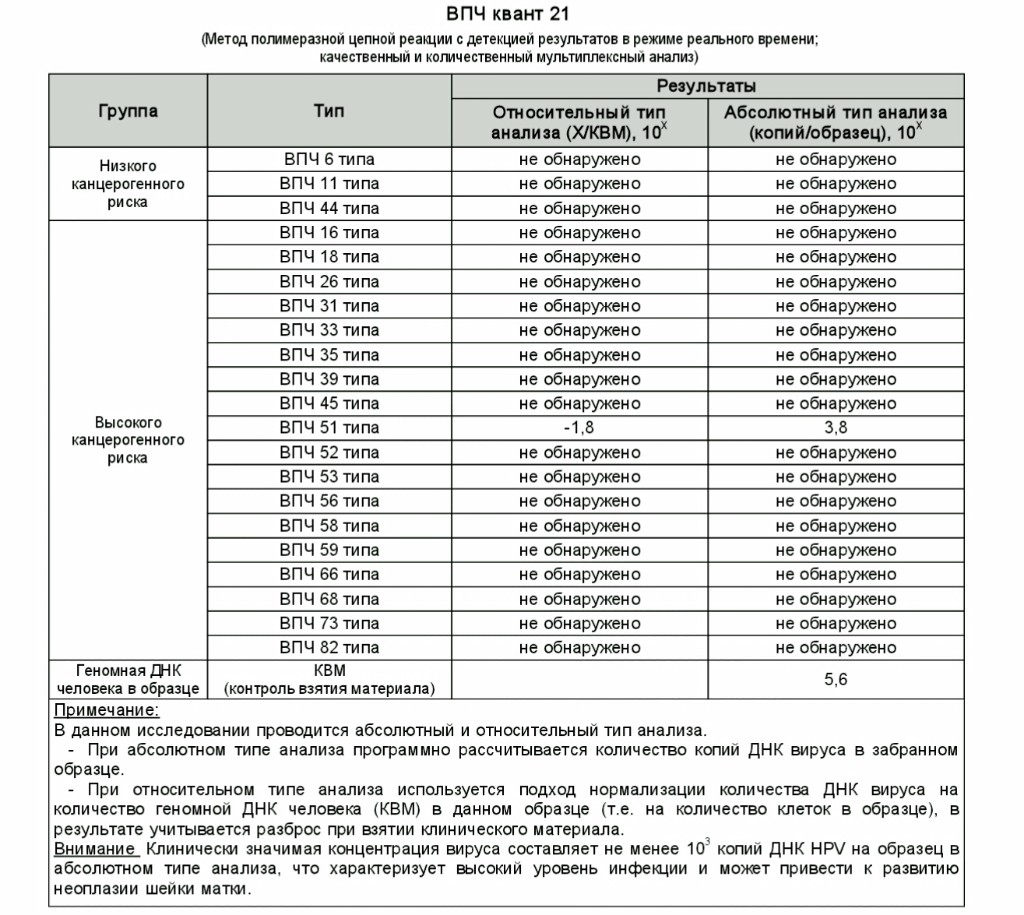 ан. (соскоб) ан. (соскоб) |
до 5 д. | 2700 р. | |
| Урогенитальные инфекции у мужчин (Нейссерия гонорея, Хламидия трахоматис, Микоплазма гениталиум, Трихомонас вагиналис, Уреаплазма уреалитикум, Уреаплазма парвум, Микоплазма хоминис, Кандида альбиканс/глабрата/крузей/парапсилозис и тропикалис), кол.ан.(соскоб) | до 5 д. | 2400 р. | |
| Фемофлор 16 (Исследование биоценоза урогенитального тракта) | до 5 д. | 2200 р. | |
| Фемофлор 8 (Исследование биоценоза урогенитального тракта) | до 5 д. | 1100 р. | |
| Фемофлор скрин (Исследование биоценоза урогенитального тракта) | до 5 д. |
1650 р. | |
| Флороценоз и NCMT (ДНК Candida albicans, ДНК Candida glabrata, ДНК Candida krusei, ДНК Candida parapsilosis/tropicalis, ДНК Ureaplasma parvum, ДНК Ureaplasma urealyticum, ДНК Mycoplasma hominis, ДНК Cardnerella vaginalis, ДНК Atopobium vaginae, ДНК Enterobacteriaceae, ДНК Staphylococcus spp., ДНК Streptococcus spp., ДНК Lactobacillus spp., ДНК Bacteria spp., ДНК Neisseria gonorrhoeae, ДНК Chlamydia trachomatis, ДНК Mycoplasma genitalium, ДНК Trichomonas vaginalis), кол.ан. | до 3 д. | 2170 р. | |
| Хламидия трахоматис (Chlamydia trachomatis), определение ДНК, кач.ан. | до 4 д. | 330 р. | |
| Хламидия трахоматис (Chlamydia trachomatis), определение ДНК, кол.ан. | до 5 д. |
720 р. | |
| Цитомегаловирус (Cytomegalovirus), определение ДНК, кач.ан. | до 4 д. | 330 р. | |
Анализы на инфекции — ПЦР, ИППП, ВИЧ, гепатит, сифилис, вирусы — Лаборатория Прогрессивные Медицинские Технологии в Челябинске
В независимой лаборатории «Прогрессивные Медицинские Технологии» вы можете выполнить широкий перечень лабораторных тестов, направленных на выявление инфекционных заболеваний человека.
Определение специфических антител — иммуноглобулинов классов A, M, G в крови c использованием методов иммуноферментного анализа (ИФА) или иммунохемилюминесцентного анализа, позволяет выявить факт инфицированности, текущий инфекционный процесс, перенесенную инфекцию, напряженность иммунитета после вакцинации.
Определение ДНК возбудителя в исследуемом материале методом полимеразной цепной реакции в реальном времени (анализ ПЦР Real-Time) — современный метод молекулярной диагностики, способный быстро и с высокой точностью выявить инфекцию даже в случае присутствия в образце единичных возбудителей.
В некоторых случаях для диагностики инфекции достаточным является только определение антител или ДНК, либо возможности лабораторной диагностики ограничены одним методом. Комплексная диагностика с использованием 2 лабораторных методов дает врачу максимально полную информацию о наличии инфекции, стадии инфекционного процесса и рисках передачи инфекции.
Для диагностики инфекций, передающихся половым путем (анализ ИППП), лаборатория предлагает как отдельные тесты, так и комплексные исследования, позволяющие при минимальных затратах провести полное обследование.
Цены
Уважаемые клиенты! Обращаем Ваше внимание: стоимость услуги проведения медицинских анализов складывается из стоимости исследований и стоимости взятия биологического материала. Сроки выполнения исследований рассчитываются с момента поступления биоматериала в лабораторию.
Лаборатория
Мы работаем на лабораторном оборудовании ведущих мировых производителей, которое обеспечивает максимально точные результаты в кратчайшие сроки.
Наши преимущества
Быстро
Точно
Надежно
Отзывы
Автор: Владимир
Отзыв: Сдавал анализ на гепатит, вежливый персонал, никаких лишних вопросов, все быстро
Автор: Антонина
Отзыв: Сдавала анализ на ЗППП, благодарна медперсоналу за деликатность
Автор: Николай
Отзыв: Детский кал на инфекции можно сдать в течение всего дня и в выходные, это очень удобно.
ПЦР — диагностика инфекционных заболеваний
ПЦР — диагностика (полимеразная цепная реакция) — высокоточный метод диагностики многочисленных инфекций, который основывается на исследовании генетического материала человека (ДНК и РНК). В зависимости от цели исследования используются кровь, слюна, мокрота, выделения половых органов и прочее биологические материалы.
ПЦР — анализЧасто бывает, что различные по своей природе вирусы могу вызывать одинаковые симптомы заболевания. ПЦР анализ позволяет определить наличие возбудителя, даже при минимальном содержании его штаммов в биологическом материале, а в отдельных случаях, выявляет даже единичные клетки вирусов или бактерий. Определяется вирус, природа его появления, устанавливается сила его воздействия на организм и количество имеющихся микробов в организме. Эта информация важна для лечащего врача при выборе лекарственных препаратов и назначении методов лечения.
ПЦР анализ позволяет определить наличие возбудителя, даже при минимальном содержании его штаммов в биологическом материале, а в отдельных случаях, выявляет даже единичные клетки вирусов или бактерий. Определяется вирус, природа его появления, устанавливается сила его воздействия на организм и количество имеющихся микробов в организме. Эта информация важна для лечащего врача при выборе лекарственных препаратов и назначении методов лечения.
В настоящее время ПЦР тест позволяет выявлять все известные современной медицине вирусные заболевания. В том числе даже те, которые могут годами «жить» в организме человека и не проявлять себя, ожидая наиболее комфортных условий для своей «работы». Диагностика «растущих» длительное время возбудителей особенно актуальна в гинекологии и урологии.
В медицинской лаборатории «Синэво» можно пройти ПЦР — диагностику по следующим заболеваниям:
Гепатит B и C
Проведение ПЦР — диагностики необходимо здесь в силу того, что вирус гепатитов имеет продолжительный инкубационный период (до 180 дней) и достаточно серьезные последствия, вплоть до летального исхода.
Заболевания, передающиеся половым путем: уреплазмол половых органов, хламидиоз, трихомониаз, микоплазмоз. Коварство заключается в том, что симптомы данных заболеваний зачастую на ранних стадиях «стерты». Эта группа заболеваний опасна тем, что может вызвать у женщин бесплодие, оказывает серьезное влияние на течение беременности, увеличивает риск развития рака шейки матки. У мужчин снижается подвижность и жизнеспособность сперматозоидов, вызывая мужское бесплодие, поражается мочеиспускательный канал и развивается простатит. Увеличиваются риски заболевания генитальным герпесом, а так же ВИЧ/СПИД. Пакет 18.1 «Обследование на ИППП».
Сдать анализ рекомендуется и супругам, желающим родить здорового ребенка. Ведь только ПЦР — диагностика позволяет выявить скрытые инфекции в организме и предотвратить их проникновение в организм плода.
Опасное и устойчивое заболевание. Зачастую болезнь не системна и протекает долгие годы в неактивном режиме. При этом возможны проявления, похожие на симптомы герпеса. Но истекают они так быстро, что не возможно точно поставить диагноз традиционным способом. Опасность герпеса в том, что он может поражать центральную нервную систему и стать причиной развития менингита и энцефалита. См. услуги ДНК вируса простого герпеса 1-го и 2-го типа (соскоб) и ДНК вируса простого герпеса 1-го и 2-го типа (кровь, качественное определение).
Тест на отцовствоБлагодаря ПЦР — диагностике инфекции выявляются на начальном этапе их развития, что способствует скорейшему выздоровлению и предотвращению серьезных осложнений.
Скрытые инфекции
Скрытыми инфекциями принято называть группу заболеваний, передающихся половым путем, течение которых практически никак не проявляется и протекает без конкретных симптомов. Поэтому при отсутствии надлежащего контроля за своим здоровьем и образом жизни скрытые инфекции выявляются поздно и чреваты своими непредсказуемыми последствиями.
Поэтому при отсутствии надлежащего контроля за своим здоровьем и образом жизни скрытые инфекции выявляются поздно и чреваты своими непредсказуемыми последствиями.
Скрытые инфекции передаются половым путем или при несоблюдении личной гигиены и нередко сочетаются группами. Особенно опасны при беременности, поскольку представляют серьезную угрозу для жизни и здоровья будущего ребенка.
К скрытым инфекциям относятся:
- хламидиоз;
- цитомегаловирусная инфекция;
- гарднереллез;
- микоплазмоз;
- герпесвирусная генитальная инфекция;
- уреаплазмоз.
Невылеченные скрытые инфекции приводят к хроническим воспалительных заболеваниям мочеполовой системы, бесплодию, привычному невынашиванию беременности, патологии развития плода.
Диагностика выявления скрытых инфекция методами, принятыми для других возбудителей, неэффективна. Помимо общего мазка на микрофлору и бактериологического посева используются ИФА (иммуноферментые анализы) и ПЦР (полимеразная цепная реакция). Для получения адекватного и достоверного результата необходимо перед сдачей анализов соблюсти несколько несложных условий:
Для получения адекватного и достоверного результата необходимо перед сдачей анализов соблюсти несколько несложных условий:
- благоприятное время для сдачи анализа – пятый-шестой день менструального цикла;
- исключить прием антибиотиков и противовирусных лекарств;
- исключить половые контакты за 2 дня до анализов;
- исключить спринцевание, использование средств интимной гигиены и местных антисептиков.
Основаниями для обращения к врачу для диагностики скрытых инфекций должны служить:
- наличие выделений, дискомфорт или зуд наружных половых органов, болезненность при мочеиспускании или половом акте;
- бесплодие;
- повторяющиеся выкидыши;
- эрозия шейки матки;
- воспалительные заболевания репродуктивной сферы;
- частая смена полового партнера.
Лечение скрытых инфекций должно быть комплексным. В зависимости от выявленного возбудителя врач назначит противомикробную терапию. В случае выявления вирусного агента будет назначены противовирусные препараты.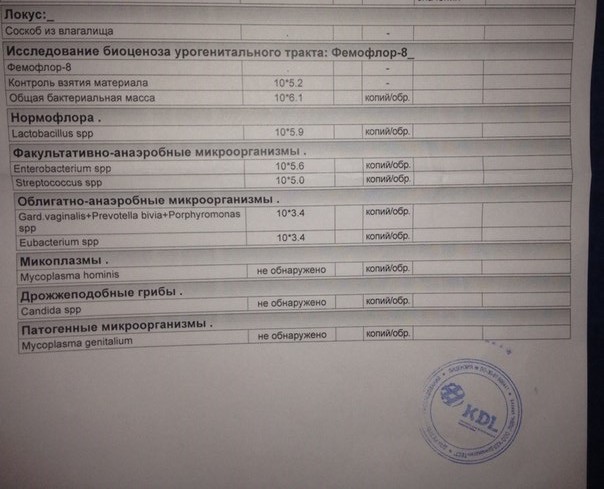 Иммуномодуляторы и иммуностимуляторы помогут усилить защитную роль иммунитета. При необходимости корректировке подвергаются гормональные нарушения. Может быть назначен курс физиотерапии.
Иммуномодуляторы и иммуностимуляторы помогут усилить защитную роль иммунитета. При необходимости корректировке подвергаются гормональные нарушения. Может быть назначен курс физиотерапии.
Не пренебрегайте заботой о своем здоровье! Своевременное выявление и грамотное лечение скрытых инфекций уберегут вас от серьезных последствий.
В Казани диагностику и лечение скрытых инфекций осуществляют специалисты Медицинского центра «Звезда».
Анализ ПЦР — точная диагностика инфекций
Полимеразная цепная реакция (Polymerase chain reaction, ПЦР, PCR) – искусственный процесс, в ходе которого многократно копируются определенные участки ДНК (РНК). Метод изобрёл в 1983 году американский биохимик Кэри Б. Мюллис. В 1993 году за это открытие он был удостоен Нобелевской премии.
Области применения ПЦР чрезвычайно широки. Особое место ПЦР занимает в медицинской практике. И причина этому проста: полимеразная цепная реакция делает невозможное возможным.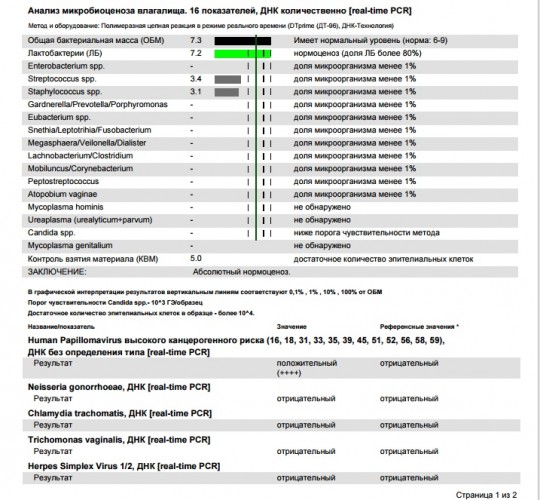
Диагностику ПЦР образно описывают как метод, с помощью которого можно находить иглу в стоге сена и затем строить стог из этих игл. «Иглой» является крошечный фрагмент генетического материала клеток (ДНК или РНК).
Открытие этого метода – выдающееся событие в области молекулярной биологии за последние десятилетия. Развитие метода ПЦР позволило медицинской диагностике подняться на качественно новый уровень.
Основы ПЦР
Основа метода — многократное избирательное копирование (амплификация) определённого участка ДНК с целью получения такого количества генетического материала, которого будет достаточно для визуального обнаружения. При этом многократно копируется только заданный участок ДНК при условии, что он присутствует в исследуемом биоматериале.
Кроме того, исследование позволяет проводить другие манипуляции с генетическим материалом. Поэтому метод широко применяется в научных исследованиях, биологической и медицинской практике: в диагностике инфекционных и наследственных заболеваний, при выявлении мутаций, генотипировании, установлении отцовства, идентификации личности и др.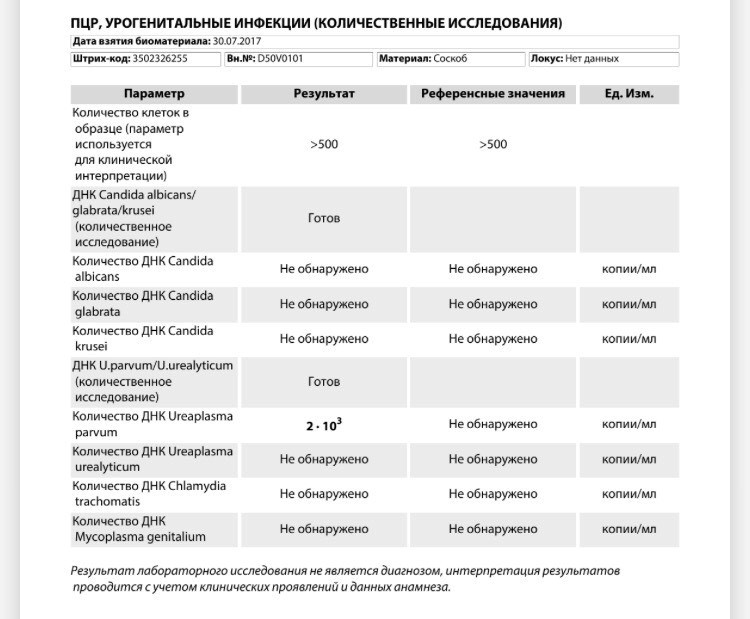
ПЦР в диагностике инфекционных болезней
Сегодня ПЦР-диагностика инфекций — один из самых точных, чувствительных и эффективных клинических лабораторных методов. Спектр выявляемых возбудителей практически неограничен – была бы разработана тест-система для анализа искомого возбудителя.
Благодаря своей высокой чувствительности, ПЦР позволяет выявить возбудителя даже при его минимальном содержании (то есть, когда в исследуемом биоматериале присутствуют всего несколько молекул его ДНК).
ПЦР выявляет возбудителей инфекционных заболеваний тогда, когда это невозможно сделать другими методами (иммунологическими, культуральными, микроскопическими). Поэтому для целого ряда возбудителей инфекций метод полимеразной цепной реакции стал «золотым стандартом», он проверен временем и одобрен клинически. Этот метод позволяет не только установить этиологию заболевания, но и контролировать течение инфекционного процесса и оценивать эффективность проводимого лечения.
Анализ методом ПЦР особенно актуален при бессимптомном течении инфекционного процесса, вызванного безусловно-патогенными микроорганизмами — возбудителями инфекций, передаваемых половым путём (Хламидия, качественное определение ДНК; Микоплазма, качественное определение ДНК; Возбудитель гонореи, качественное определение ДНК; Возбудитель трихомоноза, качественное определение ДНК). Например, при хронической гонорее у женщин даже с помощью бактериологического метода часто не удается выявить гонококк, несмотря на имеющиеся симптомы хронического воспалительного процесса в шейке матки или уретре.
Современная ПЦР-диагностика позволяет не только выявить факт наличия генетического материала возбудителя инфекции, но и определить его количество. Определение количества возбудителей важно для принятия решения о лечении, его способах и длительности, особенно если выявлены условно-патогенные микроорганизмы (Микоплазма, количественное определение ДНК; Типирование уреаплазмы, количественное определение ДНК).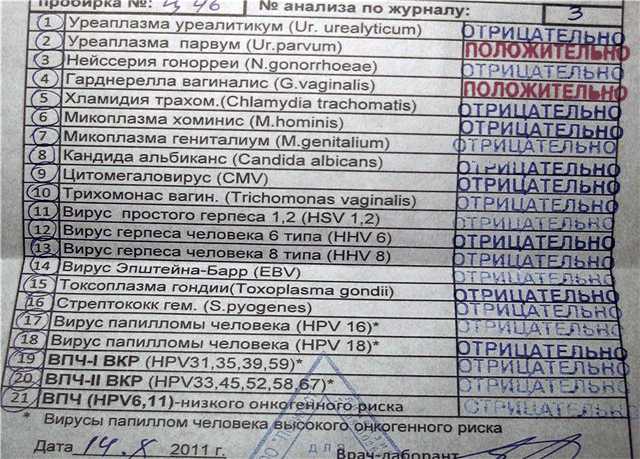
В лаборатории CMD разработан формат ПЦР исследования «Мультипрайм», позволяющий выявить в одной пробирке (и одной реакции) нескольких патогенов.
ПЦР-диагностика гепатитов
Известно как минимум 5 вирусов, которые способны вызывать поражение печени — возбудители гепатита А, В, С, D, Е. В редких случаях гепатит может быть вызван вирусами Эпштейна-Барр и простого герпеса. Все эти вирусы относятся к различным семействам, имеют разные биологические свойства и соответственно, тактика лечения будет тоже значительно отличаться.
Быстро и точно определить возбудителя – первоочередная задача врача. Без использования современных молекулярно-биологических методов это невозможно. Поэтому диагностика гепатитов методом полимеразной цепной реакции – важный шаг в установлении причины заболевания и определения дальнейшей тактики лечения.
ПЦР в диагностике ВИЧ-инфекции
Для выявления ВИЧ-инфекции в условиях лаборатории используется серологическая диагностика — обнаружение в крови антител к ВИЧ с помощью иммуноферментного анализа (ИФА).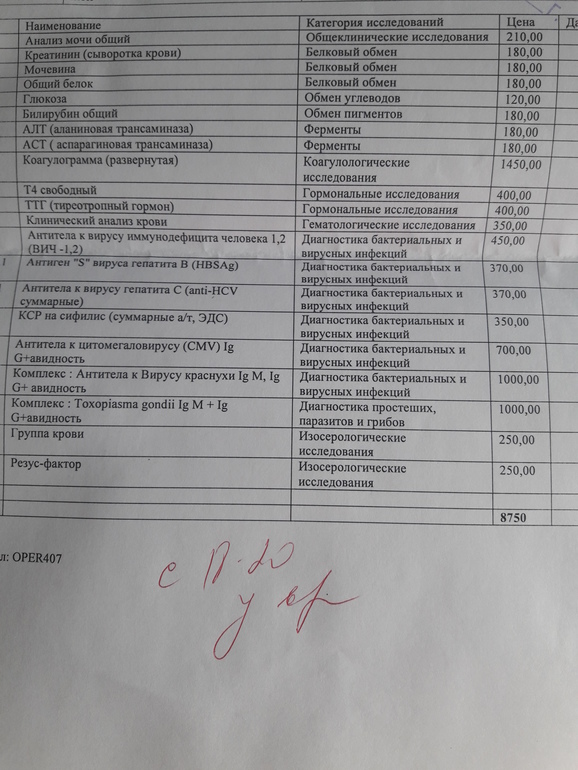 Затем следует подтверждение положительных результатов анализа методом иммуноблоттинга (ИБ). Эффективность данного подхода достигает 99% и более.
Затем следует подтверждение положительных результатов анализа методом иммуноблоттинга (ИБ). Эффективность данного подхода достигает 99% и более.
Но серологическая диагностика ВИЧ-инфекции имеет ряд ограничений:
- Неэффективность в период «серологического окна» (в первые недели после заражения антитела не выявляются по причине их отсутствия или низкой концентрации).
- Антитела к ВИЧ длительное время выявляются у всех детей, рожденных от ВИЧ-инфицированных матерей.
- Ложноположительные результаты ИФА из-за присутствия в крови антител к антигенам, сходным с антигенами ВИЧ.
- Ложноотрицательные и сомнительные результаты ИФА и иммуноблоттинга (особенно у пациентов в терминальной стадии заболевания).
Поэтому анализы ПЦР при обследовании на ВИЧ-инфекцию сегодня находят всё более широкое применение. В «Методических рекомендациях о проведении обследования на ВИЧ-инфекцию» сказано: «при наличии эпидемиологических критериев, свидетельствующих о недавнем риске заражения ВИЧ для пациентов и при этом предположительно ложноположительных или ложноотрицательных результатов ИФА и ИБ, например, при обследовании детей, рожденных от ВИЧ-инфицированных матерей, или пациентов в периоде «серологического окна», используется метод ПЦР, при котором обнаруживается генный материал ВИЧ». А в случае уже установленного диагноза ВИЧ-инфекции анализ методом ПЦР используется для прогноза, динамического наблюдения и мониторинга проводимой терапии.
А в случае уже установленного диагноза ВИЧ-инфекции анализ методом ПЦР используется для прогноза, динамического наблюдения и мониторинга проводимой терапии.
В Центре молекулярной диагностики (CMD) можно сдать ПЦР-анализ на ВИЧ анонимно.
Где сдать анализ методом ПЦР?
Вы можете сдать анализ методом ПЦР в офисе CMD, обратитесь к разделу сайта «Где сдать анализы».
Вирусная динамика и корреляция значений Ct RT-PCR в реальном времени с тяжестью заболевания при COVID-19
ОТ-ПЦР в реальном времени считается золотым стандартом подтверждающего теста на коронавирусную болезнь 2019 года (COVID-19). Однако многие ученые не согласны с этим, и важно понимать, что некоторые факторы и переменные могут привести к ложноотрицательному результату теста. В этом контексте пороговые значения цикла (Ct) используются для диагностики или прогнозирования инфекции SARS-CoV-2.Эта практика имеет важное клиническое значение, поскольку значения Ct могут коррелировать с вирусной нагрузкой. Кроме того, значения Ct имеют сильную корреляцию с несколькими гематологическими и биохимическими маркерами. Однако важно учитывать, что на значения Ct могут влиять преаналитические, аналитические и постаналитические переменные, такие как метод сбора, тип образца, время отбора проб, вирусная кинетика, условия транспортировки и хранения, экстракция нуклеиновой кислоты, вирусная РНК. нагрузка, дизайн праймера, эффективность ПЦР в реальном времени и метод определения значения Ct.Таким образом, понимание интерпретации значений Ct и других влиятельных факторов может сыграть решающую роль в интерпретации вирусной нагрузки и тяжести заболевания. В нескольких клинических исследованиях, состоящих из выборок малого или большого размера, существует несколько расхождений в отношении значительной положительной корреляции между значением Ct и тяжестью заболевания при COVID-19. В этом контексте был проведен пересмотренный обзор литературы, чтобы заполнить пробелы в знаниях о корреляции между значениями Ct и показателями тяжести/летальности у пациентов с COVID-19.
Кроме того, значения Ct имеют сильную корреляцию с несколькими гематологическими и биохимическими маркерами. Однако важно учитывать, что на значения Ct могут влиять преаналитические, аналитические и постаналитические переменные, такие как метод сбора, тип образца, время отбора проб, вирусная кинетика, условия транспортировки и хранения, экстракция нуклеиновой кислоты, вирусная РНК. нагрузка, дизайн праймера, эффективность ПЦР в реальном времени и метод определения значения Ct.Таким образом, понимание интерпретации значений Ct и других влиятельных факторов может сыграть решающую роль в интерпретации вирусной нагрузки и тяжести заболевания. В нескольких клинических исследованиях, состоящих из выборок малого или большого размера, существует несколько расхождений в отношении значительной положительной корреляции между значением Ct и тяжестью заболевания при COVID-19. В этом контексте был проведен пересмотренный обзор литературы, чтобы заполнить пробелы в знаниях о корреляции между значениями Ct и показателями тяжести/летальности у пациентов с COVID-19. Поиск в различных базах данных, таких как PubMed, Science Direct, Medline, Scopus и Google Scholar, проводился до апреля 2021 года с использованием ключевых слов, включая «ОТ-ПЦР или вирусная нагрузка», «SARS-CoV-2 и ОТ-ПЦР», «значение Ct». и вирусная нагрузка», «Значение Ct или COVID-19». Исследовательские статьи были извлечены и отобраны авторами независимо друг от друга и включены в настоящий обзор на основании их актуальности для исследования. В текущем описательном обзоре исследуется корреляция значений Ct со смертностью, прогрессированием заболевания, тяжестью и инфекционностью.Мы также обсудим факторы, которые могут повлиять на эти значения, такие как метод сбора, тип мазка, метод отбора проб и т. д.
Поиск в различных базах данных, таких как PubMed, Science Direct, Medline, Scopus и Google Scholar, проводился до апреля 2021 года с использованием ключевых слов, включая «ОТ-ПЦР или вирусная нагрузка», «SARS-CoV-2 и ОТ-ПЦР», «значение Ct». и вирусная нагрузка», «Значение Ct или COVID-19». Исследовательские статьи были извлечены и отобраны авторами независимо друг от друга и включены в настоящий обзор на основании их актуальности для исследования. В текущем описательном обзоре исследуется корреляция значений Ct со смертностью, прогрессированием заболевания, тяжестью и инфекционностью.Мы также обсудим факторы, которые могут повлиять на эти значения, такие как метод сбора, тип мазка, метод отбора проб и т. д.
Ключевые слова: COVID-19; значения Кт; ОТ-ПЦР; SARS-CoV-2; смертность; строгость; вирусная нагрузка.
Одно число может помочь определить, насколько заразен пациент с COVID-19.
 Должны ли результаты испытаний включать это? | Наука
Должны ли результаты испытаний включать это? | НаукаОтчет Science о COVID-19 поддерживается Пулитцеровским центром и Фондом Хейзинга-Саймонса.
С тех пор, как началась пандемия коронавируса, вокруг тестирования разгорелись споры: какие тесты следует сдавать, кому и как часто? Теперь эпидемиологи и эксперты в области общественного здравоохранения открывают новую дискуссию. Они говорят, что центры тестирования должны сообщать не только о том, является ли человек положительным, но и о числе, известном как значение порога цикла (CT), которое указывает, сколько вируса содержит инфицированный человек.
Сторонники указывают на новое исследование, показывающее, что значения КТ могут помочь врачам отметить пациентов с высоким риском серьезного заболевания.Недавние результаты также показывают, что эти цифры могут помочь чиновникам определить, кто заразен, и поэтому их следует изолировать, а их контакты отследить. Сторонники признают, что значение КТ — несовершенная мера.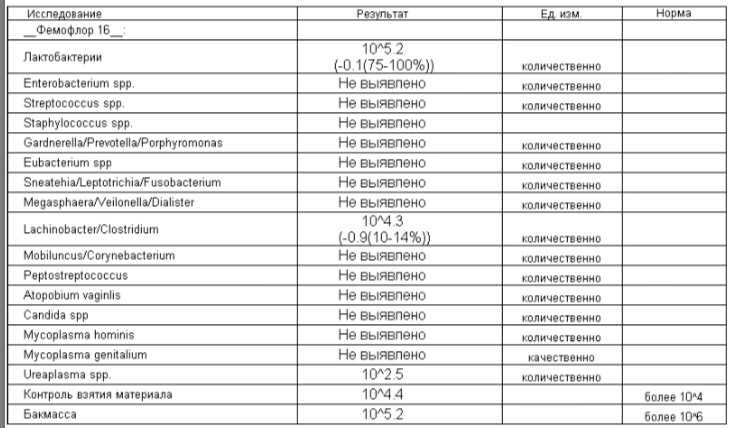 Но добавлять ли его в результаты тестов — «это один из самых насущных вопросов», — говорит Майкл Мина, врач и эпидемиолог из Гарвардского университета. Chan School of Public Health
Но добавлять ли его в результаты тестов — «это один из самых насущных вопросов», — говорит Майкл Мина, врач и эпидемиолог из Гарвардского университета. Chan School of Public Health
Стандартные тесты выявляют инфекции SARS-CoV-2 путем выделения и амплификации вирусной РНК с использованием процедуры, известной как полимеразная цепная реакция (ПЦР), которая основана на нескольких циклах амплификации для получения обнаруживаемого количества РНК.Значение CT — это количество циклов, необходимое для обнаружения вируса; В этот момент машины ПЦР перестают работать. Если положительный сигнал не наблюдается после 37-40 циклов, тест отрицательный. Но образцы, которые оказались положительными, могут начинаться с совершенно разных количеств вируса, для которых значение CT представляет собой обратную меру. Тест, который регистрирует положительный результат после 12 раундов при значении CT 12, начинается с более чем в 10 миллионов раз большего количества вирусного генетического материала, чем образец со значением CT 35.
Но один и тот же образец может давать разные значения КТ на разных машинах для тестирования, а разные мазки, взятые у одного и того же человека, могут давать разные результаты. «Значение КТ — это не абсолютная шкала, — говорит Марта Галья, вирусолог из Университета Тафтса. По словам Мины, это настораживает многих клиницистов. «Врачи по своей природе осторожны», — говорит Мина. «Они говорят: «Если мы не можем на это положиться, это ненадежно». В августовском письме Clinical Infectious Diseases члены Коллегии американских патологоанатомов призвали к осторожности при интерпретации значений КТ.
Тем не менее, Mina, Gaglia и другие утверждают, что знание того, являются ли значения CT высокими или низкими, может быть очень информативным. «Даже со всеми несовершенствами знание вирусной нагрузки может быть чрезвычайно важным», — говорит Мина.
Ранние исследования показали, что у пациентов в первые дни инфекции значения КТ ниже 30, а часто и ниже 20, что указывает на высокий уровень вируса; по мере того как организм очищается от коронавируса, значения CT постепенно повышаются. Более поздние исследования показали, что более высокая вирусная нагрузка может существенно повлиять на заразность человека и отразить тяжесть заболевания.
Более поздние исследования показали, что более высокая вирусная нагрузка может существенно повлиять на заразность человека и отразить тяжесть заболевания.
В исследовании, опубликованном на этой неделе в журнале Clinical Infectious Diseases , исследователи под руководством Бернарда Ла Скола, эксперта по инфекционным заболеваниям IHU-Méditerranée Infection, изучили 3790 положительных образцов с известными значениями CT, чтобы определить, содержат ли они жизнеспособный вирус, что указывает на пациенты, вероятно, были заразными. Ла Скола и его коллеги обнаружили, что 70% образцов со значениями CT 25 или ниже можно культивировать, по сравнению с менее чем 3% случаев со значениями CT выше 35.«Справедливо сказать, что более высокая вирусная нагрузка связана с большей заразностью», — говорит Моника Ганди, специалист по инфекционным заболеваниям из Калифорнийского университета в Сан-Франциско.
И наоборот, люди часто дают положительный результат в течение нескольких недель или даже месяцев после выздоровления, но имеют высокие значения CT, предполагая, что ПЦР идентифицировала генетический материал из неинфекционных вирусных остатков. Текущие рекомендации Центров по контролю и профилактике заболеваний и Всемирной организации здравоохранения, которые призывают пациентов изолировать себя в течение 10 дней после появления симптомов, признают, что они вряд ли будут заразными после этого периода.Но Мина и другие говорят, что недавние результаты также свидетельствуют о том, что пациент, который прошел несколько тестов с высокими значениями CT, вероятно, находится в последней стадии инфекции и не должен изолировать себя. Он добавляет, что специалисты по отслеживанию контактов должны сортировать свои усилия на основе значений CT. «Если на мой стол попадет 100 файлов [в качестве средства отслеживания контактов], я сначала расставлю приоритеты с самой высокой вирусной нагрузкой, потому что они наиболее заразны», — говорит Мина.
Текущие рекомендации Центров по контролю и профилактике заболеваний и Всемирной организации здравоохранения, которые призывают пациентов изолировать себя в течение 10 дней после появления симптомов, признают, что они вряд ли будут заразными после этого периода.Но Мина и другие говорят, что недавние результаты также свидетельствуют о том, что пациент, который прошел несколько тестов с высокими значениями CT, вероятно, находится в последней стадии инфекции и не должен изолировать себя. Он добавляет, что специалисты по отслеживанию контактов должны сортировать свои усилия на основе значений CT. «Если на мой стол попадет 100 файлов [в качестве средства отслеживания контактов], я сначала расставлю приоритеты с самой высокой вирусной нагрузкой, потому что они наиболее заразны», — говорит Мина.
Широкий доступ к данным КТ также может помочь эпидемиологам отслеживать вспышки, говорит Мина.Если исследователи увидят много низких значений CT, они могут сделать вывод, что вспышка расширяется. Но если почти все значения CT высокие, вспышка, вероятно, идет на убыль. «Мы должны перестать думать о людях как о положительных или отрицательных, и спросить, насколько положительными?» — говорит Мина.
Но если почти все значения CT высокие, вспышка, вероятно, идет на убыль. «Мы должны перестать думать о людях как о положительных или отрицательных, и спросить, насколько положительными?» — говорит Мина.
Значения КТ также могут помочь клиницистам отметить пациентов с наиболее высоким риском тяжелого заболевания и смерти. В июньском отчете исследователей из Weill Cornell Medicine было обнаружено, что среди 678 госпитализированных пациентов 35% со значением CT 25 или менее умерли по сравнению с 17.6% со значением CT от 25 до 30 и 6,2% со значением CT выше 30. В августе исследователи из Бразилии обнаружили, что среди 875 пациентов те, у кого значение CT 25 или ниже, чаще имели тяжелое заболевание или умирали. .
Ганди согласен с тем, что доступ к данным КТ может помочь клиницистам выявлять людей с высоким риском развития симптомов. Тем не менее, она и другие отмечают, что высокая вирусная нагрузка не обязательно приводит к заболеванию; около 40% людей, заразившихся SARS-CoV-2, остаются здоровыми, даже несмотря на то, что у них такое же количество вируса, как и у заболевших пациентов.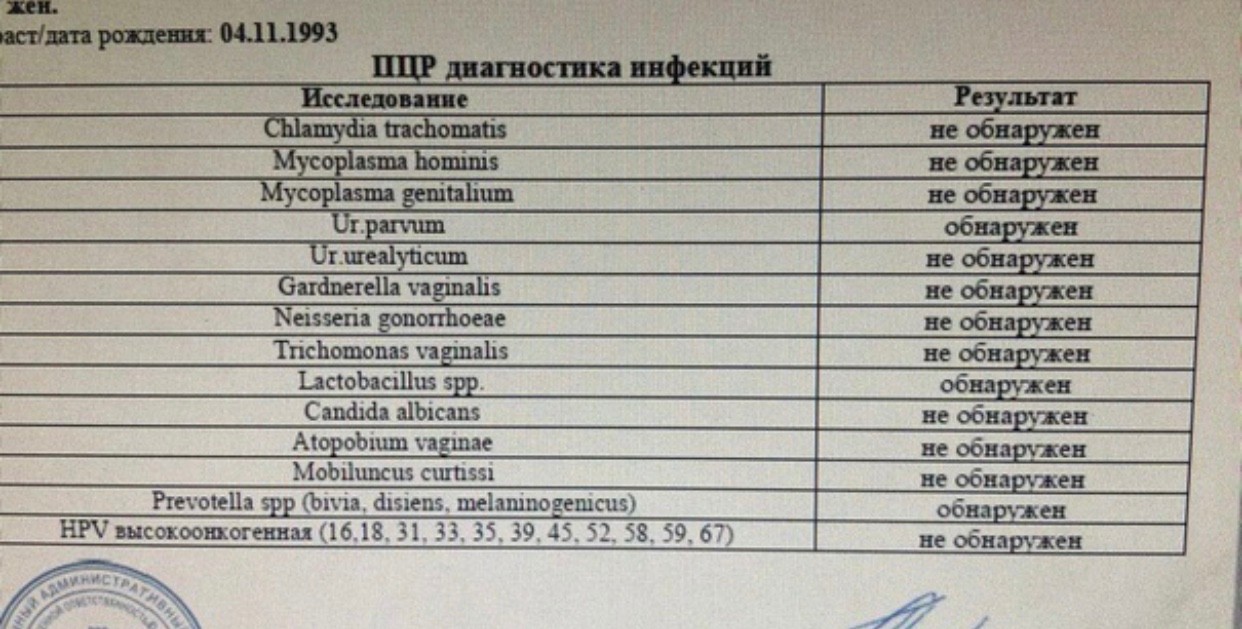 «Как врач, значение КТ — не единственное, что я буду использовать для диагностики и наблюдения за пациентами», — говорит Чану Ри, эпидемиолог больницы Brigham and Women’s Hospital. «Но я все еще нахожу это полезным».
«Как врач, значение КТ — не единственное, что я буду использовать для диагностики и наблюдения за пациентами», — говорит Чану Ри, эпидемиолог больницы Brigham and Women’s Hospital. «Но я все еще нахожу это полезным».
Продолжительность и ключевые детерминанты выделения инфекционного вируса у госпитализированных пациентов с коронавирусной болезнью-2019 (COVID-19)
Образцы и пациенты
В период с 8 марта 2020 г. Erasmus MC, которые были отправлены в нашу лабораторию для ПЦР SARS-CoV-2, также были отправлены для посева вируса.У этих пациентов результаты ПЦР на SARS-CoV-2 в диагностических образцах дыхательных путей и результаты измерений нейтрализующих антител против SARS-CoV-2 в образцах сыворотки были извлечены из нашей системы управления диагностической лабораторной информацией (LabTrain, версия 3, Бодегро, Нидерланды). Из электронных карт пациентов (HiX версия 6.1, ChipSoft, Нидерланды) была извлечена следующая информация: дата появления симптомов, тяжесть заболевания (госпитализирован в ОРИТ с ИВЛ, госпитализирован в ОРИТ с оксигенотерапией, госпитализирован в палату с оксигенотерапией).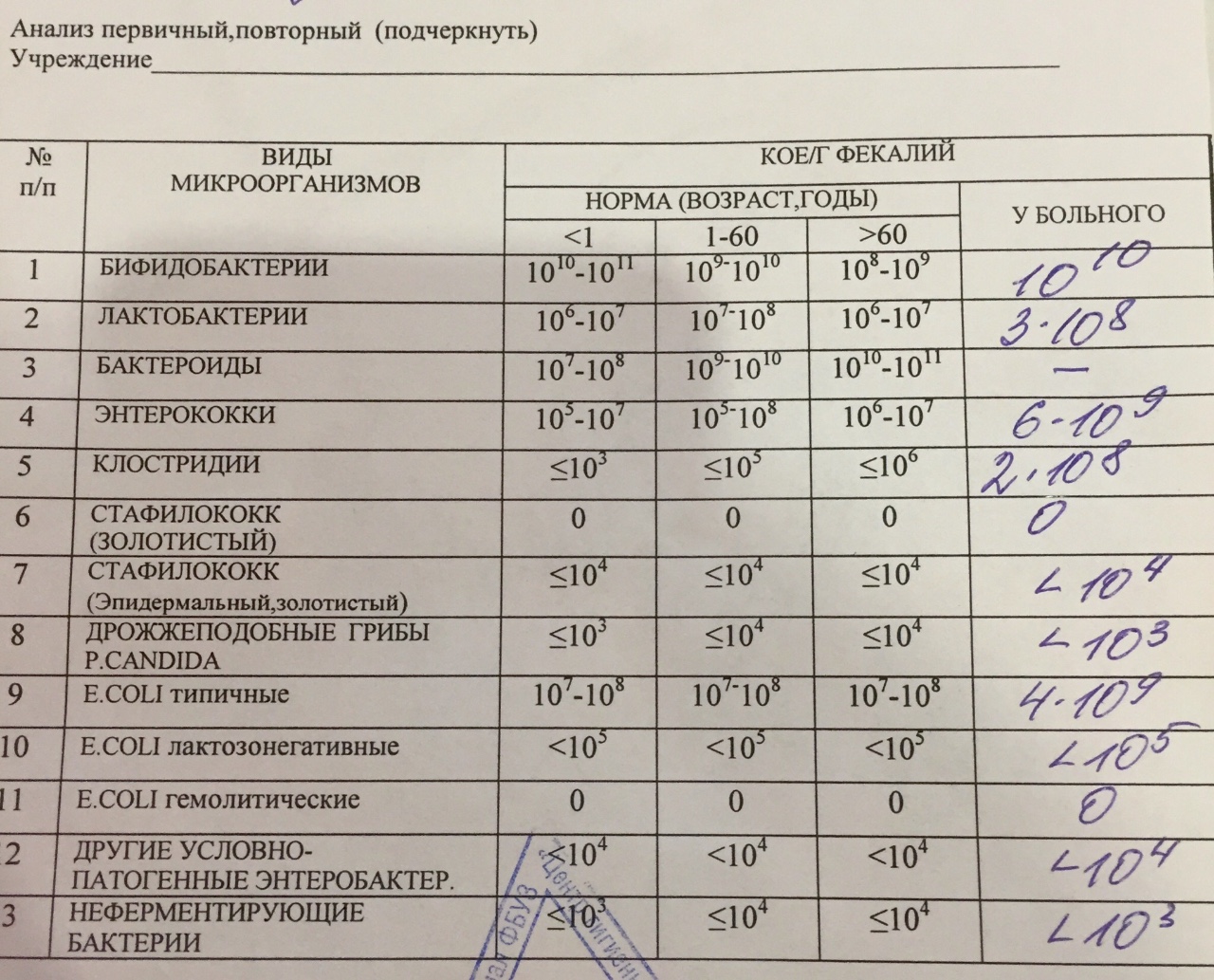 , госпитализированных в палату без оксигенотерапии), информация для классификации пациентов как иммунокомпетентных, с нетяжелым иммунодефицитом (за исключением сахарного диабета) или с тяжелым иммунодефицитом, как описано ранее 25 , оценка тяжести заболевания в соответствии с классификацией NIH (https://www.covid19treatmentguidelines.nih.gov/overview/management-of-covid-19/), а также были ли пациенты живы или нет по состоянию на 17 апреля 2020 г. В качестве программного обеспечения для сбора данных использовали Excel 2016 (Microsoft Corp, США).
, госпитализированных в палату без оксигенотерапии), информация для классификации пациентов как иммунокомпетентных, с нетяжелым иммунодефицитом (за исключением сахарного диабета) или с тяжелым иммунодефицитом, как описано ранее 25 , оценка тяжести заболевания в соответствии с классификацией NIH (https://www.covid19treatmentguidelines.nih.gov/overview/management-of-covid-19/), а также были ли пациенты живы или нет по состоянию на 17 апреля 2020 г. В качестве программного обеспечения для сбора данных использовали Excel 2016 (Microsoft Corp, США).
Обработка и анализ проб
Мазки из верхних дыхательных путей собирали в пробирки, содержащие 4 мл вирусной транспортной среды (среда Игла, модифицированная Дульбекко (DMEM, Lonza) с добавлением 40% FBS, 20 мМ 4-(2-гидроксиэтил)- 1-пиперазинэтансульфокислота (HEPES), NaCO3, 10 мкг/мл амфотерицина В, 1000 ЕД/мл пенициллина, 1000 мкг/мл стрептомицина).Супернатант пропускали через 45-мкм фильтр и использовали для ПЦР-анализа и культивирования вируса.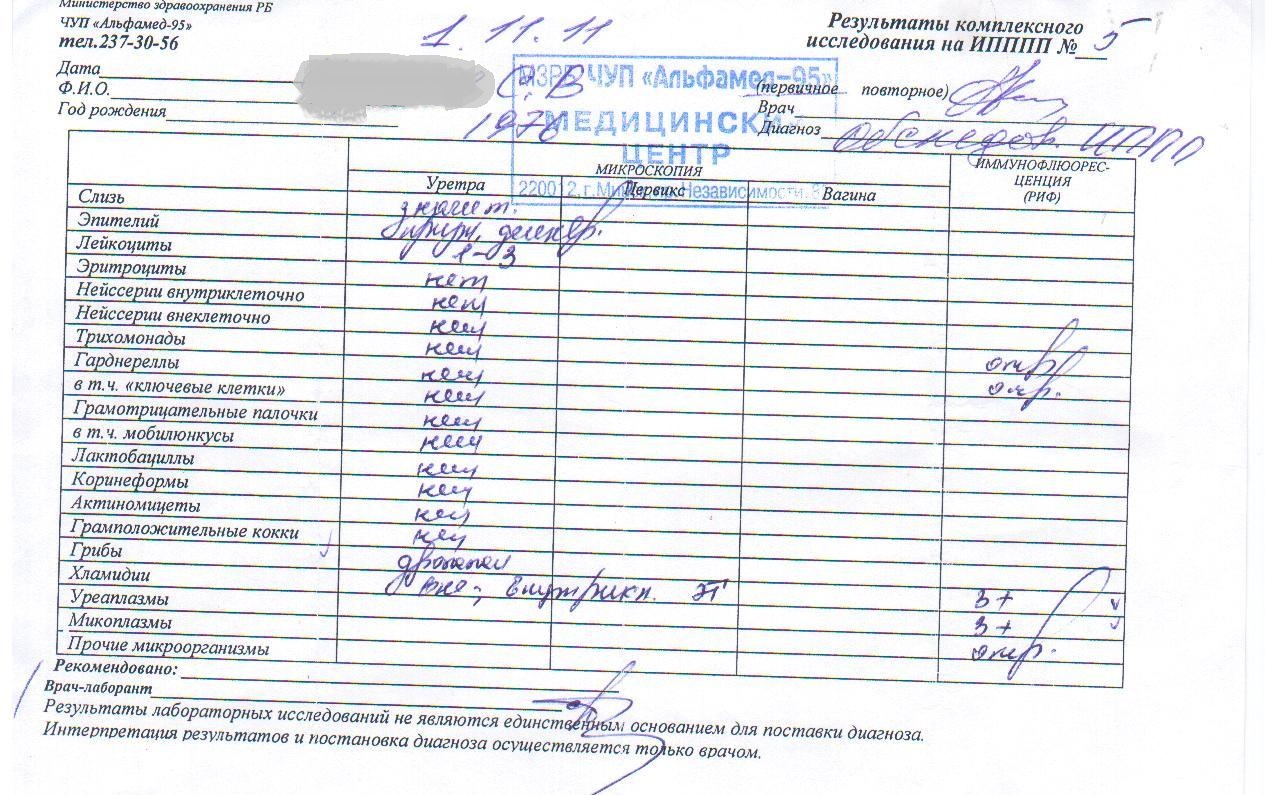 Для образцов мокроты добавляли 6 мл среды для обработки образцов (DMEM с добавлением 17 мМ HEPES, NaCO 3 , 1000 ЕД/мл пенициллина, 1000 мкг/мл стрептомицина, 12,5 мкг/мл амфотерицина В) до достижения конечного объема 6 мл. . Затем образцы встряхивали, центрифугировали, пропускали через 45-мкм фильтр и добавляли 1 часть FBS к 1,5 частям супернатанта. Впоследствии обработанные образцы использовали для ПЦР-анализа и посева вируса.
Для образцов мокроты добавляли 6 мл среды для обработки образцов (DMEM с добавлением 17 мМ HEPES, NaCO 3 , 1000 ЕД/мл пенициллина, 1000 мкг/мл стрептомицина, 12,5 мкг/мл амфотерицина В) до достижения конечного объема 6 мл. . Затем образцы встряхивали, центрифугировали, пропускали через 45-мкм фильтр и добавляли 1 часть FBS к 1,5 частям супернатанта. Впоследствии обработанные образцы использовали для ПЦР-анализа и посева вируса.
Обнаружение SARS-CoV-2 с помощью ОТ-ПЦР в реальном времени проводилось с использованием внутреннего анализа 26 или с использованием теста на SARS-CoV-2 на системе cobas ® 6800 (Roche Diagnostics). Впоследствии значения порога цикла (ct) были преобразованы в Log 10 копий РНК/мл с использованием калибровочных кривых, основанных на количественных транскриптах РНК E-гена in vitro 5 . Субгеномные РНК SARS-CoV-2 были обнаружены с помощью RT-PCR 5 .
Респираторные образцы культивировали на клетках Vero, клон 118, с использованием 24-луночных планшетов со стеклянными покровными стеклами 27 .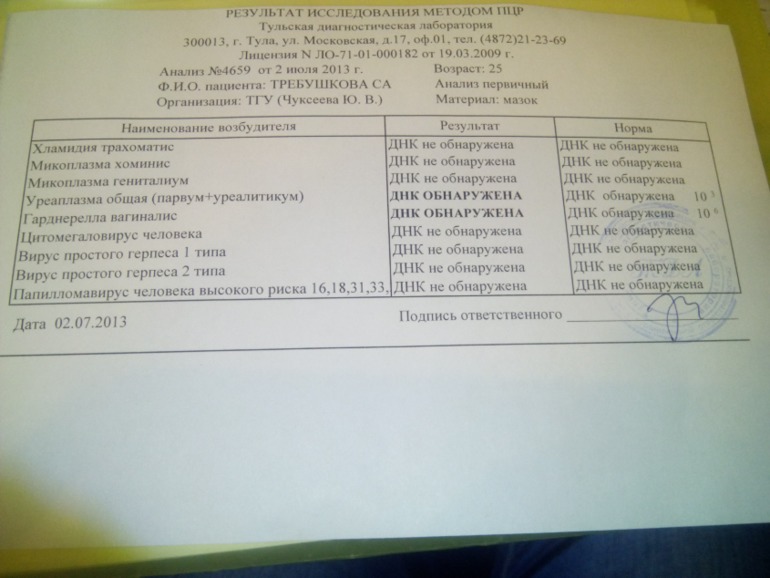 Клетки инокулировали 200 мкл образца на лунку и центрифугировали в течение 15 минут при 3500× г . После центрифугирования инокулят отбрасывали, культуральную среду вируса (среда Дульбекко, модифицированная Iscove (IMDM; Lonza) с добавлением 2 мМ L-глутамина (Lonza), 100 ЕД/мл пенициллина (Lonza), 100 мкг/мл стрептомицина (Lonza), 2,5 Добавляли мкг/мл амфотерицина В (отделение больничной фармации, Эразмус МЦ) и 1% термоинактивированной эмбриональной телячьей сыворотки (Sigma) и образцы культивировали при 37 °С и 5% СО 2 в течение 7 дней.Каждый образец культивировали в трех повторах: две повторности фиксировали ледяным ацетоном через 24 и 48 часов, соответственно, независимо от того, был ли виден цитопатический эффект (CPE). Фиксированные образцы далее анализировали с помощью иммунофлуоресценции (см. ниже). Оставшийся повтор оценивали по CPE ежедневно в течение 7 дней. Когда CPE был виден, образец фиксировали ледяным ацетоном и далее анализировали с помощью иммунофлуоресценции (см.
Клетки инокулировали 200 мкл образца на лунку и центрифугировали в течение 15 минут при 3500× г . После центрифугирования инокулят отбрасывали, культуральную среду вируса (среда Дульбекко, модифицированная Iscove (IMDM; Lonza) с добавлением 2 мМ L-глутамина (Lonza), 100 ЕД/мл пенициллина (Lonza), 100 мкг/мл стрептомицина (Lonza), 2,5 Добавляли мкг/мл амфотерицина В (отделение больничной фармации, Эразмус МЦ) и 1% термоинактивированной эмбриональной телячьей сыворотки (Sigma) и образцы культивировали при 37 °С и 5% СО 2 в течение 7 дней.Каждый образец культивировали в трех повторах: две повторности фиксировали ледяным ацетоном через 24 и 48 часов, соответственно, независимо от того, был ли виден цитопатический эффект (CPE). Фиксированные образцы далее анализировали с помощью иммунофлуоресценции (см. ниже). Оставшийся повтор оценивали по CPE ежедневно в течение 7 дней. Когда CPE был виден, образец фиксировали ледяным ацетоном и далее анализировали с помощью иммунофлуоресценции (см. ниже). Культуры вируса расценивали как отрицательные, если в течение 7 дней не было видно ЦПЭ.Для считывания иммунофлуоресценции фиксированные клетки промывали фосфатно-солевым буфером (PBS) и инкубировали в течение 30 мин при 37°C с 25 мкл 1000-кратно разведенных поликлональных кроличьих антител против нуклеопротеина SARS-CoV (Sino Biological, каталожный номер 40143-Т62). После инкубации образцы трижды промывали PBS и один раз деионизированной водой. Затем клетки инкубировали в течение 30 мин при 37°C с 25 мкл 2000-кратно разбавленного Alexa Fluor 488 поликлонального козьего антикроличьего IgG (Invitrogen, каталожный номер A-11070).Затем клетки трижды промывали PBS. Наконец, клетки инкубировали в течение 1 мин с 25 мкл синего Эвана (контрастное окрашивание), дважды промывали деионизированной водой, сушили на воздухе и анализировали с помощью флуоресцентного микроскопа.
ниже). Культуры вируса расценивали как отрицательные, если в течение 7 дней не было видно ЦПЭ.Для считывания иммунофлуоресценции фиксированные клетки промывали фосфатно-солевым буфером (PBS) и инкубировали в течение 30 мин при 37°C с 25 мкл 1000-кратно разведенных поликлональных кроличьих антител против нуклеопротеина SARS-CoV (Sino Biological, каталожный номер 40143-Т62). После инкубации образцы трижды промывали PBS и один раз деионизированной водой. Затем клетки инкубировали в течение 30 мин при 37°C с 25 мкл 2000-кратно разбавленного Alexa Fluor 488 поликлонального козьего антикроличьего IgG (Invitrogen, каталожный номер A-11070).Затем клетки трижды промывали PBS. Наконец, клетки инкубировали в течение 1 мин с 25 мкл синего Эвана (контрастное окрашивание), дважды промывали деионизированной водой, сушили на воздухе и анализировали с помощью флуоресцентного микроскопа.
Титры сывороточных нейтрализующих антител против SARS-CoV-2 (немецкий изолят; GISAID ID EPI_ISL 406862; Европейский архив вирусов, глобальный № 026V-03883) определяли с помощью теста нейтрализации уменьшения налета 22 .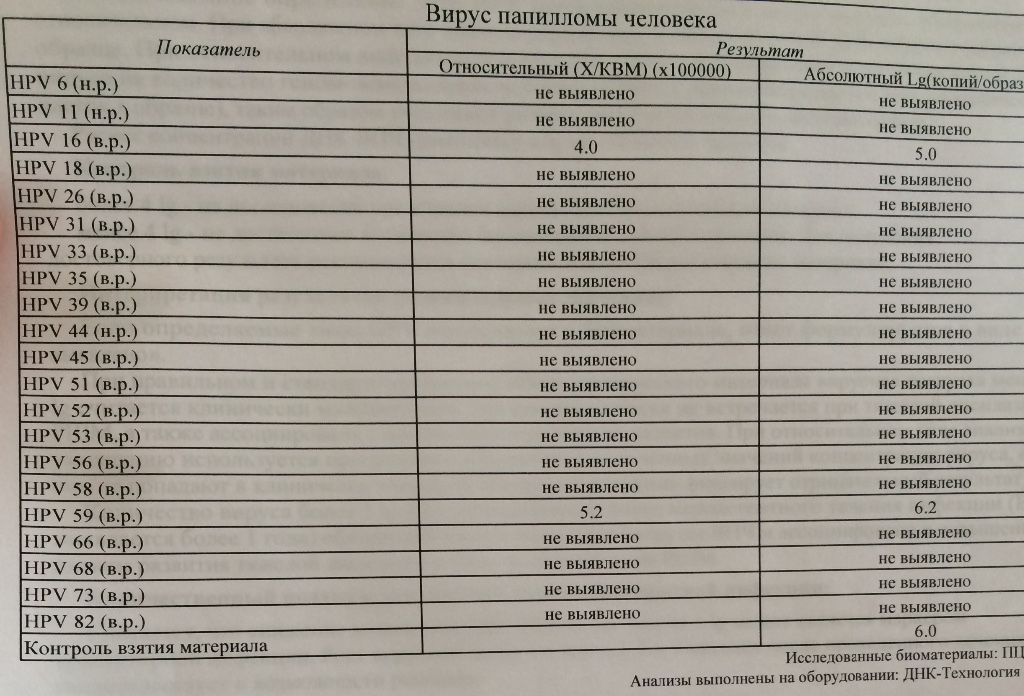 Титр нейтрализации уменьшения налета 50% (PRNT50%) 1:20 или более считался положительным, а PRNT50% ниже 1:20 отрицательным.
Титр нейтрализации уменьшения налета 50% (PRNT50%) 1:20 или более считался положительным, а PRNT50% ниже 1:20 отрицательным.
Медицинское этическое одобрение
Все образцы пациентов и данные, использованные в этом исследовании, были собраны в контексте обычного клинического ухода за пациентами. Дополнительные анализы проводились только на избыточном материале пациентов, собранном в контексте рутинного клинического ухода за больными. Институциональный наблюдательный совет Erasmus MC (Роттердам, Нидерланды) одобрил использование этих данных и образцов (METC-2015-306). METC-2015-306 — это общий протокол для изучения вирусных заболеваний. Отдел информации о конфиденциальности Erasmus MC (Роттердам, Нидерланды) отказался от информированного согласия на исследование COVID-19.Вместо этого пациенты имели право отказаться от использования их избыточного материала пациента и их медицинских данных для исследований. Система отказа Erasmus MC была проверена для всех пациентов, включенных в это исследование, и ни один из пациентов, включенных в это исследование, не отказался от использования своих избыточных материалов пациентов и их медицинских данных для исследования.
Статистический анализ
Категориальные и непрерывные переменные сравнивались с использованием критерия хи-квадрат t -критерия Стьюдента соответственно.Обобщенные оценочные уравнения использовались для определения факторов, связанных с положительным образцом вирусной культуры из дыхательных путей. Непрерывные данные в обобщенных оценочных уравнениях были дихотомизированы с использованием различных пороговых значений. В основной статье мы представляем результаты наилучшего соответствия обобщенных оценочных уравнений с использованием уровней дихотомии, которые лучше всего подходят в соответствии с квазиправдоподобием по критерию независимости (QIC) 28 . Анализ чувствительности показан в дополнительной таблице 1 и дополнительной таблице 2.Все переменные, имеющие значение p <0,1 в однофакторном анализе, были включены в многомерное общее оценочное уравнение для учета повторных измерений, полученных у одного и того же пациента во время госпитализации 29 . Для этого анализа мы использовали пакет geepack версии 1.3-1 и версию R 4.0.0 29 . Пробит-анализ проводили с помощью MedCalc версии 19.2.3 (MedCalc Software Ltd).
Для этого анализа мы использовали пакет geepack версии 1.3-1 и версию R 4.0.0 29 . Пробит-анализ проводили с помощью MedCalc версии 19.2.3 (MedCalc Software Ltd).
Роль источника финансирования
Эта работа частично финансировалась за счет гранта ЕС COVID-19 RECOVER 101003589.Спонсоры исследования не участвовали ни в дизайне исследования, ни в сборе, анализе и интерпретации данных, ни в написании отчета, ни в принятии решения о подаче статьи для публикации. Соответствующий автор имел полный доступ ко всем данным в исследовании и нес окончательную ответственность за решение о подаче на публикацию.
Сводка отчета
Дополнительную информацию о дизайне исследования можно найти в Сводке отчета об исследовании природы, связанной с этой статьей.
Тестирование на COVID-19: полимеразная цепная реакция (ПЦР) и порог цикла (Ct)
На этой странице
О пороговых значениях цикла (Ct)
В большинстве тестов, выявляющих рибонуклеиновую кислоту (РНК) или генетический отпечаток вируса, вызывающего COVID-19 (например, полимеразная цепная реакция или ПЦР), используется процесс, при котором определенные фрагменты генетического отпечатка амплифицируются с использованием температурного циклирования. реакция, повторяющаяся до 45 раз. Они называются циклами усиления.Количество генетического материала удваивается после каждого цикла. Количество циклов амплификации, необходимое для создания достаточного количества копий вирусной РНК для обнаружения, называется порогом цикла или значением Ct.
реакция, повторяющаяся до 45 раз. Они называются циклами усиления.Количество генетического материала удваивается после каждого цикла. Количество циклов амплификации, необходимое для создания достаточного количества копий вирусной РНК для обнаружения, называется порогом цикла или значением Ct.
Чем больше РНК присутствует в образце пациента, тем меньше циклов требуется, чтобы сигнал достиг порога обнаружения (низкое значение Ct). Чем меньше РНК присутствует в клиническом образце, тем больше циклов требуется. Таким образом, низкое значение Ct соответствует высокой вирусной нагрузке, а высокое значение Ct соответствует низкой вирусной нагрузке.
Пример кривой амплификации в реальном времени в логарифмическом масштабе см. на рис. 1 в публикации «Общественное здравоохранение Онтарио: обзор пороговых значений цикла и их роль в интерпретации теста ПЦР в реальном времени на SARS-CoV-2».
Кривые также можно просматривать в линейном масштабе, который будет выглядеть иначе, но не изменит интерпретацию Ct. Не все коммерческие ПЦР в реальном времени предоставляют значения Ct или кривые амплификации для просмотра пользователем. Кроме того, некоторые молекулярные анализы основаны на других технологиях (например,g., проточная цитометрия) и, следовательно, не дают значений Ct.
Не все коммерческие ПЦР в реальном времени предоставляют значения Ct или кривые амплификации для просмотра пользователем. Кроме того, некоторые молекулярные анализы основаны на других технологиях (например,g., проточная цитометрия) и, следовательно, не дают значений Ct.
Как используются значения Ct
Значение Ct является пороговым значением, при котором тест считается положительным. Это определяется производителем теста или лабораторией в процессе валидации. Это гарантирует, что тест ПЦР правильно определяет присутствие вируса, а не ложные сигналы.
В определенных обстоятельствах, например у пациентов с ослабленной иммунной системой, может потребоваться повторное тестирование образцов после выздоровления от COVID-19.Значения Ct можно использовать для отслеживания изменений количества вируса, присутствующего в образцах человека, с течением времени. Это может быть сложным и, как правило, требует консультаций между поставщиками медицинских услуг и лабораторными специалистами.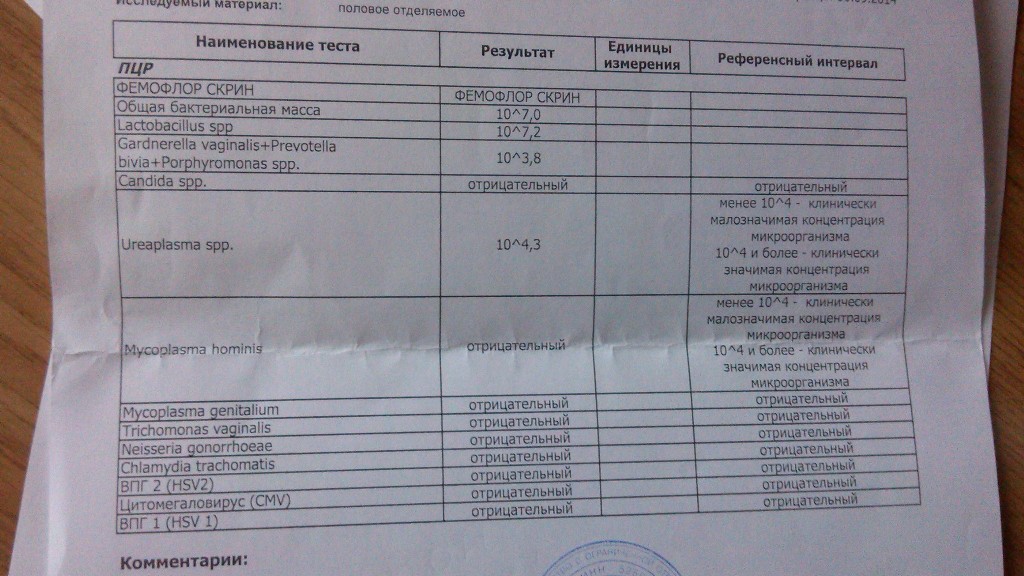
Значения Ct и контагиозность
Часто возникает вопрос, могут ли значения Ct помочь определить, заразен человек или нет. Невозможно напрямую преобразовать значение Ct в степень или продолжительность заразности.
Человек считается заразным, если он выделяет неповрежденные вирусные частицы, способные заразить других.ПЦР-тесты не могут различить вирусный геномный материал, происходящий от интактных вирусных частиц у заразных людей, или фрагменты вирусных частиц, которые присутствуют у выздоровевших людей.
Имеются убедительные доказательства того, что, когда для обнаружения вируса требуется более 35 циклов, концентрация вируса настолько низка, что маловероятно его выращивание в лаборатории. Однако клетки, используемые в лаборатории для выращивания вируса, отличаются от клеток задней стенки глотки и носа (носоглотки) или легких у людей.То, что вирус нельзя вырастить в лаборатории, не означает, что он не будет передаваться.
Многие считают, что при низком числе копий вирусной РНК (высокое значение Ct) передача вируса маловероятна.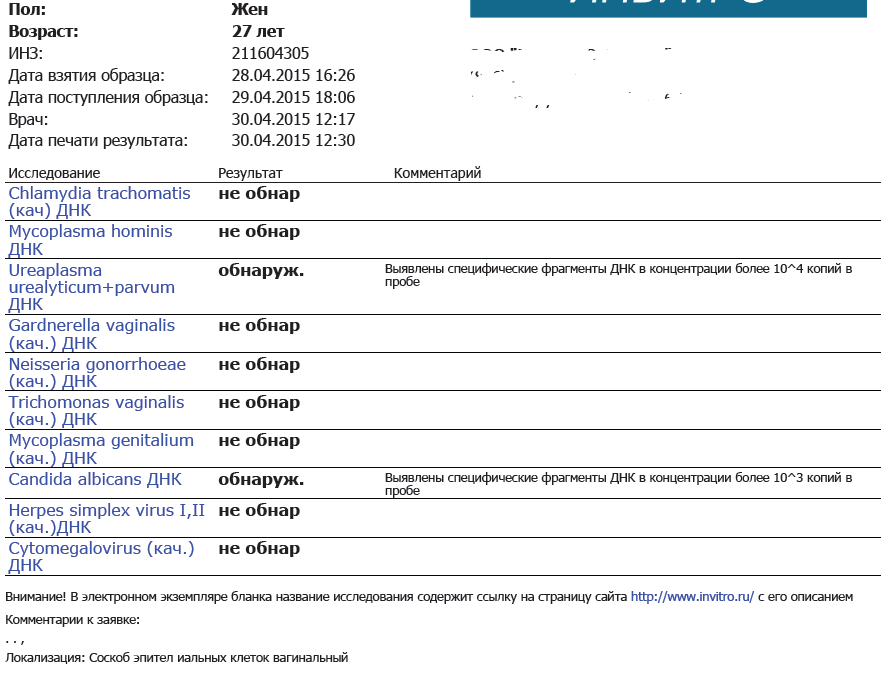 Недавнее исследование, в котором наблюдали за пациентами с симптомами, но не нуждавшимися в госпитализации, показало, что люди с более высокой вирусной нагрузкой (более низким Cts) заражали большую часть своих непосредственных контактов. Но мы не знаем, сколько вируса на самом деле требуется, чтобы вызвать инфекцию у кого-то, и есть другие важные факторы, которые могут влиять на заразность, включая здоровье подвергшегося воздействию человека и тип произошедшего воздействия.
Недавнее исследование, в котором наблюдали за пациентами с симптомами, но не нуждавшимися в госпитализации, показало, что люди с более высокой вирусной нагрузкой (более низким Cts) заражали большую часть своих непосредственных контактов. Но мы не знаем, сколько вируса на самом деле требуется, чтобы вызвать инфекцию у кого-то, и есть другие важные факторы, которые могут влиять на заразность, включая здоровье подвергшегося воздействию человека и тип произошедшего воздействия.
Факторы, которые следует учитывать при интерпретации значений Ct
Значения Ct будут зависеть от стадии инфекции
Между воздействием вируса и появлением симптомов (например, инкубационный или предсимптомный период) количество вируса в образце человека может быть изначально слишком низким, чтобы его можно было обнаружить (отрицательный результат). Человек с изначально отрицательным результатом может пройти тест с высоким значением Ct, т.е.> 30 (низкая вирусная нагрузка), а затем резко снизить значение Ct (повышенная вирусная нагрузка) в течение нескольких дней.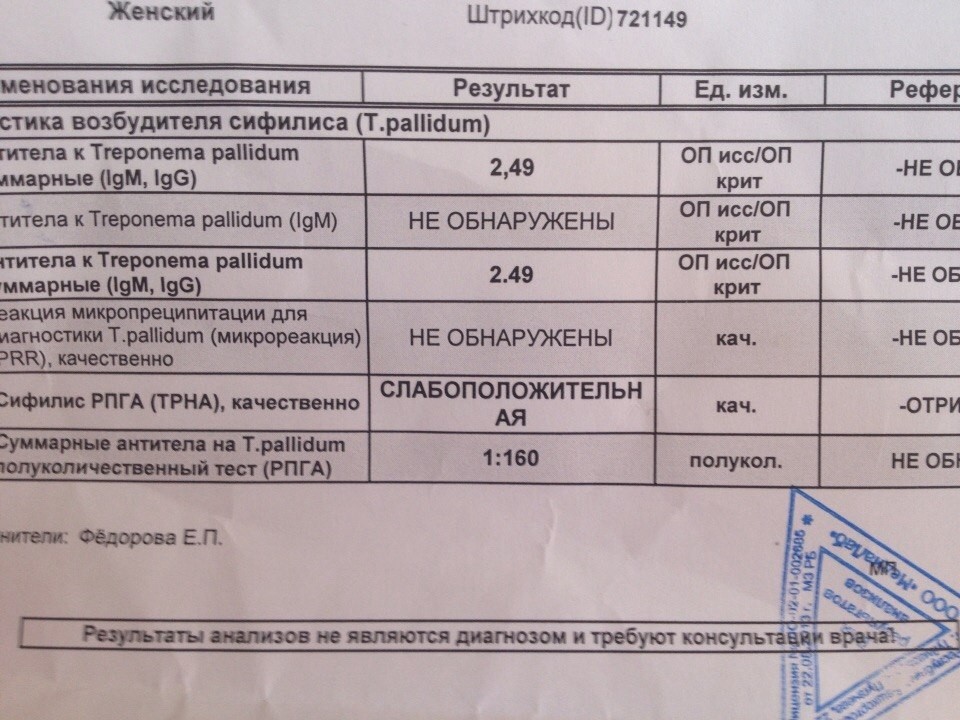 Лаборатории по всей стране наблюдали много случаев, когда человека тестировали на ранней стадии инфекции, и первоначальный образец имел очень высокое значение Ct ~ 35 (низкая концентрация вирусной РНК), а на следующий день Ct составлял примерно 14 (высокая концентрация вирусной РНК). концентрация).
Лаборатории по всей стране наблюдали много случаев, когда человека тестировали на ранней стадии инфекции, и первоначальный образец имел очень высокое значение Ct ~ 35 (низкая концентрация вирусной РНК), а на следующий день Ct составлял примерно 14 (высокая концентрация вирусной РНК). концентрация).
На значения Ct влияет тип образца, взятого у человека
Мазки из носоглотки (те, которые проникают глубоко в нос для взятия мазка с задней стенки верхней части глотки) являются наиболее чувствительным типом образцов для людей, которым не требуется госпитализация.Мазки из горла/носа и жидкости для полоскания/слюна могут содержать не так много вируса (поэтому они дадут положительный результат теста с более высоким значением Ct). У людей, у которых COVID-19 заразил легкие, эти образцы из носа/горла могут быть отрицательными, и для обнаружения вируса необходим более глубокий образец, такой как мокрота. Кроме того, тип тампонов, используемых для сбора образцов, также может влиять на значение Ct.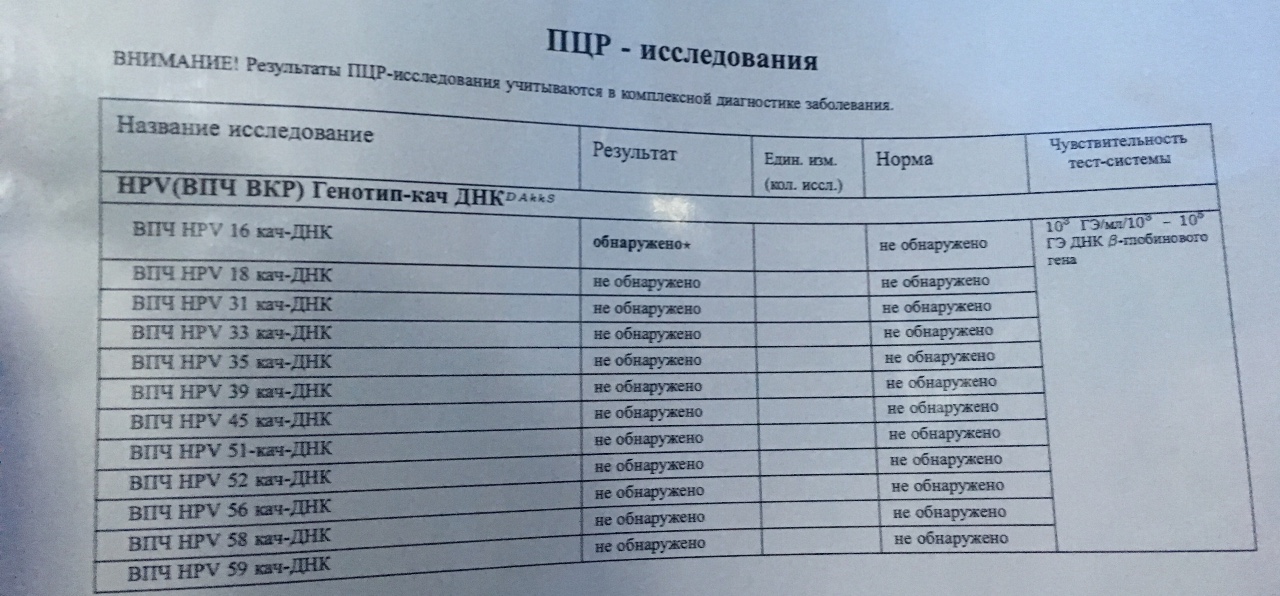
На значения Ct влияет качество образца, взятого у человека
Качество собранного образца очень важно.Если вы не получите самый лучший образец, в нем будет меньше вируса, и это может привести к тому, что образец будет иметь искусственно завышенное значение Ct у человека, в организме которого может быть много вируса.
Значения Ct нельзя сравнивать между разными тестами ПЦР
Пока не существует стандарта для сравнения одного теста с другим, поэтому диапазон Ct может сильно различаться в зависимости от типа используемого теста, в котором могут использоваться разные методы обнаружения сигнала. На самом деле, даже при тестировании идентичных образцов с помощью разных тестов ПЦР результаты могут отличаться до 8 значений Ct (т.г., с 22 по 30). Это наблюдалось в лабораториях из разных юрисдикций (например, Онтарио, Британская Колумбия и Саскачеван).
Генетический отпечаток вируса можно обнаружить спустя долгое время после того, как вирус перестанет быть заразным
ПЦР может быть положительной в течение более 100 дней или более после заражения, обычно при тестах с высокими значениями Ct, но в большинстве случаев маловероятно, что вирус передается другим людям более чем через 10 дней после появления симптомов. Этот вывод был рассмотрен в рамках Профилактики и контроля инфекций (IPAC) и практики общественного здравоохранения, которые рекомендуют изолировать пациентов на основании появления симптомов, тяжести заболевания и наличия каких-либо основных иммунодефицитных состояний, а не только на основании результатов ПЦР как в некоторых медицинских учреждениях, так и в других медицинских учреждениях. тем более в условиях сообщества.
Этот вывод был рассмотрен в рамках Профилактики и контроля инфекций (IPAC) и практики общественного здравоохранения, которые рекомендуют изолировать пациентов на основании появления симптомов, тяжести заболевания и наличия каких-либо основных иммунодефицитных состояний, а не только на основании результатов ПЦР как в некоторых медицинских учреждениях, так и в других медицинских учреждениях. тем более в условиях сообщества.
Влияние новых вариантов на значения Ct неясно
Наши текущие тесты могут обнаруживать новые вызывающие озабоченность варианты COVID-19 (ЛОС) — B.1.1.7 (впервые обнаружены в Соединенном Королевстве), B.1.351 (впервые обнаружены в Южной Африке) и P.1 (впервые обнаружены в Бразилия). Документально подтверждено, что варианты B.1.1.7 и B.1.351 более заразны, а пациенты с инфекциями B.1.1.7 имеют более низкие значения Ct (более высокая вирусная нагрузка) по сравнению с инфицированными исходно циркулирующим (невариантным) вирусом. Вирус SARS-CoV-2.B.1.351 и P. 1 находятся в стадии дальнейшего изучения. Мы внимательно следим за образцами, содержащими ЛОС, в Канаде, чтобы лучше понять влияние этих вариантов на наши лабораторные тесты.
1 находятся в стадии дальнейшего изучения. Мы внимательно следим за образцами, содержащими ЛОС, в Канаде, чтобы лучше понять влияние этих вариантов на наши лабораторные тесты.
Ключевые моменты и рекомендации
- Значения Ct иногда могут использоваться практикующими врачами в сочетании с клинической и эпидемиологической информацией для принятия обоснованных решений. Значения Ct не следует использовать отдельно для принятия конкретных клинических решений или решений в области общественного здравоохранения.
- Не все анализы амплификации нуклеиновых кислот дают значения Ct или эквивалентные прокси-меры вирусной «нагрузки РНК».
- Высокие значения Ct еще не доказали, что они могут объявить кого-то незаразным, только то, что они с меньшей вероятностью могут быть заразными.
- В связи с этим не рекомендуется, чтобы значения Ct регулярно сообщались клинически с результатами ОТ-ПЦР на SARS-CoV-2.
- Если лаборатория решит регулярно сообщать о значениях Ct, рекомендуется включить в отчет четкие формулировки относительно неопределенности интерпретации.
 Следует также указать, с какими органами может потребоваться консультация для принятия решения.
Следует также указать, с какими органами может потребоваться консультация для принятия решения.
Каталожные номера
- Обзор пороговых значений цикла и их роли в интерпретации теста ПЦР в реальном времени на SARS-CoV-2. https://www.publichealthontario.ca/-/media/documents/ncov/main/2020/09/cycle- threshold-values-sars-cov2-pcr.pdf?la=en
- Бэзил К., Макфи К., Картер И. и др. Клеточная культура SARS-CoV-2 используется для оценки инфекционности и безопасной деизоляции во время COVID-19. Clinical Infectious Diseases , октябрь 2020 г. DOI: https://doi.org/10.1093/cid/ciaa1579 Значения
- Ct: что это такое и как их можно использовать. Ассоциация лабораторий общественного здравоохранения. 2020, 9 ноября. Получено с: https://www.aphl.org/programs/preparedness/Crisis-Management/Documents/APHL-COVID19-Ct-Values.pdf#search=What%20They%20Are%20and%20How %20Они%20Может%20быть%20Б/у
- Часто задаваемые вопросы о коронавирусе (COVID-19) для лабораторий, CDC .
 Получено с: https://www.cdc.gov/coronavirus/2019-ncov/lab/faqs.html#Interpreting-Results-of-Diagnostic-Tests
Получено с: https://www.cdc.gov/coronavirus/2019-ncov/lab/faqs.html#Interpreting-Results-of-Diagnostic-Tests - Маркс А., Миллат-Мартинес П., Оучи Д. и др. Передача COVID-19 в 282 кластерах в Каталонии, Испания: когортное исследование — The Lancet Infectious Diseases 2021. Опубликовано в Интернете 2 февраля 2021 г. https://doi.org/10.1016/S1473-3099(20)30985-3
- Rhoads D, Peaper DR, She RC, Nolte F, Wojewoda C, Anderson N, Pritt BS, Колледж американских патологоанатомов (CAP) Взгляд комитета по микробиологии: необходимо соблюдать осторожность при интерпретации порогового значения цикла (Ct), Clinical Infectious Болезни , 2020, ciaa1199, https://doi.org/10.1093/cid/ciaa1199
- Синганаягам А., Патель М., Шарлетт А., Лопес Берналь Дж., Салиба В., Эллис Дж., Ладхани С., Замбон М., Гопал Р. Продолжительность заразности и корреляция с пороговыми значениями цикла ОТ-ПЦР в случаях COVID-19, Англия, Январь-май 2020 года. евро Surveill.
 2020 авг.; 25(32):2001483. DOI: https://doi.org/10.2807/1560-7917.ES.2020.25.32.2001483
2020 авг.; 25(32):2001483. DOI: https://doi.org/10.2807/1560-7917.ES.2020.25.32.2001483
Что это такое, как это делается, что означают результаты
Обзор
Что такое ПЦР-тест?
ПЦР означает полимеразную цепную реакцию.Это тест для обнаружения генетического материала определенного организма, например вируса. Тест определяет наличие вируса, если он был у вас на момент проведения теста. Тест также может обнаруживать фрагменты вируса даже после того, как вы больше не заражены.
Что такое ПЦР-тест на COVID-19?
Тест полимеразной цепной реакции (ПЦР) на COVID-19 — это молекулярный тест, который анализирует ваш образец из верхних дыхательных путей в поисках генетического материала (рибонуклеиновой кислоты или РНК) SARS-CoV-2, вируса, вызывающего COVID-19.Ученые используют технологию ПЦР для амплификации небольших количеств РНК из образцов в дезоксирибонуклеиновую кислоту (ДНК), которая реплицируется до тех пор, пока не будет обнаружен SARS-CoV-2, если он присутствует. ПЦР-тест стал золотым стандартом диагностики COVID-19 с тех пор, как он был разрешен к использованию в феврале 2020 года. Он точен и надежен.
ПЦР-тест стал золотым стандартом диагностики COVID-19 с тех пор, как он был разрешен к использованию в феврале 2020 года. Он точен и надежен.
Кто должен пройти тестирование на COVID-19?
Ваш поставщик медицинских услуг может порекомендовать пройти тестирование на COVID-19, если у вас есть какие-либо из следующих симптомов:
- Лихорадка или озноб.
- Кашель.
- Одышка или затрудненное дыхание.
- Усталость.
- Боли в мышцах или теле.
- Головная боль.
- Новая потеря вкуса или обоняния.
- Боль в горле.
- Заложенность носа или насморк.
- Тошнота или рвота.
- Диарея.
Не у всех с COVID-19 проявляются симптомы. И не у всех симптоматических людей развиваются все симптомы, перечисленные выше. Пожалуйста, проконсультируйтесь со своим лечащим врачом, если вы плохо себя чувствуете во время пандемии COVID-19, даже если вы были вакцинированы.
Детали теста
Существует три ключевых этапа ПЦР-теста на COVID-19:
- Сбор образцов: Медицинский работник использует тампон для сбора респираторного материала, обнаруженного в вашем носу.
 Тампон — это мягкий наконечник на длинной гибкой палочке, который вводят в нос. Существуют различные типы мазков из носа, в том числе мазки из носа, которые собирают образец непосредственно в ваших ноздрях, и мазки из носоглотки, которые проходят дальше в полость носа для сбора.Для сбора материала для ПЦР-теста на COVID-19 достаточно мазка любого типа. После сбора мазок запечатывают в пробирку и затем отправляют в лабораторию.
Тампон — это мягкий наконечник на длинной гибкой палочке, который вводят в нос. Существуют различные типы мазков из носа, в том числе мазки из носа, которые собирают образец непосредственно в ваших ноздрях, и мазки из носоглотки, которые проходят дальше в полость носа для сбора.Для сбора материала для ПЦР-теста на COVID-19 достаточно мазка любого типа. После сбора мазок запечатывают в пробирку и затем отправляют в лабораторию. - Извлечение: Когда научный сотрудник лаборатории получает образец, он изолирует (извлекает) генетический материал из остального материала в образце.
- ПЦР: Затем на этапе ПЦР используются специальные химические вещества и ферменты, а также прибор для ПЦР, называемый термоциклером. Каждый цикл нагревания и охлаждения увеличивает (усиливает) количество целевого генетического материала в пробирке.После многих циклов в пробирке остаются миллионы копий небольшой части генетического материала вируса SARS-CoV-2.
 Одно из химических веществ в пробирке излучает флуоресцентный свет, если в образце присутствует SARS-CoV-2. После достаточной амплификации машина ПЦР может обнаружить этот сигнал. Ученые используют специальное программное обеспечение, чтобы интерпретировать сигнал как положительный результат теста.
Одно из химических веществ в пробирке излучает флуоресцентный свет, если в образце присутствует SARS-CoV-2. После достаточной амплификации машина ПЦР может обнаружить этот сигнал. Ученые используют специальное программное обеспечение, чтобы интерпретировать сигнал как положительный результат теста.
Результаты и последующие действия
Что означают результаты ПЦР-теста на COVID-19?
Положительный результат теста Результат означает, что вы, вероятно, инфицированы SARS-CoV-2.Это может быть связано с бессимптомной инфекцией, но если у вас есть симптомы, то эта инфекция называется COVID-19. У большинства людей болезнь протекает в легкой форме, и они могут безопасно выздороветь дома без медицинской помощи. Обратитесь к своему поставщику медицинских услуг, если ваши симптомы ухудшаются или если у вас есть вопросы или опасения.
Отрицательный результат Результат означает, что вы, вероятно, не были инфицированы SARS-CoV-2 на момент взятия образца.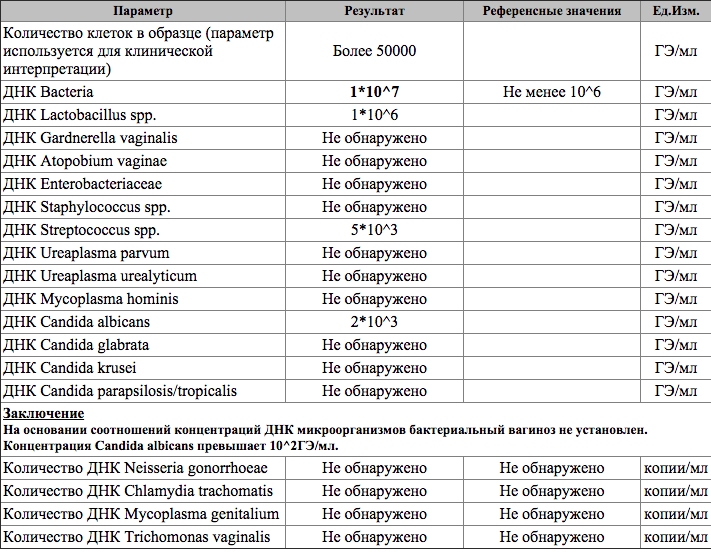 Однако возможно иметь COVID-19, но вирус не может быть обнаружен тестом.Например, это может произойти, если вы недавно заразились, но у вас еще нет симптомов, или это может произойти, если вы болели COVID-19 более недели до прохождения тестирования. Отрицательный тест не означает, что вы в безопасности в течение какого-либо периода времени: вы можете подвергнуться воздействию COVID-19 после теста, заразиться и передать вирус SARS-Cov-2 другим.
Однако возможно иметь COVID-19, но вирус не может быть обнаружен тестом.Например, это может произойти, если вы недавно заразились, но у вас еще нет симптомов, или это может произойти, если вы болели COVID-19 более недели до прохождения тестирования. Отрицательный тест не означает, что вы в безопасности в течение какого-либо периода времени: вы можете подвергнуться воздействию COVID-19 после теста, заразиться и передать вирус SARS-Cov-2 другим.
Если ваш тест положительный, поговорите со своим лечащим врачом, оставайтесь дома и изолируйте себя от других. Если ваш тест отрицательный, продолжайте принимать меры, чтобы защитить себя и других от заражения COVID-19.Узнайте больше о том, что делать, если у вас положительный результат теста, и о способах предотвращения заражения COVID-19.
Сколько времени нужно, чтобы получить результаты теста на коронавирус?
Вы должны получить результаты анализа уже через 24 часа после взятия пробы, но иногда это может занять несколько дней, в зависимости от того, сколько времени требуется пробе для доставки в лабораторию.
Через какое время после перенесенного COVID-19 у вас положительный результат теста?
Поскольку тест ПЦР настолько чувствителен, он может обнаружить очень небольшое количество вирусного материала.Это означает, что тест может продолжать обнаруживать фрагменты вируса SARS-CoV-2 даже после того, как вы выздоровели от COVID-19 и больше не заразны. Таким образом, вы можете продолжать давать положительный результат, если у вас был COVID-19 в далеком прошлом, даже если вы не можете распространять вирус SARS-CoV-2 среди других.
Длительная инфекция у лиц с ослабленным иммунитетом может возникать, когда они выделяют инфекционный вирус в течение нескольких месяцев. Также здоровые люди могут заразиться повторно. Если у вас положительный результат на SARS-CoV-2, но вы считаете, что, возможно, уже выздоровели от COVID-19, обсудите это с поставщиком медицинских услуг.
дополнительные детали
В чем разница между ПЦР и антигенными тестами на COVID-19?
Существует два типа тестов на COVID-19: ПЦР-тест и тест на антиген.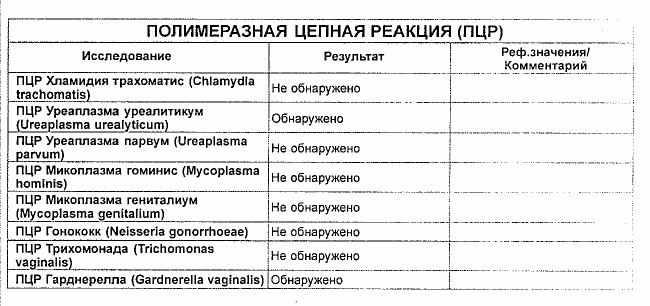
- Полимеразная цепная реакция (ПЦР) . Это проверяет наличие фактического генетического материала вируса или его фрагментов по мере его разрушения. ПЦР является наиболее надежным и точным тестом для выявления активной инфекции. ПЦР-тесты обычно занимают несколько часов, но некоторые из них выполняются быстрее.
- Тест на антиген: Выявляет фрагменты белков на поверхности вируса, называемые антигенами. Тесты на антигены обычно занимают от 15 до 30 минут. Экспресс-тесты на антигены наиболее точны, если их использовать в течение нескольких дней после появления симптомов, когда в организме присутствует наибольшее количество вируса.
Какой тест на COVID точнее?
Тест на антиген обычно быстрее, но менее чувствителен, чем тест ПЦР. Поскольку тест на антиген не так точен, как ПЦР, если тест на антиген отрицательный, ваш поставщик медицинских услуг может запросить тест ПЦР для подтверждения отрицательного результата теста на антиген.
Как узнать, где пройти тестирование на COVID-19?
Если у вас есть симптомы COVID-19 или вы контактировали с людьми, у которых есть симптомы или у которых положительный результат теста, вам может потребоваться пройти тест. Во-первых, поговорите со своим лечащим врачом. Они рассмотрят ваши симптомы лично или во время видеовстречи. При необходимости поставщик услуг заказывает тест и помогает подобрать место и время тестирования. Имейте в виду, что если вы подверглись воздействию вируса SARS-CoV-2, но у вас нет симптомов, сначала позвоните в центр тестирования, чтобы убедиться, что вас могут принять.
Вы также можете позвонить или проверить веб-сайты местных больниц в сети медицинского страхования или проверить в местных медицинских центрах или центрах неотложной помощи. Министерство здравоохранения и социальных служб США предоставляет ссылки для поиска мест тестирования в вашем штате. Вы также можете проверить веб-сайты своего штата или местного департамента здравоохранения на наличие последней информации о местах тестирования.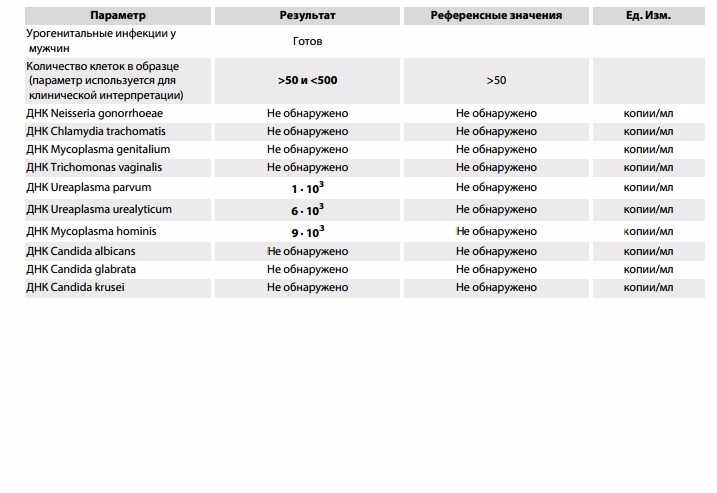 Центры по контролю за заболеваниями предоставляют ссылки на эти государственные и местные департаменты здравоохранения.
Центры по контролю за заболеваниями предоставляют ссылки на эти государственные и местные департаменты здравоохранения.
Записка из клиники Кливленда
Точные и быстрые тесты являются ключом к замедлению распространения COVID-19.Если у вас появятся симптомы, позвоните своему поставщику медицинских услуг или в местный отдел здравоохранения, чтобы определить, где пройти тестирование. Доверьтесь своему поставщику медицинских услуг, который порекомендует вам самый быстрый и точный доступный тест. Чтобы окружающие были в безопасности, вы должны носить лицевую маску, которая плотно прилегает к носу, рту и подбородку, и избегать тесного контакта с другими людьми, пока вы не получите результаты теста на COVID. Обязательно следите за своими симптомами и обращайтесь за неотложной помощью, если у вас есть:
- Проблемы с дыханием.
- Постоянная боль или давление в груди.
- Новая путаница.
- Не могу проснуться или бодрствовать.

- Синие губы или лицо.
Вы заражены коронавирусом. Но как заразиться?
Поскольку пациенты с Covid-19 наводняют больницы по всей стране, врачи сталкиваются с неразрешимым вопросом. У каких пациентов в отделении неотложной помощи с большей вероятностью будет быстрое ухудшение состояния, а какие, скорее всего, справятся с вирусом и выздоровеют?
Как оказалось, может быть способ помочь различить эти две группы, хотя он еще не получил широкого распространения.Десятки исследовательских работ, опубликованных за последние несколько месяцев, показали, что люди, чьи тела кишели коронавирусом, чаще серьезно болели и с большей вероятностью умирали по сравнению с теми, кто носил гораздо меньше вируса и с большей вероятностью оставался относительно невредимым.
Результаты показывают, что знание так называемой вирусной нагрузки — количества вируса в организме — могло бы помочь врачам прогнозировать течение пациента, отличая тех, кому может потребоваться кислородная проверка только один раз в день, например, от тех, кому это необходимо.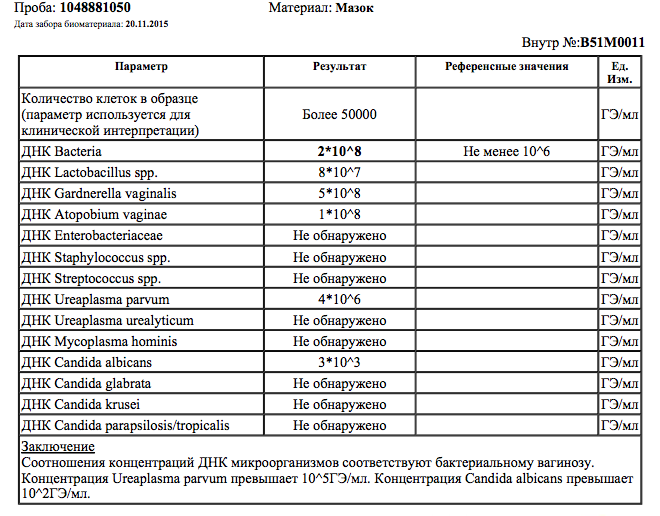 за более тщательным наблюдением, сказал доктор.Дэниел Гриффин, врач-инфекционист Колумбийского университета в Нью-Йорке.
за более тщательным наблюдением, сказал доктор.Дэниел Гриффин, врач-инфекционист Колумбийского университета в Нью-Йорке.
Отслеживание вирусной нагрузки «может действительно помочь нам стратифицировать риск», — сказал доктор Гриффин. Идея не нова: управление вирусной нагрузкой уже давно лежит в основе ухода за людьми с ВИЧ, например, и подавления передачи этого вируса.
Было предпринято мало усилий для отслеживания вирусной нагрузки у пациентов с Covid-19. Однако в этом месяце Управление по санитарному надзору за качеством пищевых продуктов и медикаментов заявило, что клинические лаборатории могут сообщать не только о том, был ли человек заражен коронавирусом, но и о том, сколько вируса было перенесено в его организме.
Это не изменение политики — лаборатории могли сообщать эту информацию с самого начала, по словам двух высокопоставленных сотрудников F.D.A. должностных лиц, которые говорили на условиях анонимности, поскольку они не были уполномочены публично говорить по этому вопросу.
Тем не менее, эта новость стала долгожданным сюрпризом для некоторых экспертов, которые в течение нескольких месяцев заставляли лаборатории записывать эту информацию.
«Это очень важный шаг со стороны FDA», — сказал доктор Майкл Мина, эпидемиолог из Гарвардского института им.Школа общественного здравоохранения Х. Чана. «Я думаю, что это шаг в правильном направлении, чтобы максимально использовать один из немногих фрагментов данных, которые у нас есть для многих позитивных людей».
Изменение FDA последовало за аналогичным шагом Департамента здравоохранения Флориды, который теперь требует, чтобы все лаборатории сообщали эту информацию.
По словам экспертов, исключение вирусной нагрузки из результатов теста было упущенной возможностью не только оптимизировать напряженные клинические ресурсы, но и лучше понять Covid-19.Например, анализ вирусной нагрузки вскоре после заражения может помочь определить, имеют ли люди, умершие от Covid-19, более высокую вирусную нагрузку в начале болезни.
Исследование, опубликованное в июне, показало, что вирусная нагрузка снижается по мере усиления иммунного ответа, «точно так же, как и для любого старого вируса», — сказал доктор Александр Гренингер, вирусолог из Вашингтонского университета в Сиэтл, руководивший исследованием.
Рост средней вирусной нагрузки во всех сообществах может указывать на рост эпидемии.«Мы можем получить представление о том, растет или уменьшается эпидемия, не полагаясь на подсчет случаев», — сказал Джеймс Хэй, научный сотрудник лаборатории доктора Мины.
К счастью, данные о вирусной нагрузке — или, по крайней мере, ее приблизительное значение — легко доступны, встроенные в результаты ПЦР. тесты, которые большинство лабораторий используют для диагностики коронавирусной инфекции.
А П.Ц.Р. тест проводится «циклами», каждый из которых удваивает количество вирусного генетического материала, изначально взятого из образца пациента.Чем выше исходная вирусная нагрузка, тем меньше циклов требуется тесту для поиска генетического материала и получения сигнала.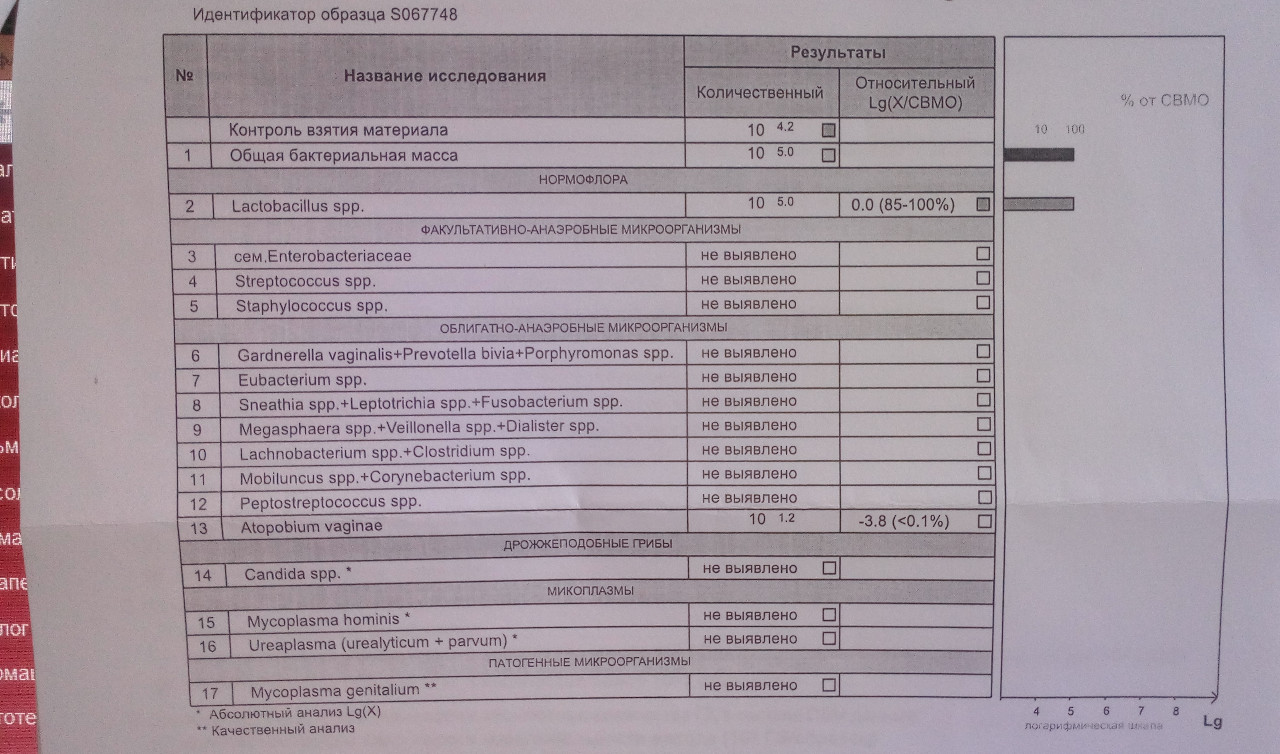
Положительный результат при низком пороге цикла или Ct предполагает высокую вирусную нагрузку у пациента. Если тест не дает положительного результата до тех пор, пока не будет завершено много циклов, у пациента, вероятно, более низкая вирусная нагрузка.
Исследователи Weill Cornell Medicine в Нью-Йорке зафиксировали вирусную нагрузку среди более чем 3000 госпитализированных пациентов с Covid-19 в день их госпитализации. Они обнаружили, что 40 процентов пациентов с высокой вирусной нагрузкой, чьи тесты были положительными при Ct 25 или ниже, умерли в больнице, по сравнению с 15 процентами пациентов с положительными тестами при более высоких Cts и предположительно более низкой вирусной нагрузке.
В другом исследовании Департамент общественного здравоохранения штата Невада обнаружил, что среднее значение Ct составляет 23,4 у людей, умерших от Covid-19, по сравнению с 27,5 у тех, кто выжил. Люди, у которых не было симптомов, имели среднее значение 29,6, что говорит о том, что у них было гораздо меньше вируса, чем у двух других групп.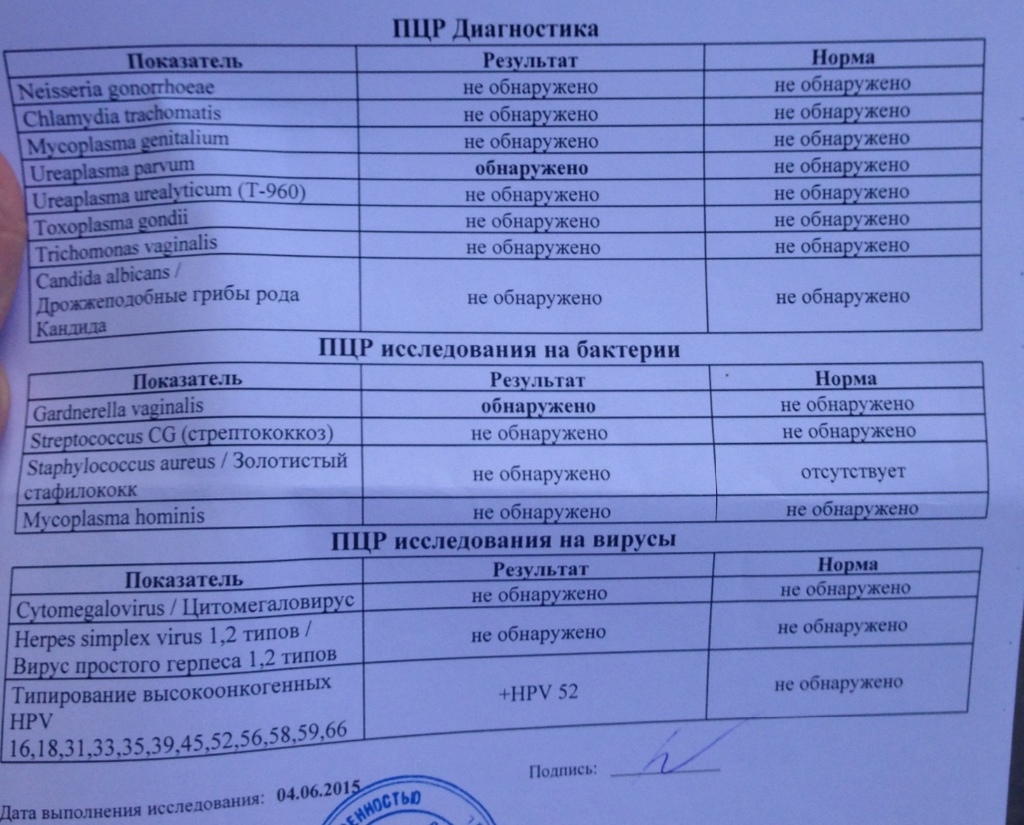
Может показаться, что эти цифры очень мало отличаются, но они соответствуют миллионам вирусных частиц. «Это не тонкие различия, — говорит доктор.— сказал Гренингер. Исследование, проведенное в его лаборатории, показало, что у пациентов с Ct менее 22 шансы умереть в течение 30 дней более чем в четыре раза выше, чем у пациентов с более низкой вирусной нагрузкой.
Однако использование значений Ct для оценки вирусной нагрузки является рискованной практикой. Измерение вирусной нагрузки для ВИЧ очень точны, потому что они основаны на образцах крови. Тесты на коронавирус основаны на взятии мазка из носа или горла — процедуре, которая подвержена ошибкам пользователя и результаты которой менее постоянны.
Количество коронавируса в организме резко меняется в ходе инфекции. Уровни повышаются от неопределяемых до положительных результатов теста всего за несколько часов, и вирусная нагрузка продолжает расти до тех пор, пока не сработает иммунный ответ.
Затем вирусная нагрузка быстро снижается. Но вирусные фрагменты могут задерживаться в организме, вызывая положительные результаты анализов еще долго после того, как пациент перестал быть заразным и болезнь прошла.
Пандемия коронавируса: основные сведения, которые необходимо знать
Учитывая эту изменчивость, определение вирусной нагрузки в определенный момент времени может оказаться бесполезным без дополнительной информации о траектории болезни, сказал доктор Б.Селин Гундер, специалист по инфекционным заболеваниям в больничном центре Бельвю и член консультативной группы новой администрации по коронавирусу.
«Когда на этой кривой вы измеряете вирусную нагрузку?» — спросил доктор Гондер.
Точное соотношение между значением Ct и соответствующей вирусной нагрузкой может варьироваться в зависимости от теста. Вместо того, чтобы подтверждать это количественное соотношение для каждой машины, F.D.A. авторизовал тесты для постановки диагнозов на основе отсечки для порога цикла.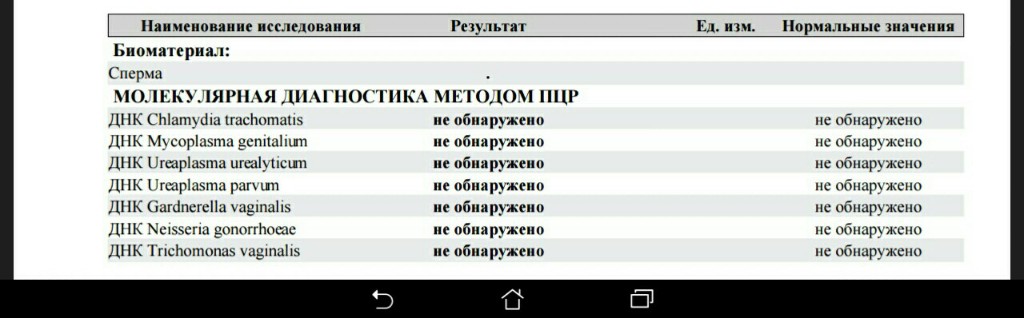
Большинство производителей консервативно устанавливают пороговые значения для своей машины для диагностики от 35 до 40, значения, которые обычно соответствуют чрезвычайно низкой вирусной нагрузке. Но точный порог положительного результата или конкретного Ct, указывающего на заразность, будет зависеть от используемого инструмента.
«Вот почему меня очень беспокоят многие из этих оценок на основе значений Ct», — сказала Сьюзен Батлер-Ву, директор клинической микробиологии Университета Южной Калифорнии.
«Конечно, это значение может быть полезным в определенных клинических обстоятельствах, — сказал д-р Батлер-Ву, — но мысль о том, что у вас может быть значение Ct единорога, которое идеально коррелирует с инфекционным и неинфекционным состоянием, заставляет меня очень нервный.»
Другие эксперты признали эти ограничения, но заявили, что польза от записи значений Ct перевешивает опасения.
«Все это действительные точки при рассмотрении результатов анализов отдельных пациентов, но это не меняет того факта, что в среднем, когда вы смотрите на результаты вступительных испытаний этих значений Ct, они действительно выявляют пациентов с высоким риском.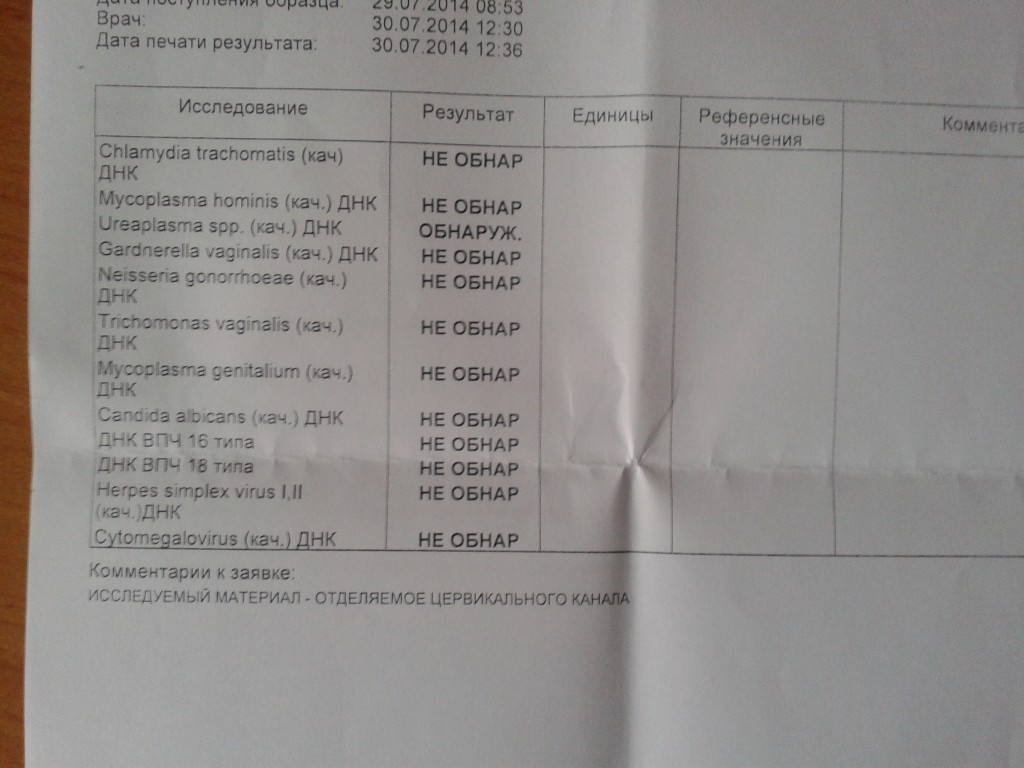 декомпенсации и смерти», — сказал доктор.Майкл Сатлин, врач-инфекционист и ведущий исследователь исследования Вейла Корнелла.
декомпенсации и смерти», — сказал доктор.Майкл Сатлин, врач-инфекционист и ведущий исследователь исследования Вейла Корнелла.
Доктор Сатлин сказал, что корректировка результатов его команды с учетом продолжительности симптомов и ряда других переменных не повлияла на высокий риск смерти у пациентов с высокой вирусной нагрузкой. «Как бы вы ни пытались приспособиться, статистически эта связь чрезвычайно сильна и никуда не исчезнет», — сказал он.
На уровне населения значения Ct также могут быть ценными во время пандемии, сказал доктор Хэй. Высокая вирусная нагрузка в большой группе пациентов может свидетельствовать о недавнем контакте с вирусом, сигнализируя о зарождающемся всплеске передачи вируса в сообществе.
«Это может быть отличным инструментом эпиднадзора для менее обеспеченных ресурсами мест, которым необходимо понимать траекторию эпидемии, но у которых нет возможности проводить регулярное выборочное тестирование», — сказал д-р Хей.
В целом, сказал он и другие, информация о вирусной нагрузке является слишком ценным показателем, чтобы ее можно было игнорировать или выбрасывать без анализа.
«Одна из проблем, с которыми пришлось столкнуться во время этой пандемии, заключается в том, что все хотят заниматься доказательной медициной и хотят двигаться с соответствующей скоростью», — сказал доктор.— сказал Гренингер. «Но мы также должны ожидать, что некоторые вещи будут правдой, например, больше вируса обычно нехорошо».
Критерии выведения пациентов с COVID-19 из изоляции
Исходная информация
27 мая 2020 г. ВОЗ опубликовала обновленное временное руководство по клиническому ведению пациентов с COVID-19, 1,2 , и представила обновленные рекомендации по критериям выписки пациентов от изоляции. Обновленные критерии отражают недавние данные о том, что пациенты, у которых симптомы исчезли, могут по-прежнему давать положительный результат на вирус COVID-19 (SARS-CoV-2) с помощью ОТ-ПЦР в течение многих недель.Несмотря на этот положительный результат теста, эти пациенты вряд ли заразны и, следовательно, вряд ли смогут передать вирус другому человеку.
В этом научном обзоре приводится обоснование изменений, внесенных в руководство по клиническому ведению пациентов с COVID-19, на основе последних научных данных. ВОЗ будет обновлять эти критерии по мере поступления дополнительной информации. Для получения дополнительной информации о клинической помощи пациентам с COVID-19 см. полное руководство ВОЗ. 1
Предыдущая рекомендация
Первоначальная рекомендация (опубликована 12 января 2020 г.)
Первый пакет технических руководств ВОЗ по клиническому ведению нового коронавируса, теперь известного как COVID-19, был опубликован в начале января 2020 г., вскоре после того, как группа случаев атипичной пневмонии была впервые зарегистрирована в Ухане, Китайская Народная Республика, 3 , и включала рекомендации о том, когда пациент с COVID-19 больше не считается заразным.
Первоначальная рекомендация подтвердить элиминацию вируса и, таким образом, разрешить выписку из изоляции, требовала, чтобы пациент был клинически выздоровел и имел два отрицательных результата ОТ-ПЦР на последовательных образцах, взятых с интервалом не менее 24 часов.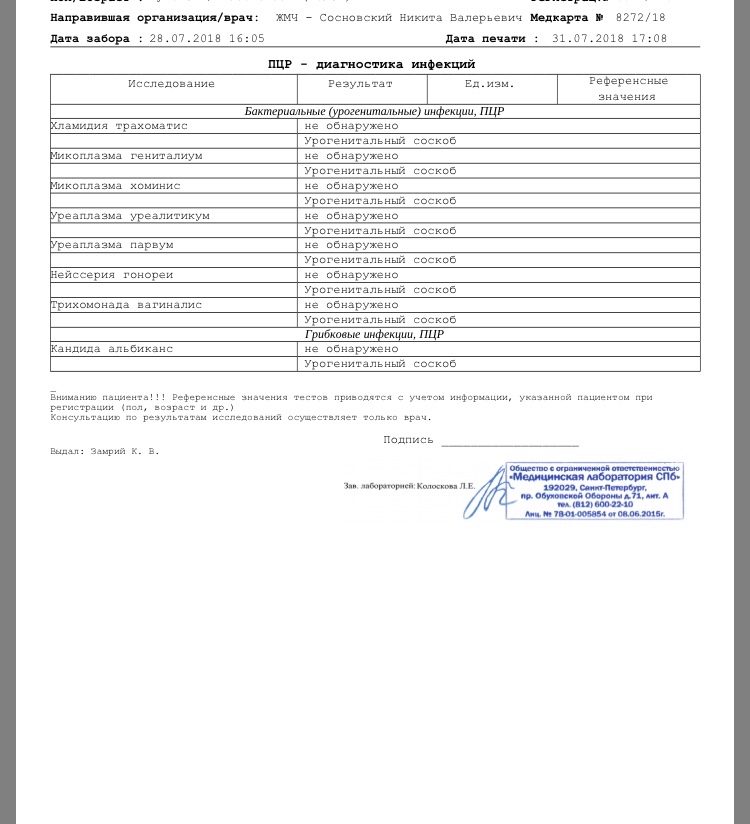 4 Эта рекомендация основана на наших знаниях и опыте работы с подобными коронавирусами, включая те, которые вызывают SARS и MERS. 5
4 Эта рекомендация основана на наших знаниях и опыте работы с подобными коронавирусами, включая те, которые вызывают SARS и MERS. 5
Обновленная рекомендация
Новая рекомендация (опубликована 27 мая 2020 г. как часть более полного руководства по клинической помощи1) критерии выписки из изоляции в рамках схемы оказания медицинской помощи пациенту с COVID-19.Эти критерии применяются ко всем случаям COVID-19, независимо от места изоляции или тяжести заболевания.
Критерии для выписки пациентов из изоляции (т. е. прекращения мер предосторожности, основанных на передаче инфекции) без необходимости повторного тестирования [1]:
- Для пациентов с симптомами: через 10 дней после появления симптомов плюс как минимум 3 дополнительных дня без симптомов (в том числе без лихорадки [1] 2] и без респираторных симптомов)[3]
- Для бессимптомных случаев[4]: через 10 дней после положительного теста на SARS-CoV-2
быть освобожденным из изоляции через 10 дней + 3 = 13 дней с момента появления симптомов; при наличии симптомов в течение 14 дней пациент может быть выписан (14 дней + 3 дня =) через 17 дней после появления симптомов; для пациента с симптомами в течение 30 дней пациент может быть выписан (30+3=) через 33 дня после появления симптомов).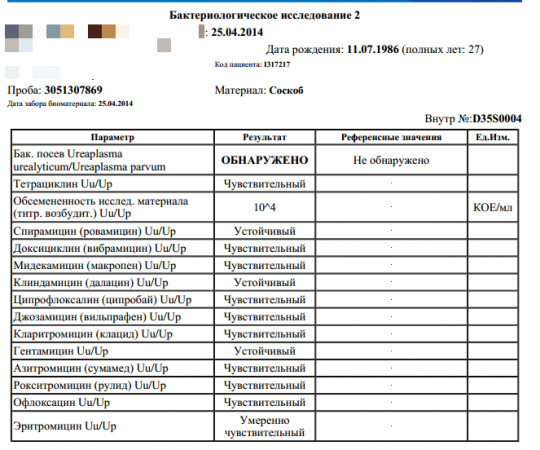
*Страны могут продолжать использовать тестирование в рамках критериев выпуска. Если это так, можно использовать первоначальную рекомендацию о двух отрицательных ПЦР-тестах с интервалом не менее 24 часов.
В чем причина изменения?
В ходе консультаций с глобальными экспертными сетями и государствами-членами ВОЗ получила информацию о том, что применение первоначальной рекомендации о двух отрицательных тестах ОТ-ПЦР с интервалом не менее 24 часов ввиду ограниченности лабораторных принадлежностей, оборудования и персонала в районах с интенсивным распространением , было чрезвычайно трудно, особенно вне больничных учреждений.
В связи с широко распространенной передачей среди населения эти первоначальные критерии для SARS-CoV-2 создали несколько проблем: здравоохранение. 13
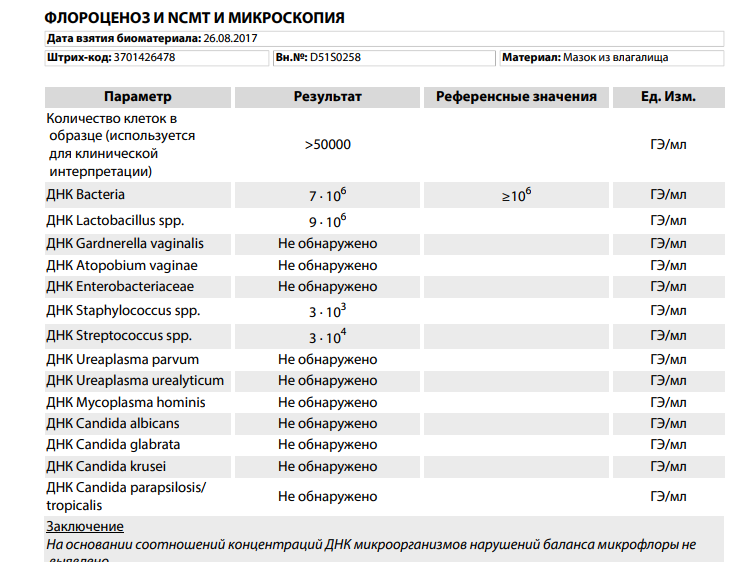 23-28
23-28 Эти проблемы и недавно полученные данные о риске передачи вируса в течение болезни COVID-19 послужили основой для обновления позиции ВОЗ в отношении сроков выписки выздоровевших пациентов из изоляции в медицинских учреждениях и за их пределами удобства. ВОЗ постоянно просматривает научную литературу о COVID-19 через свой научный отдел и свои технические группы по COVID-19. Все аспекты клинического ведения пациентов с COVID-19 и стратегии лабораторного тестирования обсуждаются в ВОЗ, а также с государствами-членами и глобальными экспертными сетями ВОЗ, состоящими из специалистов в области общественного здравоохранения, клиницистов и ученых по всему миру.Эти экспертные сети и Стратегическая и техническая консультативная группа по инфекционным опасностям (STAG-IH) 7 рассмотрели проблемы и рассмотрели имеющиеся данные в процессе принятия решения об изменении первоначальной рекомендации.
Обновленные критерии выписки из изоляции уравновешивают риски и преимущества; однако никакие критерии, которые могут быть реализованы на практике, не лишены риска. Существует минимальный остаточный риск того, что передача может произойти с этими критериями, не основанными на тестах.Могут быть ситуации, в которых минимальный остаточный риск неприемлем, например, у лиц с высоким риском передачи вируса уязвимым группам или у лиц, находящихся в ситуациях или средах с высоким риском. В этих ситуациях и у пациентов с длительными симптомами лабораторный подход все еще может быть полезен.
Существует минимальный остаточный риск того, что передача может произойти с этими критериями, не основанными на тестах.Могут быть ситуации, в которых минимальный остаточный риск неприемлем, например, у лиц с высоким риском передачи вируса уязвимым группам или у лиц, находящихся в ситуациях или средах с высоким риском. В этих ситуациях и у пациентов с длительными симптомами лабораторный подход все еще может быть полезен.
ВОЗ призывает научное сообщество собрать дополнительные данные для дальнейшего совершенствования критериев изоляции при выписке и установления условий, при которых изоляция может быть сокращена или когда возможные риски существующих критериев выписки требуют дальнейшей адаптации.Лучшее понимание риска передачи среди лиц с различными клиническими проявлениями или сопутствующими заболеваниями и в различных условиях поможет дальнейшему уточнению этих критериев. В ситуациях, которые могут по-прежнему требовать лабораторного подхода, мы рекомендуем дальнейшую оптимизацию такого лабораторного алгоритма.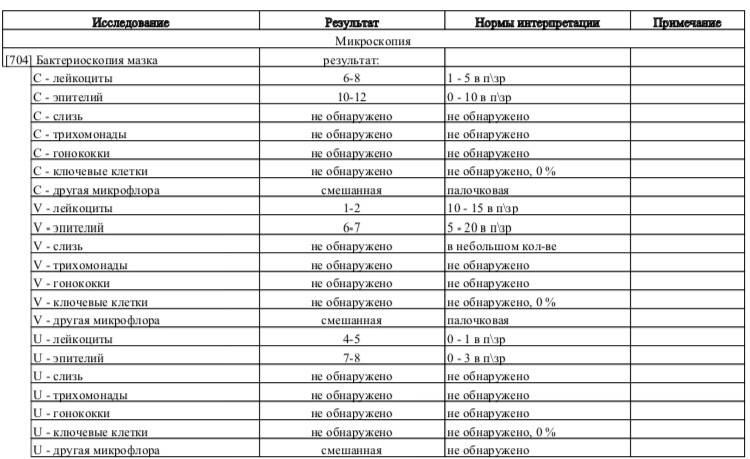 ВОЗ призывает страны продолжать тестирование пациентов, если у них есть для этого возможности, для систематического сбора данных, которые улучшат понимание и помогут лучше принимать решения о мерах профилактики и контроля инфекции, особенно среди пациентов с длительным течением заболевания или пациентов с ослабленным иммунитетом.
ВОЗ призывает страны продолжать тестирование пациентов, если у них есть для этого возможности, для систематического сбора данных, которые улучшат понимание и помогут лучше принимать решения о мерах профилактики и контроля инфекции, особенно среди пациентов с длительным течением заболевания или пациентов с ослабленным иммунитетом.
Текущее понимание риска передачи инфекции
Заражение вирусом, вызывающим COVID-19 (SARS-CoV-2), подтверждается наличием вирусной РНК, обнаруживаемой с помощью молекулярного тестирования, обычно ОТ-ПЦР. Обнаружение вирусной РНК не обязательно означает, что человек заразен и способен передать вирус другому человеку. Факторы, определяющие риск передачи, включают, остается ли вирус способным к репликации, есть ли у пациента симптомы, такие как кашель, который может распространять инфекционные капли, а также поведение и факторы окружающей среды, связанные с инфицированным человеком.Обычно через 5-10 дней после заражения SARS-CoV-2 у инфицированного человека начинают постепенно вырабатываться нейтрализующие антитела.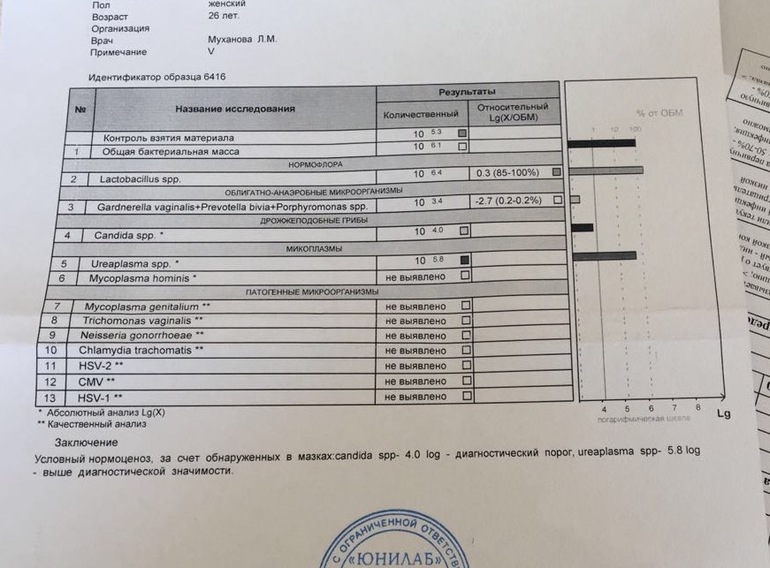 Ожидается, что связывание этих нейтрализующих антител с вирусом снизит риск передачи вируса. 10,11,29,35
Ожидается, что связывание этих нейтрализующих антител с вирусом снизит риск передачи вируса. 10,11,29,35
РНК SARS-CoV-2 выявляется у пациентов за 1–3 дня до появления симптомов, пик вирусной нагрузки в верхних дыхательных путях приходится на первую неделю инфекции, после чего снижаться со временем. 10,12,15,19,21,22,36-39 В фекалиях и нижних дыхательных путях пик этой вирусной нагрузки приходится на вторую неделю болезни. 19 Вирусная РНК была обнаружена в верхних дыхательных путях (ВДП) и нижних дыхательных путях (НВД) и кале, независимо от тяжести заболевания. 19 По-видимому, наблюдается тенденция к более длительному обнаружению вирусной РНК у более тяжелобольных пациентов. 10,14,15,18,19,41-43 Исследования обнаружения вирусной РНК у пациентов с ослабленным иммунитетом ограничены, но в одном исследовании предполагалось длительное обнаружение вирусной РНК у пациентов с трансплантацией почки. 33 В некоторых исследованиях анализировался риск передачи, связанный с появлением симптомов, и предполагаемый риск передачи был самым высоким во время или примерно во время появления симптомов и в первые 5 дней болезни.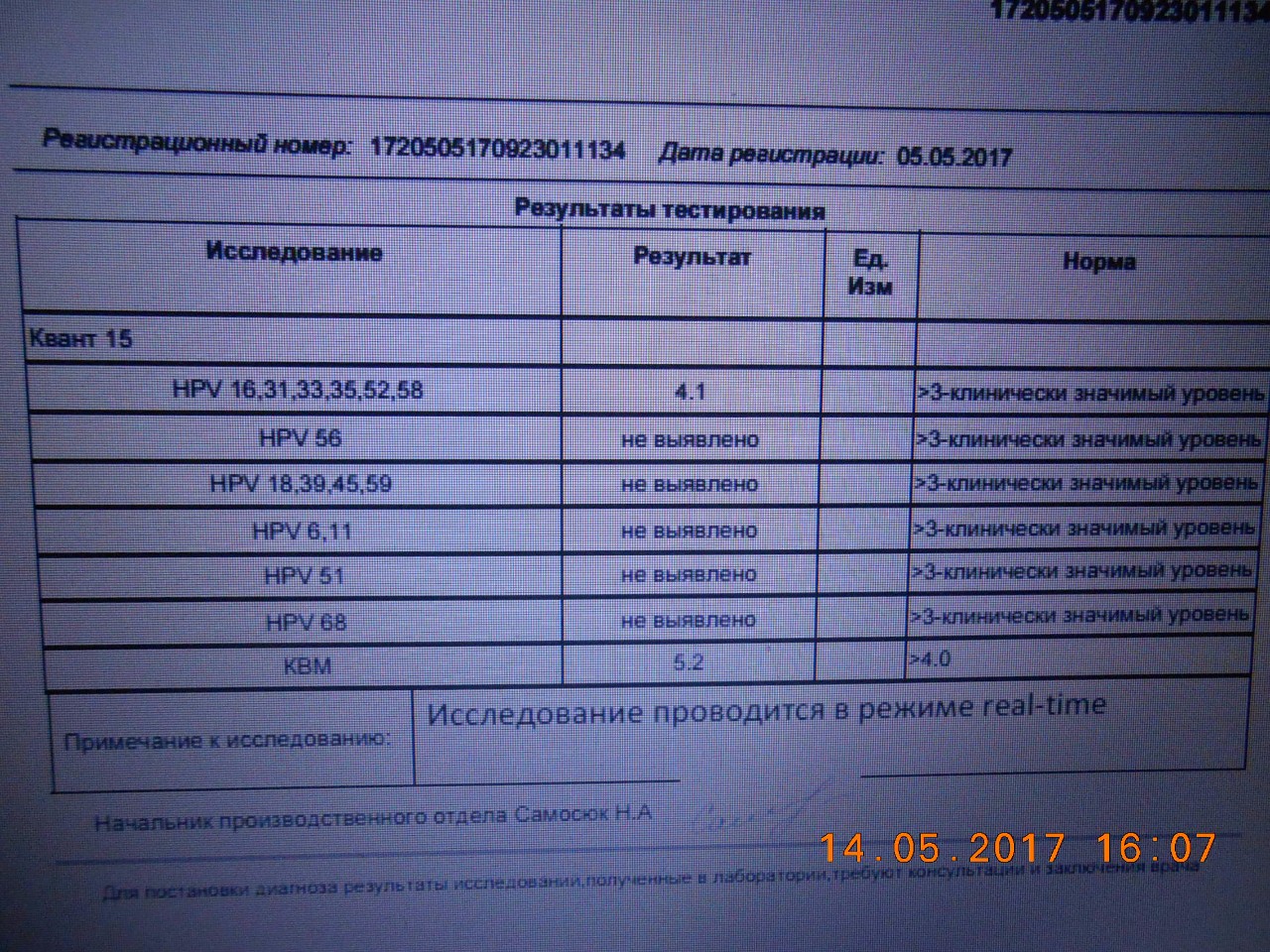 13,15
13,15
Способность вируса реплицироваться в культивируемых клетках служит суррогатным маркером инфекционности, но требует специальных лабораторных возможностей и может быть не такой чувствительной, как ПЦР. 10,20 Модели на животных могут помочь понять риск передачи инфекции. В исследовании, проведенном Сиа и др., хомяков, инфицированных SARS-CoV-2, содержали вместе со здоровыми хомяками либо на 1-й, либо на 6-й день после заражения. Передача здоровым хомячкам произошла в группе первого дня, но не в группе, подвергшейся воздействию через 6 дней после прививки.В этой модели время передачи коррелировало с обнаружением вируса с помощью клеточной культуры, но не с обнаружением вирусной РНК в смывах из носа донора. 31
Исследования с использованием вирусных культур образцов пациентов для оценки наличия инфекционного SARS-CoV-2 ограничены. 8-10,21,29,30,34 Жизнеспособный вирус был выделен у бессимптомного больного. 9 Исследование 9 пациентов с COVID-19 с заболеванием легкой и средней степени тяжести не выявило вируса SARS-CoV-2, который можно было бы культивировать из образцов дыхательных путей после 8-го дня появления симптомов.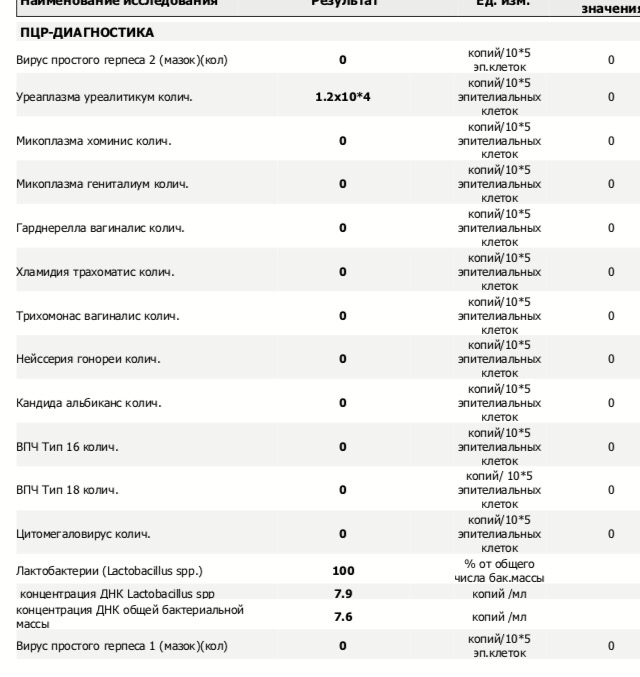 10 Три исследования пациентов с неизвестной или переменной степенью заболевания показали невозможность культивирования вируса через 7-9 дней после появления симптомов. 8,29,30 Пациенты, у которых была положительная ОТ-ПЦР при повторном тестировании после первоначальной отрицательной ОТ-ПЦР при выписке из изоляции, также были исследованы, и ни у одного из этих пациентов не были получены положительные вирусные культуры. 29 Одним из возможных исключений является отчет о пациенте с легкой формой COVID-19, у которого ПЦР-положительный результат сохранялся в течение 63 дней после появления симптомов.У этого пациента вирусные культуры были положительными в образцах из верхних дыхательных путей только в день появления симптомов, но были положительными в образцах мокроты до 18-го дня. респираторные симптомы. В проведенном в больнице исследовании 129 пациентов с COVID-19 в тяжелом или критическом состоянии у 23 пациентов был получен по крайней мере один положительный вирусный посев.
10 Три исследования пациентов с неизвестной или переменной степенью заболевания показали невозможность культивирования вируса через 7-9 дней после появления симптомов. 8,29,30 Пациенты, у которых была положительная ОТ-ПЦР при повторном тестировании после первоначальной отрицательной ОТ-ПЦР при выписке из изоляции, также были исследованы, и ни у одного из этих пациентов не были получены положительные вирусные культуры. 29 Одним из возможных исключений является отчет о пациенте с легкой формой COVID-19, у которого ПЦР-положительный результат сохранялся в течение 63 дней после появления симптомов.У этого пациента вирусные культуры были положительными в образцах из верхних дыхательных путей только в день появления симптомов, но были положительными в образцах мокроты до 18-го дня. респираторные симптомы. В проведенном в больнице исследовании 129 пациентов с COVID-19 в тяжелом или критическом состоянии у 23 пациентов был получен по крайней мере один положительный вирусный посев. В это исследование были включены 30 пациентов с ослабленным иммунитетом. Средняя продолжительность выделения вируса, измеренная с помощью посева, составляла 8 дней после начала заболевания, межквартильный диапазон составлял 5-11 дней, а диапазон составлял 0-20 дней. 11 Вероятность обнаружения вируса в культуре упала ниже 5% через 15,2 дня после появления симптомов. В этом исследовании у пациентов с положительным результатом теста на вирусную культуру все еще наблюдались симптомы во время сбора образцов. 11 В этом и других исследованиях была описана корреляция между снижением инфекционности и снижением вирусной нагрузки 10,11,29,34 и повышением уровня нейтрализующих антител. 10,11,29 Хотя вирусная РНК может быть обнаружена с помощью ПЦР даже после исчезновения симптомов, количество обнаруживаемой вирусной РНК со временем существенно снижается и, как правило, ниже порога, при котором может быть выделен вирус, способный к репликации.Таким образом, сочетание времени после появления симптомов и исчезновения симптомов кажется в целом безопасным подходом, основанным на текущих данных.
В это исследование были включены 30 пациентов с ослабленным иммунитетом. Средняя продолжительность выделения вируса, измеренная с помощью посева, составляла 8 дней после начала заболевания, межквартильный диапазон составлял 5-11 дней, а диапазон составлял 0-20 дней. 11 Вероятность обнаружения вируса в культуре упала ниже 5% через 15,2 дня после появления симптомов. В этом исследовании у пациентов с положительным результатом теста на вирусную культуру все еще наблюдались симптомы во время сбора образцов. 11 В этом и других исследованиях была описана корреляция между снижением инфекционности и снижением вирусной нагрузки 10,11,29,34 и повышением уровня нейтрализующих антител. 10,11,29 Хотя вирусная РНК может быть обнаружена с помощью ПЦР даже после исчезновения симптомов, количество обнаруживаемой вирусной РНК со временем существенно снижается и, как правило, ниже порога, при котором может быть выделен вирус, способный к репликации.Таким образом, сочетание времени после появления симптомов и исчезновения симптомов кажется в целом безопасным подходом, основанным на текущих данных.
Заключение
На основании данных, свидетельствующих о редкости вируса, который можно культивировать в образцах из дыхательных путей через 9 дней после появления симптомов, особенно у пациентов с легким течением заболевания, обычно сопровождающимся повышением уровня нейтрализующих антител и исчезновением симптомов, Представляется безопасным выводить пациентов из изоляции на основании клинических критериев, требующих минимального времени изоляции в 13 дней, а не строго на основании повторных результатов ПЦР.Важно отметить, что клинические критерии требуют, чтобы симптомы пациентов исчезли в течение как минимум трех дней до выхода из изоляции, при этом минимальное время изоляции должно составлять 13 дней с момента появления симптомов.
Эти изменения критериев выписки из изоляции (в медицинском учреждении или другом месте) уравновешивают понимание инфекционного риска и практичность требования повторного отрицательного ПЦР-теста, особенно в условиях интенсивной передачи или ограниченных запасов для тестирования.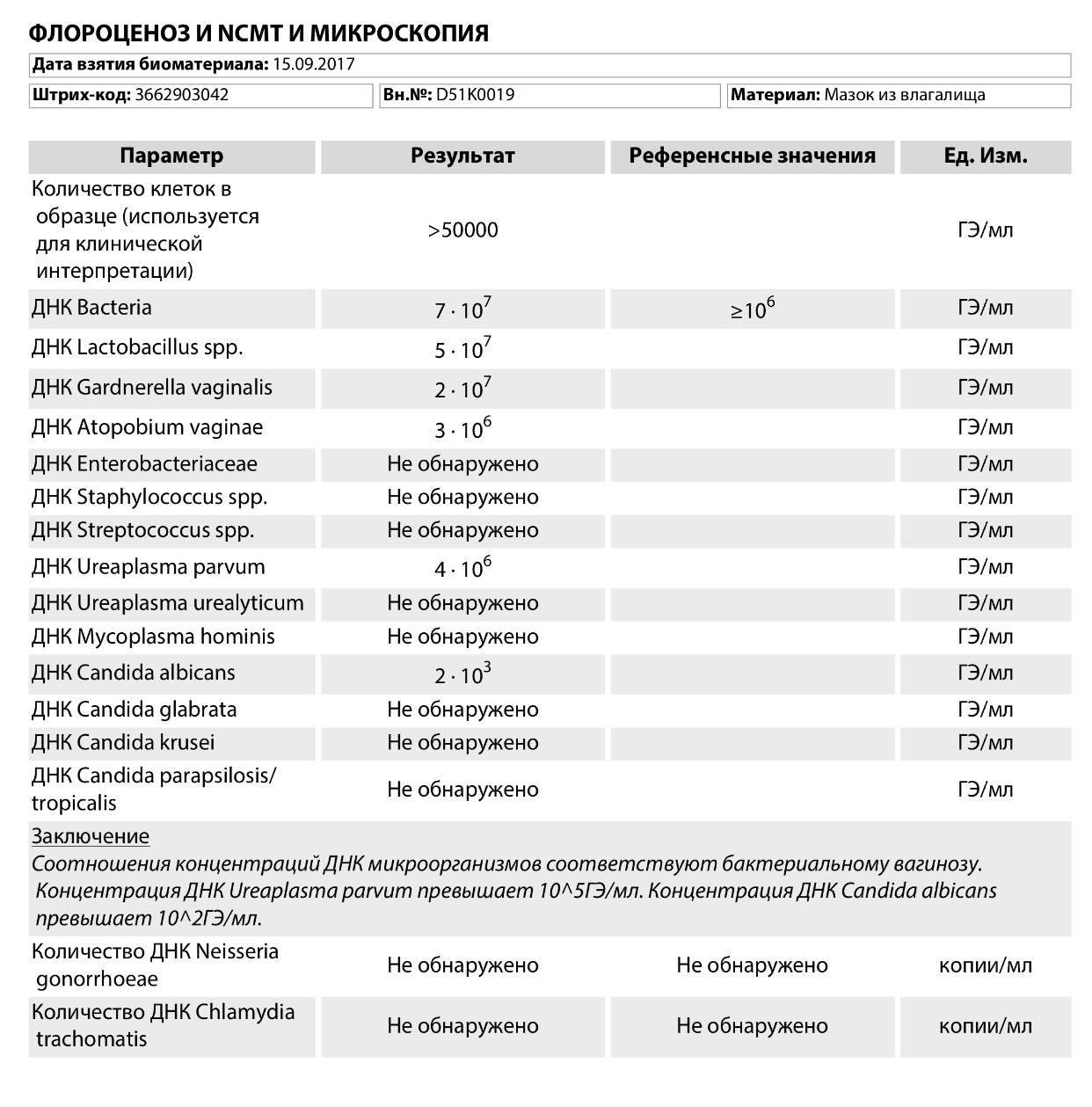 Хотя риск передачи после исчезновения симптомов, вероятно, будет минимальным, исходя из того, что известно в настоящее время, его нельзя полностью исключить. Однако подхода с нулевым риском не существует, и строгое использование ПЦР-подтверждения клиренса вирусной РНК создает другие риски (например, нехватка ресурсов и ограничение доступа к медицинской помощи для новых пациентов с острым заболеванием). У пациентов с тяжелым заболеванием, у которых симптомы проявляются в течение длительного периода времени, лабораторный подход также может помочь в принятии решения о необходимости длительной изоляции.Такой лабораторный подход может включать измерение вирусной нагрузки и уровней нейтрализующих антител (или подтвержденных эквивалентных антител). 10,11,29 Для дальнейшего подтверждения такого подхода необходимы дополнительные исследования.
Хотя риск передачи после исчезновения симптомов, вероятно, будет минимальным, исходя из того, что известно в настоящее время, его нельзя полностью исключить. Однако подхода с нулевым риском не существует, и строгое использование ПЦР-подтверждения клиренса вирусной РНК создает другие риски (например, нехватка ресурсов и ограничение доступа к медицинской помощи для новых пациентов с острым заболеванием). У пациентов с тяжелым заболеванием, у которых симптомы проявляются в течение длительного периода времени, лабораторный подход также может помочь в принятии решения о необходимости длительной изоляции.Такой лабораторный подход может включать измерение вирусной нагрузки и уровней нейтрализующих антител (или подтвержденных эквивалентных антител). 10,11,29 Для дальнейшего подтверждения такого подхода необходимы дополнительные исследования.
ВОЗ обновит эти критерии по мере поступления дополнительной информации. Для получения дополнительной информации о клинической помощи пациентам с COVID-19 см. полное руководство ВОЗ. 1
полное руководство ВОЗ. 1
[1] Страны могут продолжить использование алгоритма лабораторного тестирования в рамках критериев выдачи (подмножества) инфицированных лиц, если их оценка риска дает основания для этого.
[2] Без применения каких-либо жаропонижающих средств.
[3] Некоторые пациенты могут испытывать симптомы (например, поствирусный кашель) после периода заразности. Необходимы дальнейшие исследования. Для получения дополнительной информации о клиническом лечении пациентов с COVID-19 см. наше Руководство по клиническому ведению. 1
[4] Бессимптомный случай – это пациент с лабораторно подтвержденным положительным тестом и отсутствием симптомов на протяжении всего течения инфекции.
Ссылки
- Всемирная организация здравоохранения.Клиническое ведение COVID-19 (Временное руководство) https://www.who.int/publications-detail/clinical-management-of-covid-19, опубликовано 27 мая 2020 г.

- Всемирная организация здравоохранения. Коронавирусное заболевание (COVID-19) Ситуационный отчет – 129. 28 мая 2020 г. Доступно по адресу: https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200528-covid-19-sitrep-129. .pdf?sfvrsn=5b154880_2
- Международное общество инфекционистов ProMED. 30 декабря 2019 г. (https://promedmail.org/promed-post/?id=6864153%20#COVID19)
- Всемирная организация здравоохранения.Лабораторное тестирование людей с подозрением на заражение новым коронавирусом (nCOV) (временное руководство) (https://apps.who.int/iris/bitstream/handle/10665/330374/WHO-2019-nCoV-laboratory-2020.1-eng. pdf 10 января 2020 г.)
- Всемирная организация здравоохранения. Лаборатория технического руководства Коронавирус респираторного синдрома Ближнего Востока (БВРС-КоВ) (https://www.who.int/csr/disease/coronavirus_infections/technical-guidance-laboratory/en/)
- Всемирная организация здравоохранения. Глобальный эпиднадзор за COVID-19, вызванным заражением человека вирусом COVID-19.
 (Временное руководство) (https://www.who.int/publications/i/item/global-surveillance-for-covid-19-caused-by-human-infection-with-covid-19-virus-interim-guidance , 20 апреля 2020 г.)
(Временное руководство) (https://www.who.int/publications/i/item/global-surveillance-for-covid-19-caused-by-human-infection-with-covid-19-virus-interim-guidance , 20 апреля 2020 г.) - Всемирная организация здравоохранения. Стратегическая и техническая консультативная группа по инфекционным опасностям (STAG IH) (https://www.who.int/emergencies/diseases/strategic-and-technical-advisory-group-for-infectious-hazards/en/)
- Bullard J , Даск К., Фанк Д. и др. Прогнозирование инфекционного SARS-CoV-2 по диагностическим образцам, Clin Infect Dis .2020 г.: 10.1093/cid/ciaa638.
- Arons MM, Hatfield KM, Reddy SC, et al. Пресимптоматическая инфекция SARS-CoV 2 и передача в учреждении квалифицированного сестринского ухода. N Engl J Med. 2020; 382: 2081-90.
- Wolfel R, Corman VM, Guggemos W, et al. Вирусологическая оценка госпитализированных пациентов с COVID-19. Природа. 2020; 581: 465-69.
- Личное общение с van Kampen JJA, первым автором препринта: Van Kampen JJA, Van de Vijner DAMC, Fraaij PLA и др.
 Выделение инфекционного вируса у госпитализированных пациентов с коронавирусной болезнью 2019 (COVID-19): продолжительность и ключевые детерминанты.(Препринт) Медрхив. 2020 г.: 10.1101/2020.06.08.20125310.
Выделение инфекционного вируса у госпитализированных пациентов с коронавирусной болезнью 2019 (COVID-19): продолжительность и ключевые детерминанты.(Препринт) Медрхив. 2020 г.: 10.1101/2020.06.08.20125310. - Кому К.К., Цанг О.Т.И., Леунг В.С. и др. Временные профили вирусной нагрузки в образцах слюны из задней части ротоглотки и ответы сывороточных антител во время инфекции SARS-CoV-2: наблюдательное когортное исследование. Ланцет Infect Dis. 2020; 20(5): с. 565-74.
- Cheng HY, Jian S, Liu D и др. Отслеживание контактов, оценка динамики передачи COVID-19 на Тайване и риск в разные периоды воздействия до и после появления симптомов.JAMA Стажер Мед. 2020; е202020. doi: 10.1001/jamainternmed.2020.2020.
- Чжоу Р., Ли Ф., Чен Ф. и др. Вирусная динамика у бессимптомных пациентов с COVID-19. Int J Infect Dis. 2020 г.: 10.1016/j.ijid.2020.05.030.
- He X, Lau EHY, Wu P и др. Временная динамика выделения вируса и трансмиссивности COVID-19. Нат Мед. 2020; 26(5): стр.
 672-5.
672-5. - Лу Ю, Ли Ю, Дэн В и др. Симптоматическая инфекция связана с длительным выделением вируса при легкой форме коронавирусной болезни 2019: ретроспективное исследование 110 детей в Ухане.Pediatr Infect Dis J. 2020; 39(7): e95-9. doi: 10.1097/INF.0000000000002729.
- Мюнстер В.Дж., Фельдманн Ф., Уильямсон Б.Н. и др. Респираторное заболевание у макак-резусов, привитых SARS-CoV-2. Природа. 2020 г.: 10.1038/s41586-020-2324-7.
- Виддерс А, Брум А, Брум Дж. SARS-CoV-2: дилемма между выделением вируса и инфекционностью. Инфекция Dis Health. 2020 г.: 10.1016/j.idh.2020.05.002.
- Вайс А., Джеллингсо М., Соммер МОА. Пространственная и временная динамика SARS-CoV-2 у пациентов с COVID-19: системный обзор.(Препринт) Медрхив. 2020 г.: 10.1101/2020.05.21.20108605.
- Всемирная организация здравоохранения. Руководство по лабораторной биобезопасности, связанное с коронавирусным заболеванием (COVID-19) (https://www.who.int/publications/i/item/laboratory-biosafety-guidance-related-to-coronavirus-disease-(covid-19, 13 May 2020)
- Группа по расследованию COVID-19.
 Клинические и вирусологические характеристики первых 12 пациентов с коронавирусной болезнью 2019 (COVID-19) в США, Nat Med, 2020 doi: 10.1038/s41591-020-0877-5.
Клинические и вирусологические характеристики первых 12 пациентов с коронавирусной болезнью 2019 (COVID-19) в США, Nat Med, 2020 doi: 10.1038/s41591-020-0877-5. - Liu WD, Chang SY, Wang JT, et al. Длительное выделение вируса даже после сероконверсии у пациента с COVID-19. J заразить. 2020 г.: 10.1016/j.jinf.2020.03.063.
- Юань Дж., Коу С., Лян Ю. и др. Анализы ПЦР оказались положительными у 25 выписанных пациентов с COVID-19. Клин Инфекция Дис. 2020 г.: 10.1093/cid/ciaa398.
- Тан Х, Чжао С, Хе Д и др. Положительные тесты RT-PCR среди выписанных пациентов с COVID-19 в Шэньчжэне, Китай. Infect Control Hosp Epidemiol. 2020 г.: 10.1017/лед.2020.134.
- Ку Ю.М., Канг Э.М., Конг Х.И. Положительный результат Sars-Cov-2 в мокроте вылеченного пациента с COVID-19 . Travel Med Infect Dis. 2020; 34: стр. 101619. doi: 10.1016/j.tmaid.2020.101619.
- Ли Ю, Ху Ю, Ю Ю и др. Положительный результат на Sars-Cov-2 в фекалиях и мокроте выписанного пациента с COVID-19 в Иу, Китай.
 J Med Virol. 2020 г.: 10.1002/jmv.25905.
J Med Virol. 2020 г.: 10.1002/jmv.25905. - Xiao AT, Tong YX, Zhang S. Ложноотрицательный результат ОТ-ПЦР и длительная конверсия нуклеиновой кислоты при COVID-19: скорее, чем рецидив.J Med Virol. 2020 г.: 10.1002/jmv.25855.
- Xing Y, Mo P, Xiao Y и др. Наблюдение после выписки и выявление вируса у двух медицинских работников, выздоровевших от коронавирусной болезни 2019 г. (COVID-19), Китай, январь–февраль 2020 г. Euro Surveill, 2020; 25(10): 2000-191. doi: 10.2807/1560-7917.ES.2020.25.10.2000191.
- Неопубликованные данные, рукопись в процессе подготовки, личное сообщение Малик Пейрис, Гонконгский университет.
- Центры по контролю и профилактике заболеваний, Коронавирусная болезнь 2019 (COVID-19).Симптоматическая стратегия прекращения изоляции лиц с COVID-19. Веб-сайт, по состоянию на 12 июня 2020 г. https://www.cdc.gov/coronavirus/2019-ncov/community/strategy-discontinue-isolation.html
- Sia SF, Yan LM, Chin AWH et al. Патогенез и передача SARS-CoV-2 у золотистых хомяков .
 Природа. 2020 г.: 10.1038/s41586-020-2342-5.
Природа. 2020 г.: 10.1038/s41586-020-2342-5. - Ван В., Сюй Ю., Гао Р. и др. Обнаружение SARS-CoV-2 в различных типах клинических образцов. ЯМА. 2020; 323(18): 1843-4.дои: 10.1001/jama.2020.3786.
- Чжу Л., Гонг Н., Лю Б. и др. Коронавирусная болезнь 2019 пневмония у реципиентов почечного трансплантата с подавленным иммунитетом: сводка 10 подтвержденных случаев в Ухане, Китай. Евр Урол. 2020; 77(6):748-54.
- Ла Скола Б., Ле Бидо М., Андреани Дж. и др. Вирусная РНК-нагрузка, определенная клеточной культурой, как инструмент управления выпиской SARS-CoV-2 из инфекционных отделений. Eur J Clin Microbiol Infect Dis. 2020 г.: 10.1007/s10096-020-03913-9.
- Аткинсон Б., Петерсен Э.Выделение и инфекционность SARS-CoV-2. Ланцет. 2020; 395 (10233): стр. 1339-40.
- Цзоу Л., Руан Ф., Хуан М. и др. Вирусная нагрузка SARS-CoV-2 в образцах верхних дыхательных путей инфицированных пациентов . N Engl J Med. 2020; 382(12): стр.1177-9.

- Young BE, Ong SWX, Kalimuddin S, et al. Эпидемиологические особенности и клиническое течение пациентов, инфицированных SARS-CoV-2, в Сингапуре. ДЖАМА. 2020;323(15):1488–1494. дои: 10.1001/jama.2020.3204.
- Lescure FX, Bouadma L, Nguyen D, et al.Клинические и вирусологические данные о первых случаях COVID-19 в Европе: серия случаев. Ланцет Infect Dis. 2020; 20(6): с. 697-706. doi: 10.1016/S1473-3099(20)30200-0.
- Пан И, Чжан Д, Ян П, Пун Л.М., Ван К. Вирусная нагрузка SARS-CoV-2 в клинических образцах . Ланцет Infect Dis. 2020; 20(4): с. 411-2. doi: 10.1016/S1473-3099(20)30113-4.
- Линг Ю., Сюй С.Б., Линь Ю.С. и др. Стойкость и клиренс вирусной РНК у реабилитационных пациентов с новым коронавирусным заболеванием 2019 года.Чин Мед Дж (англ.). 2020; 133(9): с. 1039-43. дои: 10.1097/CM9.0000000000000774.
- Ху З., Сон С., Сюй С. и др. Клинические характеристики 24 бессимптомных инфекций COVID-19, выявленных среди близких контактов в Нанкине, Китай.



 Следует также указать, с какими органами может потребоваться консультация для принятия решения.
Следует также указать, с какими органами может потребоваться консультация для принятия решения. Получено с: https://www.cdc.gov/coronavirus/2019-ncov/lab/faqs.html#Interpreting-Results-of-Diagnostic-Tests
Получено с: https://www.cdc.gov/coronavirus/2019-ncov/lab/faqs.html#Interpreting-Results-of-Diagnostic-Tests 2020 авг.; 25(32):2001483. DOI: https://doi.org/10.2807/1560-7917.ES.2020.25.32.2001483
2020 авг.; 25(32):2001483. DOI: https://doi.org/10.2807/1560-7917.ES.2020.25.32.2001483 Тампон — это мягкий наконечник на длинной гибкой палочке, который вводят в нос. Существуют различные типы мазков из носа, в том числе мазки из носа, которые собирают образец непосредственно в ваших ноздрях, и мазки из носоглотки, которые проходят дальше в полость носа для сбора.Для сбора материала для ПЦР-теста на COVID-19 достаточно мазка любого типа. После сбора мазок запечатывают в пробирку и затем отправляют в лабораторию.
Тампон — это мягкий наконечник на длинной гибкой палочке, который вводят в нос. Существуют различные типы мазков из носа, в том числе мазки из носа, которые собирают образец непосредственно в ваших ноздрях, и мазки из носоглотки, которые проходят дальше в полость носа для сбора.Для сбора материала для ПЦР-теста на COVID-19 достаточно мазка любого типа. После сбора мазок запечатывают в пробирку и затем отправляют в лабораторию. Одно из химических веществ в пробирке излучает флуоресцентный свет, если в образце присутствует SARS-CoV-2. После достаточной амплификации машина ПЦР может обнаружить этот сигнал. Ученые используют специальное программное обеспечение, чтобы интерпретировать сигнал как положительный результат теста.
Одно из химических веществ в пробирке излучает флуоресцентный свет, если в образце присутствует SARS-CoV-2. После достаточной амплификации машина ПЦР может обнаружить этот сигнал. Ученые используют специальное программное обеспечение, чтобы интерпретировать сигнал как положительный результат теста.
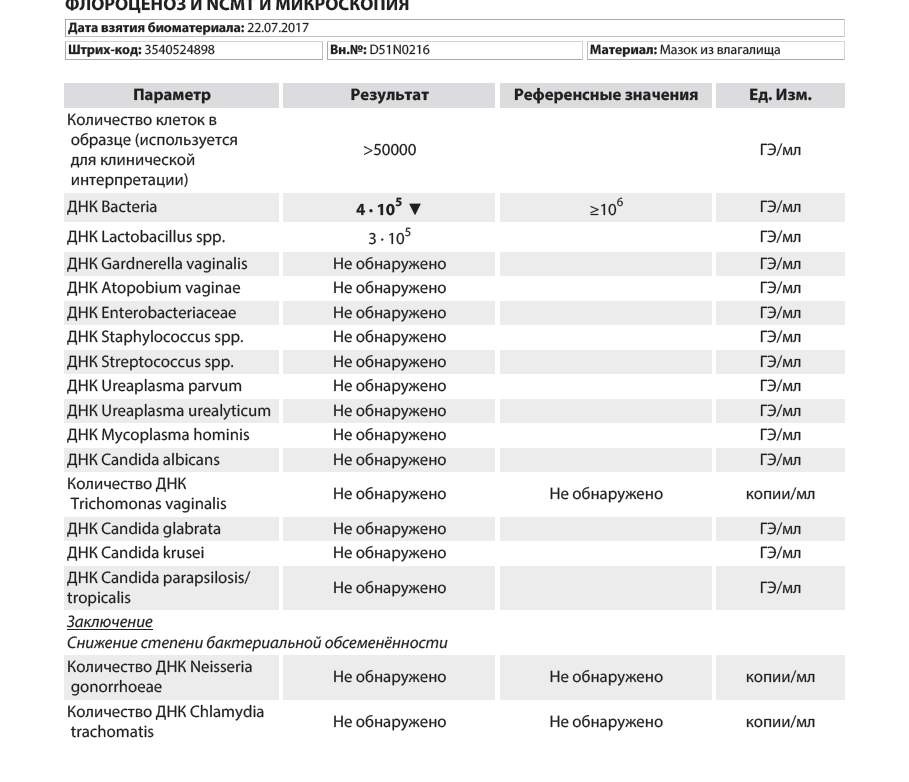
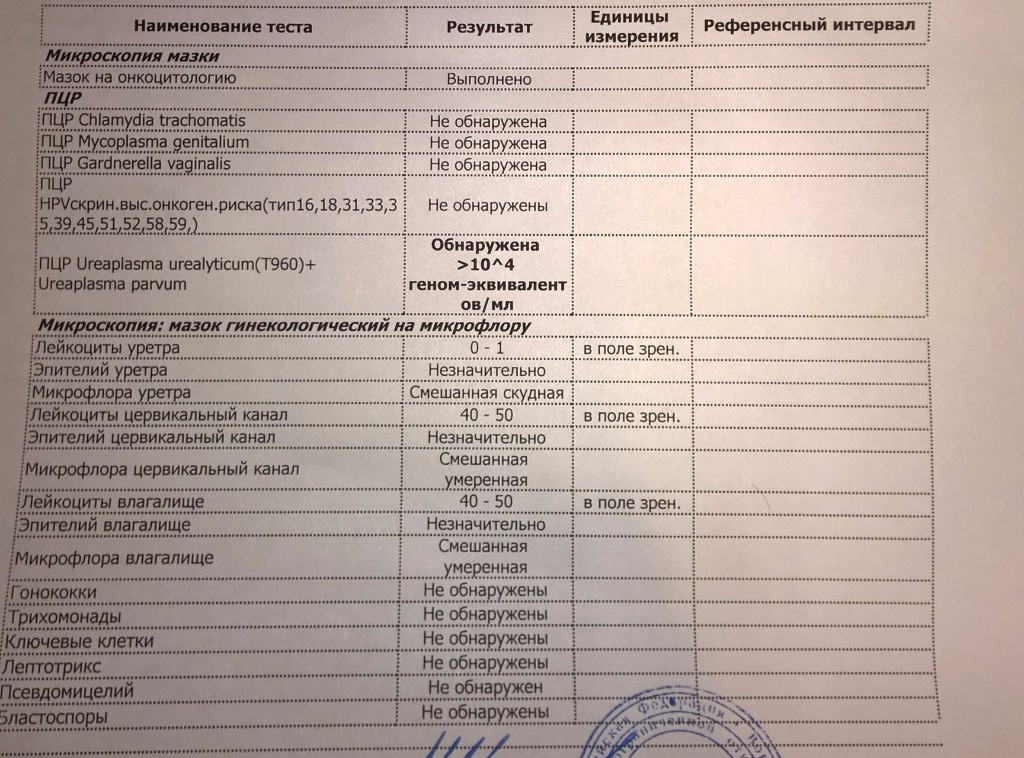 (Временное руководство) (https://www.who.int/publications/i/item/global-surveillance-for-covid-19-caused-by-human-infection-with-covid-19-virus-interim-guidance , 20 апреля 2020 г.)
(Временное руководство) (https://www.who.int/publications/i/item/global-surveillance-for-covid-19-caused-by-human-infection-with-covid-19-virus-interim-guidance , 20 апреля 2020 г.)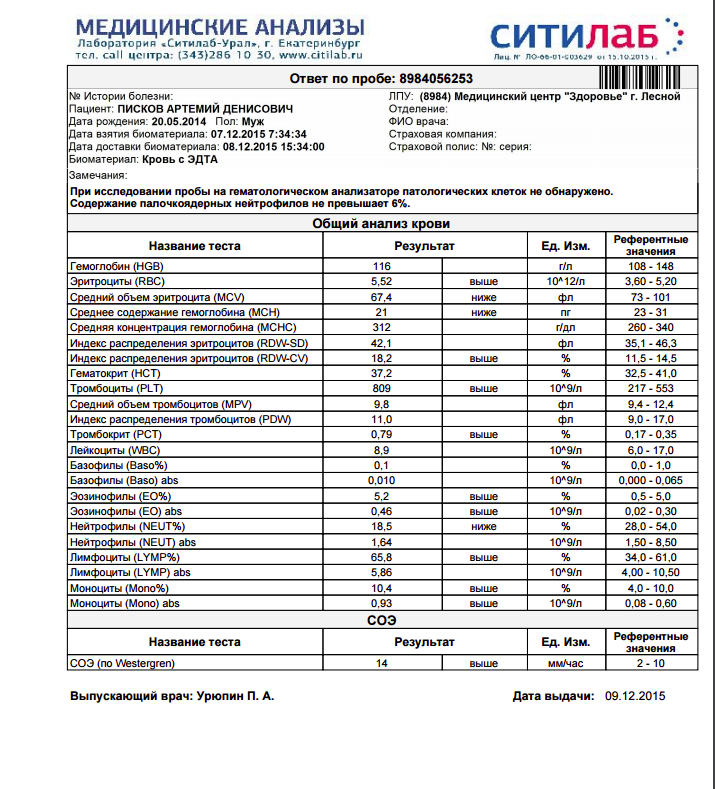 Выделение инфекционного вируса у госпитализированных пациентов с коронавирусной болезнью 2019 (COVID-19): продолжительность и ключевые детерминанты.(Препринт) Медрхив. 2020 г.: 10.1101/2020.06.08.20125310.
Выделение инфекционного вируса у госпитализированных пациентов с коронавирусной болезнью 2019 (COVID-19): продолжительность и ключевые детерминанты.(Препринт) Медрхив. 2020 г.: 10.1101/2020.06.08.20125310. 672-5.
672-5.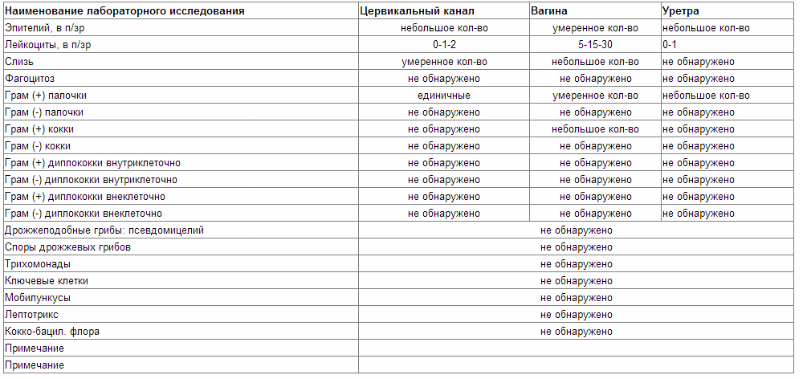 Клинические и вирусологические характеристики первых 12 пациентов с коронавирусной болезнью 2019 (COVID-19) в США, Nat Med, 2020 doi: 10.1038/s41591-020-0877-5.
Клинические и вирусологические характеристики первых 12 пациентов с коронавирусной болезнью 2019 (COVID-19) в США, Nat Med, 2020 doi: 10.1038/s41591-020-0877-5. J Med Virol. 2020 г.: 10.1002/jmv.25905.
J Med Virol. 2020 г.: 10.1002/jmv.25905.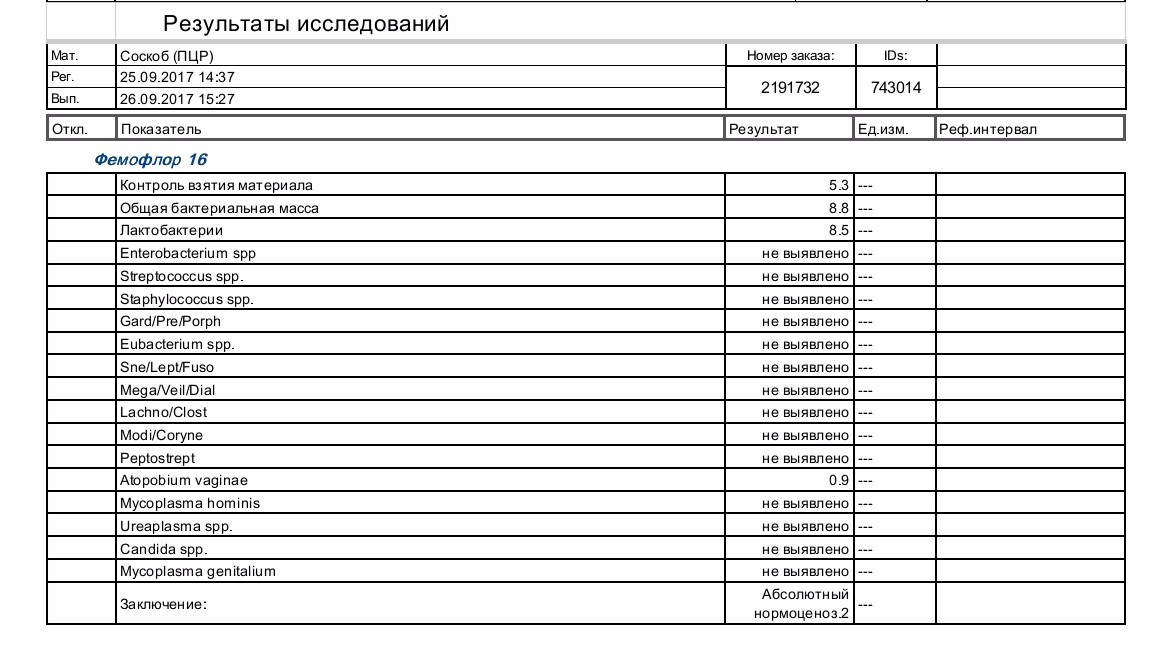 Природа. 2020 г.: 10.1038/s41586-020-2342-5.
Природа. 2020 г.: 10.1038/s41586-020-2342-5.