Рецидив тератома: МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: VI РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: VI РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
VI РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
НЕЗРЕЛЫЕ ТЕРАТОМЫ ЯИЧНИКОВ
(клинико-морфологические особенности, лечение)
И.Ю. Давыдова, В.В. Кузнецов, А.И. Карселадзе, О.В. Губина
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Одной из самых серьезных проблем современной онкогинекологии являются опухоли яичников. Первое место по частоте занимают эпителиальные новообразования.
Целый ряд редких опухолей яичников так и не знаком широкой аудитории онкогинекологов. К их числу относятся незрелые тератомы яичников (НТЯ), которые составляют 1% всех новообразований женской гонады и стоят на 3-ем месте по частоте среди герминогенных опухолей яичников после дисгерминомы и опухоли эндодермального синуса.
По определению классификации ВОЗ незрелыми называются тератомы, содержащие эмбриональные ткани наряду с дефинитивными, зрелыми тканевыми структурами.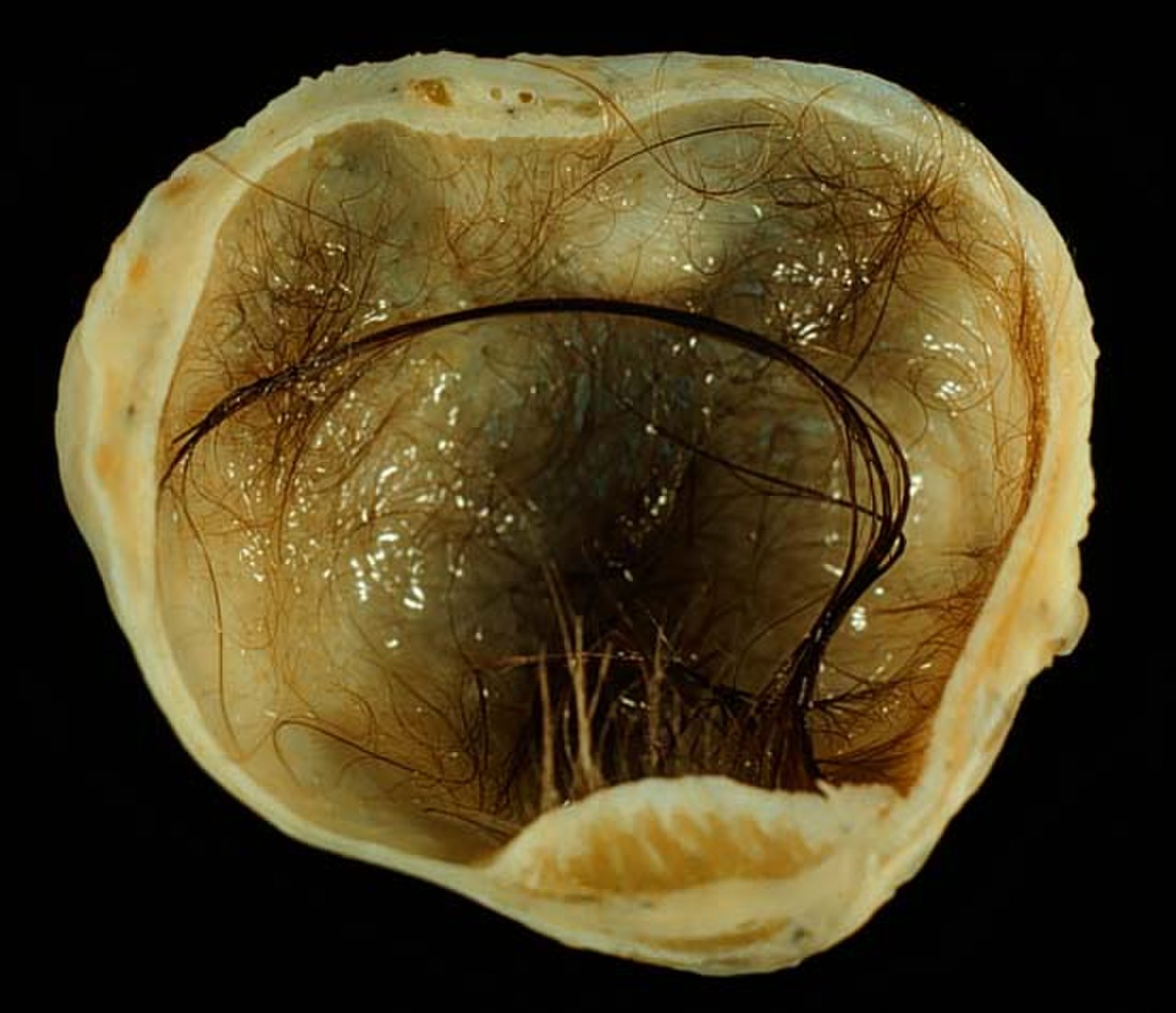
В гистологической классификации ВОЗ незрелые тератомы относятся к герминогенным опухолям яичников и входят в группу тератом.
Невзирая на отсутствие структур, имеющих формальные морфологические признаки злокачественности, незрелые тератомы обладают способностью к экстраорганной диссеминации и даже метастазированию. При этом и диссеминаты, и метастазы могут торпидно существовать годами, не вызывая значительных функциональных нарушений. В тех редких случаях, когда есть возможность сравнения микроскопической структуры первичной опухоли и диссеминатов или метастазов, выявляются убедительные признаки созревания опухолевых клеток во вторичных очагах по сравнению с первичной опухолью. В то же время внезапное прогрессирование процесса с летальным исходом структурно может быть связано с появлением анаплазированных элементов на фоне созревшей опухолевой ткани.
Подобное разнообразие клинического течения заболевания, естественно, сказывается на тактике лечения больных с незрелыми тератомами яичников.
До сих пор ведутся дискуссии о том, нужна ли химиотерапия, если морфологические признаки злокачественности не определяются? Чем предопределена клиническая стабилизация процесса в тех случаях, когда химиотерапия, по существу, не имеет клеточной мишени для воздействия
Следует подчеркнуть, что незрелые тератомы — это опухоли, поражающие молодой контингент больных, и это с особой остротой ставит вопросы сохранения детородной функции и дальнейшей социально-генетической реабилитации этих больных.
Целью настоящего исследования были:
- разработка клинико-морфологической семиотики незрелых тератом яичников, как изолированных «чистых», так и в сочетании с другими герминогенными и негерминогенными опухолями женской гонады;
- определение оптимальных методов диагностики и лечения опухоли;
- выделение основных факторов прогноза течения болезни.

Для достижения поставленной цели были определены следующие задачи:
- изучить клиническую характеристику больных с чистыми и смешанными незрелыми тератомами яичников;
- оценить возможности различных диагностических методов (УЗИ, рентгеновская компьютерная томография, внутривенная урография, иммунологические исследования) в скрининге и мониторинге;
- проанализировать эффективность различных методов лечения;
- изучить особенности рецидивирования и метастазирования при НТЯ;
- проанализировать прогностическую значимость различных клинико-морфологических и иммунологических признаков, характерных для больных как чистыми, так и смешанными незрелыми тератомами яичников;
- оценить отдаленные результаты лечения НТЯ.
Материалом для нашего исследования послужили данные о 79 больных, получавших лечение с 1966 по 2000 гг.
Для проверки гипотезы о возможности созревания злокачественных герминогенных опухолей через стадию незрелых тератом в работу была включена группа больных, в опухолевой ткани которых на фоне преобладания участков незрелой тератомы выявлялись фокусы злокачественных герминогенных новообразований.
В работе Гохта показано наличие определенной группы макрофагов, вырабатывающих фактор, способствующий росту глии. С целью уточнения роли этих макрофагов в незрелых тератомах яичников у части больных нами было проведено иммуногистохимическое исследование материала для выявления CD-68 положительных макрофагов в опухолевой ткани и динамики их количества в процессе прогрессии заболевания.
Стадия заболевания определялась на основании классификации Международной федерации акушеров и гинекологов.
Гистологическая градация незрелых тератом яичника по степеням зрелости производилась по методу Norris, которая учитывает нарастание незрелого нейрогенного эпителия.
Большинство больных находились в возрастном интервале от 15 до 25 лет. При статистической обработке материала доказано отсутствие статистически значимой разницы в выживаемости в зависимости от возраста.
У 81,1% больных была I стадия заболевания; II стадию заболевания мы не наблюдали; у 18,9% пациенток была III стадия заболевания.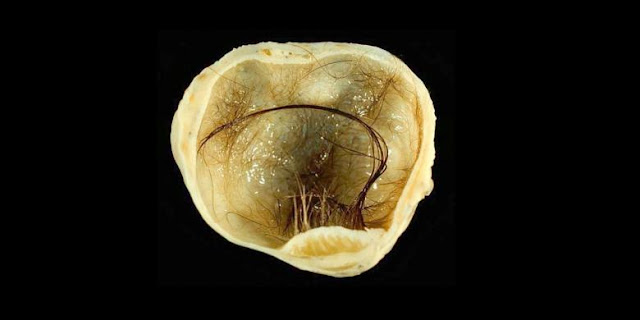
По степеням зрелости больные распределялись следующим образом: I и II степени зрелости опухоли были у 81% больных, III степень — у 19 % пациенток.
Патогномоничных клинических проявлений при НТЯ не выявлено.
Основными жалобами, сопровождающими данное заболевание, являются боль в животе как острого, так и тупого характера, увеличение живота. Реже больные предъявляли жалобы на повышение температуры тела, нарушение менструальной функции.
Инструментальные методы исследования, УЗИ, внутривенная урография, рентгеновская компьютерная томография позволяли предположить тератоидный характер новообразования, однако тип тератомы (зрелая или незрелая) данные методы не определили ни в одном наблюдении.
Следует особо отметить, что ?-фетопротеин, считающийся для клинициста патогномоничным для злокачественных герминогенных опухолей, был повышенным у 73,3% больных незрелыми тератомами яичников.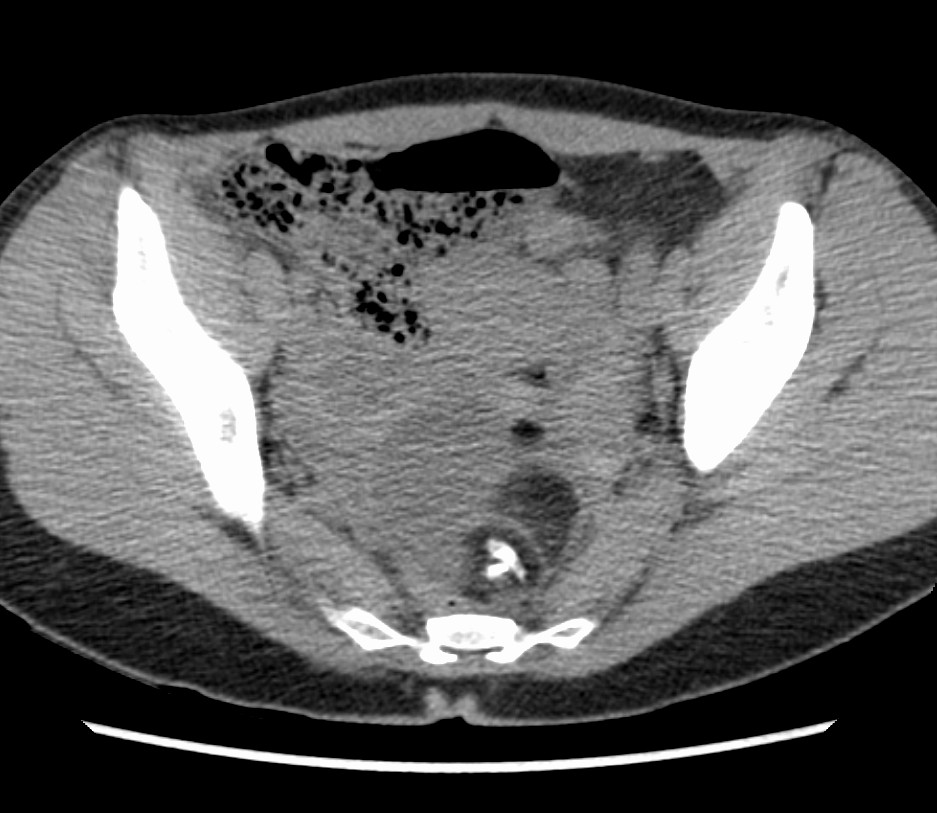 Высокий уровень хорионического гонадотропина, безусловно, свидетельствует о наличии хориокарциномы.
Высокий уровень хорионического гонадотропина, безусловно, свидетельствует о наличии хориокарциномы.
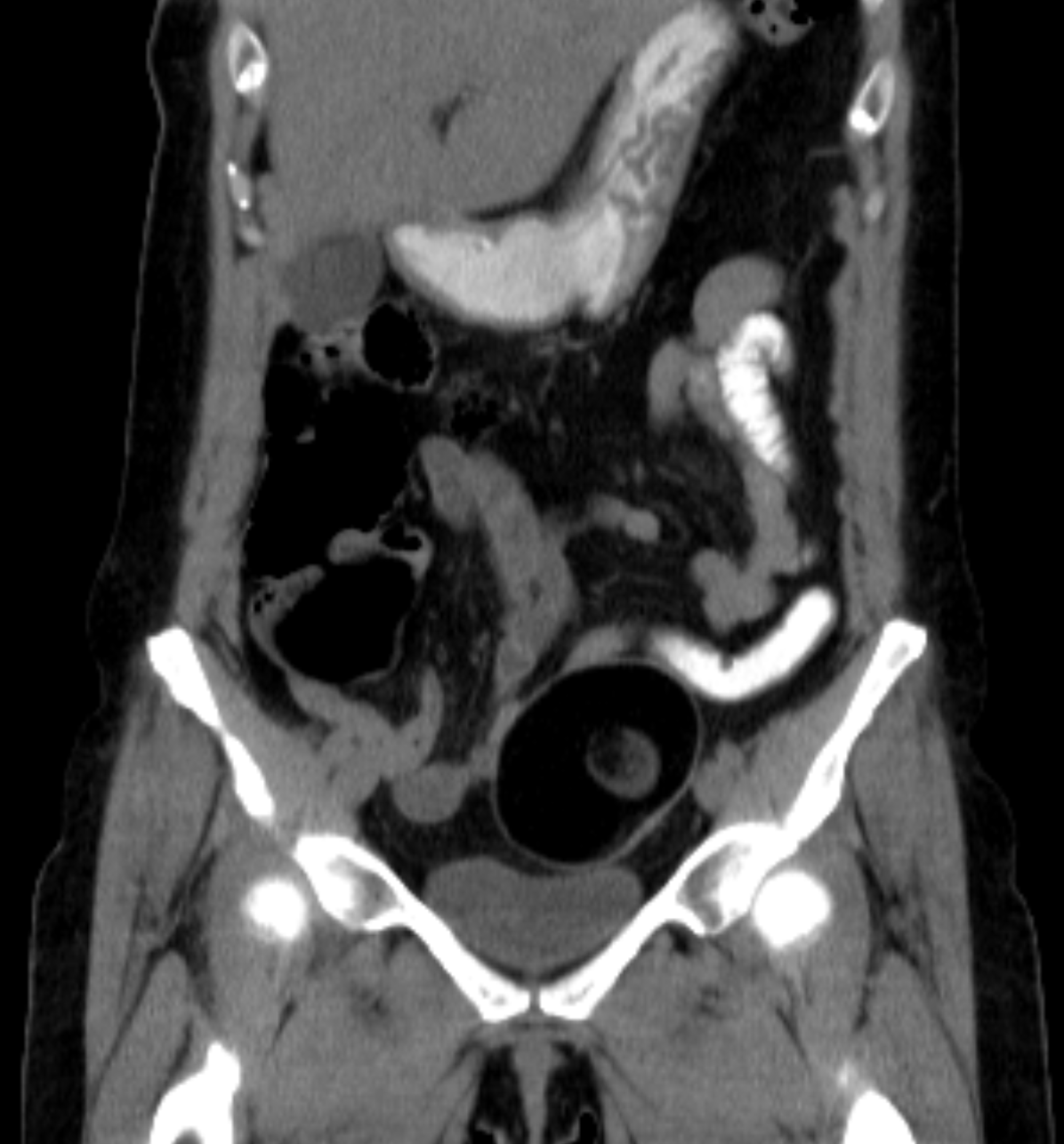
Макроскопически незрелая тератома представляет собой кистозное или кистозно-солидное образование преимущественно больших размеров.
Несмотря на то, что инвазия первичной опухоли в соседние органы и ткани для незрелой тератомы не характерна, у 28% больных во время операции определялась адгезия новообразования к органам, в большинстве случаев — большому сальнику, кишке.
Как правило, адгезия опухоли к окружающим органам и тканям была следствием микроперфорации капсулы новообразования или сопровождала распространенный опухолевый процесс. У каждой четвертой больной отмечен перекрут ножки опухоли.
Микроскопически незрелая тератома содержит, как правило, структуры и зрелой тератомы, на фоне которых происходит размножение клеток незрелой нейрогенной природы или незрелого хряща.
НТЯ характеризуются специфическими формами диссеминации и рецидивирования.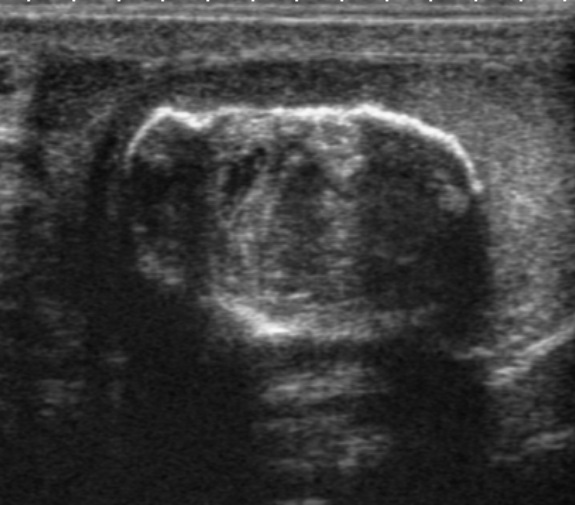 Диссеминаты или рецидивы могут быть представлены как производными одной тканевой направленности, так и элементами всех зародышевых листков.
Диссеминаты или рецидивы могут быть представлены как производными одной тканевой направленности, так и элементами всех зародышевых листков.
К первой группе относятся больные с глиоматозом брюшины. Мы наблюдали 7 больных с этим редким видом диссеминации. Глиоматоз брюшины является специфической формой диссеминации незрелой тератомы. Обнаруженные диссеминаты по брюшине и в большом сальнике представляли собой разрастания нейроглиальной ткани. У 2 больных обнаружены микрометастазы в большом сальнике, визуально и пальпаторно не определяемые.
Имплантаты нейроглии растут под мезотелиальным покровом, однако никогда не прорастают в органы брюшной полости. Глиоматоз брюшины не зависит от степени дифференцировки первичной опухоли.
Течение глиоматоза относительно доброкачественное. Так, ни в одном наблюдении мы не видели сдавления органов с нарушением их функции. При рецидиве заболевания также возможен глиоматоз брюшины.
Бывает и другой тип диссеминации, когда рецидивная опухоль представлена производными всех тканевых элементов, которые были в первичном очаге.
Рецидив заболевания в нашем исследовании наблюдался в 41% наблюдений, у большинства больных — в течение 10 мес. после операции. У 1 пациентки несколько рецидивов развилось в сроке от 4 мес. до 5 лет.
Рецидивные опухоли или диссеминаты могут или совпадать по степени зрелости с первичной опухолью или отличаться как в сторону понижения, так и в сторону повышения степени дифференцировки.
Приведем примеры. Больной 21 года по поводу незрелой тератомы яичника была выполнена односторонняя аднексэктомия. Гистологически определялась незрелая нейроглиальная ткань, представленная коммитированными клетками. Через 2 мес. отмечено прогрессирование заболевания. Рецидивная опухоль была удалена. Гистологическое заключение: более зрелая нейроглиальная ткань. Больная жива 15 лет.
В другом наблюдении у больной 18 лет первичная опухоль была представлена незрелой тератомой. Микроскопически опухоль была представлена сравнительно зрелой глиальной тканью. Через 1,5 мес. Отмечено прогрессирование болезни. Рецидивная опухоль в малом тазу и брюшной полости удалена. Микроскопически отмечено снижение дифференцировки опухоли до скоплений коммитированных клеток. Больная умерла через 8 мес. от прогрессирования заболевания.
Через 1,5 мес. Отмечено прогрессирование болезни. Рецидивная опухоль в малом тазу и брюшной полости удалена. Микроскопически отмечено снижение дифференцировки опухоли до скоплений коммитированных клеток. Больная умерла через 8 мес. от прогрессирования заболевания.
Третье наблюдение демонстрирует развитие злокачественной герминогенной опухоли (опухоли эндодермального синуса) в незрелой тератоме. Больной 19 лет по поводу незрелой тератомы была выполнена аднексэктомия. Через 3 мес. зафиксировано прогрессирование болезни, в связи с чем произведена надвлагалищная ампутация матки с придатками, удаление опухолевых узлов. Гистологическое заключение: более зрелая нейроглия. В послеоперационном периоде проведена химиотерапия, на фоне которой отмечен рост опухоли. Рецидивная опухоль была удалена. При исследовании микропрепаратов обнаружена злокачественная герминогенная опухоль — опухоль эндодермального синуса. Больная умерла через 1 год от прогрессирования болезни.
Механизм созревания рецидивов в определенной мере прояснило изучение динамики числа специфических макрофагов, дающих положительную CD-68 реакцию, которое показало, что в незрелой нервной ткани CD-68 положительные макрофаги определяются как единичные. В участках зрелой глии CD-68 положительные макрофаги обычно формируют гнездные скопления, порой занимающие все поле зрения как в первичной опухоли, так и в рецидивной. И всегда число CD-68 положительных макрофагов однозначно повышается по мере созревания нейрогенных элементов в сторону нейроглии.
В участках зрелой глии CD-68 положительные макрофаги обычно формируют гнездные скопления, порой занимающие все поле зрения как в первичной опухоли, так и в рецидивной. И всегда число CD-68 положительных макрофагов однозначно повышается по мере созревания нейрогенных элементов в сторону нейроглии.
Незрелая тератома метастазирует, по данным наших исследований, в 18,5% случаев в печень, легкие, кости. Течение метастатического процесса может быть различным: от агрессивного до торпидного, как, например, в следующем клиническом наблюдении. Больной 15 лет выполнена экстирпация матки с придатками по поводу незрелой тератомы яичника III стадии. Через 6 мес. после комплексного лечения возникли множественные метастазы в легких с обеих сторон до 8 см в диаметре, метастазы в печень. При трансбронхиальной биопсии обнаружена идентичность метастатической опухоли и первичного новообразования. Больная была выписана с рекомендацией проведения симптоматического лечения. Через 15 лет динамики со стороны метастазов в легких и печени не наблюдалось. Больная живет 21 год, хотя признаки дыхательной недостаточности сохраняются.
Больная живет 21 год, хотя признаки дыхательной недостаточности сохраняются.
Несмотря на возможность относительно доброкачественного течения НТЯ при наличии метастазов, 5-летняя выживаемость таких больных была существенно ниже и составила 38,8 % в сравнении с 80% в группе пациенток, у которых метастазирования не наблюдалось.
Прогрессирование незрелой тератомы может быть обусловлено присутствием в опухоли саркоматозного компонента и плоскоклеточного рака, несмотря на общепринятое мнение, что плоскоклеточный рак может развиваться в дермоидной кисте. Дальнейшее прогрессирование будет обусловлено соматическим компонентом опухоли.
Вторая группа смешанных опухолей была включена в исследование с целью проверки гипотезы о возможности трансформации злокачественных герминогенных опухолей в более зрелые структуры. До сегодняшнего дня большинство авторов считает зрелые и незрелые тератомы результатом созревания гоноцитов, дающих начало и злокачественным герминогенным опухолям. Следовательно, логически можно предположить, что наличие соматических структур одновременно с герминогенными означает склонность опухоли к повышению дифференцировки и созреванию. Если это так, то гипотетически злокачественные герминогенные опухоли, сочетающиеся с незрелой и даже зрелой тератомой, должны протекать более благоприятно, чем в чистом виде. Однако прогностически эта группа ничем не отличалась от течения злокачественных герминогенных новообразований без присутствия незрелой тератомы.
Следовательно, логически можно предположить, что наличие соматических структур одновременно с герминогенными означает склонность опухоли к повышению дифференцировки и созреванию. Если это так, то гипотетически злокачественные герминогенные опухоли, сочетающиеся с незрелой и даже зрелой тератомой, должны протекать более благоприятно, чем в чистом виде. Однако прогностически эта группа ничем не отличалась от течения злокачественных герминогенных новообразований без присутствия незрелой тератомы.
Уровень α-фетопротеина у больных со смешанными незрелыми тератомами был на порядок выше. Максимальный уровень α-фетопротеина при «чистых» НТЯ был равен 2000 нг/мл, при смешанных НТЯ — 125000 нг/мл.
Частота рецидивов и метастазов при смешанных НТЯ выше по сравнению с «чистыми» НТЯ. Смешанные НТЯ в 53% наблюдений метастазировали в забрюшинные лимфоузлы, печень, легкие.
Отдельно следует остановиться на лечении незрелых тератом яичников. Большинству больных проведено комбинированное лечение, включающее операцию и химиотерапию. Односторонняя аднексэктомия выполнена подавляющему большинству пациенток. Мы должны подчеркнуть, что трактовка результатов проведенной химиотерапии затруднена, поскольку больные лечились в разное время, получали самые разнообразные схемы химиотерапии. Тем не менее, предварительные результаты анализа этих данных говорят о следующем.
Большинству больных проведено комбинированное лечение, включающее операцию и химиотерапию. Односторонняя аднексэктомия выполнена подавляющему большинству пациенток. Мы должны подчеркнуть, что трактовка результатов проведенной химиотерапии затруднена, поскольку больные лечились в разное время, получали самые разнообразные схемы химиотерапии. Тем не менее, предварительные результаты анализа этих данных говорят о следующем.
Традиционные схемы химиотерапии с применением препаратов платины, блеомицина, этопозида, винбластина существенно влияют на выживаемость (рис. 1).
рРис. 1. Выживаемость больных с «чистой» незрелой тератомой яичников в зависимости от режима химиотерапии.
Выживаемость в группе смешанных опухолей была значительно хуже. У больных незрелой тератомой яичников в чистом виде выживаемость соответствовала 73,4%±8,5%, тогда как в группе больных незрелой тератомой в сочетании со злокачественными герминогенными и негерминогенными опухолями яичников — 24,2%±5,7%.
Выживаемость больных при рецидивах чистых незрелых тератом яичников существенно улучшается при комбинированном лечении, по сравнению с одной химиотерапией. Так, при применении комбинированного метода лечения 3-летняя выживаемость больных НТЯ с рецидивом заболевания составила 50%, тогда как при проведении только химиотерапии — 13,3%. Выявлено статистически значимое влияние размера остаточной опухоли на выживаемость (рис. 2).
рРис. 2. Выживаемость больных с чистой тератомой в зависимости от наличия остаточной опухоли.
Таким образом, наше исследование демонстрирует возможность изменения дифференцировки опухолевой ткани незрелых тератом яичников в разных направлениях: от созревания до анаплазии в течение определенного периода времени. Доказано возникновение в незрелой тератоме не только герминогенных злокачественных опухолей, но и новообразований иного гистогенеза (саркома, рак). Критически переосмыслена гипотеза о созревании злокачественных герминогенных опухолей через стадию незрелых тератом. Установлено, что прогноз указанной группы больных (незрелые тератомы яичников в сочетании с герминогенными и негерминогенными опухолями, так называемые «смешанные» тератомы яичников) мало чем отличается от прогноза у пациенток с герминогенными опухолями яичников без компонента незрелой тератомы. Обоснована целесообразность применения химиотерапии даже в тех случаях, когда прогрессирование процесса идет при морфологически дифференцированных структурах.
Критически переосмыслена гипотеза о созревании злокачественных герминогенных опухолей через стадию незрелых тератом. Установлено, что прогноз указанной группы больных (незрелые тератомы яичников в сочетании с герминогенными и негерминогенными опухолями, так называемые «смешанные» тератомы яичников) мало чем отличается от прогноза у пациенток с герминогенными опухолями яичников без компонента незрелой тератомы. Обоснована целесообразность применения химиотерапии даже в тех случаях, когда прогрессирование процесса идет при морфологически дифференцированных структурах.
Герминогенные опухоли (внечерепные) у детей и подростков
Иногда зародышевые клетки могут образовывать опухоли — их называют «герминогенные опухоли» (ГО). Они могут быть доброкачественными (не раковыми) или злокачественными (раковыми).
Поскольку зародышевые клетки начинают расти на очень ранних этапах развития плода, они иногда могут перемещаться в области за пределами яичника или яичка. Герминогенные опухоли могут появляться в различных частях тела:
- Яичники или яички (гонадные)
- Шея
- Областьмежду легкими (медиастинальные)
- Задняя часть брюшной полости (ретроперитонеальные)
- Нижняячасть позвоночника или копчик (крестец)
- Головной мозг (см.
 внутричерепные герминогенные опухоли)
внутричерепные герминогенные опухоли)
Внечерепные герминогенные опухоли — это все герминогенные опухоли, которые возникают за пределами головного мозга.Обычновнечерепные герминогенные опухоли формируются в репродуктивных органах (яичники или яички). Они называются гонадными герминогенными опухолями.
Зародышевые клетки также могут перемещаться за пределы репродуктивной системы и образовывать опухоли. Герминогенные опухоли, которые образуются за пределами яичников и яичек, называются внегонадными герминогенными опухолями. Около половины герминогенных опухолей образуются за пределами яичников и яичек. Эти опухоли обычно растут вдоль средней линии тела (его центра).
Герминогенные опухоли могут развиваться в любом возрасте, от младенчества до зрелости. Среди пациентов детского возраста они чаще всего встречаются у маленьких детей и подростков 15–19 лет. Эти опухоли составляют около 3% от всех случаев рака у детей.
Для лечения некоторых детей с герминогенной опухолью может быть достаточно только хирургической операции. Химиотерапия может использоваться в дополнение к хирургическому вмешательству для лечения заболевания на поздних стадиях или уменьшения размера опухоли перед операцией. Если опухоль может быть полностью удалена хирургическим путем, вероятность излечения очень высокая.
Химиотерапия может использоваться в дополнение к хирургическому вмешательству для лечения заболевания на поздних стадиях или уменьшения размера опухоли перед операцией. Если опухоль может быть полностью удалена хирургическим путем, вероятность излечения очень высокая.
Существует несколько типов герминогенных опухолей.
Доброкачественные опухоли мягких тканей
ФИБРОГИСТИОЦИТАРНЫЕ ОПУХОЛИ И ОПУХОЛЕПОДОБНЫЕ ПОРАЖЕНИЯ
Ксантома
Редкое заболевание, локализуется чаще в коже. Встречается у людей с нарушенным липидным обменом, обычно множественное. Локализуется также в сухожилиях. Представлено мелкими узелками, частью типа ксантелазм.
Юношеская ксантогранулема
Небольшой узелок в толще дермы или подкожной клетчатке. Исчезает спонтанно.
Фиброзная гистиоцитома
Чаще встречается в среднем возрасте, локализуется преимущественно на нижних конечностях. Обычно имеет форму плотного узла до 10см, растет медленно. После хирургического удаления рецидивы редки.
После хирургического удаления рецидивы редки.
ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ ЖИРОВОЙ ТКАНИ
Липома
Одна из самых частых доброкачественных опухолей (30—40%). Может возникнуть всюду, где есть жировая ткань. При локализации в дерме обычно инкапсулированная, в других участках тела слабо отграничена. Озлокачествляться могут опухоли, локализованные в забрюшинном пространстве, другие локализации практически не озлокачествляются. Липомы нередко бывают множественными, иногда развиваются симметрично. Рост их не связан с общим состоянием организма. Опухоль имеет форму узла дольчатого строения. При длительном существовании в липоме могут развиваться дистрофические изменения, обызвествление, оссификация.
Существуют многочисленные варианты зрелых жировых опухолей, которые отличаются от классической липомы как клиническими проявлениями, так и некоторыми морфологическими особенностями.
Миелолипома
Редкая опухоль, чаще встречается в забрюшинном пространстве, клетчатке малого таза, надпочечниках. Не озлокачествляется.
Не озлокачествляется.
Подкожная ангиолипома
Многочисленные болезненные узлы. Встречается чаще в молодом возрасте у мужчин на передней стенке живота, на предплечье.
Веретеноклеточная липома
Наблюдается чаще у взрослых мужчин (90%). Узел округлой формы, плотный, медленно растущий, чаще локализован в области плечевого сустава, спины. Рецидивы и метастазы после иссечения не описаны, несмотря на тот факт, что опухоль может инфильтрировать окружающие ткани.
В хондро- и остеолипомах выявляют метапластические участки костной и хрящевой ткани.
Доброкачественный липобластоматоз
Подразделяется на узловатую (добр. липобластома) и диффузную (добр. липобластоматоз) формы. Болеют чаще мальчики до 7 лет (88%). Опухоль локализуется на нижней конечности, в области ягодиц и на верхней конечности — надплечье и кисть. Описаны также поражение шеи, средостения, туловища. Опухолевый узел инкапсулированный, дольчатый, шаровидной формы, может достичь 14 см.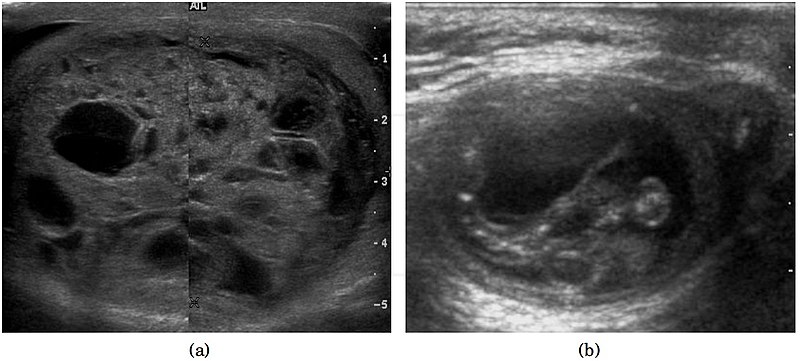 После хирургического лечения возможны рецидивы, иногда повторные. Метастазы не описаны.
После хирургического лечения возможны рецидивы, иногда повторные. Метастазы не описаны.
Гебернома (фетальная липома)
Липома из липобластов, псевдолипома — исключительно редкая опухоль, локализуется в местах, где имеется бурый жир (шея, аксилярная область, сина, средостение). Представлен дольчатым узлом обычно маленького размера. Не рецидивирует и не метастазирует.
ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ МЫШЕЧНОЙ ТКАНИ
Опухоли мышечной ткани делят на опухоли гладких мышц — лейомиомы, и поперечно полосатых — рабдомиомы. Опухоли встречаются достаточно редко.
Лейомиома
Зрелая доброкачественная опухоль. Возникает в любом возрасте у лиц обоих полов. Нередко бывает множественной. Опухоль может озлокачествляться. Лечение хирургическое.
Лейомиома, развивающаяся из мышечной стенки мелких сосудов — небольшие, часто множественные нечетко отграниченные и медленно растущие узлы, часто с изъязвленной кожей, клинически очень напоминает саркому Капоши.
Генитальная лейомиома образуется из мышечной оболочки мошонки, больших половых губ, промежности, сосков молочной железы. Может быть множественной. В опухоли нередко отмечается клеточный полиморфизм. Гормонозависимая. Лечение хирургическое.
Ангиолейомиома из замыкающих артерий
Клинически резко болезненная опухоль, которая при внешних воздействиях или эмоциях может менять размеры. Размеры обычно маленькие, чаще встречается у пожилых людей, на конечностях, вблизи суставов. Характеризуется медленным ростом и доброкачественным течением.
Рабдомиома
Редкая зрелая доброкачественная опухоль, имеет в своей основе поперечно полосатую мышечную ткань. Поражает сердце и мягкие ткани. Представляет собой умеренно плотный узел с четкими границами, инкапсулированная. Метастазов рабдомиомы не описано. Рецидивы крайне редки. Микроскопически различают 3 субтипа — миксоидный, феталный клеточный и взрослый. Выделяют также рабдомиому женских гениталий. Рецидивирует в основном взрослый тип.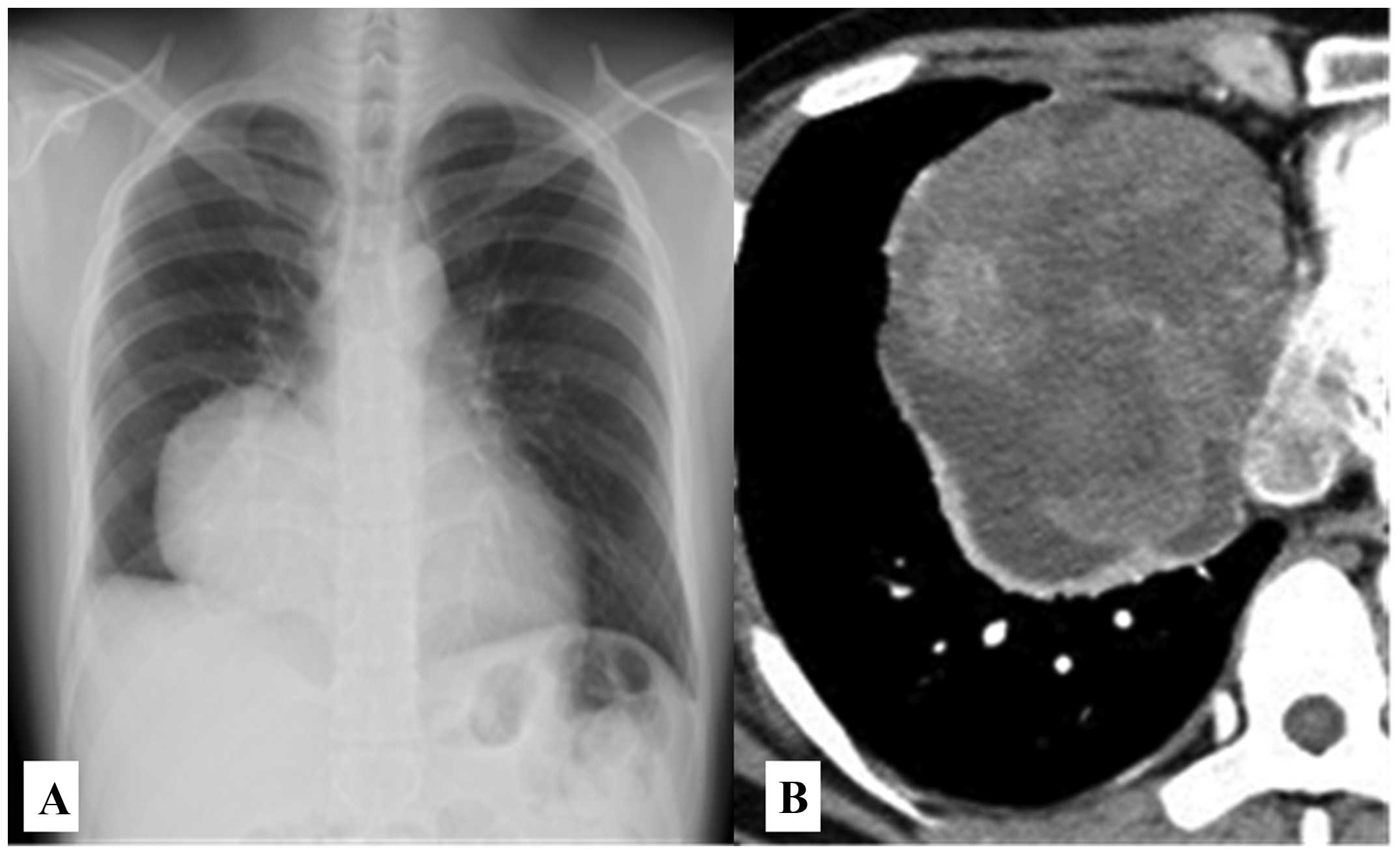
ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ КРОВЕНОСНЫХ И ЛИМФАТИЧЕСКИХ СОСУДОВ
Эти поражения включают в себя различные процессы, значительное число из них рассматриваются в дерматологии. Часть из них относится к порокам развития сосудистой системы опухолевидного характера, часть к истинным опухолям.
Капиллярная ангиома
Истинное новообразование с пролиферацией эндотелиальных клеток.
Доброкачественная гемангиоэндотелиома
Врожденная патология, встречается у новорожденных и грудных детей, чаще у девочек, с локализацией в области головы.
Капиллярная гемангиома
После липомы наиболее частая опухоль мягких тканей, часто бывает множественной, максимальной величины достигает к 6 месячному возрасту, при множественном поражении возможны локализации во внутренних органах
Кавернозная гемангиома
Образование, состоящее из причудливых полостей типа синусоид различной величины. Локализуется в коже, мышцах, внутренних органах. Имеет доброкачественное течение.
Имеет доброкачественное течение.
Старческая гемангиома
Истинная опухоль, характеризуется пролиферацией капилляров с последующей их кавернизацией с вторичными изменениями.
Гемангиома
Зрелая доброкачественная опухоль сосудистого происхождения, встречается часто. Поражает чаще людей среднего возраста, локализуется на слизистой оболочке носа, губы, на коже лица, конечностей, в молочной железе. Представляет собой четко отграниченный узел серовато-розового цвета 2—3 см. Опухоль нередко может озлокачествляться и перейти в ангиосаркому.
Артериальная ангиома
Конгломерат порочно развитых сосудов, не имеет признаков опухоли.
Гломангиома (гломусная опухоль, опухоль Барре—Массона)
Встречается в виде изолированной опухоли или в виде множественной диссеминированной семейной гломусангиомы. Опухоль доброкачественная, встречается у пожилых людей, в кистях и стопах, чаще в зоне ногтевого ложа. Может поражать кожу голени, бедра, лица, туловища. В единичных наблюдениях отмечена в почках, влагалище, костях. При локализации в коже опухоль резко болезненная. Не рецидивирует и не метастазирует.
В единичных наблюдениях отмечена в почках, влагалище, костях. При локализации в коже опухоль резко болезненная. Не рецидивирует и не метастазирует.
Гемангиоперицитома
Встречается редко, может возникнуть в любом возрасте. Локализуется в коже, реже в толще мягких тканей. Имеет вид отграниченного плотного узла красного цвета. Опухоль может озлокачествляться — давая рецидивы и метастазы, считается потенциально злокачественным процессом. Озлокачествление до 20% случаев описано у взрослых. Процесс у детей имеет доброкачественный характер.
Лимфангиома
Наблюдается чаще у детей как порок развития лимфатических сосудов, однако может встречаться в любом возрасте. Чаще локализуется на шее, слизистой полости рта.
ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ И ОПУХОЛЕПОДОБНЫЕ ЗАБОЛЕВАНИЯ СИНОВИАЛЬНОЙ ТКАНИ (СУСТАВОВ)
Доброкачественная синовиома без гигантских клеток
Существование доброкачественных синовиом обсуждается. Большинство авторов склоняется к тому, что все синовиомы являются злокачественными независимо от степени зрелости.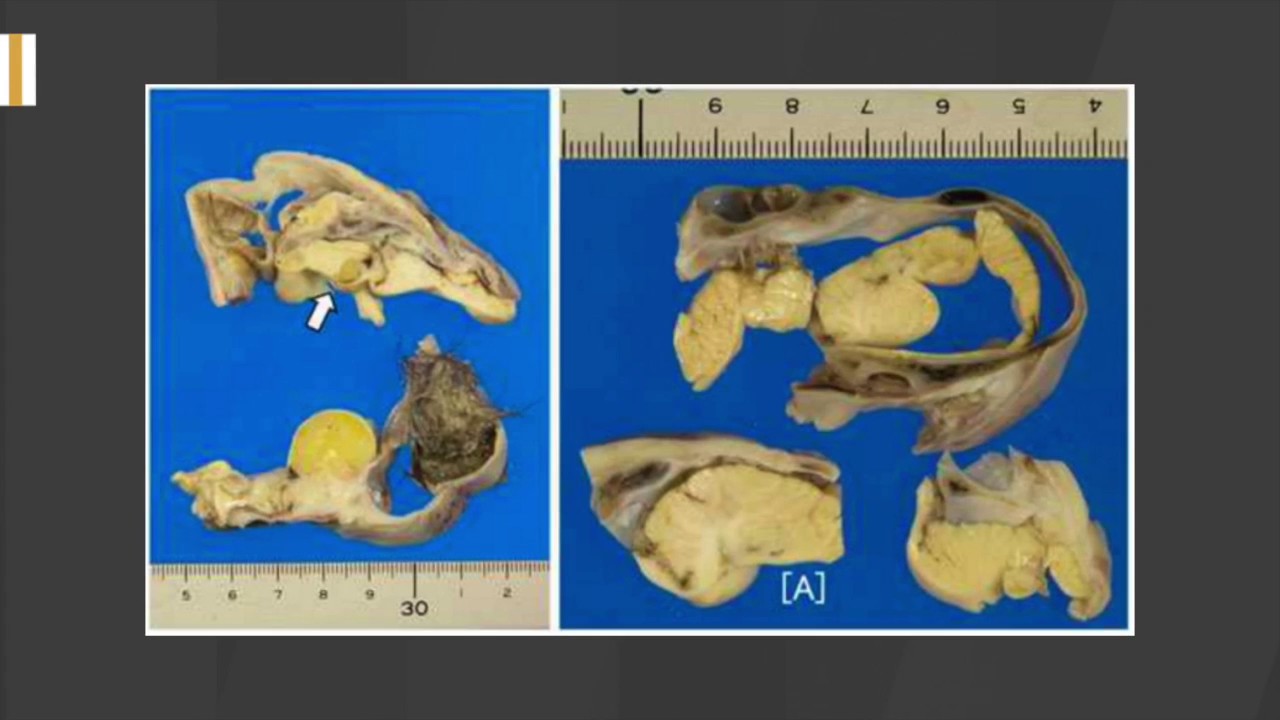 Опухоль поражает главным образом коленный сустав, в виде небольших плотных узлов. Лечение хирургическое, однако больные должны наблюдаться в течение 5—9 лет. Болезнь может дать рецидивы и метастазы.
Опухоль поражает главным образом коленный сустав, в виде небольших плотных узлов. Лечение хирургическое, однако больные должны наблюдаться в течение 5—9 лет. Болезнь может дать рецидивы и метастазы.
Доброкачественная гигантоклеточная синовиома (нодулярный тендосиновиит)
Псевдоопухолевый процесс, встречается достаточно часто. В 15% процесс возникает в области синовиальной оболочки суставов, в 80% — в сухожильных влагалищах, в 5% — в слизистых сумках. Представляет собой узловатое образование, чаще локализованное на пальцах кистей, реже стоп и еще реже в области крупных суставов. Излюбленная локализация — межфаланговые суставы. Чаще встречается у женщин 30—60 лет. При длительном существовании может вызвать атрофию окружающих тканей, в том числе и кости. Процесс часто рецидивиреут, большая часть рецидивов связана с неполным удалением. Метастазов не дает.
Пигментный виллонодулярный синовит
Располагается внутри оболочки суставов, чаще в зоне коленного локтевого и плечевого суставов. Встречается в среднем возрасте. Этиология не ясна.
Встречается в среднем возрасте. Этиология не ясна.
ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ ПЕРИФЕРИЧЕСКИХ НЕРВОВ
Травматическая или ампутационная неврома
Возникает как результат посттравматической гиперрегенерации нерва. Представляет собой небольшой болезненный узел.
Нейрофиброма
Одиночная, медленно растущая доброкачественная опухоль мезенхимальной оболочки нервного ствола любой локализации, но чаще всего развивается на седалищном нерве и межреберных нервах. Возникает у людей любого возраста. Клинически определяется в виде небольших размеров плотно-эластической консистенции с гладкой поверхностью опухолевого узла, при пальпации которого боль иррадирует по ходу нерва. Некоторые опухоли могут достигать больших размеров. Рост опухоли может происходить как к периферии от нерва, так и в толще нервного ствола, что выявляется при ее морфологическом исследовании.
Лечение хирургическое. Прогноз хороший. Особое заболевание — множественный нейрофиброматоз (болезнь Реклингхаузена), которое относится к группе диспластических процессов. Описаны случаи озлокачествления одной из множественных нейрофибром при этом заболевании.
Описаны случаи озлокачествления одной из множественных нейрофибром при этом заболевании.
Неврилеммома (невринома, шваннома)
Доброкачественная опухоль шванновской оболочки. Образуется по ходу нервных стволов. Бывает одиночной. Прогноз благоприятный.
Удаление кисты копчика — иссечение эпителиального копчикового хода
Что такое эпителиальный копчиковый ход?
Эпителиальный копчиковый ход (ЭКХ, киста копчика, дермоидная киста копчика, дермоидная фистула копчика, пилонидальный синус/ киста копчика, пилонидальная болезнь, эпителиальные погружения крестцово-копчиковой области) представляет собой канал шириной несколько миллиметров (или полость), выстланный кожей. Он относится к воспалительным заболеваниям кожи и подкожной клетчатки межъягодичной складки и крестцово-копчиковой области. Этот канал располагается в области между ягодиц, выше наружного отверстия заднего прохода (прямой кишки), он идет от кожи вглубь и слепо заканчивается в мягких тканях. Открывается, такой свищевой ход обычно на коже одним или несколькими точеными отверстиями и, иногда, содержит пучок волос. Отверстия эти могут длительное время быть незамеченными, так как часто не имеют никаких неприятных симптомов и только в случае развития воспаления привлекают внимание.
Открывается, такой свищевой ход обычно на коже одним или несколькими точеными отверстиями и, иногда, содержит пучок волос. Отверстия эти могут длительное время быть незамеченными, так как часто не имеют никаких неприятных симптомов и только в случае развития воспаления привлекают внимание.
Важно! При наличии в межъягодичной складке безболезненных отверстий без каких- либо дополнительных симптомов, заболевание называют бессимптомным ЭКХ (рис 1). Данная форма ЭКХ не нуждается в хирургическом лечении и требует лишь тщательного соблюдения элементарных правил гигиены самим пациентом и периодических осмотров проктологом.
Рисунок 1. Бессимптомное течение ЭКХ (стрелкой указано первичное отверстие без признаков воспаления)
При развитии воспалительной реакции, чему обычно предшествует закупорка наружного отверстия, эпителиальный копчиковый ход сначала проявляется болезненным уплотнением на коже в области межъягодичной складки (важно знать, что иногда, особенно при длительном отсутствии адекватного лечения, свищевые ходы могут приобретать причудливые формы и появляться за пределами указанной области (рис. 2).
2).
Рисунок 2. Редкая форма ЭКХ с наличием множественных свищей в перианальной области (стрелками указаны множественные вторичные свищевые отверстия, образовавшиеся в результате длительно существующей хронической формы заболевания)
Важно! Возникновение подобной формы возможно при несвоевременном и/или неадекватном хирургическом лечении.
При отсутствии адекватного лечения болезненные ощущения нарастают и уплотнение превращается в полноценный абсцесс (гнойник). Далее обычно существует три варианта развития заболевания:
- гнойник продолжает увеличиваться и заставляет обратиться к врачам в экстренном порядке;
- гнойник самостоятельно спонтанно дренируется в имеющийся свищевой ход, что проявляется истечением гноя в области межъягодичной складки. При этом болезненные ощущения и температура тела постепенно снижаются и пациент может расценить это, как излечение, и в дальнейшем не обратиться к врачу;
- кожа над гнойником разрушается острым воспалительным процессом и абсцесс самопроизвольно «прорывается» наружу.
 После опорожнения гнойного очага болезненные ощущения резко снижаются, температура тела нормализуется.
После опорожнения гнойного очага болезненные ощущения резко снижаются, температура тела нормализуется.
В последних двух случаях значительное облегчение состояния приводит многих пациентов к мысли об отсутствии необходимости дальнейшего лечения. Однако несмотря на то, что в большинстве случаев кожная рана со временем заживает, сама причина воспалительного процесса – гнойная полость с элементами внедрившегося волоса – сохраняется в мягких тканях, и создаются предпосылки для нового скопления гнойного отделяемого и процесс повторяется.Важно! При любом из вариантов течения заболевания необходимо, как можно раньше, обратиться к проктологу для оценки необходимости дальнейшего лечения и исключения более серьезных заболеваний данной области.
Почему образуется ЭКХ?
Долгое время механизм заболевания оставался загадкой для врачей, однако в 50-х годах прошлого столетия было найдено объяснение почему развивается данное заболевание, и оно до сих пор удивляет как молодых врачей, так и пациентов. Межьягодичная складка имеет несколько особенностей: она предрасположена к потливости, большую часть времени сдавлена нижним бельем и верхней одеждой, труднодосягаема для самостоятельного осмотра. При ходьбе между сведёнными ягодицами возникает своеобразный «насосный» эффект. Волос, попавший в межьягодичную складку, под действием этого эффекта внедряется в толщу кожного покрова, затем в подкожную клетчатку, где и образуется инфицированная полость (рис. 3). Это предрасполагает к развитию местного воспалительного процесса в межъягодичной складке, что облегчает возможность внедрения волос в толщу кожного покрова.
Межьягодичная складка имеет несколько особенностей: она предрасположена к потливости, большую часть времени сдавлена нижним бельем и верхней одеждой, труднодосягаема для самостоятельного осмотра. При ходьбе между сведёнными ягодицами возникает своеобразный «насосный» эффект. Волос, попавший в межьягодичную складку, под действием этого эффекта внедряется в толщу кожного покрова, затем в подкожную клетчатку, где и образуется инфицированная полость (рис. 3). Это предрасполагает к развитию местного воспалительного процесса в межъягодичной складке, что облегчает возможность внедрения волос в толщу кожного покрова.
а)
б)
в)
Рисунок 3. Механизм образования ЭКХ:
а. Схема движения ягодиц при ходьбе с формированием эффекта вакуумного насоса
б. Фотография начального этапа внедрения волоса в кожу межьягодичной складки
в. Схема развития воспалительного процесса (стрелкой указан абсцесс)
Какие основные симптомы заболевания? Как проявляется ЭКХ?
Примерно в половине случаев заболевание длительное время протекает бессимптомно. Единственным проявлением может быть наличие одного или нескольких отверстий или ямочек на коже межъягодичной складки, из которого иногда виден пучок волос.
Единственным проявлением может быть наличие одного или нескольких отверстий или ямочек на коже межъягодичной складки, из которого иногда виден пучок волос.
Важно! Отсутствие других симптомов часто является причиной позднего выявления заболевания, или выявления его, как случайной находки, при осмотрах по поводу других проблем.
В просвет кожного канала, сформированного ранее внедрением волоса, попадают микроорганизмы с поверхности кожи или из области заднего прохода, что неизбежно приводит к развитию хронического, рецидивирующего (повторяющегося) воспаления и формированию абсцесса.
- При воспалении ЭКХ наиболее часто возникают следующие симптомы:
- Боли в области крестца и копчика;
- Покраснение и уплотнение кожи в области межьягодичной складки или чуть с боку от нее;
- Кровянистые или гнойные выделения из отверстий эпителиального копчикового хода;
- Повышение температуры тела;
- Появление дополнительных (вторичных) отверстий вдоль или рядом с межъягодичной складкой;
- Выделения из дополнительно образовавшихся отверстий;
- Общая слабость;
- Невозможность вести обычную физическую и трудовую активность(рис.
 4).
4).
Рисунок 4. Абсцесс эпителиального копчикового хода (стрелками указаны первичные отверстия, расположенные в межъягодичной складке. Область предполагаемого абсцесса ограничена оранжевой линией)
Кто находится в группе риска развития ЭКХ?
Заболевание в 4 раза чаще возникает у мужчин, чем женщин. ЭКХ относится к группе не часто встречающихся болезней и выявляется лишь у 26 из 100.000 человек. В основном, болеют молодые люди трудоспособного возраста от 15 до 30 лет. По статистике, чаще всего ЭКХ встречается у арабов и кавказских народов, реже у афроамериканцев.
Факторами риска развития ЭКХ являются:
- избыточное оволосение
- избыточная масса тела
- недостаточное внимание к гигиене области копчика
- сидячий образ жизни
- ношение тесной и узкой одежды (штанов, юбок)
Что такое рецидив заболевания и как его избежать?
Еще одной формой заболевания является рецидив (повторное развитие) эпителиального копчикового хода, который возникает через некоторое время (от 1 года и более) после ранее перенесенного радикального хирургического лечения эпителиального копчикового хода.
Важно! В группе риска возникновения рецидива ЭКХ находятся как пациенты, которым ранее было выполнено оперативное вмешательство в недостаточном объеме, так и пациенты, у которых развилось нарушение процесса заживления послеоперационной раны.
В случае возникновения рецидива ЭКХ показано повторное хирургическое лечение, которое в свою очередь становится более сложным, в связи с развитием рубцового процесса в зоне вмешательства, увеличивается срок госпитализации, ухудшается косметический эффект.
Как диагностировать ЭКХ?
Диагноз эпителиальный копчиковый ход устанавливается после сопоставления данных, полученных от пациента и его осмотра с результатами инструментальных методов обследования. Вам необходимо будет подробно рассказать специалисту о том, когда появились первые жалобы, какие Вы замечали изменения в этой области до момента обращения, вспомнить были ли эпизоды нагноения и самопроизвольного вскрытия ЭКХ. Врач обязательно проведет осмотр межъягодичной складки и прилежащей ягодичной области. В некоторых случаях, при распространенном процессе или нетипичном течении заболевания может понадобиться пальцевое исследование прямой кишки. Отнеситесь с пониманием к этому простому исследованию, ведь нам важно, чтобы диагноз был установлен правильно.
В некоторых случаях, при распространенном процессе или нетипичном течении заболевания может понадобиться пальцевое исследование прямой кишки. Отнеситесь с пониманием к этому простому исследованию, ведь нам важно, чтобы диагноз был установлен правильно.
Инструментальные исследования оказывают большую помощь врачам в установке диагноза и определении степени распространенности процесса, особенно это касается абсцедирующего течения ЭКХ и рецидивных форм заболевания.
К инструментальным методам относятся:
1. УЗИ мягких тканей крестцово-копчиковой области. Этот метод диагностики позволяет оценить размеры, распространенность процесса, наличие связи между гнойными полостями, выявить глубоко расположенные абсцессы, определение которых при помощи осмотра и ощупывания этой области невозможно. УЗИ позволяет хирургу заранее определится с объемом оперативного вмешательства, спланировать методику закрытия кожного дефекта после удаления ЭКХ (рис.5).
Рисунок 5. УЗ-картина эпителиального копчикового хода в проекции межъягодичной складки
(при УЗ-исследовании мягких тканей, непосредственно под кожей, в толще подкожно-жировой клетчатки
определяется неоднородное образование размерами 25х32 мм с ровными четкими контурами с
включениями)
УЗ-картина эпителиального копчикового хода в проекции межъягодичной складки
(при УЗ-исследовании мягких тканей, непосредственно под кожей, в толще подкожно-жировой клетчатки
определяется неоднородное образование размерами 25х32 мм с ровными четкими контурами с
включениями)
2. Фистулография — введение в сформировавшийся ход контрастного вещества и выполнение рентгеновского исследования. Этот метод позволяет определить направление гнойных ходов, связь их с первичным ходом и позволяет хирургу также более детально спланировать операцию.
В некоторых сложных случаях могут понадобиться дополнительные обследования:
- Аноскопия — осмотр анального канала с помощью аноскопа — специального оптического прибора для безболезненного осмотра самого конечного отдела пищеварительного тракта. Данное исследование позволяет визуально оценить слизистую оболочку прямой кишки и анального канала. Аноскопия в большинстве случаев необходима для проведения дифференциальной диагностики ЭКХ с заболеваниями анального канала и прямой кишки.

- МРТ (магнитно-резонансная томография) органов малого таза – исследование, позволяющее получить детальное изображение интересующей области в различных проекциях, в частности малого таза и области крестца. Этот метод более дорогостоящий по сравнению с УЗИ, но позволяет точно поставить диагноз в сложных случаях ЭКХ, при рецидивах заболевания, наличии сочетанных заболеваний.
Дополнительные исследования помогут специалистам отличить сложные прямокишечные свищи от новообразований крестца и мягких тканей крестцово-копчиковой области, нарушений эмбрионального развития, в случае, если ультразвукового исследования будет недостаточно для установления диагноза (рис.6).
Рисунок 6. МРТ-изображение осложненного эпителиального копчикового хода (на МРТ в боковой проекции определяется изменение подкожно-жирового слоя на уровне крестца и копчика с образованием полости)
Как отличить ЭКХ от других заболеваний?
Некоторые другие заболевания могут иметь сходные с ЭКХ проявления, что требует проведения дифференциальной диагностики.
Фурункул
Фурункул представляет собой воспаление мягких тканей вокруг волосяного фолликула. Сначала появляется уплотнение и покраснение ткани вокруг волоса. Затем формируется стержень белого цвета, вокруг которого сохраняется зона гиперемии. Абсцесс ЭКХ может быть похож на фурункул, однако отличительной особенностью будет являться наличие первичных отверстий в межъягодичной складке (рис.7).
Рисунок 7. ЭКХ с формирующимся абсцессом ( стрелкой указано первичное отверстие. Зона формирующегося абсцесса ограничена оранжевой линией)
Прямокишечный свищ
Наружное свищевое отверстие чаще всего расположено на коже рядом с анусом (на перианальной коже). При наличии внутреннего свищевого отверстия, которое располагается в анальном канале, его можно определить с помощью пальцевого исследования прямой кишки или при фистулографии. При ЭКХ отсутствует связь хода с прямой кишкой, что подтверждается зондированием и или при МРТ-исследовании, а при наружном осмотре заметны первичные отверстия копчикового хода.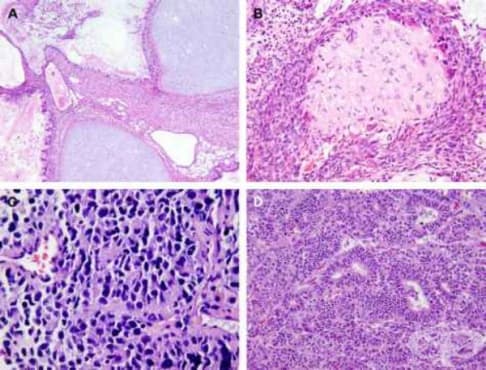
Пресакральная тератома
Пресакральные тератомы могут иметь так называемый эмбриональный ход, открывающийся на коже вблизи заднепроходного отверстия в виде эпителизированной воронки. Пресакральные тератомы располагаются между задней стенкой прямой кишки и передней поверхностью крестца, что можно установить при пальцевом исследовании. В то же время эпителиальный копчиковый ход располагается под кожей на задней поверхности крестца и копчика. Окончательным методом, позволяющим точно поставить диагноз в таких случаях должна быть МРТ.
Инфицированная рана
Простая инфицированная рана в интересующей области может возникнуть, если у пациента была травма крестцово-копчиковой области, операция по поводу свища прямой кишки или иссечение эпителиального копчикового хода. В этой ситуации также принципиальное значение имеет наличие первичных отверстий ЭКХ, данные о течении заболевания, наличие информации о каких-либо вмешательствах в указанной области.
Всегда ли нужно лечить ЭКХ?
Определяющим фактором в выборе способа лечения ЭКХ является форма заболевания. Случайно выявленная бессимптомная форма заболевания не требует сиюминутного срочного оперативного лечения. С целью профилактики развития острого воспаления пилонидальной кисты при бессимптомной форме заболевания необходимо проводить ежедневные гигиенические мероприятия, избегать травматических воздействий на область ЭКХ и ношения тесной и узкой одежды, удалить волосы (с помощью периодического бритья или эпиляции) в области межьягодичной борозды и ягодиц. Тем не менее, такие профилактические мероприятия не гарантируют отсутствие развития осложнений ЭКХ.
Случайно выявленная бессимптомная форма заболевания не требует сиюминутного срочного оперативного лечения. С целью профилактики развития острого воспаления пилонидальной кисты при бессимптомной форме заболевания необходимо проводить ежедневные гигиенические мероприятия, избегать травматических воздействий на область ЭКХ и ношения тесной и узкой одежды, удалить волосы (с помощью периодического бритья или эпиляции) в области межьягодичной борозды и ягодиц. Тем не менее, такие профилактические мероприятия не гарантируют отсутствие развития осложнений ЭКХ.
На начальных стадиях формирования абсцесса ЭКХ (стадия инфильтрации) когда только начинают появляться первые симптомы (нарастающая болезненность в области крестца и копчика, отек тканей в области межъягодичной складки, незначительное повышение температуры) возможно остановить воспалительный процесс применением антибиотиков и удалением внедрившегося пучка волос.
Важно! Даже если симптомы не носят выраженного характера и развиваются медленно, необходимо в кратчайшие сроки проконсультироваться у специалиста для исключения более опасных заболеваний и правильного планирования лечения!
Проведение лечения следует доверять только опытному специалисту, так как не всегда бывает просто найти грань между абсцессом (это состояние требует обязательного хирургического лечения!) и так называемым инфильтратом, когда хирургическое лечение неэффективно. Иногда визуального осмотра и пальпации бывает недостаточно для определения стадии воспалительного процесса. Тогда на помощь специалисту приходит ультразвуковое исследование мягких тканей, которое позволяет определить дальнейшую тактику лечения.
Иногда визуального осмотра и пальпации бывает недостаточно для определения стадии воспалительного процесса. Тогда на помощь специалисту приходит ультразвуковое исследование мягких тканей, которое позволяет определить дальнейшую тактику лечения.
Важно! Во всех более тяжелых случаях, при других формах заболевания, показано хирургическое лечение.
При возникновении острого абсцесса ЭКХ показано срочное хирургическое лечение, которое направлено в первую очередь на эвакуацию гноя и скорейшее облегчение состояния пациента.
Как избавиться от ЭКХ навсегда?
Основным радикальным методом лечения ЭКХ – то есть методом, направленным на полное удаление источника воспалительного процесса, является хирургический. В зависимости от распространенности заболевания выполняют различные виды оперативных вмешательств. Существует более 50 различных методик для лечения ЭКХ. Такое большое количество возможных способов хирургического лечения связано с тем, что в настоящее время отсутствует оптимальный способ, который можно было бы назвать «золотым стандартом» лечения для всех пациентов с ЭКХ. В каждом случае выбор техники оперативного вмешательства должен быть индивидуален: должны учитываться несколько факторов — клиническая картина заболевания, стадия заболевания и обширность поражения, возможность временного ограничения физической активности в послеоперационном периоде.
В каждом случае выбор техники оперативного вмешательства должен быть индивидуален: должны учитываться несколько факторов — клиническая картина заболевания, стадия заболевания и обширность поражения, возможность временного ограничения физической активности в послеоперационном периоде.
Важно! После некоторых операций будет необходимо строго избегать сидения в течение 2-3 недель для правильного заживления раны. Это необходимо учитывать при согласовании метода хирургического лечения с врачом. Врач всегда может предложить несколько альтернативных методик.
Выбрать лучший способ поможет сделать специалист, который владеет и использует в своей практике несколько наиболее эффективных методик.
Какая операция выполняется при возникновении абсцесса (острого нагноения) ЭКХ?
В случае развития острого абсцесса ЭКХ в большинстве случаев потребуется последовательное выполнение двух операций. Лечение гнойного очага ЭКХ следует проводить в специализированном колопроктологическом стационаре. Его основная цель обеспечить полноценную эвакуацию гнойного содержимого, купировать воспалительные явления в окружающих мягких тканях, предотвратить дальнейшее распространение гнойного процесса.
Его основная цель обеспечить полноценную эвакуацию гнойного содержимого, купировать воспалительные явления в окружающих мягких тканях, предотвратить дальнейшее распространение гнойного процесса.
Важно! Даже такой простой этап, как вскрытие абсцесса ЭКХ, может значительно усложнить второе (основное) хирургическое вмешательство при несоблюдении простых правил.
Разрез должен быть небольших размеров и располагаться как можно ближе к средней линии (межъягодичной складке). Во время второй операции рубец от ранее выполненного разреза необходимо будет удалить единым блоком с основным объемом ткани ЭКХ. Чем больше будет первичный рубец, тем больше тканей нужно будет удалить при второй операции. В тоже время, не следует делать слишком маленький разрез, так как залогом успешного выздоровления является адекватное дренирование гнойно-воспалительного очага (рис.8).
a)
б)
Рисунок 8. Этапы хирургического лечения абсцесса ЭКХ:
а) местная анестезия
б) разрез над местом наибольшей флюктуации и эвакуация гнойного отделяемого со взятием материала на определение микроорганизма, вызвавшего воспаление.
Правильно выполненное вскрытие абсцесса приводит к исчезновению боли, температуры и улучшению самочувствия. Однако окончательно воспалительные процессы (изменения в окружающих тканях) после первого этапа оперативного вмешательства (вскрытия и дренирования абсцесса ЭКХ) стихают обычно в течение 1-2 недель.
После успешного проведения первого этапа хирургического лечения, который будет сопровождаться уменьшением проявлений острого воспаления и, по сути, являться «симптоматической операцией», не менее важным является проведение второго этапа — радикальной операции, направленной на полное удаление пилонидальной кисты с пораженным участком кожи и подкожной жировой клетчатки и последующим пластическим этапом для достижения хорошего косметического результата.
Важно! При остром воспалении именно двухэтапное лечение является наиболее эффективным и быстро приводит к восстановлению трудоспособности. Несмотря на улучшения состояния после вскрытия и дренирования абсцесса ЭКХ, крайне необходимо провести вторую радикальную операцию, поскольку каждое последующее воспаление будет вовлекать в процесс все больше количество неизмененных тканей!
При незначительных размерах гнойного очага и высоком уровне профессионализма хирурга иногда возможно одноэтапное радикальное лечение острого ЭКХ.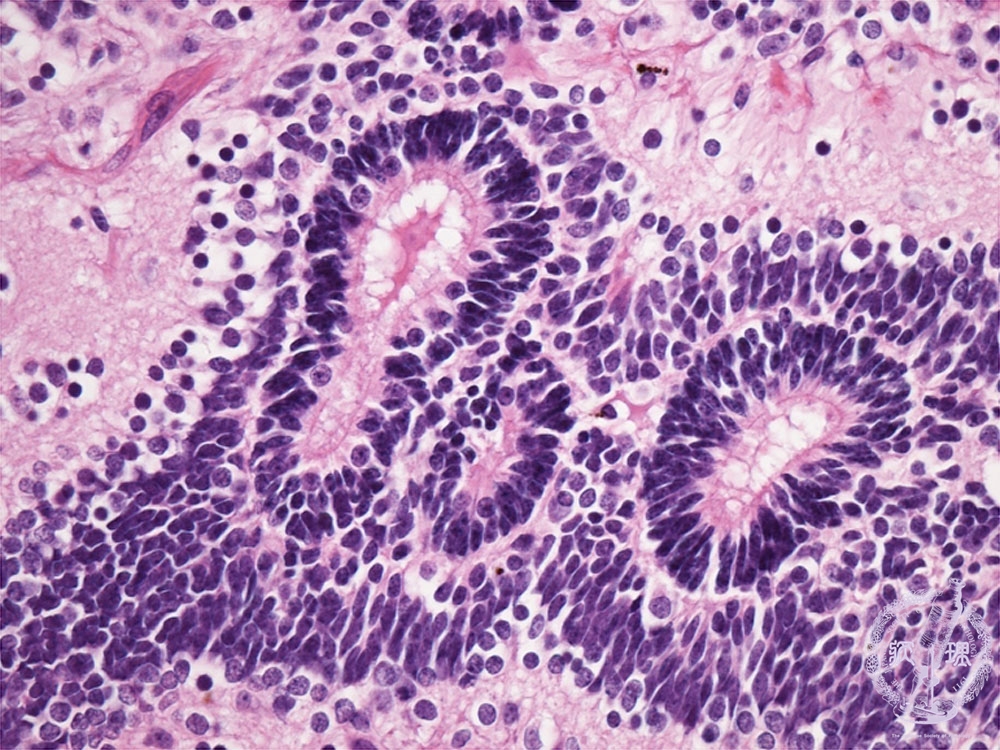
Длительно существующие воспалительные изменения приводят к стойкому болевому синдрому и длительным срокам нетрудоспособности, нарушению качества жизни, возникновению осложнений и рецидивов после второго этапа хирургического лечения, усложняют выполнение радикальной операции. Оптимально выполнять вторую (радикальную) операцию спустя 3-4 недели после вскрытия и дренирования абсцесса ЭКХ.
Какие операции выполняются при хронических и рецидивирующих формах ЭКХ?
В настоящее время существует большое количество различных радикальных операций для удаления ЭКХ, каждая из которых имеет свои преимущества и недостатки.
Все виды оперативных вмешательств можно разделить на 2 большие группы:
- Малоинвазивные методики.
- Радикальное хирургическое лечение с ушиванием раны наглухо.
Малоинвазивные методики
К малоинвазивным методикам относится, например, синсуэктомия и лазерная деструкция ЭКХ. Преимуществом данных методик является то, что после их выполнения не наступает значительного ограничения физической активности, возможен возврат к трудовой деятельности в тот же день после выполненного оперативного вмешательства.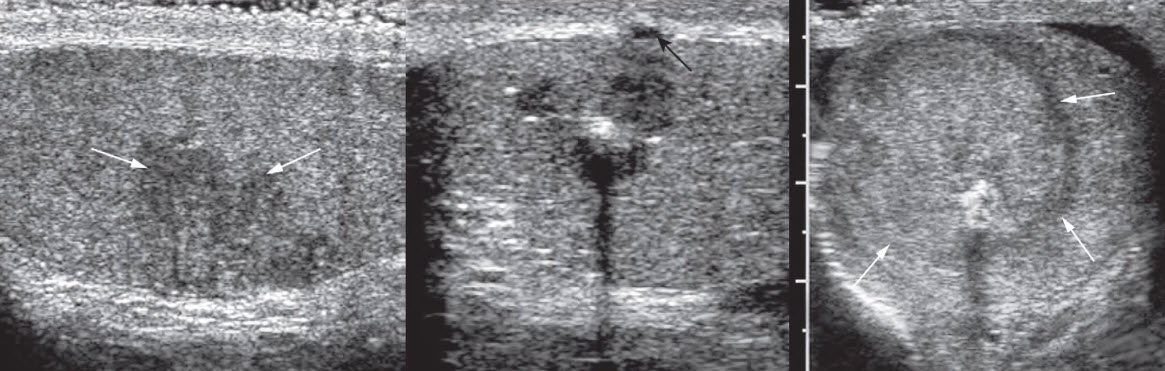 Недостатком является: возможность выполнения только при небольших размерах ЭКХ (выбор объема и возможности выполнения определяет врач после выполненного УЗИ).
Недостатком является: возможность выполнения только при небольших размерах ЭКХ (выбор объема и возможности выполнения определяет врач после выполненного УЗИ).
а) Синусэктомия
В случае наличия у пациента только первичных ходов, а так же при отсутствии затеков и дополнительных ходов или ответвлений, согласно дополнительным методам обследования возможно проведение малоинвазивной операции – синусэктомии. Эта операция подразумевает собой очень экономное иссечение эпителиальных ходов с помощью скальпеля с оставление кожных мостиков между первичными ходами. Это позволяет максимально быстро вернуться к работе, получив отличный косметический результат (рис.9).
a)
б)
Рисунок 9:
а) вид послеоперационной раны после синсуэктомии
б) внешний вид послеоперационного рубца после через 3 недели после синусэктомии
б) Лазерная абляция ЭКХ (диодный лазер)
Суть операции состоит в обработке первичных ходов ЭКХ при помощи лазера. Это позволяет разрушить ходы ЭКХ и предотвратить развитие осложнений этого заболевания. Для операции используется лазер с определенной длиной волны в непрерывном режиме. В ходы ЭКХ луч лазера доставляется с помощью светодиода (рис.10). Мощность лазера может составлять от 1,5 до 3 Вт. Общая длительность работы составляет от 5 до 25 минут и зависит от стадии болезни, длины копчикового хода. Благодаря способности концентрировать своё действие только на поражённых тканях, процедура является малоинвазивной, сопровождается минимальным болевым синдромом. Помимо этого, лазер обладает коагулирующим свойством, тем самым он позволяет минимизировать возможность возникновения кровотечения из затронутых сосудов.
Это позволяет разрушить ходы ЭКХ и предотвратить развитие осложнений этого заболевания. Для операции используется лазер с определенной длиной волны в непрерывном режиме. В ходы ЭКХ луч лазера доставляется с помощью светодиода (рис.10). Мощность лазера может составлять от 1,5 до 3 Вт. Общая длительность работы составляет от 5 до 25 минут и зависит от стадии болезни, длины копчикового хода. Благодаря способности концентрировать своё действие только на поражённых тканях, процедура является малоинвазивной, сопровождается минимальным болевым синдромом. Помимо этого, лазер обладает коагулирующим свойством, тем самым он позволяет минимизировать возможность возникновения кровотечения из затронутых сосудов.
Рисунок 10. Лазерная абляция ходов ЭКХ
Радикальное хирургическое иссечение с ушиванием раны наглухо
Такая операция, пожалуй, самая распространенная в России, предполагает более обширное иссечение эпителиального синуса/хода с пластикой дефекта местными тканями. Существует множество мнений о том, насколько эта операция эффективна и безопасна. В руках опытного хирурга, как правило, вероятность рецидива при данном виде вмешательства не превышает 3-5% и легко переносится пациентами. Основным отрицательным моментом данной технологии является необходимость ограничить подвижность и исключить сидение после операции на период от нескольких дней о нескольких недель.
Существует множество мнений о том, насколько эта операция эффективна и безопасна. В руках опытного хирурга, как правило, вероятность рецидива при данном виде вмешательства не превышает 3-5% и легко переносится пациентами. Основным отрицательным моментом данной технологии является необходимость ограничить подвижность и исключить сидение после операции на период от нескольких дней о нескольких недель.
Вид оперативного вмешательства окончательно определяется после осмотра и получения результатов УЗИ мягких тканей крестцово-копчиковой области и, в случае необходимости, дополнительных методов обследования.
Основные современные модификации радикального лечения ЭКХ:
1. Иссечение ЭКХ с перемещением кожно-фасциально-мышечных лоскутов
В нашей клинике разработана авторская методика (патент), предполагающая создание фасциально-мышечных лоскутов для закрытия послеоперационной раны. Суть методики заключается в перемещении собственных мягких тканей и создании прочного фасциального каркаса (фасция – прочная оболочка, покрывающая мышцы нашего организма) в области вмешательства, что снижает подвижность краев раны, ускоряя заживление. Именно натяжение и чрезмерная нагрузка на послеоперационную рану — основной фактор неудовлетворительных результатов лечения. Эта методика позволяет добиться максимально быстрого восстановления больного при минимальных разрезах кожи, низкой частоты осложнений и хорошего косметического результата, так как послеоперационный рубец располагается в межъягодичной складке и остается практически незаметным после операции (рис.11).
Именно натяжение и чрезмерная нагрузка на послеоперационную рану — основной фактор неудовлетворительных результатов лечения. Эта методика позволяет добиться максимально быстрого восстановления больного при минимальных разрезах кожи, низкой частоты осложнений и хорошего косметического результата, так как послеоперационный рубец располагается в межъягодичной складке и остается практически незаметным после операции (рис.11).
а)
б)
в)
Рисунок 11:
а) первичные отверстия ЭКХ, расположенные в межъягодичной складке
б) вид раны после иссечения ЭКХ с последующим выполнением пластики кожно-фасциальными лоскутами (наложены единичные узловые швы на рану. Послеоперационный рубец расположен в межъягодичной борозде, что обеспечивает хороший косметический эффект)
в) вид послеоперационного рубца через 3 недели после операции
2. Операция по иссечению ЭКХ с пластикой по Каридакису
Операция по иссечению ЭКХ с пластикой по Каридакису В 1976 году армейский хирург G.E.Karydakis предложил технику операции для радикального лечения эпителиального копчикового хода. Суть операции заключалась в том, что радикальное иссечение всех пораженных тканей происходит из разреза, несколько смещенного от срединной линии, расположенного рядом с межъягодичной бороздой. Операция сопровождается небольшим процентом рецидивов и послеоперационных осложнений. Однако ее недостатком является наличие послеоперационного рубца вне ягодичной борозды, что обеспечивает худший косметический дефект (рис.12).
Рисунок 12. Схема выполнения операции по иссечению ЭКХ с пластикой по Каридакису
3. Операция по иссечению ЭКХ с пластикой по Баском
Американский хирург Джон Баском предложил два вида операции при различных стадиях заболевания: при наличии острого воспаления ЭКХ — Bascom I и для радиального лечения заболевания — Bascom II. Радикальная операция, предложенная автором одна из наиболее спорных в лечении ЭКХ. Методика предполагает удаление только незначительных участков кожи (с сохранением подкожной клетчатки), содержащей первичные отверстия ЭКХ. Иссечение же крупной пилонидальной кисты при ее наличии выполняется из разреза, выполненного в стороне от срединной складки.
Радикальная операция, предложенная автором одна из наиболее спорных в лечении ЭКХ. Методика предполагает удаление только незначительных участков кожи (с сохранением подкожной клетчатки), содержащей первичные отверстия ЭКХ. Иссечение же крупной пилонидальной кисты при ее наличии выполняется из разреза, выполненного в стороне от срединной складки.
Рисунок 13. Схема операции по иссечению ЭКХ с пластикой по Баском
4. Марсупилизация
Еще одной, ранее популярной, методикой хирургического лечения ЭКХ является метод марсупилизации, который предполагает иссечение свищевого хода единым блоком с кожей и подкожно-жировой клетчаткой с последующим подшиванием кожных краев ко дну раны. Однако, в настоящее время данная методика практически не используется в связи с длительным реабилитационным периодом и неудовлетворительными косметическими результатами (рис 14).
Кожная пластика после радикального хирургического лечения ЭКХ
Основной проблемой заживления раны после иссечения ЭКХ является наличие широкого дефекта мягких тканей. Подкожная клетчатка в области крестца плотно фиксирована к подлежащему апоневрозу и фасциям, поэтому при закрытии дефекта оставшимися мягкими тканями создается натяжение, что сопровождается в послеоперационном периоде высоким риском расхождения краев раны, длительным заживлением.
Подкожная клетчатка в области крестца плотно фиксирована к подлежащему апоневрозу и фасциям, поэтому при закрытии дефекта оставшимися мягкими тканями создается натяжение, что сопровождается в послеоперационном периоде высоким риском расхождения краев раны, длительным заживлением.
Проблема закрытия образовавшегося дефекта местными тканями с пластикой кожными лоскутами особенно важна при хронических и рецидивирующих формах заболевания.
Существуют различные формы и виды кожно-подкожных лоскутов (Z, V-Y- образных, Limberg-flap) для закрытия дефекта, возникшего после удаления ЭКХ. Возможность и необходимость применения того или иного вида пластики определяет врач на основании данных осмотра, особенностей операции, объема удаленных тканей, желания пациента.
Рисунок 14. Варианты закрытия послеоперационного раневого дефекта после иссечения ЭКХ:
а) пластика по Лимбергу
б) Z-образная пластика
Как правильно выбрать клинику и хирурга для лечения в моем случае?
Подводя итог обзора хирургических методов лечения следует сказать, что выбор вида операции несомненно является прерогативой хирурга, однако сегодня это решение принимается совместно с пациентом. При обсуждении плана оперативного вмешательства (объема оперативного вмешательства) конкретно в Вашем случае, хирург должен предложить Вам различные современные инструменты( приспособления), необходимые при операции, рассказав при этом преимущества и недостатки их использования. Если в разговоре с Вами хирург не пытается обсудить разные подходы к лечению конкретно Вашего ЭКХ, а предлагает безальтернативный метод, то это зачастую свидетельствует о том, что в его арсенале нет места другим методикам.
При обсуждении плана оперативного вмешательства (объема оперативного вмешательства) конкретно в Вашем случае, хирург должен предложить Вам различные современные инструменты( приспособления), необходимые при операции, рассказав при этом преимущества и недостатки их использования. Если в разговоре с Вами хирург не пытается обсудить разные подходы к лечению конкретно Вашего ЭКХ, а предлагает безальтернативный метод, то это зачастую свидетельствует о том, что в его арсенале нет места другим методикам.
В такой ситуации Вы вправе обратиться к другому врачу за «вторым» мнением. Необходимо особенно тщательно подходить к выбору как хирурга, так и учреждения для хирургического лечения в случае, когда имеется места сложный или рецидивный ЭКХ, когда лечение часто сопряжено в обширным иссечением тканей в области крестца.
Как нужно подготовиться к операции?
Накануне вечером перед госпитализацией в стационар для хирургического лечения необходимо выполнить бритье крестцово-копчиковой и, в случае необходимости, ягодичной области. Возможен вариант выполнения лазерной (александритовым или диодным лазером) или фотоэпиляции за несколько дней до госпитализации. Однако, последние два метода малоэффективны для удаления светлых волос. Еще одним методом удаления волос является электроэпиляция, она отличается большей болезненностью, но подходит для всех типов волос. Эффект после процедур, возможно, будет достигнут не сразу, поэтому лучше их выполнять заранее — за 14 дней до операции. Бритье, как альтернатива эпиляции, займет у Вас меньше времени и средств, но в тоже время возможны повреждения кожи, которые могут стать источником инфекции. Другой специальной подготовки к операции не требуется, достаточно будет отказаться от приема пищи и жидкостей за 8 часов до операции.
Возможен вариант выполнения лазерной (александритовым или диодным лазером) или фотоэпиляции за несколько дней до госпитализации. Однако, последние два метода малоэффективны для удаления светлых волос. Еще одним методом удаления волос является электроэпиляция, она отличается большей болезненностью, но подходит для всех типов волос. Эффект после процедур, возможно, будет достигнут не сразу, поэтому лучше их выполнять заранее — за 14 дней до операции. Бритье, как альтернатива эпиляции, займет у Вас меньше времени и средств, но в тоже время возможны повреждения кожи, которые могут стать источником инфекции. Другой специальной подготовки к операции не требуется, достаточно будет отказаться от приема пищи и жидкостей за 8 часов до операции.
Что делать в послеоперационном периоде?
Период времени, требующийся для полного восстановления после операции как правило не больше 3 недель, однако в редких случаях может достигать 1 – 3 месяца. Продолжительность периода нетрудоспособности редко превышает 21 день, а применение современных хирургических технологий позволяет перевести оперированного пациента на амбулаторный режим долечивания уже на 1-2 сутки после операции. Вам нужно быть готовым в тому, что после операции в области послеоперационной раны на несколько дней будет установлен дренаж для активного удаления, отделяемого из раны в течение нескольких дней. В стационаре, а затем на амбулаторном этапе Вам будут выполняется перевязки для контроля заживления раны. Лечащий врач и медицинский персонал подробно расскажет, какого режима труда и отдыха следует придерживаться в ближайшем послеоперационном периоде. В редких случаях на несколько дней будут назначены антибактериальные препараты. Также может потребоваться контроль заживления раны с помощью ультразвукового исследования.
Вам нужно быть готовым в тому, что после операции в области послеоперационной раны на несколько дней будет установлен дренаж для активного удаления, отделяемого из раны в течение нескольких дней. В стационаре, а затем на амбулаторном этапе Вам будут выполняется перевязки для контроля заживления раны. Лечащий врач и медицинский персонал подробно расскажет, какого режима труда и отдыха следует придерживаться в ближайшем послеоперационном периоде. В редких случаях на несколько дней будут назначены антибактериальные препараты. Также может потребоваться контроль заживления раны с помощью ультразвукового исследования.
Существуют ли способы профилактики рецидивов/повторов заболевания?
Несмотря на радикальность проводимых операций, всегда остается риск развития рецидива заболевания. Для снижения этого риска рекомендуется:
- соблюдение правил личной гигиены и особенностей ухода за послеоперационной раной, которые будут озвучены медицинским персоналом;
- бритье крестцово-копчиковой области в течение 3 месяцев после операции;
- ограничение сидения в течение 2 недель и интенсивных физических нагрузок в течение 2 месяцев после операции.

- своевременные визиты к лечащему врачу в ранние послеоперационные сроки
Page 14 — pdf_publisher2_project
Page 14 — pdf_publisher2_project№ 4. 2014 г. Журнал «Паллиативная медицина и реабилитация»
Лечение больных с семиномой/дисгерминомой дает лучшие результаты, чем у больных с другими герми-ногенными опухолями. Другой морфологической особенностью герминогенных опухолей гонад явля-ется рост опухоли внутри пораженного органа с наличием хорошо выраженной капсулы. Этим гер-миногенные опухоли яичника отличаются от рака яичника, при котором процесс идет по поверхности пораженного органа, и появлением опухолевых кле-ток в брюшной полости уже при I стадии процесса. У больных с герминогенными опухолями яичников имеются и другие клинические особенности. Так, при анализе больных с I стадией опухоли желточного мешка яичника в 84% случаев выявляются субклини-ческие метастазы (25). Следовательно, для решения вопроса об определении стадии процесса и возмож-ности проведения только хирургического лечения необходимо рассматривать и другие показатели. При определении тактики лечения девочки с незрелой тератомой яичника следует учитывать, кроме стадии процесса, степень дифференцировки опухолевых клеток (G). При дифференцировке G3 только после хирургического удаления опухоли рецидивы наблю-даются в 70% случаев (36). При III степени злокаче-ственности опухоли живы в течение 5 лет только 25% больных с незрелыми тератомами. Следует помнить, что тератоидные опухоли разной степени злокаче-ственности могут быть в составе смешанных герми-ногенных опухолей. Доля тератоидных опухолей в составе смешанных составляет 78,24%, причем 47% составляют опухоли, имеющие G III (19). Кроме того, установлено, что незрелая тератома G III не является «чистой» опухолью, в 83% случаев имеет в своем составе микроскопические фокусы опухоли желточного мешка, что является фактором рецидива заболевания (5).
Следовательно, для решения вопроса об определении стадии процесса и возмож-ности проведения только хирургического лечения необходимо рассматривать и другие показатели. При определении тактики лечения девочки с незрелой тератомой яичника следует учитывать, кроме стадии процесса, степень дифференцировки опухолевых клеток (G). При дифференцировке G3 только после хирургического удаления опухоли рецидивы наблю-даются в 70% случаев (36). При III степени злокаче-ственности опухоли живы в течение 5 лет только 25% больных с незрелыми тератомами. Следует помнить, что тератоидные опухоли разной степени злокаче-ственности могут быть в составе смешанных герми-ногенных опухолей. Доля тератоидных опухолей в составе смешанных составляет 78,24%, причем 47% составляют опухоли, имеющие G III (19). Кроме того, установлено, что незрелая тератома G III не является «чистой» опухолью, в 83% случаев имеет в своем составе микроскопические фокусы опухоли желточного мешка, что является фактором рецидива заболевания (5). Учитывая это, Li H. с соавторами (26) утверждают, что проведение только хирургиче-ского вмешательства у данной группы больных ведет к ухудшению результатов лечения. Однако другие исследователи предлагают не обращать внимания на степень дифференцировки клеток незрелой терато-мы и химиотерапию проводить в случае рецидива заболевания (11).
Учитывая это, Li H. с соавторами (26) утверждают, что проведение только хирургиче-ского вмешательства у данной группы больных ведет к ухудшению результатов лечения. Однако другие исследователи предлагают не обращать внимания на степень дифференцировки клеток незрелой терато-мы и химиотерапию проводить в случае рецидива заболевания (11).
Незрелая тератома значительно чаще определяет-ся при поражении опухолью яичника, а не яичка (5). Еще одной отличительной особенностью тератоид-ных опухолей яичника от подобных опухолей яичка является обнаружение во время операции у 30% больных глиоматоза брюшины (30). Это значительно отличается от данных других авторов, которые утвер-ждали, что глиоматоз – редкое явление Однозначно высказаться о влиянии глиоматоза брюшины на течение опухолевого процесса сложно. Многие авто-ры считают, что глиоматоз брюшины не является неблагоприятным признаком заболевания и не тре-бует дополнительного лечения (22, 39). Nielsen S.N. с соавторами (35) считают, что наличие глиоматоза
предполагает более благоприятный прогноз, однако эти же авторы подтверждают возможность прогресси-рования тератомы по брюшине. Авторы предлагают вести поиск, кроме клеток глии, тератоидных элемен-тов в данных имплантантах. Наличие тератоидных элементов отрицательно сказывается на прогнозе заболевания. Nagashima K. с соавторами еще в 1974 г. (32) описали возможность злокачественного пораже-ния брюшины после удаления кистозной тератомы яичника с глиоматозом брюшины.Злокачественная трансформация глиоматоза брюшины наблюдается, как правило, через 7 и более лет. Иногда этот диагноз ставится после повторной лапаротомии и удаления рецидивирующей опухоли брюшной полости (51). Mengshoi S.C. с соавторами (31) описывают случай прогрессирования болезни через 54 года после удале-ния дермоидной кисты. Современные исследования (54) подтверждают значительное снижение 2-летней безрецидивной выживаемости у больных с незрелой тератомой и наличием глиоматоза брюшины по срав-нению с больными, у которых глиоматоз брюшины отсутствовал (59,3% и 96,3% соответственно). Авторы утверждают, что глиоматоз брюшины – важный про-гностический фактор, влияющий на частоту рециди-вов у больных с незрелыми тератомами яичника, но не оказываюший значительного влияния на общую выживаемость больных с незрелыми тератомами.
Авторы предлагают вести поиск, кроме клеток глии, тератоидных элемен-тов в данных имплантантах. Наличие тератоидных элементов отрицательно сказывается на прогнозе заболевания. Nagashima K. с соавторами еще в 1974 г. (32) описали возможность злокачественного пораже-ния брюшины после удаления кистозной тератомы яичника с глиоматозом брюшины.Злокачественная трансформация глиоматоза брюшины наблюдается, как правило, через 7 и более лет. Иногда этот диагноз ставится после повторной лапаротомии и удаления рецидивирующей опухоли брюшной полости (51). Mengshoi S.C. с соавторами (31) описывают случай прогрессирования болезни через 54 года после удале-ния дермоидной кисты. Современные исследования (54) подтверждают значительное снижение 2-летней безрецидивной выживаемости у больных с незрелой тератомой и наличием глиоматоза брюшины по срав-нению с больными, у которых глиоматоз брюшины отсутствовал (59,3% и 96,3% соответственно). Авторы утверждают, что глиоматоз брюшины – важный про-гностический фактор, влияющий на частоту рециди-вов у больных с незрелыми тератомами яичника, но не оказываюший значительного влияния на общую выживаемость больных с незрелыми тератомами. Незрелые тератомы яичников с глиоматозом брюши-ны имеют большие размеры по сравнению с незрелы-ми тертомами без глиоматоза (19 см в диаметре по сравнению с 13 см).
Незрелые тератомы яичников с глиоматозом брюши-ны имеют большие размеры по сравнению с незрелы-ми тертомами без глиоматоза (19 см в диаметре по сравнению с 13 см).
Таким образом, лечение пациентов с незрелой тератомой яичника определяется не только стадией процесса, но и степенью незрелости первичной опу-холи, наличием глиоматоза брюшины и размерами опухоли. Если в имплантантах брюшины обнаруже-ны незрелая глиальная ткань или компоненты тера-тоидной опухоли, лечение должно проводиться по плану лечения метастатической незрелой тератомы яичника. Дети с тератомой яичника и глиоматозом брюшины требуют длительного наблюдения, так как возможны поздние рецидивы заболевания со злока-чественной трансформацией глиальных компонен-тов на брюшине (13, 15). Данные осложнения прак-тически отсутствуют у больных с незрелыми терато-мами яичка, так как нет диссеминации процесса по брюшине, т.е. условия лечения детей с незрелыми тератомами яичка значительно лучше.
Следовательно, дети с различными по своему мор-фологическому строению опухолями гонад и локали-зацией поражения имеют разный прогноз и должны получать лечение с учетом рисков течения опухоле-вого процесса. Значение имеет поиск дополнитель-ной информации при морфологическом исследова-нии удаленной опухоли. Степень митотической активности клеток, сосудистая инвазия, зоны некро-зов – все имеет значение для определения прогноза.
Значение имеет поиск дополнитель-ной информации при морфологическом исследова-нии удаленной опухоли. Степень митотической активности клеток, сосудистая инвазия, зоны некро-зов – все имеет значение для определения прогноза.
Публикации в СМИ
ТЕРАТОМЫ состоят из структур, не свойственных той части тела, где расположены подобные образования.
Типы • Эпидермоидные кисты возникают чаще других тератом. Они выстланы многослойным плоским эпителием, добавочных структур, как правило, не содержат • Дермоидные кисты — полости, покрытые многослойным эпителием и содержащие придатки кожи (например, волосы, железистую ткань) • Тератоидные кисты выстланы эпителием и заполнены сыроподобной массой. Голова и шея — редкая их локализация.
Тератомы на шее обычно диагностируют сразу после рождения, редко — после первого года жизни • Характеристика •• Размер образования — обычно 5–12 см в наибольшем измерении, содержимое полужидкое, иногда плотное •• У детей с шейными дермоидами обычны стридорозное дыхание, удушье и цианоз вследствие сдавления или смещения трахеи. Возможна дисфагия •• У некоторых детей симптомов при рождении нет, но они возникают через несколько недель или месяцев • Лечение — удаление тератом в раннем детстве.
Возможна дисфагия •• У некоторых детей симптомов при рождении нет, но они возникают через несколько недель или месяцев • Лечение — удаление тератом в раннем детстве.
Малигнизированные тератомы на шее редки, чаще возникают у взрослых. Прогноз крайне неблагоприятный.
СОСУДИСТЫЕ ОПУХОЛИ
Гемангиома — наиболее распространённая опухоль головы и шеи у детей. Девочки страдают чаще мальчиков. Поражение обычно единичное.
• Типы гемангиом •• Капиллярные гемангиомы ••• Редко возникают у взрослых ••• Могут появляться внезапно и достигать больших размеров, после чего нередко регрессируют •• Кавернозные гемангиомы более постоянны в размерах. Спонтанный регресс чаще претерпевают гемангиомы, выявленные при рождении, чем возникшие позже •• Артериовенозные гемангиомы возникают исключительно у взрослых, избирательно поражают губы и кожу области рта •• Инвазивные гемангиомы расположены в глубоких подкожных тканях, фасциальных прослойках и мышцах ••• Выглядят как инфильтраты на шее, чаще возникают у детей ••• Имеют тенденцию к рецидивированию после удаления, но не метастазируют ••• Чаще поражают жевательную и трапециевидную мышцы ••• Внутримышечные гемангиомы обычно обнаруживают в юношеском возрасте.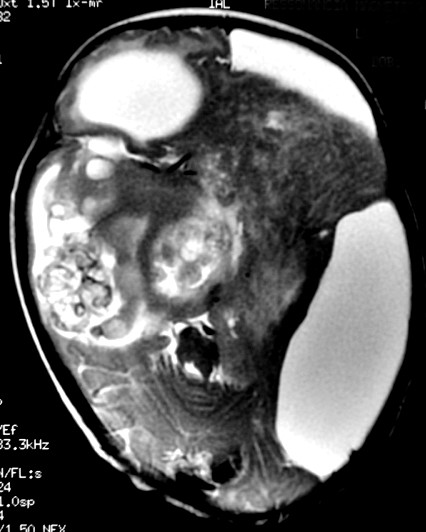 При пальпации они подвижные и плотные. Как правило, над ними нет шума и пульсации. Часто возникает болевой синдром вследствие сдавления близлежащих структур •• Подъязычные гемангиомы обычно относят к капиллярному типу. Могут обусловить возникновение стридорозного дыхания сразу при рождении или вскоре после него. Часто спаяны с кожей.
При пальпации они подвижные и плотные. Как правило, над ними нет шума и пульсации. Часто возникает болевой синдром вследствие сдавления близлежащих структур •• Подъязычные гемангиомы обычно относят к капиллярному типу. Могут обусловить возникновение стридорозного дыхания сразу при рождении или вскоре после него. Часто спаяны с кожей.
• Лечение •• Врождённые гемангиомы кожи. При отсутствии быстрого роста показана выжидательная тактика ••• Когда ребёнок достигает школьного возраста, возможно удаление образований, вызывающих косметические дефекты ••• При лечении кожных поражений обнадёживающие результаты даёт лазерная терапия, криодеструкция •• Подъязычные поражения. Назначают ГК, реже производят иссечение лазером или трахеостомию •• При распространённых поражениях необходима операция. Великолепные результаты даёт суперселективная эмболизация питающих гемангиому сосудов и последующая терапия сверхвысокочастотными токами.
Кисты-гигромы ведут себя как опухоли. Их обнаруживают в большинстве случаев на шее, чаще при рождении или вскоре после него.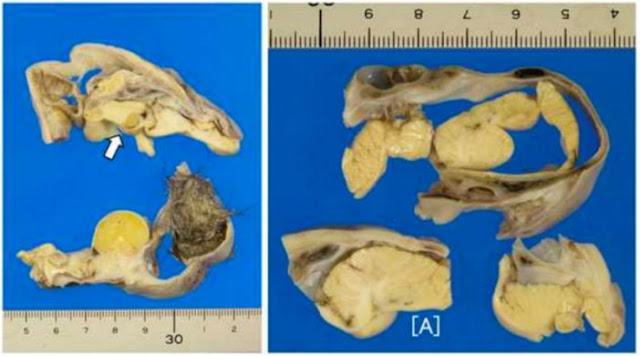
• Анатомия. Излюбленная локализация — лопаточно-трапециевидный треугольник шеи •• Сверху они могут достигать щеки или околоушной области, а снизу — средостения или подмышечной области •• Возможно распространение больших образований за грудино-ключично-сосцевидной мышцей на передний отдел шеи (вплоть до распространения на противоположную сторону) •• Возможно вовлечение дна ротовой полости и корня языка.
• Клиническая картина •• Сложности при грудном вскармливании •• Деформации лица или шеи •• Нарушения дыхания •• Признаки сдавления плечевого сплетения: боль и гиперестезия •• Иногда происходит внезапное увеличение размера кисты при спонтанном кровоизлиянии в неё.
• Характеристика •• Гигромы могут прогрессировать, оставаться неизменными или регрессировать •• Малые поражения бывают однокамерными и плотными •• Большие опухоли обычно многокамерные, подвижные, их можно сдавить •• Стенки кист напряжены. Поскольку камеры имеют тенденцию к объединению, разрыв стенки одной из них приводит к частичному коллабированию остальных.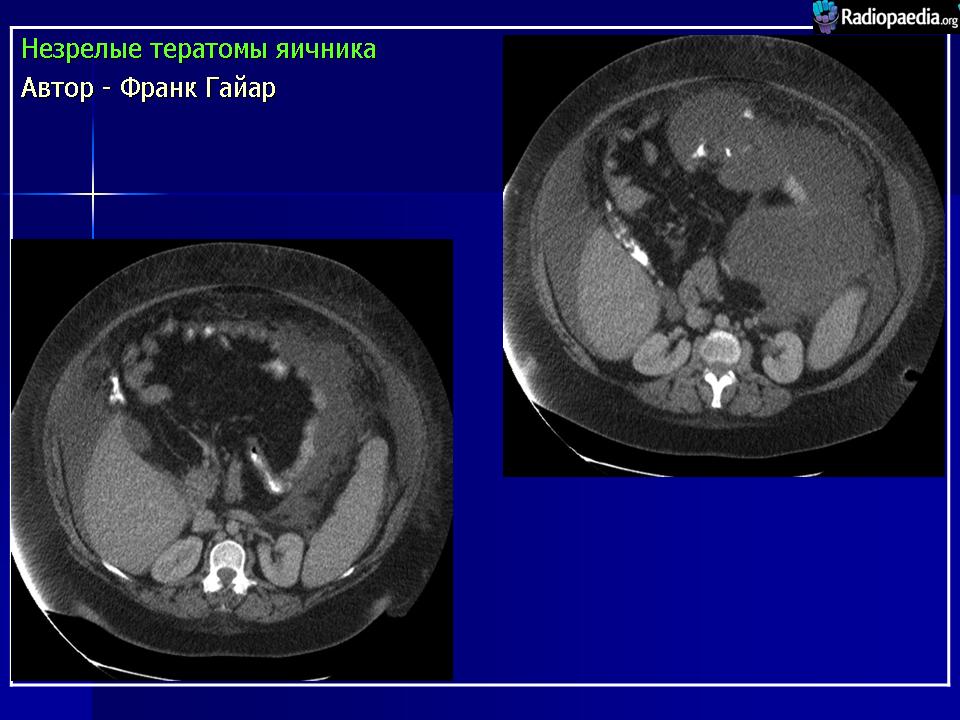
• Лечение — хирургическое •• Часто возникают рецидивы, поскольку кисты способны врастать в прилегающие ткани, что делает невозможным их полное удаление •• Чем больше выражен лимфангиоматозный компонент гигромы, тем больше вероятность рецидива.
МКБ-10 • D17.0 Доброкачественное новообразование жировой ткани кожи и подкожной клетчатки головы, лица и шеи • D21.0 Доброкачественное новообразование соединительной и других мягких тканей головы, лица и шеи • D18 Гемангиома и лимфангиома любой локализации • D21.0 Доброкачественное новообразование соединительной и других мягких тканей головы, лица и шеи.
Прогностические факторы рецидива зрелых кистозных тератом яичников после хирургического удаления
Цель: Изучить частоту рецидивов и прогностические факторы рецидивов после хирургического удаления зрелых кистозных тератом яичников (ЗКТ).
Дизайн исследования: Ретроспективное исследование 382 пациентов, перенесших хирургическое удаление MCT и чьи данные послеоперационного наблюдения были доступны в течение шести месяцев.Пациенты, перенесшие сопутствующую овариэктомию или имевшие овариэктомию в анамнезе, были исключены. Медицинские записи были проверены на наличие признаков рецидива. Модель опасности Кокса использовалась для оценки прогностических факторов рецидива. Категориальные данные сравнивались с использованием критерия хи-квадрат и точного критерия Фишера.
Результаты: Было 16 рецидивов в течение среднего периода наблюдения 43.0 месяцев, с частотой рецидивов 4,2%. Молодой возраст (<30 лет, Y) (отношение рисков (ОР) 2,98; 95% доверительный интервал (ДИ) 1,04–8,62, P = 0,043), большая киста (≥8 см в диаметре, L) (ОР 2,75; 95 % ДИ 1,03–7,37, P = 0,044) и билатеральность (B) (HR 2,88; 95% ДИ 1,07–7,76, P = 0,036) оказались значимыми прогностическими факторами./111/111_12.jpg) Когда у пациента были все эти три фактора, частота рецидивов составляла 21,0%, в противном случае 3,4% (P<0,01). Пациенты с Y+L, Y+B и B+L также показали значительно более высокую частоту рецидивов (21.4%, 15,9% и 11,4% соответственно).
Когда у пациента были все эти три фактора, частота рецидивов составляла 21,0%, в противном случае 3,4% (P<0,01). Пациенты с Y+L, Y+B и B+L также показали значительно более высокую частоту рецидивов (21.4%, 15,9% и 11,4% соответственно).
Вывод: Долгосрочная частота рецидивов после хирургического удаления MCT в этом исследовании составляет 4,2%. Пациенты молодого возраста (<30 лет) или большие кисты (≥8 см в диаметре) или двусторонние кисты имеют высокий риск рецидива, который еще выше, если у пациента имеется более одного из этих факторов.
Ключевые слова: зрелая кистозная тератома яичников; Повторение; Хирургическое иссечение.
Необычный рецидив незрелой тератомы: клинический случай
Oncol Lett. 2016 апрель; 11(4): 2453–2456.
XUELU LI
1 Отделение хирургии груди, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, КНР
DANDAN ZHU
2 Отделение интенсивной терапии, Университет, Далянь, Ляонин 116023, КНР
LI LV
3 Отделение патологии, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, с.Китай
JIAN YU
2 Отделение интенсивной терапии, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, КНР Китай
1 Отделение хирургии груди, Вторая больница Даляньского медицинского университета , Далянь, Ляонин 116023, КНР
2 Отделение интенсивной терапии, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, КНР
3 Отделение патологии, Вторая больница Даляньского медицинского университета , Далянь, Ляонин 116023, с.R. China
Корреспонденция на : Доктор Цзянь Юй, Отделение интенсивной терапии, Второй госпиталь Даляньского медицинского университета, 467 Zhong Shan Road, Далянь, Ляонин 116023, КНР, E-mail: moc. 361@lxilumd
361@lxilumd* Внесено поровну
Получено 1 марта 2015 г .; Принято 19 ноября 2015 г.
Эта статья была процитирована другими статьями в PMC.Abstract
24-летняя женщина, у которой ранее была диагностирована незрелая тератома правого яичника, была направлена во Вторую больницу Даляньского медицинского университета (Далянь, Китай) из-за болей в животе.Ранее пациентка перенесла лапаротомию и овариэктомию правого яичника. Несмотря на это, через 10 лет после операции у пациента развились обширные метастазы в брюшную полость в сочетании с повышенными уровнями сывороточного ракового антигена (СА)-125 и СА19-9. У пациента был высокий риск рецидива, а метастазы в печени и селезенке впоследствии были диагностированы как зрелые тератомы. Чтобы предотвратить возможность рецидива заболевания, требуется частое послеоперационное наблюдение, состоящее из анализа изображений и тестирования сывороточных маркеров.Что касается опубликованной литературы, других пациентов с гигантской тератомой с ассоциированным метастазированием не было. Из-за отсутствия регулярных последующих посещений в Китае опухоль в настоящем исследовании была распознана слишком поздно. Таким образом, для повышения эффективности выявления рецидивирующих тератом необходим более длительный период наблюдения за пациентами с высоким риском рецидива.
Из-за отсутствия регулярных последующих посещений в Китае опухоль в настоящем исследовании была распознана слишком поздно. Таким образом, для повышения эффективности выявления рецидивирующих тератом необходим более длительный период наблюдения за пациентами с высоким риском рецидива.
Ключевые слова: тератома, рецидив, метастазирование, синдром растущей тератомы энтодерма (желудочно-кишечный и бронхиальный эпителий, ткань щитовидной железы) и мезодерма (жир, кости, мышцы и хрящи) (1).Незрелые тератомы — это редкие опухоли, развивающиеся в яичниках, на которые приходится 0,25–3% опухолей, развивающихся в яичниках, причем люди подвергаются большему риску в течение первых двух десятилетий жизни (1). Напротив, зрелые тератомы чаще всего встречаются у женщин в возрасте от 20 до 40 лет (2). Тератомы имеют высокую частоту рецидивов и метастазирования, а незрелые опухолевые ткани могут быть преобразованы в зрелые ткани после послеоперационного рецидива. Конверсия незрелой тератомы характеризуется медленным ростом, поэтому симптомы не типичны. Клиницисты часто пренебрегают диагностикой тератом. Если размер опухоли > 6 см, хирурги обычно прибегают к хирургическому лечению. Рецидив обычно развивается после хирургического удаления опухоли, часто в течение первого года первичной терапии (3). В настоящем исследовании описан случай пациентки, которой была выполнена резекция незрелой тератомы, которая в дальнейшем переросла в зрелые тератомы, обнаруженные в виде обширных абдоминальных метастазов в печень, селезенку и полость таза, выявленных через 10 лет.
Клиницисты часто пренебрегают диагностикой тератом. Если размер опухоли > 6 см, хирурги обычно прибегают к хирургическому лечению. Рецидив обычно развивается после хирургического удаления опухоли, часто в течение первого года первичной терапии (3). В настоящем исследовании описан случай пациентки, которой была выполнена резекция незрелой тератомы, которая в дальнейшем переросла в зрелые тератомы, обнаруженные в виде обширных абдоминальных метастазов в печень, селезенку и полость таза, выявленных через 10 лет.
История болезни
24-летняя женщина была направлена в отделение общей хирургии Второй больницы Даляньского медицинского университета (Далянь, Китай) 24 апреля 2013 г. в связи с периодическими болями в верхней части живота. При физикальном осмотре правой половины живота было обнаружено твердое, крупное образование, подвижное при пальпации. Болезненность в животе, рикошетная боль и мышечное напряжение были неощутимыми, без каких-либо других положительных признаков. При подробном изучении анамнеза больной отмечена незрелая тератома правого яичника, диагностированная 10 лет назад, по поводу которой больной была выполнена лапаротомия и овариэктомия правого яичника.Послеоперационный патологический анализ выявил незрелую тератому с официальным диагнозом незрелой тератомы 2 степени [система классификации Норриса (4)]. Назначена адъювантная терапия, состоящая из 3 циклов блеомицина (20 ЕД/м 2 ), этопозида (1675 мг/м 2 ) и цисплатина (20 мг/м 2 ) после операции. На последнем сеансе химиотерапии остаточной опухоли не наблюдалось. Впоследствии пациент был потерян для последующего наблюдения.
При подробном изучении анамнеза больной отмечена незрелая тератома правого яичника, диагностированная 10 лет назад, по поводу которой больной была выполнена лапаротомия и овариэктомия правого яичника.Послеоперационный патологический анализ выявил незрелую тератому с официальным диагнозом незрелой тератомы 2 степени [система классификации Норриса (4)]. Назначена адъювантная терапия, состоящая из 3 циклов блеомицина (20 ЕД/м 2 ), этопозида (1675 мг/м 2 ) и цисплатина (20 мг/м 2 ) после операции. На последнем сеансе химиотерапии остаточной опухоли не наблюдалось. Впоследствии пациент был потерян для последующего наблюдения.
На основании истории болезни пациента возникло подозрение на рецидив тератомы.Примечательно, что лабораторные тесты показали повышенный уровень сывороточных маркеров ракового антигена (СА)-125 и СА19-9 (). Для оценки гигантской опухоли в брюшной полости пациенту было проведено ультразвуковое исследование и компьютерная томография (КТ). Тотальная КТ брюшной полости с контрастированием выявила сложную кистозную массу размером 18,6×15,7 см 2 в правой доле печени (). Кроме того, в селезенке была обнаружена еще одна опухоль, которая проявляла те же свойства, что и гигантское образование (1).
Тотальная КТ брюшной полости с контрастированием выявила сложную кистозную массу размером 18,6×15,7 см 2 в правой доле печени (). Кроме того, в селезенке была обнаружена еще одна опухоль, которая проявляла те же свойства, что и гигантское образование (1).
(A) Улучшенное сканирование брюшной компьютерной томографии. Масса (18,6×15,7 см 2 ) была идентифицирована в правой доле печени, демонстрируя кальцификацию и кистозные изменения. (B) На поверхности селезенки также была идентифицирована масса, демонстрирующая кальцификацию (белая стрелка). (C) Абдоминальный коронарный срез показал, что сдавленный правый желудочек, правая почка и поджелудочная железа сместились влево, а в тазовой полости наблюдался асцит. (D) Сосудистое ремоделирование.
Таблица I.
Динамическое изменение онкомаркеров.
| Уровень постхирургии, KU / L | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Уровень опухоли | Уровень до операции, KU / L | 7 сут.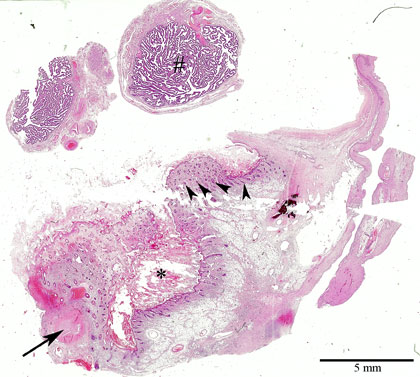 | 30 сут. | 180 сут.51 | 250.50 | 23.00 | 23.00 | 0.00-35.00 | |
| 440.63 | 201,9 | 40150 201 0 | 40150 | 5.20 | 0.00-35.00 | ||||
С учетом размера опухоли, сжатие симптоматики (правый желудочек, правая почка и поджелудочная железа смещены влево; ) и повышенных сывороточных маркеров наиболее вероятен диагноз незрелой тератомы. В последующем больному выполнена лапаротомия.Нельзя было исключить возможную инвазию опухоли в печень, поэтому было подготовлено искусственное кровообращение. После входа в брюшную полость опухоль удаляли из правой доли печени, блокировали первые ворота печени и резецировали правую печеночную вену в месте инфильтрации опухоли. В последующем удалось полностью удалить образование с поверхности селезенки. Гигантская опухоль была богата сальными веществами, внутри массы были идентифицированы ткани волосяного стержня и зубы.Отчет о патологии подтвердил, что все опухоли на поверхности печени и селезенки, а также в полости малого таза были зрелыми тератомами (). После резекции опухоли не было выявлено признаков рецидива или метастазирования в течение 1 и 6 месяцев наблюдения, и были запланированы последующие последующие обследования каждые 3–6 месяцев.
В последующем больному выполнена лапаротомия.Нельзя было исключить возможную инвазию опухоли в печень, поэтому было подготовлено искусственное кровообращение. После входа в брюшную полость опухоль удаляли из правой доли печени, блокировали первые ворота печени и резецировали правую печеночную вену в месте инфильтрации опухоли. В последующем удалось полностью удалить образование с поверхности селезенки. Гигантская опухоль была богата сальными веществами, внутри массы были идентифицированы ткани волосяного стержня и зубы.Отчет о патологии подтвердил, что все опухоли на поверхности печени и селезенки, а также в полости малого таза были зрелыми тератомами (). После резекции опухоли не было выявлено признаков рецидива или метастазирования в течение 1 и 6 месяцев наблюдения, и были запланированы последующие последующие обследования каждые 3–6 месяцев.
Общий образец печени. (A) Опухоль (29×24 см 2 ) содержала ткани стержня волоса и зубы (черная стрелка). (B) Внутри масса содержала обильные желеобразные и сальные вещества, ткани волосяного стержня и зубы.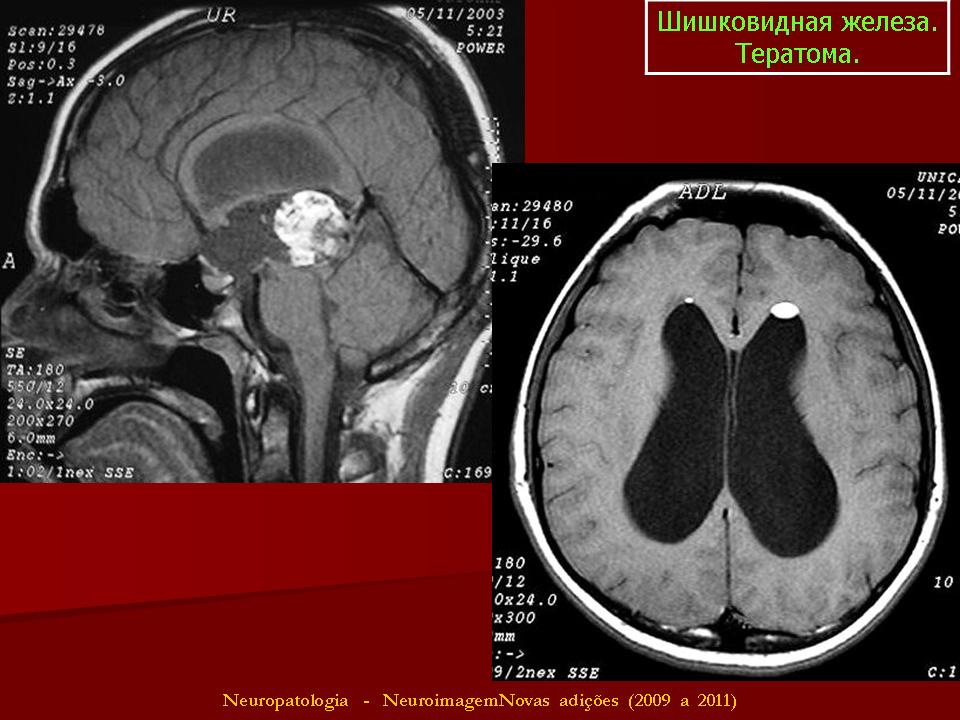
Особенности окрашивания гематоксилином и эозином. (A) Зрелые компоненты бронхиальных эпителиальных клеток, бронхиальных желез и бронхиального хряща. (B) Типичный бронхиальный эпителий. Микрофотографии, показывающие ткань кожи с (C) сальными железами и (D) волосами, (E) пластинчатой костью и (F) кальцификацией. Увеличение, х100.
Обсуждение
Незрелые тератомы яичника являются редкими опухолями, составляя <3% всех тератом, расположенных в яичниках. Заболевание обычно возникает в течение первых двух десятилетий жизни, а опухоли состоят из ткани, происходящей из двух или более слоев зародышевых клеток (эктодермы, мезодермы и/или энтодермы), содержащей незрелые и эмбриональные структуры (1).Текущий случай представлен классическими симптомами и гистологическими проявлениями, связанными с незрелыми тератомами. Удаление таких опухолей часто сопровождается локальным рецидивом в течение первого года от начала первичной терапии (3). Настоящий пациент был потерян для последующего наблюдения после начальной химиотерапии, но у него развились редкие зрелые тератомы и обширные метастазы в брюшную полость через 10 лет.
Зрелые тератомы, как правило, доброкачественные, однако может произойти злокачественная трансформация, хотя и редко.Пик заболеваемости такими опухолями приходится на женщин в возрасте 20–40 лет. Заболевание характеризуется медленным ростом со скоростью роста 1,8 мм в год, а при размерах опухоли <6 см хирурги обычно прибегают к консервативному лечению (1). Синдром растущей тератомы — редкое состояние, наблюдающееся у мужчин и женщин, с опухолями зародышевых клеток, пролеченными соответствующим образом, характеризующееся персистенцией или развитием увеличивающихся масс после адъювантной химиотерапии, нормальными значениями маркеров опухоли и наличием зрелых тератом в образце.Если диагноз синдрома растущей тератомы подтверждается, хирург должен определить возможность операбельности опухоли, а также взвесить риски и преимущества хирургического вмешательства (5). Это необходимо для обеспечения оптимального лечения заболевания и предотвращения ненужной химиотерапии. В данном случае производители сыворотки, СА-125 и СА19-9, демонстрировали особенно высокие уровни по сравнению с уровнями, наблюдаемыми при синдроме растущей тератомы. Иссечение проводили на опухолях размером менее 2 см.После операции на патологических срезах из разных мест опухоли незрелых элементов не обнаружено. Дальнейшее лечение пациентке не проводилось. Насколько нам известно, такое метастазирование зрелой тератомы в печень, селезенку и полость таза встречается особенно редко.
Иссечение проводили на опухолях размером менее 2 см.После операции на патологических срезах из разных мест опухоли незрелых элементов не обнаружено. Дальнейшее лечение пациентке не проводилось. Насколько нам известно, такое метастазирование зрелой тератомы в печень, селезенку и полость таза встречается особенно редко.
При постановке дифференциального диагноза тератом измерение сывороточных уровней СА-125 и СА19-9 является распространенным методом, используемым для раннего выявления. Ustunyurt и соавт. (6) сообщили, что сывороточный СА19-9 является наиболее надежным онкомаркером зрелых кистозных тератом яичников и что уровни сывороточного СА19-9 часто связаны с размером тератомы; однако он не обладает высокой специфичностью или чувствительностью.Bast и соавт. (7) сообщили, что СА-125 в сыворотке является надежным маркером и что в сочетании с повышенным уровнем СА19-9 это может быть дифференциальным признаком злокачественных опухолей. Примечательно, что в данном случае изменение уровней СА-125 и СА19-9 в сыворотке было больше по сравнению с типичным изменением (1).
Harada и соавт. (8) предположили, что прогностическими факторами рецидива являются молодой возраст (<30 лет), большой размер кисты (>8 см) и двустороннее появление зрелых тератом.В данном случае у пациента был высокий риск рецидива. Чтобы предотвратить остаточное заболевание, требуется частый послеоперационный визуализирующий анализ и тестирование сывороточных маркеров. В литературе, насколько нам известно, не было описано ни одного пациента с гигантской тератомой, у которого были бы такие же редкие метастазы, как у пациента в данном случае. Из-за отсутствия повторных приемов в Китае опухоль была распознана слишком поздно. Для повышения вероятности выявления рецидивирующих тератом требуются более длительные периоды наблюдения за пациентами с высоким риском рецидива.
Ссылки
1. Saba L, Guerriero S, Sulcis R, Virgilio B, Melis G, Mallarini G. Зрелые и незрелые тератомы яичников: характеристики КТ, УЗИ и МРТ. Евр Дж Радиол. 2009; 72: 454–463. doi: 10.1016/j. ejrad.2008.07.044. [PubMed] [CrossRef] [Google Scholar]3. Барвад А., Дей П., Шивалингам Дж. Метастазы зрелого компонента в пролеченном случае незрелой тератомы, диагностированной при тонкоигольной аспирационной цитологии печени. Диагностика Цитопатол. 2011;39:711–713. doi: 10.1002/dc.21513. [PubMed] [CrossRef] [Google Scholar]4.Норрис Х.Дж., Зиркин Х.Дж., Бенсон В.Л. Незрелая (злокачественная) тератома яичника: клинико-патологическое исследование 58 случаев. Рак. 1976; 37: 2359–2372. doi: 10.1002/1097-0142(197605)37:5<2359::AID-CNCR2820370528>3.0.CO;2-Q. [PubMed] [CrossRef] [Google Scholar]5. Берд К., Стани М.П., Гербольд Н.К., Лит К.А., III, Гамильтон К.А. Синдром растущей тератомы: краткое сообщение и алгоритм управления. Aust NZ J Obstet Gynaecol. 2013;53:318–321. doi: 10.1111/ajo.12084. [PubMed] [CrossRef] [Google Scholar]6.Устунюрт Э., Гунгор Т., Искендер С., Устунюрт Б.О., Бильге У., Молламахмутоглу Л. Онкомаркеры в зрелых кистозных тератомах яичника. Arch Gynecol Obstet. 2009; 279: 145–147.
ejrad.2008.07.044. [PubMed] [CrossRef] [Google Scholar]3. Барвад А., Дей П., Шивалингам Дж. Метастазы зрелого компонента в пролеченном случае незрелой тератомы, диагностированной при тонкоигольной аспирационной цитологии печени. Диагностика Цитопатол. 2011;39:711–713. doi: 10.1002/dc.21513. [PubMed] [CrossRef] [Google Scholar]4.Норрис Х.Дж., Зиркин Х.Дж., Бенсон В.Л. Незрелая (злокачественная) тератома яичника: клинико-патологическое исследование 58 случаев. Рак. 1976; 37: 2359–2372. doi: 10.1002/1097-0142(197605)37:5<2359::AID-CNCR2820370528>3.0.CO;2-Q. [PubMed] [CrossRef] [Google Scholar]5. Берд К., Стани М.П., Гербольд Н.К., Лит К.А., III, Гамильтон К.А. Синдром растущей тератомы: краткое сообщение и алгоритм управления. Aust NZ J Obstet Gynaecol. 2013;53:318–321. doi: 10.1111/ajo.12084. [PubMed] [CrossRef] [Google Scholar]6.Устунюрт Э., Гунгор Т., Искендер С., Устунюрт Б.О., Бильге У., Молламахмутоглу Л. Онкомаркеры в зрелых кистозных тератомах яичника. Arch Gynecol Obstet. 2009; 279: 145–147. doi: 10.1007/s00404-008-0688-2. [PubMed] [CrossRef] [Google Scholar]7. Bast RC, Jr, Badgwell D, Lu Z, Marquez R, Rosen D, Liu J, Baggerly KA, Atkinson EN, Skates S, Zhang Z, et al. Новые онкомаркеры: CA125 и выше. Int J Gynecol Рак. 2005; 15 (Приложение 3): 274–281. doi: 10.1111/j.1525-1438.2005.00441.x. [PubMed] [CrossRef] [Google Scholar]8.Harada M, Osuga Y, Fujimoto A, Fujimoto A, Fujii T, Yano T, Kozuma S. Прогностические факторы рецидива зрелых кистозных тератом яичников после хирургического удаления. Eur J Obstet Gynecol Reprod Biol. 2013; 171:325–328. doi: 10.1016/j.ejogrb.2013.09.004. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1007/s00404-008-0688-2. [PubMed] [CrossRef] [Google Scholar]7. Bast RC, Jr, Badgwell D, Lu Z, Marquez R, Rosen D, Liu J, Baggerly KA, Atkinson EN, Skates S, Zhang Z, et al. Новые онкомаркеры: CA125 и выше. Int J Gynecol Рак. 2005; 15 (Приложение 3): 274–281. doi: 10.1111/j.1525-1438.2005.00441.x. [PubMed] [CrossRef] [Google Scholar]8.Harada M, Osuga Y, Fujimoto A, Fujimoto A, Fujii T, Yano T, Kozuma S. Прогностические факторы рецидива зрелых кистозных тератом яичников после хирургического удаления. Eur J Obstet Gynecol Reprod Biol. 2013; 171:325–328. doi: 10.1016/j.ejogrb.2013.09.004. [PubMed] [CrossRef] [Google Scholar]Необычный рецидив незрелой тератомы: история болезни
Oncol Lett. 2016 апрель; 11(4): 2453–2456.
XUELU LI
1 Отделение хирургии груди, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, с.R. China
DANDAN ZHU
2 Отделение интенсивной терапии, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, КНР
LI LV
3 Отделение патологии, Вторая больница Даляньский медицинский университет, Далянь, Ляонин 116023, КНР
JIAN YU
2 Отделение интенсивной терапии, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, с. Республика Китай
Республика Китай
1 Отделение хирургии груди, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, КНР Китай
2 Отделение интенсивной терапии, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, КНР
3 Отделение патологии, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, КНР
Связь с : Д-р Цзянь Ю, отделение реаниматологии, Вторая больница Даляньского медицинского университета Университет, 467 Zhong Shan Road, Далянь, Ляонин 116023, с.Р. Китай, электронная почта: moc.361@lxilumd* Внесено поровну
Получено 1 марта 2015 г .; Принято 19 ноября 2015 г.
Эта статья была процитирована другими статьями в PMC.Abstract
24-летняя женщина, у которой ранее была диагностирована незрелая тератома правого яичника, была направлена во Вторую больницу Даляньского медицинского университета (Далянь, Китай) из-за болей в животе. Ранее пациентка перенесла лапаротомию и овариэктомию правого яичника. Несмотря на это, через 10 лет после операции у пациента развились обширные метастазы в брюшную полость в сочетании с повышенными уровнями сывороточного ракового антигена (СА)-125 и СА19-9.У пациента был высокий риск рецидива, а метастазы в печени и селезенке впоследствии были диагностированы как зрелые тератомы. Чтобы предотвратить возможность рецидива заболевания, требуется частое послеоперационное наблюдение, состоящее из анализа изображений и тестирования сывороточных маркеров. Что касается опубликованной литературы, других пациентов с гигантской тератомой с ассоциированным метастазированием не было. Из-за отсутствия регулярных последующих посещений в Китае опухоль в настоящем исследовании была распознана слишком поздно.Таким образом, для повышения эффективности выявления рецидивирующих тератом необходим более длительный период наблюдения за пациентами с высоким риском рецидива.
Ранее пациентка перенесла лапаротомию и овариэктомию правого яичника. Несмотря на это, через 10 лет после операции у пациента развились обширные метастазы в брюшную полость в сочетании с повышенными уровнями сывороточного ракового антигена (СА)-125 и СА19-9.У пациента был высокий риск рецидива, а метастазы в печени и селезенке впоследствии были диагностированы как зрелые тератомы. Чтобы предотвратить возможность рецидива заболевания, требуется частое послеоперационное наблюдение, состоящее из анализа изображений и тестирования сывороточных маркеров. Что касается опубликованной литературы, других пациентов с гигантской тератомой с ассоциированным метастазированием не было. Из-за отсутствия регулярных последующих посещений в Китае опухоль в настоящем исследовании была распознана слишком поздно.Таким образом, для повышения эффективности выявления рецидивирующих тератом необходим более длительный период наблюдения за пациентами с высоким риском рецидива.
Ключевые слова: тератома, рецидив, метастазирование, синдром растущей тератомы энтодерма (желудочно-кишечный и бронхиальный эпителий, ткань щитовидной железы) и мезодерма (жир, кости, мышцы и хрящи) (1).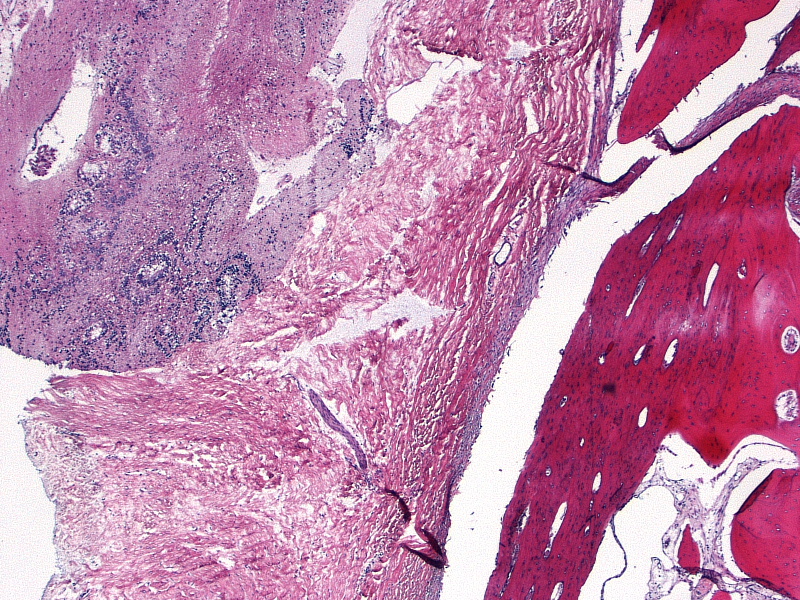 Незрелые тератомы — это редкие опухоли, развивающиеся в яичниках, на которые приходится 0,25–3% опухолей, развивающихся в яичниках, причем люди подвергаются большему риску в течение первых двух десятилетий жизни (1). Напротив, зрелые тератомы чаще всего встречаются у женщин в возрасте от 20 до 40 лет (2). Тератомы имеют высокую частоту рецидивов и метастазирования, а незрелые опухолевые ткани могут быть преобразованы в зрелые ткани после послеоперационного рецидива. Конверсия незрелой тератомы характеризуется медленным ростом, поэтому симптомы не типичны.Клиницисты часто пренебрегают диагностикой тератом. Если размер опухоли > 6 см, хирурги обычно прибегают к хирургическому лечению. Рецидив обычно развивается после хирургического удаления опухоли, часто в течение первого года первичной терапии (3). В настоящем исследовании описан случай пациентки, которой была выполнена резекция незрелой тератомы, которая в дальнейшем переросла в зрелые тератомы, обнаруженные в виде обширных абдоминальных метастазов в печень, селезенку и полость таза, выявленных через 10 лет.
Незрелые тератомы — это редкие опухоли, развивающиеся в яичниках, на которые приходится 0,25–3% опухолей, развивающихся в яичниках, причем люди подвергаются большему риску в течение первых двух десятилетий жизни (1). Напротив, зрелые тератомы чаще всего встречаются у женщин в возрасте от 20 до 40 лет (2). Тератомы имеют высокую частоту рецидивов и метастазирования, а незрелые опухолевые ткани могут быть преобразованы в зрелые ткани после послеоперационного рецидива. Конверсия незрелой тератомы характеризуется медленным ростом, поэтому симптомы не типичны.Клиницисты часто пренебрегают диагностикой тератом. Если размер опухоли > 6 см, хирурги обычно прибегают к хирургическому лечению. Рецидив обычно развивается после хирургического удаления опухоли, часто в течение первого года первичной терапии (3). В настоящем исследовании описан случай пациентки, которой была выполнена резекция незрелой тератомы, которая в дальнейшем переросла в зрелые тератомы, обнаруженные в виде обширных абдоминальных метастазов в печень, селезенку и полость таза, выявленных через 10 лет.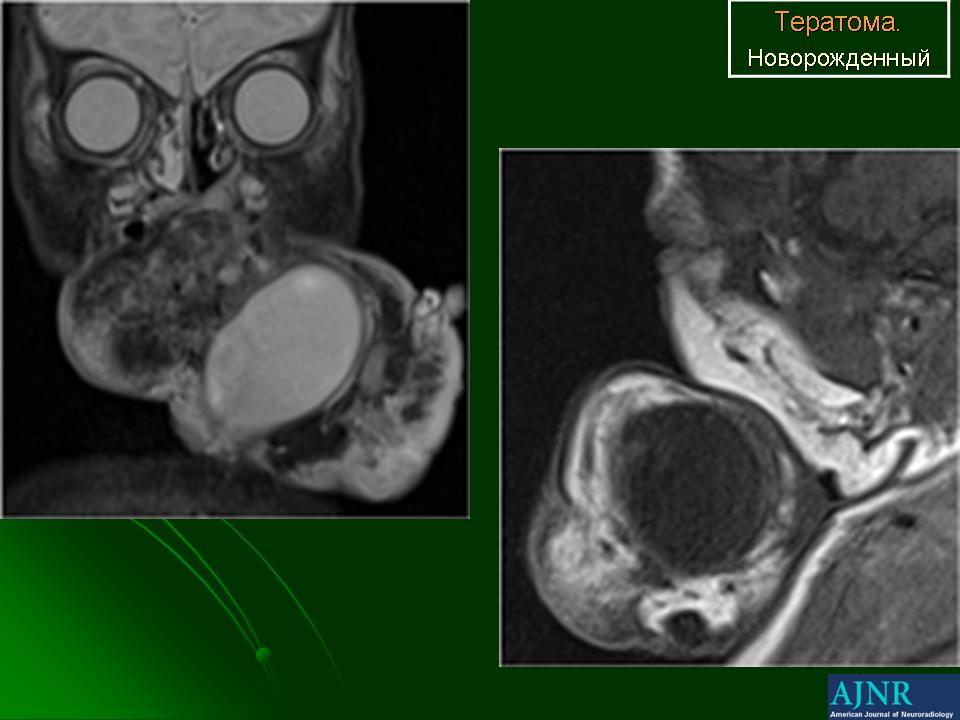
История болезни
24-летняя женщина была направлена в отделение общей хирургии Второй больницы Даляньского медицинского университета (Далянь, Китай) 24 апреля 2013 г. в связи с периодическими болями в верхней части живота. При физикальном осмотре правой половины живота было обнаружено твердое, крупное образование, подвижное при пальпации. Болезненность в животе, рикошетная боль и мышечное напряжение были неощутимыми, без каких-либо других положительных признаков. При подробном изучении анамнеза больной отмечена незрелая тератома правого яичника, диагностированная 10 лет назад, по поводу которой больной была выполнена лапаротомия и овариэктомия правого яичника.Послеоперационный патологический анализ выявил незрелую тератому с официальным диагнозом незрелой тератомы 2 степени [система классификации Норриса (4)]. Назначена адъювантная терапия, состоящая из 3 циклов блеомицина (20 ЕД/м 2 ), этопозида (1675 мг/м 2 ) и цисплатина (20 мг/м 2 ) после операции.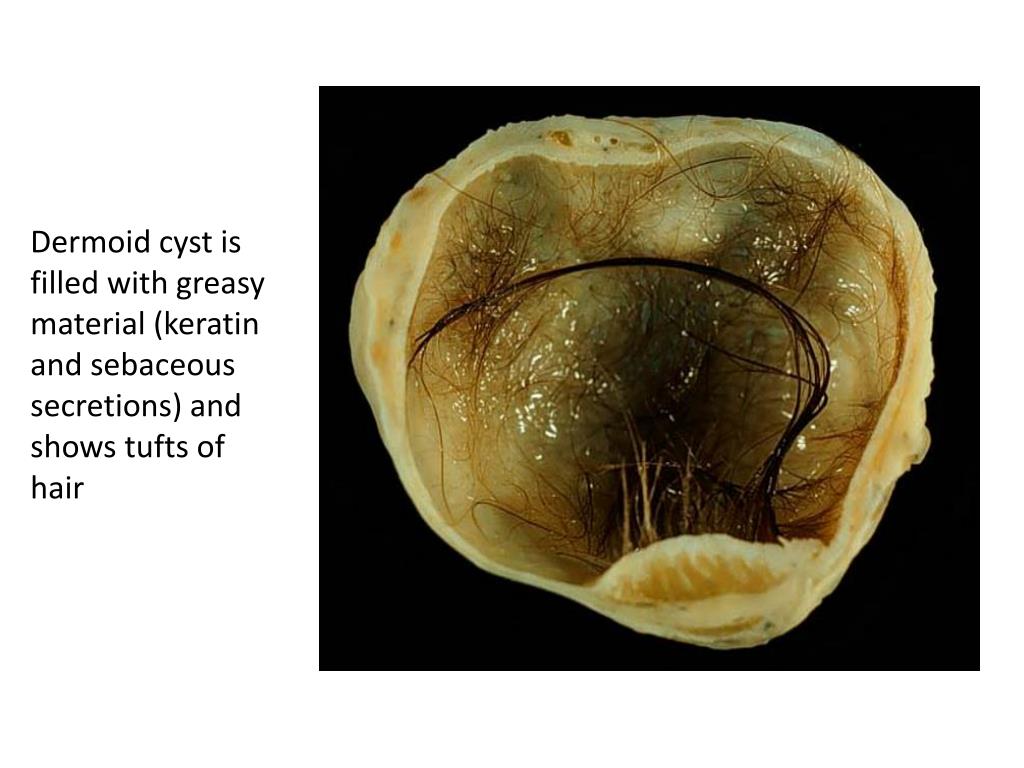 На последнем сеансе химиотерапии остаточной опухоли не наблюдалось. Впоследствии пациент был потерян для последующего наблюдения.
На последнем сеансе химиотерапии остаточной опухоли не наблюдалось. Впоследствии пациент был потерян для последующего наблюдения.
На основании истории болезни пациента возникло подозрение на рецидив тератомы.Примечательно, что лабораторные тесты показали повышенный уровень сывороточных маркеров ракового антигена (СА)-125 и СА19-9 (). Для оценки гигантской опухоли в брюшной полости пациенту было проведено ультразвуковое исследование и компьютерная томография (КТ). Тотальная КТ брюшной полости с контрастированием выявила сложную кистозную массу размером 18,6×15,7 см 2 в правой доле печени (). Кроме того, в селезенке была обнаружена еще одна опухоль, которая проявляла те же свойства, что и гигантское образование (1).
(A) Улучшенное сканирование брюшной компьютерной томографии. Масса (18,6×15,7 см 2 ) была идентифицирована в правой доле печени, демонстрируя кальцификацию и кистозные изменения. (B) На поверхности селезенки также была идентифицирована масса, демонстрирующая кальцификацию (белая стрелка).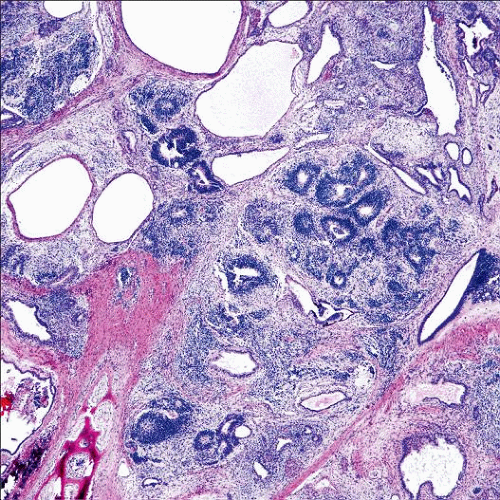 (C) Абдоминальный коронарный срез показал, что сдавленный правый желудочек, правая почка и поджелудочная железа сместились влево, а в тазовой полости наблюдался асцит. (D) Сосудистое ремоделирование.
(C) Абдоминальный коронарный срез показал, что сдавленный правый желудочек, правая почка и поджелудочная железа сместились влево, а в тазовой полости наблюдался асцит. (D) Сосудистое ремоделирование.
Таблица I.
Динамическое изменение онкомаркеров.
| Уровень постхирургии, KU / L | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Уровень опухоли | Уровень до операции, KU / L | 7 сут.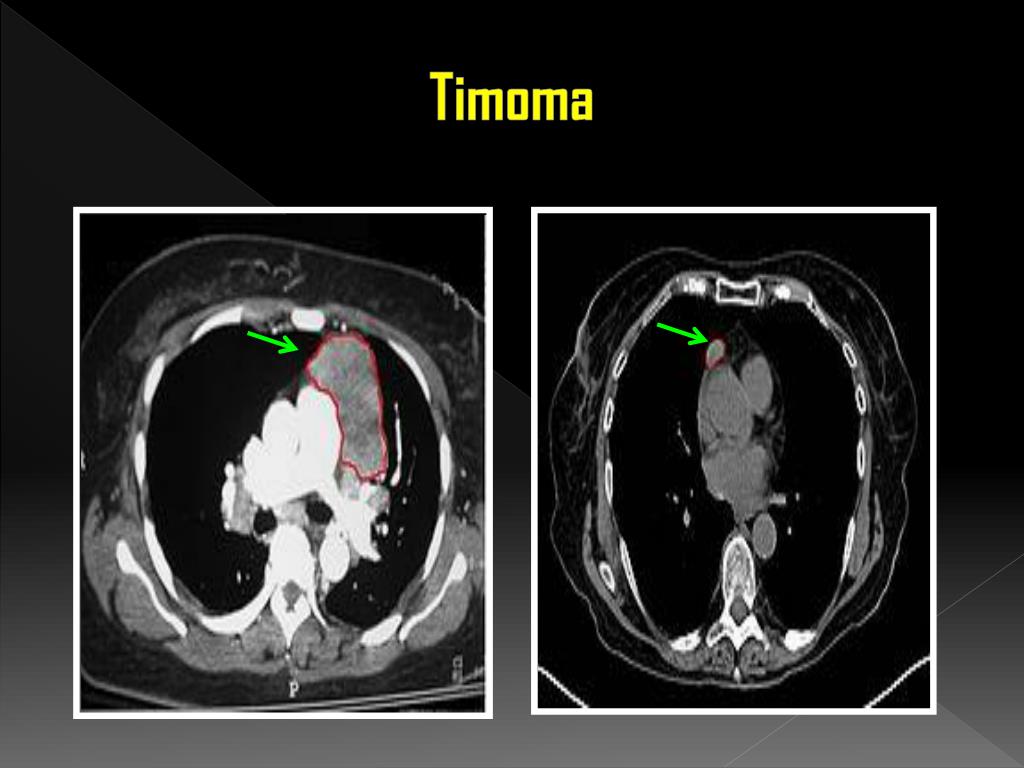 | 30 сут. | 180 сут.51 | 250.50 | 23.00 | 23.00 | 0.00-35.00 | |
| 440.63 | 201,9 | 40150 201 0 | 40150 | 5.20 | 0.00-35.00 | ||||
С учетом размера опухоли, сжатие симптоматики (правый желудочек, правая почка и поджелудочная железа смещены влево; ) и повышенных сывороточных маркеров наиболее вероятен диагноз незрелой тератомы.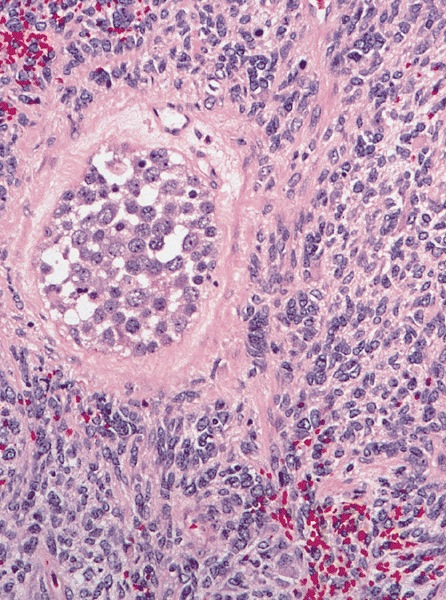 В последующем больному выполнена лапаротомия.Нельзя было исключить возможную инвазию опухоли в печень, поэтому было подготовлено искусственное кровообращение. После входа в брюшную полость опухоль удаляли из правой доли печени, блокировали первые ворота печени и резецировали правую печеночную вену в месте инфильтрации опухоли. В последующем удалось полностью удалить образование с поверхности селезенки. Гигантская опухоль была богата сальными веществами, внутри массы были идентифицированы ткани волосяного стержня и зубы.Отчет о патологии подтвердил, что все опухоли на поверхности печени и селезенки, а также в полости малого таза были зрелыми тератомами (). После резекции опухоли не было выявлено признаков рецидива или метастазирования в течение 1 и 6 месяцев наблюдения, и были запланированы последующие последующие обследования каждые 3–6 месяцев.
В последующем больному выполнена лапаротомия.Нельзя было исключить возможную инвазию опухоли в печень, поэтому было подготовлено искусственное кровообращение. После входа в брюшную полость опухоль удаляли из правой доли печени, блокировали первые ворота печени и резецировали правую печеночную вену в месте инфильтрации опухоли. В последующем удалось полностью удалить образование с поверхности селезенки. Гигантская опухоль была богата сальными веществами, внутри массы были идентифицированы ткани волосяного стержня и зубы.Отчет о патологии подтвердил, что все опухоли на поверхности печени и селезенки, а также в полости малого таза были зрелыми тератомами (). После резекции опухоли не было выявлено признаков рецидива или метастазирования в течение 1 и 6 месяцев наблюдения, и были запланированы последующие последующие обследования каждые 3–6 месяцев.
Общий образец печени. (A) Опухоль (29×24 см 2 ) содержала ткани стержня волоса и зубы (черная стрелка). (B) Внутри масса содержала обильные желеобразные и сальные вещества, ткани волосяного стержня и зубы.
Особенности окрашивания гематоксилином и эозином. (A) Зрелые компоненты бронхиальных эпителиальных клеток, бронхиальных желез и бронхиального хряща. (B) Типичный бронхиальный эпителий. Микрофотографии, показывающие ткань кожи с (C) сальными железами и (D) волосами, (E) пластинчатой костью и (F) кальцификацией. Увеличение, х100.
Обсуждение
Незрелые тератомы яичника являются редкими опухолями, составляя <3% всех тератом, расположенных в яичниках. Заболевание обычно возникает в течение первых двух десятилетий жизни, а опухоли состоят из ткани, происходящей из двух или более слоев зародышевых клеток (эктодермы, мезодермы и/или энтодермы), содержащей незрелые и эмбриональные структуры (1).Текущий случай представлен классическими симптомами и гистологическими проявлениями, связанными с незрелыми тератомами. Удаление таких опухолей часто сопровождается локальным рецидивом в течение первого года от начала первичной терапии (3). Настоящий пациент был потерян для последующего наблюдения после начальной химиотерапии, но у него развились редкие зрелые тератомы и обширные метастазы в брюшную полость через 10 лет.
Зрелые тератомы, как правило, доброкачественные, однако может произойти злокачественная трансформация, хотя и редко.Пик заболеваемости такими опухолями приходится на женщин в возрасте 20–40 лет. Заболевание характеризуется медленным ростом со скоростью роста 1,8 мм в год, а при размерах опухоли <6 см хирурги обычно прибегают к консервативному лечению (1). Синдром растущей тератомы — редкое состояние, наблюдающееся у мужчин и женщин, с опухолями зародышевых клеток, пролеченными соответствующим образом, характеризующееся персистенцией или развитием увеличивающихся масс после адъювантной химиотерапии, нормальными значениями маркеров опухоли и наличием зрелых тератом в образце.Если диагноз синдрома растущей тератомы подтверждается, хирург должен определить возможность операбельности опухоли, а также взвесить риски и преимущества хирургического вмешательства (5). Это необходимо для обеспечения оптимального лечения заболевания и предотвращения ненужной химиотерапии. В данном случае производители сыворотки, СА-125 и СА19-9, демонстрировали особенно высокие уровни по сравнению с уровнями, наблюдаемыми при синдроме растущей тератомы. Иссечение проводили на опухолях размером менее 2 см.После операции на патологических срезах из разных мест опухоли незрелых элементов не обнаружено. Дальнейшее лечение пациентке не проводилось. Насколько нам известно, такое метастазирование зрелой тератомы в печень, селезенку и полость таза встречается особенно редко.
Иссечение проводили на опухолях размером менее 2 см.После операции на патологических срезах из разных мест опухоли незрелых элементов не обнаружено. Дальнейшее лечение пациентке не проводилось. Насколько нам известно, такое метастазирование зрелой тератомы в печень, селезенку и полость таза встречается особенно редко.
При постановке дифференциального диагноза тератом измерение сывороточных уровней СА-125 и СА19-9 является распространенным методом, используемым для раннего выявления. Ustunyurt и соавт. (6) сообщили, что сывороточный СА19-9 является наиболее надежным онкомаркером зрелых кистозных тератом яичников и что уровни сывороточного СА19-9 часто связаны с размером тератомы; однако он не обладает высокой специфичностью или чувствительностью.Bast и соавт. (7) сообщили, что СА-125 в сыворотке является надежным маркером и что в сочетании с повышенным уровнем СА19-9 это может быть дифференциальным признаком злокачественных опухолей. Примечательно, что в данном случае изменение уровней СА-125 и СА19-9 в сыворотке было больше по сравнению с типичным изменением (1).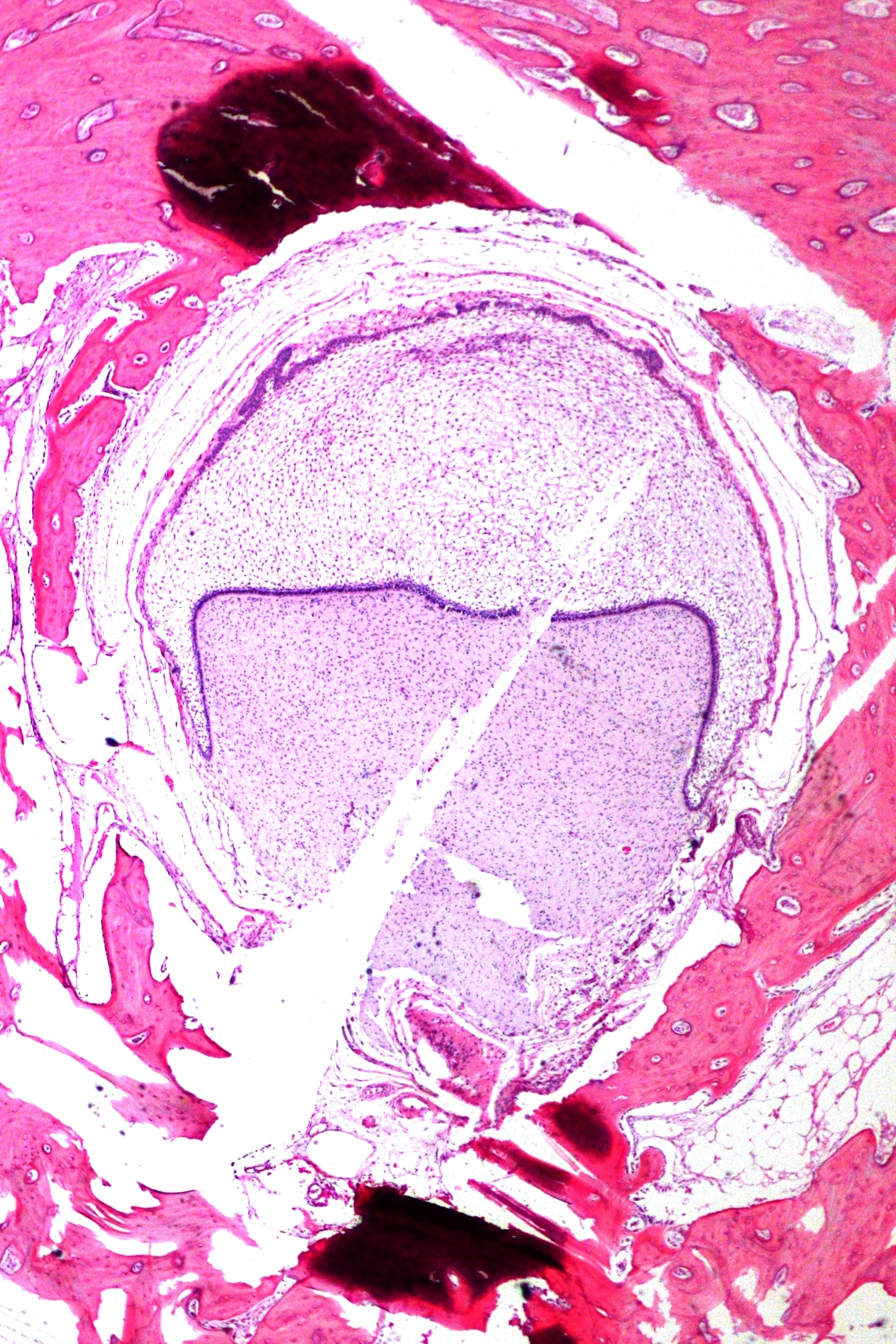
Harada и соавт. (8) предположили, что прогностическими факторами рецидива являются молодой возраст (<30 лет), большой размер кисты (>8 см) и двустороннее появление зрелых тератом.В данном случае у пациента был высокий риск рецидива. Чтобы предотвратить остаточное заболевание, требуется частый послеоперационный визуализирующий анализ и тестирование сывороточных маркеров. В литературе, насколько нам известно, не было описано ни одного пациента с гигантской тератомой, у которого были бы такие же редкие метастазы, как у пациента в данном случае. Из-за отсутствия повторных приемов в Китае опухоль была распознана слишком поздно. Для повышения вероятности выявления рецидивирующих тератом требуются более длительные периоды наблюдения за пациентами с высоким риском рецидива.
Ссылки
1. Saba L, Guerriero S, Sulcis R, Virgilio B, Melis G, Mallarini G. Зрелые и незрелые тератомы яичников: характеристики КТ, УЗИ и МРТ. Евр Дж Радиол. 2009; 72: 454–463. doi: 10.1016/j.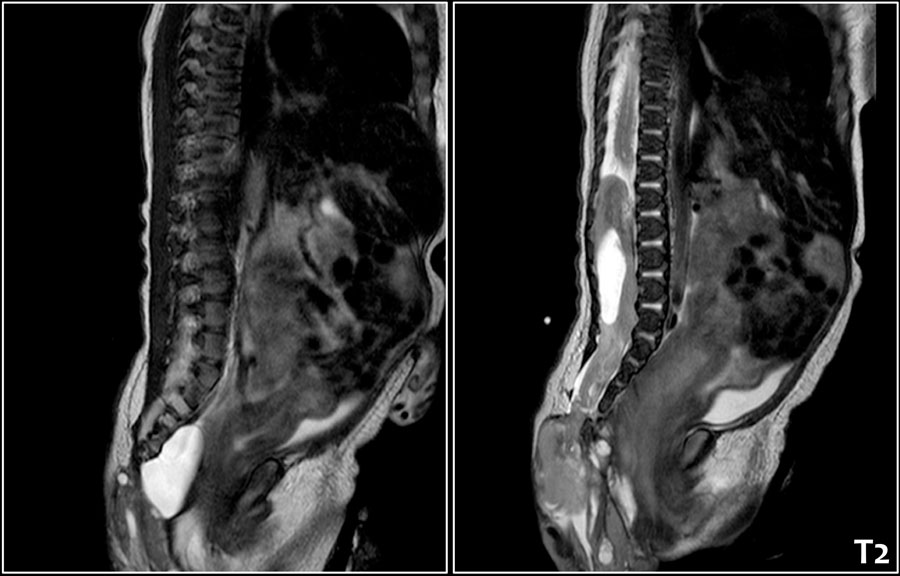 ejrad.2008.07.044. [PubMed] [CrossRef] [Google Scholar]3. Барвад А., Дей П., Шивалингам Дж. Метастазы зрелого компонента в пролеченном случае незрелой тератомы, диагностированной при тонкоигольной аспирационной цитологии печени. Диагностика Цитопатол. 2011;39:711–713. doi: 10.1002/dc.21513. [PubMed] [CrossRef] [Google Scholar]4.Норрис Х.Дж., Зиркин Х.Дж., Бенсон В.Л. Незрелая (злокачественная) тератома яичника: клинико-патологическое исследование 58 случаев. Рак. 1976; 37: 2359–2372. doi: 10.1002/1097-0142(197605)37:5<2359::AID-CNCR2820370528>3.0.CO;2-Q. [PubMed] [CrossRef] [Google Scholar]5. Берд К., Стани М.П., Гербольд Н.К., Лит К.А., III, Гамильтон К.А. Синдром растущей тератомы: краткое сообщение и алгоритм управления. Aust NZ J Obstet Gynaecol. 2013;53:318–321. doi: 10.1111/ajo.12084. [PubMed] [CrossRef] [Google Scholar]6.Устунюрт Э., Гунгор Т., Искендер С., Устунюрт Б.О., Бильге У., Молламахмутоглу Л. Онкомаркеры в зрелых кистозных тератомах яичника. Arch Gynecol Obstet. 2009; 279: 145–147.
ejrad.2008.07.044. [PubMed] [CrossRef] [Google Scholar]3. Барвад А., Дей П., Шивалингам Дж. Метастазы зрелого компонента в пролеченном случае незрелой тератомы, диагностированной при тонкоигольной аспирационной цитологии печени. Диагностика Цитопатол. 2011;39:711–713. doi: 10.1002/dc.21513. [PubMed] [CrossRef] [Google Scholar]4.Норрис Х.Дж., Зиркин Х.Дж., Бенсон В.Л. Незрелая (злокачественная) тератома яичника: клинико-патологическое исследование 58 случаев. Рак. 1976; 37: 2359–2372. doi: 10.1002/1097-0142(197605)37:5<2359::AID-CNCR2820370528>3.0.CO;2-Q. [PubMed] [CrossRef] [Google Scholar]5. Берд К., Стани М.П., Гербольд Н.К., Лит К.А., III, Гамильтон К.А. Синдром растущей тератомы: краткое сообщение и алгоритм управления. Aust NZ J Obstet Gynaecol. 2013;53:318–321. doi: 10.1111/ajo.12084. [PubMed] [CrossRef] [Google Scholar]6.Устунюрт Э., Гунгор Т., Искендер С., Устунюрт Б.О., Бильге У., Молламахмутоглу Л. Онкомаркеры в зрелых кистозных тератомах яичника. Arch Gynecol Obstet. 2009; 279: 145–147.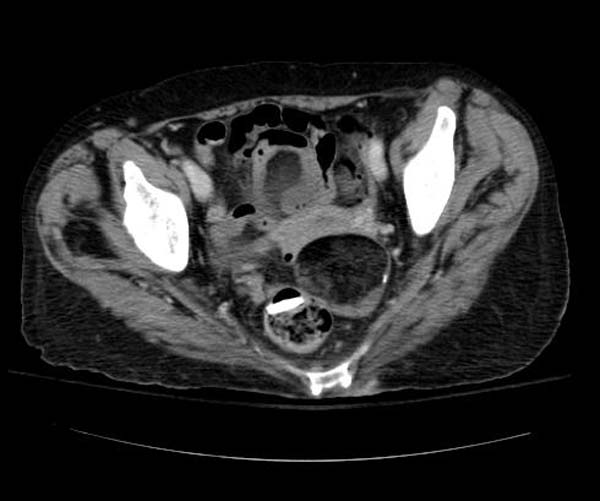 doi: 10.1007/s00404-008-0688-2. [PubMed] [CrossRef] [Google Scholar]7. Bast RC, Jr, Badgwell D, Lu Z, Marquez R, Rosen D, Liu J, Baggerly KA, Atkinson EN, Skates S, Zhang Z, et al. Новые онкомаркеры: CA125 и выше. Int J Gynecol Рак. 2005; 15 (Приложение 3): 274–281. doi: 10.1111/j.1525-1438.2005.00441.x. [PubMed] [CrossRef] [Google Scholar]8.Harada M, Osuga Y, Fujimoto A, Fujimoto A, Fujii T, Yano T, Kozuma S. Прогностические факторы рецидива зрелых кистозных тератом яичников после хирургического удаления. Eur J Obstet Gynecol Reprod Biol. 2013; 171:325–328. doi: 10.1016/j.ejogrb.2013.09.004. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1007/s00404-008-0688-2. [PubMed] [CrossRef] [Google Scholar]7. Bast RC, Jr, Badgwell D, Lu Z, Marquez R, Rosen D, Liu J, Baggerly KA, Atkinson EN, Skates S, Zhang Z, et al. Новые онкомаркеры: CA125 и выше. Int J Gynecol Рак. 2005; 15 (Приложение 3): 274–281. doi: 10.1111/j.1525-1438.2005.00441.x. [PubMed] [CrossRef] [Google Scholar]8.Harada M, Osuga Y, Fujimoto A, Fujimoto A, Fujii T, Yano T, Kozuma S. Прогностические факторы рецидива зрелых кистозных тератом яичников после хирургического удаления. Eur J Obstet Gynecol Reprod Biol. 2013; 171:325–328. doi: 10.1016/j.ejogrb.2013.09.004. [PubMed] [CrossRef] [Google Scholar]Необычный рецидив незрелой тератомы: история болезни
Oncol Lett. 2016 апрель; 11(4): 2453–2456.
XUELU LI
1 Отделение хирургии груди, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, с.R. China
DANDAN ZHU
2 Отделение интенсивной терапии, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, КНР
LI LV
3 Отделение патологии, Вторая больница Даляньский медицинский университет, Далянь, Ляонин 116023, КНР
JIAN YU
2 Отделение интенсивной терапии, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, с. Республика Китай
Республика Китай
1 Отделение хирургии груди, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, КНР Китай
2 Отделение интенсивной терапии, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, КНР
3 Отделение патологии, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, КНР
Связь с : Д-р Цзянь Ю, отделение реаниматологии, Вторая больница Даляньского медицинского университета Университет, 467 Zhong Shan Road, Далянь, Ляонин 116023, с.Р. Китай, электронная почта: moc.361@lxilumd* Внесено поровну
Получено 1 марта 2015 г .; Принято 19 ноября 2015 г.
Эта статья была процитирована другими статьями в PMC.Abstract
24-летняя женщина, у которой ранее была диагностирована незрелая тератома правого яичника, была направлена во Вторую больницу Даляньского медицинского университета (Далянь, Китай) из-за болей в животе. Ранее пациентка перенесла лапаротомию и овариэктомию правого яичника. Несмотря на это, через 10 лет после операции у пациента развились обширные метастазы в брюшную полость в сочетании с повышенными уровнями сывороточного ракового антигена (СА)-125 и СА19-9.У пациента был высокий риск рецидива, а метастазы в печени и селезенке впоследствии были диагностированы как зрелые тератомы. Чтобы предотвратить возможность рецидива заболевания, требуется частое послеоперационное наблюдение, состоящее из анализа изображений и тестирования сывороточных маркеров. Что касается опубликованной литературы, других пациентов с гигантской тератомой с ассоциированным метастазированием не было. Из-за отсутствия регулярных последующих посещений в Китае опухоль в настоящем исследовании была распознана слишком поздно.Таким образом, для повышения эффективности выявления рецидивирующих тератом необходим более длительный период наблюдения за пациентами с высоким риском рецидива.
Ранее пациентка перенесла лапаротомию и овариэктомию правого яичника. Несмотря на это, через 10 лет после операции у пациента развились обширные метастазы в брюшную полость в сочетании с повышенными уровнями сывороточного ракового антигена (СА)-125 и СА19-9.У пациента был высокий риск рецидива, а метастазы в печени и селезенке впоследствии были диагностированы как зрелые тератомы. Чтобы предотвратить возможность рецидива заболевания, требуется частое послеоперационное наблюдение, состоящее из анализа изображений и тестирования сывороточных маркеров. Что касается опубликованной литературы, других пациентов с гигантской тератомой с ассоциированным метастазированием не было. Из-за отсутствия регулярных последующих посещений в Китае опухоль в настоящем исследовании была распознана слишком поздно.Таким образом, для повышения эффективности выявления рецидивирующих тератом необходим более длительный период наблюдения за пациентами с высоким риском рецидива.
Ключевые слова: тератома, рецидив, метастазирование, синдром растущей тератомы энтодерма (желудочно-кишечный и бронхиальный эпителий, ткань щитовидной железы) и мезодерма (жир, кости, мышцы и хрящи) (1).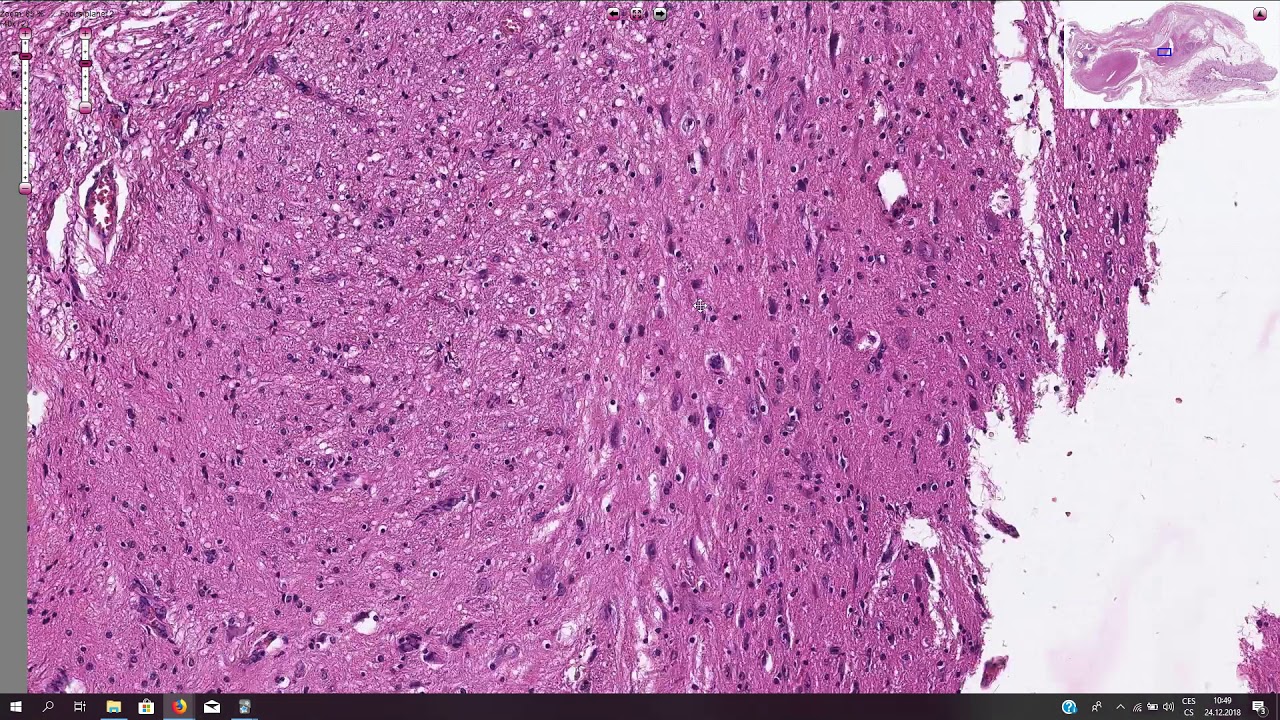 Незрелые тератомы — это редкие опухоли, развивающиеся в яичниках, на которые приходится 0,25–3% опухолей, развивающихся в яичниках, причем люди подвергаются большему риску в течение первых двух десятилетий жизни (1). Напротив, зрелые тератомы чаще всего встречаются у женщин в возрасте от 20 до 40 лет (2). Тератомы имеют высокую частоту рецидивов и метастазирования, а незрелые опухолевые ткани могут быть преобразованы в зрелые ткани после послеоперационного рецидива. Конверсия незрелой тератомы характеризуется медленным ростом, поэтому симптомы не типичны.Клиницисты часто пренебрегают диагностикой тератом. Если размер опухоли > 6 см, хирурги обычно прибегают к хирургическому лечению. Рецидив обычно развивается после хирургического удаления опухоли, часто в течение первого года первичной терапии (3). В настоящем исследовании описан случай пациентки, которой была выполнена резекция незрелой тератомы, которая в дальнейшем переросла в зрелые тератомы, обнаруженные в виде обширных абдоминальных метастазов в печень, селезенку и полость таза, выявленных через 10 лет.
Незрелые тератомы — это редкие опухоли, развивающиеся в яичниках, на которые приходится 0,25–3% опухолей, развивающихся в яичниках, причем люди подвергаются большему риску в течение первых двух десятилетий жизни (1). Напротив, зрелые тератомы чаще всего встречаются у женщин в возрасте от 20 до 40 лет (2). Тератомы имеют высокую частоту рецидивов и метастазирования, а незрелые опухолевые ткани могут быть преобразованы в зрелые ткани после послеоперационного рецидива. Конверсия незрелой тератомы характеризуется медленным ростом, поэтому симптомы не типичны.Клиницисты часто пренебрегают диагностикой тератом. Если размер опухоли > 6 см, хирурги обычно прибегают к хирургическому лечению. Рецидив обычно развивается после хирургического удаления опухоли, часто в течение первого года первичной терапии (3). В настоящем исследовании описан случай пациентки, которой была выполнена резекция незрелой тератомы, которая в дальнейшем переросла в зрелые тератомы, обнаруженные в виде обширных абдоминальных метастазов в печень, селезенку и полость таза, выявленных через 10 лет.
История болезни
24-летняя женщина была направлена в отделение общей хирургии Второй больницы Даляньского медицинского университета (Далянь, Китай) 24 апреля 2013 г. в связи с периодическими болями в верхней части живота. При физикальном осмотре правой половины живота было обнаружено твердое, крупное образование, подвижное при пальпации. Болезненность в животе, рикошетная боль и мышечное напряжение были неощутимыми, без каких-либо других положительных признаков. При подробном изучении анамнеза больной отмечена незрелая тератома правого яичника, диагностированная 10 лет назад, по поводу которой больной была выполнена лапаротомия и овариэктомия правого яичника.Послеоперационный патологический анализ выявил незрелую тератому с официальным диагнозом незрелой тератомы 2 степени [система классификации Норриса (4)]. Назначена адъювантная терапия, состоящая из 3 циклов блеомицина (20 ЕД/м 2 ), этопозида (1675 мг/м 2 ) и цисплатина (20 мг/м 2 ) после операции. На последнем сеансе химиотерапии остаточной опухоли не наблюдалось. Впоследствии пациент был потерян для последующего наблюдения.
На последнем сеансе химиотерапии остаточной опухоли не наблюдалось. Впоследствии пациент был потерян для последующего наблюдения.
На основании истории болезни пациента возникло подозрение на рецидив тератомы.Примечательно, что лабораторные тесты показали повышенный уровень сывороточных маркеров ракового антигена (СА)-125 и СА19-9 (). Для оценки гигантской опухоли в брюшной полости пациенту было проведено ультразвуковое исследование и компьютерная томография (КТ). Тотальная КТ брюшной полости с контрастированием выявила сложную кистозную массу размером 18,6×15,7 см 2 в правой доле печени (). Кроме того, в селезенке была обнаружена еще одна опухоль, которая проявляла те же свойства, что и гигантское образование (1).
(A) Улучшенное сканирование брюшной компьютерной томографии. Масса (18,6×15,7 см 2 ) была идентифицирована в правой доле печени, демонстрируя кальцификацию и кистозные изменения. (B) На поверхности селезенки также была идентифицирована масса, демонстрирующая кальцификацию (белая стрелка). (C) Абдоминальный коронарный срез показал, что сдавленный правый желудочек, правая почка и поджелудочная железа сместились влево, а в тазовой полости наблюдался асцит. (D) Сосудистое ремоделирование.
(C) Абдоминальный коронарный срез показал, что сдавленный правый желудочек, правая почка и поджелудочная железа сместились влево, а в тазовой полости наблюдался асцит. (D) Сосудистое ремоделирование.
Таблица I.
Динамическое изменение онкомаркеров.
| Уровень постхирургии, KU / L | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Уровень опухоли | Уровень до операции, KU / L | 7 сут. | 30 сут. | 180 сут.51 | 250.50 | 23.00 | 23.00 | 0.00-35.00 | |
| 440.63 | 201,9 | 40150 201 0 | 40150 | 5.20 | 0.00-35.00 | ||||
С учетом размера опухоли, сжатие симптоматики (правый желудочек, правая почка и поджелудочная железа смещены влево; ) и повышенных сывороточных маркеров наиболее вероятен диагноз незрелой тератомы.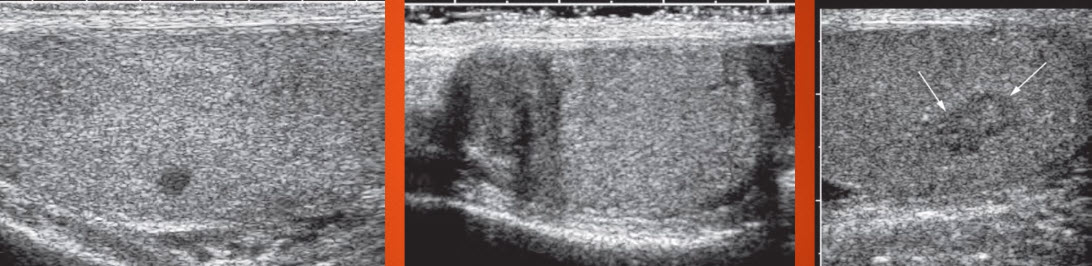 В последующем больному выполнена лапаротомия.Нельзя было исключить возможную инвазию опухоли в печень, поэтому было подготовлено искусственное кровообращение. После входа в брюшную полость опухоль удаляли из правой доли печени, блокировали первые ворота печени и резецировали правую печеночную вену в месте инфильтрации опухоли. В последующем удалось полностью удалить образование с поверхности селезенки. Гигантская опухоль была богата сальными веществами, внутри массы были идентифицированы ткани волосяного стержня и зубы.Отчет о патологии подтвердил, что все опухоли на поверхности печени и селезенки, а также в полости малого таза были зрелыми тератомами (). После резекции опухоли не было выявлено признаков рецидива или метастазирования в течение 1 и 6 месяцев наблюдения, и были запланированы последующие последующие обследования каждые 3–6 месяцев.
В последующем больному выполнена лапаротомия.Нельзя было исключить возможную инвазию опухоли в печень, поэтому было подготовлено искусственное кровообращение. После входа в брюшную полость опухоль удаляли из правой доли печени, блокировали первые ворота печени и резецировали правую печеночную вену в месте инфильтрации опухоли. В последующем удалось полностью удалить образование с поверхности селезенки. Гигантская опухоль была богата сальными веществами, внутри массы были идентифицированы ткани волосяного стержня и зубы.Отчет о патологии подтвердил, что все опухоли на поверхности печени и селезенки, а также в полости малого таза были зрелыми тератомами (). После резекции опухоли не было выявлено признаков рецидива или метастазирования в течение 1 и 6 месяцев наблюдения, и были запланированы последующие последующие обследования каждые 3–6 месяцев.
Общий образец печени. (A) Опухоль (29×24 см 2 ) содержала ткани стержня волоса и зубы (черная стрелка). (B) Внутри масса содержала обильные желеобразные и сальные вещества, ткани волосяного стержня и зубы.
Особенности окрашивания гематоксилином и эозином. (A) Зрелые компоненты бронхиальных эпителиальных клеток, бронхиальных желез и бронхиального хряща. (B) Типичный бронхиальный эпителий. Микрофотографии, показывающие ткань кожи с (C) сальными железами и (D) волосами, (E) пластинчатой костью и (F) кальцификацией. Увеличение, х100.
Обсуждение
Незрелые тератомы яичника являются редкими опухолями, составляя <3% всех тератом, расположенных в яичниках. Заболевание обычно возникает в течение первых двух десятилетий жизни, а опухоли состоят из ткани, происходящей из двух или более слоев зародышевых клеток (эктодермы, мезодермы и/или энтодермы), содержащей незрелые и эмбриональные структуры (1).Текущий случай представлен классическими симптомами и гистологическими проявлениями, связанными с незрелыми тератомами. Удаление таких опухолей часто сопровождается локальным рецидивом в течение первого года от начала первичной терапии (3). Настоящий пациент был потерян для последующего наблюдения после начальной химиотерапии, но у него развились редкие зрелые тератомы и обширные метастазы в брюшную полость через 10 лет.
Зрелые тератомы, как правило, доброкачественные, однако может произойти злокачественная трансформация, хотя и редко.Пик заболеваемости такими опухолями приходится на женщин в возрасте 20–40 лет. Заболевание характеризуется медленным ростом со скоростью роста 1,8 мм в год, а при размерах опухоли <6 см хирурги обычно прибегают к консервативному лечению (1). Синдром растущей тератомы — редкое состояние, наблюдающееся у мужчин и женщин, с опухолями зародышевых клеток, пролеченными соответствующим образом, характеризующееся персистенцией или развитием увеличивающихся масс после адъювантной химиотерапии, нормальными значениями маркеров опухоли и наличием зрелых тератом в образце.Если диагноз синдрома растущей тератомы подтверждается, хирург должен определить возможность операбельности опухоли, а также взвесить риски и преимущества хирургического вмешательства (5). Это необходимо для обеспечения оптимального лечения заболевания и предотвращения ненужной химиотерапии. В данном случае производители сыворотки, СА-125 и СА19-9, демонстрировали особенно высокие уровни по сравнению с уровнями, наблюдаемыми при синдроме растущей тератомы.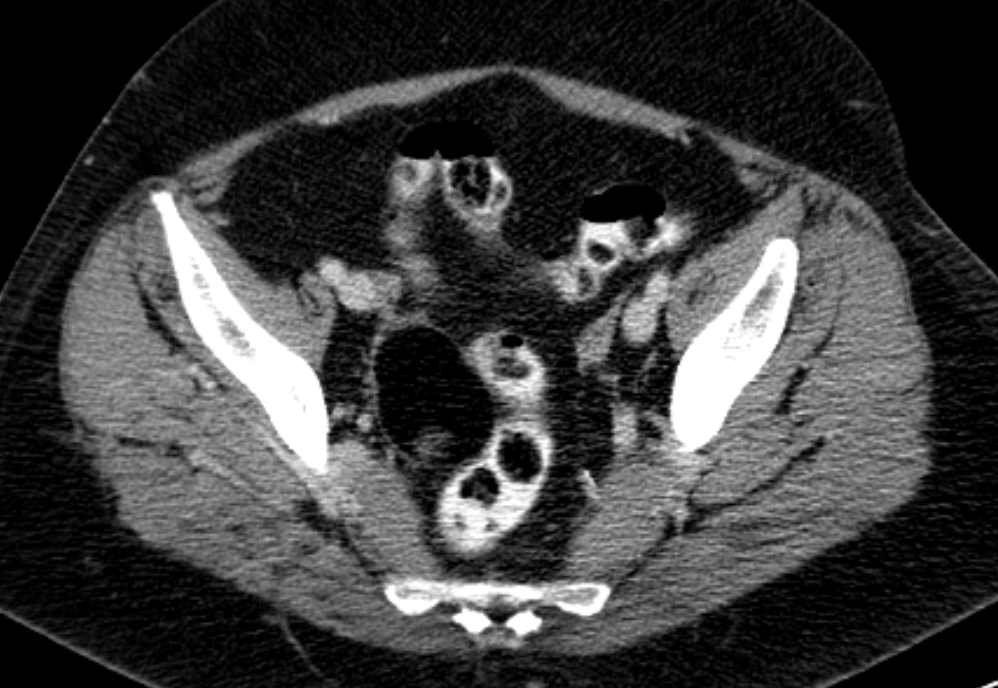 Иссечение проводили на опухолях размером менее 2 см.После операции на патологических срезах из разных мест опухоли незрелых элементов не обнаружено. Дальнейшее лечение пациентке не проводилось. Насколько нам известно, такое метастазирование зрелой тератомы в печень, селезенку и полость таза встречается особенно редко.
Иссечение проводили на опухолях размером менее 2 см.После операции на патологических срезах из разных мест опухоли незрелых элементов не обнаружено. Дальнейшее лечение пациентке не проводилось. Насколько нам известно, такое метастазирование зрелой тератомы в печень, селезенку и полость таза встречается особенно редко.
При постановке дифференциального диагноза тератом измерение сывороточных уровней СА-125 и СА19-9 является распространенным методом, используемым для раннего выявления. Ustunyurt и соавт. (6) сообщили, что сывороточный СА19-9 является наиболее надежным онкомаркером зрелых кистозных тератом яичников и что уровни сывороточного СА19-9 часто связаны с размером тератомы; однако он не обладает высокой специфичностью или чувствительностью.Bast и соавт. (7) сообщили, что СА-125 в сыворотке является надежным маркером и что в сочетании с повышенным уровнем СА19-9 это может быть дифференциальным признаком злокачественных опухолей. Примечательно, что в данном случае изменение уровней СА-125 и СА19-9 в сыворотке было больше по сравнению с типичным изменением (1).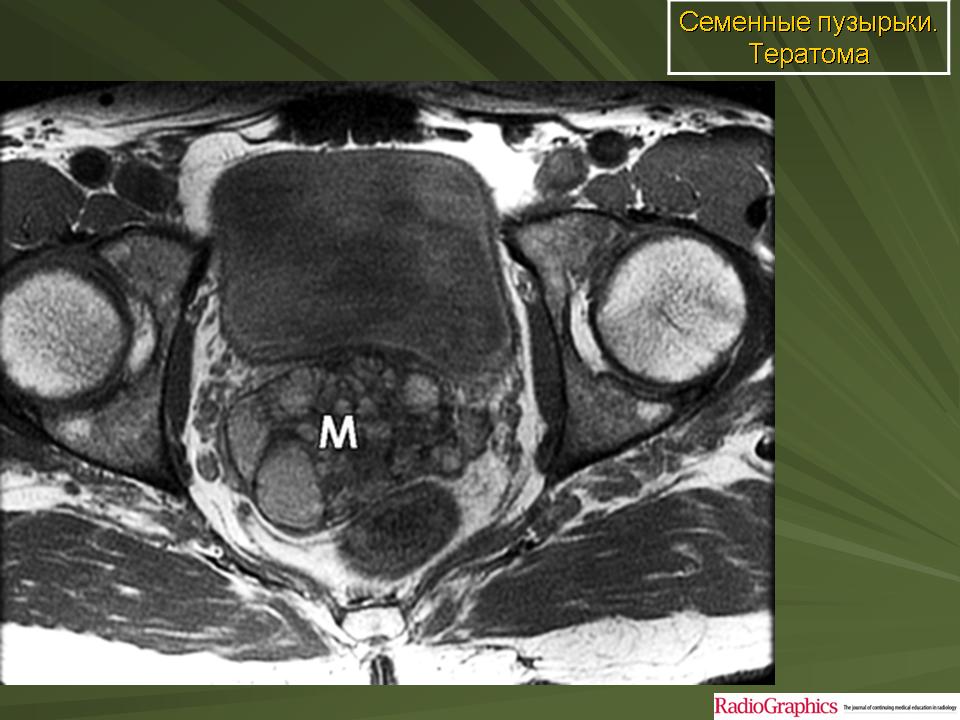
Harada и соавт. (8) предположили, что прогностическими факторами рецидива являются молодой возраст (<30 лет), большой размер кисты (>8 см) и двустороннее появление зрелых тератом.В данном случае у пациента был высокий риск рецидива. Чтобы предотвратить остаточное заболевание, требуется частый послеоперационный визуализирующий анализ и тестирование сывороточных маркеров. В литературе, насколько нам известно, не было описано ни одного пациента с гигантской тератомой, у которого были бы такие же редкие метастазы, как у пациента в данном случае. Из-за отсутствия повторных приемов в Китае опухоль была распознана слишком поздно. Для повышения вероятности выявления рецидивирующих тератом требуются более длительные периоды наблюдения за пациентами с высоким риском рецидива.
Ссылки
1. Saba L, Guerriero S, Sulcis R, Virgilio B, Melis G, Mallarini G. Зрелые и незрелые тератомы яичников: характеристики КТ, УЗИ и МРТ. Евр Дж Радиол. 2009; 72: 454–463. doi: 10.1016/j. ejrad.2008.07.044. [PubMed] [CrossRef] [Google Scholar]3. Барвад А., Дей П., Шивалингам Дж. Метастазы зрелого компонента в пролеченном случае незрелой тератомы, диагностированной при тонкоигольной аспирационной цитологии печени. Диагностика Цитопатол. 2011;39:711–713. doi: 10.1002/dc.21513. [PubMed] [CrossRef] [Google Scholar]4.Норрис Х.Дж., Зиркин Х.Дж., Бенсон В.Л. Незрелая (злокачественная) тератома яичника: клинико-патологическое исследование 58 случаев. Рак. 1976; 37: 2359–2372. doi: 10.1002/1097-0142(197605)37:5<2359::AID-CNCR2820370528>3.0.CO;2-Q. [PubMed] [CrossRef] [Google Scholar]5. Берд К., Стани М.П., Гербольд Н.К., Лит К.А., III, Гамильтон К.А. Синдром растущей тератомы: краткое сообщение и алгоритм управления. Aust NZ J Obstet Gynaecol. 2013;53:318–321. doi: 10.1111/ajo.12084. [PubMed] [CrossRef] [Google Scholar]6.Устунюрт Э., Гунгор Т., Искендер С., Устунюрт Б.О., Бильге У., Молламахмутоглу Л. Онкомаркеры в зрелых кистозных тератомах яичника. Arch Gynecol Obstet. 2009; 279: 145–147.
ejrad.2008.07.044. [PubMed] [CrossRef] [Google Scholar]3. Барвад А., Дей П., Шивалингам Дж. Метастазы зрелого компонента в пролеченном случае незрелой тератомы, диагностированной при тонкоигольной аспирационной цитологии печени. Диагностика Цитопатол. 2011;39:711–713. doi: 10.1002/dc.21513. [PubMed] [CrossRef] [Google Scholar]4.Норрис Х.Дж., Зиркин Х.Дж., Бенсон В.Л. Незрелая (злокачественная) тератома яичника: клинико-патологическое исследование 58 случаев. Рак. 1976; 37: 2359–2372. doi: 10.1002/1097-0142(197605)37:5<2359::AID-CNCR2820370528>3.0.CO;2-Q. [PubMed] [CrossRef] [Google Scholar]5. Берд К., Стани М.П., Гербольд Н.К., Лит К.А., III, Гамильтон К.А. Синдром растущей тератомы: краткое сообщение и алгоритм управления. Aust NZ J Obstet Gynaecol. 2013;53:318–321. doi: 10.1111/ajo.12084. [PubMed] [CrossRef] [Google Scholar]6.Устунюрт Э., Гунгор Т., Искендер С., Устунюрт Б.О., Бильге У., Молламахмутоглу Л. Онкомаркеры в зрелых кистозных тератомах яичника. Arch Gynecol Obstet. 2009; 279: 145–147. doi: 10.1007/s00404-008-0688-2. [PubMed] [CrossRef] [Google Scholar]7. Bast RC, Jr, Badgwell D, Lu Z, Marquez R, Rosen D, Liu J, Baggerly KA, Atkinson EN, Skates S, Zhang Z, et al. Новые онкомаркеры: CA125 и выше. Int J Gynecol Рак. 2005; 15 (Приложение 3): 274–281. doi: 10.1111/j.1525-1438.2005.00441.x. [PubMed] [CrossRef] [Google Scholar]8.Harada M, Osuga Y, Fujimoto A, Fujimoto A, Fujii T, Yano T, Kozuma S. Прогностические факторы рецидива зрелых кистозных тератом яичников после хирургического удаления. Eur J Obstet Gynecol Reprod Biol. 2013; 171:325–328. doi: 10.1016/j.ejogrb.2013.09.004. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1007/s00404-008-0688-2. [PubMed] [CrossRef] [Google Scholar]7. Bast RC, Jr, Badgwell D, Lu Z, Marquez R, Rosen D, Liu J, Baggerly KA, Atkinson EN, Skates S, Zhang Z, et al. Новые онкомаркеры: CA125 и выше. Int J Gynecol Рак. 2005; 15 (Приложение 3): 274–281. doi: 10.1111/j.1525-1438.2005.00441.x. [PubMed] [CrossRef] [Google Scholar]8.Harada M, Osuga Y, Fujimoto A, Fujimoto A, Fujii T, Yano T, Kozuma S. Прогностические факторы рецидива зрелых кистозных тератом яичников после хирургического удаления. Eur J Obstet Gynecol Reprod Biol. 2013; 171:325–328. doi: 10.1016/j.ejogrb.2013.09.004. [PubMed] [CrossRef] [Google Scholar]Необычный рецидив незрелой тератомы: история болезни
Oncol Lett. 2016 апрель; 11(4): 2453–2456.
XUELU LI
1 Отделение хирургии груди, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, с.R. China
DANDAN ZHU
2 Отделение интенсивной терапии, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, КНР
LI LV
3 Отделение патологии, Вторая больница Даляньский медицинский университет, Далянь, Ляонин 116023, КНР
JIAN YU
2 Отделение интенсивной терапии, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, с.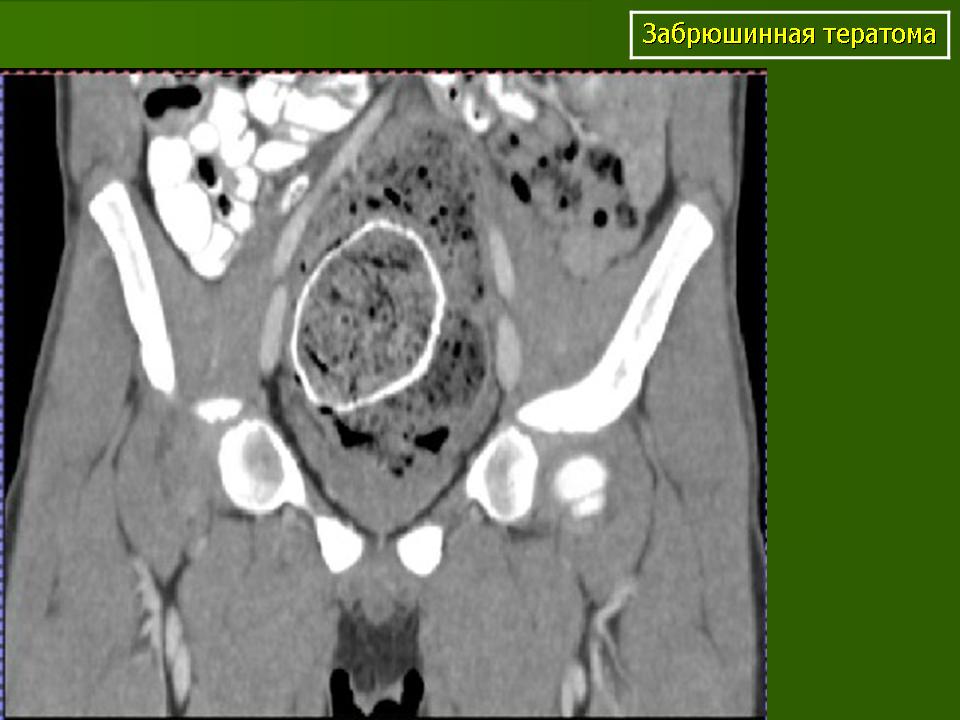 Республика Китай
Республика Китай
1 Отделение хирургии груди, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, КНР Китай
2 Отделение интенсивной терапии, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, КНР
3 Отделение патологии, Вторая больница Даляньского медицинского университета, Далянь, Ляонин 116023, КНР
Связь с : Д-р Цзянь Ю, отделение реаниматологии, Вторая больница Даляньского медицинского университета Университет, 467 Zhong Shan Road, Далянь, Ляонин 116023, с.Р. Китай, электронная почта: moc.361@lxilumd* Внесено поровну
Получено 1 марта 2015 г .; Принято 19 ноября 2015 г.
Эта статья была процитирована другими статьями в PMC.Abstract
24-летняя женщина, у которой ранее была диагностирована незрелая тератома правого яичника, была направлена во Вторую больницу Даляньского медицинского университета (Далянь, Китай) из-за болей в животе.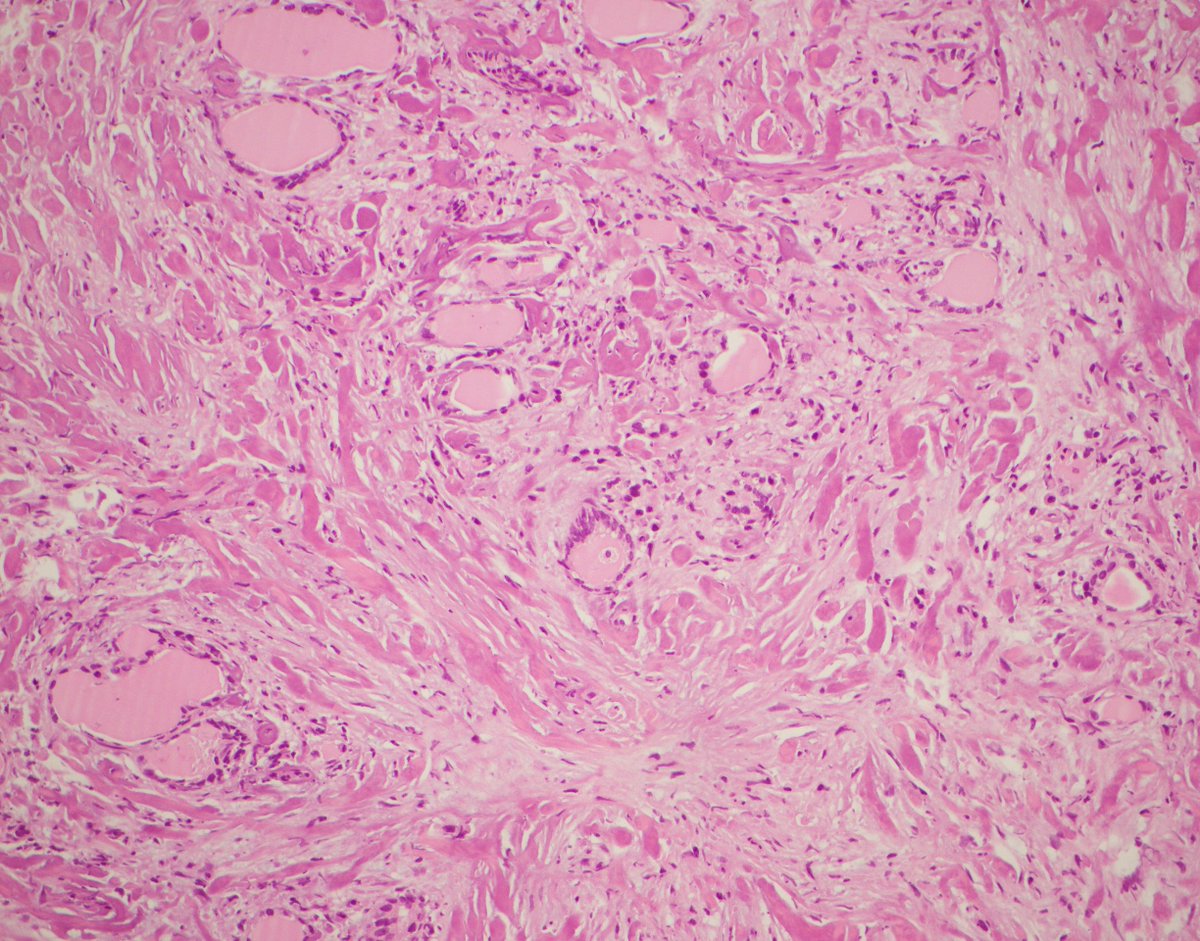 Ранее пациентка перенесла лапаротомию и овариэктомию правого яичника. Несмотря на это, через 10 лет после операции у пациента развились обширные метастазы в брюшную полость в сочетании с повышенными уровнями сывороточного ракового антигена (СА)-125 и СА19-9.У пациента был высокий риск рецидива, а метастазы в печени и селезенке впоследствии были диагностированы как зрелые тератомы. Чтобы предотвратить возможность рецидива заболевания, требуется частое послеоперационное наблюдение, состоящее из анализа изображений и тестирования сывороточных маркеров. Что касается опубликованной литературы, других пациентов с гигантской тератомой с ассоциированным метастазированием не было. Из-за отсутствия регулярных последующих посещений в Китае опухоль в настоящем исследовании была распознана слишком поздно.Таким образом, для повышения эффективности выявления рецидивирующих тератом необходим более длительный период наблюдения за пациентами с высоким риском рецидива.
Ранее пациентка перенесла лапаротомию и овариэктомию правого яичника. Несмотря на это, через 10 лет после операции у пациента развились обширные метастазы в брюшную полость в сочетании с повышенными уровнями сывороточного ракового антигена (СА)-125 и СА19-9.У пациента был высокий риск рецидива, а метастазы в печени и селезенке впоследствии были диагностированы как зрелые тератомы. Чтобы предотвратить возможность рецидива заболевания, требуется частое послеоперационное наблюдение, состоящее из анализа изображений и тестирования сывороточных маркеров. Что касается опубликованной литературы, других пациентов с гигантской тератомой с ассоциированным метастазированием не было. Из-за отсутствия регулярных последующих посещений в Китае опухоль в настоящем исследовании была распознана слишком поздно.Таким образом, для повышения эффективности выявления рецидивирующих тератом необходим более длительный период наблюдения за пациентами с высоким риском рецидива.
Ключевые слова: тератома, рецидив, метастазирование, синдром растущей тератомы энтодерма (желудочно-кишечный и бронхиальный эпителий, ткань щитовидной железы) и мезодерма (жир, кости, мышцы и хрящи) (1).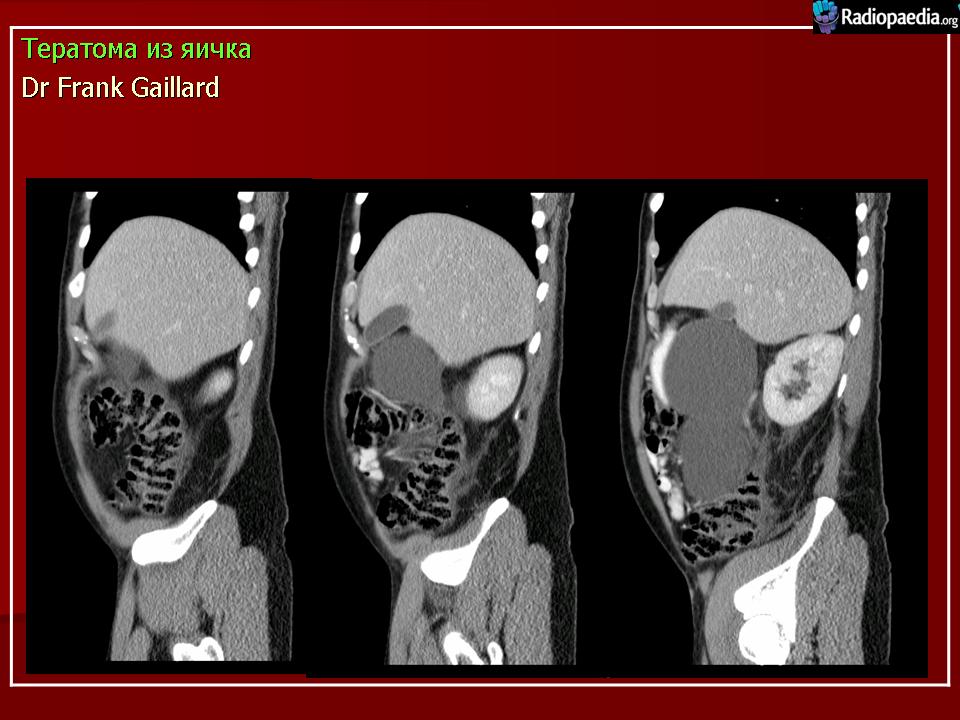 Незрелые тератомы — это редкие опухоли, развивающиеся в яичниках, на которые приходится 0,25–3% опухолей, развивающихся в яичниках, причем люди подвергаются большему риску в течение первых двух десятилетий жизни (1). Напротив, зрелые тератомы чаще всего встречаются у женщин в возрасте от 20 до 40 лет (2). Тератомы имеют высокую частоту рецидивов и метастазирования, а незрелые опухолевые ткани могут быть преобразованы в зрелые ткани после послеоперационного рецидива. Конверсия незрелой тератомы характеризуется медленным ростом, поэтому симптомы не типичны.Клиницисты часто пренебрегают диагностикой тератом. Если размер опухоли > 6 см, хирурги обычно прибегают к хирургическому лечению. Рецидив обычно развивается после хирургического удаления опухоли, часто в течение первого года первичной терапии (3). В настоящем исследовании описан случай пациентки, которой была выполнена резекция незрелой тератомы, которая в дальнейшем переросла в зрелые тератомы, обнаруженные в виде обширных абдоминальных метастазов в печень, селезенку и полость таза, выявленных через 10 лет.
Незрелые тератомы — это редкие опухоли, развивающиеся в яичниках, на которые приходится 0,25–3% опухолей, развивающихся в яичниках, причем люди подвергаются большему риску в течение первых двух десятилетий жизни (1). Напротив, зрелые тератомы чаще всего встречаются у женщин в возрасте от 20 до 40 лет (2). Тератомы имеют высокую частоту рецидивов и метастазирования, а незрелые опухолевые ткани могут быть преобразованы в зрелые ткани после послеоперационного рецидива. Конверсия незрелой тератомы характеризуется медленным ростом, поэтому симптомы не типичны.Клиницисты часто пренебрегают диагностикой тератом. Если размер опухоли > 6 см, хирурги обычно прибегают к хирургическому лечению. Рецидив обычно развивается после хирургического удаления опухоли, часто в течение первого года первичной терапии (3). В настоящем исследовании описан случай пациентки, которой была выполнена резекция незрелой тератомы, которая в дальнейшем переросла в зрелые тератомы, обнаруженные в виде обширных абдоминальных метастазов в печень, селезенку и полость таза, выявленных через 10 лет.
История болезни
24-летняя женщина была направлена в отделение общей хирургии Второй больницы Даляньского медицинского университета (Далянь, Китай) 24 апреля 2013 г. в связи с периодическими болями в верхней части живота. При физикальном осмотре правой половины живота было обнаружено твердое, крупное образование, подвижное при пальпации. Болезненность в животе, рикошетная боль и мышечное напряжение были неощутимыми, без каких-либо других положительных признаков. При подробном изучении анамнеза больной отмечена незрелая тератома правого яичника, диагностированная 10 лет назад, по поводу которой больной была выполнена лапаротомия и овариэктомия правого яичника.Послеоперационный патологический анализ выявил незрелую тератому с официальным диагнозом незрелой тератомы 2 степени [система классификации Норриса (4)]. Назначена адъювантная терапия, состоящая из 3 циклов блеомицина (20 ЕД/м 2 ), этопозида (1675 мг/м 2 ) и цисплатина (20 мг/м 2 ) после операции. На последнем сеансе химиотерапии остаточной опухоли не наблюдалось. Впоследствии пациент был потерян для последующего наблюдения.
На последнем сеансе химиотерапии остаточной опухоли не наблюдалось. Впоследствии пациент был потерян для последующего наблюдения.
На основании истории болезни пациента возникло подозрение на рецидив тератомы.Примечательно, что лабораторные тесты показали повышенный уровень сывороточных маркеров ракового антигена (СА)-125 и СА19-9 (). Для оценки гигантской опухоли в брюшной полости пациенту было проведено ультразвуковое исследование и компьютерная томография (КТ). Тотальная КТ брюшной полости с контрастированием выявила сложную кистозную массу размером 18,6×15,7 см 2 в правой доле печени (). Кроме того, в селезенке была обнаружена еще одна опухоль, которая проявляла те же свойства, что и гигантское образование (1).
(A) Улучшенное сканирование брюшной компьютерной томографии. Масса (18,6×15,7 см 2 ) была идентифицирована в правой доле печени, демонстрируя кальцификацию и кистозные изменения. (B) На поверхности селезенки также была идентифицирована масса, демонстрирующая кальцификацию (белая стрелка). (C) Абдоминальный коронарный срез показал, что сдавленный правый желудочек, правая почка и поджелудочная железа сместились влево, а в тазовой полости наблюдался асцит. (D) Сосудистое ремоделирование.
(C) Абдоминальный коронарный срез показал, что сдавленный правый желудочек, правая почка и поджелудочная железа сместились влево, а в тазовой полости наблюдался асцит. (D) Сосудистое ремоделирование.
Таблица I.
Динамическое изменение онкомаркеров.
| Уровень постхирургии, KU / L | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Уровень опухоли | Уровень до операции, KU / L | 7 сут. | 30 сут. | 180 сут.51 | 250.50 | 23.00 | 23.00 | 0.00-35.00 | |
| 440.63 | 201,9 | 40150 201 0 | 40150 | 5.20 | 0.00-35.00 | ||||
С учетом размера опухоли, сжатие симптоматики (правый желудочек, правая почка и поджелудочная железа смещены влево; ) и повышенных сывороточных маркеров наиболее вероятен диагноз незрелой тератомы. В последующем больному выполнена лапаротомия.Нельзя было исключить возможную инвазию опухоли в печень, поэтому было подготовлено искусственное кровообращение. После входа в брюшную полость опухоль удаляли из правой доли печени, блокировали первые ворота печени и резецировали правую печеночную вену в месте инфильтрации опухоли. В последующем удалось полностью удалить образование с поверхности селезенки. Гигантская опухоль была богата сальными веществами, внутри массы были идентифицированы ткани волосяного стержня и зубы.Отчет о патологии подтвердил, что все опухоли на поверхности печени и селезенки, а также в полости малого таза были зрелыми тератомами (). После резекции опухоли не было выявлено признаков рецидива или метастазирования в течение 1 и 6 месяцев наблюдения, и были запланированы последующие последующие обследования каждые 3–6 месяцев.
В последующем больному выполнена лапаротомия.Нельзя было исключить возможную инвазию опухоли в печень, поэтому было подготовлено искусственное кровообращение. После входа в брюшную полость опухоль удаляли из правой доли печени, блокировали первые ворота печени и резецировали правую печеночную вену в месте инфильтрации опухоли. В последующем удалось полностью удалить образование с поверхности селезенки. Гигантская опухоль была богата сальными веществами, внутри массы были идентифицированы ткани волосяного стержня и зубы.Отчет о патологии подтвердил, что все опухоли на поверхности печени и селезенки, а также в полости малого таза были зрелыми тератомами (). После резекции опухоли не было выявлено признаков рецидива или метастазирования в течение 1 и 6 месяцев наблюдения, и были запланированы последующие последующие обследования каждые 3–6 месяцев.
Общий образец печени. (A) Опухоль (29×24 см 2 ) содержала ткани стержня волоса и зубы (черная стрелка). (B) Внутри масса содержала обильные желеобразные и сальные вещества, ткани волосяного стержня и зубы.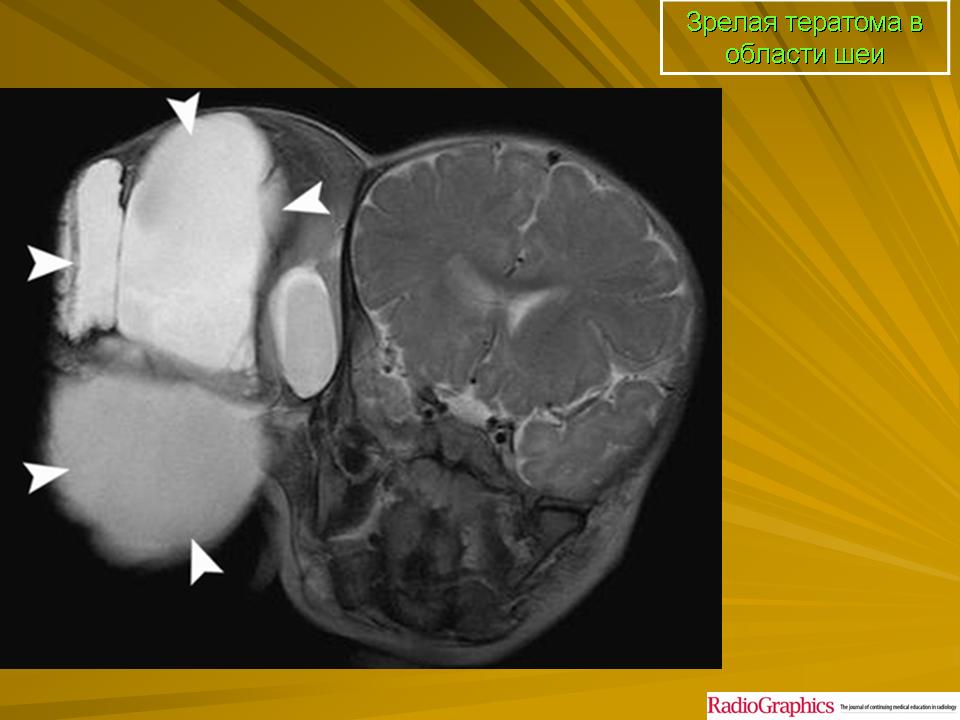
Особенности окрашивания гематоксилином и эозином. (A) Зрелые компоненты бронхиальных эпителиальных клеток, бронхиальных желез и бронхиального хряща. (B) Типичный бронхиальный эпителий. Микрофотографии, показывающие ткань кожи с (C) сальными железами и (D) волосами, (E) пластинчатой костью и (F) кальцификацией. Увеличение, х100.
Обсуждение
Незрелые тератомы яичника являются редкими опухолями, составляя <3% всех тератом, расположенных в яичниках. Заболевание обычно возникает в течение первых двух десятилетий жизни, а опухоли состоят из ткани, происходящей из двух или более слоев зародышевых клеток (эктодермы, мезодермы и/или энтодермы), содержащей незрелые и эмбриональные структуры (1).Текущий случай представлен классическими симптомами и гистологическими проявлениями, связанными с незрелыми тератомами. Удаление таких опухолей часто сопровождается локальным рецидивом в течение первого года от начала первичной терапии (3). Настоящий пациент был потерян для последующего наблюдения после начальной химиотерапии, но у него развились редкие зрелые тератомы и обширные метастазы в брюшную полость через 10 лет.
Зрелые тератомы, как правило, доброкачественные, однако может произойти злокачественная трансформация, хотя и редко.Пик заболеваемости такими опухолями приходится на женщин в возрасте 20–40 лет. Заболевание характеризуется медленным ростом со скоростью роста 1,8 мм в год, а при размерах опухоли <6 см хирурги обычно прибегают к консервативному лечению (1). Синдром растущей тератомы — редкое состояние, наблюдающееся у мужчин и женщин, с опухолями зародышевых клеток, пролеченными соответствующим образом, характеризующееся персистенцией или развитием увеличивающихся масс после адъювантной химиотерапии, нормальными значениями маркеров опухоли и наличием зрелых тератом в образце.Если диагноз синдрома растущей тератомы подтверждается, хирург должен определить возможность операбельности опухоли, а также взвесить риски и преимущества хирургического вмешательства (5). Это необходимо для обеспечения оптимального лечения заболевания и предотвращения ненужной химиотерапии. В данном случае производители сыворотки, СА-125 и СА19-9, демонстрировали особенно высокие уровни по сравнению с уровнями, наблюдаемыми при синдроме растущей тератомы.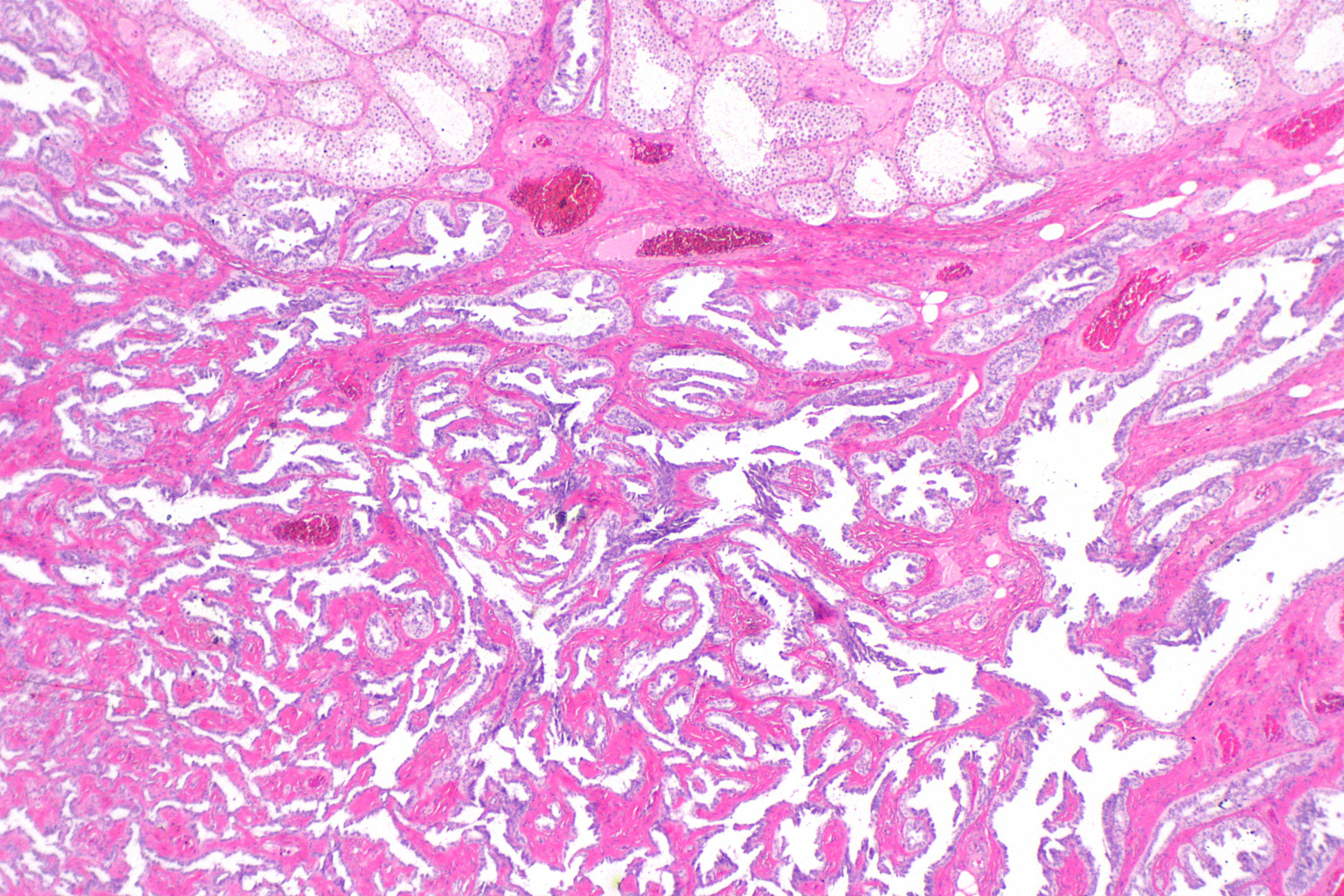 Иссечение проводили на опухолях размером менее 2 см.После операции на патологических срезах из разных мест опухоли незрелых элементов не обнаружено. Дальнейшее лечение пациентке не проводилось. Насколько нам известно, такое метастазирование зрелой тератомы в печень, селезенку и полость таза встречается особенно редко.
Иссечение проводили на опухолях размером менее 2 см.После операции на патологических срезах из разных мест опухоли незрелых элементов не обнаружено. Дальнейшее лечение пациентке не проводилось. Насколько нам известно, такое метастазирование зрелой тератомы в печень, селезенку и полость таза встречается особенно редко.
При постановке дифференциального диагноза тератом измерение сывороточных уровней СА-125 и СА19-9 является распространенным методом, используемым для раннего выявления. Ustunyurt и соавт. (6) сообщили, что сывороточный СА19-9 является наиболее надежным онкомаркером зрелых кистозных тератом яичников и что уровни сывороточного СА19-9 часто связаны с размером тератомы; однако он не обладает высокой специфичностью или чувствительностью.Bast и соавт. (7) сообщили, что СА-125 в сыворотке является надежным маркером и что в сочетании с повышенным уровнем СА19-9 это может быть дифференциальным признаком злокачественных опухолей. Примечательно, что в данном случае изменение уровней СА-125 и СА19-9 в сыворотке было больше по сравнению с типичным изменением (1).
Harada и соавт. (8) предположили, что прогностическими факторами рецидива являются молодой возраст (<30 лет), большой размер кисты (>8 см) и двустороннее появление зрелых тератом.В данном случае у пациента был высокий риск рецидива. Чтобы предотвратить остаточное заболевание, требуется частый послеоперационный визуализирующий анализ и тестирование сывороточных маркеров. В литературе, насколько нам известно, не было описано ни одного пациента с гигантской тератомой, у которого были бы такие же редкие метастазы, как у пациента в данном случае. Из-за отсутствия повторных приемов в Китае опухоль была распознана слишком поздно. Для повышения вероятности выявления рецидивирующих тератом требуются более длительные периоды наблюдения за пациентами с высоким риском рецидива.
Ссылки
1. Saba L, Guerriero S, Sulcis R, Virgilio B, Melis G, Mallarini G. Зрелые и незрелые тератомы яичников: характеристики КТ, УЗИ и МРТ. Евр Дж Радиол. 2009; 72: 454–463. doi: 10.1016/j.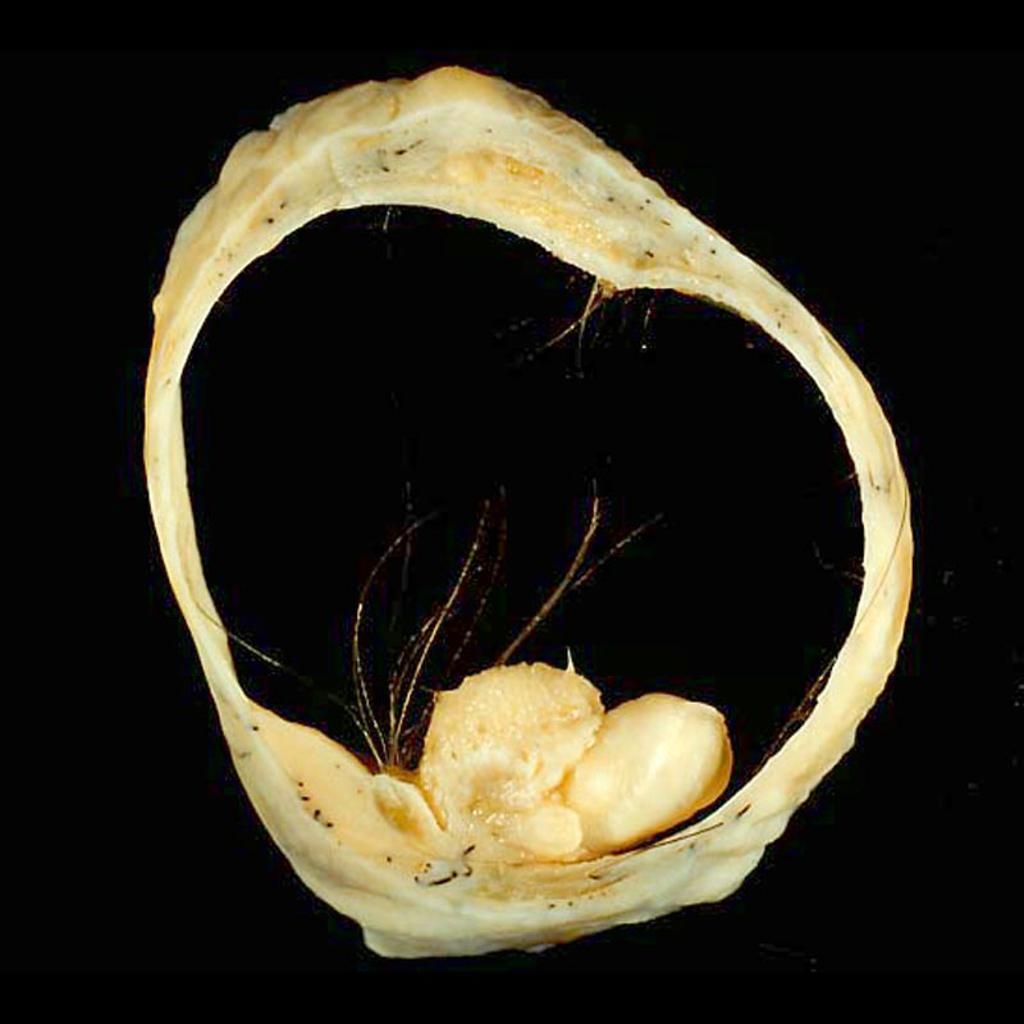 ejrad.2008.07.044. [PubMed] [CrossRef] [Google Scholar]3. Барвад А., Дей П., Шивалингам Дж. Метастазы зрелого компонента в пролеченном случае незрелой тератомы, диагностированной при тонкоигольной аспирационной цитологии печени. Диагностика Цитопатол. 2011;39:711–713. doi: 10.1002/dc.21513. [PubMed] [CrossRef] [Google Scholar]4.Норрис Х.Дж., Зиркин Х.Дж., Бенсон В.Л. Незрелая (злокачественная) тератома яичника: клинико-патологическое исследование 58 случаев. Рак. 1976; 37: 2359–2372. doi: 10.1002/1097-0142(197605)37:5<2359::AID-CNCR2820370528>3.0.CO;2-Q. [PubMed] [CrossRef] [Google Scholar]5. Берд К., Стани М.П., Гербольд Н.К., Лит К.А., III, Гамильтон К.А. Синдром растущей тератомы: краткое сообщение и алгоритм управления. Aust NZ J Obstet Gynaecol. 2013;53:318–321. doi: 10.1111/ajo.12084. [PubMed] [CrossRef] [Google Scholar]6.Устунюрт Э., Гунгор Т., Искендер С., Устунюрт Б.О., Бильге У., Молламахмутоглу Л. Онкомаркеры в зрелых кистозных тератомах яичника. Arch Gynecol Obstet. 2009; 279: 145–147.
ejrad.2008.07.044. [PubMed] [CrossRef] [Google Scholar]3. Барвад А., Дей П., Шивалингам Дж. Метастазы зрелого компонента в пролеченном случае незрелой тератомы, диагностированной при тонкоигольной аспирационной цитологии печени. Диагностика Цитопатол. 2011;39:711–713. doi: 10.1002/dc.21513. [PubMed] [CrossRef] [Google Scholar]4.Норрис Х.Дж., Зиркин Х.Дж., Бенсон В.Л. Незрелая (злокачественная) тератома яичника: клинико-патологическое исследование 58 случаев. Рак. 1976; 37: 2359–2372. doi: 10.1002/1097-0142(197605)37:5<2359::AID-CNCR2820370528>3.0.CO;2-Q. [PubMed] [CrossRef] [Google Scholar]5. Берд К., Стани М.П., Гербольд Н.К., Лит К.А., III, Гамильтон К.А. Синдром растущей тератомы: краткое сообщение и алгоритм управления. Aust NZ J Obstet Gynaecol. 2013;53:318–321. doi: 10.1111/ajo.12084. [PubMed] [CrossRef] [Google Scholar]6.Устунюрт Э., Гунгор Т., Искендер С., Устунюрт Б.О., Бильге У., Молламахмутоглу Л. Онкомаркеры в зрелых кистозных тератомах яичника. Arch Gynecol Obstet. 2009; 279: 145–147. doi: 10.1007/s00404-008-0688-2. [PubMed] [CrossRef] [Google Scholar]7. Bast RC, Jr, Badgwell D, Lu Z, Marquez R, Rosen D, Liu J, Baggerly KA, Atkinson EN, Skates S, Zhang Z, et al. Новые онкомаркеры: CA125 и выше. Int J Gynecol Рак. 2005; 15 (Приложение 3): 274–281. doi: 10.1111/j.1525-1438.2005.00441.x. [PubMed] [CrossRef] [Google Scholar]8.Harada M, Osuga Y, Fujimoto A, Fujimoto A, Fujii T, Yano T, Kozuma S. Прогностические факторы рецидива зрелых кистозных тератом яичников после хирургического удаления. Eur J Obstet Gynecol Reprod Biol. 2013; 171:325–328. doi: 10.1016/j.ejogrb.2013.09.004. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1007/s00404-008-0688-2. [PubMed] [CrossRef] [Google Scholar]7. Bast RC, Jr, Badgwell D, Lu Z, Marquez R, Rosen D, Liu J, Baggerly KA, Atkinson EN, Skates S, Zhang Z, et al. Новые онкомаркеры: CA125 и выше. Int J Gynecol Рак. 2005; 15 (Приложение 3): 274–281. doi: 10.1111/j.1525-1438.2005.00441.x. [PubMed] [CrossRef] [Google Scholar]8.Harada M, Osuga Y, Fujimoto A, Fujimoto A, Fujii T, Yano T, Kozuma S. Прогностические факторы рецидива зрелых кистозных тератом яичников после хирургического удаления. Eur J Obstet Gynecol Reprod Biol. 2013; 171:325–328. doi: 10.1016/j.ejogrb.2013.09.004. [PubMed] [CrossRef] [Google Scholar]Случай рецидивирующей двусторонней зрелой тератомы яичников у молодой женщины | BMC Women’s Health
Слово «тератома» происходит от греческого слова «тератон», означающего чудовище, а термин «дермоидная киста» был введен Лебланом в 1831 году [1, 2].Тератомы часто состоят из нескольких эмбриональных слоев и классифицируются как зрелые или незрелые типы.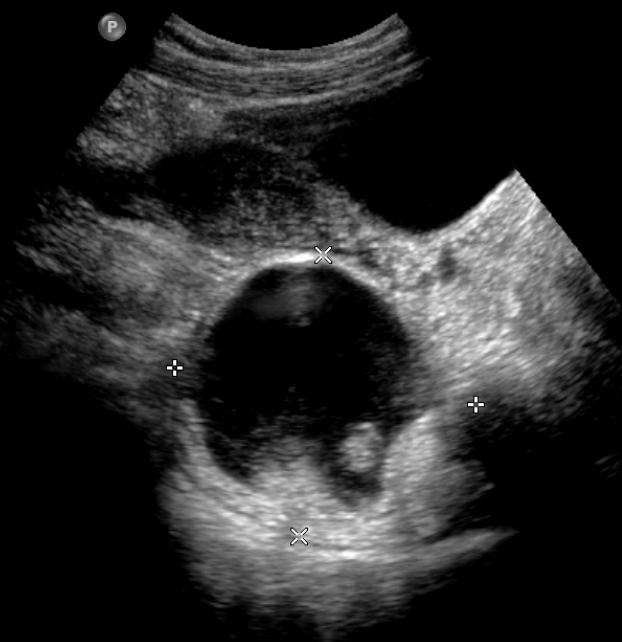 Зрелый тип тератомы является доброкачественным, тогда как незрелый тип тератомы также является доброкачественным, но имеет более агрессивное течение [3]. Зрелые кистозные тератомы являются наиболее распространенным типом, на их долю приходится примерно 10–20% всех случаев опухолей яичников [4]. Заболевание встречается у пациенток практически любого возраста, от детского возраста до постменопаузы, хотя пик заболеваемости приходится на женщин в возрасте 20–40 лет [5].Зрелые кистозные тератомы обычно растут медленно, с расчетной скоростью роста 1,8 мм/год [6], хотя было показано, что некоторые из них растут быстрее. Зрелые кистозные тератомы обычно односторонние, и только примерно 8–15% являются двусторонними; кроме того, они имеют долгосрочную частоту рецидивов после хирургического удаления 4,2% [7]. В данном случае у пациентки в анамнезе было 3 тератомы правого яичника, и клиническое течение включало переход от односторонних к двусторонним опухолям. Насколько нам известно, эти находки редки среди случаев зрелых кистозных тератом яичников.
Зрелый тип тератомы является доброкачественным, тогда как незрелый тип тератомы также является доброкачественным, но имеет более агрессивное течение [3]. Зрелые кистозные тератомы являются наиболее распространенным типом, на их долю приходится примерно 10–20% всех случаев опухолей яичников [4]. Заболевание встречается у пациенток практически любого возраста, от детского возраста до постменопаузы, хотя пик заболеваемости приходится на женщин в возрасте 20–40 лет [5].Зрелые кистозные тератомы обычно растут медленно, с расчетной скоростью роста 1,8 мм/год [6], хотя было показано, что некоторые из них растут быстрее. Зрелые кистозные тератомы обычно односторонние, и только примерно 8–15% являются двусторонними; кроме того, они имеют долгосрочную частоту рецидивов после хирургического удаления 4,2% [7]. В данном случае у пациентки в анамнезе было 3 тератомы правого яичника, и клиническое течение включало переход от односторонних к двусторонним опухолям. Насколько нам известно, эти находки редки среди случаев зрелых кистозных тератом яичников.
Повышение уровня эстрогена и прогестерона может объяснить увеличение размеров зрелых кистозных тератом после полового созревания и остановку их роста после менопаузы [8]. У взрослых пациентов зрелые кистозные тератомы часто обнаруживаются случайно во время рутинных процедур визуализации или во время операций на органах брюшной полости или таза, выполненных по другим причинам; большинство этих случаев (64,5%) протекают бессимптомно [9]. Однако у детей и подростков эти опухоли яичников также могут иметь различные клинические проявления, такие как боль и вздутие живота, вызванные перекрутом опухоли или раздражением связок [10].
Ультрасонография и онкомаркеры, такие как СА125, СА19-9 и альфа-фетопротеин, являются распространенными инструментами, используемыми для раннего выявления и характеристики образований яичников, таких как зрелые или незрелые тератомы. Ультрасонография — превосходная неинвазивная исследовательская процедура, которую можно использовать для женщин любого возраста [11, 12]. Среди вышеупомянутых опухолевых образователей сывороточный CA19-9 является наиболее надежным биомаркером зрелых кистозных тератом яичников; более высокие уровни сывороточного CA19-9 коррелируют с большими размерами опухоли.Однако диагностическая ценность СА19-9 у пациентов со зрелыми кистозными опухолями невелика при использовании отдельно [13]. Клинически сывороточный CA125 до сих пор используется для различения доброкачественных и злокачественных образований таза [14]. В данном случае был отмечен переход от одностороннего к двустороннему поражению яичников с повышенным уровнем СА125 (103,1 ЕД/мл). На основании данных серологического исследования мы заподозрили наличие злокачественного новообразования. Поэтому ей была проведена КТ брюшной полости и таза с контрастированием, а также диагностическая лапаротомия.Гистопатологические данные подтвердили наличие двусторонних зрелых кистозных тератом.
Среди вышеупомянутых опухолевых образователей сывороточный CA19-9 является наиболее надежным биомаркером зрелых кистозных тератом яичников; более высокие уровни сывороточного CA19-9 коррелируют с большими размерами опухоли.Однако диагностическая ценность СА19-9 у пациентов со зрелыми кистозными опухолями невелика при использовании отдельно [13]. Клинически сывороточный CA125 до сих пор используется для различения доброкачественных и злокачественных образований таза [14]. В данном случае был отмечен переход от одностороннего к двустороннему поражению яичников с повышенным уровнем СА125 (103,1 ЕД/мл). На основании данных серологического исследования мы заподозрили наличие злокачественного новообразования. Поэтому ей была проведена КТ брюшной полости и таза с контрастированием, а также диагностическая лапаротомия.Гистопатологические данные подтвердили наличие двусторонних зрелых кистозных тератом.
У большинства пациентов со зрелыми кистозными тератомами лапароскопическое или лапаротомное хирургическое иссечение может поставить окончательный диагноз, облегчить симптомы и предотвратить осложнения [15]. Лапароскопическое лечение опухолей яичников является потенциально более безопасной альтернативой для молодых женщин, у которых сохранение фертильности является желательным результатом [16]. Зарегистрированная частота послеоперационного рецидива на одном и том же яичнике составляет 3–4% [17].Ранее контралатеральный яичник также рекомендовали для биопсии во время операции, но эта процедура больше не показана из-за доступности точных сонографических изображений [17]. По данным Harada et al., молодой возраст (<30 лет), большой размер кисты (диаметром >8 см) и двустороннее возникновение являются прогностическими факторами риска рецидива, при этом риск рецидива особенно высок при наличии более один из этих факторов [18]. В данном случае ее молодой возраст (16 лет) на момент постановки первоначального диагноза был фактором риска рецидива.Однако случаи, связанные с двумя послеоперационными рецидивами и переходом от одностороннего к двустороннему поражению яичников, редки.
Лапароскопическое лечение опухолей яичников является потенциально более безопасной альтернативой для молодых женщин, у которых сохранение фертильности является желательным результатом [16]. Зарегистрированная частота послеоперационного рецидива на одном и том же яичнике составляет 3–4% [17].Ранее контралатеральный яичник также рекомендовали для биопсии во время операции, но эта процедура больше не показана из-за доступности точных сонографических изображений [17]. По данным Harada et al., молодой возраст (<30 лет), большой размер кисты (диаметром >8 см) и двустороннее возникновение являются прогностическими факторами риска рецидива, при этом риск рецидива особенно высок при наличии более один из этих факторов [18]. В данном случае ее молодой возраст (16 лет) на момент постановки первоначального диагноза был фактором риска рецидива.Однако случаи, связанные с двумя послеоперационными рецидивами и переходом от одностороннего к двустороннему поражению яичников, редки.
Рецидивирующая смешанная герминогенная опухоль яичников с необычной злокачественной трансформацией: клинический случай | Journal of Ovarian Research

Gershenson DM, Del Junco G, Copeland LJ, Rutledge FN. Смешанные герминогенные опухоли яичников. Акушерство Гинекол. 1984;64(2):200–6.
КАС пабмед Google Scholar
Smith HO, Berwick M, Verschraegen CF, Wiggins C, Lansing L, Muller CY, et al. Заболеваемость и показатели выживаемости при злокачественных герминогенных опухолях у женщин. Акушерство Гинекол. 2006;107(5):1075–85.
Артикул Google Scholar
Burkman RT. Гинекология Берека и Новака. ДЖАМА. 2012;308(5):516–7.
КАС Статья Google Scholar
О’Коннор Д.М., Норрис Х.Дж.Влияние степени на исход незрелых (злокачественных) тератом яичников I стадии и воспроизводимость классификации. Int j Gynecol Pathol. 1994;13(4):283–9.
КАС Статья Google Scholar
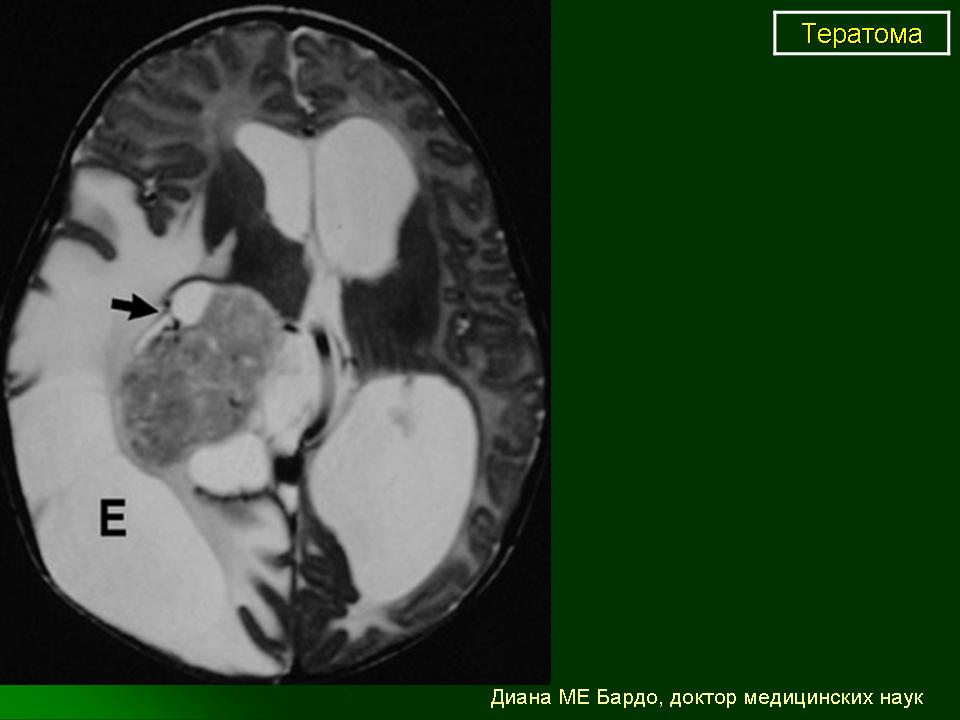
Норрис Х.Дж., Зиркин Х.Дж., Бенсон В.Л. Незрелая (злокачественная) тератома яичника: клинико-патологическое исследование 58 случаев. Рак. 1976; 37 (5): 2359–72.
КАС Статья Google Scholar
Erratum, Pashankar F, Hale JP, Dang H, et al. Показана ли адъювантная химиотерапия при незрелых тератомах яичников? Комбинированный анализ данных Международного сотрудничества по злокачественным герминогенным опухолям. Рак. 2016;122:230–7 Рак. 2018;124(6):1302.
Артикул Google Scholar
Vicus D, Beiner ME, Clarke B, Klachook S, Le LW, Laframboise S, et al. Незрелая тератома яичников: лечение и исход в одной институциональной когорте.Гинекол Онкол. 2011;123(1):50–3.
Артикул Google Scholar
Пектазиды D, Пектазиды E, Кассанос Д. Герминогенные опухоли яичников. Cancer Treat Rev. 2008;34(5):427–41.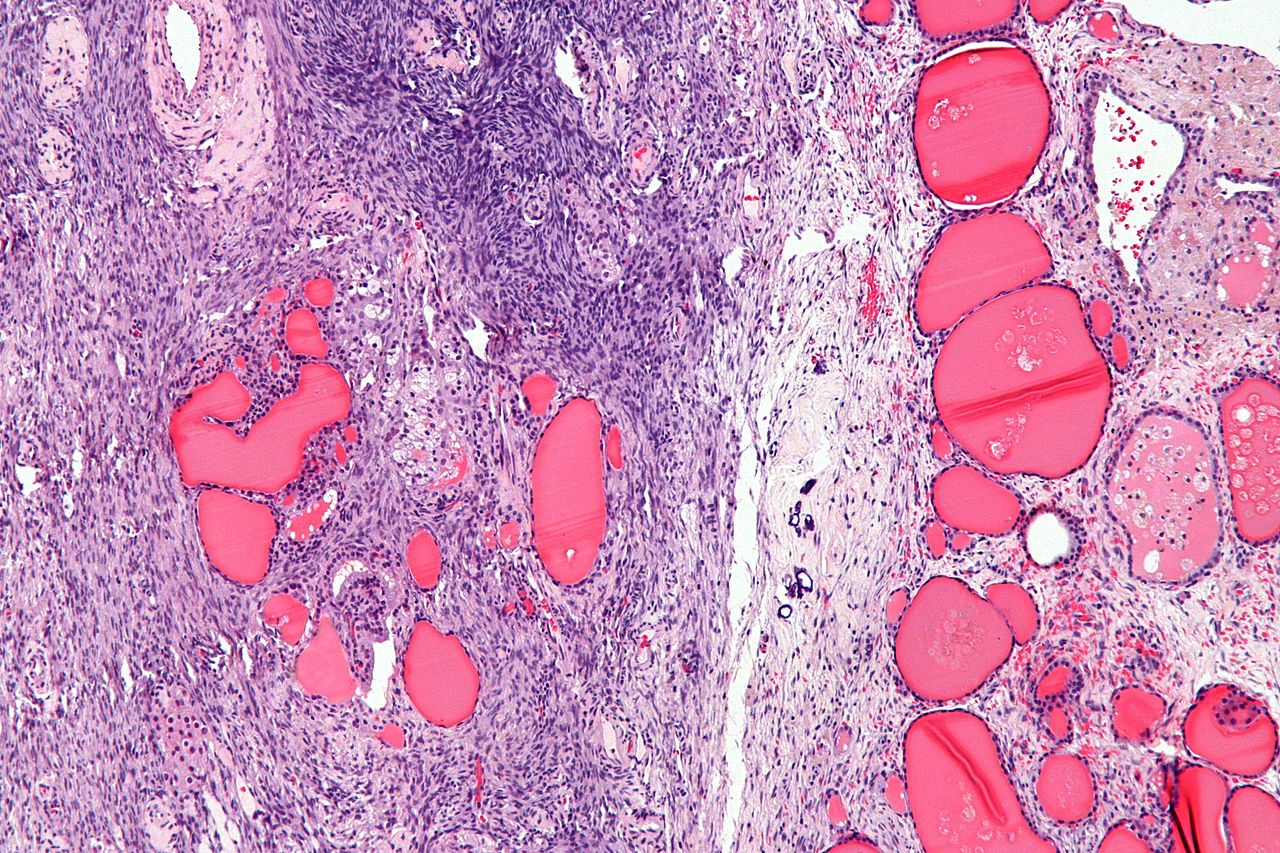
КАС Статья Google Scholar
Гершенсон Д.М. Лечение герминогенных опухолей яичников. Дж. Клин Онкол. 2007;25(20):2938–43.
КАС Статья Google Scholar
Муругаесу Н., Шмид П., Дэнси Г., Агарвал Р., Холден Л., Макнейш И. и др. Злокачественные герминогенные опухоли яичников: идентификация новых прогностических маркеров и долгосрочный результат после мультимодального лечения. Дж. Клин Онкол. 2006;24(30):4862–6.
Артикул Google Scholar
Паттерсон Д.М., Растин Г.Дж. Споры в лечении герминогенных опухолей яичников. Curr Opin Oncol. 2006;18(5):500–6.
Артикул Google Scholar
Улбрайт ТМ. Опухоли зародышевых клеток гонад: выборочный обзор, подчеркивающий проблемы дифференциальной диагностики, недавно оцененные и спорные вопросы. Мод Патол. 2005; 18 (Приложение 2): S61–79.
Мод Патол. 2005; 18 (Приложение 2): S61–79.
Артикул Google Scholar
Вудрафф Д.Д., Протос П., Петерсон В.Ф. Тератомы яичников. Связь гистологических и онтогенных факторов с прогнозом. Am J Obstet Gynecol. 1968; 102 (5): 702–15.
КАС Статья Google Scholar
Li J, Yang W, Wu X. Прогностические факторы и роль спасительной хирургии при химиофрактерных злокачественных новообразованиях яичников: исследование китайских пациентов. Гинекол Онкол. 2007;105(3):769–75.
Артикул Google Scholar
Bouquet de Joliniere J, Ben Ali N, Fadhlaoui A, Dubuisson JB, Guillou L, Sutter A, et al. Два сообщения о случаях злокачественной герминогенной опухоли яичника и гранулезоклеточной опухоли: интерес иммунохимии опухолей к выявлению и лечению.Фронт Онкол. 2014;4:97.
КАС пабмед ПабМед Центральный Google Scholar

Матей Д., Браун Дж., Фрейзер Л. Обновления в лечении опухолей зародышевых клеток яичников. Книга Am Soc Clin Oncol Educ. 2013: е210-е216.
Янаи-Инбар I, Скалли Р.Э. Связь дермоидных кист яичников и незрелых тератом: анализ 350 случаев незрелых тератом и 10 случаев дермоидных кист с микроскопическими очагами незрелой ткани.Int J Gynecol Pathol. 1987;6(3):203–12.
КАС Статья Google Scholar
Резк Ю., Шейнфельд Дж., Чи Д.С. Продленная выживаемость после спасительной операции по поводу незрелой тератомы яичника, фракционирующей химиотерапией: отчет о клиническом случае и обзор литературы. Гинекол Онкол. 2005;96(3):883–7.
Артикул Google Scholar
DiSaia PJ, Saltz A, Kagan AR, Morrow CP.Химиотерапевтическая ретроконверсия незрелой тератомы яичника. Акушерство Гинекол. 1977;49(3):346–50.
КАС пабмед Google Scholar
Munkarah A, Gershenson DM, Levenback C, Silva EG, Messing MJ, Morris M, et al. Спасательная операция при химиорезистентных герминогенных опухолях яичников. Гинекол Онкол. 1994;55(2):217–23.
КАС Статья Google Scholar
Дэвид Ю.Б., Вайс А., Шехтман Л., Шалев Е. Химиоконверсия опухоли после хирургического вмешательства, химиотерапии и нормализации сывороточных опухолевых маркеров у женщины с герминогенной опухолью яичника смешанного типа. Гинекол Онкол. 2002;84(3):464–7.
Артикул Google Scholar
Li S, Liu Z, Dong C, Long F, Liu Q, Sun D, et al. Синдром растущей тератомы, вторичный по отношению к гигантской незрелой тератоме яичников у девочки-подростка: отчет о клиническом случае и обзор литературы.Лекарство. 2016;95(7):e2647.
Артикул Google Scholar
Comerci JT Jr, Licciardi F, Bergh PA, Gregori C, Breen JL.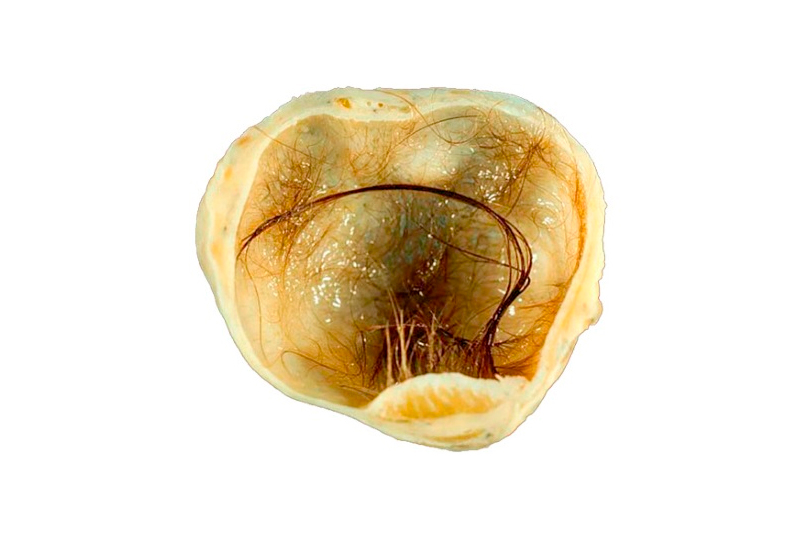 Зрелая кистозная тератома: клинико-патологическая оценка 517 случаев и обзор литературы. Акушерство Гинекол. 1994;84(1):22–8.
Зрелая кистозная тератома: клинико-патологическая оценка 517 случаев и обзор литературы. Акушерство Гинекол. 1994;84(1):22–8.
ПабМед Google Scholar
Hackethal A, Brueggmann D, Bohlmann MK, Franke FE, Tinneberg HR, Munstedt K.Плоскоклеточный рак при зрелой кистозной тератоме яичника: систематический обзор и анализ опубликованных данных. Ланцет Онкол. 2008;9(12):1173–80.
Артикул Google Scholar
Дэйви Д.Д., Улбрайт Т.М., Лёрер П.Дж., Эйнхорн Л.Х., Донохью Д.П., Уильямс С.Д. Значение атипии в тератоматозных метастазах после химиотерапии злокачественных герминогенных опухолей. Рак. 1987; 59 (3): 533–9.
КАС Статья Google Scholar
Castedo SM, de Jong B, Oosterhuis JW, Idenburg VJ, Seruca R, Buist J, et al. Хромосомные изменения в зрелых резидуальных тератомах после полихимиотерапии.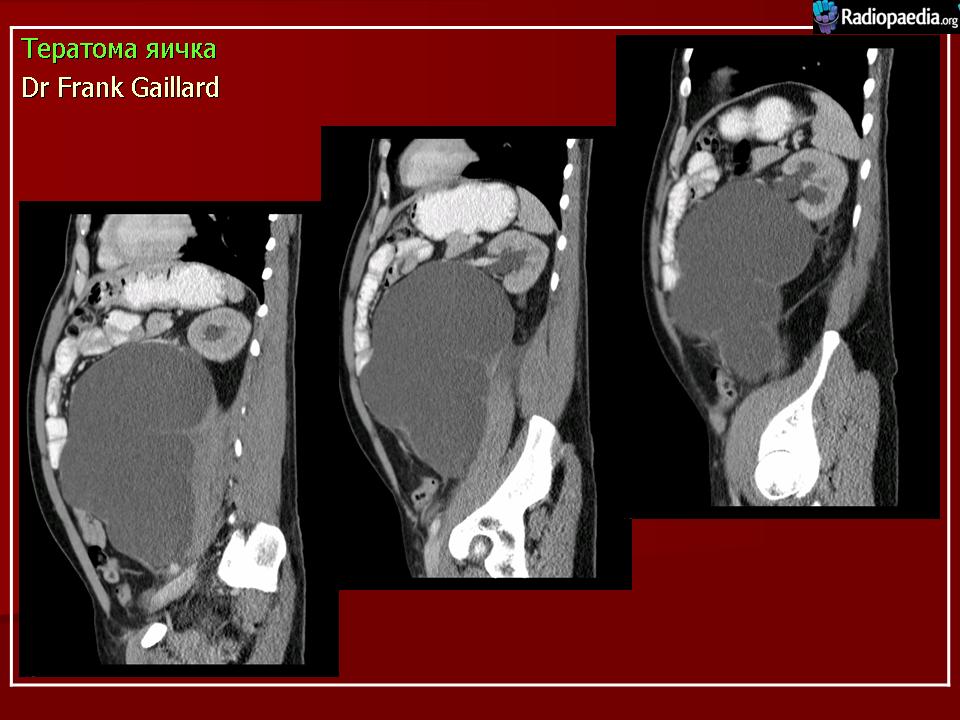 Рак Рез. 1989;49(3):672–6.
Рак Рез. 1989;49(3):672–6.
КАС пабмед Google Scholar
Molenaar WM, Oosterhuis JW, Meiring A, Sleyfer DT, Schraffordt Koops H, Cornelisse CJ. Гистология и содержание ДНК вторичного злокачественного новообразования, возникающего в зрелом остаточном поражении через шесть лет после химиотерапии диссеминированной несеминоматозной опухоли яичка.Рак. 1986; 58 (2): 264–8.
КАС Статья Google Scholar
Дэвис Г.Л. Злокачественная меланома, возникающая при зрелой кистозной тератоме яичника (дермоидная киста). Отчет о двух случаях и анализ литературы. Int J Gynecol Pathol. 1996;15(4):356–62.
КАС Статья Google Scholar
Нарендра Х., Манилал Б., Ревант Г., Правин К.С., Радхика К., Аша Т.Метастазирующая первичная злокачественная меланома яичника: диагностическая загадка. J Gynecol Surg. 2015;31(3):166–72.
2015;31(3):166–72.
Артикул Google Scholar
Cronje HS, Woodruff JD. Первичная злокачественная меланома яичников, возникающая при кистозной тератоме. Гинекол Онкол. 1981;12(3):379–83.
КАС Статья Google Scholar
Хён Х.С., Мун С.Т. Первичная злокачественная меланома, возникающая в кистозной тератоме.Акушерство Gynecol Sci. 2013;56(3):201–4.
Артикул Google Scholar
Poulos C, Cheng L, Zhang S, Gersell DJ, Ulbright TM. Анализ тератом яичников на изохромосому 12p: доказательства, подтверждающие двойной гистогенетический путь тератоматозных элементов. Мод Патол. 2006;19(6):766–71.
КАС Статья Google Scholar
Salani R, Backes FJ, Fung MF, Holschneider CH, Parker LP, Bristow RE, et al.Наблюдение после лечения и диагностика рецидивов у женщин с гинекологическими злокачественными новообразованиями: рекомендации Общества гинекологов-онкологов.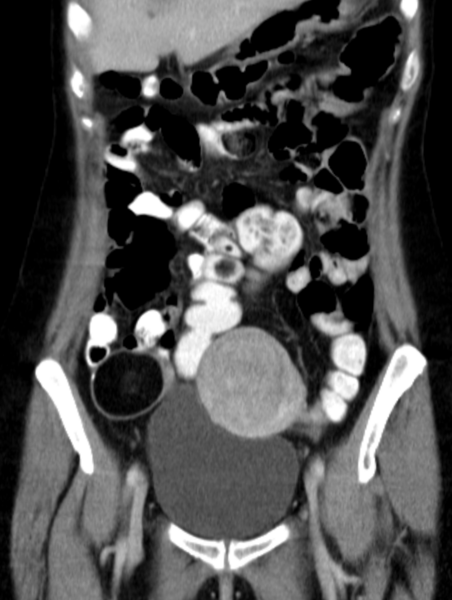 Am J Obstet Gynecol. 2011;204(6):466–78.
Am J Obstet Gynecol. 2011;204(6):466–78.
Артикул Google Scholar
Васкес И., Растин Г.Дж. Современные противоречия в лечении герминогенных опухолей яичников. Curr Opin Oncol. 2013;25(5):539–45.
КАС Статья Google Scholar
Einhorn LH, Williams SD, Chamness A, Brames MJ, Perkins SM, Abonour R. Высокодозная химиотерапия и спасение стволовых клеток при метастатических опухолях зародышевых клеток. N Engl J Med. 2007;357(4):340–8.
КАС Статья Google Scholar
Ричи Дж.П. Доклиническая и клиническая активность сунитиниба у пациентов с резистентными к цисплатину или множественными рецидивами герминогенных опухолей: совместное исследование Канадской онкологической урологической группы/Германской исследовательской группы рака яичек.Дж Урол. 2013;189(2):533–4.
КАС Статья Google Scholar

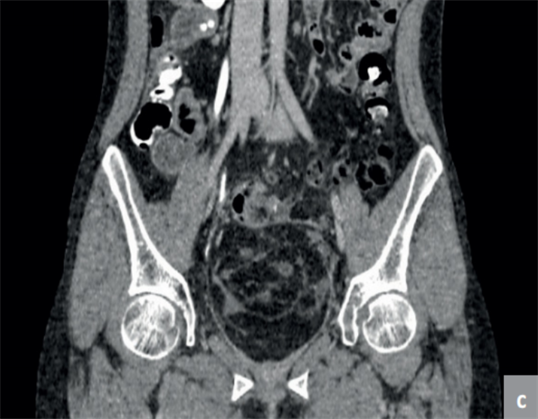
 внутричерепные герминогенные опухоли)
внутричерепные герминогенные опухоли)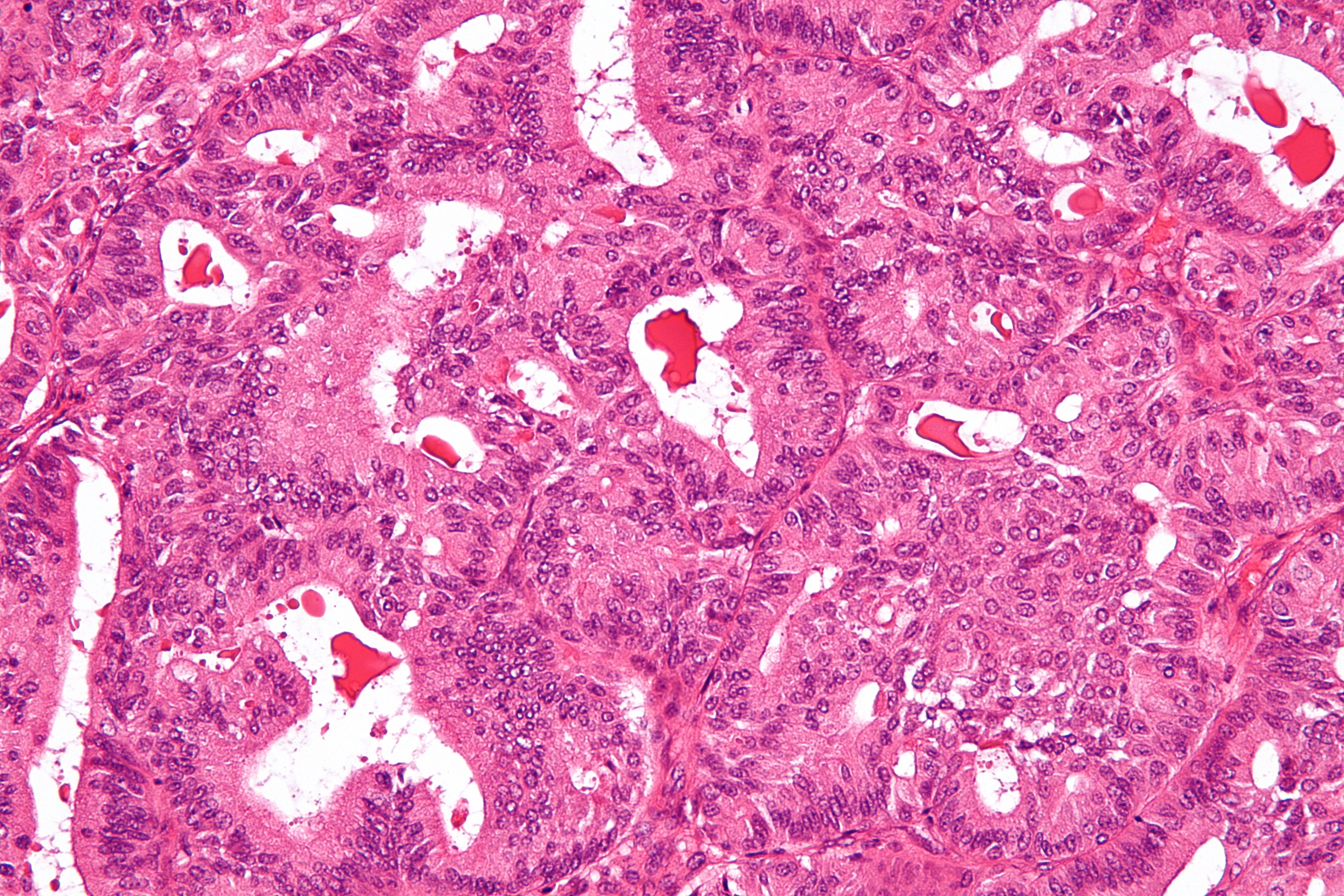 После опорожнения гнойного очага болезненные ощущения резко снижаются, температура тела нормализуется.
После опорожнения гнойного очага болезненные ощущения резко снижаются, температура тела нормализуется. 4).
4).