Туберкулез пути заражения: Туберкулез, пути заражения — Ханты–Мансийский клинический противотуберкулезный диспансер
Туберкулез – проблемы и пути их решения
Озвучить
Ежегодно 24 марта отмечается Всемирный День борьбы с туберкулезом. Туберкулез – медленный «убийца». Согласно статистике, одна треть населения земли болеет туберкулезом в латентной, то есть неактивной форме, что составляет 2 миллиарда людей. От этой болезни ежегодно погибает до 1,6 млн. человек. Туберкулез – повсеместно распространенное, хроническое инфекционное заболевание, которое вызывается микобактериями, передается преимущественно воздушно – капельным путём и сопровождается чаше всего поражением легких. Туберкулёз считается одним из древнейших инфекционных заболеваний: археологические находки свидетельствуют о туберкулезных поражениях скелета животных, существовавших на земле 7 млн. лет до н.э. Такие же изменения обнаружены в скелете человека, жившего на территории Европы 5 тыс. лет до н.э. «Легочная чахотка» была известна жителям Вавилона (2000 лет до н.э.) и подробно описана Гиппократом.
 При этом возбудители заболевания передаются от больных к здоровым людям с капельками мокроты при кашле, чихании, разговоре. Алиментарное заражение туберкулезом связано с недостаточной термической обработкой продуктов питания, полученных от больных туберкулезом животных (мясо, молоко, молочные продукты, яйца). Алиментарным путем могут заражаться и грудные дети, вскармливаемые молоком больных туберкулезом матерей. При контактном пути передача туберкулеза происходит через инфицированные полотенца, белье, постельные принадлежности, посуду. Восприимчивый коллектив — может оказать наиболее существенное влияние на распространение туберкулеза. Здесь важная роль принадлежит как общей реактивности организма каждого человека, так и специфическому противотуберкулезному иммунитету. Последний достигается иммунизацией вакцинами БЦЖ или БЦЖ-М. Аэрозольный механизм передачи является наиболее «эффективным», при этом возбудитель попадает в организм здорового человека через дыхательные пути.
При этом возбудители заболевания передаются от больных к здоровым людям с капельками мокроты при кашле, чихании, разговоре. Алиментарное заражение туберкулезом связано с недостаточной термической обработкой продуктов питания, полученных от больных туберкулезом животных (мясо, молоко, молочные продукты, яйца). Алиментарным путем могут заражаться и грудные дети, вскармливаемые молоком больных туберкулезом матерей. При контактном пути передача туберкулеза происходит через инфицированные полотенца, белье, постельные принадлежности, посуду. Восприимчивый коллектив — может оказать наиболее существенное влияние на распространение туберкулеза. Здесь важная роль принадлежит как общей реактивности организма каждого человека, так и специфическому противотуберкулезному иммунитету. Последний достигается иммунизацией вакцинами БЦЖ или БЦЖ-М. Аэрозольный механизм передачи является наиболее «эффективным», при этом возбудитель попадает в организм здорового человека через дыхательные пути.  Но, действие отрицательных факторов, (неполноценное питание, неудовлетворительные жилищно-бытовые условия, психо — эмоциональные стрессы, курение, злоупотребление алкоголем), способствуют снижению защитных сил организма и «пробуждению» очагов «дремлющей» инфекции. К факторам, способствующим заболеванию туберкулезом, следует, прежде всего, отнести: неполноценное питание, алкоголь, курение, наркотики, ВИЧ — инфицированность, нарушение правил гигиены, стресс, переутомление.
Но, действие отрицательных факторов, (неполноценное питание, неудовлетворительные жилищно-бытовые условия, психо — эмоциональные стрессы, курение, злоупотребление алкоголем), способствуют снижению защитных сил организма и «пробуждению» очагов «дремлющей» инфекции. К факторам, способствующим заболеванию туберкулезом, следует, прежде всего, отнести: неполноценное питание, алкоголь, курение, наркотики, ВИЧ — инфицированность, нарушение правил гигиены, стресс, переутомление.
Профилактические мероприятия делятся на санитарные, социальные и медицинские.
Санитарная профилактика заключается в проведении сотрудниками санитарной службы первичной обработки «очагов» туберкулезной инфекции.
Социальная профилактика только в настоящее время приобретает цивилизованные формы, обращено внимание на лиц без определенного места жительства и иммигрантов. При этом только в последние годы появились узаконенные формы работы по профилактике туберкулеза в этой группе населения. Информированность населения о состоянии заболеваемости туберкулезом оказалась значительно сниженной. Упущено время.
Информированность населения о состоянии заболеваемости туберкулезом оказалась значительно сниженной. Упущено время.
Медицинская профилактика в виде создания специфического иммунитета у детей через вакцинацию и ревакцинацию вакциной БЦЖ, которая проводится новорожденным на 3-7 сутки. Повторное введение вакцины (ревакцинация) осуществляется в 7 и 14 лет.
Кроме этого к медицинской профилактике относятся ежегодные профилактические флюорографические осмотры.
В случае заболевания основным методом в комплексном лечении больных туберкулезом является химиотерапия (назначаются специфические противотуберкулезные препараты). Успешность лечения во многом зависит от своевременного выявления больных. Кроме того, вовремя не выявленный больной с «открытой» формой туберкулеза в течение года может заразить от 10 до 15 человек. По этим причинам каждый человек должен ежегодно проходить профилактические медицинские осмотры методом флюорографии. Следует запомнить, что уклонение от обследования приводит к заражению окружающих, выявлению уже тяжелых форм заболевания, которые лечатся годами и заканчиваются инвалидностью и даже смертью, тогда как, своевременно выявленный туберкулез, может быть излечен.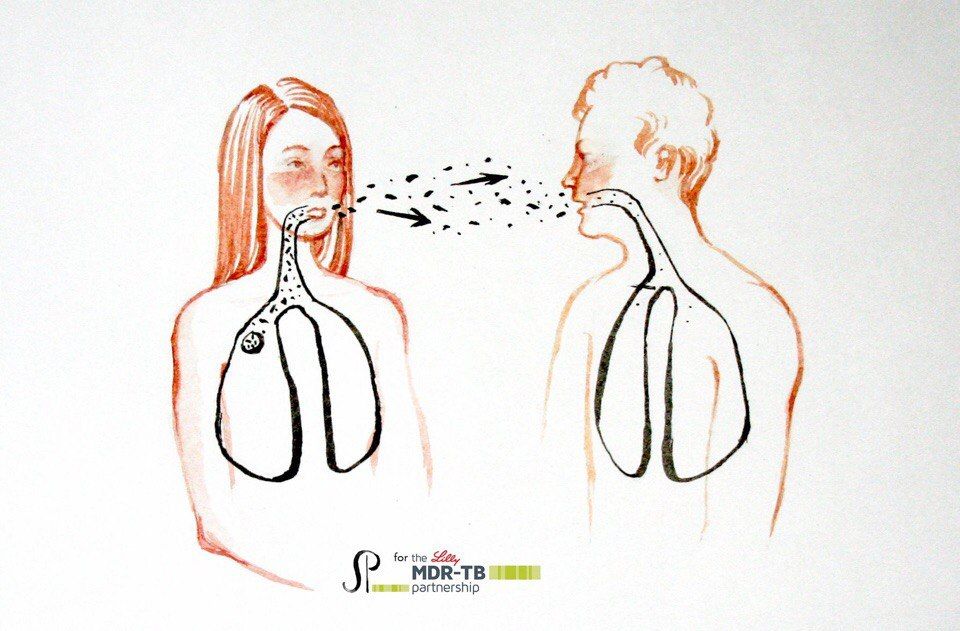
Успех или поражение в битве с туберкулезом более чем наполовину зависит от самого пациента. Его воля, желание выздороветь несмотря ни на что способны творить чудеса.
Профилактика туберкулеза
- Соблюдайте режим труда и отдыха
- Питайтесь едой сбалансированной по содержанию белков, жиров и углеводов, богатой витаминами и микроэлементами
- Регулярно занимайтесь спортом
- Больше бывайте на свежем воздухе
- Не курите и не позволяйте курить другим в вашем окружении
- Не употребляйте алкоголь и наркотики
- Часто проветривайте помещения, где вы находитесь, и проводите влажную уборку
- Пользуйтесь индивидуальной посудой
- Обязательно соблюдайте личную гигиену
10. Держитесь подальше от кашляющих людей
Наше здоровье зависит от нас! Берегите здоровье! Жизни – да, туберкулезу – нет!
Туберкулез — пути заражения, первые признаки заболевания, меры профилактики
Туберкулез — распространенное инфекционное заболевание, возбудителем которого является микобактерия туберкулеза (палочка Коха).
В настоящее время не только в России, но и в других странах, независимо от уровня экономического развития, туберкулез является важнейшей проблемой. Ежегодно в мире около 1 млрд людей инфицируются туберкулезом; 8-10 млн заболевают и до 3 млн человек умирают от этой инфекции, сообщили читателям Бердск-Онлайн специалисты Центра гигиены и эпидемиологии в Новосибирской области по городу Бердску.
Туберкулез относят к социальному заболеванию, т.к. развивается туберкулез в организме людей, которые плохо питаются, злоупотребляют алкоголем, курением, пользуются наркотиками, не соблюдают санитарно-гигиенические нормы поведения. Кроме того, этому способствуют волнения, стрессы, переутомление.
Основные источники заражения туберкулезом
Основным источником заражения человека микобактериями являются люди больные открытыми формами туберкулеза, т.е. те которые выделяют бациллы Коха во внешнюю среду. Больной человек вместе с мокротой при кашле, чихании, разговоре выделяет в окружающую среду миллионы микобактерий, которые распространяются в воздухе в радиусе 2- 6 м, затем осаждаются вместе с пылью на пол, на предметы и могут в течение многих лет оставаться жизнеспособными.
Заразиться туберкулезом можно при тесном общении с больными туберкулезом. Контактное заражение происходит: при поцелуе, через носовой платок больного, через одежду, посуду, полотенце, постельное белье и другие вещи, на которые попала мокрота, содержащая большое количество микобактерий. Заразиться туберкулезом можно и от больных туберкулезом животных как при непосредственном контакте с ними, так и при употреблении полученного от них молока, молочных продуктов и мяса.
Кто в группе риска по заражению туберкулезом?
Болезнь развивается лишь у 10-15% процентов лиц заразившихся микобактерией туберкулеза.
Главной причиной этого является снижение иммунитета. К факторам, которые снижают иммунитет, относятся: простудные заболевания, грипп, инфекционные заболевания (ветряная оспа, корь, коклюш), хронический бронхит, бронхиальная астма, частые заболевания бронхитом, сахарный диабет, язвенная болезнь желудка и двенадцатиперстной кишки, СПИД, применение гормональных препаратов, неполноценное питание, злоупотребление алкоголем и курение, физическое перенапряжение.
Основные признаки туберкулеза
Заболевание туберкулезом, как правило, развивается постепенно, но в ряде случаев может развиться остро. Оно напоминает течение бронхита, респираторной вирусной инфекции, пневмонии.
Основными признаками заболевания туберкулезом являются симптомы интоксикации которые проявляются: повышением температуры тела, нередко периодическое ее повышение, общей слабостью, недомоганием, быстрой утомляемостью, снижением аппетита, раздражительностью, снижением внимания, потливостью, особенно по ночам, похуданием. Если эти симптомы беспокоят Вас в течение 2 -3 недель, то следует исключать заражение туберкулезом. Кроме того, появляются и симптомы поражения того органа, где локализуется туберкулезный процесс. Так как наиболее часто поражаются туберкулезом легкие, то у больных появляются такие симптомы: кашель, вначале сухой, затем влажный с мокротой. Беспокоит одышка, вначале при физической нагрузке. Боли в грудной клетке. А может быть и кровохарканье.
Что делать при появлении признаков заболевания?
При появлении первых признаков заболевания самолечением заниматься нельзя, следует обратиться к врачу за медицинской помощью. Следует помнить, что чем меньше времени прошло от момента выявления заражения туберкулезом до обследования у врача-фтизиатра, тем выше вероятность того, что заболевание будет вылечено своевременно.
Для выявления инфицирования микобактериями туберкулеза используется внутрикожная диагностическая проба Манту с туберкулином. Проба проводится всем детям, 1 раз в год, а детям с повышенным риском заболеть туберкулезом (из контакта с больными туберкулезом, часто болеющими) — 2 раза в год. У взрослых для выявления заболевания проводят флюорографическое обследование органов дыхания, которое позволяет выявить начальные признаки туберкулеза легких. Этот метод обследования однократно в год совершенно безвреден, доза рентгеновского облучения очень мала.
Как защитить себя от заражения туберкулезом?
Соблюдайте режим труда и отдыха.
Питание должно быть сбалансированным по содержанию белков, жиров и углеводов, богато витаминами и микроэлементами.
Регулярно занимайтесь спортом
Больше бывайте на свежем воздухе.
Не курите, не позволяйте курить другим в вашем окружении.
Не злоупотребляйте алкоголем.
Чаще проветривайте помещения, где находитесь (класс, квартира и др.)
Систематически проводите влажную уборку помещений.
Пользуйтесь индивидуальной посудой и средствами гигиены.
Обязательно соблюдайте личную гигиену (мытье рук после возвращения с улицы, из транспорта, из туалета и перед едой).
Механизмы передачи микобактерий: как микобактерии туберкулеза проникают и выходят из организма человека
Опубликовано в Интернете 10 ноября 2016 г. doi: 10.2217/fmb-2016-0185
* 1 , 2
Информация об авторе Примечания к статье Информация об авторских правах и лицензиях Отказ от ответственности
В 1882 году, читая лекцию о своем открытии причины туберкулеза, Роберт Кох сказал: «Если важность болезни для человечества измеряется количеством смертельных случаев, она причины, то туберкулез следует считать гораздо более важным, чем самые страшные инфекционные болезни, чума, холера и тому подобное». Хотя идентификация Кохом Mycobacterium tuberculosis (Mtb) как причина туберкулеза предвещала многие будущие открытия и методы лечения, Mtb остается ответственным за 1,5 миллиона смертей ежегодно. Поэтому необходимы дополнительные исследования на всех стадиях инфекции Mtb. Этот комментарий обеспечивает основу для понимания двух центральных вопросов биологии Mtb на крайних стадиях инфекционного жизненного цикла: как Mtb попадает в организм и как он ускользает?
Хотя идентификация Кохом Mycobacterium tuberculosis (Mtb) как причина туберкулеза предвещала многие будущие открытия и методы лечения, Mtb остается ответственным за 1,5 миллиона смертей ежегодно. Поэтому необходимы дополнительные исследования на всех стадиях инфекции Mtb. Этот комментарий обеспечивает основу для понимания двух центральных вопросов биологии Mtb на крайних стадиях инфекционного жизненного цикла: как Mtb попадает в организм и как он ускользает?
Туберкулезная палочка передается от человека к человеку почти исключительно аэрозольными частицами. Размер инфекционных капель Mtb у инфицированных пациентов колеблется от 0,65 (маленький) до > 7,0 мкм (средний-крупный) [1]. В то время как небольшие аэрозольные частицы Mtb, как ожидается, проходят через носоглотку или трахеобронхиальную область и оседают в дистальных дыхательных путях, более крупные частицы могут задерживаться в верхних дыхательных путях или ротоглотке, где они потенциально могут привести к туберкулезу ротоглотки или шейных лимфатических узлов [2]. ]. Несмотря на кажущуюся легкость, с которой распространяется Mtb, как еще в настоящее время могут быть заражены почти 2 миллиарда человек? — и убедительные эпидемиологические доказательства, связывающие воздушно-капельную передачу с тесными личными контактами, прямо демонстрирующие аэрозольную передачу Mtb, чрезвычайно трудны [3]. Действительно, Райли
]. Несмотря на кажущуюся легкость, с которой распространяется Mtb, как еще в настоящее время могут быть заражены почти 2 миллиарда человек? — и убедительные эпидемиологические доказательства, связывающие воздушно-капельную передачу с тесными личными контактами, прямо демонстрирующие аэрозольную передачу Mtb, чрезвычайно трудны [3]. Действительно, Райли
Простейшая модель взаимодействия человека с Mtb представлена бинарным результатом воздействия Mtb на наивного человека: развитие либо бессимптомной латентной инфекции, либо активного заболевания, характеризующегося лихорадкой, потерей веса и кровавым кашлем.


Текущая парадигма первичной туберкулезной инфекции заключается в том, что мелкие переносимые по воздуху частицы распространяются в терминальные альвеолы, где резидентные альвеолярные макрофаги или тканевые дендритные клетки поглощают бактерии дыхательных путей. Впоследствии инфицированные макрофаги или дендритные клетки мигрируют в дренирующие лимфатические узлы, активируют адаптивный иммунитет, а затем возвращаются в исходный очаг инфекции, где формируется гранулема [6]. Однако, прежде чем достичь терминальных альвеол, некоторые мелкие и крупные частицы, вероятно, задерживаются вдоль слизистой оболочки, где они могут взаимодействовать с неврожденными иммунными клетками между MALT и выше. Орофарингеальный MALT, широко распространенный в детстве, но регрессирующий у взрослых, включает ассоциированную с носом лимфатическую ткань, миндалины и аденоиды кольца Вальдейера и лимфатическую ткань, ассоциированную с бронхами. Интересно, что MALT преобладает в уязвимый период раннего детства и подросткового возраста, когда туберкулез проявляется в более тяжелых и диссеминированных формах. Покрывающие MALT представляют собой как первичные эпителиальные клетки, так и специализированные клетки, называемые микроскладчатыми клетками (М-клетки), последние функции которых как в дыхательных путях, так и в желудочно-кишечном тракте заключаются в поглощении и трансцитозе чужеродных антигенов [7,8]. Ранее было продемонстрировано, что эпителиальные клетки дыхательных путей могут способствовать распространению Mtb из дыхательных путей [9].], и недавно была установлена функциональная роль М-клеток в проникновении Mtb [10], что расширило наблюдения, сделанные более 15 лет назад [11]. Истощение M-клеток перед инфекцией дыхательных путей приводит к меньшему количеству Mtb, извлеченному из дренирующих лимфатических узлов во время инфекции носа или дыхательных путей, и защите от долгосрочной смертности, опосредованной Mtb, у мышей [10]. В этих экспериментах не тестировалось ни влияние трансцитоза Mtb М-клетками на адаптивный иммунитет, ни то, как доза инокулята влияет на иммунный ответ.
Покрывающие MALT представляют собой как первичные эпителиальные клетки, так и специализированные клетки, называемые микроскладчатыми клетками (М-клетки), последние функции которых как в дыхательных путях, так и в желудочно-кишечном тракте заключаются в поглощении и трансцитозе чужеродных антигенов [7,8]. Ранее было продемонстрировано, что эпителиальные клетки дыхательных путей могут способствовать распространению Mtb из дыхательных путей [9].], и недавно была установлена функциональная роль М-клеток в проникновении Mtb [10], что расширило наблюдения, сделанные более 15 лет назад [11]. Истощение M-клеток перед инфекцией дыхательных путей приводит к меньшему количеству Mtb, извлеченному из дренирующих лимфатических узлов во время инфекции носа или дыхательных путей, и защите от долгосрочной смертности, опосредованной Mtb, у мышей [10]. В этих экспериментах не тестировалось ни влияние трансцитоза Mtb М-клетками на адаптивный иммунитет, ни то, как доза инокулята влияет на иммунный ответ. Поскольку нацеливание на М-клетки недавно было предложено в качестве метода индукции ответа на вакцину в MALT, а также системно [12], М-клетки занимают видное место в назальной лимфатической ткани [13], а интраназальная вакцинация БЦЖ обеспечивает усиленную защиту от инфекции Mtb [12]. 14], также возможно, что низкий уровень или повторная инфекция (т. е. менее 10 бактерий) в верхних дыхательных путях приводит к прямой доставке Mtb к APC в MALT по пути, который стимулирует более сильный защитный иммунный ответ, чем когда Mtb непосредственно поглощаются альвеолярными макрофагами. Таким образом, как доза инокулята, так и размер частиц могут влиять на исход заболевания, так что у людей, чьи М-клетки трансцитозируют малобациллярные или более крупные частицы Mtb, развивается латентное заболевание или даже остаются полностью неинфицированными. Однако, если первоначальная доза Mtb, трансцитируемая М-клетками слизистой оболочки верхних дыхательных путей, подавляет первичный местный ответ, то дренирование Mtb в местные лимфатические узлы может привести к лимфатическому заболеванию, как это наблюдается при золотухе.
Поскольку нацеливание на М-клетки недавно было предложено в качестве метода индукции ответа на вакцину в MALT, а также системно [12], М-клетки занимают видное место в назальной лимфатической ткани [13], а интраназальная вакцинация БЦЖ обеспечивает усиленную защиту от инфекции Mtb [12]. 14], также возможно, что низкий уровень или повторная инфекция (т. е. менее 10 бактерий) в верхних дыхательных путях приводит к прямой доставке Mtb к APC в MALT по пути, который стимулирует более сильный защитный иммунный ответ, чем когда Mtb непосредственно поглощаются альвеолярными макрофагами. Таким образом, как доза инокулята, так и размер частиц могут влиять на исход заболевания, так что у людей, чьи М-клетки трансцитозируют малобациллярные или более крупные частицы Mtb, развивается латентное заболевание или даже остаются полностью неинфицированными. Однако, если первоначальная доза Mtb, трансцитируемая М-клетками слизистой оболочки верхних дыхательных путей, подавляет первичный местный ответ, то дренирование Mtb в местные лимфатические узлы может привести к лимфатическому заболеванию, как это наблюдается при золотухе. Точно так же, если частицы очень малы, они могут полностью миновать эпителиальные клетки и достигать терминальных альвеол, где их поглощают фагоциты дыхательных путей.
Точно так же, если частицы очень малы, они могут полностью миновать эпителиальные клетки и достигать терминальных альвеол, где их поглощают фагоциты дыхательных путей.
Успех любого бактериального патогена в конечном счете зависит от его способности размножаться и заражать новых хозяев. Многие патогенные бактерии взаимодействуют с хозяевами, секретируя молекулы вирулентности, такие как белки и липиды. Классическим примером является выработка холерного токсина Vibrio cholerae , который способствует распространению возбудителя от человека к человеку, вызывая обильную водянистую диарею. Mtb также использует сложные способы распространения, включая казеоз, доступ к бронхиальному дереву и передачу воздушно-капельным путем при кашле.
Недавно было высказано предположение, что переход туберкулеза дыхательных путей от начальной, бессимптомной инфекции к симптоматическому, некротическому и полостному заболеванию происходит в три этапа [15]. В этой модели первая стадия отражает раннее инфицирование альвеолярных макрофагов Mtb и активацию клеточно-опосредованного иммунитета с последующим иммунным контролем с образованием гранулемы. У некоторых людей наступает вторая стадия, представленная накоплением антигенов Mtb и липидов хозяина в дыхательных путях, что приводит к бронхиальной обструкции и обструктивной липидной пневмонии. Наконец, в зависимости от реакции хозяина, третья стадия характеризуется либо полостной, либо фиброзно-казеозной болезнью с коммуникацией с внешним миром. Механизмы, ответственные за каждую стадию и, в частности, за формирование обструктивной липидной пневмонии, недостаточно известны, хотя в некоторых исследованиях выявлена важная роль матриксных металлопротеиназ хозяина в разрушении и диссеминации тканей [16].
У некоторых людей наступает вторая стадия, представленная накоплением антигенов Mtb и липидов хозяина в дыхательных путях, что приводит к бронхиальной обструкции и обструктивной липидной пневмонии. Наконец, в зависимости от реакции хозяина, третья стадия характеризуется либо полостной, либо фиброзно-казеозной болезнью с коммуникацией с внешним миром. Механизмы, ответственные за каждую стадию и, в частности, за формирование обструктивной липидной пневмонии, недостаточно известны, хотя в некоторых исследованиях выявлена важная роль матриксных металлопротеиназ хозяина в разрушении и диссеминации тканей [16].
Хотя кашель является хорошо известным отличительным признаком активного туберкулеза легких, очень мало известно о патогенезе инфекционного кашля [17]. Кашель может быть естественным следствием воспаления легких и выработки хозяином простагландинов, брадикинина и других медиаторов воспаления, которые активируют афферентные нейрональные С-волокна в слизистой оболочке легких [18]. Кроме того, образование полости или кисты само по себе может вызывать механическую активацию либо быстро адаптирующихся рецепторов, либо медленно адаптирующихся рецепторов растяжения, которые могут повышать чувствительность легких к триггерам кашля [19].,20]. И наоборот, сам кашель, возможно, вызванный секретируемыми микобактериальными факторами, может привести к аэрозолизации Mtb и/или образованию полостей. В этой модели гранулема или область казеозно-некротической пневмонии может быть вызвана образованием полости очень высокими механическими силами (внутригрудное давление до 300 мм рт.ст. и скорость выдоха до 800 км/ч), вызванными сильным кашлем [ 18], заставляя ослабленный внеклеточный матрикс и эластическую ткань [16] растягиваться в полость. Таким образом, хотя кашель может быть основным путем аэрозолизации и распространения, он может предшествовать стадии полостной болезни и/или совпадать с ней.
Кроме того, образование полости или кисты само по себе может вызывать механическую активацию либо быстро адаптирующихся рецепторов, либо медленно адаптирующихся рецепторов растяжения, которые могут повышать чувствительность легких к триггерам кашля [19].,20]. И наоборот, сам кашель, возможно, вызванный секретируемыми микобактериальными факторами, может привести к аэрозолизации Mtb и/или образованию полостей. В этой модели гранулема или область казеозно-некротической пневмонии может быть вызвана образованием полости очень высокими механическими силами (внутригрудное давление до 300 мм рт.ст. и скорость выдоха до 800 км/ч), вызванными сильным кашлем [ 18], заставляя ослабленный внеклеточный матрикс и эластическую ткань [16] растягиваться в полость. Таким образом, хотя кашель может быть основным путем аэрозолизации и распространения, он может предшествовать стадии полостной болезни и/или совпадать с ней.
Несмотря на то, что после открытия Кохом туберкулеза был достигнут значительный прогресс в понимании врожденных и адаптивных реакций на инфекцию Mtb, то, как Mtb проникает в слизистую оболочку, чтобы инициировать инфекцию, и как он обращает процесс, чтобы ускользнуть, остается плохо изученным. Необходимы новые подходы для дальнейшего выяснения этих критических событий в патогенезе туберкулеза.
Необходимы новые подходы для дальнейшего выяснения этих критических событий в патогенезе туберкулеза.
Раскрытие финансовых и конкурирующих интересов
M Shiloh поддерживается финансированием NIH, номера грантов AI099439, АИ109725, АИ125939, АИ111023. Автор не имеет никаких других соответствующих связей или финансового участия с какой-либо организацией или юридическим лицом, имеющим финансовый интерес или финансовый конфликт с предметом или материалами, обсуждаемыми в рукописи, кроме раскрытых.
При написании этой рукописи помощь в написании не использовалась.
1. Феннелли К.П., Мартыни Дж.В., Фултон К.Е., Орм И.М., Кейв Д.М., Хейфец Л.Б. Аэрозоли, вызывающие кашель Mycobacterium tuberculosis : новый метод изучения инфекционности. утра. Дж. Дыхание. крит. Уход Мед. 2004;169(5):604–609. [PubMed] [Google Scholar]
2. Fennelly KP, Jones-Lopez EC. Количество и качество вдыхаемой дозы позволяет прогнозировать иммунопатологию при туберкулезе. Фронт. Иммунол. 2015;6:313. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Фронт. Иммунол. 2015;6:313. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Roy CJ, Milton DK. Воздушно-капельный путь передачи инфекционной инфекции – неуловимый путь. Н. англ. Дж. Мед. 2004;350(17):1710–1712. [PubMed] [Google Scholar]
4. Riley RL, Mills CC, Nyka W, et al. Воздушная диссеминация туберкулеза легких. Двухлетнее исследование заражения в туберкулезном отделении. 1959. утра. Дж. Эпидемиол. 1995;142(1):3–14. [PubMed] [Google Scholar]
5. Pienaar E, Fluitt AM, Whitney SE, Freifeld AG, Viljoen HJ. Модель передачи туберкулеза и стратегии вмешательства в городском жилом районе. Вычисл. биол. хим. 2010;34(2):86–96. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Russell DG, Barry CE, 3rd, Flynn JL. Туберкулез: то, чего мы не знаем, может и причиняет нам вред. Наука . 2010;328(5980):852–856. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Ван Дж., Густи В., Сарасвати А. , Ло Д.Д. Конвергентное и дивергентное развитие линий М-клеток в эпителии слизистой оболочки мышей. Дж. Иммунол. 2011;187(10):5277–5285. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Ло Д.Д. Конвергентное и дивергентное развитие линий М-клеток в эпителии слизистой оболочки мышей. Дж. Иммунол. 2011;187(10):5277–5285. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Мабботт Н.А., Дональдсон Д.С., Оно Х., Уильямс И.Р., Махаджан А. Клетки Microfold (M): важные посты иммунного надзора в кишечном эпителии. Иммунол слизистых оболочек. 2013;6(4):666–677. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Bermudez LE, Goodman J. Mycobacterium tuberculosis внедряется и размножается внутри альвеолярных клеток типа II. Заразить. Иммун. 1996;64(4):1400–1406. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Nair VR, Franco LH, Zacharia VM, et al. Клетки микроскладок активно перемещают Mycobacterium tuberculosis , чтобы инициировать инфекцию. Отчет ячейки 2016;16(5):1253–1258. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Teitelbaum R, Schubert W, Gunther L, et al. М-клетка как входные ворота в легкие для бактериального возбудителя Mycobacterium tuberculosis . Иммунитет . 1999;10(6):641–650. [PubMed] [Google Scholar]
М-клетка как входные ворота в легкие для бактериального возбудителя Mycobacterium tuberculosis . Иммунитет . 1999;10(6):641–650. [PubMed] [Google Scholar]
12. Lo DD, Ling J, Eckelhoefer AH. Нацеливание на М-клетки с помощью нацеливающего пептида клаудина 4 может усиливать ответы IgA слизистой оболочки. Биотехнология BMC. 2012;12:7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Mutoh M, Kimura S, Takahashi-Iwanaga H, Hisamoto M, Iwanaga T, Iida J. RANKL регулирует дифференцировку клеток микроскладок в лимфоидной ткани, ассоциированной с носоглоткой мыши (NALT) Cell Tissue Res. 2015;364(1):175–184. [PubMed] [Google Scholar]
14. Деррик С.К., Колибаб К., Ян А., Моррис С.Л. Интраназальное введение Mycobacterium bovis БЦЖ обеспечивает превосходную защиту от аэрозольной инфекции Mycobacterium tuberculosis у мышей. клин. Вакцина Иммунол. 2014;21(10):1443–1451. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Hunter RL. Туберкулез как трехактная пьеса: новая парадигма патогенеза туберкулеза легких. Tuberculosis (Edinb.) 2016; 97:8–17. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Hunter RL. Туберкулез как трехактная пьеса: новая парадигма патогенеза туберкулеза легких. Tuberculosis (Edinb.) 2016; 97:8–17. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Elkington PT, D’armiento JM, Friedland JS. Туберкулезная иммунопатология: забытая роль разрушения внеклеточного матрикса. Науч. Перевод Мед. 2011;3(71):71–76. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Тернер Р.Д., Ботамли Г.Х. Кашель и передача туберкулеза. Дж. Заражение. Дис. 2015;211(9):1367–1372. [PubMed] [Google Scholar]
18. Polverino M, Polverino F, Fasolino M, Ando F, Alfieri A, De Blasio F. Анатомия и нейропатофизиология дуги кашлевого рефлекса. Мультидисциплинарный. Дыхание Мед. 2012;7(1):5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Mazzone SB. Обзор сенсорных рецепторов, регулирующих кашель. Кашель . 2005; 1:2. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Mazzone SB, Undem BJ. Вагусная афферентная иннервация дыхательных путей в норме и при патологии. Физиол. Ред. 2016;96(3):975–1024. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Вагусная афферентная иннервация дыхательных путей в норме и при патологии. Физиол. Ред. 2016;96(3):975–1024. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Что мы знаем о передаче туберкулеза: обзор
1. Всемирная организация здравоохранения (ВОЗ). Глобальный отчет по туберкулезу, 2016 г. WHO/HTM/TB/2016.13. Женева, Швейцария: ВОЗ, 2016 г. [Google Scholar]
2. Хубен Р.М., Додд П.Дж. Глобальное бремя латентной туберкулезной инфекции: переоценка с использованием математического моделирования. ПЛОС Мед 2016; 13:e1002152. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Барнагарвала Т. Персонал противотуберкулезной больницы живет в тени страшной болезни. Индийский экспресс. Уттар-Прадеш, Индия: IE Online Media Services, 2014. [Google Scholar]
4.
Линхардт К., Глазиу П., Уплекар М., Лённрот К., Гетахун Х., Равильоне М.
Глобальная борьба с туберкулезом: извлеченные уроки и перспективы на будущее. Nat Rev Microbiol 2012; 10: 407–16. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
5. Херманс С., Хорсбург С. Р. мл., Вуд Р. Столетие эпидемиологии туберкулеза в Северном и Южном полушариях: различное влияние мер борьбы. ПЛоС Один 2015; 10:e0135179. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Хубен Р.М., Мензис Н.А., Самнер Т. и др.. Осуществимость достижения глобальных целей ВОЗ по туберкулезу к 2025 г. в Южной Африке, Китае и Индии: комбинированный анализ 11 математических моделей. Ланцет Глоб Здоровье 2016; 4:e806–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Абу-Раддад Л.Дж., Сабателли Л., Ахтерберг Дж.Т. и др.. Эпидемиологические преимущества более эффективных противотуберкулезных вакцин, лекарств и средств диагностики. Proc Natl Acad Sci U S A 2009; 106:13980–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Dobbs TE, Kimmerling ME. Микобактерии туберкулеза. В электронной книге по терапии СПИДа. Филадельфия, Пенсильвания: Elsevier, 2008. [Google Scholar]
9.
Уэллс ВФ. При воздушно-капельной инфекции. Исследование II. Капли и ядра капель. Am J Hyg. 1934: 611–8. [Google Scholar]
При воздушно-капельной инфекции. Исследование II. Капли и ядра капель. Am J Hyg. 1934: 611–8. [Google Scholar]
10. Райли Р.Л., О’Грэйди Ф.. Воздушно-капельная инфекция: передача и контроль. Нью-Йорк, штат Нью-Йорк: Macmillan, 1961. [Google Scholar]
11. Райли Р.Л., Миллс К.С., Ника В. и др.. Воздушное распространение туберкулеза легких: двухлетнее исследование заражения в туберкулезном отделении. Ам Дж Хиг 1959; 70:185–96. [Google Scholar]
12. Райли Р.Л., Миллс К.С., О’Грейди Ф., Султан Л.У., Виттштадт Ф., Шивпури Д.Н. Заразность воздуха туберкулезного отделения. Ультрафиолетовое облучение зараженного воздуха: сравнительная заразность разных больных. Am Rev Respir Dis 1962; 85:511–25. [PubMed] [Google Scholar]
13. Чепмен Дж. С., Дайерли, доктор медицины. Социальные и другие факторы внутрисемейной передачи туберкулеза. Am Rev Respir Dis 1964; 90:48–60. [PubMed] [Академия Google]
14.
Дауди Д.У., Азман А.С., Кендалл Э.А., Матема Б.
Преобразование борьбы с туберкулезом: нацеливание на катализаторы передачи. Clin Infect Dis 2014; 59:1123–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Clin Infect Dis 2014; 59:1123–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Зелнер Дж. Л., Мюррей М. Б., Бесерра М. С. и др.. Возрастные риски заражения туберкулезом в результате облучения в домашнем хозяйстве и сообществе и возможности для вмешательств в условиях высокого бремени. Am J Epidemiol 2014; 180:853–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Тернер Р.Д., Ботамли Г.Х. Кашель и передача туберкулеза. J Infect Dis 2015; 211: 1367–72. [PubMed] [Google Scholar]
17. Дхармадхикари А.С., Мфахлеле М., Вентер К. и др.. Быстрое влияние эффективного лечения на передачу туберкулеза с множественной лекарственной устойчивостью. Int J Tuberc Lung Dis 2014; 18:1019–25. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Huang CC, Tchetgen ET, Becerra MC и др.. Влияние иммуносупрессии, связанной с ВИЧ, на риск передачи туберкулеза бытовым контактам. Clin Infect Dis 2014; 58:765–74. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Корбетт Э.Л., Бандасон Т., Чунг Ю.Б. и др..
Эпидемиология туберкулеза в популяции с высокой распространенностью ВИЧ при усиленной диагностике симптоматического заболевания. ПЛОС Мед 2007; 4:e22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Корбетт Э.Л., Бандасон Т., Чунг Ю.Б. и др..
Эпидемиология туберкулеза в популяции с высокой распространенностью ВИЧ при усиленной диагностике симптоматического заболевания. ПЛОС Мед 2007; 4:e22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Лоун С.Д., Вуд Р., Де Кок К.М., Кранцер К., Льюис Дж.Дж., Черчиярд Г.Дж. Антиретровирусная терапия и профилактическая терапия изониазидом для профилактики ВИЧ-ассоциированного туберкулеза в условиях ограниченных ресурсов здравоохранения. Ланцет Infect Dis 2010; 10:489–98. [PubMed] [Google Scholar]
21. Захария Р., Бемельманс М., Акессон А. и др.. Сокращение регистрации случаев туберкулеза, связанное с расширением масштабов антиретровирусного лечения в сельских районах Малави. Int J Tuberc Lung Dis 2011; 15:933–7. [PubMed] [Google Scholar]
22. Dodd PJ, Looker C, Plumb ID и др.. Возрастные и половые модели социальных контактов и заболеваемость микобактериями туберкулеза. Am J Epidemiol 2016; 183:156–66. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Nobelprize.org. Роберт Кох — Нобелевская лекция. Стокгольм, Швеция: Nobel Media, 2014.
https://www.nobelprize.org/nobel_prize/medicine/laureates/1905/koch-lecture.html. По состоянию на 12 августа 2017 г. [Google Scholar]
Nobelprize.org. Роберт Кох — Нобелевская лекция. Стокгольм, Швеция: Nobel Media, 2014.
https://www.nobelprize.org/nobel_prize/medicine/laureates/1905/koch-lecture.html. По состоянию на 12 августа 2017 г. [Google Scholar]
24. Шах Н.С., Юэн К.М., Хео М., Толман А.В., Бесерра М.С. Результаты контактных исследований в домохозяйствах больных лекарственно-устойчивым туберкулезом: систематический обзор и метаанализ. Clin Infect Dis 2014; 58:381–91. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Зелнер Дж. Л., Мюррей М. Б., Бесерра М. С. и др.. Выявление очагов передачи мультирезистентного туберкулеза с использованием пространственных и молекулярно-генетических данных. J Infect Dis 2016; 213: 287–94. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Эндрюс Дж.Р., Морроу С., Валенски Р.П., Вуд Р. Объединение данных о социальных контактах и окружающей среде при оценке передачи туберкулеза в южноафриканском поселке. J Infect Dis 2014; 210: 597–603. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Йейтс Т.А., Хан П.Ю., Найт Г.М. и др..
Передача микобактерий туберкулеза в условиях высокого бремени. Ланцет Infect Dis 2016; 16: 227–38. [PubMed] [Google Scholar]
Йейтс Т.А., Хан П.Ю., Найт Г.М. и др..
Передача микобактерий туберкулеза в условиях высокого бремени. Ланцет Infect Dis 2016; 16: 227–38. [PubMed] [Google Scholar]
28. Эндрюс Дж.Р., Морроу С., Вуд Р. Моделирование роли общественного транспорта в устойчивой передаче туберкулеза в Южной Африке. Am J Epidemiol 2013; 177: 556–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Черчиярд Г.Дж., Филдинг К.Л., Льюис Дж.Дж. и др.; Группа по изучению туберкулеза Тибела Испытание массовой профилактической терапии изониазидом для борьбы с туберкулезом. N Engl J Med 2014; 370:301–10. [PubMed] [Академия Google]
30. Телисингх Л., Филдинг К.Л., Малден Дж.Л. и др.. Высокая распространенность туберкулеза в южноафриканской тюрьме: необходимость рутинного скрининга на туберкулез. ПЛоС Один 2014; 9:e87262. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31.
Джонстон-Робертсон С., Лоун С.Д., Велте А., Беккер Л.Г., Вуд Р.
Туберкулез в южноафриканской тюрьме — анализ моделирования передачи. S Afr Med J 2011; 101:809–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]
S Afr Med J 2011; 101:809–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Эскомб А.Р., Хуарото Л., Тикона Э. и др.. Риск передачи туберкулеза и инфекционный контроль в отделении неотложной помощи больницы в Лиме, Перу. Int J Tuberc Lung Dis 2010; 14:1120–6. [PubMed] [Академия Google]
33. Эскомб А.Р., Мур Д.А., Гилман Р.Х. и др.. Ультрафиолетовое освещение верхней комнаты и отрицательная ионизация воздуха для предотвращения передачи туберкулеза. PLoS Med 2009; 6:е43. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Баррера Э., Ливчиц В., Нарделл Э. F-A-S-T: переориентированная, усиленная, административная стратегия борьбы с передачей туберкулеза. Int J Tuberc Lung Dis 2015; 19: 381–4. [PubMed] [Google Scholar]
35. Cegielski JP, Griffith DE, McGaha PK и др.. Ликвидация туберкулеза в одном районе за раз. Am J Общественное здравоохранение 2013; 103:1292–300. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36.
Фокс Г.Дж., Барри С. Е., Бриттон В.Дж., Маркс Г.Б.
Контактное исследование на туберкулез: систематический обзор и метаанализ. Евро Респир J 2013; 41:140–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Е., Бриттон В.Дж., Маркс Г.Б.
Контактное исследование на туберкулез: систематический обзор и метаанализ. Евро Респир J 2013; 41:140–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Шанаубе К. Связь между величиной Т-клеточного интерферон-гамма-ответа на специфические антигены Mycobacterium tuberculosis и риском прогрессирования туберкулеза в домашних контактах, протестированная с помощью анализа QuantiFERON-TB Gold In-Tube [диссертация]. Лондон, Великобритания: Лондонская школа гигиены и тропической медицины, 2014 г. [Google Scholar]
38. Ханифа И., Грант А.Д., Льюис Дж., Корбетт Э.Л., Филдинг К., Черчиярд Г. Распространенность латентной туберкулезной инфекции среди золотодобытчиков в Южной Африке. Int J Tuberc Lung Dis 2009; 13:39–46. [PubMed] [Google Scholar]
39.
Коуи РЛ.
Краткосрочный курс химиопрофилактики туберкулеза рифампицином, изониазидом и пиразинамидом, оцененный у золотодобытчиков с хроническим силикозом: двойное слепое плацебо-контролируемое исследование. Tuber Lung Dis 1996; 77:239–43. [PubMed] [Академия Google]
Tuber Lung Dis 1996; 77:239–43. [PubMed] [Академия Google]
40. Комсток Г.В., Фереби С.Х., Хаммес Л.М. Контролируемое испытание профилактики изониазидом в масштабах всего сообщества на Аляске. Am Rev Respir Dis 1967; 95:935–43. [PubMed] [Google Scholar]
41. Найбо Дж., Фара А.Р., Кристенсен О.В.. Отчет о пилотном проекте химиотерапии (Тунис 9). Женева, Швейцария: Всемирная организация здравоохранения, 1963 г. [Google Scholar]
42. Фереби Ш. Испытания контролируемой химиопрофилактики туберкулеза. Общий обзор. Библ Туберк 1970; 26:28–106. [PubMed] [Академия Google]
43. Хорвиц О., Пейн П.Г., Уилбек Э. Эпидемиологические основы ликвидации туберкулеза. 4. Испытание изониазида в Гренландии. Bull World Health Organ 1966; 35: 509–26. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Хорвиц О, Магнус К. Эпидемиологическая оценка химиопрофилактики туберкулеза. Am J Epidemiol 1974; 99:333–42. [PubMed] [Google Scholar]
45.
Комсток Г.В., Баум С. , Снайдер Д.Э. мл.
Профилактика изониазидом среди эскимосов Аляски: окончательный отчет об исследованиях изониазида в вефиле. Am Rev Respir Dis 1979; 119:827–30. [PubMed] [Google Scholar]
, Снайдер Д.Э. мл.
Профилактика изониазидом среди эскимосов Аляски: окончательный отчет об исследованиях изониазида в вефиле. Am Rev Respir Dis 1979; 119:827–30. [PubMed] [Google Scholar]
46. Рендлман Нью-Джерси. Обязательный скрининг на туберкулез среди бездомных. Am J Prev Med 1999; 17:108–13. [PubMed] [Google Scholar]
47. Корбетт Э.Л., Бандасон Т., Дуонг Т. и др.. Сравнение двух активных стратегий выявления случаев для диагностики симптоматического туберкулеза с положительным мазком и борьбы с инфекционным туберкулезом на уровне сообщества в Хараре, Зимбабве (DETECTB): кластерное рандомизированное исследование. Ланцет 2010; 376: 1244–53. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Айлес Х., Муйойета М., Дю Туа Э. и др.; ЗАМСТАР команда Влияние домашних и общественных вмешательств на бремя туберкулеза в южной части Африки: рандомизированное исследование ZAMSTAR. Ланцет 2013; 382: 1183–94. [PubMed] [Google Scholar]
49.
Кавальканте С.К., Дуровни Б.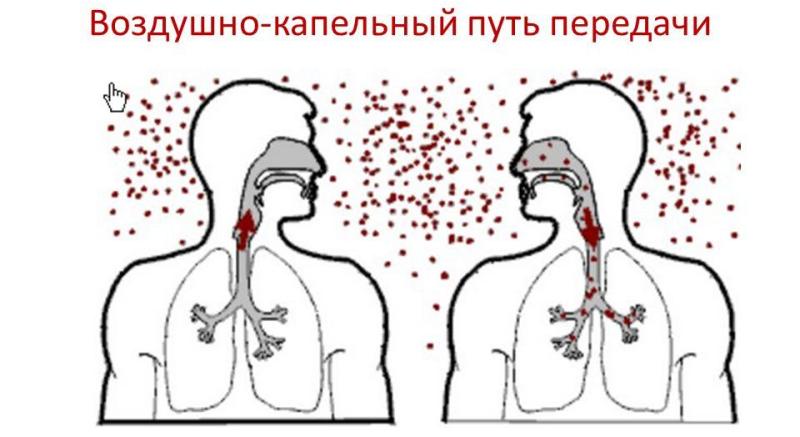 , Барнс Г.Л. и др..
Рандомизированное клиническое испытание расширенной DOTS для борьбы с туберкулезом в Рио-де-Жанейро, Бразилия. Int J Tuberc Lung Dis 2010; 14: 203–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Барнс Г.Л. и др..
Рандомизированное клиническое испытание расширенной DOTS для борьбы с туберкулезом в Рио-де-Жанейро, Бразилия. Int J Tuberc Lung Dis 2010; 14: 203–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Дуровни Б., Сарачени В., Моултон Л.Х. и др.. Влияние улучшенного скрининга на туберкулез и профилактической терапии изониазидом на заболеваемость туберкулезом и смертность у пациентов с ВИЧ в клиниках Рио-де-Жанейро, Бразилия: ступенчатое кластерное рандомизированное исследование. Ланцет Infect Dis 2013; 13:852–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Кранцер К., Афнан-Холмс Х., Томлин К. и др.. Преимущества скрининга на активную форму туберкулеза для населения и отдельных лиц: систематический обзор. Int J Tuberc Lung Dis 2013; 17: 432–46. [PubMed] [Академия Google]
52. Смолл ПМ, Пай М. Диагноз туберкулез – время изменить правила игры. N Engl J Med 2010; 363:1070–1. [PubMed] [Google Scholar]
53.
Беме С.С., Набета П. , Хиллеманн Д. и др..
Быстрое молекулярное выявление туберкулеза и устойчивости к рифампину. N Engl J Med 2010; 363: 1005–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Хиллеманн Д. и др..
Быстрое молекулярное выявление туберкулеза и устойчивости к рифампину. N Engl J Med 2010; 363: 1005–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Погост Г.Дж., Стивенс В.С., Маметья Л.Д. и др.. Сравнение Xpert MTB/RIF с микроскопией мокроты в качестве исходного диагностического теста на туберкулез: кластерное рандомизированное исследование, включенное в развертывание Xpert MTB/RIF в Южной Африке. Ланцет Глоб Здоровье 2015; 3:e450–7. [PubMed] [Академия Google]
55. Терон Г., Зижена Л., Чанда Д. и др.; Команда ТБ-НЕАТ Осуществимость, точность и клинический эффект тестирования Xpert MTB/RIF на туберкулез по месту оказания помощи в учреждениях первичной медико-санитарной помощи в Африке: многоцентровое рандомизированное контролируемое исследование. Ланцет 2014; 383: 424–35. [PubMed] [Google Scholar]
56.
Кендалл Э.А., Шреста С., Коэн Т. и др..
Установление приоритетов для новых схем лечения туберкулеза: эпидемиологическая модель. ПЛОС Мед 2017; 14:e1002202.
